罗非鱼别称非洲鲫鱼,肉质鲜嫩,富含多种营养物质,是中国鱼类养殖中的重要品种[1]。目前,罗非鱼的加工主要以冻全鱼与冻鱼片为主,在加工过程中会产生大量的鱼鳞副产物,由于这些副产物市场价值不高,往往存在直接丢弃、加工利用率低等问题[2]。有研究表明,鱼鳞中丰富的胶原蛋白具有抗氧化、降血压、调节免疫等生物活性,利用酸、碱、酶解等方法可将鱼鳞胶原蛋白进一步降解成小分子的胶原肽,与胶原蛋白相比,胶原肽在消化吸收、功能特性等方面都有明显提高[3]。
近年来,微量元素与胶原肽形成螯合物的研究备受关注。锌是人和动物所需重要的微量元素之一,具有重要生物功能。锌在细胞生长和分化、蛋白质和DNA合成、脂质代谢和免疫功能等方面都发挥重要作用[4]。当胶原肽与锌离子结合时,可以作为锌补充剂,在消化过程中避免与植酸、膳食纤维在胃肠道内形成不溶性复合物,其锌吸收利用率往往高于锌盐及蛋白-锌螯合物[5],还能有效增强其生物活性,如抗氧化[6]、抑菌[7]等功效,添加到饲料、食品、化妆品中,具有很大的研发价值[8]。
在前期实验中,实验室以罗非鱼鳞为原料,制备了罗非鱼鳞胶原肽螯合锌,并进行了分离纯化[9-10]。本文拟对罗非鱼鳞胶原肽螯合锌的组成结构及抗氧化、抑菌功效进行进一步的分析研究,为罗非鱼鱼鳞的精深加工及高值化利用提供技术参考。
1 材料与方法
1.1 材料与试剂
罗非鱼鳞胶原肽(collagen peptide,CP)和罗非鱼鳞胶原肽螯合锌(CP-Zn),实验室自制[9-10];DPPH生化试剂(BR)、标准氨基酸,Sigma-Aldrich上海贸易有限公司;LB琼脂培养基、马铃薯葡萄糖琼脂培养基,索莱宝生物科技有限公司;大肠埃希氏杆菌[Escherichia coli,CMCC(B) 44103]、枯草芽孢杆菌[Bacillus subtilis,CMCC(B) 63501]、白色假丝酵母[Candida albicans,AS2.2086]、金黄色葡萄球菌[Staphylococcus aureus,CMCC(B) 26003],厦门大学生命科学学院;其他化学试剂均为分析纯。
1.2 仪器与设备
UDK13自动凯氏定氮仪,意大利VELP公司;Mili-Q超纯水纯化系统,美国millipore公司;AA-6680原子吸收光谱,日本岛津公司;生物超净工作台,苏净安泰公司;ZQTY-90S全温恒温培养箱,上海知楚仪器有限公司;立式压力蒸气灭菌器,STIK施都凯仪器设备有限公司;Bruker microflex基质辅助激光解吸电离飞行时间质谱仪,德国布鲁克道尔顿公司;戴安ICS3000离子色谱仪、AminoPac PA10氨基酸分析柱(2 mm×250 mm)、AminoPac PA10保护柱(2 mm×50 mm),美国赛默飞世尔科技公司。
1.3 试验方法
1.3.1 成分测定
水分含量的测定:直接干燥法(GB/T 5009.3—2010);灰分含量的测定:马弗炉灰化法(GB/T 5009.4—2010);粗蛋白含量的测定:微量凯氏定氮法(GB/T 5009.5—2016);锌浓度的测定:采用原子吸收光谱法(GB/T 5009.14—2017)。
1.3.2 基质辅助激光解析电离飞行时间质谱(matrix assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)检测
20 mg 2, 5-二羟基苯甲酸(2, 5-dihydroxybenzoic acid,DHB)溶解于1 mL 的乙腈水溶液(乙腈的体积分数为50%)中作为基质溶液。将10 g/L 的样品水溶液与等体积的基质溶液混匀后,取1 μL点样于不锈钢靶上,自然干燥后,推入离子源中测定。质谱条件:337 nm N2 激光光源,激光脉冲3 ns, 加速电压19.0 kV,反射电压15.4 kV。谱图采集模式为正离子反射模式,每张谱图累计600次[11]。
1.3.3 氨基酸组成检测
称取0.1 g样品于水解管中,加入10 mL 6 mol/L的HCl,置于110 ℃的恒温干燥箱内,待消化完全后,稀释200倍,用0.44 μm的滤膜过滤,收集滤出液,待上样。采用AminoPac PA10氨基酸分析柱,以1 mol/L CH3COONa、250 mmol/L NaOH的水溶液为流动相,进样量10 μL测定样品的氨基酸组成和含量[12]。
1.3.4 DPPH自由基清除率的测定
将检测样品与等体积的0.1 mol/L DPPH-无水乙醇溶液混合均匀,室温避光反应30 min,于517 nm处测吸光值;样品与无水乙醇溶液混合反应为对照组;超纯水与DPPH-无水乙醇溶液混合反应为空白组[13]。每组试验重复3次,取平均值并求标准差。DPPH清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A0、A1、A2 分别为空白组、对照组、样品组的吸光度。
1.3.5 羟自由基清除率的测定
在0.4 mL样品中依次加入0.4 mL 9 mmol/L的FeSO4、0.4 mL 9 mmol/L的水杨酸-乙醇溶液和0.4 mL 8.8 mmol/L H2O2,37 ℃下水浴30 min,于510 nm处测吸光度。以超纯水代替H2O2作为对照组;以超纯水代替样品作为空白组[14]。羟自由基清除率的计算如公式(2)所示:
羟自由基清除率![]()
(2)
式中:A0、A1、A2 分别为空白组、对照组、样品组的吸光度。
1.3.6 Fe3+还原能力的测定
取0.5 mL样品溶液,加入0.5 mL 10 g/L K3[Fe(CN)6]溶液,混匀,于50 ℃水浴保温20 min,再加入0.5 mL的100 g/L三氯乙酸溶液,混匀后8 000 r/min离心10 min后取上清液1 mL,加入1 mL超纯水和150 μL 1 g/L的FeCl3溶液,混匀,静置10 min后,于700 nm处测定吸光度[15]。
1.3.7 抑菌活性检测
用接种环分别挑取大肠埃希氏杆菌、枯草芽孢杆菌和金黄色葡萄球菌的适量菌体,于LB固体培养基上划线,37 ℃恒温培养24 h;挑取白色假丝酵母的适量菌体,于马铃薯葡萄糖固体培养基上划线,28 ℃恒温培养24 h。将活化好的菌体用无菌生理盐水稀释重悬至105 CFU/mL,均匀涂布于琼脂培养基上。
用无菌移液枪各吸取10 μL 300 g/L的CP及CP-Zn溶液,缓慢滴加在直径约6 mm的灭菌滤纸片上,待其扩散均匀,再将滤纸片平铺于含菌平板上,在培养箱中恒温培养24 h,培养结束后观察是否具有抑菌效果,测定抑菌圈直径[16]。
1.3.8 统计方法
以SPSS 统计软件对实验数据进行处理,数值以![]() 表示。
表示。
2 结果与分析
2.1 成分分析
CP和CP-Zn的主要组成成分如表1所示,与GB 31645—2018《食品安全国家标准 胶原蛋白肽》中的理化指标相比,CP的蛋白质量分数≥90.0%,灰分质量分数≤7.0%,水分质量分数≤7.0%,均符合胶原蛋白肽的国家标准。在与锌发生螯合后,蛋白质量分数有所下降,锌的质量分数较高,达到(13.31±1.49)%,说明制备的CP有较好的锌螯合能力。
表1 CP和CP-Zn的主要组成成分 单位:%
Table 1 Main composition of CP and CP-Zn

样品蛋白质水分锌灰分CP90.40±0.385.48±1.26-3.30±0.68CP-Zn81.54±1.063.97±0.1813.31±1.49-
注:“-”表示未检测
2.2 MALDI-TOF质谱图
图1是CP和CP-Zn的MALDI-TOF质谱图。由图1-a可知CP的m/z出峰位置均在1 200以内,主要为胶原寡肽。如图1-b所示,CP-Zn的主要特征峰为质荷比887.980的离子,指认为[M-H+Zn]+,与图1-a相比可以得出,主要是823.667的准分子离子峰[M+H]+结合了1个锌得到的,这同时也表明了CP-Zn的生成[17]。
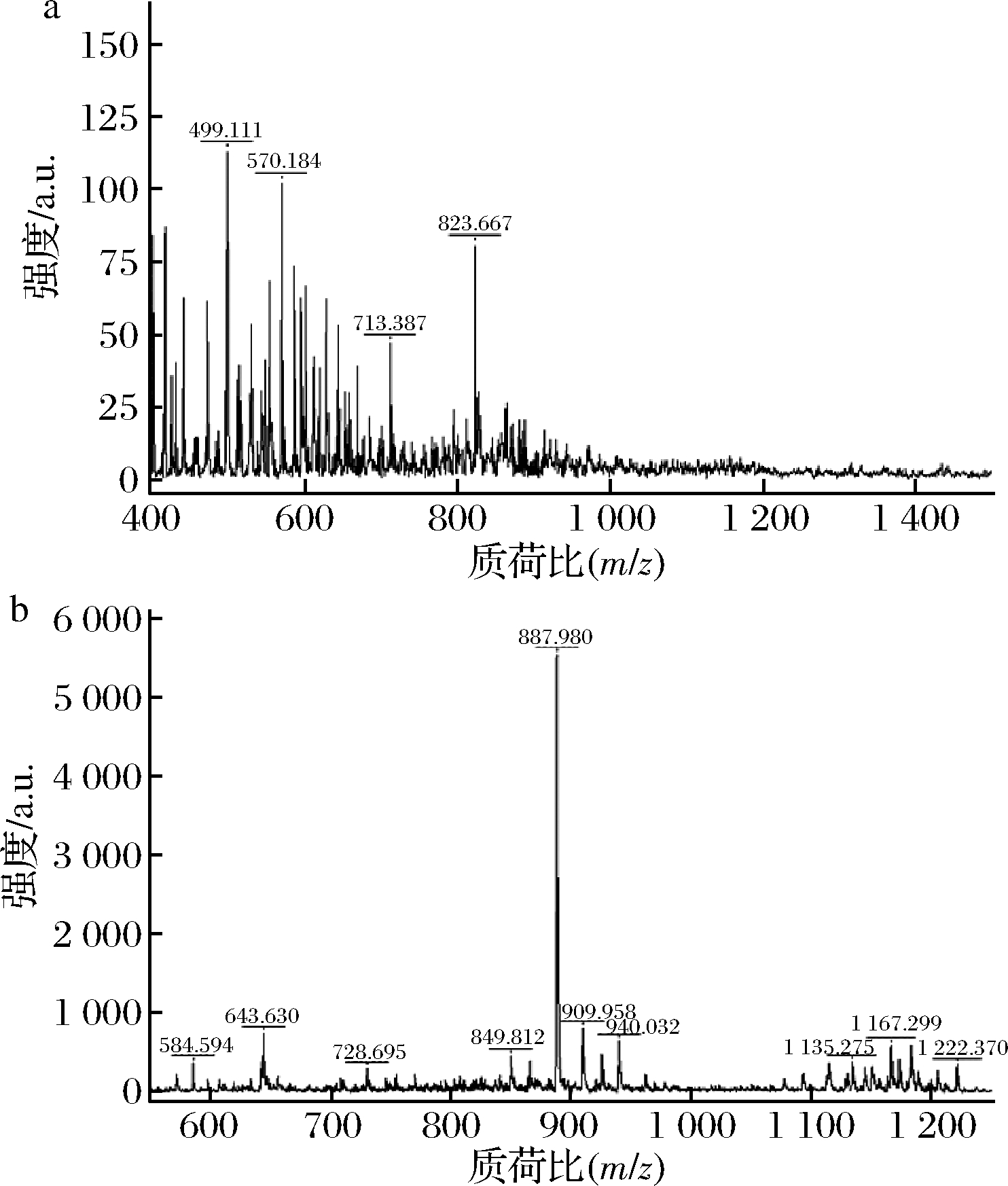
a-CP;b-CP-Zn
图1 CP和CP-Zn的MALDI-TOF 质谱图
Fig.1 MALDI-TOF mass spectra of CP and CP-Zn
2.3 氨基酸组成分析
表2为CP和CP-Zn的氨基酸组成及比例,CP中总的氨基酸质量分数为88.68%,与表1中检测的蛋白质量分数较为相近。其中羟脯氨酸为胶原肽的特征氨基酸,其质量分数最高,其次为天冬氨酸和甘氨酸。与锌螯合后,酸性氨基酸天冬氨酸与谷氨酸在总氨基酸的比例明显增加,这说明酸性氨基酸具有较强的锌结合能力,侧链的羧基很可能是锌离子的重要螯合位点[18]。螯合锌中氨基酸的质量分数为81.99%,与表1中检测的蛋白质量分数基本吻合。
表2 CP和CP-Zn的氨基酸组成及比例 单位:%
Table 2 Amino acid composition and proportion of CP and CP-Zn
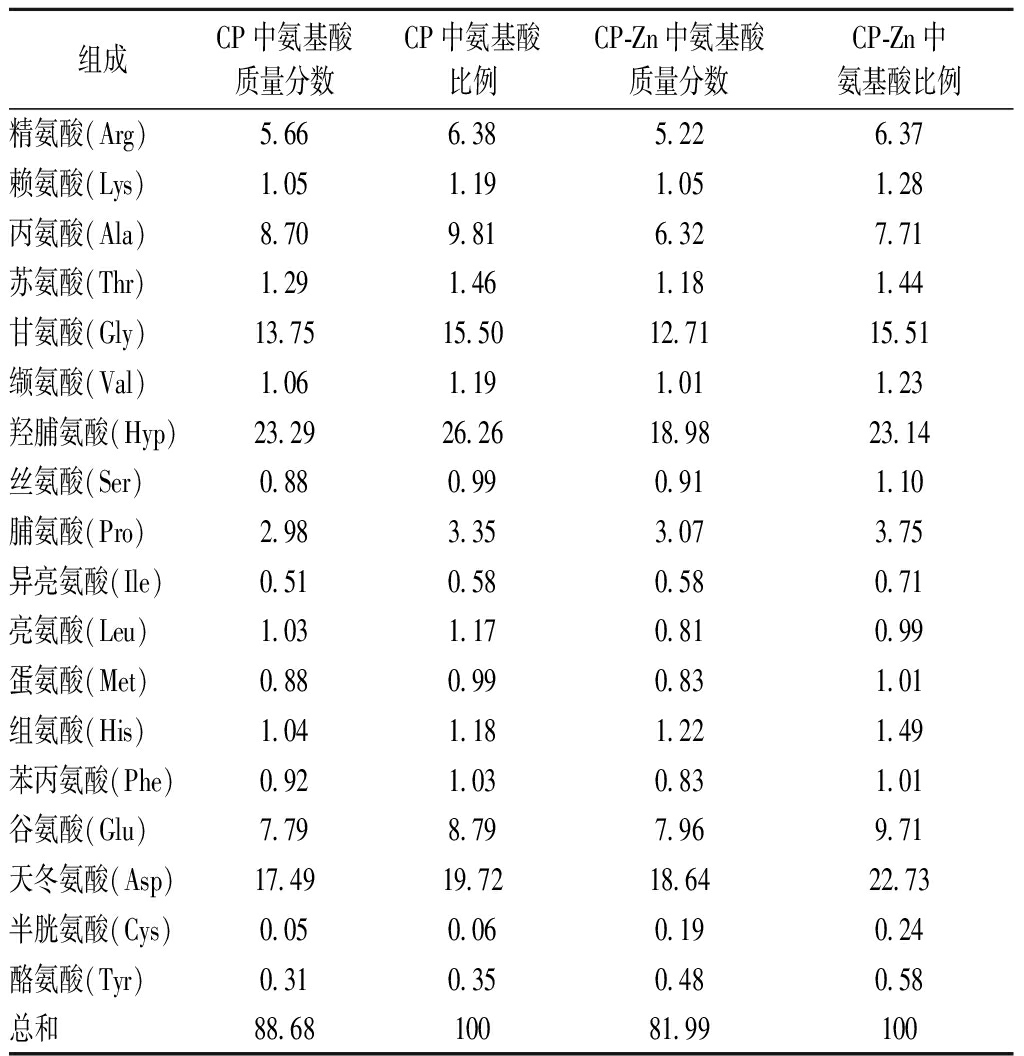
组成CP中氨基酸质量分数CP中氨基酸比例CP-Zn中氨基酸质量分数CP-Zn中氨基酸比例精氨酸(Arg)5.666.385.226.37赖氨酸(Lys)1.051.191.051.28丙氨酸(Ala)8.709.816.327.71苏氨酸(Thr)1.291.461.181.44甘氨酸(Gly)13.7515.5012.7115.51缬氨酸(Val)1.061.191.011.23羟脯氨酸(Hyp)23.2926.2618.9823.14丝氨酸(Ser)0.880.990.911.10脯氨酸(Pro)2.983.353.073.75异亮氨酸(Ile)0.510.580.580.71亮氨酸(Leu)1.031.170.810.99蛋氨酸(Met)0.880.990.831.01组氨酸(His)1.041.181.221.49苯丙氨酸(Phe)0.921.030.831.01谷氨酸(Glu)7.798.797.969.71天冬氨酸(Asp)17.4919.7218.6422.73半胱氨酸(Cys)0.050.060.190.24酪氨酸(Tyr)0.310.350.480.58总和88.6810081.99100
2.4 体外抗氧化活性实验
CP及CP-Zn对DPPH自由基的清除效果如图2所示,当CP的质量浓度为10 g/L时,对DPPH自由基的清除率约为59.73%,而等质量浓度的CP-Zn对DPPH自由基的清除率约为65.91%,说明CP-Zn对DPPH自由基具有较好的清除效果[19]。经计算可以得出,CP和CP-Zn的IC50值分别为6.30和3.69 g/L。
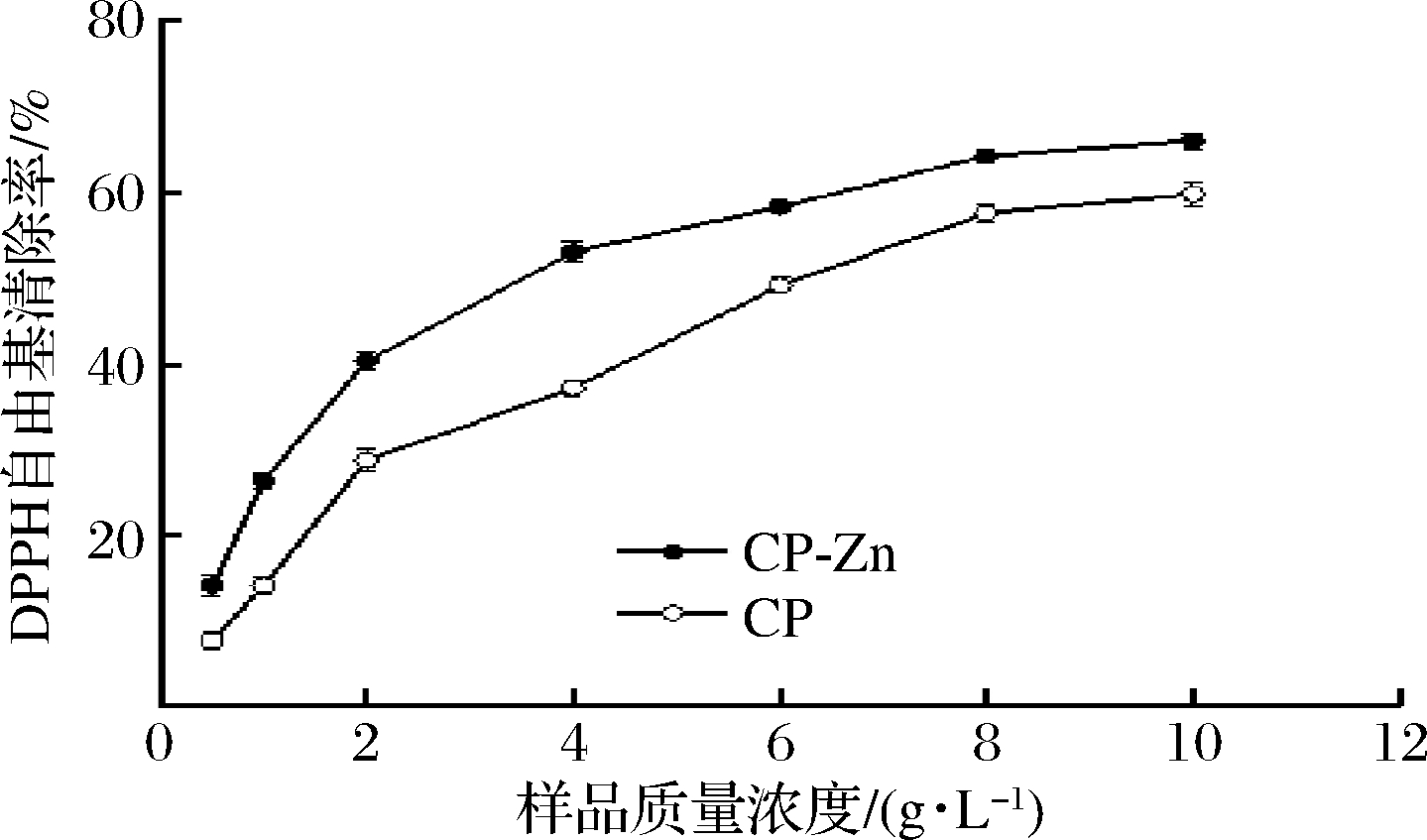
图2 CP及CP-Zn对DPPH自由基的清除效果
Fig.2 Scavenging effect of CP and CP-Zn on DPPH free radical
CP及CP-Zn对羟自由基的清除效果如图3所示。CP及CP-Zn对羟自由基都有一定的清除作用,而且清除能力随样品浓度的变化而变化[20]。经计算求得CP清除羟自由基的IC50值约为10.51 g/L,而CP-Zn约为6.59 g/L。可见CP在与锌螯合后对羟自由基的清除能力增强。
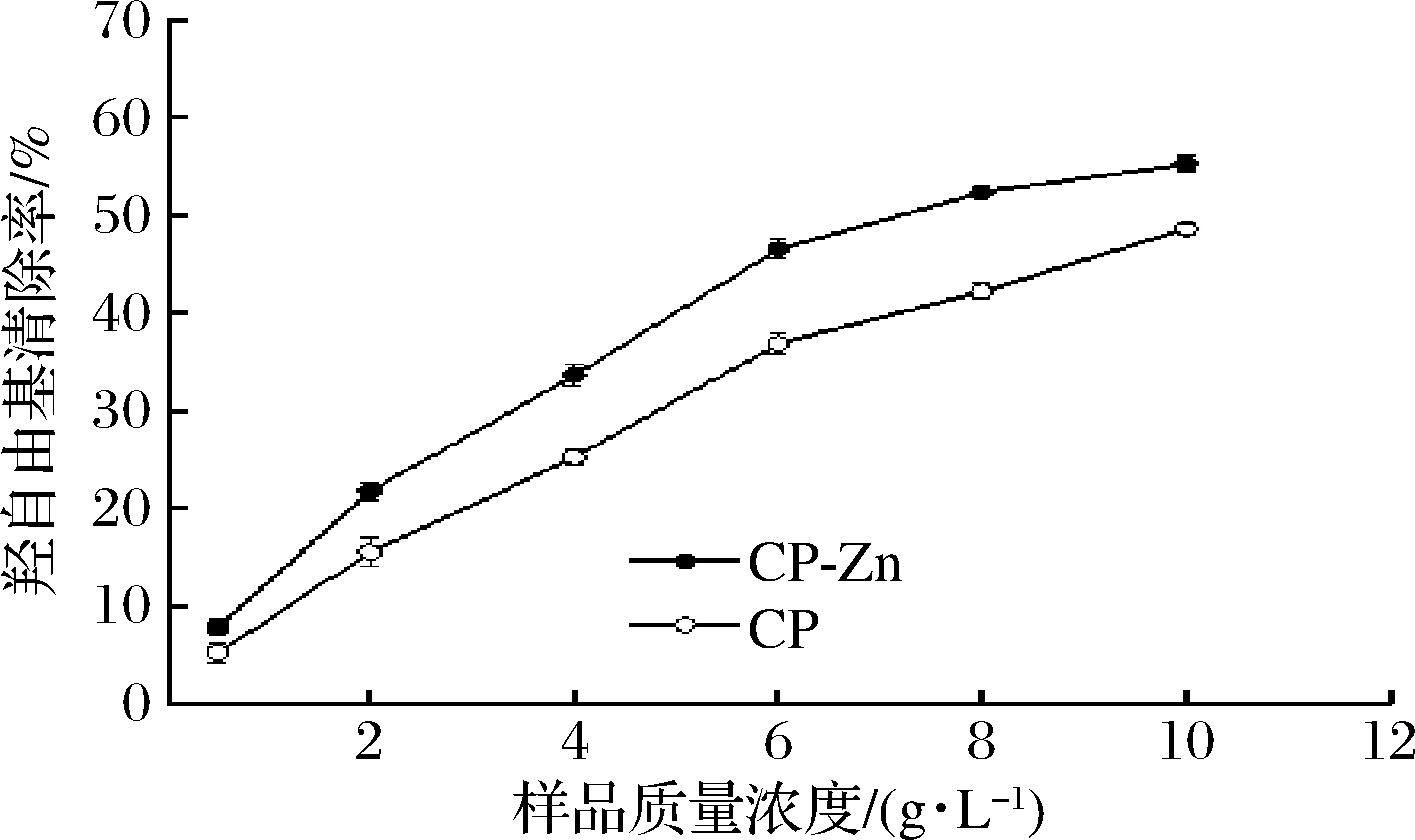
图3 CP及CP-Zn对羟自由基的清除效果
Fig.3 Scavenging effect of CP and CP-Zn on hydroxyl free radical
CP及CP-Zn的Fe3+还原能力如图4所示,CP-Zn的Fe3+还原能力高于CP,特别是在质量浓度高于4 g/L时,抗氧化优势明显。
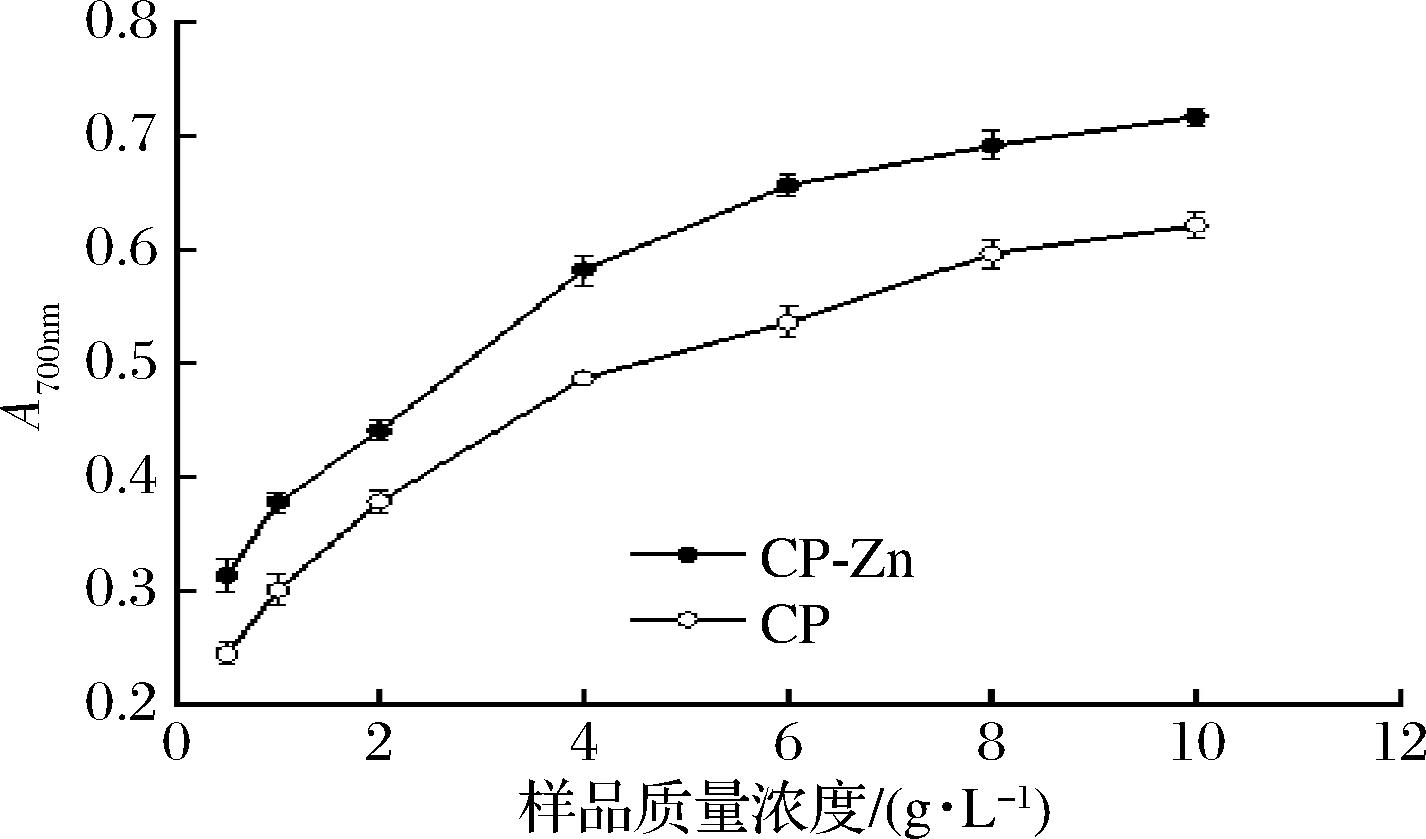
图4 CP及CP-Zn的还原能力
Fig.4 Reducing power of CP and CP-Zn
螯合工艺使得CP的抗氧化、还原能力大大提升,这很可能是因为多肽的抗氧化能力与其氨基酸的种类和组成具有一定的相关性,而且具有较强金属螯合能力的氨基酸往往也表现出良好的抗氧化活性[21]。如谷氨酸、天冬氨酸可以提供酸性氢原子增强肽类物质的还原能力[22];含咪唑基的组氨酸能够通过电子的直接转移抑制自由基[23];酪氨酸作为芳香族氨基酸可以参与供氢,减慢或终止自由基链式反应[24]。当CP与锌离子螯合后,天冬氨酸、谷氨酸、组氨酸、酪氨酸等氨基酸的比例均有所增加,从而改变了其抗氧化、还原能力。
2.5 抑菌效果
图5是CP及CP-Zn对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和白色假丝酵母等4种指示菌的抑菌效果图。CP对4种指示菌均未表现出抑菌活性,而CP-Zn的抑菌效果良好。螯合锌对枯草芽孢杆菌的抑菌效果最为明显,抑菌圈约为22.0 mm,其次是金黄色葡萄球菌,抑菌圈约为20.1 mm,对白色假丝酵母和大肠杆菌的抑菌圈分别约为17.1 mm和15.2 mm。实验结果表明CP与锌离子螯合后能够增强其抑菌活性,锌离子的加入对抑菌效果起了关键作用[25]。

1-CP-Zn;2-CP a-大肠杆菌;b-金黄色葡萄球菌;c-枯草芽孢杆菌;d-白色假丝酵母
图5 CP及CP-Zn的抑菌效果
Fig.5 Antibacterial effect of CP and CP-Zn
3 结论
以罗非鱼鳞为原料,通过螯合工艺制备了罗非鱼鳞胶原肽螯合锌。MALDI-TOF 质谱图显示罗非鱼鳞胶原肽为分子质量<1 200的小分子胶原肽,经螯合后,可以检测到[M-H+Zn]+的准离子峰,说明生成了肽-锌螯合物。氨基酸分析结果表明罗非鱼鳞胶原肽中富含羟脯氨酸、天冬氨酸和甘氨酸,与锌离子螯合后,谷氨酸和天冬氨酸等酸性氨基酸的比例明显提高。罗非鱼鳞胶原肽螯合锌的抗氧化、还原能力明显强于胶原肽,螯合后氨基酸组成比例的变化可能是主要原因。罗非鱼鳞胶原肽螯合锌对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和白色假丝酵母都有较强的抑制作用,而胶原肽无抑菌活性。本试验结果表明罗非鱼鳞胶原肽螯合锌具有良好的体外抗氧化活性及抑菌活性,这为罗非鱼鳞胶原肽螯合锌的开发应用提供了一定的理论基础。
[1] RUAN J P, CHEN J D, ZENG J, et al.The protective effects of Nile tilapia (Oreochromis niloticus) scale collagen hydrolysate against oxidative stress induced by tributyltin in HepG2 cells[J].Environmental Science and Pollution Research, 2019, 26(4):3 612-3 620.
[2] REN Y, WU H, CHI Y L, et al.Structural characterization, erythrocyte protection, and antifatigue effect of antioxidant collagen peptides from tilapia (Oreochromis nilotica L.) skin[J].Food & Function, 2020, 11:10 149-10 160.
[3] 李灵, 徐梁棕, 汪少芸.罗非鱼鱼鳞胶原多肽的优化制备及其生物活性研究[J].福州大学学报(自然科学版), 2018, 46(1):120-127.
LI L, XU L Z, WANG S Y.Optimization preparation of collagen peptides from scale of tilapia and study on their biological activity[J].Journal of Fuzhou University(Natural Science Edition), 2018, 46(1):120-127.
[4] WANG Q L, XIONG Y L.Zinc-binding behavior of hemp protein hydrolysates:Soluble versus insoluble zinc-peptide complexes[J].Journal of Functional Foods, 2018, 49:105-112.
[5] CHEN L, SHEN X R, XIA G H.Effect of molecular weight of tilapia (Oreochromis niloticus) skin collagen peptide fractions on zinc-chelating capacity and bioaccessibility of the zinc-peptide fractions complexes in vitro digestion[J].Applied Sciences, 2020, 10(6):2 041.
[6] ZHANG Z R, ZHOU F B, LIU X L, et al.Particulate nanocomposite from oyster (Crassostrea rivularis) hydrolysates via zinc chelation improves zinc solubility and peptide activity[J].Food Chemistry, 2018, 258:269-277.
[7] FANG Z, XU L Z, LIN Y L, et al.The preservative potential of Octopus scraps peptides-Zinc chelate against Staphylococcus aureus:Its fabrication, antibacterial activity and action mode[J].Food Control, 2019, 98:24-33.
[8] 李晨, 陈复生, 布冠好.肽锌螯合物研究进展[J].食品工业, 2020, 41(2):217-220.
LI C, CHEN F S, BU G H.Research progress of zinc-chelating peptide[J].The Food Industry, 2020, 41(2):217-220.
[9] 郭洪辉, 洪专.响应面法优化罗非鱼鳞胶原肽螯合锌的制备工艺[J].食品工业, 2017, 38(12):82-86.
GUO H H, HONG Z.Optimization of preparation process for collagen peptide chelated zinc from tilapia scales via response surface methodology[J].The Food Industry, 2017, 38(12):82-86.
[10] 郭洪辉, 洪专.纳滤膜对罗非鱼鳞胶原肽螯合锌脱盐性能的研究[J].食品工业, 2017, 38(9):103-106.
GUO H H, HONG Z.Study on the desalination of collagen peptide chelated zinc from tilapia scales with nanofiltration membranes[J].The Food Industry, 2017, 38(9):103-106.
[11] DING D, YU T F, DU B W, et al.Collagen hydrolysate from Thunnus orientalis bone induces osteoblast proliferation and differentiation[J].Chemical Engineering Science, 2019, 205:143-150.
[12] 宋卫得, 杜利君, 高尧华, 等.积分脉冲安培检测-离子色谱法同时测定果汁中20种氨基酸[J].中国食品添加剂, 2019,30(8):132-138.
SONG W D, DU L J, GAO Y H, et al.Simultaneous determination of twenty amino acids in fruit juice by ion chromatography with integrated pulsed amperometric detection[J].China Food Additives, 2019,30(8):132-138.
[13] 豆佳毓, 梁琪, 张炎.脱脂牦牛乳硬质干酪成熟期间水溶性多肽的抗氧化活性[J].食品与发酵工业, 2020, 46(10):80-86.
DOU J Y, LIANG Q, ZHANG Y.Antioxidant activity of water-soluble polypeptide during the maturation of skim yak milk hard cheese[J].Food and Fermentation Industries, 2020, 46(10):80-86.
[14] 秦修远, 陆路, 崔欣悦, 等.豌豆低聚肽硒螯合物的体外抗氧化作用[J].中国食品学报, 2020, 20(5):53-58.
QIN X Y, LU L, CUI X Y, et al.Antioxidant effects in vitro of selenium-chelating pea oligopeptide[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(5):53-58.
[15] AKINYEDE A I, FAGBEMI T N, OSUNDAHUNSI O F, et al.Amino acid composition and antioxidant properties of the enzymatic hydrolysate of calabash nutmeg (Monodora myristica) and its membrane ultrafiltration peptide fractions[J].Journal of Food Biochemistry, 2020, 45(3):e13437.
[16] 姜良萍, 李博, 罗永康, 等.鲢鱼源多肽锌的制备工艺对其抑菌活性的影响[J].食品科技, 2013, 38(2):125-130.
JIANG L P, LI B, LUO Y K, et al.Effects on the antibacterial activity of preparation technology for complexes of Zn2+ and peptides from silver carp (Hypophthalmichthys molitrix) proteins[J].Food Science and Technology, 2013, 38(2):125-130.
[17] 姜丹丹, 侯虎, 杜芬, 等.鳕鱼皮源锌肽螯合物结构表征及基于Caco-2 细胞模型评价其促锌吸收特性[J].中国食品学报, 2018, 18(9):265-272.
JIANG D D, HOU H, DU F, et al.Characterization of peptide-zinc complex from Alaska pollock skin and the evaluation of transport-uptake of zinc by Caco-2 monolayer cell model[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(9):265-272.
[18] 刘晓容, 郭俊斌, 廖婉雯, 等.酶法制备乳源钙螯合肽及其特性表征[J].食品研究与开发, 2020, 41(8):60-67.
LIU X R, GUO J B, LIAO W W, et al.Preparation and characterization of milk-derived calcium chelating peptide by enzymatic method[J].Food Research and Development, 2020, 41(8):60-67.
[19] 汪婧瑜, 张业辉, 阮奇珺, 等, 超声波对乌鳢短肽-锌结构及抗氧化性的影响[J].食品科学技术学报, 2020, 38(1):104-110.
WANG J Y, ZHANG Y H, RUAN Q J, et al.Effect of ultrasonic treatment on structure and antioxidant activity of Channa argus short peptide-zinc[J].Journal of Food Science and Technology, 2020, 38(1):104-110.
[20] 林海燕, 王珊珊, 孙珊, 等.响应面法优化南极磷虾亚铁螯合肽制备工艺及其理化性质[J].食品工业科技, 2019, 40(21):166-173.
LIN H Y, WANG S S, SUN S, et al.Optimization of preparation of iron-chelating peptides from Antarctic krill by response surface methodology and its physicochemical properties[J].Science and Technology of Food Industry, 2019, 40(21):166-173.
[21] AI S G, TANABE S, NISHIMURA T.Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment [J].Journal of Agricultural and Food Chemistry, 2003, 51(12):3 661-3 667.
[22] UDENIGWE C C, ALUKO R E.Chemometric analysis of the amino acid requirements of antioxidant food protein hydrolysates [J].International Journal of Molecular Sciences, 2011, 12(5):3 148-3 161.
[23] HABINSHUTI I, MU T H, ZHANG M.Ultrasound microwave-assisted enzymatic production and characterisation of antioxidant peptides from sweet potato protein[J].Ultrasonics-Sonochemistry, 2020, 69:105262.
[24] 毕秋芸. 裙带菜多肽的制备及其抗氧化活性的研究[J].中国调味品, 2019, 44(5):104-110.
BI Q Y.Study on the preparation and antioxidant activity of polypeptides from Undaria pinnatifida[J].China Condiment, 2019, 44(5):104-110.
[25] 龚毅, 胡晓波, 彭丽霞, 等.锌氨基酸螯合物的抑菌活性研究[J].食品科学, 2009, 30(17):84-87.
GONG Y, HU X B, PENG L X, et al.Antibacterial activities of four zinc-amino acid chelates[J].Food Science, 2009, 30(17):84-87.