在全球肥胖症患病率快速增长的大背景下,开发天然健康稀有糖代替已有的甜味剂成为研究热点。其中热量低、甜度高且具有独特生理功能的D-阿洛酮糖是当前最有竞争力的代糖之一[1-2]。D-阿洛酮糖是D-果糖的C-3位同分异构体,具有蔗糖70%的甜度和0.3%的热量[3],安全性得到了美国食品和药物管理局(Food and Drug Administration,FDA)的认可。此外D-阿洛酮糖还具有降低血糖[2, 4]、控制体重、抗氧化[5-6]等生物活性,这也进一步使其市场需求激增。
D-阿洛酮糖在自然界中很少存在[7],目前有化学合成法[8]和生物酶法[9]2种人工制备途径,绿色环保、工艺简单的酶法制备是主流方法。根据Izumoring稀有糖转化策略,D-果糖在D-阿洛酮糖3-差向异构酶(D-psicose 3-epimerase,DPE)的催化下,C-3位置发生可逆的差向异构化反应生成D-阿洛酮糖。已经报道了来自Ruminococcus sp.[10]、Clostridium bolteae[11]、Clostridium cellulolyticum[12]等的多种DPE,大多最适pH为弱碱性,温度高于50 ℃时迅速失活,常温下不宜贮存,影响其工业化应用[13]。
常用的提高蛋白质分子贮存稳定性的方法以蛋白质分子改造、化学修饰以及添加稳定剂3种为主。添加稳定剂是最受相关工业产品青睐,也是最便捷的改良方法。常用添加剂[14]有:(1)酶的底物或其辅助因子[15]:一定浓度的底物与酶结合,可以维持酶的构象;(2)金属离子[16]:特定金属离子可以维持金属酶的构象,有相关报道指出在Co2+存在时DPE的热稳定性有一定提升[17-18];(3)多元醇与糖[19]:多元醇和糖类主要通过与酶形成氢键来起保护作用,常用的多元醇有甘油、山梨醇、甘露醇等,常用的糖类有甘露糖、乳糖、海藻糖等;(4)具有吸附性的多聚体:通过吸附周围环境中的水,避免蛋白质被周围水溶液环境影响[20]。
虽然目前已有关于Clostridium cellulolyticum DPE(CcDPE)的稳定剂配方,但复杂繁琐[20]。本研究同样以CcDPE为对象,开发更高效易得的贮存稳定剂。结果表明,仅仅添加Co2+和甘油便可以在不影响后续酶反应的前提下,将25 ℃下CcDPE半衰期延长到80 d,为提高CcDPE工业适用性提供了基础。
1 材料与方法
1.1 菌株与培养基
菌株为本实验室构建保存的枯草芽孢杆菌重组菌株Bacillus subtilis /pHY300PLK-ccdpe。
LB液体培养基(g/L):酵母粉5.0,胰蛋白胨10.0,NaCl 10.0。
LB固体培养基:在LB液体培养基的基础配方上,添加20 g/L的琼脂。
TB培养基(g/L):酵母粉24.0,甘油5.0,胰蛋白胨12.0,K2HPO4·3H2O 16.43,KH2PO4 2.31。
甘油、CoCl2·6H2O、山梨醇、尼泊金甲酯、聚乙二醇-6000、海藻糖、4-羟乙基哌嗪乙磺酸{2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES}、NaCl、K2HPO4·3H2O、KH2PO4、四环素,生工生物工程(上海)股份有限公司;果糖,上海麦克林生化科技有限公司;液相标准样品D-阿洛酮糖,梯希爱(上海)化成工业发展有限公司。
1.2 试验方法
1.2.1 制备酶液
将本实验室保存菌株B.subtilis/pHY300PLK-ccdpe, 以2‰的接种量接入10 mL LB(含30 mg/L四环素)中,37 ℃, 200 r/min培养12 h。再以5%的接种量接入TB(30 mg/L四环素抗性)培养基中,37 ℃,200 r/min培养2 h后,转至33 ℃,200 r/min发酵48 h。发酵结束,离心收集菌液(8 000×g,15 min,4 ℃),弃置上清液。用一定体积的pH 7.5的20 mmol/L HEPES(0.1 mmol/L Co2+)重悬复溶。100 MPa高压匀浆破壁,循环3次。将破壁后获得的悬液进行离心(8 000×g, 20 min, 4 ℃),取上清液即为DPE粗酶液。
1.2.2 DPE酶活力的测定与酶转化
酶活力测定:在60 ℃,pH 7.5的条件下,以800 μL 100 g/L的D-果糖为底物,添加200 μL的酶液,精准反应10 min后煮沸灭酶。体系中D-阿洛酮糖和D-果糖的最终含量由HPLC测定,以产生D-阿洛酮糖的速率来表征酶活力。
酶活力单位定义:在60 ℃,pH 7.5的条件下,在单位时间(1 min)内产生1 μmol D-阿洛酮糖定义为1个酶活力单位(U)。
酶转化方法:在60 ℃,pH 7.5的条件下,以300 g/L的D-果糖为底物,20 U/mL加酶量,反应4 h。煮沸灭酶后用HPLC方法检测体系中D-阿洛酮糖和D-果糖含量,计算转化率。
HPLC条件:流动相为75%乙腈;柱温35 ℃;流速0.8 mL/min;进样量10 μL。
1.3 贮存稳定剂的选择
综合考虑成本与稳定效果,在DPE酶液中加入糖类、醇类、金属离子以及吸附性聚合物作为稳定剂,比较不同稳定剂的稳定效果。
1.3.1 单一稳定剂对酶稳定性的影响
将单一的60 g/L的果糖、体积分数为20%的甘油、1 mmol/L的Co2+、20 mmol/L的山梨醇、0.3%的尼泊金甲酯、4%的聚乙二醇-6000、20 mmol/L的海藻糖等加入到酶液中,4 ℃贮存,在贮存期间每隔一段时间测定酶液中残余酶活力。
1.3.2 复合稳定剂
选定稳定效果最好的2种稳定剂进行复配,分别在4、25 ℃下保存,测定酶活力随着时间的变化。
1.4 数据处理
每组实验设置3个平行实验,使用Origin 8.0软件处理数据。
2 结果与分析
2.1 稳定剂种类
不同种类稳定剂在4 ℃下对DPE的稳定效果如图1所示。海藻糖、聚乙二醇-6000以及尼泊金甲酯对维持酶活力稳定无正向效应;果糖和山梨醇对底物有一定作用,但是作用效果不显著;Co2+和甘油对CcDPE的稳定效果较好。
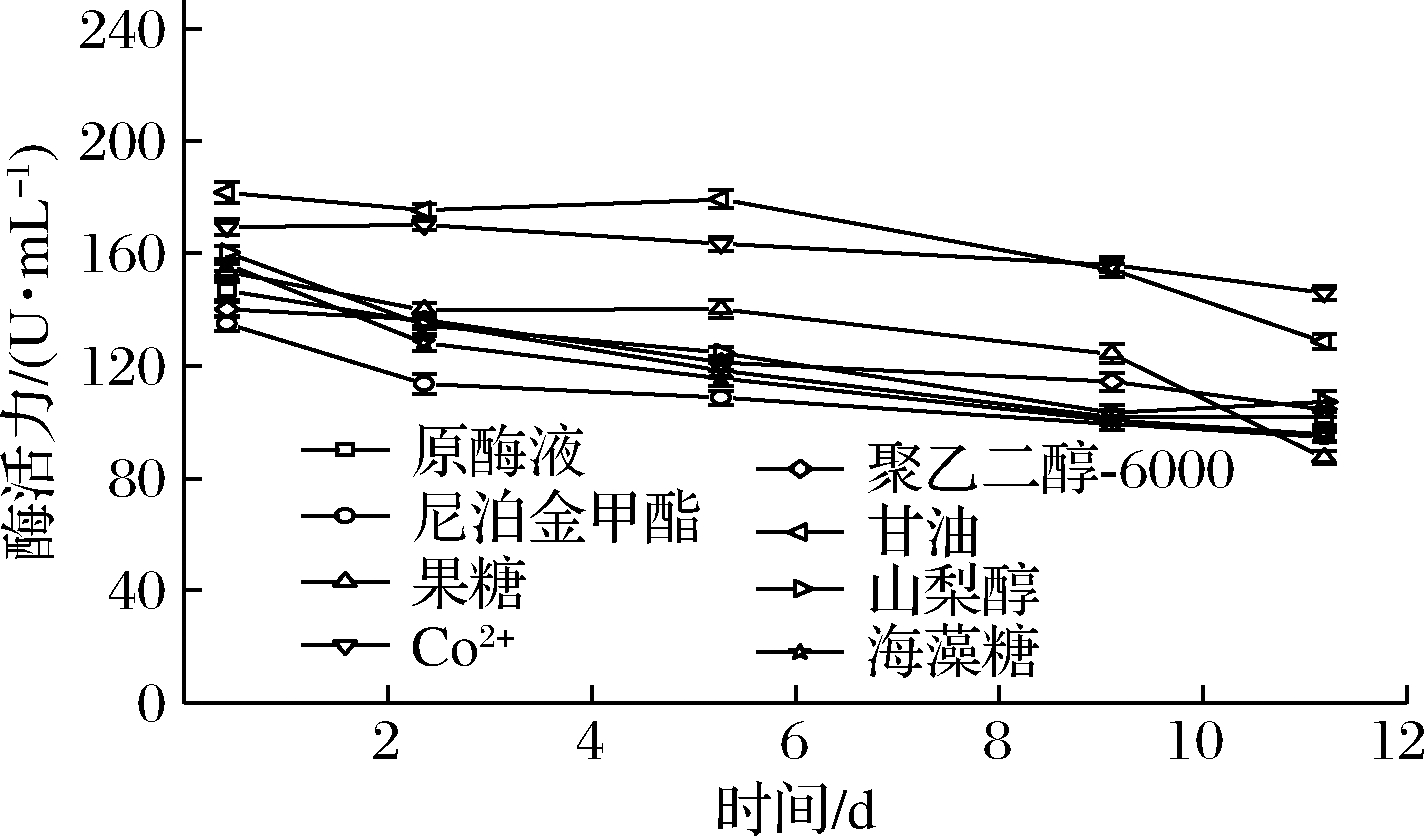
图1 4 ℃下不同稳定剂对于CcDPE的稳定效果
Fig.1 Effect of different stabilizers on the stability of CcDPE at 4 ℃
其中尼泊金甲酯因适宜环境偏酸性,在pH 7.5的酶液中作用效果不佳。果糖作为CcDPE发生酶反应的底物,可以与CcDPE结合形成复合物起保护作用。Co2+作为CcDPE的活性金属离子,可以使CcDPE构象更加稳定[16]。甘油作为常用的小分子稳定剂,可以降低体系的极性,与蛋白质形成氢键,隔绝周围的水分子环境,有助于蛋白结构稳定[14, 19, 21]。
为了验证稳定剂对后续的酶转化实验的影响,用最终甘油体积分数为0%、10%、20%与30%的CcDPE酶液进行酶转化。反应完全后,转化率依次为28.75%、28.86%、28.92%与28.91%,证明甘油不会对后续的酶转化造成影响。因此选定成本低廉的甘油和Co2+进行浓度优化和复配。
2.2 单一稳定剂浓度优化
在4、25 ℃下,对单一稳定剂Co2+、甘油的添加浓度进行优化,不同条件下CcDPE半衰期结果如表1与表2所示。
表1 不同浓度Co2+添加下CcDPE的半衰期 单位:d
Table 1 The half-life of CcDPE with different concentration of Co2+
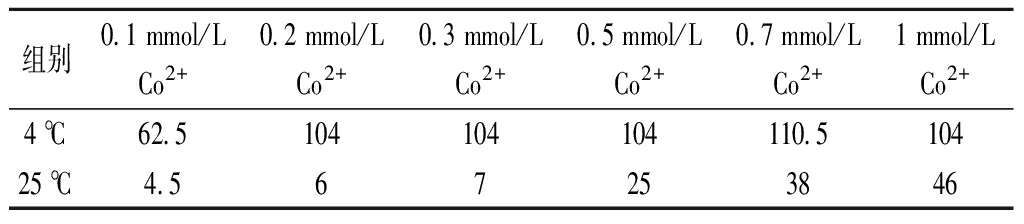
组别0.1 mmol/LCo2+0.2 mmol/LCo2+0.3 mmol/LCo2+0.5 mmol/LCo2+0.7 mmol/LCo2+1 mmol/LCo2+4 ℃62.5 104 104 104 110.5 104 25 ℃4.5 6 7 25 38 46
表2 不同浓度甘油添加下CcDPE的半衰期 单位:d
Table 2 The half-life of CcDPE with different concentration of glycerin

组别0%甘油10%甘油20%甘油30%甘油4 ℃42 4216716725 ℃4.558 33
设定0.1、0.2、0.3、0.7、1 mmol/L的Co2+浓度梯度。4 ℃(图2-a)下Co2+浓度对稳定效果影响不大。25 ℃(图2-b)下,0.2 mmol/L以上的Co2+浓度有明显的效果,作用效果与Co2+浓度呈正相关,0.5、0.7、1 mmol/L的Co2+可以分别将酶液半衰期延长到25、38、46 d。
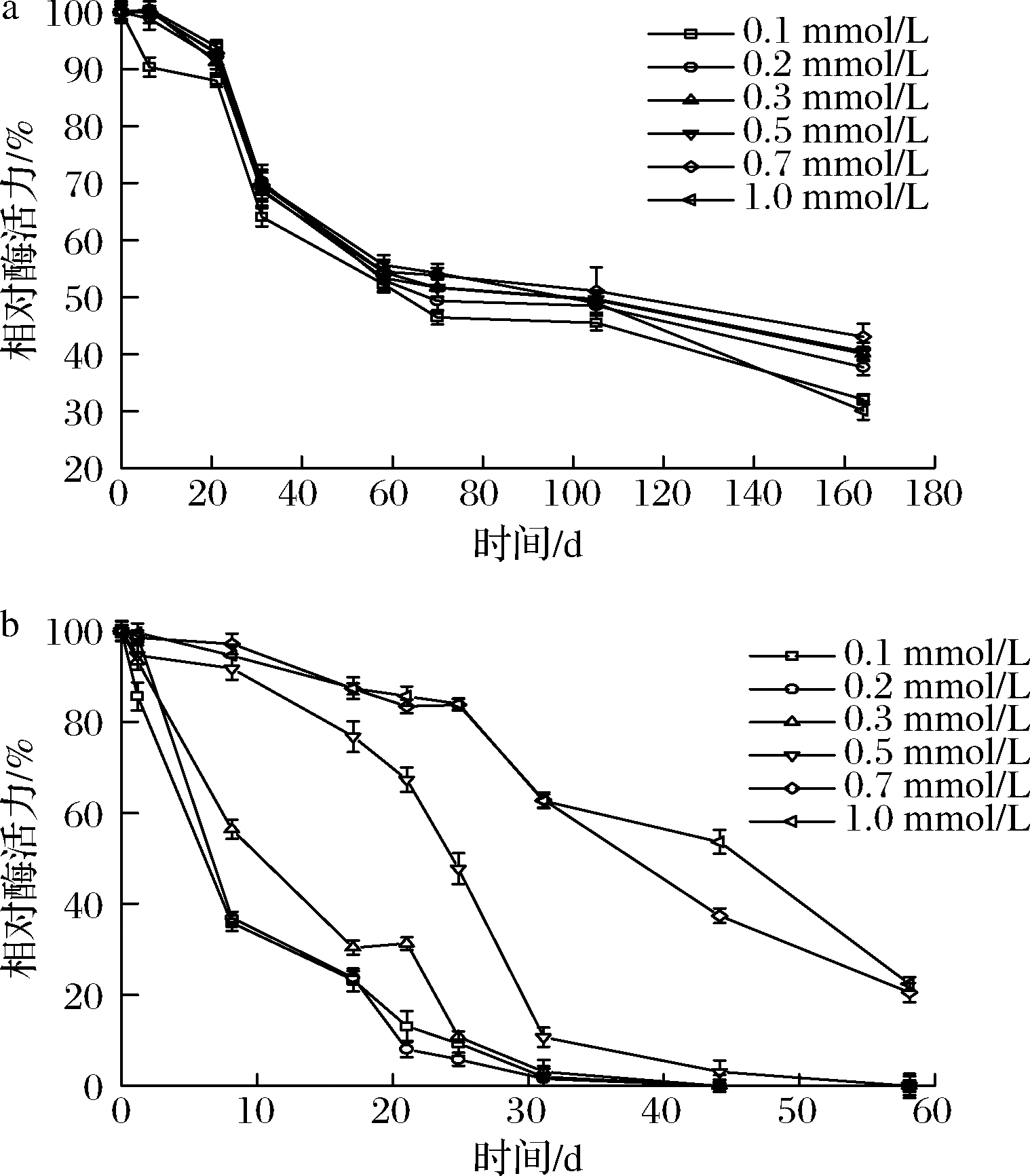
a-4 ℃;b-25 ℃
图2 不同浓度的Co2+对于CcDPE的稳定效果
Fig.2 Effect of different Co2+ concentrations on stability of CcDPE
对于甘油而言,设定0%、10%、20%、30%(体积分数)的浓度梯度。4 ℃(图3-a)下,10%的甘油在前20 d对酶活力有一定程度稳定作用,20%、30%组作用效果接近,成功将粗酶液半衰期延长到约167 d。25 ℃(图3-b)下,30%的甘油将粗酶液半衰期成功延长至33 d,是对照组的7倍。
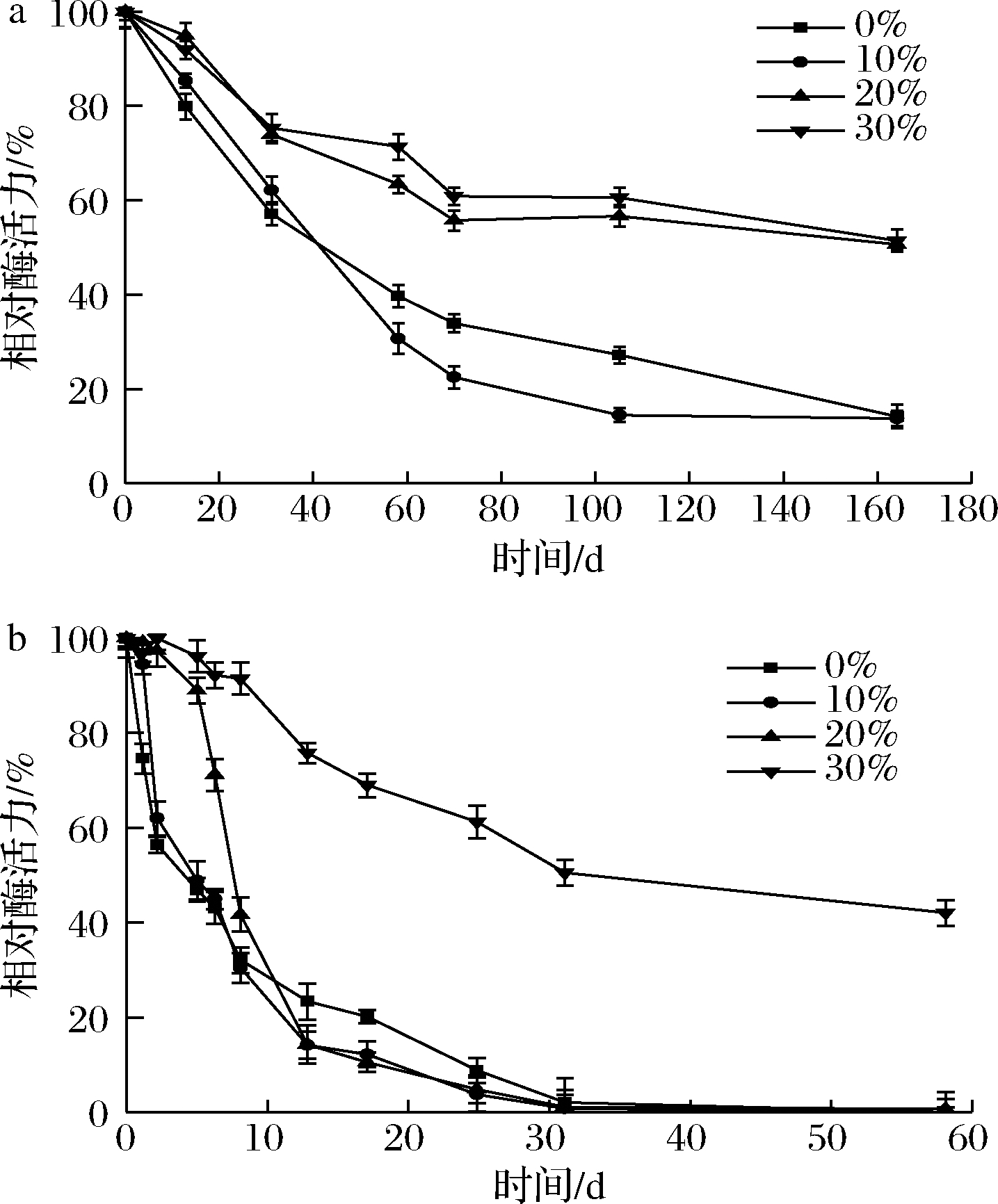
a-4 ℃;b-25 ℃
图3 不同浓度的甘油对于CcDPE的稳定效果
Fig.3 Effect of different glycerin concentrations on stability of CcDPE
2.3 复合稳定剂的效果
优化甘油与Co2+的复配稳定剂配方,不同条件下CcDPE半衰期见表3。4 ℃下(图4-a)放置150 d,不同组别的残余酶活力均稳定在70%以上,效果相差不显著。25 ℃下,效果最好的是20%甘油与0.5 mmol/L Co2+的组合,将CcDPE粗酶液半衰期延长到80 d。
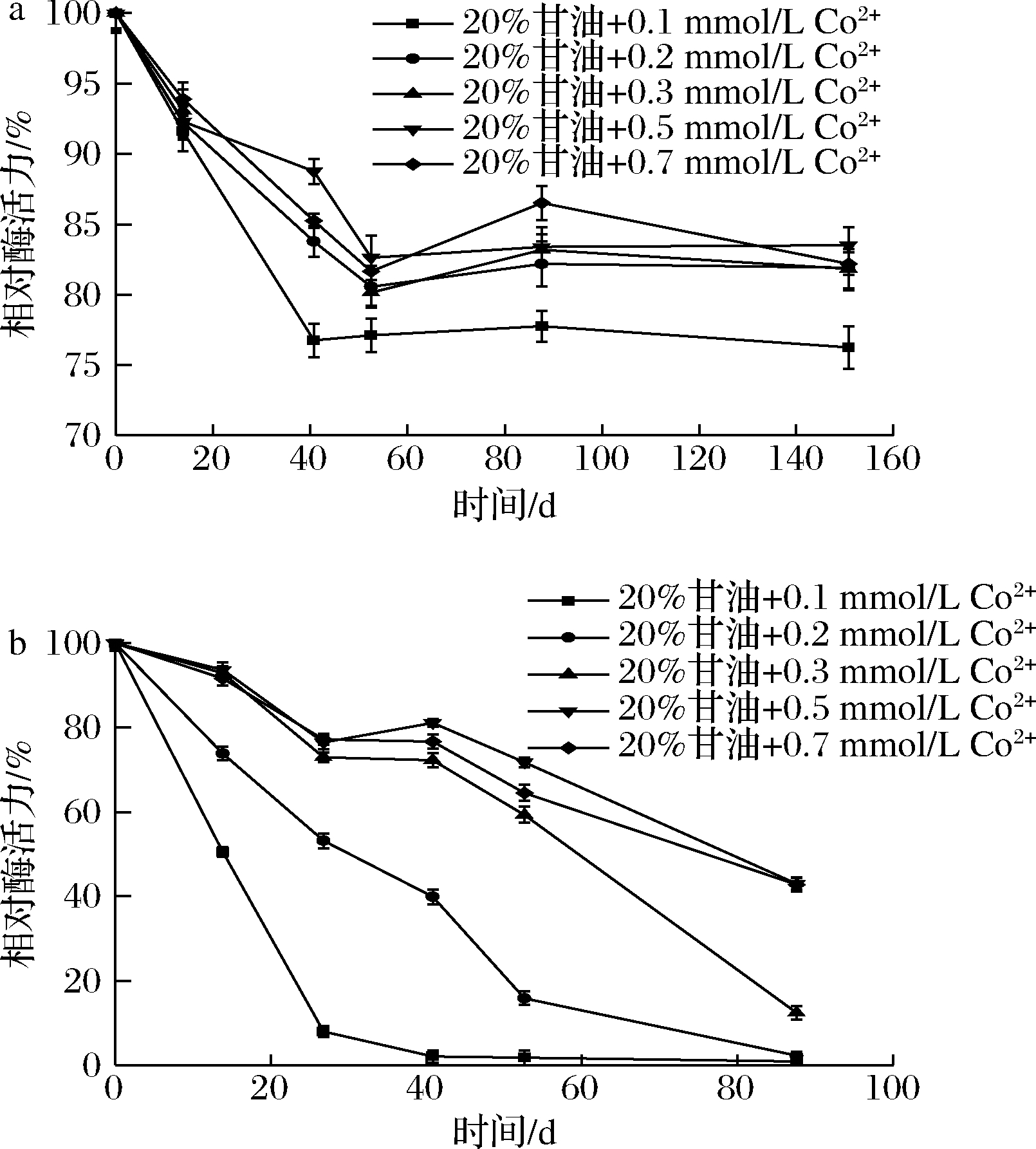
a-4 ℃;b-25 ℃
图4 复合稳定剂对CcDPE稳定性的影响
Fig.4 Effect of combined stabilizers on stability of CcDPE
表3 不同复合稳定剂配方下CcDPE的半衰期 单位:d
Table 3 The half-life of CcDPE under different combined stabilizer formulations

组别20%甘油+0.1 mmol/L Co2+20%甘油+0.2 mmol/L Co2+20%甘油+0.3 mmol/L Co2+20%甘油+0.5 mmol/L Co2+20%甘油+0.7 mmol/L Co2+4 ℃150 d残余酶活力都在70%以上25 ℃14.130.8 59.680.0 81.3
SOENGAS等[8]发现含1 mmol/L Mn2+的来自Geobacillus stearothermophilus的L-阿拉伯糖异构酶在70 ℃下孵育2 h后几乎没有活性丧失,而无Mn2+的对照组酶的残留活性为70%。MU等[17]发现Co2+对CcDPE构象有维稳作用。张巧等[20]向CcDPE粗酶液中添加0.3%尼泊金甲酯、2 mmol/L MgSO4,6%果糖以及4%肌醇,将25 ℃下的半衰期延长到62 d;ZHANG等[22]又指出MnSO4和乙二醇能通过维持DPE构象稳定性提高贮存稳定性,25 ℃贮存30 d的实验组残余酶活力分别高出对照组17%与10%。本研究仅添加金属离子[16]和甘油[19] 便可将CcDPE于25 ℃下的半衰期延长至80 d,绿色高效,更适合后续在食品、医疗等领域的推广。
3 结论
本研究以CcDPE为对象,通过添加Co2+和甘油,解决了工业应用中贮存稳定性差的问题。结果显示,4 ℃下,Co2+浓度对稳定效果影响不大;25 ℃下,0.2 mmol/L以上的Co2+作用效果与浓度正相关,1 mmol/L的Co2+可以将粗酶液半衰期延长到46 d。4 ℃下,体积分数为20%和30%的甘油均可将CcDPE半衰期延长至167 d;25 ℃下,30%的甘油可以将半衰期延长到33 d。优化复合稳定剂配方,20%甘油与0.5 mmol/L Co2+组合可以将25 ℃下CcDPE的半衰期延长至80 d。研究结果为CcDPE进一步工业化应用提供了支撑。
[1] MOORADIAN A D, SMITH M, TOKUDA M, The role of artificial and natural sweeteners in reducing the consumption of table sugar:A narrative review[J].Clinical Nutrition ESPEN, 2017,18:1-8.
[2] HAN Y, PARK H, CHOI B R, et al.Alteration of microbiome profile by D-allulose in amelioration of high-fat-diet-induced obesity in mice[J].Nutrients, 2020,12(2):352-365.
[3] 黄擎宇, 徐铮,熊强,等.零热量甜味剂D-阿洛酮糖的研发进展[J].工业微生物, 2020, 50 (3):57-63.
HUANG Q Y, XU Z, XIONG Q, et al.Progress in research and development of calorie-free sweetener D-allulose production[J].Industrial Microbiology, 2020, 50 (3):57-63.
[4] BRAUNSTEIN C R, NORONHA J C, KHAN T A, et al.Effect of fructose and its epimers on postprandial carbohydrate metabolism:A systematic review and meta-analysis[J].Clinical Nutrition, 2020, 39 (11):3 308-3 318.
[5] MUNEUCHI G, HOSSAIN A, YAMAGUCHI F, et al.The rare sugar D-allose has a reducing effect against ischemia-reperfusion injury on the rat abdominal skin island flap model[J].Journal of Surgical Research, 2013, 183 (2):976-981.
[6] MURATA A, SEKIYA K, WATANABE Y, et al.A novel inhibitory effect of d-allose on production of reactive oxygen species from neutrophils[J].Journal of Bioscience and Bioengineering, 2003, 96 (1):89-91.
[7] HOUGH L, STACEY B E.The occurrence of D-ribohexulose in Itea ilicifolia, Itea virginica, and Itea yunnanensis[J].Phytochemistry,1963, 2 (4):315-320.
[8] SOENGAS R, IZUMORI K, SIMONE M I, et al.Kiliani reactions on ketoses:Branched carbohydrate building blocks from D-tagatose and D-psicose[J].Tetrahedron Letters, 2005, 46 (34):5 755-5 759.
[9] JIANG S W, XIAO W, ZHU X X, et al.Review on D-allulose:In vivo metabolism, catalytic mechanism, engineering strain construction, bio-production technology[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:26.
[10] ZHU Y M, MEN Y, BAI W,et al.Overexpression of D-psicose 3-epimerase from Ruminococcus sp.in Escherichia coli and its potential application in D-psicose production[J].Biotechnology Letters, 2012, 34 (10):1 901-1 906.
[11] JIA M, MU W M, CHU F F, et al.A D-psicose 3-epimerase with neutral pH optimum from Clostridium bolteae for D-psicose production:Cloning, expression, purification, and characterization[J].Applied Microbiology and Biotechnology,2014, 98 (2):717-725.
[12] ZHU J X, LI Y, WANG J Z, et al.Adaptive steered molecular dynamics combined with protein structure networks revealing the mechanism of Y68I/G109P mutations that enhance the catalytic activity of D-psicose 3-epimerase from Clostridium bolteae[J].Frontiers in Chemistry, 2018, 6:437.
[13] 孙帆. 解纤维梭菌D-阿洛酮糖3-差向异构酶在枯草芽孢杆菌中的重组表达、应用及固定化研究[D].无锡:江南大学, 2018.
SUN F.Recombinant expression, application of Clostridium cellulolyticum H10 DPEase in Bacillus subtilis and immobilized cells[D].Wuxi:Jiangnan University, 2018.
[14] 王亚军, 曹块.添加剂提高酶稳定性研究进展[J].发酵科技通讯, 2016, 45 (3):188-192.
WANG Y J, CAO K.Advance in enzymes stability enhancement through additives supplementing[J].Bulletin of Fermentation Science and Technology, 2016, 45 (3):188-192.
[15] KIM J, GRATE J W, WANG P,et al.Nanostructures for enzyme stabilization[J].Chemical Engineering Science, 2006, 61 (3):1 017-1 026.
[16] 吴京平. 金属离子对蛋白酶活力和热稳定性的影响[J].中国皮革, 2004, 33(11):32-36.
WU J P.Effect of metal ion on activity and hot stability of protease[J].China Leather, 2004, 33(11):32-36.
[17] MU W M, CHU F F, XING Q C, et al.Cloning, expression, and characterization of a D-psicose 3-epimerase from Clostridium cellulolyticum H10[J].Journal of Agricultural and Food Chemistry, 2011, 59 (14):7 785-7 792.
[18] CHAN H C, ZHU Y M, HU Y M, et al.Crystal structures of D-psicose 3-epimerase from Clostridium cellulolyticum H10 and its complex with ketohexose sugars[J].Protein & Cell, 2012, 3(2):123-131.
[19] 许燕波, 钱春香, 陆兆文.甘油提高巴氏芽孢杆菌脲酶的热稳定性[J].东南大学学报(自然科学版), 2013, 43 (1):147-151.
XU Y B, QIAN C X, LU Z W. Study on enhancing urease thermostability of Bacillus pasteurii by glycerol[J].Journal of Southeast University(Natural Science Edition), 2013, 43(1):147-151.
[20] 张巧, 帅玉英, 张涛,等.D-塔格糖3-差向异构酶的储存稳定性[J].食品与发酵工业, 2014, 40 (12):1-5.
ZHANG Q, SHUAI Y Y, ZHANG T, et al.Study on storage stability of D-tagatose 3-epimerase[J].Food and Fermentation Industries, 2014, 40 (12):1-5.
[21] 叶双双, 周丽, 周哲敏.基于保护剂筛选及优化策略提高苯丙氨酸羟化酶热稳定性[J].食品与发酵工业, 2016, 42 (6):56-61.
YE S S, ZHOU L, ZHOU Z M.Enhancement of thermostability of phenylalanine hydroxylase based on the strategy of screening and optimization of additives[J].Food and Fermentation Industries, 2016, 42 (6):56-61.
[22] ZHANG Q, JIANG B, ZHANG T, et al.Deactivation kinetics and the effects of additives on storage stability and structure of D-psicose 3-epimerase[J].Biotechnology Letters, 2018, 40(1):173-179.