胰蛋白酶(EC 3.4.21.4)是一种碱性蛋白酶,能专一性催化蛋白质肽链中精氨酸(R)或赖氨酸(K)残基羧基端的肽键或酰胺键的水解[1]。胰蛋白酶已经广泛应用于皮革软化、洗涤、食品和制药工业,约占工业酶制剂市场的3%[2]。目前大部分市售胰蛋白酶主要从猪、牛、羊等哺乳动物[3]的胰腺组织提取。然而,哺乳动物组织提取物通常具有免疫原性及病原体污染[4]等隐患,限制了其在食品与医药领域的应用。因此,微生物来源胰蛋白酶的开发成为重要研究方向。
目前动物来源胰蛋白酶的异源表达以猪胰蛋白酶为主要研究对象,其在大肠杆菌中以包涵体形式表达,在包涵体复性后,最高产量为209 mg/L活性胰蛋白酶[5](2 L发酵罐)。在毕赤酵母中,猪胰蛋白酶以酶原的形式表达,产量为480 mg/L,经肠激酶激活后酶活力可达19.2 U/mL[6](5 L发酵罐)。微生物来源胰蛋白酶主要研究对象为尖孢镰刀菌胰蛋白酶(Fusarium oxysporum trypsin,FOT)与灰色链霉菌胰蛋白酶(Streptomyces griseus trypsin, SGT)。FOT在毕赤酵母中以成熟酶的形式表达,酶活力为2.7 U/mL(摇瓶水平)[7]。重组SGT在大肠杆菌中同样以包涵体形式存在,而在变铅青链霉菌与枯草芽孢杆菌中SGT以成熟酶的形式实现了活性表达,最大酶活力分别为9.21 U/mL(摇瓶水平)[8]与33.8 U/mL(摇瓶水平)[9]。针对SGT表达量低、酶原活化效率低和稳定性差等问题,本研究室通过融合高效分泌信号肽、自活化前导肽、疏水性前导肽及自降解位点突变(R145I/K101A/R201V)等策略[10-12],实现了SGT在毕赤酵母中的高效活性表达,5 L发酵罐的酰胺降解酶活力为549.18 U/mL,是目前文献报道的重组SGT最高产量。因此,毕赤酵母较其他宿主更适于SGT的表达。
目前,研究者已提出一系列基于宿主改造和发酵条件优化提高毕赤酵母产酶性能的策略。毕赤酵母宿主改造主要基于过量表达分子伴侣,其中Cne1蛋白具有辅助糖蛋白折叠的功能,与葡萄糖氧化酶(glucose oxidase,GOD)共表达时,GOD酶活力提高141%[13]。Ssa4与Bmh2蛋白能够提高蛋白运输速率,2F5 FAB单克隆抗体片段与其分别共表达时,表达量分别提高了60%与50%[14]。Vhb蛋白能够增强氧气运输速率,与纤维素酶Cel5A共表达时,Cel5A的酶活提高了40%[15]。此外,转录因子Yap1参与毕赤酵母碳水化合物代谢与氧化应激反应,其与β-葡萄糖醛酸苷酶PGUS共表达时,PGUS酶活力提高80.4%[16]。转录因子Aft1参与蛋白折叠和分泌,与水蛭透明质酸酶LHyal共表达时,LHyal酶活力提高47.1%[17]。发酵条件优化集中于培养基pH优化及补料控制。对于最适反应pH或稳定pH偏碱性的重组酶,pH<5.5将限制活性酶的产量。在中性pH条件下诱导表达Penicillium cyclopium二酰基甘油脂肪酶在毕赤酵母的胞外表达量可达到2.43 g/L[18]。以甲醇为诱导剂的醇氧化酶 (alcohol oxidase,AOX)启动子是毕赤酵母系统最重要的启动子之一,但甲醇对细胞的毒害作用日趋受到重视。作为AOX1启动子的非抑制性碳源,山梨醇与甲醇混合补料能将毕赤酵母主要供能途径由甲醛异化供能转向三羧酸循环,细胞产热与耗氧速率下降的同时强化目标蛋白合成途径[19-20]。
在前期构建的产SGT重组毕赤酵母的基础上[10-11],本研究考察了转录因子(Aft1和Yap1)及分子伴侣(Cne1、Ssa4、Bmh2和Vhb)对SGT表达的影响,并优化了发酵pH及补料策略,显著提高了SGT的发酵水平,为降低胰蛋白酶工业化生产提供了重要的基础数据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
整合表达质粒pGAPZB[17]、Escherichia coli JM109和重组菌PP-SGTm[11](含重组质粒pPIC9K-SGTm的Pichia pastoris GS115)均为作者所在实验室保存。
1.1.2 主要试剂
限制性内切酶AvrⅡ、大肠杆菌感受态制备试剂盒、PrimerSTAR Max DNA 聚合酶、酵母基因组DNA 抽提试剂盒,TaKaRa 公司;无缝克隆试剂盒、博莱霉素、质粒提取试剂盒,上海生工公司;酵母粉、胰蛋白胨,Oxoid 公司;底物BAPNA,Sigma 公司(美国);蛋白质Maker、蛋白电泳 Loading buffer、Bis-Tris 预制凝胶,Invitrogen 公司;BCA 蛋白浓度检测试剂盒,天根公司。其他常规试剂及药品为国产或进口分装。
1.1.3 培养基
LB培养基(g/L):酵母提取物 5,蛋白胨 10,NaCl 5,pH 7.0。
YPD 培养基(g/L):酵母提取物 10,蛋白胨 20,D-葡萄糖 20。
BMMY培养基:酵母提取物10 g/L,蛋白胨20 g/L,甲醇10 g/L,PBS 50 mmol/L,10×YNB 酵母基础氮源母液10%(体积分数),生物素 4×10-4 g/L。
BMGY培养基:酵母提取物10 g/L,蛋白胨20 g/L,甘油20 g/L,PBS 50 mmol/L,10×YNB酵母基础氮源母液10%(体积分数),生物素 4×10-4 g/L。
BSMG 培养基(g/L):CaSO4·2H2O 0.93,K2SO4 24.6,MgSO4·7H2O 14.9,(NH4)2SO4 10,甘油 40,六水甘油磷酸钠 12,PTM1 4 mL/L。
PTM1 微量元素溶液(g/L):CuSO4·5H2O 6,KI 0.08,MnSO4·H2O 3,Na2MoO4·2H2O 0.2,H3BO30.02,CoCl2 0.5,ZnCl2 20,FeSO4·7H2O 65,Biotin 0.2,H2SO4 5 mL/L。
1.2 实验方法
1.2.1 分子伴侣及转录因子表达载体的构建及转化
按表1引物以毕赤酵母GS115基因组为模板扩增Bmh2(Genebank NO:28198501)、Cne1(Genebank NO:8198102)、Ssa4(Genebank NO:8197809)、Yap1(Genebank NO:18200866)与Aft1(Genebank NO:18200866)基因;以质粒pGapZB为模板,扩增含有相应分子伴侣基因同源臂的载体片段。按照上海生工无缝克隆试剂盒说明书,连接转录因子或分子伴侣基因与对应载体片段。连接完成后转化E.coli JM109,提取重组质粒进行测序验证。Vhb(GenBank No.AAA27585.1)基因由上海生工根据毕赤酵母密码子偏好性合成,并克隆至pGapZB载体(图1-a)。
将上述分子伴侣及转录因子的表达载体分别用AvrⅡ酶切,将线性化的载体转化PP-SGTm感受态。将菌液涂布于含100 μg/mL博莱霉素YPD平板,采用pGapZB载体的通用引物pGAPF与3AOX(表1)进行菌落PCR验证。获得单一目标分子伴侣或转录因子基因条带的克隆即为阳性转化子。
1.2.2 重组毕赤酵母摇瓶发酵
重组毕赤酵母于YPD平板30 ℃培养48 h后,挑取单菌落接种含有50 mL YPD培养基的250 mL 摇瓶中,于30 ℃和220 r/min培养至OD600=7。将发酵液于5 000 r/min离心5 min,去除上清液后,用无菌生理盐水洗涤菌体沉淀2次。分别用50 mL pH为5.0、5.5、6.0、6.5和7.0 的BMMY培养基重悬菌体,于30 ℃和220 r/min 下继续发酵,每24 h补加1%的甲醇。发酵120 h后,取发酵上清液测定SGT酶活力。
为测定pH对菌体生长的影响,重组毕赤酵母于YPD平板30 ℃培养48 h后,挑取单菌落接种至pH分别为5.0、5.5、6.0、6.5和7.0 的含50 mL BMGY培养基的250 mL摇瓶中,30 ℃和220 r/min培养120 h。测定OD600并绘制生长曲线。
表1 本研究所用引物
Table 1 Primers used in this study

基因名称引物名称引物序列Aft1Aft1-FatgtctttgattccagagaagaagctttAft1-RctagaacttcataaaggcgttgtcatgagYap1Yap1-FatgagtgacgtggtaaacaagagagcggcaaYap1-RctatttaaacatggaaaaatcgacaacatctggctcagtctCne1Cne1-FatgaagatctctaccattgcaagttctacgttgttCne1-RctaggttctctttgtagctttagtcgagttcttagcagSsa4Ssa4-FatgggtaaatcaattggaattgatttgggtaccacatactctSsa4-RttaatcgacttcttccacggttggtccgcBmh2Bmh2-FatgtcaagagaagattctgtttatttagcaaaactagctgagBmh2-RtcactcttcatctttgggagcagvttvtgtvtAft1载体片段GB-Aft-FttcttctctggaatcaaagacatttcgaaatagttgttcaattgattgaaatagggaGB-Aft-RttcttctctggaatcaaagacatttcgaaatagttgttcaattgattgaaatagggaYap1载体片段GB-Yap-FctcttgtttaccacgtcactcatttcgaaatagttgttcaattgattgaaatagggaGB-Yap-RcgatttttccatgtttaaatagtctagaacaaaaactcatctcagaagagCne1载体片段GB-Cne-FtgcaatggtagagatcttcatttcgaaatagttgttcaattgattgaaatagggaGB-Cne-RtaaagctacaaagagaacctagtctagaacaaaaactcatctcagaagagSsa4载体片段GB-Ssa-FaattgatttacccatttcgaaatagttgttcaattgattgaaatagggaGB-Ssa-RgaagaagtcgattaatctagaacaaaaactcatctcagaagagBmh2载体片段GB-Bmh-FtgctcccaaagatgaagagtgatctagaacaaaaactcatctcagaagagGB-Bmh-RtaaacagaatcttctcttgacatttcgaaatagttgttcaattgattgaaatagggaPGAPZB通用引物PGAPFgtccctatttcaatcaattgaa3AOXtggcattctgacatcctc
注:下划线为分子伴侣或转录因子基因对应的同源臂序列
1.2.3 重组毕赤酵母5 L罐发酵
将重组毕赤酵母在YPD平板上30 ℃培养48 h,挑取单菌落接种含有200 mL YPD培养基的2 L 摇瓶中,30 ℃、220 r/min培养至OD600=7。将发酵液接种至含有2 L BSMG培养基的5 L发酵罐中。以50%氨水和30%磷酸溶液控制pH 5.5,设定初始发酵温度、搅拌转速和通气量分别为30 ℃、400 r/min和2 L/min;当发酵液溶解氧上升至60%时,以0.18/h的比生长速率,指数流加250 mL的500 g/L甘油(含12 mL/L PTM1),通气量调节至4 L/min,搅拌转速与溶氧关联(溶解氧维持20%)。指数速率如公式(1)所示:
(1)
式中:μset,设定比生长速率,h-1;ρx0 ,初始菌体质量浓度,g/L;V0 ,初始体积,L;ρs,发酵液中甘油浓度,g/L;YX/S,菌体得率系数,g/g;t,指数流加开始后的发酵时间。
待发酵液溶解氧再次上升至60%时,控制pH 6.5开始恒速流加甲醇与山梨醇[6 g/(L·h)]。甲醇与山梨醇的质量比分别设为20∶0、20∶0.5、20∶1和20∶1.5。每隔12 h取1次样,测定菌体干重和酶活力等性质。
1.2.4 甘油浓度的测定
采用高碘酸钠比色法[21]测定发酵液中的甘油浓度。
1.2.5 胰蛋白酶酰胺酶活力的测定
以Nα-苯甲酰-DL-精氨酸-p-硝基苯酰胺(Nα-benzoyl-DL-arginine-4-nitroanilide hydrochloride,BAPNA)为底物测定胰蛋白酶活力。将100 μL酶液与900 μL BAPNA溶液(50 mmol/L pH 8.0 磷酸钾缓冲液,20 mmol/L CaCl2,10 mmol/L BAPNA)混合后,测定其在37 ℃下410 nm处吸光值变化值(ΔA410/min)。酶活力定义为:在37 ℃下,升高0.1即为胰蛋白酶的1个酰胺酶水解单位[12]。计算如公式(2)所示:
酰胺酶活力![]()
(2)
1.2.6 毕赤酵母醇氧化酶活力的测定
取1 mL重组毕赤酵母发酵液,离心后收集菌体,用去离子水洗涤2次。用50 mmol/L pH 7.5 的PBS重悬并测定OD600。取300 μL的重悬液于0 ℃高压匀浆破碎,加入700 μL PBS 溶液,混匀后于4 ℃和8 000 r/min离心10 min,取上清液置于冰上。反应体系共3 mL:100 mmol/L pH 6.0 PBS,4.3 μmol/L苯酚,200 μmol/L甲醇,1 μmol/L 4-氨基安替吡啉,15 U的辣根过氧化物酶以及1 mL待测酶液。在37 ℃下测定在500 nm处吸光度的改变,计算醌的增加量从而测定醇氧化酶的活力。酶活力单位定义为:1 mL 细胞重悬液,在OD600=1时,37 ℃,pH 6.0的条件下1 min产生1 μmol 的过氧化氢所需的酶量[22]。
1.2.7 SDS-PAGE 凝胶电泳分析
具体操作方法请参考Invitrogen 公司Bis-Tris 预制凝胶说明书。
2 结果与分析
2.1 共表达转录因子及分子伴侣对SGT酶活力的影响
在前期构建的重组毕赤酵母中[10-11],以pPIC9K为整合表达载体,在SGT突变体(R145I/K101A/R201V/Q151P)上游依次融合了高效分泌信号肽、自活化前导肽及疏水性前导肽(图1-a)。为进一步提高SGT的表达水平,基于pGAPZB分别构建了转录因子(Aft1和Yap1)及分子伴侣(Cne1、Ssa4、Bmh2和Vhb)的整合表达载体(图1-a),并转化至上述重组毕赤酵母中与SGT共表达。菌落PCR分析显示,扩增得到的转录因子及分子伴侣基因片段得到与各自理论分子量一致的条带(图1-b)。
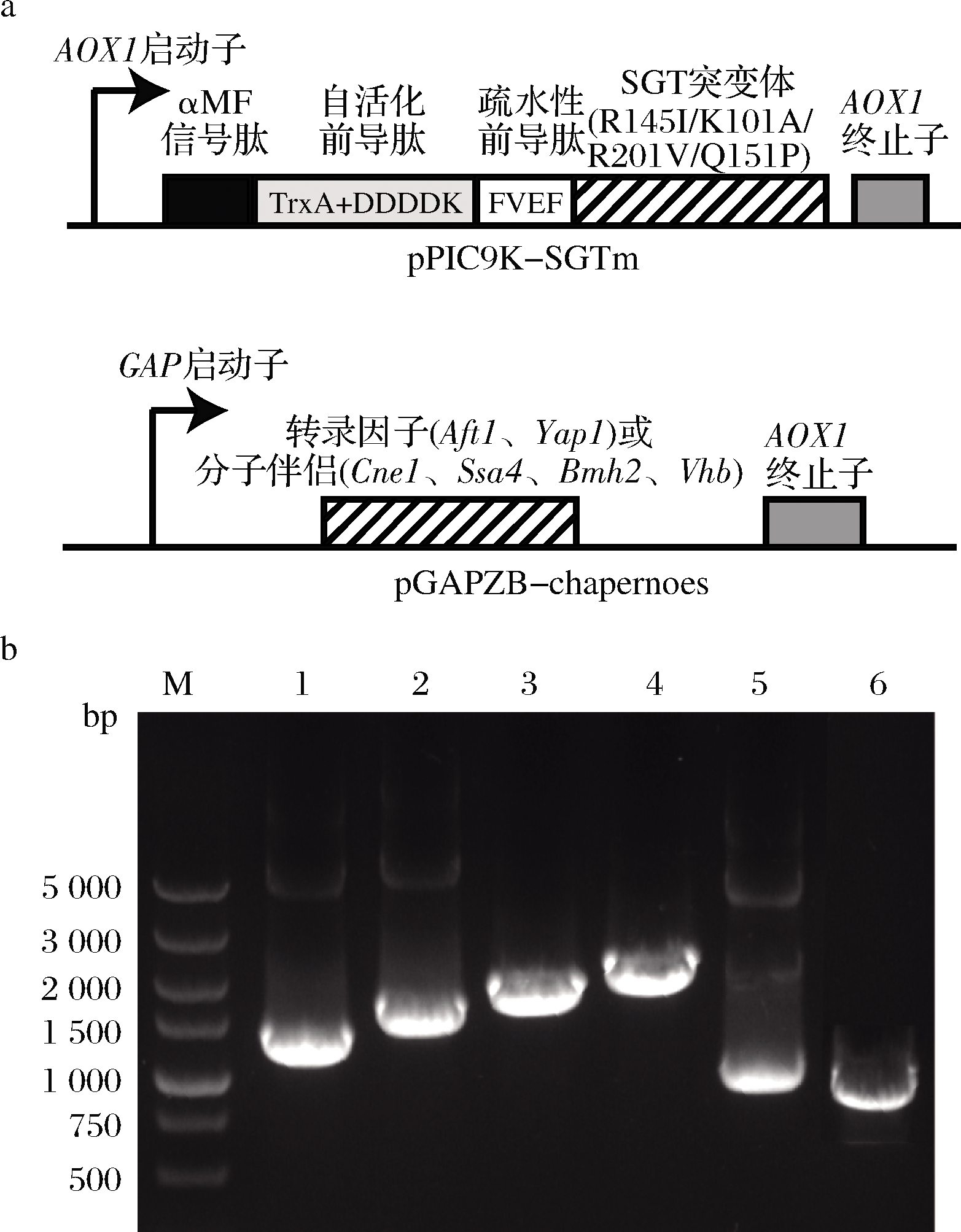
M-DNA标准分子质量;1-Aftl;2-Yapl;3-Cnel;4-Ssa4;5-Bmh2;6-Vhb a-SGT突变体与分子伴侣或转录因子表达质粒示意图; b-菌落PCR验证共表达菌株
图1 共表达SGT突变体与分子伴侣(或转录因子) 重组毕赤酵母的构建
Fig.1 The scheme of the recombinant P.pastoris co-expressing SGT mutant and chaperones (or transcription factors)
如图2所示,甲醇诱导120 h后,共表达转录因子Aft1使SGT酶活力提高19.71%,达到217.30 U/mL,而其他转录因子或分子伴侣的表达使SGT酶活力有所下降。Aft1的过表达也使胞外总蛋白含量较对照提高了9.8%达到了753.51 μg/mL。研究表明,在毕赤酵母中Aft1调控多个分子伴侣的表达,涉及蛋白折叠(Pdi1和BiP)、糖基化(Och1)、胞内运输(Sec12、Sec23、Sec61和Gos1)及蛋白跨膜运输(Kin1)等过程[23]。上述结果表明,Aft1有效促进了SGT的分泌表达。
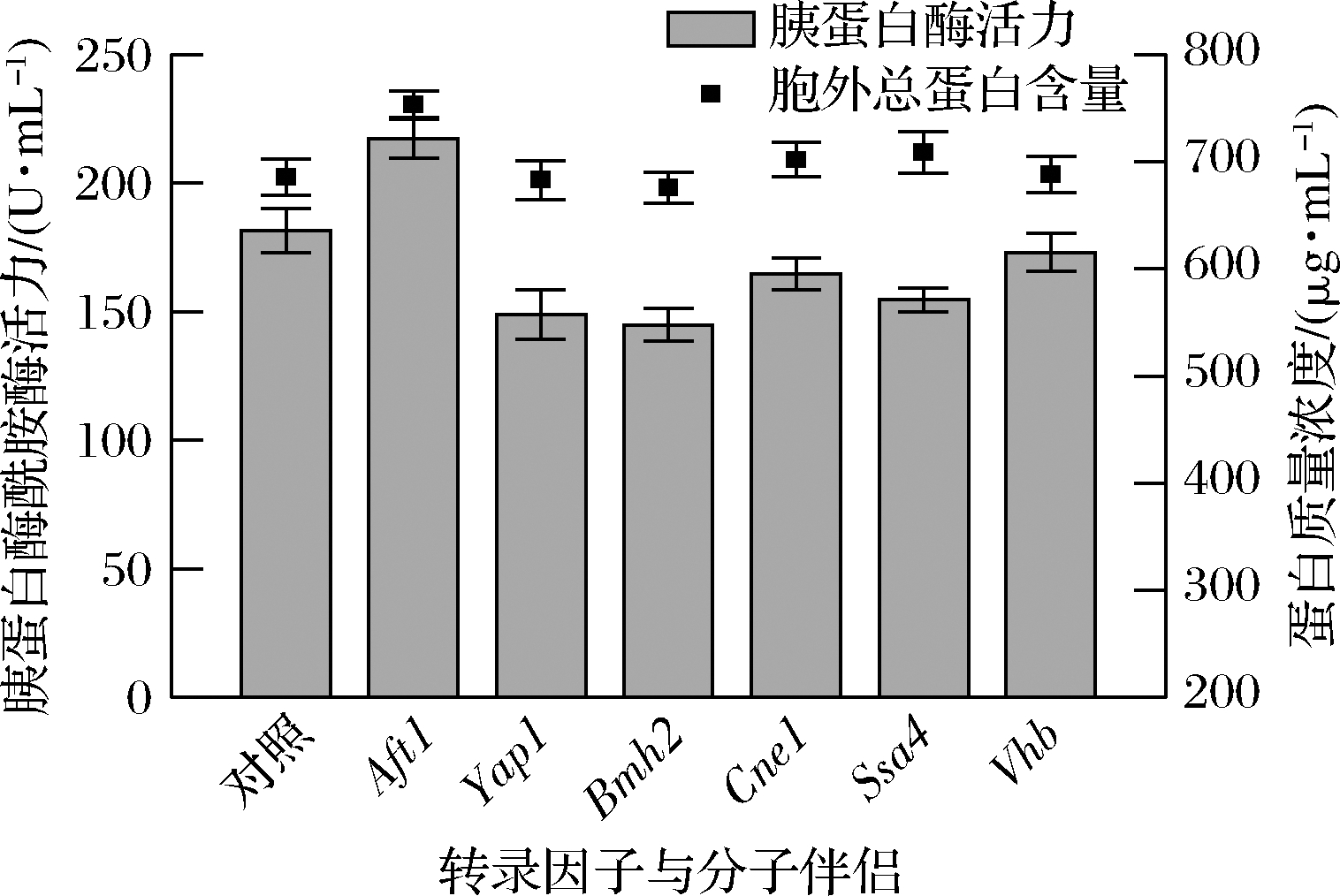
图2 共表分子伴侣或转录因子对SGT产量的影响
Fig.2 The effect of the co-expression of transcription factors or chaperones on SGT yield in shake-flask
2.2 pH对SGT在毕赤酵母中表达的影响
在前期研究中,SGT上游融合了牛胰蛋白酶的酶原区序列DDDDK(图1-a),能够被SGT自身所识别和切割,使得以前体形式合成的SGT实现自活化[12]。值得注意的是,SGT的最适反应pH为8.0[12],而毕赤酵母发酵通常在pH 5.0~5.5的环境下进行,较低pH发酵环境显然不利于SGT的自活化。因此,重组毕赤酵母诱导阶段的pH可能是影响SGT活性表达的重要因素。
摇瓶培养结果显示,在BMMY培养基中,重组菌PP-SGTm/Aft1的最适诱导表达pH为6.5,较pH 5.5下的酶活力提高了16.71%,达到了253.61 U/mL(图3-a)。然而,进一步将pH提高至7.0,SGT酶活力却显著下降(图3-a)。将重组菌PP-SGTm/Aft1分别接入pH 5~7的BMGY培养基测定其生长曲线。结果显示,发酵菌株的最适生长pH为5.5,发酵菌株在摇瓶培养64 h后OD600达到了最大值(图3-b)。当环境pH达到7时,PP-SGTm/Aft1的生长受到明显抑制(图3-b)。上述结果表明,pH 6.5提高了SGT活化效率的同时,又确保了重组菌生长活性。
基于pH优化结果,验证了PP-SGTm/Aft1在5 L罐的发酵产量。将生长阶段控制在5.5以获得最大菌体浓度与将诱导阶段的pH控制在6.5。为克服发酵罐常用基础盐培养基(BSM)在pH>5.5易形成磷酸盐沉淀的问题,选用BSMG培养基进行发酵[18]。如图4所示,BSMG培养基在发酵120 h时,菌体干重达到最大值121.62 g/L;发酵144 h后,酶活力达2 220.34 U/mL,较摇瓶发酵提高7.75倍。
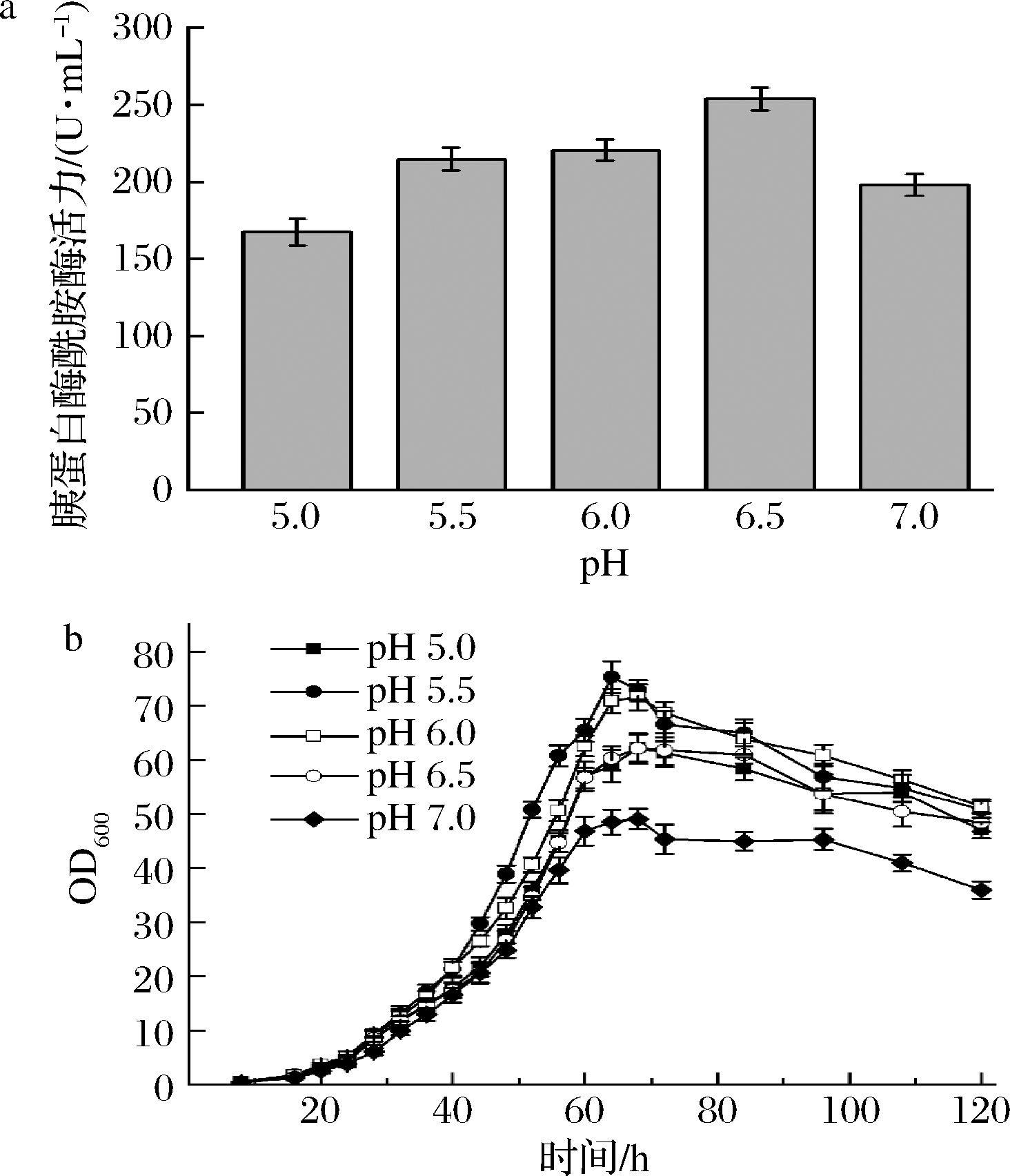
a-不同pH的BMMY对SGT产量的影响; b-不同pH的BMGY对PP-SGTm/Aft1生长的影响
图3 pH对重组毕赤酵母PP-SGTm/Aft1发酵的影响
Fig.3 The effect of pH on the fermentation of the PP-SGTm/Aft1
2.3 双碳源混合流加提高SGT发酵水平
重组毕赤酵母单独流加甲醇时,高浓度的甲醇易对菌体产生毒害作用,且细胞生长和外源蛋白表达途径会竞争甲醇,影响外源蛋白表达效率。研究显示,在诱导过程中添加少量山梨醇能够显著改善上述问题[24]。如图4-a所示,甲醇与山梨醇以20∶0.5的质量比混合流加时,SGT产量在发酵144 h后达到了2 667.24 U/mL,较仅流加甲醇的酶活力提高了20.1%。进一步提高甲醇与山梨醇质量比至20∶1时,SGT产量有所下降,但仍高于仅流加甲醇的酶活力。当甲醇与山梨醇质量比达到20∶1.5时,SGT产量低于纯甲醇流加(图4-a)。SDS-PAGE分析显示,在发酵60 h后各流加条件下,重组菌发酵上清液均能看到较清晰的SGT蛋白条带(图4-b)。与仅流加甲醇相比,甲醇与山梨醇质量比为20∶0.5和20∶1时对应的SGT蛋白条带更粗,与酶活力测定结果一致(图4-b)。
与仅流加纯甲醇相比,发酵144 h时,双碳源混合流加使菌体量提高22.1%~29.1%,高山梨醇流加比例更有助于菌体生长(图4-c)。混合流加能够改善菌体生长状况,但菌体生长与SGT的产量并不密切相关(图4-a、图4-c)。重组菌PP-SGTm/Aft1中,SGT以醇氧化酶(AOX)启动子表达,宿主AOX的变化能够间接反应SGT基因的表达效率。如图4-d所示,甲醇与山梨醇以质量比20∶0.5和20∶1混合流加时,发酵60 h后AOX 活性比单流加甲醇分别提高36.3%和43.7%,且发酵后期仍能维持更高的AOX活性;而甲醇与山梨醇以质量比20∶1.5流加与仅补甲醇的AOX活性相近,且在发酵后期其活性低于后者(图4-d)。上述结果表明,双碳源混合流加增强了AOX1启动子活性,从而提高SGT在毕赤酵母中的产量。
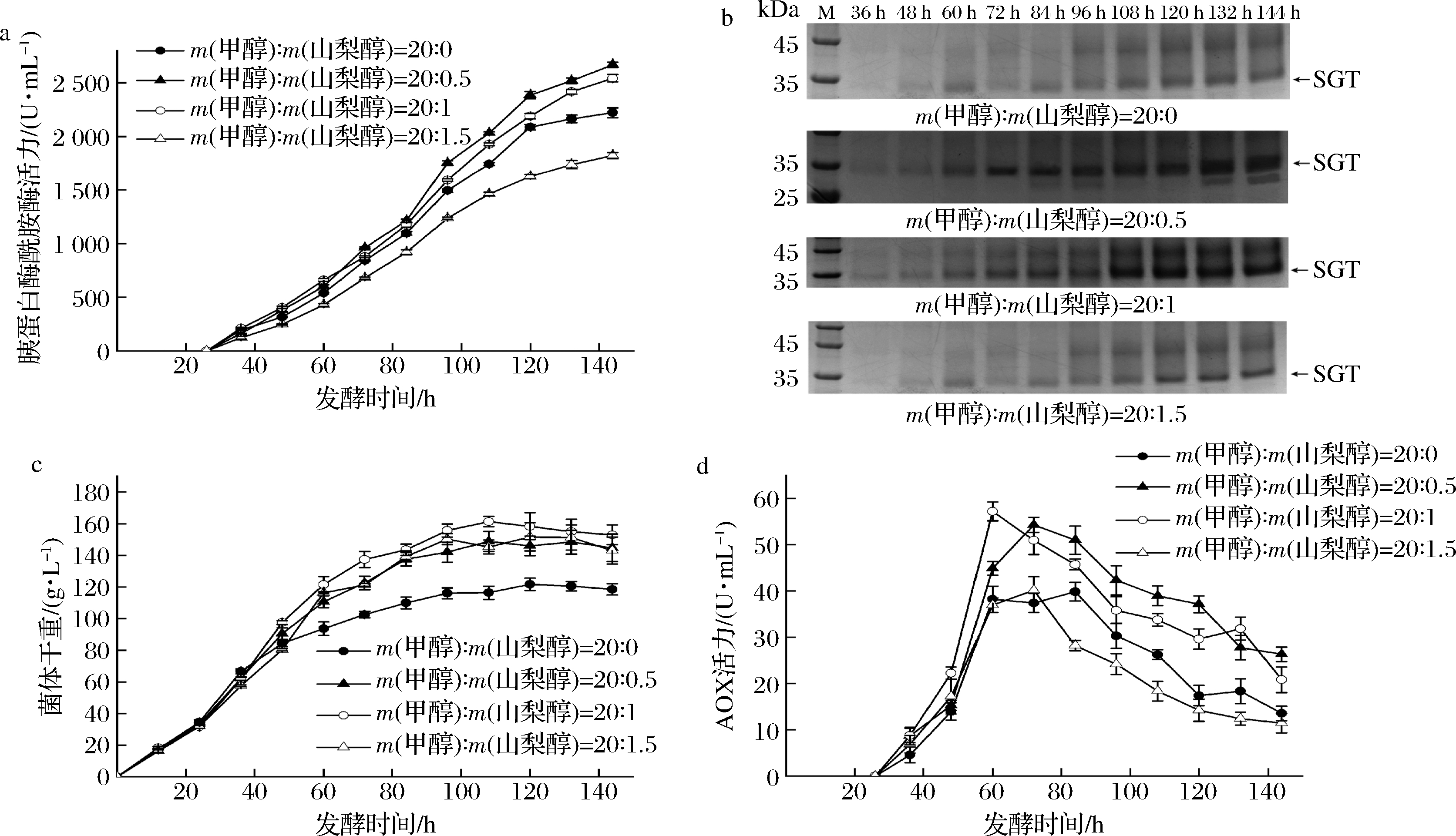
a-双碳源混合比例对SGT活力的影响;b-SDS-PAGE分析双碳源混合比例对SGT表达量的影响; c-双碳源混合比例对菌体生长的影响;d-双碳源混合比例对AOX活力的影响
图4 甲醇与山梨醇混合流加对PP-SGTm/Aft1发酵的影响
Fig.4 The effect of the co-feeding of methanol and sorbitol on the fermentation of the PP-SGTm/Aft1
3 结论与讨论
早期应用毕赤酵母异源表达胰蛋白酶的研究中,由于对毕赤酵母表达系统的研究不够完善使得胰蛋白酶活力达到19.2 U/mL后没有进一步提升[6]。随着毕赤酵母作为表达异源蛋白宿主的研究不断深入,使用更高效的表达元件[10]、发掘更新颖与高效的转录因子与分子伴侣[16]以及针对目的蛋白性质优化发酵条件[18]是目前克服毕赤酵母表达瓶颈的主要手段。
本研究在前期构建的高产SGT重组毕赤酵母的基础上,通过共表达转录因子Aft1使摇瓶水平的SGT产量提高19.71%。转录因子Aft1能够调控蛋白分泌相关的多个分子伴侣,这可能是较其他分子伴侣更有助于提高SGT表达水平的主要原因。由于SGT以前体形式合成,发酵过程高效自活化亦是影响其活性表达的重要因素。基于SGT的最适反应pH与毕赤酵母最适生长pH的差异,本研究确定了最佳的发酵pH为6.5。因此,有效平衡SGT的活化和菌体生长,同样是提高SGT活性表达的有效途径。在上述菌株改造和条件优化的基础上,采用混合流加碳源[m(甲醇)∶m(山梨醇)=20∶0.5]使SGT发酵水平进一步提升至2 667.24 U/mL,为其工业化发酵生产提供了重要基础数据。
SGT能够催化蛋白水解,发酵过程中成熟SGT的自降解同样是其高产的主要限制性因素[11]。通过分子改造提高SGT分子稳定性和抗自降解能力,将是其后续研究的主要内容之一。
[1] ESPEJO-CARPIO F J, PÉREZ-G LVEZ R, GUADIX A, et al.Artificial neuronal networks (ANN) to model the hydrolysis of goat milk protein by subtilisin and trypsin [J].Journal of Dairy Research, 2018, 85(3):339-346.
LVEZ R, GUADIX A, et al.Artificial neuronal networks (ANN) to model the hydrolysis of goat milk protein by subtilisin and trypsin [J].Journal of Dairy Research, 2018, 85(3):339-346.
[2] SAXENA S.Microbial Enzymes and Their Industrial Applications[M].Springer India, 2015.
[3] ZHANG H, HUANG R Y, JALILI P R, et al.Improved mass spectrometric characterization of protein glycosylation reveals unusual glycosylation of maize-derived bovine trypsin [J].Analytical Chemistry, 2010, 82(24):10 095-10 101.
[4] LOMBARDI J, WOITOVICH VALETTI N, PIC G, et al.Obtainment of a highly concentrated pancreatic serine proteases extract from bovine pancreas by precipitation with polyacrylate [J].Separation and Purification Technology, 2013, 116:170-174.
G, et al.Obtainment of a highly concentrated pancreatic serine proteases extract from bovine pancreas by precipitation with polyacrylate [J].Separation and Purification Technology, 2013, 116:170-174.
[5] NANJUNDAIAH S N, MA J, SUKUMARAN S, et al.Development of clone with novel TrpE fusion tag in E.coli for overexpression of trypsin in a bench-scale bioreactor [J].Preparative Biochemistry & Biotechnology, 2021, 51(2):144-152.
[6] SHU M, SHEN W, WANG X J, et al.Expression, activation and characterization of porcine trypsin in Pichia pastoris GS115 [J].Protein Expression and Purification, 2015, 114:149-155.
[7] YANG N, LING Z, PENG L, et al.Improvement of enzymatic stability and catalytic efficiency of recombinant Fusarium oxysporum trypsin with different N-terminal residues produced by Pichia pastoris [J].Journal of Microbiology and Biotechnology, 2018, 28(9):1 482-1 492.
[8] 马腾博, 令桢民, 康振, 等.灰色链霉菌胰蛋白酶在变铅青链霉菌中的异源表达及酶学性质分析[J].生物工程学报, 2013, 29(4):466-479.
MA T B, LING Z M, KANG Z, et al.Heterologous expression and enzymatic analysis of Streptomyces griseus trypsin in Streptomyces lividans [J].Chinese Journal of Biotechnology, 2013, 29(4):466-479.
[9] WANG Z K, LI X G, TIAN J W, et al.Cloning, heterologous expression and characterization of a novel Streptomyces trypsin in Bacillus subtilis SCK6[J].International Journal of Biological Macromolecules, 2020, 147:890-897.
[10] ZHANG Y F, HUANG H, YAO X H, et al.High-yield secretory production of stable, active trypsin through engineering of the N-terminal peptide and self-degradation sites in Pichia pastoris [J].Bioresource Technology, 2018, 247:81-87.
[11] ZHANG Y F, LIANG Q X, ZHANG C Z, et al.Improving production of Streptomyces griseus trypsin for enzymatic processing of insulin precursor [J].Microbial Cell Factories, 2020, 19(1):88.
[12] 令桢民. Streptomyces griseus胰蛋白酶的分子改造[D].无锡:江南大学,2013.
LING Z M.Molecular engineering of Streptomyces griseus trypsin[D].Wuxi:Jiangnan University, 2013.
[13] GU L, ZHANG J, DU G C, et al.Multivariate modular engineering of the protein secretory pathway for production of heterologous glucose oxidase in Pichia pastoris [J].Enzyme and Microbial Technology, 2015, 68:33-42.
[14] GASSER B, SAUER M, MAURER M, et al.Transcriptomics-based identification of novel factors enhancing heterologous protein secretion in yeasts [J].Applied and Environmental Microbiology, 2007, 73(20):6 499-6 507.
[15] SUN F F, YANG H M, BAI R H, et al.Enhanced heterologous expression of Trichoderma reesei Cel5A/Cel6A in Pichia pastoris with extracellular co-expression of Vitreoscilla hemoglobin [J].Journal of Chemical Technology and Biotechnology, 2018, 93(1):35-42.
[16] HUANGFU J, XU Y H, LI C, et al.Overexpressing target helper genes enhances secretion and glycosylation of recombinant proteins in Pichia pastoris under simulated microgravity [J].Journal of Industrial Microbiology & Biotechnology, 2016, 43(10):1 429-1 439.
[17] HUANG H, LIANG Q X, WANG Y, et al.High-level constitutive expression of leech hyaluronidase with combined strategies in recombinant Pichia pastoris [J].Applied Microbiology and Biotechnology, 2020, 104(4):1 621-1 632.
[18] HUANG J J, YANG Z, GUAN F F, et al.A novel mono- and diacylglycerol lipase highly expressed in Pichia pastoris and its application for food emulsifier preparation [J].Process Biochemistry, 2013, 48(12):1 899-1 904.
[19] ÇELIK E, ÇAL K P, OLIVER S G.Fed-batch methanol feeding strategy for recombinant protein production by Pichia pastoris in the presence of co-substrate sorbitol [J].Yeast, 2009, 26(9):473-484.
K P, OLIVER S G.Fed-batch methanol feeding strategy for recombinant protein production by Pichia pastoris in the presence of co-substrate sorbitol [J].Yeast, 2009, 26(9):473-484.
[20] RAM N R, FERRER P, VALERO F.Sorbitol co-feeding reduces metabolic burden caused by the overexpression of a Rhizopus oryzae lipase in Pichia pastoris [J].Journal of Biotechnology, 2007, 130(1):39-46.
N R, FERRER P, VALERO F.Sorbitol co-feeding reduces metabolic burden caused by the overexpression of a Rhizopus oryzae lipase in Pichia pastoris [J].Journal of Biotechnology, 2007, 130(1):39-46.
[21] 张永生, 高辉, 王艳萍.克拉维酸发酵液中碳源—甘油含量的比色法测定 [J].天津科技大学学报, 2006,21(1):15-17.
ZHANG Y S, GAO H, WANG Y P, et al.Determination of glycerol content in clavulanic acid broth by spectrophotometry [J].Journal of Tianjin University of Science and Technology, 2006,21(1):15-17.
[22] SUYE S I, OGAWA A, YOKOYAMA S, et al.Screening and identification of Candida methanosorbosa as alcohol oxidase-producing methanol using yeast [J].Agricultural and biological chemistry, 1990, 54(5):1 297-1 298.
[23] 王儒昕, 韩琴, 陈园园, 等.共表达分子伴侣PDI和转录因子Aft1对毕赤酵母表达人溶菌酶的影响 [J].食品科学, 2020, 41(10):124-130.
WANG R X, HAN Q, CHEN Y Y, et al.Effect of co-expression of chaperone PDI and transcription factor Aft1 on the expression of recombinant human lysozyme in Pichia pastoris[J].Food Science, 2020, 41(10):124-130.
[24] WANG Z H, WANG Y, ZHANG D X, et al.Enhancement of cell viability and alkaline polygalacturonate lyase production by sorbitol co-feeding with methanol in Pichia pastoris fermentation [J].Bioresource Technology, 2010, 101(4):1 318-1 323.