南美白对虾(Litopenaeus vannamei),又名凡纳滨对虾,其富含的虾青素具有抗氧化、抑制炎症及调节免疫活性等多种生物功能,因此深受消费者欢迎。腐败希瓦氏菌在南美白对虾贮藏过程中代谢产生异臭味物质,导致其腐败变质[1]。黑变是导致虾类水产品品质劣变的另一重要原因,且黑变速率往往早于微生物腐败[2-3]。虽然黑色素的产生并不会造成食用安全性问题,但增加了消费者感官上的不可接受性[4]。现有研究普遍认为,黑变的发生主要是在虾内源性多酚氧化酶(polyphenol oxidase,PPO)催化下酪氨酸氧化成L-3,4-二羟基苯丙氨酸(3,4-dihydroxyphenyl L-alanine,L-DOPA),而后转变成醌类物质[5],从而进一步氧化成深棕色黑色素或参与蛋白质官能团的聚合反应,形成交联聚合物,呈现为深色的黑色素[6],而不是由微生物代谢产生的,但其激活过程可能与微生物有关[7]。
为了解微生物在虾类黑变过程中的作用,本研究将腐败希瓦氏菌接种于经灭菌处理的南美白对虾上,分析南美白对虾在贮藏过程中的品质和理化指标的变化,探究腐败希瓦氏菌对南美白对虾黑变及品质劣变的影响,以期为揭示南美白对虾品质劣变的原因提供一定的理论依据。
1 材料与方法
1.1 试验原料
腐败希瓦氏菌(Shewanella putrefaciens QY38,NCBI号:KX692894),课题组前期从腐败南美白对虾中分离、筛选并鉴定,并在-80 ℃下保存菌株。
南美白对虾购于上海市浦东新区芦潮港海鲜市场,用碎冰使其休克失活,并用双蒸水清洗2次。
1.2 试验试剂
4-己基间苯二酚(4-hexylresorcinol,4-HR),上海阿拉丁试剂公司;Proclin-300、PPO活性检测试剂盒,北京索莱宝科技有限公司;磷酸盐缓冲液、氯化钠、氢氧化钠,国药集团化学试剂有限公司;铁琼脂培养基,青岛海博生物技术有限公司。
1.3 仪器与设备
TA.XT Plus质构仪,英国Stable Micro System公司;CR-400型色差计,日本Konica Minolta公司;Kjeltec 2300型凯氏定氮仪,瑞士FOSS公司;超净工作台,上海康福特环境科技有限公司;XB220A-SCS分析天平,北京普利赛斯科技有限公司;H-2050R台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;UV-2100紫外-可见分光光度计,美国尤尼柯仪器有限公司;LDZM-40KCS-Ⅲ型立式压力蒸汽灭菌器,上海申安医疗机械厂;LHS-100CL型恒温恒湿箱,上海一恒科学仪器有限公司;MR23-060H-I型低场核磁共振分析仪,上海纽迈电子科技有限公司。
1.4 试验方法
1.4.1 菌种活化
参考YANG等[8]的方法,腐败希瓦氏菌QY38菌株实验前进行活化处理:30 ℃水浴解冻冻存的腐败希瓦氏菌菌液,取1 mL至灭菌的9 mL脑心浸肉汤中30 ℃、150 r/min活化18 h,取活化菌液1 mL至9 mL胰蛋白胨大豆肉汤培养基中,30 ℃、150 r/min培养8 h,得到在对数期的腐败希瓦氏菌菌液(108 CFU/mL),使用前用无菌生理盐水稀释至106 CFU/mL。
1.4.2 样品预处理
将鲜活的南美白对虾用碎冰低温致死,挑选无损伤且质量在16~18 g的虾若干,先经过0.05% Proclin-300浸泡10 min灭菌处理,然后用无菌水冲洗3遍,之后随机分为3组。以未接菌为对照组(A组),接种腐败希瓦氏菌为B组及以0.15 mg/mL 4-HR浸泡5 min并接种腐败希瓦氏菌的组别为C组。在无菌密封袋中,4 ℃冰箱贮藏,各指标测定1次/d。
1.4.3 感官评分
依据对虾的卫生标准并参考赵海鹏等[9]的方法,对南美白对虾从肌肉组织、外观和气味等方面进行评分。
1.4.4 色差值
根据QIAN等[10]的方法稍做修改,用白色校准板校准色差计后,测定南美白对虾头和第二腹节的L*、a*、b*的值,每个平行样品测定3次,取平均值。
根据公式(1)计算总白度值[11],平行测定3次。
白度值=100-[(100-L*)2+a*2+b*2]0.5
(1)
式中:L*值为亮度,黑白差值;a*值为红绿差值;b*值为黄蓝差值。
1.4.5 质构特性的测定
根据蓝蔚青等[12]的方法稍做修改,对南美白对虾第二腹节肌肉置于测试面中心进行质地多面分析(texture profile analysis,TPA)。测试条件为:平底柱形探头P50、测前速率3.00 mm/s、测试速率1.00 mm/s、测后速率1.00 mm/s、压缩变形率30%,每个样品测试6次,取平均值。
1.4.6 挥发性盐基氮(total volatile basic nitrogen,TVB-N)测定
参考GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》,利用自动凯氏定氮仪平行测定各组样品贮藏期间的TVB-N值,每组5 g样品做3个平行,取平均值,结果以mg/100g表示。
1.4.7 PPO活性
参照试剂盒说明书进行操作,以1 min 1 g组织在1 mL反应体系中使410 nm处吸光度变化的值表示酶活力。
1.4.8 菌落总数(total viable count,TVC)测定
在超净台上操作,称取25.00 g虾肉于225 mL无菌生理盐水中混合,参考GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法用铁琼脂培养基测定虾的菌落数。每个稀释度作2次平行,以灭菌的稀释度作为空白对照试验,结果以lgCFU/g表示。
1.4.9 低场核磁共振(low field nuclear magnetic resonance,LF-NMR)分析
将整只带壳南美白对虾用保鲜膜包裹,放入核磁检测管中。参考张楠楠等[13]的方法设置参数,通过对序列指数衰减曲线图经分析软件进行批量反演,得到样品在不同时期的横向弛豫时间T2谱图。
1.4.10 核磁共振成像技术(magnetic resonance imaging,MRI)分析
采用MRI技术测定样品的质子密度图谱,将带壳南美白对虾包上保鲜膜后直接放入直径70 mm的核磁管中,随后在低场核磁共振成像仪中予以成像分析。
1.4.11 肌浆蛋白组成测定
参考NIAMNUY等[14]的方法,取虾肉5 g,加入10倍体积预冷的缓冲液A(15.6 mmol/L Na2HPO4,3.5 mmol/L KH2PO4,pH 7.5)均质,4 ℃下10 000 r/min 离心15 min,再在沉淀中加入10倍体积缓冲液A,重复上述操作2次,将3次离心后的上清液合并,即为肌浆蛋白提取液。
将不同待测样品溶液与2倍上样缓冲液等体积混合,沸水浴5 min。采用12%分离胶和5%浓缩胶制胶,使用80 V进行SDS-PAGE,待样品进入分离胶时电压调至100 V,直至电泳结束,进行考马斯亮蓝染色液染色,使用脱色液脱色至蛋白质条带清晰。
1.5 数据处理
试验数据采用重复试验平均值,以“平均值±标准偏差”表示。通过SPSS 17.0软件进行显著性差异分析,采用Origin 8.5软件进行绘图,组间分析采用t检验,显著性界值以P<0.01为极显著,P<0.05为显著,P>0.05为不显著。
2 结果与分析
2.1 接种腐败希瓦氏菌的南美白对虾微生物生长情况
4 ℃条件下不同处理方式的南美白对虾微生物变化情况如图1所示。A组初始菌落数为3.44 lgCFU/g,而新鲜南美白对虾的初始菌落总数一般为4.28 lgCFU/g[15],说明Proclin-300处理能够减菌90%左右,且在贮藏过程中始终与接菌组保持2 lgCFU/g左右的差值。B、C接菌组的初始菌落总数为6.11 lgCFU/g和6.27 lgCFU/g,比对照组至少高2.67 lgCFU/g,说明背景杂菌在接种腐败希瓦氏菌的群落中占比较小。在贮藏过程中,3组样品的菌落总数、嗜冷菌和产H2S菌的菌落数均呈上升趋势,且2组接菌组微生物数量相近。接菌组中产H2S菌数量与菌落总数和嗜冷菌接近,而腐败希瓦氏菌属于产H2S菌[16],说明接菌组中能产H2S的腐败希瓦氏菌占主导地位,对虾可能产生的腐败影响主要由腐败希瓦氏菌产生。
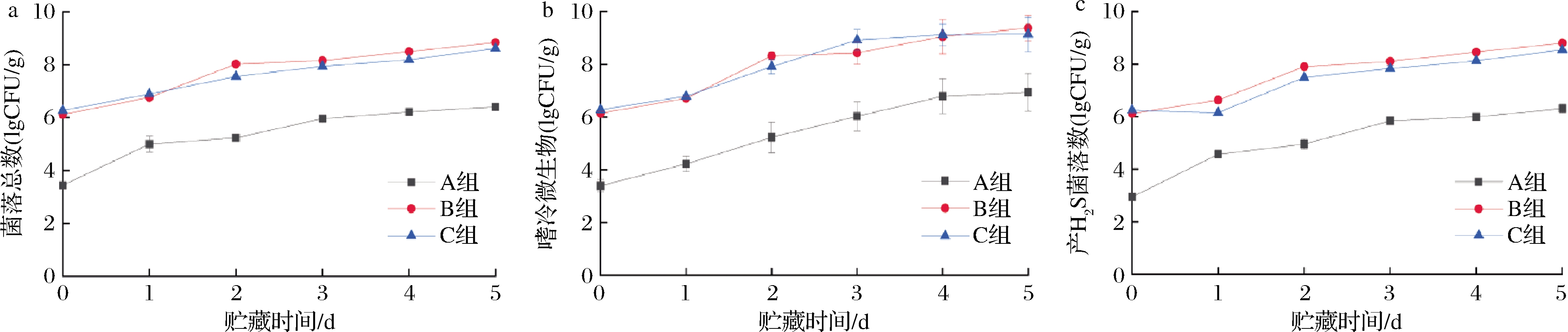
a-总菌;b-嗜冷微生物;c-产H2S菌
图1 不同处理方式南美白对虾微生物的变化图
Fig.1 Changes in microorganism of shrimps in different treatment groups
2.2 接种腐败希瓦氏菌的南美白对虾感官评分
南美白对虾的感官评分主要由肌肉组织、外观和气味3部分组成,其变化如图2所示。4 ℃条件下未接菌的A组在Proclin-300的作用下微生物生长较缓,虽然肉质、气味、脱壳松软度方面较接菌组好,但在贮藏2 d后就出现了黑变现象,说明Proclin-300不能抑制黑变;B组为添加了Proclin-300的接菌组,不仅发生了严重的黑变,且在腐败希瓦氏菌的作用下出现汁液流失、散发强烈的氨臭味和硫臭味、虾壳变软等品质劣变现象,感官评分最低;C组为添加了4-HR的接菌组,该组别在4-HR的作用下显著延缓南美白对虾黑变,虾身呈现灰白色不透明状,因黑变程度低,其感官总体评分仍高于其他2个组别,进一步证实4-HR是一种有效的抑黑变保鲜剂[4]。
2.3 接种腐败希瓦氏菌对南美白对虾PPO活性的影响
PPO大部分分布于对虾血液里、头胸部和关节处等,是其免疫应答系统的重要组成部分[17],也是多酚氧化酶原激活系统(propolyphenol oxidase activating system,proPPO-AS)级联反应链中的关键酶,是黑色素形成的限速条件[18]。图3为不同处理组对虾PPO活性的变化情况。

图2 不同处理方式南美白对虾的感官评分变化
Fig.2 Changes of sensory score of shrimps in different treatment groups
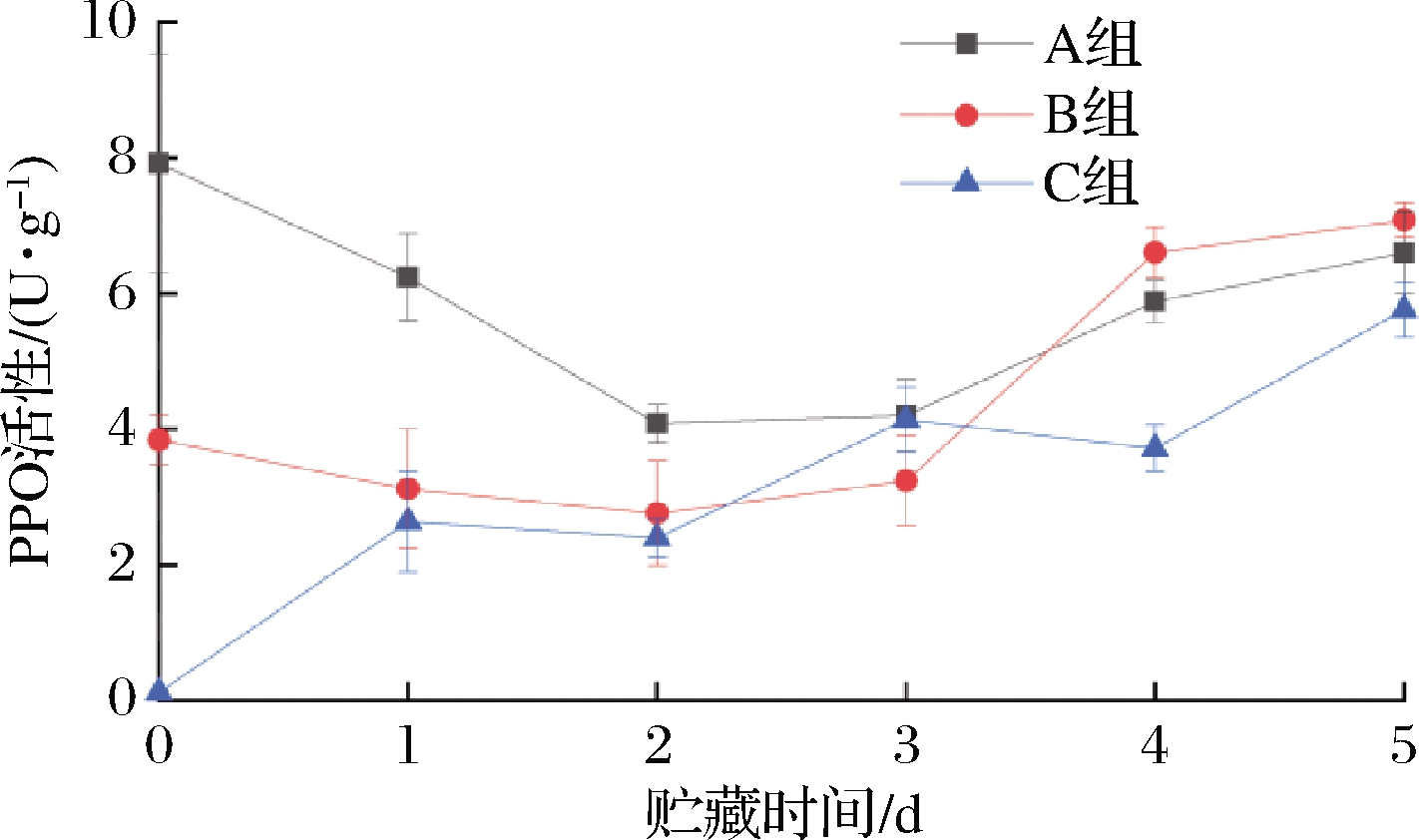
图3 不同处理组对虾PPO活性的变化
Fig.3 Changes of PPO activity of shrimps in different treatment groups
从3图中可以看出,3组样品中A组的PPO活性初始值最高,为7.92 U/g,而C组PPO活性仅为 0.12 U/g,这与4-HR对虾中PPO活性抑制作用有关,而Procline-300抑菌处理对PPO活性无显著影响。研究表明Procline-300是一种微生物抑制剂,但对酶活性的影响较小[19]。A组PPO活性呈现先下降后上升的趋势,可能与初始微生物数量较低,其后缓慢增加的变化趋势有关。有研究表明微生物多糖如几丁质,β-葡聚糖,脂多糖和脂蛋白酸等免疫调节性碳水化合物可以激活proPPO-AS系统[20],在对虾血淋巴中通过一系列级联反应将无活性的多酚氧化酶原(propolyphenol oxidase,proPPO)转化为有活性的PPO[21]。B组的初始PPO活性为3.84 U/g,第3天后快速升高,第5天时达到7.08 U/g,且已超过A组,说明接种腐败希瓦氏菌能够促进PPO活性的升高。C组PPO活性在初始阶段因受到4-HR的抑制而明显偏低,但在贮藏过程中呈现逐渐上升的趋势,这可能与接菌后PPO在微生物和内源酶的作用下不断被激活释放有关,但整体水平始终低于B组和A组。
2.4 接种腐败希瓦氏菌的南美白对虾色差值变化
南美白对虾在贮藏和加工过程中,体表会出现黑斑,是多酚氧化酶催化酪氨酸氧化等一系列反应产生的黑色素[22]。由图4-a和图4-b可知,随着贮藏时间的延长,4-HR抑酶组白度值始终高于未抑酶组,说明抑制PPO活性能够显著延缓南美白对虾的黑变。而同样经过Proclin-300处理的接菌组白度值低于未接菌组,可能是由于腐败希瓦氏菌的细胞壁能激活酪氨酸酶原,进而影响黑变的反应速度[23]。
新鲜虾体因虾青素与蛋白质复合而呈绿或蓝色,但在贮藏过程中其蛋白质-色素复合体被分解,导致色素游离使体表变红[24],通常由a*值表示虾体红变情况。由图4-c和图4-d可知,随着贮藏时间的延长,样品a*值持续增加。由于南美白对虾头部含有内脏等不透明的有色物质,头部较虾体较早开始变红,且接菌组始终高于未接菌组,说明腐败希瓦氏菌促进蛋白质的降解进而促进虾体内的虾青素或虾青素酯的释放。而虾身样品色泽相对透明,各组别a*值虽持续上升但显著性差异不明显,仅最后1 d的接菌组显著高于未接菌组。
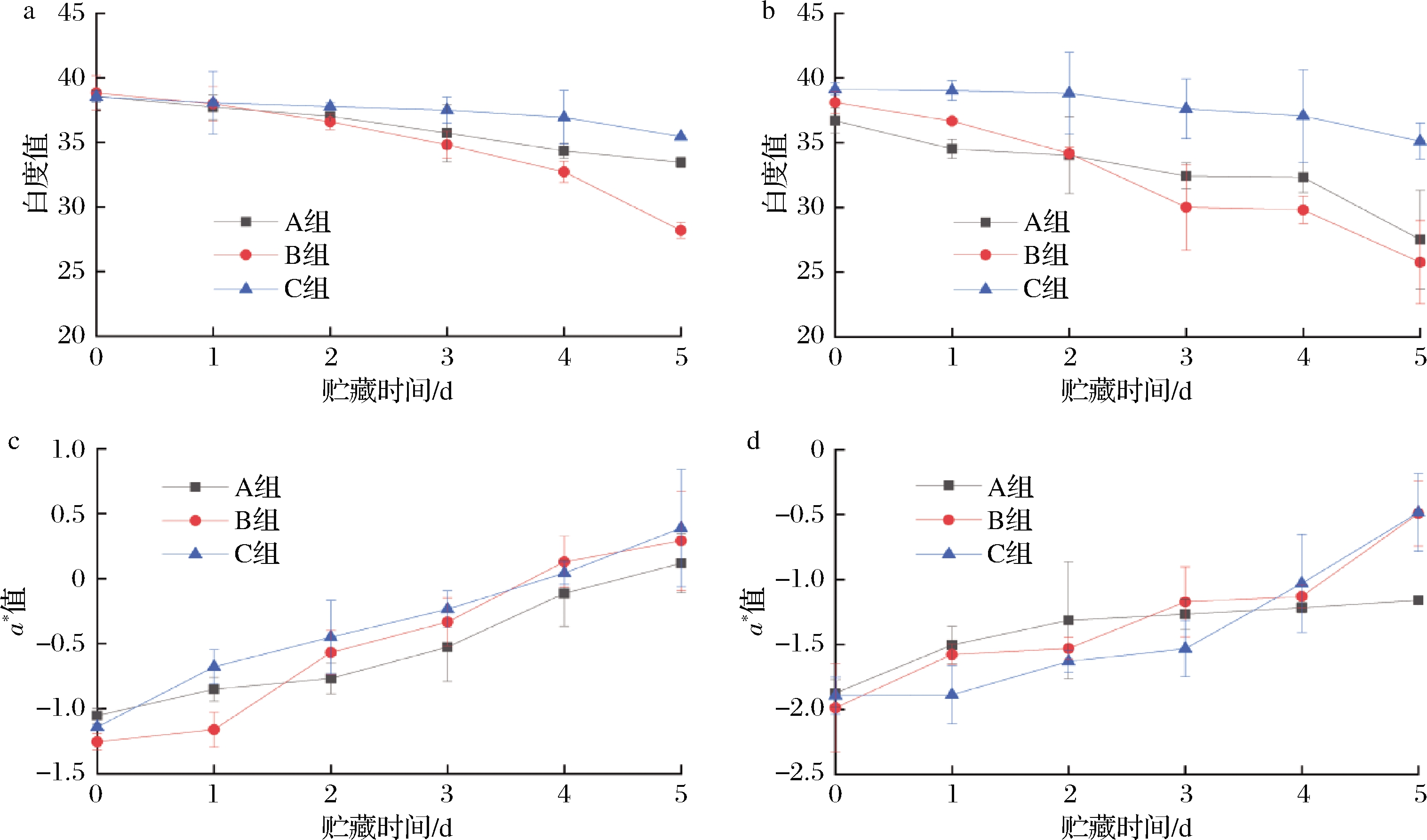
a、c-虾头;b、d-虾身
图4 不同处理组的白度值和a*值的变化
Fig.4 Changes in variance of lightness and redness (a*) in different treatment groups
2.5 接种腐败希瓦氏菌对南美白对虾TVB-N含量的影响
TVB-N含量常用于评价水产品腐败程度,通过反映水产品中蛋白质在微生物和酶的共同作用下,分解而产生的三甲胺、二甲胺、氨和其他胺类等碱性含氮物生成量[12, 25]。由图5可知,3组样品TVB-N值含量在贮藏初期分别为5.49、7.78、9.38 mg/100g,接菌组样品的TVB-N值略高,这可能与接种腐败希瓦氏菌的浸泡处理有关。随着贮藏时间的延长,3组样品的TVB-N含量整体呈上升趋势,B和C两组接菌组在贮藏前2 d TVB-N含量相近,且略高于未接菌组,表明TVB-N含量的上升与腐败希瓦氏菌生长代谢活动有关。贮藏3 d后,C组TVB-N值整体水平明显高于A组和B组,且组别间差异逐渐增大,这可能与该组别中在4-HR的作用下黑色素生成减少有关。有研究表明黑色素物质具有抑制腐败菌生长的作用[26],而本研究表明黑色素物质的作用可能更多表现在抑制腐败菌的致腐能力。

图5 不同处理组对虾TVB-N值的变化
Fig.5 Changes in TVB-N value of shrimps in different treatment groups
2.6 接种腐败希瓦氏菌对南美白对虾质构特性的影响
虾类等水产品在微生物与内源酶的作用下,其肌肉组织与质构特性发生相应变化,最终导致肌体软化、弹性和食用口感下降,其中弹性反映食品恢复形状的能力,可部分反映食物的口感[12]。如图6所示,随着南美白对虾贮藏时间的延长,各组硬度、弹性均呈下降趋势。贮藏至第3天时,B组样品的硬度降至6 536.80 g,A、C组在第3天的时候分别为6 475.26和6 690.36 g;同时,样品的弹性由初期0.91、0.90、0.92在贮藏末期分别降至0.85、0.80、0.69,弹性损失率分别为7.02%、11.57%、24.14%。在整个贮藏期间,A组样品的硬度略高于B、C组,但B、C组差异不明显。如图6-b所示,随着贮藏时间的延长,咀嚼性下降幅度增加,第5天时咀嚼性分别降低 53.94%、54.49%、54.57%,且在贮藏过程中,A、B组样品的咀嚼性下降速度缓于C组。由质构结果的组间差异显著性分析,肌肉硬度、肌肉细胞间凝聚力与弹性下降会造成样品的咀嚼性降低(P>0.01)。这可能表明接种腐败希瓦氏菌会加速南美白对虾肌肉蛋白的腐败,最终导致硬度和弹性的下降。C组的硬度和弹性在贮藏中后期出现明显的下降,与TVB-N的变化呈负相关,说明C组虾肉蛋白在贮藏中后期发生了更严重的降解劣变。
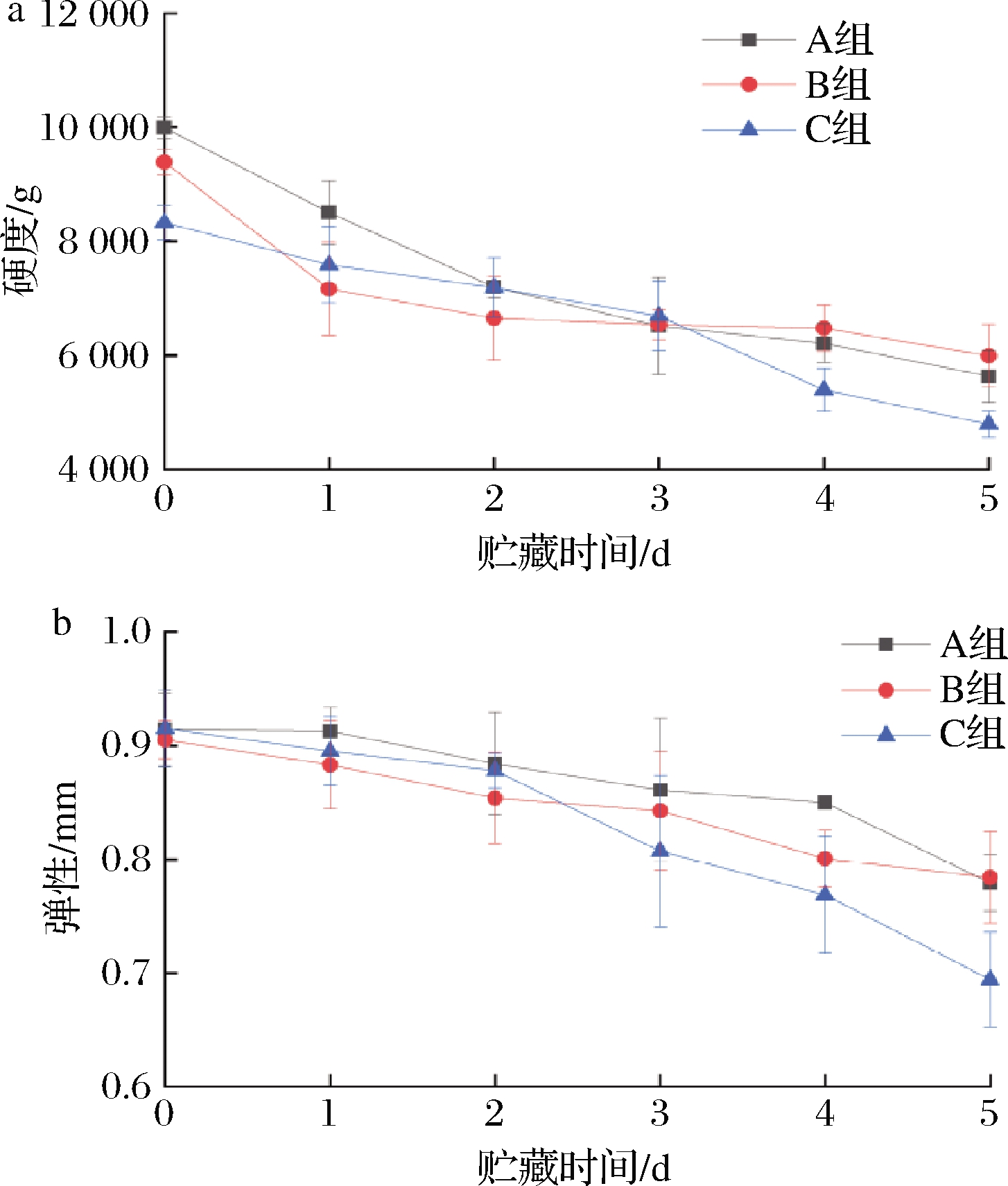
a-硬度;b-弹性
图6 不同处理组对虾硬度和弹性的变化
Fig.6 Changes of polyphenol oxidase activity of shrimps in different treatment groups
2.7 接种腐败希瓦氏菌对南美白对虾核磁共振与成像的影响
MRI通过呈现二维的质子密度图,能够直观地检测到肌体内水分的空间分布状态。样品不同区域的信号强度与水分子含量成正比,一般来说,图像中颜色越亮,代表此区域的水质子信号越强,表明虾仁体内的水分含量就越高[12]。如图7所示,相较于新鲜样品,处理后虾头部水分含量有所下降,虾质子密度图整体色泽仍呈红色,主要集中在虾头。随着贮藏时间的延长,3组南美白对虾虾肉中质子密度加权像伪彩图的亮度逐渐减弱,在3 d后开始虾身呈现与底色相近的蓝色,虾头部的红色区域也逐渐变小、变黄,表明水分逐渐流失,说明品质发生严重的劣变。LF-NMR的横向弛豫时间图谱上有3个峰,分别是T21(0.1~4.0 ms)、T22(10~86 ms)、T23(200~900 ms)[12]。在整个贮藏期间,随着贮藏时间的延长,3组样品T22振幅均明显降低,说明在对虾中自由水移动性逐渐增强,即虾肉持水性降低。其中未接种腐败希瓦氏菌的组别虾肉中非水组分物质结合更牢固,表明腐败希瓦氏菌影响南美白对虾的腐败,破坏其肌肉结构,导致束缚水向自由水转变,肌肉中水分流失。

a-1H-MRI图;b-信号强度图
图7 不同处理组对虾的1H-MRI图和信号强度图
Fig.7 Pseudo color of 1H-MRI and signal intensity for shrimps in different treatment groups
注:X-鲜样;A-Proclin-300处理;B-Proclin-300+ 腐败希瓦氏菌处理;C-4-HR处理;0~5分别表示贮藏0~5 d
2.8 接种腐败希瓦氏菌对南美白对虾肌浆蛋白的影响
水产品肌肉蛋白质可以分为细胞内蛋白质(肌原纤维蛋白、肌浆蛋白)和细胞外蛋白质(碱溶性蛋白和肌基质蛋白),其中肌浆蛋白是水溶性蛋白的主要成分,其变化可用于指示虾的鲜度变化[27]。由图8可知,A组中条带I(66 kDa),光密度在贮藏前后变化不明显,但在B、C组中快速消失,说明腐败希瓦氏菌会加速条带I蛋白的分解。3组样品中条带II(45 kDa)、III(27~45 kDa)、IV(14.4~27 kDa)光密度在贮藏过程逐渐减弱直至消失,说明这几种主要的肌浆蛋白也发生了降解,这可能是内源性蛋白酶和细菌蛋白酶共同作用的结果。
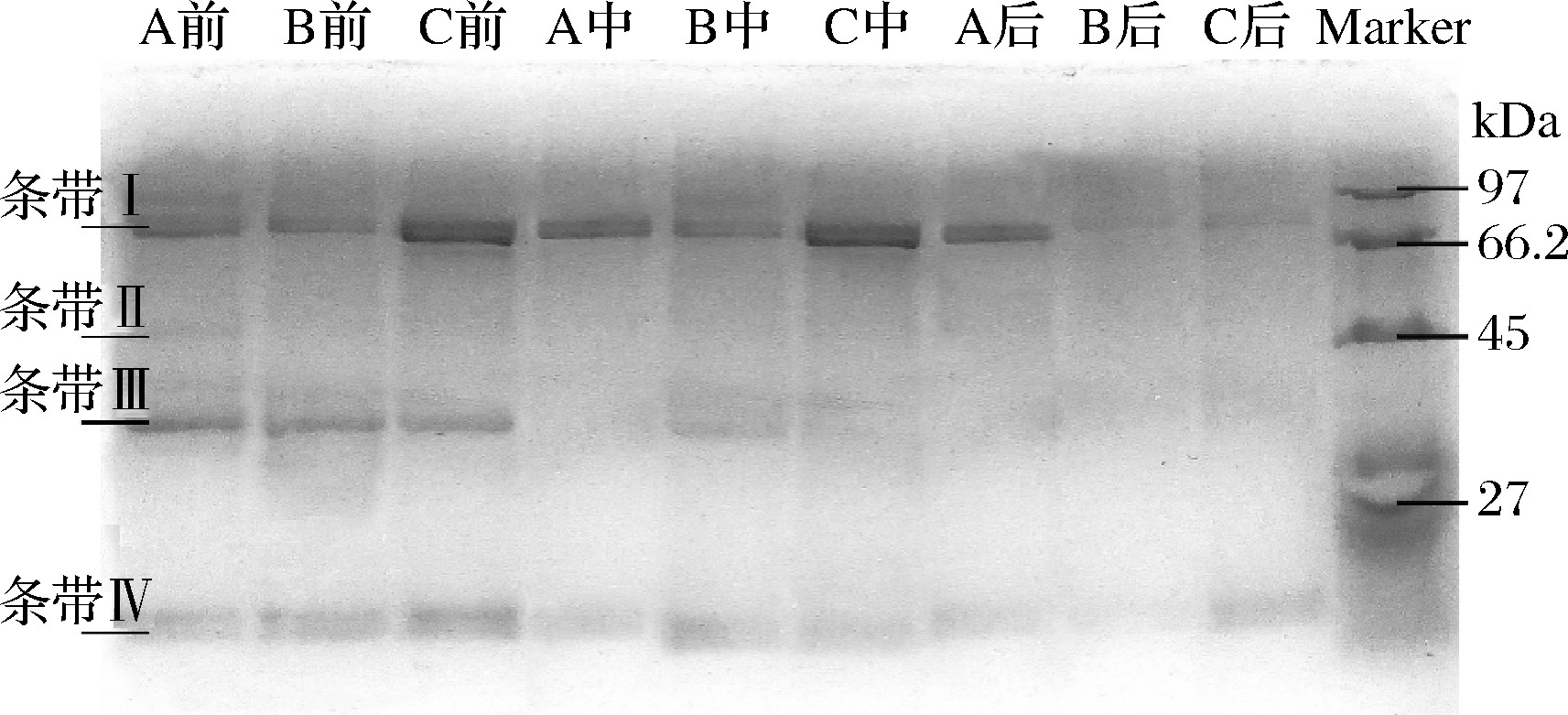
图8 不同处理组对虾肌浆蛋白的SDS-PAGE结果
Fig.8 SDS-PAGE of sarcoplasmic protein for shrimps in different treatment groups
3 结论
本文分别以未接菌组和4-HR处理的接菌组为对照,探究了腐败希瓦氏菌对南美白对虾黑变及品质的影响,发现腐败希瓦氏菌不仅与虾肉蛋白的降解、水分流失、硬度和弹性的下降明显相关,且具有促进PPO活性和对虾黑变的作用,该作用机理可能与PPO原激活系统有关,因此其生长变化应受到关注和抑制。4-HR作为虾类保鲜剂仅能通过抑制PPO酶活性发挥防黑变作用,而对微生物引起的腐败变质没有影响,因此在使用过程中需要配合抑菌剂才能达到相对较好的保鲜效果。
[1] 钱韻芳, 杨胜平, 谢晶, 等.气调包装凡纳滨对虾特定腐败菌致腐败能力研究[J].中国食品学报, 2015, 15(1):85-91.
QIAN Y F, YANG S P, XIE J, et al.Studies on the putrefaction potential of the specific spoilage organisms from modified atmosphere packaged Litopenaeus vannamei[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(1):85-91.
[2] NIRMAL N P, BENJAKUL S.Biochemical properties of polyphenoloxidase from the cephalothorax of Pacific white shrimp (Litopenaeus vannamei)[J].International Aquatic Research, 2012, 4(1):1-13.
[3] 凌萍华, 谢晶.气调包装、冰温技术和保鲜剂在虾类保鲜上的应用[J].山西农业科学, 2009, 37(7):73-76.
LING P H, XIE J.Application of air conditioned package, controlled freezing-point and fresh-keeping agents on preservation of shrimp[J].Journal of Shanxi Agricultural Sciences, 2009, 37(7):73-76.
[4] 钱韻芳, 杨胜平, 谢晶.4-己基间苯二酚对凡纳滨对虾3种腐败菌的抑菌活性及虾品质的影响[J].食品科学, 2017, 38(21):21-29.
QIAN Y F, YANG S P, XIE J.Antibacterial activity of 4-hexylresorcinol against three spoilage bacteria in culture and its effect on the quality of Pacific white shrimp [J].Food Science, 2017, 38(21):21-29.
[5] BAILEY M E, FIEGER E A, NOVAK A F.Phenol oxidase in shrimp and crab[J].Journal of Food Science, 1960, 25(5):565-572.
[6] NIRMAL N P, BENJAKUL S.Use of tea extracts for inhibition of polyphenoloxidase and retardation of quality loss of Pacific white shrimp during iced storage[J].LWT, 2011, 44(4):924-932.
[7] YANG H, JI T W, XIONG H R, et al.A trypsin-like serine protease domain of masquerade gene in crayfish Procambarus clarkii could activate prophenoloxidase and inhibit bacterial growth[J].Developmental and Comparative Immunology, 2021, 117:103980.
[8] YANG S P, XIE J, CHENG Y, et al.Response of Shewanella putrefaciens to low temperature regulated by membrane fluidity and fatty acid metabolism[J].LWT, 2020, 117:108638.
[9] 赵海鹏, 谢晶.南美白对虾复合生物保鲜剂的优选[J].食品科学, 2010,31(14):294-298.
ZHAO H P, XIE J.Formulation optimization of a biological preservative for Pacific white shrimp [J].Food Science, 2010,31(14):294-298.
[10] QIAN Y F, XIE J, YANG S P, et al.Study of the quality changes and myofibrillar proteins of white shrimp (Litopenaeus vannamei) under modified atmosphere packaging with varying CO2 levels[J].European Food Research and Technology, 2013, 236(4):629-635.
[11] NYAISABA B M, LIU X X, ZHU S C, et al.Effect of hydroxyl-radical on the biochemical properties and structure of myofibrillar protein from Alaska pollock (Theragra chalcogramma)[J].LWT, 2019, 106:15-21.
[12] 蓝蔚青, 胡潇予, 阮东娜, 等.流化冰处理对南美白对虾冰藏期间品质与水分迁移变化的影响[J].食品科学, 2019, 40(9):248-255.
LAN W Q, HU X Y, RUAN D N, et al.Effect of slurry ice on the quality and water mobility of Pacific white shrimps (Litopenaeus vannamei) during storage[J].Food Science, 2019, 40(9):248-255.
[13] 张楠楠, 蓝蔚青, 黄夏, 等.迷迭香复配液对大黄鱼冰藏品质及水分迁移的影响[J].食品科学, 2019, 40(7):247-253.
ZHANG N N, LAN W Q, HUANG X, et al.Effect of rosemary extract and ε-polylysine blend on the quality and moisture migration of large yellow croaker during ice storage[J].Food Science, 2019, 40(7):247-253.
[14] NIAMNUY C, DEVAHASTIN S, SOPONRONNARIT S.Changes in protein compositions and their effects on physical changes of shrimp during boiling in salt solution[J].Food Chemistry, 2008, 108(1):165-175.
[15] QIAN Y F, YANG S P, XIE J, et al.Impact of the O2 concentrations on bacterial communities and quality of modified atmosphere packaged Pacific white shrimp (Litopenaeus vannamei)[J].Journal of Food Science, 2013, 78(12):1 878-1 884.
[16] VOGEL B F, VENKATESWARAN K, SATOMI M, et al.Identification of Shewanella baltica as the most important H2S-producing species during iced storage of Danish marine fish[J].Applied and Environmental Microbiology, 2005, 71:6 689-6 697.
[17] ANDERSEN S O.Insect cuticular sclerotization:A review[J].Insect Biochemistry and Molecular Biology,2010,40(3):166-178.
[18] NIRMAL N P, BENJAKUL S.Use of tea extracts for inhibition of polyphenoloxidase and retardation of quality loss of Pacific white shrimp during iced storage[J].LWT, 2011, 44(4):924-932.
[19] ZHANG X C, XIE J.The differential effects of endogenous cathepsin and microorganisms on changes in the texture and flavor substances of grouper (Epinephelus coioides) fillets[J].RSC Advances, 2020, 10(18):10 764-10 775.
[20] JEYACHANDRAN S, CHANDRABOSE S, SINGH S K, et al.Characterization and structural analysis of prophenoloxidase in mud crab Scylla serrata and discovering novel chemical inhibitors through virtual screening[J].Structural Chemistry, 2020, 31(4):1 563-1 584.
[21] AMPARYUP P, CHAROENSAPSRI W, TASSANAKAJON A.Prophenoloxidase system and its role in shrimp immune responses against major pathogens[J].Fish and Shellfish Immunology, 2013, 34(4):990-1 001.
[22] BARTOLO I, BIRK E O.Some factors affecting Norway lobster (Nephrops norvegicus) cuticle polyphenol oxidase activity and blackspot development[J].International Journal of Food Science and Technology, 1998, 33(3):329-336.
[23] 谢晶, 程颖, 杨胜平, 等.腐败希瓦氏菌对凡纳滨对虾氨基酸及生物胺含量的影响[J].中国食品学报, 2018, 18(1):169-175.
XIE J, CHENG Y, YANG S P, et al.Effect of Shewanella putrefaciens on the amino acids metabolism and biogenic amines production in Litopenaeus vannamei[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(1):169-175.
[24] SILA A, NASRI M, BOUGATEF A.Isolation and characterisation of carotenoproteins from deep-water pink shrimp processing waste[J].International Journal of Biological Macromolecules, 2012, 51(5):953-959.
[25] 谢晶, 叶晶鑫, 杨胜平, 等.腐败希瓦氏菌和荧光假单胞菌对冷藏凡纳滨对虾虾汁品质的影响[J].食品科学, 2018, 39(13):1-6.
XIE J, YE J X, YANG S P, et al.Evaluation of the spoilage potential of Shewanella putrefaciens and Pseudomonas fluorescens on Pacific white shrimp (Litopenaeus vannamei) juice during cold storage[J].Food Science, 2018, 39(13):1-6.
[26] SOSA M F, SOBRERO P, VALVERDE C, et al.A black-pigmented pseudomonad isolate with antibacterial activity against phyllospheric pathogens[J].Rhizosphere, 2020, 15:100207.
[27] 李学鹏, 李聪, 王金厢, 等.中国对虾冷藏过程中肌肉蛋白质的降解规律[J].中国食品学报, 2015, 15(6):59-68.
LI X P, LI C, WANG J X, et al.The degradation of muscle protein of chinese shrimp (Fenneropenaeus chinensis) during refrigerated storage[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(6):59-68.