紫蓝草(Peristrophe roxburghiana)为爵床科植物,又名红蓝、红丝线[1],紫蓝草具有清热解毒、消肿止痛等功效[2-3]。有研究表明,紫蓝草含有黄酮类化合物、生物碱、β-谷甾醇、豆甾醇、香豆素、苯丙素、三萜、甾体、苷类及挥发油等化学成分[4-7],具有多种生物和药物活性,包括防癌[8]、降血压[9]、降血脂[10]、抗炎[11]、保护肝脏[12-13]、抑制血栓[14]等。民间常把紫蓝草用来染制糯米,蒸出来的紫色糯米晶莹剔透,清香扑鼻,是云南、贵州等少数民族特色食品“五彩饭”的一种。
近几年我国有关天然色素的提取、抗氧化活性评估、组成成分分析、安全性评价等领域的研究逐渐增多,如成黎[15]对天然色素的特性、应用、安全性进行了评价;黎海利等[16]对红肉火龙果皮色素进行了提取工艺的优化及其抗氧化性的研究;刘长姣等[17]对黑米色素成分及提取工艺进行了综述。隆金桥等[18-19]对紫蓝草紫色素的提取及稳定性进行了研究,发现紫色素具有一定的耐氧化性,其提取工艺为:微波功率320 W、微波时间80 s、料液比1∶20。
目前针对地方特色五彩饭中紫蓝草色素对大米染色方面的研究尚未见报道。植物色素对大米的着色是植物色素与大米淀粉和蛋白质发生了结合作用。徐塬等[20-22]对乌饭树树叶色素对大米蛋白和淀粉相互作用进行研究,认为乌饭树叶色素与大米蛋白之间以疏水作用和氢键作用进行结合;刘立增等[23]探讨红曲红色素在淀粉颗粒表面的吸附机制中发现羟基红曲红色素分子与淀粉颗粒间的吸附是以氢键为主的物理吸附作用;AMOAKO等[24]在研究中发现直链淀粉和聚合原花青素之间形成II型半结晶V型包合物。但就目前来看,在天然色素对糯米中淀粉与蛋白相互作用机制方面的研究还相对较少。
本文以云南产的人工种植紫蓝草为原料,采用紫外可见光谱确定紫蓝草紫色素提取溶剂乙醇浓度的选择及最大吸收波长;采用单因素和响应面优化设计,对紫蓝草紫色素的提取工艺进行优化,并通过扫描电镜(scanning electron microscope, SEM)初步研究优化提取的色素对糯米的染色表观性能的影响,以期获得紫蓝草色素最佳提取工艺,为紫蓝草染制糯米的产业化生产和紫蓝草色素开发利用提供理论依据,为少数民族特色食品——五彩饭的开发提供科学依据。
1 材料与方法
1.1 材料与试剂
紫蓝草,于2019年8月10日采自云南省红河州河口县桥头乡甘子树村,东经103°23′~104°17′,北纬22°30′~23°02′,海拔930 m,晒干储存备用;糯米产自云南版纳;无水乙醇,分析纯。
1.2 仪器与设备
DFT-100型手提式高速中药粉碎机,温岭市林大机械有限公司;RE-5210型旋转蒸发器,上海亚荣生化仪器厂;TDL-5-A型离心机,上海安亭科学仪器厂;FD-1A-50型冷冻干燥机,上海比朗仪器制造有限公司;80-2型离心机,上海安亭科学仪器厂;UV-1800型紫外可见分光光度计,上海翱艺仪器有限公司;S-4800 型扫描电子显微镜,日本日立公司。
1.3 实验方法
1.3.1 紫蓝草紫色素提取工艺
紫蓝草紫色素提取工艺如下:
紫蓝草→烘干→磨粉→过筛→加入30%(体积分数)乙醇溶液47 ℃浸提20 min→离心过滤→旋转蒸发浓缩→冷冻干燥→粗提物(备用)
1.3.2 紫蓝草紫色素提取溶剂的选择及最大吸收波长的确定
称取1.0 g植物粉末于锥形瓶中,分别加入50 mL超纯水、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%(均为体积分数)乙醇,在50 ℃条件下浸提2 h,取出于3 000 r/min离心10 min,取上清液稀释相同倍数,在190~800 nm做紫外可见光光谱扫描。
1.3.3 单因素试验设计
以吸光度为指标,在不同条件下考察料液比、提取时间、提取温度3个因素对紫蓝草提取效果的影响。
1.3.3.1 料液比对紫蓝草紫色素提取吸光度的影响
称取1.00 g植物粉末于锥形瓶中,加入10、20、30、40、50、60、70 mL 30%(体积分数)乙醇,在50 ℃条件下浸提2 h,取出于3 000 r/min离心10 min,取上清液稀释至相同体积,在598 nm测吸光度。
1.3.3.2 提取温度对紫蓝草紫色素提取吸光度的影响
称取1.00 g植物粉末于烧杯中,加入40 mL 30%乙醇,在30、40、50、60、70、80 ℃条件下浸提2 h,取出于3 000 r/min离心10 min,取上清液稀释相同倍数,在598 nm测吸光度。
1.3.3.3 提取时间对紫蓝草紫色素提取吸光度的影响
称取1.00 g植物粉末于烧杯中,加入40 mL 30%乙醇,在50 ℃条件下浸提10、20、30、40、50 min,取出于3 000 r/min离心10 min,取上清液稀释相同倍数,在598 nm测吸光度。
1.3.4 响应面优化试验设计
响应面试验设计如表1所示:
表1 响应面试验因素与水平设计表
Table 1 Independent variables and their levels used in response surface analysis
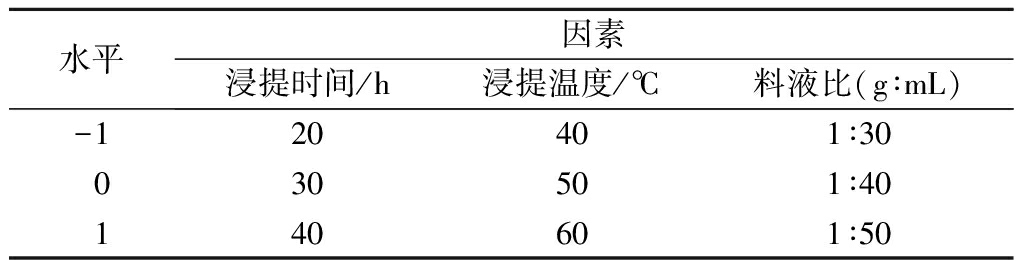
水平因素浸提时间/h浸提温度/℃料液比(g∶mL)-120401∶30030501∶40140601∶50
1.3.5 扫描电镜的样品制备
1.3.5.1 紫蓝草色素染色糯米饭制备
以传统民间植物染饭工艺流程为基础,结合曹昌伟等[25]密蒙花黄色素染制黄米饭工艺,基本工艺流程为:
原料糯米→称量→淘洗→紫蓝草染料常温浸泡5 h
1.3.5.2 扫描电子显微镜观察
以紫蓝草紫色素、白糯米、紫蓝草紫色素染色糯米为观测样本。挑选出外形完整的米粒,用刀片将米粒横向从中间断开。让米粒的断面朝上,用导电双面胶粘附在铜台上,采用离子溅射仪对断面进行真空喷金处理。然后在 10.0 kV的工作电压下,分别放大不同倍数并拍照记录。
1.4 数据处理
采用Excel 2010、Design-Expert 8.0.6、Origin Pro 9.1进行数据整理和响应面分析;利用 SPSS 19.0 进行方差显著性分析。
2 结果与分析
2.1 单因素试验
2.1.1 紫蓝草紫色素提取溶剂的选择及最大吸收波长的确定
当乙醇体积分数为0%~40%时,紫蓝草色素的紫外吸收光谱趋势如图1所示,此时样品颜色仍为紫红色(图2),在220~260 nm和 560~600 nm处有2个吸收峰,由于在220~260 nm处的吸光值不符合朗伯比尔定律[26],因此选择560~600 nm确定最佳吸收波长。由图1可看出,当吸光度为598 nm时吸光度最大,因此确定紫蓝草紫色素的最佳吸收波长为598 nm。随着乙醇浓度持续增加,样品颜色逐渐由紫红色变成绿色(图2),而紫色素的吸收光谱变成了另一种趋势(图1),样品在210、250和663 nm处均有强吸收峰;当乙醇浓度为50%~80%时,样品在600 nm附近仍有弱吸收峰,但随着乙醇浓度继续增加,600 nm附近的吸收峰消失,随之在300和430 nm处出现吸收峰。原因可能是紫蓝草紫色素溶于低浓度的乙醇溶液,而不溶或难溶于高浓度的乙醇溶液,且高浓度的乙醇溶液可将紫蓝草中其他杂质物质提取出来。由图1可看出,当乙醇体积分数为30%时,得到的吸光度值最大,紫蓝草紫色素提取效果最好。

a-紫蓝草紫色素紫外-可见光吸收光谱;b-不同乙醇浓度对紫蓝草紫色素吸光值的影响;c-紫蓝草紫色素的吸光值变化
图1 紫蓝草紫色素提取溶剂的选择及最大吸收波长的确定
Fig.1 Extraction solvent selection and determination of maximum absorption wavelength of pigment from Peristrophe roxburghiana
注:图中小写字母表示差异显著(P<0.05)(下同)

图2 不同乙醇体积分数对紫蓝草紫色素提取颜色变化的影响
Fig.2 Effect of different ethanol concentration on the color change of pigment from Peristrophe roxburghiana
2.1.1 提取料液比对色素提取液吸光度的影响
由图3可看出,紫蓝草紫色素得率随着提取料液比的不断升高先呈现快速增长的趋势,当料液比达到1∶50(g∶mL)时达到最大,吸光度为1.36±0.07,此时若继续增加提取溶剂体积,紫蓝草紫色素的提取率反而呈下降趋势,由于料液比为1∶40 (g∶mL)时吸光度为1.35±0.06,与料液比为1∶50 (g∶mL)时差异不显著(P>0.05),经综合考虑,因此选择料液比为1∶40 (g∶mL)。
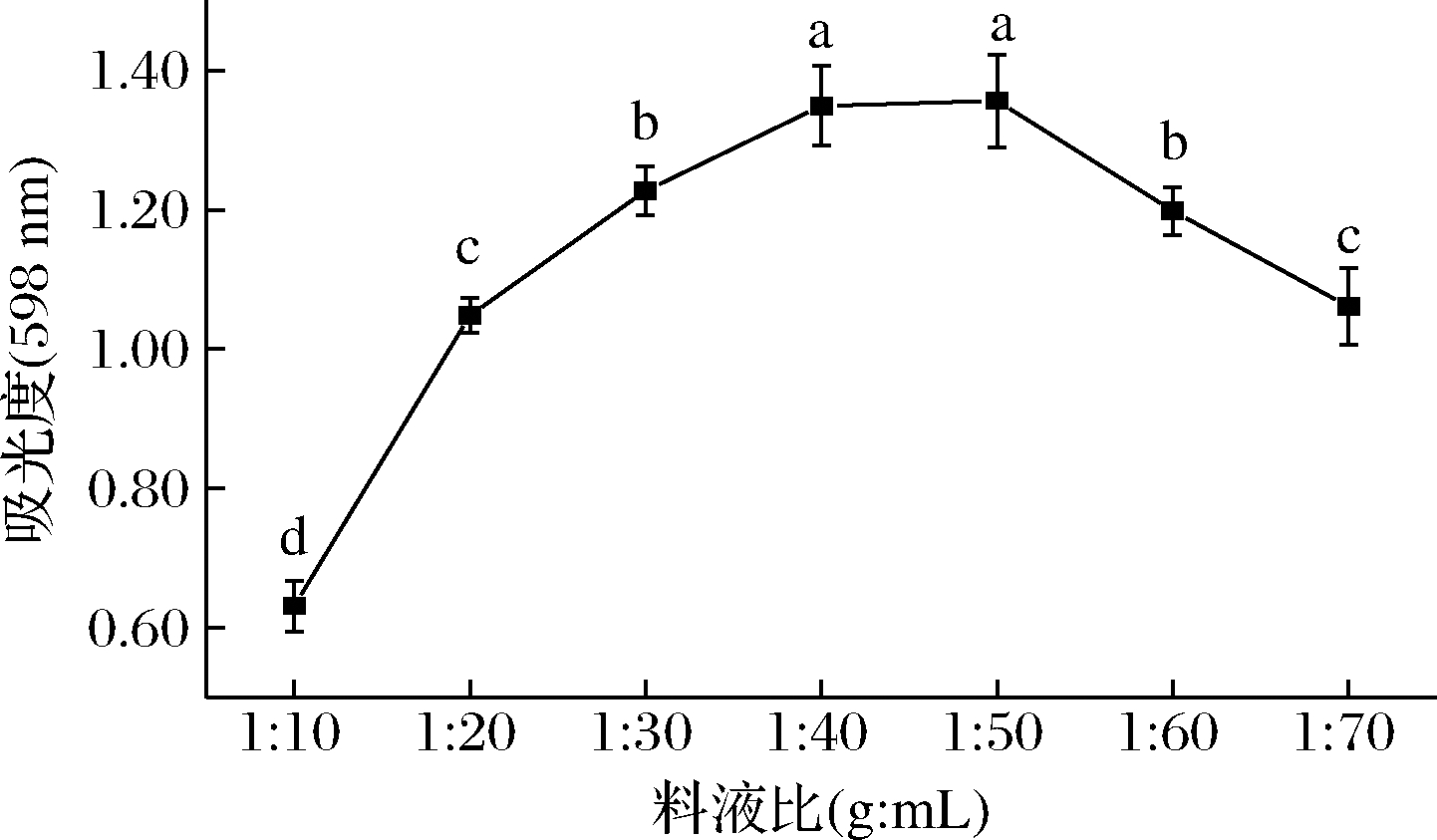
图3 料液比对色素得率的影响
Fig.3 Effect of water-material ratio on the yield of pigments
2.1.2 提取温度对色素提取吸光度的影响
由图4可以看出,随着提取温度的不断升高,紫蓝草紫色素提取效果呈现快速增长的趋势,当提取温度为50 ℃时达到最大,为1.26±0.07,且差异显著(P<0.05),而后提取效果随着提取温度的继续升高而迅速下降。但是当提取温度达到80 ℃时吸光度却显著上升(P<0.05),原因可能是提取溶剂在此温度下有挥发现象,导致体系中色素浓度增加。
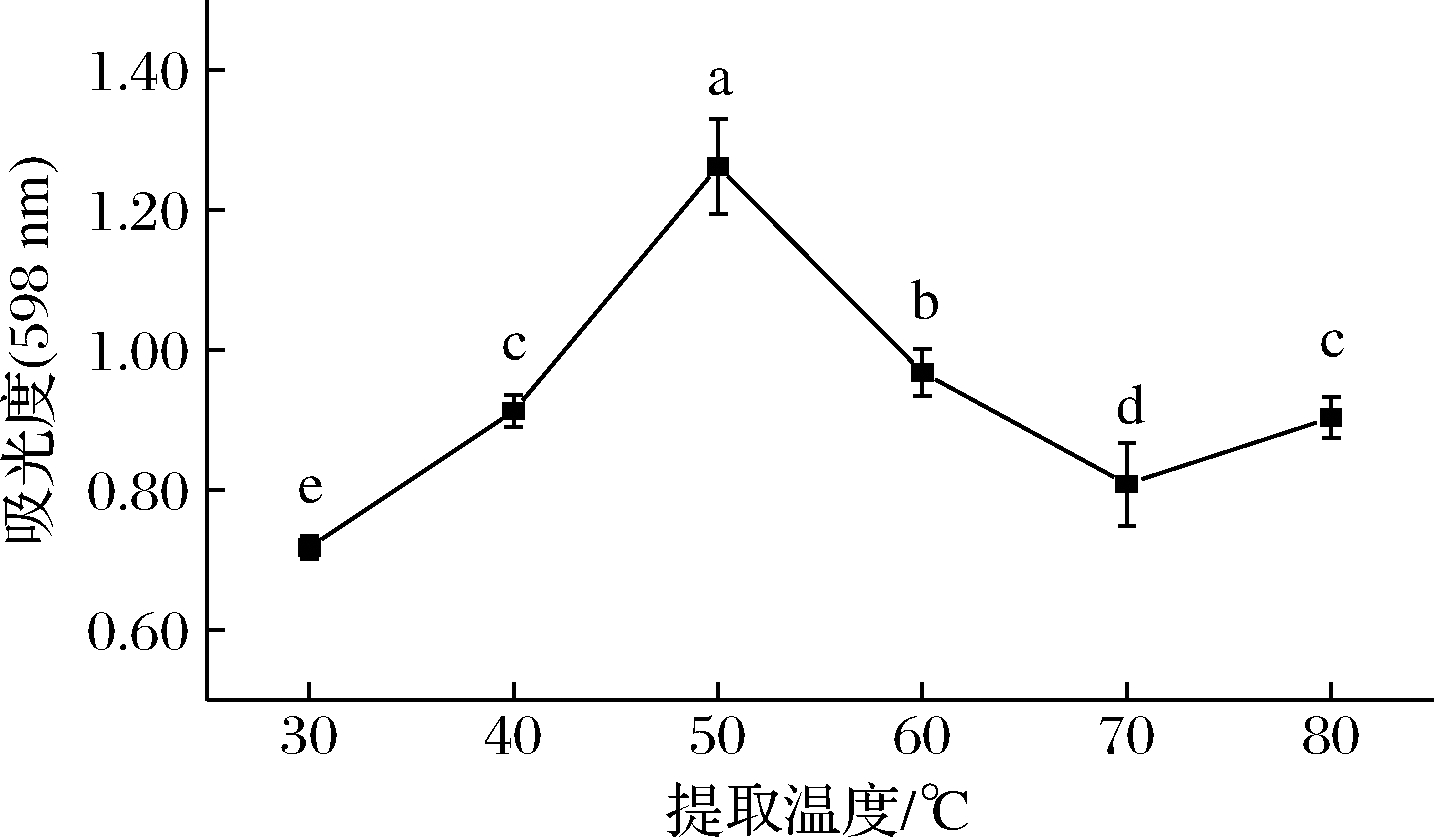
图4 提取温度对色素得率的影响
Fig.4 Effect of temperature on the yield of pigments
2.1.3 提取时间对色素提取吸光度的影响
由图5可以看出,紫蓝草紫色素的提取效果随着提取时间的增加呈现先上升后下降的趋势,在30 min时达到最大,为1.26±0.01,且差异显著(P<0.05)。因此,提取时间为30 min最佳。
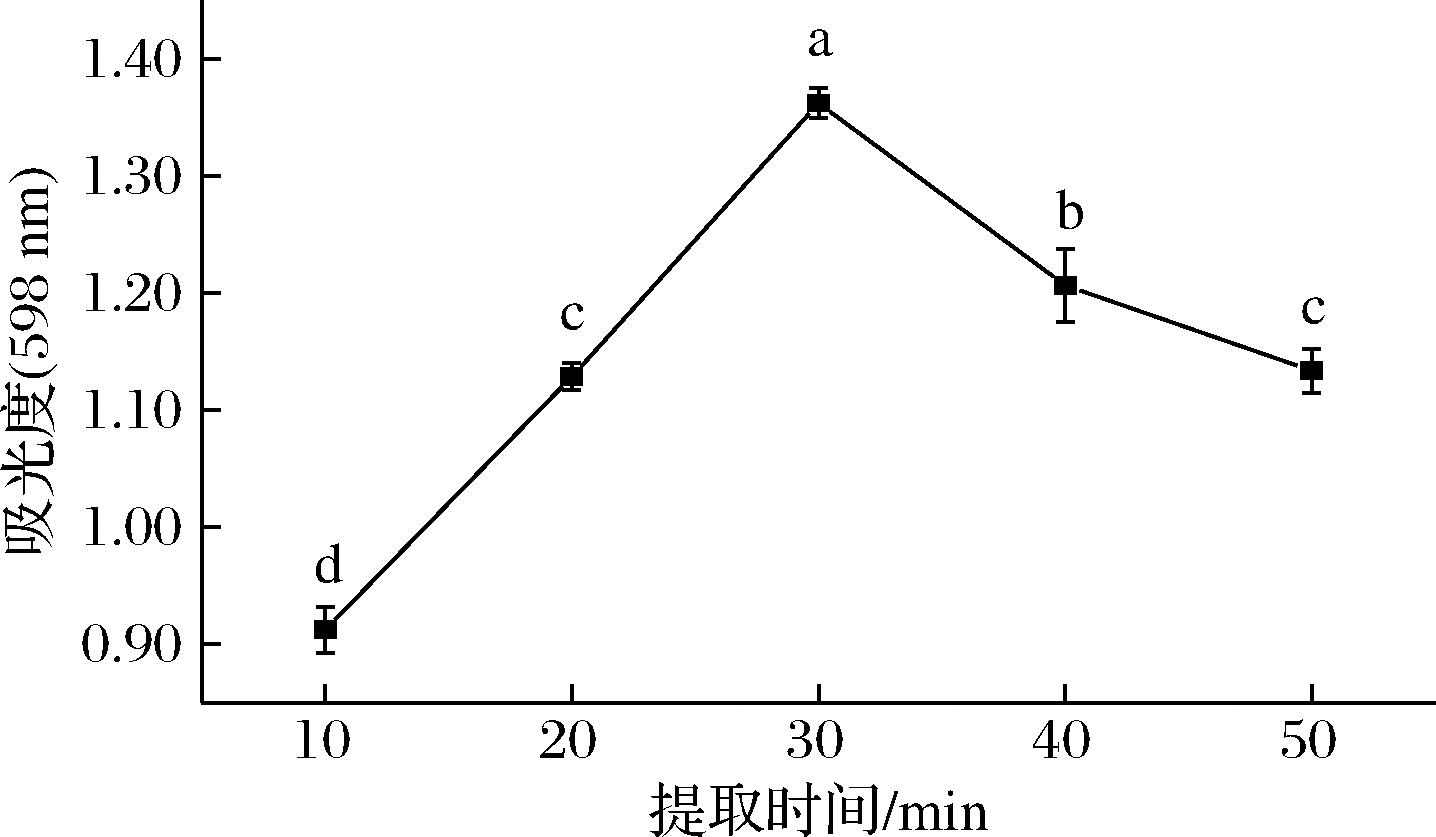
图5 提取时间对色素得率的影响
Fig.5 The effect of time on the yield of pigments
2.2 响应面优化试验
2.2.1 响应面实验设计与结果
根据单因素实验结果,由Design-Expert 8.0.6统计分析软件设计出的实验方案及实验结果如表2所示,以吸光度为响应值,以提取时间(A),提取温度(B),料液比(C)为自变量,建立3因素3水平中心组合实验设计。
表2 响应面分析方案与结果
Table 2 Experimental design and results for response surface analysis
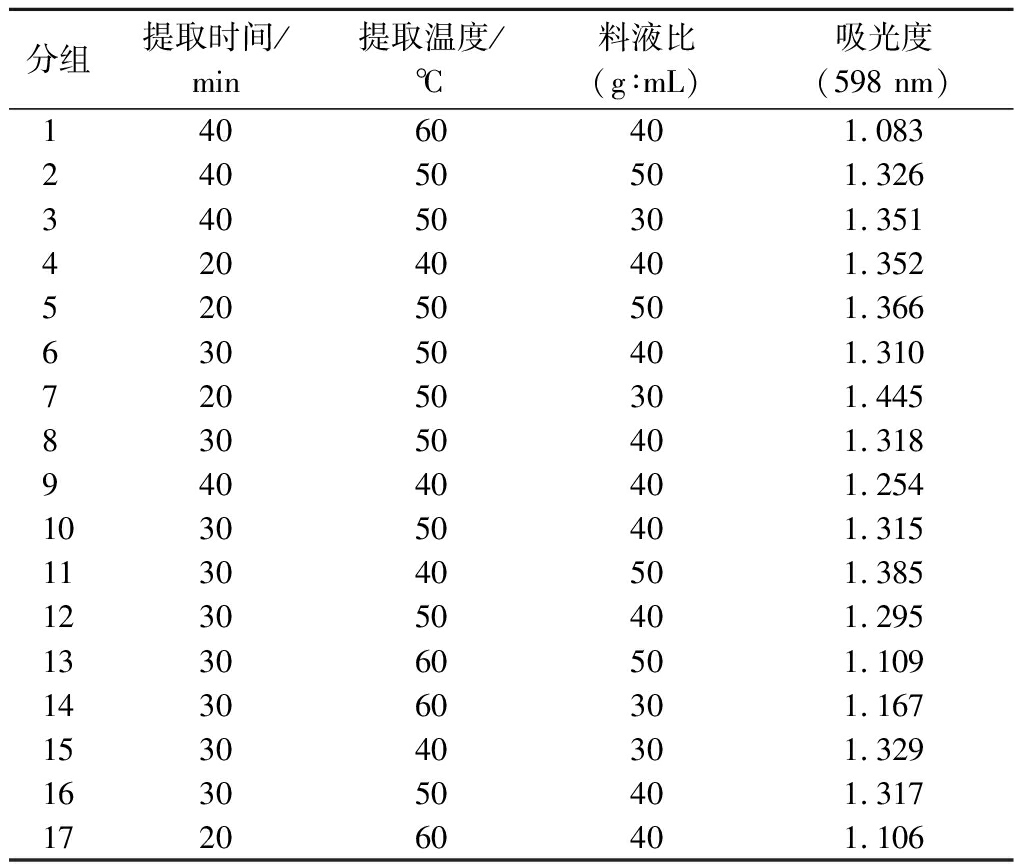
分组提取时间/min提取温度/℃料液比(g∶mL)吸光度(598 nm)14060401.083 24050501.326 34050301.351 42040401.352 52050501.366 63050401.310 72050301.445 83050401.318 94040401.254 103050401.315 113040501.385 123050401.295 133060501.109 143060301.167 153040301.329 163050401.317 172060401.106
2.2.2 模型建立及显著性检验
利用Design-Expert 8.0.6 软件进行多元回归拟合,回归模型的方差分析结果见表3。对各因素回归拟合后,二次方程模型为:Y=1.31-0.032A-0.11B-0.013C+0.019AB+0.013AC-0.029BC+0.006 0A2-0.12B2+0.055C2
表3 紫蓝草紫色素得率回归模型方差分析表
Table 3 Analysis of variance analysis of degree of the yield of pigments
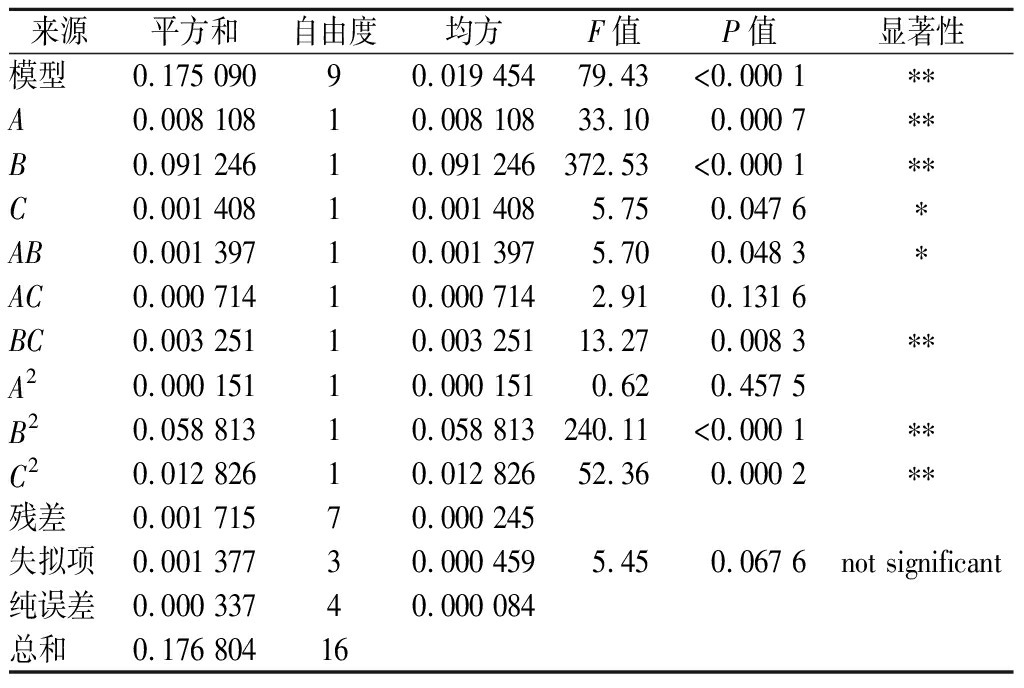
来源平方和自由度均方F值P值显著性模型0.175 09090.019 45479.43<0.000 1∗∗A0.008 10810.008 10833.100.000 7∗∗B0.091 24610.091 246372.53<0.000 1∗∗C0.001 40810.001 4085.750.047 6∗AB0.001 39710.001 3975.700.048 3∗AC0.000 71410.000 7142.910.131 6BC0.003 25110.003 25113.270.008 3∗∗A20.000 15110.000 1510.620.457 5B20.058 81310.058 813240.11<0.000 1∗∗C20.012 82610.012 82652.360.000 2∗∗残差0.001 71570.000 245失拟项0.001 37730.000 4595.450.067 6not significant纯误差0.000 33740.000 084总和0.176 80416
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)
由表3方差分析可知,紫蓝草紫色素提取工艺回归模型F值=79.43且显著性检验P< 0.000 1,差异极显著,说明该模型与实际拟合良好,经此试验优化后的工艺可行;紫蓝草紫色素提取工艺回归模型失拟性检验P=0.067 6>0.05,差异不显著,说明所得回归方程与实际拟合中非正常误差所占比例较小。该模型中决定系数R2=0.990 3,调整系数![]() 说明该模型能解释97.78%响应值的变化。该模型C.V值为1.22%,表明实验的可靠性很高。综上所述,回归模型拟合程度良好,试验误差小,能够准确地分析和预测紫蓝草紫色素提取工艺,具有一定的实践指导意义。
说明该模型能解释97.78%响应值的变化。该模型C.V值为1.22%,表明实验的可靠性很高。综上所述,回归模型拟合程度良好,试验误差小,能够准确地分析和预测紫蓝草紫色素提取工艺,具有一定的实践指导意义。
模型中一次项A、B对色素提取效果达到极显著水平(P<0.01), C对色素提取效果达到显著水平(P<0.05);模型中交互项BC对色素提取效果达到极显著水平(P<0.01),AB对色素提取效果达到显著水平(P<0.05),AC对色素提取效果不显著(P>0.05);模型中二次项B2、C2对色素提取效果达到极显著水平(P<0.01),A2对色素提取效果不显著(P>0.05)。由回归系数显著性表明,在所取因素水平范围内,各因素对紫蓝草紫色素提取工艺影响的顺序为:提取温度>提取时间>料液比。
2.2.3 最佳条件的确定和回归模型的验证
图6是提取时间(A)、提取温度(B)、料液比(C)3个因素之间交互作用的响应面图和等高线图,等高线是响应面图在水平方向上的投影[27]。
由图6可看出,提取温度和料液比交互作用呈马鞍形,表示2因素交互作用显著[28]。同时在提取温度和料液比交互作用的等高线图中,等高线沿提取温度的增加方向密集,降低方向稀疏,说明增加提取温度会更显著地影响色素提取效果。同理,降低提取时间和料液比会更显著地影响色素提取效果。

图6 各因素交互作用的响应面图和等高线图
Fig.6 The response surface and contour plot for interaction of various factors
二次回归模型拟合结果显示,提取时间为20.41 min,提取温度为45.96 ℃,提取料液比为1∶30.18(g∶mL),此时预测吸光度为1.45。为了验证模型的有效性,同时考虑到实际情况,将最佳工艺条件修改为提取时间为20 min,提取温度为45 ℃,提取料液比为1∶30(g∶mL),在此条件下进行6次重复试验,结果表明吸光度为1.412±0.018,与预测值接近,说明模型准确可靠。
2.3 扫描电子显微镜观察分析结果
2.3.1 紫蓝草紫色素颗粒扫描电镜
扫描电镜能够直观反映紫蓝草紫色素颗粒的粒径大小与形貌[29],图7是放大2 000倍下紫蓝草紫色素的微观形态,紫蓝草紫色素颗粒是表面光滑的不规则片状颗粒。

图7 紫蓝草紫色素颗粒显微结构形态
Fig.7 Microstructure and morphology of pigment from Peristrophe roxburghiana
2.3.2 糯米染色前后扫描电镜
白糯米和紫蓝草紫色素染色糯米(以下简称紫糯米)的微观形态如图8所示。通过扫描电镜可以看出白糯米米粒横断面胚乳细胞的排列形式,如图8-A1所示,粳糯米胚乳细胞为由糯米横断面中心向外呈辐射状排列的长方柱状细胞[30],将淀粉粒包裹其中。同时通过图8-A2可看出,胚乳细胞内的复合淀粉粒介于完全被覆盖和完全暴露出来之间,同时胚乳细胞表面有微孔和花纹,因此实验用粳糯米为介于裸露型和非裸露型之间的中间型胚乳细胞。由图8-A3可看出,胚乳细胞横断面有裂纹,这可能是因为糯米在浸泡时米粒吸水产生裂缝。由图8-A4和图8-A5可看出,胚乳细胞内的单粒淀粉粒大小差异不大,为各面呈凹陷状态紧密排列的多面体;同时存在由多个单粒淀粉里组成的复合淀粉粒[31]。并且可以明显看出,大米横断面分布着一些“小孔”(如图灰色圆圈标注区域),这些小孔是细胞内和细胞外之间的物质在胚乳生长时进行物质交换时留下的通道[32]。

A-白糯米胚乳细胞微观结构(A1:×100、A2:×500、A3:×1 000、 A4:×2 000、A5:×5 000);B-紫糯米胚乳细胞微观结构(B1:×100、 B2:×500、B3:×1 000、B4:×2 000、B5:×10 000)
图8 染色前后生糯米胚乳细胞表面微观结构
Fig.8 Microstructure of albuminous cells of raw glutinous rice before and after dyeing
对比同一放大倍数的白糯米和紫糯米,由图8-A1、图8-B1和图8-A2、图8-B2可以明显看出在胚乳细胞淀粉粒变得粗糙不光滑,淀粉粒或复合淀粉体表面凹凸不平,并且有碎片颗粒嵌在淀粉粒之间。可以观察到图8-B3糯米横断面上胚乳细胞间隙变大,并且镶嵌有发光碎片(如图白色椭圆圈标注区域),猜测碎片为紫蓝草紫色素;同时图8-B3分布的小孔明显比图8-A3增多变大。由图8-A4、图8-B4可观察到,复合淀粉体表面出现孔状凹陷,同时复合淀粉体间出现与凹陷大小类似的圆球体,可能是镶嵌在淀粉粒间的蛋白颗粒脱落[33]所致。由图8-A5、图8-B5可观察到,淀粉粒表面凹凸不平,粗糙且不均匀,由表面光滑的状态变为表面呈波纹状凹陷状态,可能是淀粉粒与色素发生相互作用所致。
2.3.3 糊化糯米染色前后扫描电镜
糊化白糯米和糊化紫糯米的微观形态见图9。由图9可以看出,白糯米胚乳细胞淀粉粒已经糊化,表面多孔且粗糙,糯米胚乳细胞结构消失,横断面淀粉粒形态改变,相互交联,没有淀粉粒或复合淀粉体的形状存在,淀粉糊化后淀粉颗粒与水分子发生水合溶胀,氢键断裂,淀粉晶体结构崩溃,淀粉分子链溶出并相互缠绕成为网络状海绵样结构,这与朱晓倩等[34]家用压力锅烹调米饭的研究一致。
对比图9-C1和图9-D1可以看出,同一浸泡条件和蒸煮条件的白糯米的糊化度明显高于紫糯米,糊化白糯米细胞内部复合淀粉体和淀粉粒相互交联,产生一种丝状物,伸展并相互交织成为具有孔洞的海绵样结构,而紫糯米的糊化状态则呈纤维状,混乱没有孔隙,可能是紫蓝草紫色素与淀粉粒的吸附作用影响了淀粉粒之间的交联,降低糯米米粒的吸水作用,阻碍淀粉分子打开,降低淀粉糊化,这一结果与许多研究[35-38]一致,多酚类物质与淀粉的结合会显著降低淀粉的糊化及消化,这意味着紫蓝草紫色素与淀粉的结合可能会抑制淀粉的消化率。

C-糊化白糯米胚乳细胞微观结构(C1:×400、C2:×2 000) D-糊化紫糯米胚乳细胞微观结构(D1:×400、D2:×2 000)
图9 染色前后糊化糯米胚乳细胞表面微观结构
Fig.9 Microstructure of albuminous cells of gelatinized glutinous rice before and after dyeing
3 结论
紫蓝草紫色素的最佳提取工艺为提取时间为20 min,提取温度为45 ℃,提取料液比为1∶30(g∶mL),提取液吸光度为1.412±0.018。
SEM分析表明,紫蓝草紫色素颗粒呈现碎片状;淀粉粒与色素发生相互作用,紫糯米淀粉粒表面由光滑的状态变为皱缩、粗糙不均匀状态;紫蓝草紫色素与淀粉粒的吸附作用影响了淀粉的糊化。
[1] 曹庆玺, 邓洁媚, 姬生国, 等.红丝线药材的HPLC指纹图谱研究[J].中国药房, 2016, 27(36):5 130-5 132.
CAO Q X, DENG J M, JI S G, et al.Study on HPLC fingerprint of Lycianthes biflora[J].China Pharmacy, 2016, 27(36):5 130-5 132.
[2] 刘同方, 于华忠, 刘建兰, 等.红丝线化学成分及药理活性研究进展[J].广东农业科学, 2013, 40(19):116-119;124.
LIU T F, YU H Z, LIU J L, et al.Research progress on chemical components and pharmacological activities of Peristrophe roxburghiana (Schult.) Brem[J].Guangdong Agricultural Sciences, 2013, 40(19):116-119;124.
[3] 徐玉琳, 李英, 林秋晓, 等.红丝线草醇提取物的降压作用研究[J].今日药学, 2011, 21(2):77-78;87.
XU Y L, LI Y, LIN Q X, et al.Study on the antihypertensive effect of alcohol extract from Radix Aucklandiae[J].Pharmacy Today, 2011, 21(2):77-78;87.
[4] 韦正, 黄秀香, 赖红芳.红蓝草的化学成分、药理活性及开发应用[J].天然产物研究与开发, 2016, 28(12):2 035-2 043.
WEI Z, HUANG X X, LAI H F, et al.Review on chemical composition,pharmacological activity and application of Peristrophe baphica (Spreng) Bremek[J].Natural Product Research and Development, 2016, 28(12):2 035-2 043.
[5] 蒋小华, 谢运昌, 梁靖, 等.红丝线化学成分的研究[J].中成药, 2017, 39(11):2 319-2 321.
JIANG X H, XIE Y C, LIANG J, et al.Chemical constituents from Peristrophe baphica[J].Chinese Traditional Patent Medicine, 2017, 39(11):2 319-2 321.
[6] KHUE D B, SAO MAI D, TUAN P M, et al.Peristrophe roxburghiana—A review[J].Annals:Food Science and Technology, 2014, 15(1):1-9.
[7] 蒋小华, 谢运昌, 李娟, 等.鲜、干品红丝线叶挥发油化学成分的GC-MS分析[J].精细化工, 2012, 29(4):326-329;351.
JIANG X H, XIE Y C, LI J, et al.GC-MS Analysis of the essential oils from fresh and dry leaves of Peristrophe baphica[J].Fine Chemicals, 2012, 29(4):326-329;351.
[8] THUY T T, HUONG N T T, NHUNG L T H, et al.Isolation, characterisation and biological evaluation of a phenoxazine, a natural dyestuff isolated from leaves of Peristrophe bivalvis[J].Natural Product Research, 2013, 27(8):771-774.
[9] CHENG Z, LU J, LIU J.Effects of Peritrophe roxburghiana on blood pressure in renal hypertensive and hyperlipidemic rats[J].Journal of Chinese Medicinal Materials, 2004, 27(12):927-930.
[10] ALUKO E O, ADEJUMOBI O A, FASANMADEA A.Peristrophe roxburghiana leaf extracts exhibited anti-hypertensive and anti-lipidemic properties in L-NAME hypertensive rats[J].Life Sciences, 2019, 234:116753.
[11] YANG Z J, ZHANG Y H, YAO X Q, et al.Anti-inflammatory activity of chemical constituents isolated from Peristrophe roxburghiana[J].Latin American Journal of Pharmacy, 2012, 31(9):1 279-1 284.
[12] 何思陆, 郭小葆, 徐灵源, 等.红丝线多糖对鼠源肝星状HSCs-T6细胞增殖的抑制作用及其机制研究[J].中国药房, 2016, 27(4):485-488.
HE S L, GUO X B, XU L Y, et al.Study on inhibitory effect of Lycianthes biflora polysaccharide on the proliferation of hepatic stellate HSCs-T6 cells in rats and its mechanism[J] China Pharmacy, 2016, 27(4):485-488.
[13] 李志超, 黄俊敏, 李红莉.红丝线草对肝纤维化大鼠肝组织MMP-1及TIMP-1表达的影响[J].贵阳医学院学报, 2015, 40(1):52-55.
LI Z C, HUANG J M, LI H L, et al.Effect of Peristrophe japonica on the expression of MMP-1 and TIMP-1 in hepatic tissue of hepatic fibrosis rats[J] Journal of Guizhou Medical University, 2015, 40(1):52-55.
[14] YANG W, GU F, LU J, et al.Effect of the extract from Peristrophe roxburghiana on hemorheology in rats[J].Zhong Yao Cai, 2002, 25(10):727-728.
[15] 成黎. 天然食用色素的特性、应用、安全性评价及安全控制[J].食品科学, 2012, 33(23):399-404.
CHENG L.Characteristics, application, safety evaluation and safety control of natural food pigments[J].Food Science, 2012, 33(23):399-404.
[16] 黎海利, 刘锴栋, 袁长春, 等.红肉火龙果果皮色素提取工艺优化及其抗氧化活性[J].食品与发酵工业, 2014, 40(12):203-209.
LI H L, LIU K D, YUAN C C, et al.Extraction and antioxidant activity of pigment from red pitaya peel[J].Food and Fermentation Industries, 2014, 40(12):203-209.
[17] 刘长姣, 于徊萍, 孟宪梅.黑米色素成分和提取工艺研究进展[J].中国食品添加剂, 2015(11):141-145.
LIU C J, YU H P, MENG X M.Research on the components and extraction process of black rice pigment[J].China Food Additives, 2015(11):141-145.
[18] 隆金桥, 谢宇奇.紫蓝草紫色素的提取及稳定性研究[J].食品研究与开发, 2014, 35(10):70-72.
LONG J Q, XIE Y Q.Stability of purpurin of Peristrophe roxburghiana[J].Food Research and Development, 2014, 35(10):70-72.
[19] 隆金桥, 谢宇奇.紫蓝草紫色素微波水提工艺优化及耐氧化性分析[J].南方农业学报, 2013, 44(12):2 062-2 065.
LONG J Q, XIE Y Q.Microwave H2O extraction technology optimization and antioxidant analysis of purpurin from Peristrophe roxburghiana[J].Journal of Southern Agriculture, 2013, 44(12):2 062-2 065.
[20] 徐塬, 王立.乌饭树树叶色素对大米蛋白的染色机理[J].中国食品学报, 2016, 16(4):58-64.
XU Y, WANG L.The dyeing mechanism of Vaccinium bracteatum Thunb.Leaves′ pigment and rice protein[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(4):58-64.
[21] 徐塬, 王立, 钱海峰, 等.乌饭树树叶色素与大米蛋白相互作用的研究[J].现代食品科技, 2015, 31(12):121-127.
XU Y, WANG L, QIAN H F, et al.Interactions between Vaccinium bracteatum Thunb.Leaf pigment and rice protein[J].Modern Food Science and Technology, 2015, 31(12):121-127.
[22] 徐塬. 乌饭树树叶提取物与大米蛋白和淀粉相互作用的研究[D].无锡:江南大学, 2015.
XU Y.The interaction between Vaccinium bracteatum Thunb.Leaf extraction and rice protein/starch[D].Wuxi:Jiangnan University, 2015.
[23] 刘立增, 孟宪昉, 郭俊杰, 等.红曲红色素在淀粉颗粒表面吸附机制研究[J].食品研究与开发, 2015, 36(14):41-44.
LIU L Z, MENG X F, GUO J J, et al.Study on the adsorption mechanism of Red Monascus pigment on the surface of starch[J].Food Research and Development, 2015, 36(14):41-44.
[24] AMOAKO D B, AWIKA J M.Resistant starch formation through intrahelical V-complexes between polymeric proanthocyanidins and amylose[J].Food Chemistry, 2019, 285:326-333.
[25] 曹昌伟, 杨越超, 张建跃, 等.响应面法优化密蒙花黄色素染制黄米饭工艺研究[J].食品研究与开发, 2017, 38(20):75-79.
CAO C W, YANG Y C, ZHANG J Y, et al.Study on optimization of colorful rice dyed with yellow pigment by response surface methodology[J].Food Research and Development, 2017, 38(20):75-79.
[26] BUIJS K, MAURICE M J.Some considerations on apparent deviations from lambert-beer′s law[J].Elsevier, 1969, 47(3):469-474.
[27] 蒲立柠, 陈光静, 阚建全.响应面试验优化青稞麸皮薏仁红曲霉发酵工艺[J].食品科学, 2017, 38(2):264-270.
PU L N, CHEN G J, KAN J Q.Optimization of fermentation process of a mixture of highland barley bran and Coix seed by Monascus using resonse surface methodology[J].Food Science, 2017, 38(2):264-270.
[28] 赵存朝, 王雪峰, 黄梦, 等.贯筋藤酶解山羊乳酪蛋白糖巨肽的工艺研究[J].中国乳品工业, 2017, 46(9):25-29.
ZHAO C C, WANG X F, HUANG M, et al.Study on enzymatic hydrolysis of goat milk preparation casein glycomacropeptide by protease in dregea sinensis (hemsl.) [J].China Dairy Industry, 2017, 46(9):25-29.
[29] SARRATE R, TIC J R, MI
J R, MI ARRO M, et al.Modification of the morphology and particle size of pharmaceutical excipients by spray drying technique[J].Powder Technology, 2015, 270:244-255.
ARRO M, et al.Modification of the morphology and particle size of pharmaceutical excipients by spray drying technique[J].Powder Technology, 2015, 270:244-255.
[30] 瞿波, 徐运启, 傅丽霞.品质不同的稻米胚乳细胞形态特征的扫描电镜观察[J].华中农业大学学报, 1991(4):404-408;433-434.
QU B, XU Y Q, FU L X.Morphological characteristics of rice endosperm cells with different qualities were observed by scanning electron microscope[J].Journal of Huazhong Agricultural University, 1991(4):404-408;433-434.
[31] 王立峰, 陈超, 杨精华, 等.大米小包装储藏过程中脂类及微观结构的变化[J].中国农业科学, 2015, 48(9):1 807-1 817.
WANG L F, CHEN C, YANG J H, et al.Lipid and microstructure changes of small packaged rice during storage[J].Scientia Agricultura Sinica, 2015, 48(9):1 807-1 817.
[32] RENZETTI S, ARENDT E K.Effect of protease treatment on the baking quality of brown rice bread:From textural and rheological properties to biochemistry and microstructure[J].Journal of Cereal Science, 2009, 50(1):22-28.
[33] 周显青, 张玉荣, 李里特.不同模拟储藏条件下粳米胚乳显微结构变化[J].农业工程学报, 2010, 26(5):329-334.
ZHOU X Q, ZHANG Y R, LI L T.Microscopic structure changes of Japonica milled rice endosperm under typical simulating storage conditions[J].Transactions of the Chinese Society of Agricultural Engineering, 2010, 26(5):329-334.
[34] 朱晓倩, 范志红, 王淑颖, 等.家用压力锅烹调对米饭品质的影响[J].食品科学, 2013, 34(21):55-59.
ZHU X Q, FAN Z H, WANG S Y, et al.Effect of domestic cooking on quality of cooked rice[J].Food Science, 2013, 34(21):55-59.
[35] XIE F, HUANG Q, FANG F, et al.Effects of tea polyphenols and gluten addition on in vitro wheat starch digestion properties[J].International Journal of Biological Macromolecules, 2019,126:525-530.
[36] SUN L, MIAO M.Dietary polyphenols modulate starch digestion and glycaemic level:A review[J].Critical Reviews in Food Science & Nutrition, 2020,60(4):1-15.
[37] AMOAKO D B, AWIKA J M.Resistant starch formation through intrahelical V-complexes between polymeric proanthocyanidins and amylose[J].Food Chemistry, 2019,285:326-333.
[38] GUO Z, ZHAO B, CHEN J, et al.Insight into the characterization and digestion of lotus seed starch-tea polyphenol complexes prepared under high hydrostatic pressure[J].Food Chemistry, 2019, 297:124992.