娃娃菜(Brassica pekinensis)属于十字花科芸薹属白菜亚种,比普通大白菜纤维含量少,食用口感佳,加上含有丰富的营养素,近些年倍受消费者青睐。据研究,娃娃菜中富含胡萝卜素和钙、磷、铁等元素[1]。此外,娃娃菜组织内含有的抗坏血酸和总酚等抗氧化物质,能有效清除人体内的自由基,经常食用娃娃菜可有效防止和减少心血管和肿瘤等疾病的发生,极具药用价值[2]。但是娃娃菜在采摘后呼吸极其旺盛,叶片容易失水皱缩。常温环境下娃娃菜组织内抗氧化物质含量的减少会造成活性氧的积累和细胞膜受损,导致营养成分的流失和叶片的快速衰老,加速了其品质劣变,不利于长期贮藏[3]。
1-甲基环丙烯(1-methylcyclopropene,1-MCP)是一种安全有效的乙烯受体抑制剂,具有无毒、易合成及稳定性强等优点[4]。商品化的1-MCP粉剂与水接触后产生挥发性气体,与乙烯受体进行不可逆结合后可有效抑制果蔬采后呼吸强度,进而延缓其成熟和衰老[5]。研究表明,1-MCP能维持生菜、青菜和包菜较高的抗坏血酸含量,延缓叶绿素的降解[6];有效抑制油菜[7]的呼吸速率,保持其良好的贮藏品质。然而1-MCP的这种有益影响常因作物种类、处理浓度及时间等因素的不同而不同。例如MENG等[8]的研究显示,1-MCP处理可抑制白菜的脱帮,但澳大利亚学者发现0.1、1 μL/L的1-MCP对白菜采后的贮藏特性无影响[9]。可见,1-MCP对蔬菜贮藏特性的影响依赖于其本身的特性。目前尚未见1-MCP对娃娃菜贮藏特性影响的报道。
因此,本研究以娃娃菜为试材,研究了常温(20±1) ℃贮藏条件下,1-MCP熏蒸处理对采后娃娃菜贮藏品质、呼吸强度、活性物质含量、抗氧化能力及抗氧化酶活性的影响,以期从活性氧代谢角度分析其保鲜效果,旨在为娃娃菜的采后化学保鲜应用提供技术参考。
1 材料与方法
1.1 材料与处理
娃娃菜购自江苏省南京市众彩物流批发市场,挑选大小均匀、无明显机械损伤的娃娃菜作为试验材料。将挑选好的娃娃菜随机分为2组,每组60颗娃娃菜用于随后的处理。所用1-MCP由美国罗门哈斯有限公司生产,有效成分含量为0.14%。包装材料统一采用打孔聚乙烯防雾袋(厚度20 μm,规格250 mm×350 mm)。
1-MCP熏蒸处理:根据前期预实验的结果,选用1 μL/L的1-MCP对娃娃菜进行处理。将挑选好的新鲜娃娃菜与装有1-MCP溶液的锥形瓶置于容积为21 L的密闭封箱内,每箱装20颗娃娃菜,每个处理3箱。在(20±1) ℃条件下熏蒸24 h后开盖通风半小时。对照组(CK)只在锥形瓶中加入去离子水,其他处理同1-MCP处理。处理后的娃娃菜装入带孔聚乙烯防雾袋中,封口包装后置于(20±1) ℃,相对湿度80%~90%条件下贮藏,每6 d取样1次,观察娃娃菜表型,用鲜样测定乙烯释放速率和呼吸速率,每组取12颗娃娃菜,从娃娃菜上剥离3片叶帮,取叶帮最上端1/3组织用液氮速冻,置于-80 ℃保存,用于各项品质、生理指标的测定。
1.2 仪器与设备
pH计、PL202-L型分析天平,上海梅特勒-托利多仪器有限公司;1260高效液相色谱仪,美国安捷伦科技有限公司;A11 Basic液氮研磨器,广州艾卡仪器设备有限公司;3K15高速冷冻离心机,美国Sigma-Aldrich公司;UV-1102紫外可见分光光度计,上海天美科学仪器有限公司;Techonlogies 7280A气相色谱仪,安捷伦科技(中国)有限公司。
1.3 指标测定方法
1.3.1 呼吸速率和乙烯释放速率的测定
乙烯释放速率的测定参考王瑶等[10]的方法,略有改动。每组取12颗娃娃菜,其中每个平行4颗,称重后置于密封箱中。于(25±1) ℃条件下密闭4 h后取气1 mL,用气相色谱完成测定。色谱条件:FID检测器,柱温70 ℃,N2压力0.5 MPa,H2压力0.3 MPa,空气压力0.5 MPa,重复3次,外标法定量。呼吸速率测定除了要打开镍转化炉外(375 ℃),其他条件同乙烯释放率的测定。乙烯释放速率以μL/(kg·h)表示,呼吸速率以mg CO2/(kg·h)表示。
1.3.2 丙二醛(malondialdehyde, MDA)含量的测定
MDA含量的测定参考高建晓等[11]的方法,略有改动。称取1.0 g样品,加入5 mL 5%(体积分数)的三氯乙酸充分研磨,将所得匀浆离心(10 000×g,20 min,4 ℃),取上清液2 mL,加入2 mL 0.67%(体积分数)硫代巴比妥酸,混合后水浴煮沸30 min,完全冷却后离心,分别取上清液测定其在450、532和600 nm处的吸光度,计算MDA含量并用μmol/g表示。
1.3.3 可溶性糖和可溶性蛋白含量的测定
可溶性糖含量的测定采用蒽酮比色法[12],结果以mg/g表示。
可溶性蛋白含量的测定参考BRADFORD[13]的方法,略有改动。称取0.5 g样品,加入5 mL 0.1 mol/L磷酸缓冲液(pH 7.2)匀浆,离心(10 000×g,15 min,4 ℃),取上清液0.1 mL,加入0.9 mL蒸馏水和5 mL考马斯亮蓝G-250,混匀于595 nm处比色,计算可溶性蛋白含量并用mg/g表示。
1.3.4 总硫代葡萄糖苷含量的测定
总硫代葡萄糖苷含量的测定参考王淑雯[14]的方法,略有改动。称取1.0 g样品,加入5 mL煮沸的75%(体积分数)甲醇溶液,80 ℃水浴锅中浸提15 min,10 000×g离心15 min,取上清1 mL,加入氯化钯显色液和羧甲基纤维素那溶液各1 mL,测定540 nm处吸光值,结果以mg/g表示。
1.3.5 抗氧化物质含量的测定
总酚含量的测定参考GHASEMNEZHAD等[15]的方法,略有改动。称取1.0 g样品,加入5 mL 80%(体积分数)的乙醇溶液充分研磨成匀浆,离心(10 000×g,15 min,4 ℃)获得上清液。取0.1 mL上清,加入0.9 mL蒸馏水和0.5 mL Folin-酚试剂,于25 ℃水浴3 min,最后加入1 mL饱和碳酸钠,置于25 ℃ 下保温1 h后测定760 nm处吸光值。以没食子酸标品建立标准曲线,通过标准曲线计算总酚含量并用μg/g表示。
抗坏血酸含量的测定采用钼蓝比色法[16]。结果以mg/100g表示。
萝卜硫素含量的测定参考GUO等[17]的方法,略有改动。称取1.0 g样品,加入5 mL蒸馏水,于37 ℃水解3 h后加入8 mL二氯甲烷,采用氮吹仪吹干后用2 mL 10%(体积分数)乙腈超声溶解,过0.22 μm有机系膜,HPLC测定。液相色谱分析条件:XDB-C18色谱柱(250 mm×4.6 mm×5 μm);检测波长:254 nm,流速0.6 mL/min,进样量20 μL,柱温30 ℃。流动相A为超纯水,流动相B为乙腈,洗脱程序:0~25 min,10%~60%乙晴;25~30 min,60%~100%乙晴。
类胡萝卜素含量的测定参考李合生[12]的方法,略有改动。称取1.0 g样品,经液氮研磨后加入95%(以及分数)乙醇4 mL,避光常温浸提6.5 h,过滤后取上清液,以95%乙醇为空白校零,分别测定上清液在474、642和665 nm处的吸光值,每个样品重复3次,根据公式(1)~公式(3)计算:
叶绿素/(mg·L-1)=9.99 A665-0.087 A642
(1)
叶绿素/(mg·L-1)=17.7 A642-3.04 A665
(2)
类胡萝卜素/(mg·L-1)=4.92 A474-0.025 5 [a]-0.225[b]
(3)
式中:[a]、[b]分别表示叶绿素a和b的浓度。
1.3.6 超氧阴离子自由基![]() 生成率和H2O2含量测定
生成率和H2O2含量测定
![]() 生成率采用羟胺法[18]测定,结果以μmol/(min·g)表示。
生成率采用羟胺法[18]测定,结果以μmol/(min·g)表示。
H2O2含量的测定参考谭钺等[19]的方法,略有改动。称取1.0 g样品,离心管中加入5 mL预冷丙酮,振荡摇匀后离心(10 000×g,15 min,4 ℃)。取1 mL上清液,各管加入0.1 mL 5%(体积分数)硫酸钛和0.2 mL浓氨水,待形成沉淀后,再次离心弃上清液。沉淀物质使用丙酮反复清洗4次,直至植物色素褪去。最后向洗涤后的沉淀中加入3 mL 2 mol/L硫酸,待沉淀完全溶解后测定412 nm处吸光值。并以H2O2作为标准物质,计算H2O2含量并用μmol/g表示。
1.3.7 抗氧化能力的测定
上清液制备:称取2.0 g样品,加入15 mL 95%乙醇充分研磨,4 ℃冰箱中浸提5 h,10 000×g离心20 min后留存上清液备用。DPPH自由基和羟自由基(hydroxyl radical, ·OH)清除率的测定参考DONG等[20]的方法。![]() 清除率的测定参考罗淑芬等[21]的方法。
清除率的测定参考罗淑芬等[21]的方法。
总还原力的测定参考SOONG等[22]的方法,略有改动。称取1.0 g样品,冰浴上加入5 mL去离子水,匀浆后离心(10 000×g,25 min,4 ℃),取1 mL上清,依次加入2.5 mL 0.2 mol/L、pH 6.6磷酸缓冲液和2.5 mL 1 g/100mL铁氰化钾溶液,混合均匀后50 ℃避光水浴20 min,然后加入2.5 mL 10 g/100mL的三氯乙酸,振荡摇匀后以4 000 × g离心10 min。最后取离心后上清液2.5 mL,加入2.5 mL去离子水和0.5 mL 0.1 g/100mL氯化铁溶液,常温静置10 min后测定700 nm处吸光值,结果以吸光值的大小表示。
1.3.8 抗氧化酶活性的测定
过氧化物酶(peroxidase, POD)和过氧化氢酶(catalase, CAT)活性的测定参考MOHAMED等[23]的方法。
超氧化物歧化酶(superoxide dismutase, SOD)活性的测定参考JIANG等[18]的方法,略有改动。反应体系为:130 mmol/L甲硫氨酸、750 μmol/L氮蓝四唑、20 μmol/L核黄素、100 μmol/L EDTA和粗酶液各1 mL。于560 nm处测定吸光值。以每分钟每克样品组织的反应体系对氮蓝四唑光化还原的抑制为50%为1个酶活单位(U),SOD活性单位为U/g。
抗坏血酸过氧化物酶(ascorbic acid peroxidase, APX)和谷胱甘肽还原酶(glutathione reductase, GR)活性的测定参考曹建康等[24]的方法。
1.4 数据处理
所有数据均平行测定3次,数据采用平均值±标准误差,使用SPSS 20.0进行邓肯氏单因素方差分析(P<0.05)和相关性分析,并用Origin 96软件作图。
2 结果与分析
2.1 1-MCP对娃娃菜外观品质的影响
由图1可以看出,至贮藏中期,CK组娃娃菜外观品质有所下降,叶端出现轻微腐烂,贮藏中后期(12~24 d),叶片腐烂面积持续增加,根部亦发生脱帮,品质急剧下降。而处理组娃娃菜贮藏结束时叶片完整性高,仍可维持较好的外观品质。可见,与CK组相比,1 μL/L 1-MCP熏蒸处理对采后娃娃菜有较好的保鲜效果。
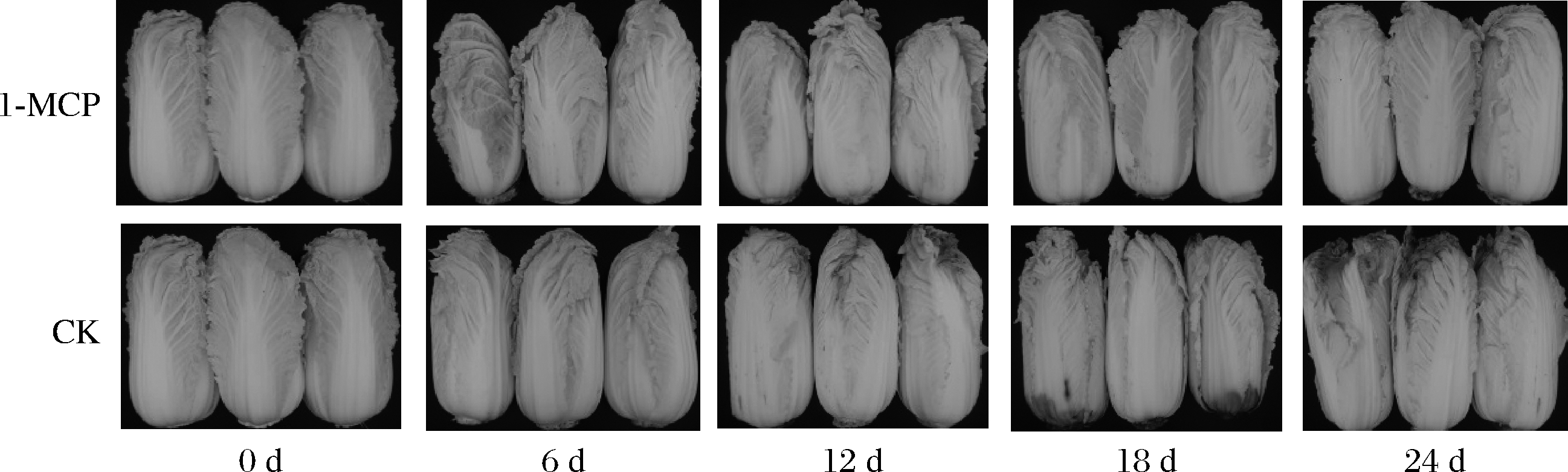
图1 1-MCP处理对娃娃菜外观品质的影响
Fig.1 Effect of 1-MCP on the appearance quality of baby cabbage
2.2 1-MCP对娃娃菜呼吸速率和乙烯释放速率的影响
蔬菜采后呼吸速率过高会加快其营养物质的损耗,适当降低呼吸速率,有助于延长蔬菜的贮藏期。由图2-A可看出,采后新鲜娃娃菜的呼吸速率较高,其0 d的呼吸速率高达46.40 mg CO2/(kg·h),这可能是导致常温下娃娃菜不耐贮的重要原因之一。贮藏至6 d时,处理组和CK组娃娃菜的呼吸速率均急剧下降至最小值,之后逐渐上升,但1-MCP处理组娃娃菜的呼吸速率在贮藏的第6、18和24 天均显著低于CK组,这表明1-MCP熏蒸处理对娃娃菜贮藏期间的呼吸速率有明显抑制作用。
乙烯是一种可诱导果蔬转色、成熟,并促进其衰老的激素。由图2-B可知,娃娃菜在贮藏过程中乙烯释放速率呈先升高再下降的趋势。在贮藏的第6天乙烯释放速率达到峰值,CK组娃娃菜乙烯释放速率是1-MCP处理组2.99倍,且在贮藏期间1-MCP处理组乙烯释放速率均显著低于对照组。可见,1-MCP处理可以减缓娃娃菜的衰老。

A-呼吸速率;B-乙烯释放速率
图2 1-MCP处理对娃娃菜呼吸速率和乙烯释放速率的影响
Fig.2 Effects of 1-MCP treatment on the respiratory rate and ethylene release rate of baby cabbage
注:*表示差异显著(P<0.05)(下同)
2.3 1-MCP对娃娃菜MDA含量的影响
由图3可知,CK组和1-MCP处理组娃娃菜的MDA含量均随贮藏时间的延长而上升。贮藏前期(0~6 d),2组娃娃菜MDA含量差异并不显著,但在贮藏的第12、18、24 天时,1-MCP处理组娃娃菜的MDA含量均显著低于CK组,且CK组娃娃菜的MDA含量分别是1-MCP处理组的1.35、1.34、1.22倍。这表明1-MCP处理可延缓娃娃菜组织内MDA积累,对其细胞膜的完整性有一定保护作用。
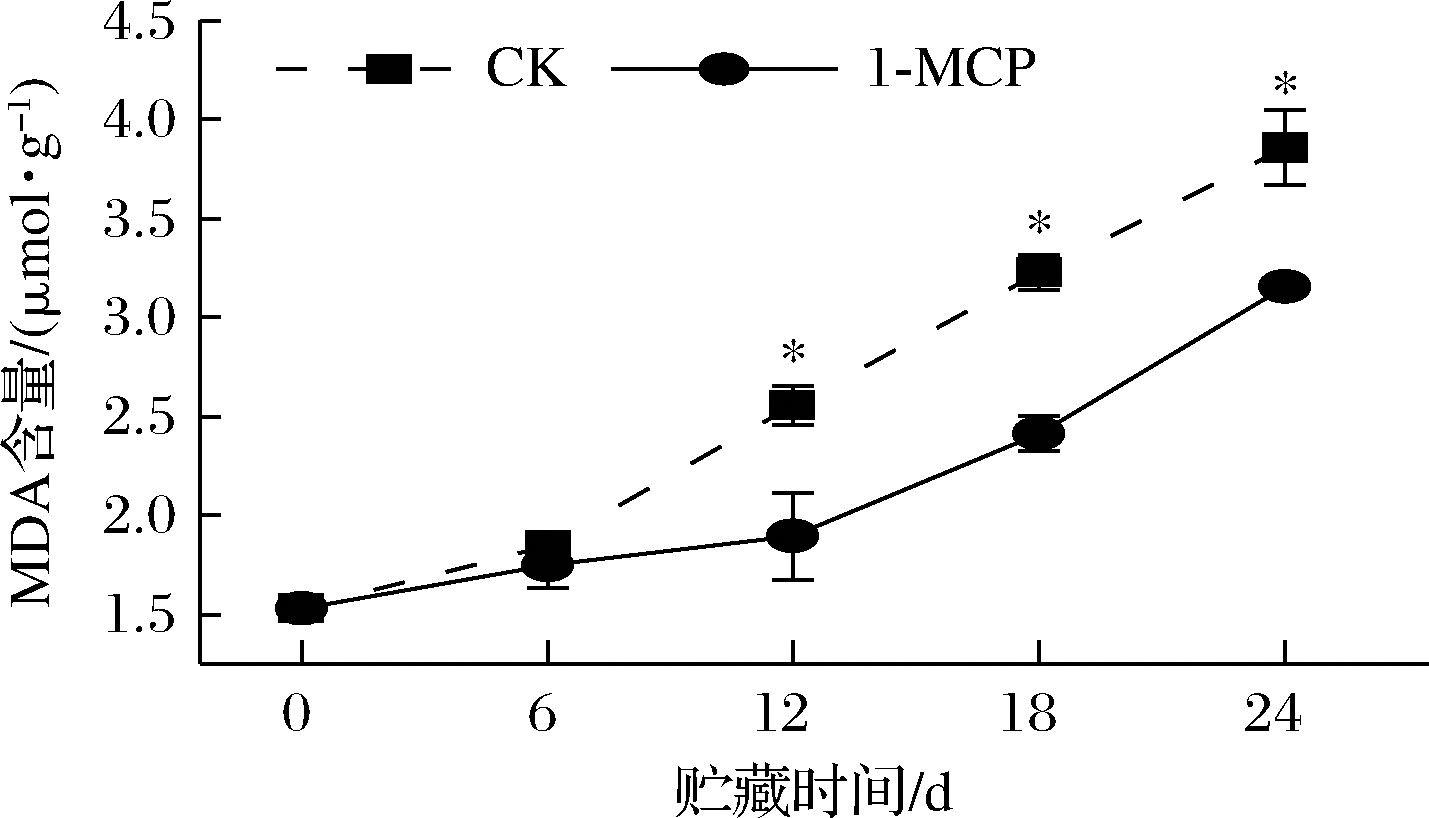
图3 1-MCP处理对娃娃菜MDA含量的影响
Fig.3 Effect of 1-MCP treatment on MDA content of baby cabbage
2.4 1-MCP对娃娃菜可溶性糖和可溶性蛋白含量的影响
如图4-A所示,采后娃娃菜在贮藏过程中,其可溶性糖和蛋白含量均随着贮藏时间的增加而逐渐下降。贮藏初期(0~6 d),CK组的可溶性糖含量与处理组无显著性差异;在贮藏的第24天时,CK组与1-MCP处理组娃娃菜的可溶性糖含量分别为7.59 mg/g和12.16 mg/g,与0 d相比分别下降了46.29%和66.48%,差异性显著。图4-B显示,在贮藏初期(0~6 d),2组处理娃娃菜的可溶性蛋白含量均出现显著下降的趋势。在贮藏期间,1-MCP处理组娃娃菜的可溶性蛋白含量显著高于CK组,在贮藏的第24 天,处理组可溶性蛋白含量是CK组的1.14倍。由此可见,1 μL/L 1-MCP处理能有效减缓娃娃菜贮藏过程中可溶性糖和可溶性蛋白含量的降解。
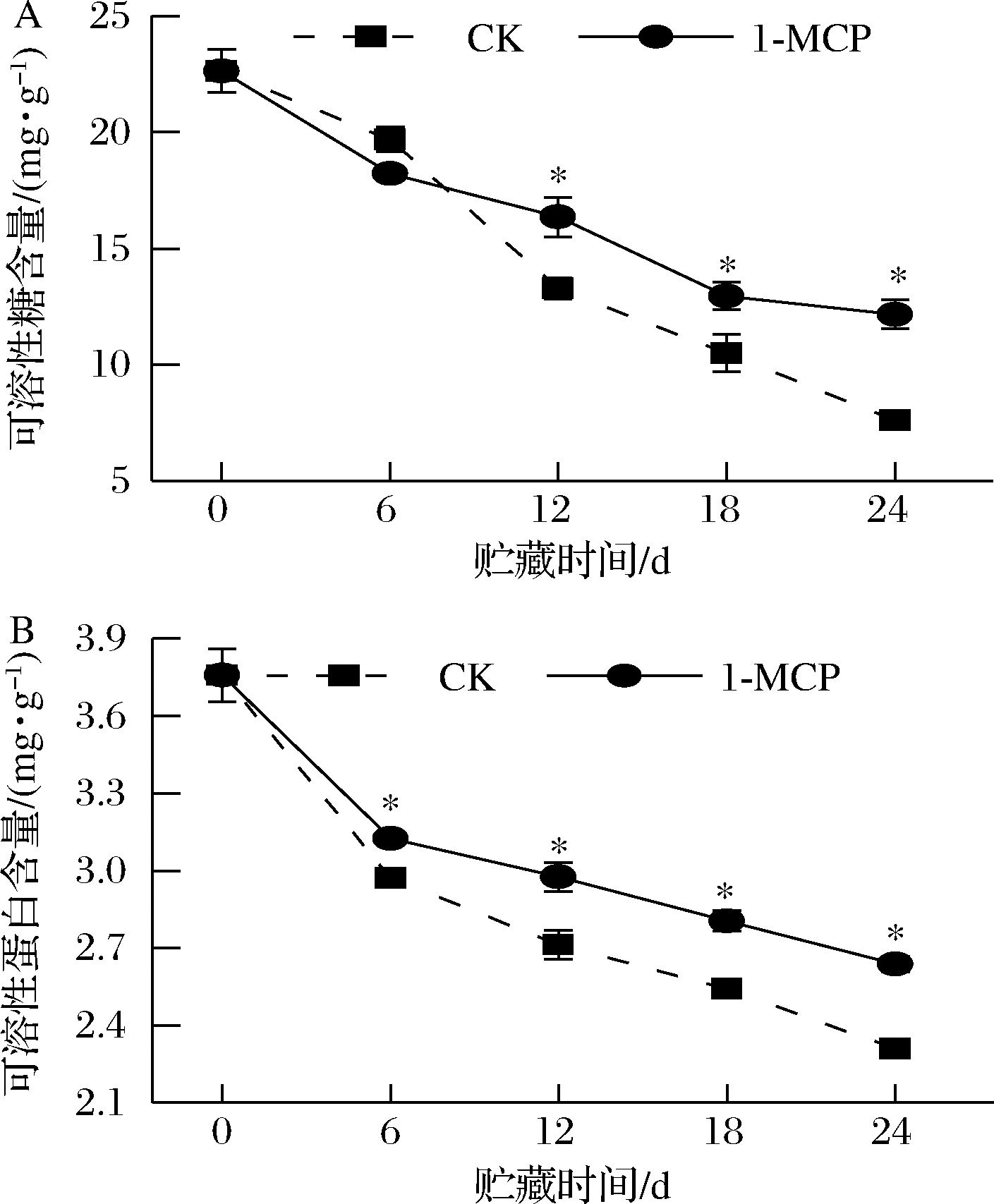
A-可溶性糖;B-可溶性蛋白
图4 1-MCP处理对娃娃菜可溶性糖和可溶性蛋白 含量的影响
Fig.4 Effects of 1-MCP treatment on the soluble sugar and protein contents of baby cabbage
2.5 1-MCP对娃娃菜活性物质含量的影响
硫代葡萄糖苷是十字花科蔬菜特有的活性成分。由图5-A可知,1-MCP处理有效抑制了娃娃菜总硫代葡萄糖苷的降解。贮藏至24 d时,CK组娃娃菜的总硫苷含量从1.88 mg/g降到0.70 mg/g,保留率仅为37.23%,1-MCP处理组总硫苷含量由1.88 mg/g降至0.94 mg/g,保留率为50.00%。这表明,1-MCP处理有利于娃娃菜总硫代葡萄糖苷在贮藏过程中的保留,提高贮藏效果。
果蔬组织中酚类物质的含量可反映其抗氧化能力的强弱。由图5-B可看出,娃娃菜在贮藏期间总酚含量呈先上升后下降趋势,上升的原因可能是膜脂过氧化引起了酚类物质的合成。贮藏中前期(0~12 d),1-MCP处理和CK组娃娃菜的总酚含量均不断增加,在第12天出现高峰,分别为354.46 μg/g和309.35 μg/g。贮藏中后期(12~24 d)总酚含量开始下降,但1-MCP处理组娃娃菜的总酚含量高于CK,例如,在贮藏第12、18和24天,其总酚含量分别是CK组的1.15、1.16、1.14倍。可见,1-MCP处理可抑制娃娃菜总酚含量的下降。
类胡萝卜素具有较强的抗氧化活性,是脂溶性抗氧化剂的良好来源。图5-C结果显示,1-MCP处理有效减缓了娃娃菜组织中类胡萝卜素含量的下降。例如,在贮藏第12、18、24天时,类胡萝卜素的含量分别是CK组的1.38、1.33、1.75倍。可见,1-MCP处理可以维持娃娃菜组织较高的类胡萝卜素含量。
如图5-D所示,随着贮藏时间的延长,娃娃菜组织中抗坏血酸含量不断下降。而与CK相比,1 μL/L 1-MCP处理可有效降低娃娃菜中抗坏血酸的损失。例如,贮藏的第6、12、18、24天,1-MCP组娃娃菜的抗坏血酸含量分别为66.58、59.13、52.47、51.37 mg/100g,分别比CK组高4.94、5.07、6.02、9.66 mg/100g。因此,1-MCP处理能显著抑制娃娃菜中抗坏血酸含量的降解,保持良好的营养品质。
娃娃菜在采后贮藏过程中萝卜硫素含量的变化趋势与抗坏血酸含量变化趋势相似(图5-E)。贮藏初期(0~6 d),1-MCP与CK组娃娃菜的萝卜硫素含量急剧下降,分别从0 d的54.15 μg/g降至第6天的37.71 μg/g 和29.14 μg/g,其保留率分别为69.64%和53.81%。之后萝卜硫素含量持续下降,贮藏至12、18和24 d时,1-MCP组娃娃菜的萝卜硫素含量显著高于CK组,在贮藏的第24天,1-MCP组娃娃菜的萝卜硫素含量是CK组的1.34倍。由此可见,1-MCP处理可有效维持采后娃娃菜贮藏期间萝卜硫素的含量。

A-总硫代葡萄糖苷;B-总酚;C-类胡萝卜素;D-抗坏血酸;E-萝卜硫素
图5 1-MCP处理对娃娃菜总硫代葡萄糖苷、总酚、类胡萝卜素、抗坏血酸和萝卜硫素含量的影响
Fig.5 Effects of 1-MCP treatment on the contents of total glucosinolates, total phenol, carotenoid, ascorbic acid and sulforaphane of baby cabbage
2.6 1-MCP对娃娃菜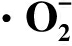 生成率和H2O2含量的影响
生成率和H2O2含量的影响
娃娃菜组织内![]() 生成率在贮藏期间呈上升趋势(图6-A)。在贮藏的6、12、18和24 d,CK组
生成率在贮藏期间呈上升趋势(图6-A)。在贮藏的6、12、18和24 d,CK组![]() 生成率分别为1.89、2.15、2.27、2.84 μmol/(min·g),分别是1-MCP组的1.11、1.21、1.28、1.20倍。且除贮藏第6天外,2组娃娃菜
生成率分别为1.89、2.15、2.27、2.84 μmol/(min·g),分别是1-MCP组的1.11、1.21、1.28、1.20倍。且除贮藏第6天外,2组娃娃菜![]() 生成率均表现出显著性差异。可见,1-MCP处理能有效减缓娃娃菜贮藏过程中
生成率均表现出显著性差异。可见,1-MCP处理能有效减缓娃娃菜贮藏过程中![]() 的生成率。
的生成率。
如图6-B所示,随着贮藏时间的延长,娃娃菜组织内H2O2逐渐积累,1-MCP和CK组娃娃菜的H2O2含量在贮藏第18天时达到峰值,其含量分别为9.73 μmol/g和10.67 μmol/g。贮藏后期(18~24 d),娃娃菜的H2O2含量开始下降,至贮藏结束时,1-MCP组则降至7.54 μmol/g,而CK组H2O2含量降至8.50 μmol/g,是1-MCP组的1.13倍。可见,1-MCP处理对娃娃菜组织中H2O2含量的累积有明显抑制作用。

![]() 生成率;B-H2O2含量
生成率;B-H2O2含量
图6 1-MCP处理对娃娃菜![]() 生成率和H2O2含量的影响
生成率和H2O2含量的影响
Fig.6 Effects of 1-MCP treatment on the generation rate of ![]() and H2O2 content of baby cabbage
and H2O2 content of baby cabbage
2.7 1-MCP对娃娃菜抗氧化能力的影响
娃娃菜采后在贮藏期间,DPPH自由基清除率总体呈下降趋势,但1-MCP组的下降幅度比CK组小(图7-A)。贮藏至第6、12天时,CK组和1-MCP组娃娃菜的DPPH自由基清除率无显著性差异。至第18、24天时,1-MCP组的DPPH自由基清除率分别为79.96%和77.81%,分别比CK组提高10.47%和12.76%。
如图7-B所示,娃娃菜在贮藏中前期(0~12 d)·OH清除率大幅度下降,之后降幅有所减小。贮藏至第6天,1-MCP和CK组娃娃菜·OH清除率从0 d的26.75%分别降至22.89%和22.94%。在贮藏的6~24 d,1-MCP处理组娃娃菜·OH清除率高于CK组,其中在贮藏的第12、18、24天,1-MCP处理组的·OH清除率分别比CK组提高5.22%、8.33%和5.77%。
如图7-C所示,娃娃菜的![]() 清除率呈先上升后下降趋势,除在贮藏第6天外,1-MCP处理组娃娃菜的
清除率呈先上升后下降趋势,除在贮藏第6天外,1-MCP处理组娃娃菜的![]() 清除率均显著高于CK组。在贮藏的第24天,1-MCP处理组娃娃菜
清除率均显著高于CK组。在贮藏的第24天,1-MCP处理组娃娃菜![]() 清除率是CK组的1.65倍。这表明,1-MCP处理可提高采后娃娃菜
清除率是CK组的1.65倍。这表明,1-MCP处理可提高采后娃娃菜![]() 清除能力。
清除能力。
贮藏期间娃娃菜组织中总还原力呈先上升后下降再上升的趋势(图7-D)。在贮藏的第6、12天,1-MCP 和CK组总还原力分别为0.80、0.77和0.78、0.73。贮藏中后期(12~24 d),娃娃菜组织内总还原力不断增加,贮藏至18、24 d时,1-MCP处理组娃娃菜的总还原力分别为0.88和0.95,分别是CK组的1.09倍和1.17倍。可见,采用1 μL/L 1-MCP处理娃娃菜可维持其组织较高的总还原力。

A-DPPH自由基清除率;B-·OH清除率;![]() 清除率;D-总还原力
清除率;D-总还原力
图7 1-MCP处理对娃娃菜DPPH自由基![]() 清除能力和总还原力的影响
清除能力和总还原力的影响
Fig.7 Effects of 1-MCP treatment on the scavenging ability of DPPH radical, ·OH, ![]() and total reducing power of baby cabbage
and total reducing power of baby cabbage
2.8 1-MCP对娃娃菜抗氧化酶活性的影响
如图8-A所示,贮藏期间,CK组娃娃菜的CAT活性不断下降,而1-MCP组娃娃菜的CAT活性呈先上升后下降的趋势,在贮藏的第6、18天,1-MCP组娃娃菜CAT活性为143.67 U/g和53.75 U/g,分别是CK组的1.34倍和1.38倍。可见,1-MCP处理可以维持娃娃菜较高的CAT活性。
娃娃菜在贮藏期间POD活性呈先上升后下降趋势(图8-B)。贮藏至第6天时CK组娃娃菜的POD活性出现峰值,其酶活性为1 331.27 U/g,而1-MCP组POD活性在贮藏中前期(0~12 d)持续增加并在第12天达到峰值,其酶活性高达1 528.33 U/g,极显著高于CK组的1 021.25 U/g。贮藏至18、24 d时,1-MCP组娃娃菜酶活性降至1 264.03 U/g和1 233.90 U/g,分别是CK组的1.31倍和1.30倍。由此可见,1-MCP处理显著提高了娃娃菜组织POD活性。
随着贮藏时间的延长,娃娃菜组织内SOD活性呈逐渐下降的趋势(图8-C)。除在贮藏第6天外,1-MCP处理组娃娃菜的SOD活性均显著高于CK组,在贮藏的第12、18、24天,其SOD活性为0.42、0.40、0.36 U/g,分别是CK组的1.08、1.08、1.09倍。可见,1-MCP处理显著提高了采后娃娃菜组织内SOD活性。
APX是娃娃菜抵御活性氧代谢的抗氧化酶。由图8-D可知,贮藏过程中APX活性变化趋势与POD相似。贮藏初期(0~6 d),APX酶活性逐渐升高,在贮藏第6天达到高峰,1-MCP组娃娃菜的APX酶活性为525.00 U/g,显著高于CK组的423.00 U/g。之后APX酶活性急剧下降,贮藏的第12、24天,1-MCP组APX酶活性分别为404.83和254.33 U/g,分别比CK组高92.33 U/g和53.66 U/g。可见,1-MCP处理能够维持娃娃菜组织较高的APX活性,从而提高娃娃菜在贮藏期间对氧化胁迫的耐受能力。
如图8-E所示,娃娃菜在贮藏过程中组织内GR活性处于波动变化趋势。在贮藏后期(18~24 d),1-MCP组娃娃菜的GR活性极显著高于CK。例如,第18、24天,1-MCP组GR活性分别为174.75 U/g和152.25 U/g,分别是CK组的1.16倍和1.19倍。这表明,1-MCP处理可维持娃娃菜组织较高的GR活性。
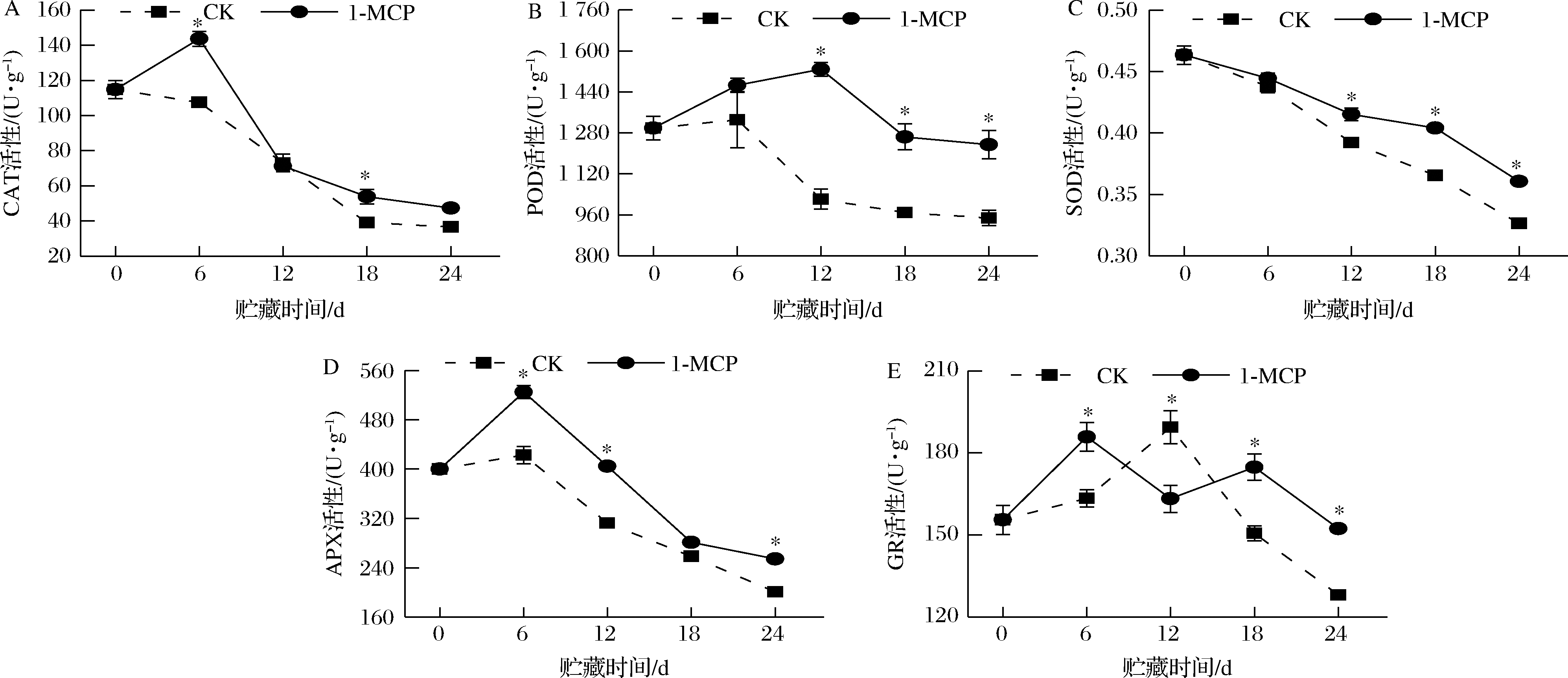
A-CAT;B-POD;C-SOD;D-APX;E-GR
图8 1-MCP处理对娃娃菜CAT、POD、SOD、APX和GR活性的影响
Fig.8 Effects of 1-MCP treatment on CAT, POD, SOD, APX and GR activities of baby cabbage
2.9 相关性分析
对娃娃菜贮藏期间的21个品质、生理指标进行相关性分析,结果以热图矩阵显示。由图9可看出,可溶性糖、可溶性蛋白与总硫苷含量、抗氧化物质(类胡萝卜素、抗坏血酸和萝卜硫素)含量、H2O2含量![]() 生成率、抗氧化能力(DPPH自由基、·OH和总还原力)及CAT、SOD活性均具有显著相关性,三者间的相关性达到极显著水平。
生成率、抗氧化能力(DPPH自由基、·OH和总还原力)及CAT、SOD活性均具有显著相关性,三者间的相关性达到极显著水平。![]() 生成率除与呼吸速率、乙烯释放速率、总酚含量、H2O2含量
生成率除与呼吸速率、乙烯释放速率、总酚含量、H2O2含量![]() 清除率、总还原力和GR活性不存在相关性外,与其他各项指标均有显著相关性。总酚含量除与乙烯释放速率具有相关性,还与POD和GR活性显著相关,相关系数分别是0.71和0.69。H2O2含量与·OH清除率、CAT及APX活性呈显著负相关,相关系数分别为-0.74、-0.71、-0.68。MDA含量、DPPH自由基和·OH清除率与四大抗氧化酶(POD、CAT、SOD和APX)活性呈极显著正相关,且三者之间也存在极显著相关性,它们与抗氧化酶活性的正相关关系说明了娃娃菜贮藏过程中抗氧化酶活性的高低是影响其抗氧化能力,维持贮藏品质的重要因素。五大抗氧化酶中,SOD和APX活性不仅与POD和CAT活性显著相关,还与多项指标具有相关性,而GR活性只与总酚含量正相关。综合相关性分析结果来看,1-MCP处理能够维持采后娃娃菜良好的外观品质与其组织内保持较高的抗氧化能力密切相关,贮藏期间其抗氧化能力与活性氧代谢水平是由抗氧化酶和非酶类抗氧化物质共同决定。
清除率、总还原力和GR活性不存在相关性外,与其他各项指标均有显著相关性。总酚含量除与乙烯释放速率具有相关性,还与POD和GR活性显著相关,相关系数分别是0.71和0.69。H2O2含量与·OH清除率、CAT及APX活性呈显著负相关,相关系数分别为-0.74、-0.71、-0.68。MDA含量、DPPH自由基和·OH清除率与四大抗氧化酶(POD、CAT、SOD和APX)活性呈极显著正相关,且三者之间也存在极显著相关性,它们与抗氧化酶活性的正相关关系说明了娃娃菜贮藏过程中抗氧化酶活性的高低是影响其抗氧化能力,维持贮藏品质的重要因素。五大抗氧化酶中,SOD和APX活性不仅与POD和CAT活性显著相关,还与多项指标具有相关性,而GR活性只与总酚含量正相关。综合相关性分析结果来看,1-MCP处理能够维持采后娃娃菜良好的外观品质与其组织内保持较高的抗氧化能力密切相关,贮藏期间其抗氧化能力与活性氧代谢水平是由抗氧化酶和非酶类抗氧化物质共同决定。

图9 娃娃菜品质与生理生化指标的相关性
Fig.9 Correlation analysis between quality and physiological and biochemical indexes of baby cabbage
注:*代表差异显著(P<0.05);**代表差异极显著(P<0.01)
3 讨论
呼吸速率和乙烯释放速率是影响果蔬衰老的重要因素,呼吸作用过强会导致其品质下降,乙烯的产生会加快果蔬的衰老进程。1-MCP可特异性结合乙烯受体,进而抑制果蔬后熟相关的品质及生理变化。其中可溶性糖和蛋白是果蔬重要的品质指标,也是绝大多数蔬菜主要的底物和能量供给物质。汪俏梅等[25]研究发现,1-MCP对青花菜的呼吸速率和乙烯释放速率有明显抑制作用,并能提高可溶性蛋白含量。本研究结果显示,娃娃菜刚采摘后(0 d)受机械伤、环境温度改变等因素的影响,使其呼吸速率达到最高值,随后呈直线下降的趋势,贮藏6 d后呈持续上升的趋势,可见,娃娃菜属于典型的呼吸后期上升型蔬菜。而乙烯释放速率在第6天达到高峰,随后逐渐下降。娃娃菜的可溶性糖和蛋白含量随着呼吸速率的增强和乙烯的产生,呈逐渐下降的趋势。而经过1-MCP处理可以显著减缓娃娃菜呼吸速率的上升,抑制乙烯的产生,并维持较高的可溶性糖和蛋白含量,延缓其衰老进程。
植物体在代谢过程在中能够通过多种途径产生![]() 和·OH等活性氧,活性氧代谢失调是导致叶片衰老的重要因素。娃娃菜在采后贮藏的过程也是逐渐步入衰老的过程,贮藏初期为了适应环境胁迫,娃娃菜自身产生活性氧的能力增强,然而随着叶片的不断衰老,生理代谢出现紊乱使其清除活性氧能力下降。活性氧的大量积累会引发或加剧其膜脂过氧化作用,使细胞膜损伤,对娃娃菜组织造成不可逆的伤害,最终引起品质劣变[26]。本研究结果显示,娃娃菜在采后贮藏过程中MDA含量和
和·OH等活性氧,活性氧代谢失调是导致叶片衰老的重要因素。娃娃菜在采后贮藏的过程也是逐渐步入衰老的过程,贮藏初期为了适应环境胁迫,娃娃菜自身产生活性氧的能力增强,然而随着叶片的不断衰老,生理代谢出现紊乱使其清除活性氧能力下降。活性氧的大量积累会引发或加剧其膜脂过氧化作用,使细胞膜损伤,对娃娃菜组织造成不可逆的伤害,最终引起品质劣变[26]。本研究结果显示,娃娃菜在采后贮藏过程中MDA含量和![]() 生成率呈极显著正相关,均呈直线增加趋势,H2O2含量在贮藏前期也呈增加的趋势。使用1-MCP处理有效抑制了娃娃菜机体内
生成率呈极显著正相关,均呈直线增加趋势,H2O2含量在贮藏前期也呈增加的趋势。使用1-MCP处理有效抑制了娃娃菜机体内![]() 和H2O2的累积。这与1-MCP处理油菜可以抑制MDA含量的积累,减轻活性氧代谢对组织的损伤,起到良好保鲜效果的研究结果一致[27]。
和H2O2的累积。这与1-MCP处理油菜可以抑制MDA含量的积累,减轻活性氧代谢对组织的损伤,起到良好保鲜效果的研究结果一致[27]。
及时清除娃娃菜的活性氧是维持其采后正常代谢的重要一环,也是减缓娃娃菜衰老,延长其保鲜期的关键。植物体内活性氧的清除是由非酶促清除系统和酶促清除系统来完成的。非酶促清除系统主要是指植物体内含有的活性物质对活性氧的清除,如硫代葡萄糖苷、萝卜硫素、类胡萝卜素、抗化血酸和总酚等。在本研究中,萝卜硫素、类胡萝卜素和抗坏血酸均与![]() 生成率呈极显著负相关,硫代葡萄糖苷与
生成率呈极显著负相关,硫代葡萄糖苷与![]() 生成率、H2O2含量呈显著负相关,说明这些活性物质的含量影响着娃娃菜组织活性氧的清除能力,经1-MCP处理使得娃娃菜组织中硫代葡萄糖苷、萝卜硫素、类胡萝卜素、抗坏血酸和总酚等活性物质的含量显著提高,从而直接清除娃娃菜在贮藏过程中产生的活性氧,延缓其衰老进程。类似的研究也指出,1-MCP处理可以减缓牛心甘蓝中总硫代葡萄糖苷、萝卜硫素和抗坏血酸等活性成分含量的下降,维持机体较高的抗氧化能力[28]。
生成率、H2O2含量呈显著负相关,说明这些活性物质的含量影响着娃娃菜组织活性氧的清除能力,经1-MCP处理使得娃娃菜组织中硫代葡萄糖苷、萝卜硫素、类胡萝卜素、抗坏血酸和总酚等活性物质的含量显著提高,从而直接清除娃娃菜在贮藏过程中产生的活性氧,延缓其衰老进程。类似的研究也指出,1-MCP处理可以减缓牛心甘蓝中总硫代葡萄糖苷、萝卜硫素和抗坏血酸等活性成分含量的下降,维持机体较高的抗氧化能力[28]。
酶促清除系统对活性氧的清除主要依靠植物自身的保护酶系统实现,如SOD、CAT、POD、APX和GR等。SOD是抑制氧自由基对植物细胞造成损伤的主要活性氧清除酶系;CAT是植物体内重要的内源性活性氧清除剂,可有效清除自由基,催化H2O2生成水,并减少·OH的形成;而POD是植物体中活性较高的氧化还原酶,能够催化H2O2、氧化酚类和胺类化合物[27];此外,APX和GR也能够参与活性氧清除系统,在清除植物体内活性氧自由基中表现为协同作用。娃娃菜在贮藏期间叶片衰老产生活性氧的同时会激活自身细胞内抗氧化酶的活性将其清除。在本研究中,四大抗氧化酶(POD、CAT、SOD和APX)的活性与DPPH自由基、·OH清除率呈极显著正相关,说明提高娃娃菜的抗氧化酶活性,其自由基清除能力也得以提升。随着贮藏时间的延长,娃娃菜中的抗氧化酶活性呈下降的趋势,但经1-MCP处理的娃娃菜SOD、CAT、POD、APX和GR活性均显著提高,使得组织内DPPH自由基![]() 清除能力及总还原力也得以提升,并维持了较高的抗氧化能力。史君彦等[29]和史萌等[30]的研究也证实了1-MCP处理可以增强抗氧化酶活性,减轻贮藏期间油菜和韭菜中活性氧代谢对组织造成的损伤。
清除能力及总还原力也得以提升,并维持了较高的抗氧化能力。史君彦等[29]和史萌等[30]的研究也证实了1-MCP处理可以增强抗氧化酶活性,减轻贮藏期间油菜和韭菜中活性氧代谢对组织造成的损伤。
4 结论
在(20±1) ℃条件下,1 μL/L 1-MCP熏蒸处理显著降低了娃娃菜采后呼吸速率和乙烯释放速率,抑制其MDA和H2O2的积累,保护了细胞膜的完整性,从而延缓叶片的衰老腐败。此外,1-MCP处理减缓了娃娃菜组织内可溶性糖和可溶性蛋白含量的下降,维持了较高的总硫代葡萄糖苷、总酚、抗坏血酸、类胡萝卜素和萝卜硫素等活性物质的含量,同时提高了抗氧化酶(SOD、CAT、POD、APX和GR)的活性及自由基(DPPH自由基![]() 和·OH)清除能力,并维持较高的抗氧化能力,从而减少了活性氧对娃娃菜组织造成的氧化伤害作用,延长娃娃菜的贮藏期。
和·OH)清除能力,并维持较高的抗氧化能力,从而减少了活性氧对娃娃菜组织造成的氧化伤害作用,延长娃娃菜的贮藏期。
[1] 湛长菊. 娃娃菜的特征特性及高产栽培技术[J].现代农业科技, 2008(19):63-65.
ZHAN C J.The characteristics and high yield cultivation techniques of baby cabbage[J].Modern Agricultural Science and Technology, 2008(19):63-65.
[2] 周秋阳, 赵利, 濮杨, 等.高O2结合高CO2气调包装对绿芦笋抗氧化活性的影响[J].食品科技, 2016, 41(5):18-23.
ZHOU Q Y, ZHAO L, PU Y, et al.Effect of high oxygen modified atmosphere packaging combined with high carbon dioxide on antioxidant activity in green asparagus[J].Food Science and Technology, 2016, 41(5):18-23.
[3] 王丽娇, 牟其云, 李文香, 等.微真空条件对西兰花叶绿素降解与内源抗氧化性的影响[J].食品科学, 2013, 34(20):312-317.
WANG L J, MU Q Y, LI W X, et al.Effect of micro-vacuum conditions on broccoli chlorophyll degradation and endogenous oxidation resistance[J].Food Science, 2013, 34(20):312-317.
[4] SISLER E C, SEREK M.Compounds controlling the ethylene receptor[J].Botanical Bulletin-Academia Sinica Taipei, 1999, 40(1):1-7.
[5] 张鲁斌, 贾志伟, 谷会, 等.低温贮藏对货架期菠萝黑心病发生和果实品质维持的影响[J].果树学报, 2013, 30(4):675-680:728.
ZHANG L B, JIA Z W, GU H, et al.Effect of low temperature storage on pineapple blackheart and fruit quality during shelf-life[J].Journal of Fruit Science, 2013, 30(4):675-680;728.
[6] 杜传来, 高会.1-MCP对几种叶菜保鲜效果的影响[J].食品与机械, 2010, 26(3):57-61.
DU C L, GAO H.Effect on fresh-keeping of leaf vegetables by 1-MCP[J].Food & Machinery, 2010, 26(3):57-61.
[7] 王剑功, 李江阔, 张鹏, 等.不同浓度1-甲基环丙烯处理对油菜保鲜效果的影响[J].食品科技, 2016, 41(3):40-45.
WANG J G, LI J K, ZHANG P, et al.Different concentrations of 1-MCP treatment on preservation of rapeseed[J].Food Science and Technology, 2016, 41(3):40-45.
[8] MENG J, ZHOU Q, ZHOU X, et al.Ethylene and 1-MCP treatments affect leaf abscission and associated metabolism of Chinese cabbage[J].Postharvest Biology and Technology, 2019, 157:110963.
[9] PORTER K L, COLLINS G, KLIEBER A.1-MCP does not improve the shelf-life of Chinese cabbage[J].Journal of the Science of Food and Agriculture, 2005, 85(2):293-296.
[10] 王瑶, 罗淑芬, 胡花丽, 等.外源NO处理对采后鲜莲子品质及乙烯代谢的影响[J].现代食品科技, 2019, 35(11):100-108.
WANG Y, LUO S F, HU H L, et al.Effects of exogenous NO treatment on the postharvest quality and ethylene metabolism of fresh Lotus seeds[J].Modern Food Science and Technology, 2019, 35(11):100-108.
[11] 高建晓, 王毓宁, 李鹏霞, 等.漆蜡涂膜对鲜莲蓬采后褐变的影响[J].食品科学, 2016, 37(18):275-282.
GAO J X, WANG Y N, LI P X, et al.Effects of lacquer wax coating on postharvest browning of fresh lotus pods[J].Food Science, 2016, 37(18):275-282.
[12] 王学奎. 植物生理生化实验原理与技术[M].北京:高等教育出版社, 2010.
WANG X K.Principles and Techniques of Plant Physiological Biochemical Experiment[M].Beijing:Higher Education Press, 2010.
[13] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1-2):248-254.
[14] 王淑雯. 芥菜芽苗中异硫氰酸酯富集调控技术及其咀嚼片开发[D].扬州:扬州大学, 2017.
WANG S W.Regulation of isothiocyanate enrichment in mustard sprout and development of chewing tablets[D].Yangzhou:Yangzhou University, 2017.
[15] GHASEMNEZHAD M, SHERAFATI M, PAYVAST G A.Variation in phenolic compounds, ascorbic acid and antioxidant activity of five coloured bell pepper (Capsicum annum) fruits at two different harvest times[J].Journal of Functional Foods, 2011, 3(1):44-49.
[16] 史君彦, 高丽朴, 左进华, 等.纳米膜和PVC膜包装对西兰花贮藏保鲜的影响[J].食品工业科技, 2016, 37(19):255-258;266.
SHI J Y, GAO L P, ZUO J H, et al.Effect of nanofilm and PVC film packaging on preservation of broccoli during the storage[J].Science and Technology of Food Industry, 2016, 37(19):255-258;266.
[17] GUO L P, YANG R Q, WANG Z Y, et al.Glucoraphanin, sulforaphane and myrosinase activity in germinating Broccoli sprouts as affected by growth temperature and plant organs[J].Journal of Functional Foods, 2014,9:70-77.
[18] JIANG T J, JAHANGIR M M, JIANG Z H, et al.Influence of UV-C treatment on antioxidant capacity, antioxidant enzyme activity and texture of postharvest shiitake (Lentinus edodes) mushrooms during storage[J].Postharvest Biology and Technology, 2010, 56(3):209-215.
[19] 谭钺, 王茂生, 吕勐, 等.不同破眠处理对油桃休眠芽H2O2含量及相关酶活性的影响[J].中国农学通报, 2014, 30(28):128-132.
TAN Y, WANG M S, LYU M, et al.Effects of different dormancy-breaking treatments on H2O2 content and activity of related enzymes of dormant nectarine buds[J].Chinese Agricultural Science Bulletin, 2014, 30(28):128-132.
[20] DONG T T, SHI J Y, JIANG C Z, et al.A short-term carbon dioxide treatment inhibits the browning of fresh-cut burdock[J].Postharvest Biology and Technology, 2015, 110:96-102.
[21] 罗淑芬, 胡花丽, 周宏胜, 等.不同温度条件下薄膜包装对西兰花采后品质的影响[J].江苏农业学报, 2019, 35(2):420-428.
LUO S F, HU H L, ZHOU H S, et al.Effects of packaging films on postharvest quality of broccoli at different temperatures[J].Jiangsu Journal of Agricultural Sciences, 2019, 35(2):420-428.
[22] SOONG Y Y, BARLOW P J.Antioxidant activity and phenolic content of selected fruit seeds[J].Food Chemistry, 2004, 88(3):411-417.
[23] MOHAMED S A, AWAD M A, AL-QURASHI A D.Antioxidant activity, antioxidant compounds, antioxidant and hydrolytic enzymes activities of ‘Barhee’ dates at harvest and during storage as affected by pre-harvest spray of some growth regulators[J].Scientia Horticulturae, 2014, 167:91-99.
[24] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007:125-127.
CAO J K, JIANG W B, ZHAO Y M.Experiment Guidance of Postharvest Physiology and Biochemistry of Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007:125-127.
[25] 汪俏梅, 郭得平, KYIKYI W, 等.1-甲基环丙烯延缓青花菜衰老的效应及机理[J].园艺学报, 2004,31(2):205-209.
WANG Q M, GUO D P, KYIKYI W, et al.Effect of 1-MCP on delaying the senescence of broccoli and its possible physiological mechanism[J].Acta Horticulturae Sinica, 2004,31(2):205-209.
[26] 王宝山. 生物自由基与植物膜伤害[J].植物生理学通讯, 1988,24(2):12-16.
WANG B S.Biological free radicals and membrane damage of plants[J].Plant Physiology Communications, 1988,24(2):12-16.
[27] AGHDAM M S, BODBODAK S.Physiological and biochemical mechanisms regulating chilling tolerance in fruits and vegetables under postharvest salicylates and jasmonates treatments[J].Scientia Horticulturae, 2013, 156:73-85.
[28] 胡花丽, 赵欢欢, 罗淑芬, 等.多变量统计分析评价1-甲基环丙烯对牛心甘蓝贮藏特性的影响[J].食品发酵与工业,2020, 46(16):208-214.
HU H L, ZHAO H H, LUO S F, et al.Evaluation the effect of 1-methylcyclopropene on storage characteristic of heart-shaped cabbage based on multivariate statistical analysis[J].Food and Fermentation Industries, 2020, 46(16):208-214.
[29] 史君彦, 王清, 高丽朴, 等.1-MCP处理对油菜贮藏品质影响的研究[J].食品研究与开发, 2017, 38(23):188-192.
SHI J Y, WANG Q, GAO L P, et al.Effect of 1-MCP treatment on storage quality of pak choy[J].Food Research and Development, 2017, 38(23):188-192.
[30] 史萌, 郑秋丽, 高丽朴, 等.1-MCP处理对韭菜采后贮藏生理和品质的影响[J].保鲜与加工, 2019, 19(3):58-63.
SHI M, ZHENG Q L, GAO L P, et al.Effects of 1-MCP treatment on storage physiology and quality of postharvest Chinese chive[J].Storage and Process, 2019, 19(3):58-63.