紫苏又称白苏、苏麻、野苏、黑苏等,学名紫苏子,种植区域广泛,具备独特的香味,是一种一年生的药食两用植物。刘大川等[1]的研究显示,紫苏籽粕中的蛋白质含量多达40%,是一种高蛋白原料,紫苏籽粕中含有多种氨基酸(尤其是赖氨酸、蛋氨酸含量很高)、此外紫苏还有一种独特的香味,是一种非常优质且安全的用于提取蛋白质的植物原料。
目前大量研究证实生物体并不是全部将蛋白质全部降解为单个氨基酸然后再吸收利用,部分蛋白质是以被机体分解为小肽的形式吸收的,而且小肽吸收难度相对较低,比氨基酸吸收的效果更好[2],目前,国内外对于紫苏粕的研究主要集中在蛋白、多糖以及黄酮类的提取方法与提取工艺优化方面[3-11],混菌发酵紫苏粕提高其加工品质的同时,也产生了部分紫苏小肽, 课题组对比了混菌发酵与未发酵的紫苏粕小肽含量,发现混菌发酵后的紫苏粕中小肽含量提高了26.40%[12];发酵前后紫苏粕中小肽提取及其抗氧化活性的研究未见有报道。为进一步获得混菌发酵紫苏粕小肽的提取工艺与混菌发酵紫苏粕小肽的抗氧化特性,试验采用单因素与正交试验研究酶解pH、温度、时间与底物浓度对发酵紫苏籽粕中小肽得率的影响,并以DPPH自由基清除率、羟自由基(·OH)清除率和还原力为指标对发酵前后紫苏小肽的体外抗氧化能力进行评价,研究混菌发酵对紫苏小肽抗氧化性的影响。
1 材料与方法
1.1 材料与试剂
紫苏籽,洮南市百群食品有限公司;牛肉膏、蛋白胨(生物试剂),天津市北辰方正试剂厂;凝结芽孢杆菌(Bacilluscoagulans),粮油食品深加工重点实验室保存菌种;乳酸克鲁维酵母菌(Kluyveromyceslactis,ATCC-12426),北京北纳创联生物技术研究院;硫酸亚铁(分析纯),天津市光复科技发展有限公司;过氧化氢(分析纯),开原化学试剂一厂;磷酸二氢钠(分析纯),北京化学试剂有限公司;碱性蛋白酶(200 U/mg),上海源叶生物科技有限公司。
1.2 材料与试剂
KQ-800KDE高功率数控超声波仪,昆山市超声仪器有限公司;SHZ-D(Ⅲ)型循环水真空泵,郑州市亚荣仪器有限公司;TDL-5-A离心机,上海博讯实业有限公司医疗设备厂;TS2231020高压灭菌锅,上海东亚压力容器制造有限公司;4A220-50-06超临界萃取装置,江苏南通市华安超临界萃取有限公司;AgilentCary60UV-Vis紫外-可见分光光度计,美国安捷伦科技公司。
1.3 实验方法
1.3.1 菌种活化
取1%的乳酸克鲁维酵母悬液放入50 mL MRS培养基中,摇匀,放于30 ℃,65 r/min的恒温水浴振荡器中培养18 h,将其作为1代菌液。取微量凝结芽孢杆菌粉末于50 mL LB培养基中,摇匀后放于36 ℃,65 r/min恒温水浴振荡器中培养18 h,将其作为1代菌液。分别吸取1%的1代菌液于各自的培养基中,培养条件同上,作为2代菌液。
1.3.2 原料处理
紫苏籽经超临界CO2技术萃取,萃取条件为:萃取Ⅰ、分离Ⅰ、分离Ⅱ的温度分别设置为40、40、50 ℃,萃取Ⅰ压力为23.5~25.5 MPa、分离Ⅰ、分离Ⅱ、贮藏罐压力均在5 MPa左右,流量为20 L/h,萃取时间为5.5 h。萃取后的紫苏籽超微粉碎(74 μm)后放入高压蒸气灭菌锅中灭菌(121 ℃,20 min)。按照乳酸克鲁维酵母与凝结芽孢杆菌比例为1∶1,料水比为1∶2.5(g∶mL),接种量为12%,在33 ℃条件下混菌发酵2 d,用高压蒸气锅灭菌,冻干后得到发酵紫苏粕粉,冷藏备用。
1.3.3 紫苏粕小肽提取
1.3.3.1 紫苏小肽的提取
称取发酵紫苏粕5.0 g置于200 mL三角瓶中,加蒸馏水100 mL后密封,超声处理20 min,调节pH,加入5%(质量分数)的碱性蛋白酶(酶活200 U/mg),在温度为45 ℃的水浴振荡器中酶解210 min,灭酶15 min,真空抽滤,取滤液,再加入滤液2倍的无水乙醇沉淀12 h后,取沉淀倒入培养皿中,冻干备用[13]。以相同的方法在相同的工艺条件下提取未发酵紫苏粕小肽。小肽得率计算如公式(1)所示:
小肽得率![]()
(1)
1.3.3.2 单因素试验与正交试验
调节pH值分别为7.5、8.0、8.5、9.0、9.5,底物质量分数为3%,酶解温度45 ℃,酶解时间150 min,提取紫苏小肽;酶解温度分别设置为35、40、45、50、55 ℃,底物质量分数为3%,pH 8.0,酶解时间150 min,提取紫苏小肽;酶解时间分别为120、150、180、210、240 min,底物质量分数为3%,pH 8.0,酶解温度45 ℃,提取紫苏小肽;底物质量分数为1%、2%、3%、4%、5%,pH 8.0,酶解温度45 ℃,酶解时间150 min,提取紫苏小肽。根据各单因素试验结果设计正交试验确定提取发酵紫苏粕小肽的最佳工艺条件。
1.3.4 紫苏小肽抗氧化活性的测定
1.3.4.1 DPPH自由基清除能力的测定
分别取2 mL不同质量浓度的发酵紫苏粕小肽样品液于试管中,加入2 mL DPPH无水乙醇溶液,摇匀,在室温下暗处反应30 min后测定波长517 nm处的吸光度An,同时测定2 mL DPPH溶液加2 mL无水乙醇的吸光度Ac和2 mL样品液加2 mL乙醇混合后的吸光度Am,计算DPPH自由基的清除率[14],如公式(2)所示:
DPPH自由基清除率![]()
(2)
以相同的方法测定未发酵紫苏粕小肽的An、Am、Ac,并计算其DPPH自由基的清除率。
1.3.4.2 ·OH清除能力的测定
参考殷军等[15]、王莉娟等[16]和程诗韔等[17]的方法,在10 mL试管中依次加入6 mmol/L硫酸亚铁溶液1.0 mL,不同质量浓度的样品溶液1.0 mL,6 mmol/L双氧水溶液1.0 mL,摇匀后静置10 min,加入6 mmol/L水杨酸溶液1.0 mL,静置30 min后于波长510 nm处测定其吸光度,以相同的方法测定未发酵紫苏小肽的吸光度,分别计算·OH清除率,如公式(3)所示:
·OH清除率![]()
(3)
式中:Av,不加紫苏小肽样品液的吸光度;Ai,加入紫苏小肽反应后溶液的吸光度;Aj,不加水杨酸样品液的吸光度。
1.3.4.3 还原力测定
依据WANG等[18]方法,用蒸馏水作对照,测定各样品在700 nm波长处的吸光度;以相同方法测定未发酵紫苏小肽的吸光度。
1.3.5 数据分析与处理
图表中数据为3次平行实验检测数据的平均值,误差为标准偏差。所得数据用Microsoft Excel软件进行计算、制图整理,用正交设计助手软件进行方差分析。
2 结果与分析
2.1 紫苏中小肽的提取方法优化
2.1.1 单因素试验结果与分析
2.1.1.1 pH对紫苏粕中小肽得率的影响
由图1可知,随着pH增加小肽得率先迅速增加然后缓慢降低,在pH 8.5时提取率最高,为(16.40±0.42)%,因此最佳的酶解pH值为8.5,高于或低于此值,反应效率都会下降。pH对酶活力影响的原因主要是由于pH值会影响酶底物的解离状态、破坏酶的空间结构、引起酶活性部位构象的改变,从而影响酶的活性[19-20]。
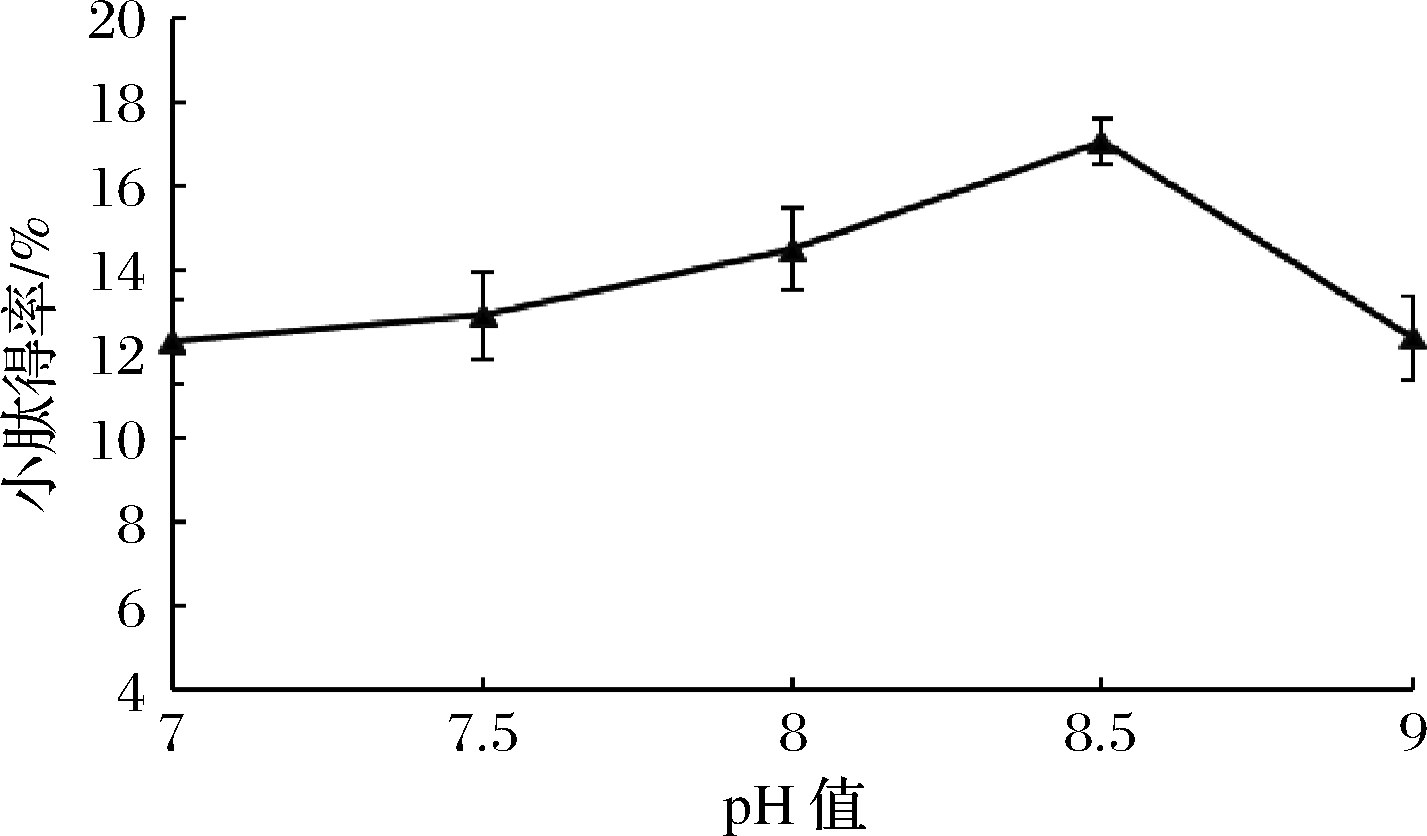
图1 pH值对混菌发酵紫苏粕小肽得率的影响
Fig.1 The effect of pH value on the small peptide yield of fermented Perilla meal
2.1.1.2 温度对紫苏粕中小肽得率的影响
由图2可知,随着酶解温度的增加紫苏小肽得率先迅速增加然后又急剧减少,最适酶解温度为45 ℃,此条件下小肽得率为(16.40±2.45)%。随着温度的上升,反应速度加快,温度超过45 ℃,小肽得率下降显著(P<0.05),最适温度常受到反应时间、离子强度、底物浓度等因素的影响而改变,因此最适温度不是蛋白酶的特征性物理常数[19-20]。
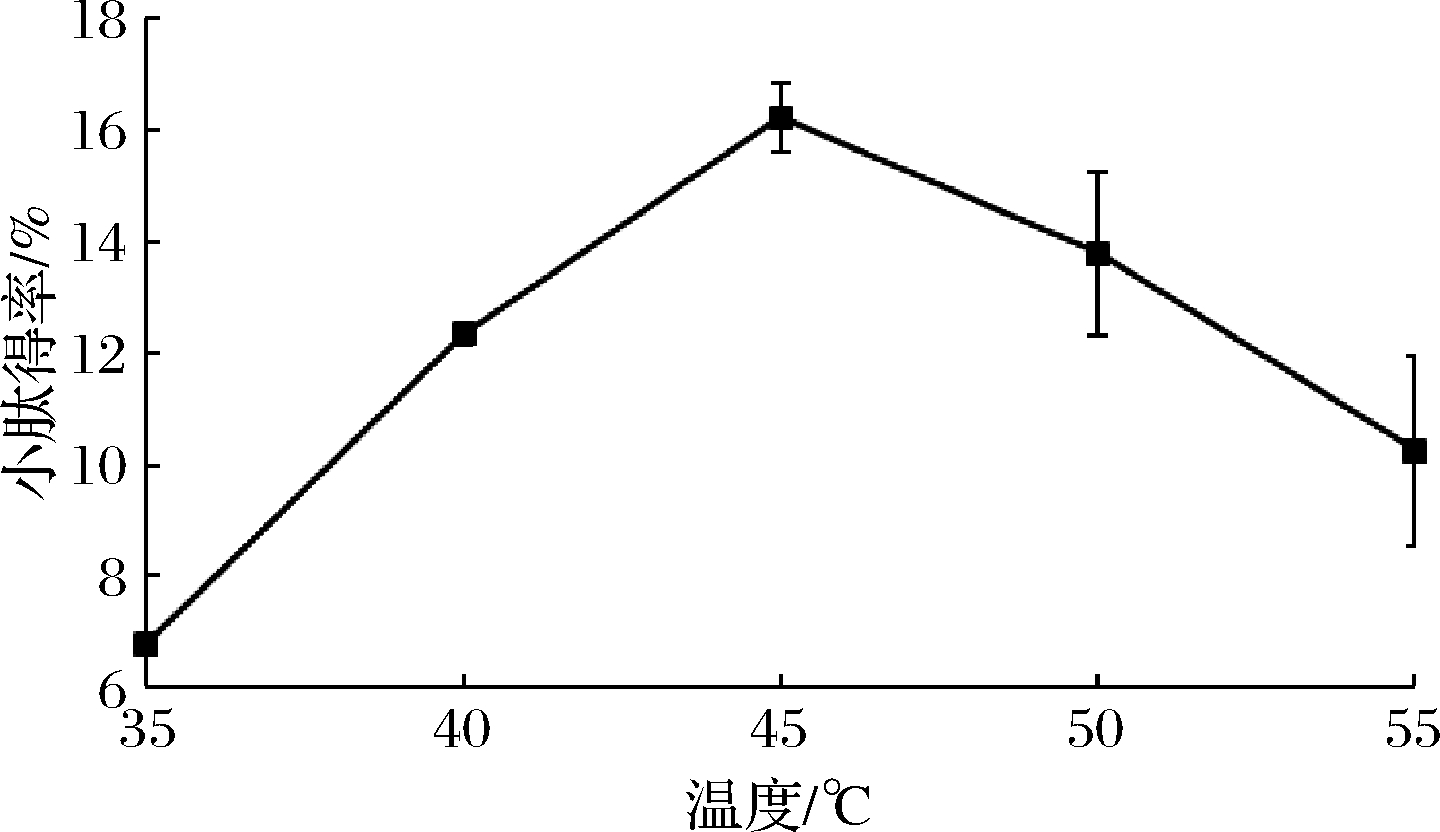
图2 温度对混菌发酵紫苏粕小肽得率的影响
Fig.2 The effect of temperature on the small peptide yield of fermented Perilla meal
2.1.1.3 时间对紫苏粕中小肽得率的影响
由图3可知,酶解反应在150 min之前反应速度较快,150 min之后速率达到最快,而180 min之后反应速度明显放缓,几乎处于停滞状态,210 min时小肽得率最高为(10.54±0.45)%。这是因为酶解反应刚开始时,蛋白酶的浓度相对来说比较高,蛋白酶的活性也就高,同时底物浓度也比较高,所以此时的反应速度较快;然而随着反应的进行,酶的总活力不断下降,反应的速度也就不断减慢直到反应几乎停止,此时表现为小肽得率几乎不再增加[21]。
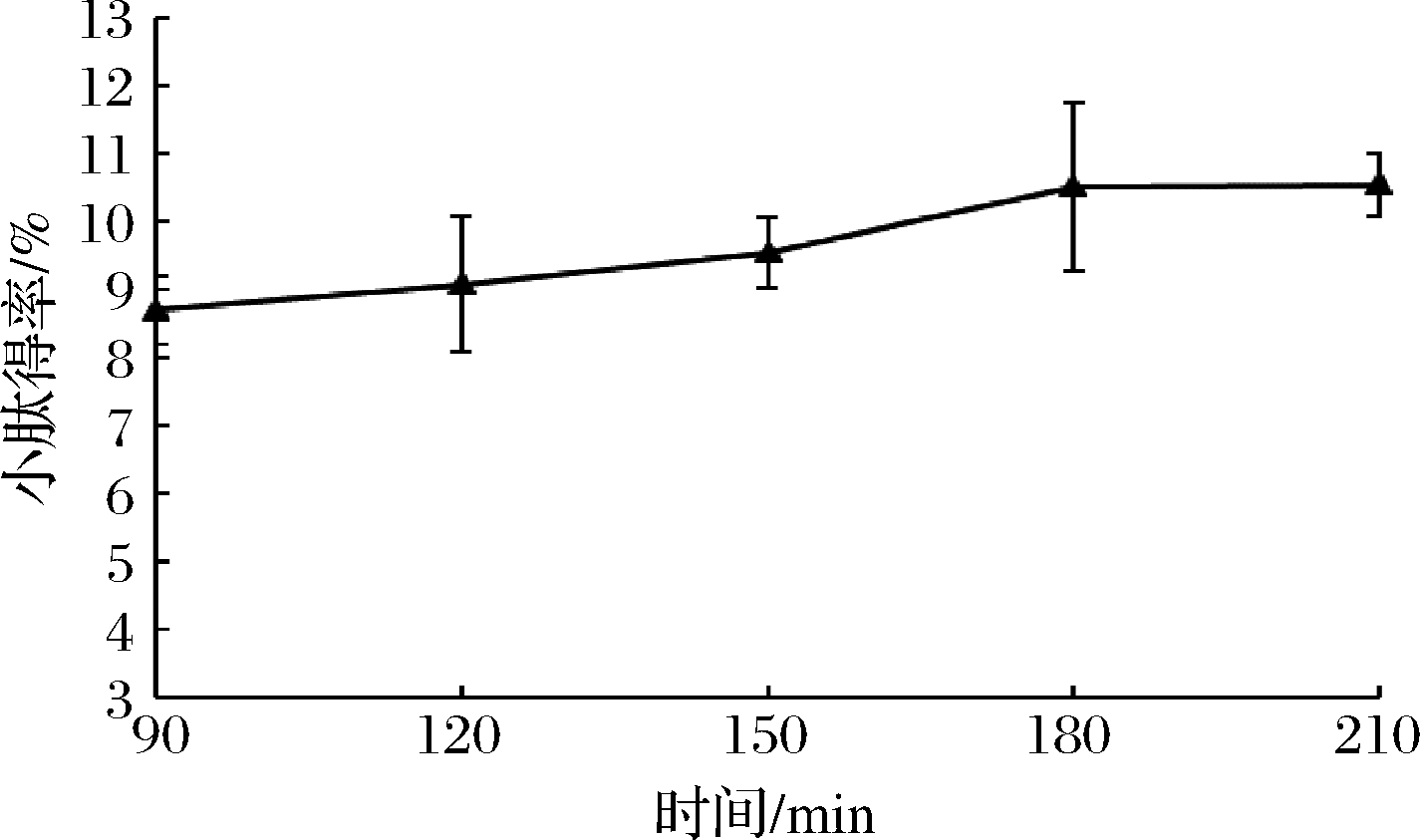
图3 时间对混菌发酵紫苏粕小肽得率的影响
Fig.3 The effect of time on the small peptide yield of fermented Perilla meal
2.1.1.4 底物浓度对紫苏粕中小肽得率的影响
由图4可知,底物质量分数在1%~4%时,随着紫苏粕浓度的增加小肽得率先快速增长,然后缓慢提高,当底物质量分数为4%时,提取率最高,达到(23.4±0.52)%,说明紫苏蛋白浓度较低时,底物浓度与酶的水解反应正相关,当底物质量分数超过4%以后,小肽得率反而出现缓慢下降的趋势。从酶解反应的角度来看,高浓度的紫苏蛋白吸水膨胀,溶液中自由水的含量减少,阻止了碱性蛋白酶分子的扩散,其与底物结合的几率减少,因此抑制酶解反应的进行;或者是因为反应过程中紫苏蛋白与蛋白酶结合生成的产物没有生物活性,从而降低了碱性蛋白酶水解蛋白反应的效率[19-20]。
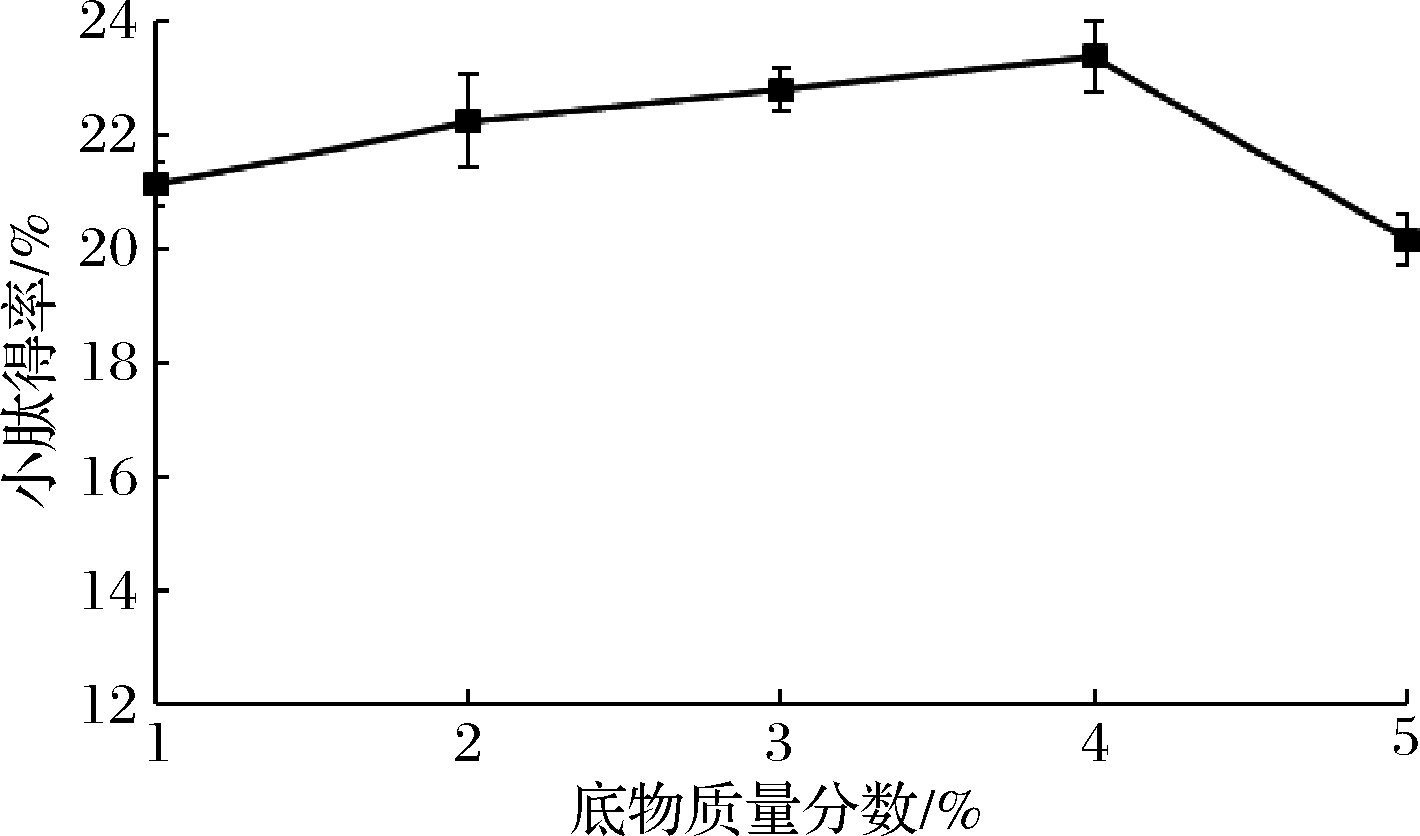
图4 底物浓度对混菌发酵紫苏粕小肽得率的影响
Fig.4 The effect of substrate concentration on the small peptide yield of fermented Perilla meal
2.1.2 正交试验结果与分析
由于各因素对紫苏小肽得率的影响并不是单一线性的,实际上是受到时间、温度、底物浓度、pH值这4个因素的交叉影响,然而最适合蛋白酶的pH值与底物浓度、酶的等电点等都有一定的关系,也就是说最适pH值只有在特定的条件下才能起作用。因此选择固定pH 8.5,考察其余3个因素对小肽得率的交互影响,进行正交试验,以小肽得率为试验指标。正交试验因素和正交试验结果见表1和表2。
表1 正交试验因素水平
Table 1 Orthogonal test factor level
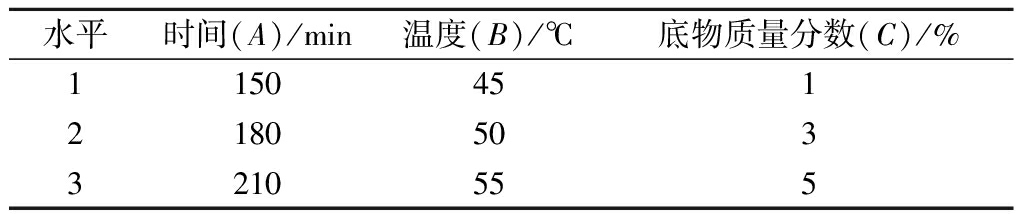
水平时间(A)/min温度(B)/℃底物质量分数(C)/%115045121805033210555
由表2可知,在正交试验的各因素中,时间、温度、底物浓度对小肽得率的影响依次增大。通过比较指标总和与各因素的关系可以看出提取紫苏小肽的最佳工艺组合为A3B1C3,即酶解时间210 min,酶解温度45 ℃,底物浓度5%。
表2 正交试验结果
Table 2 Orthogonal test results
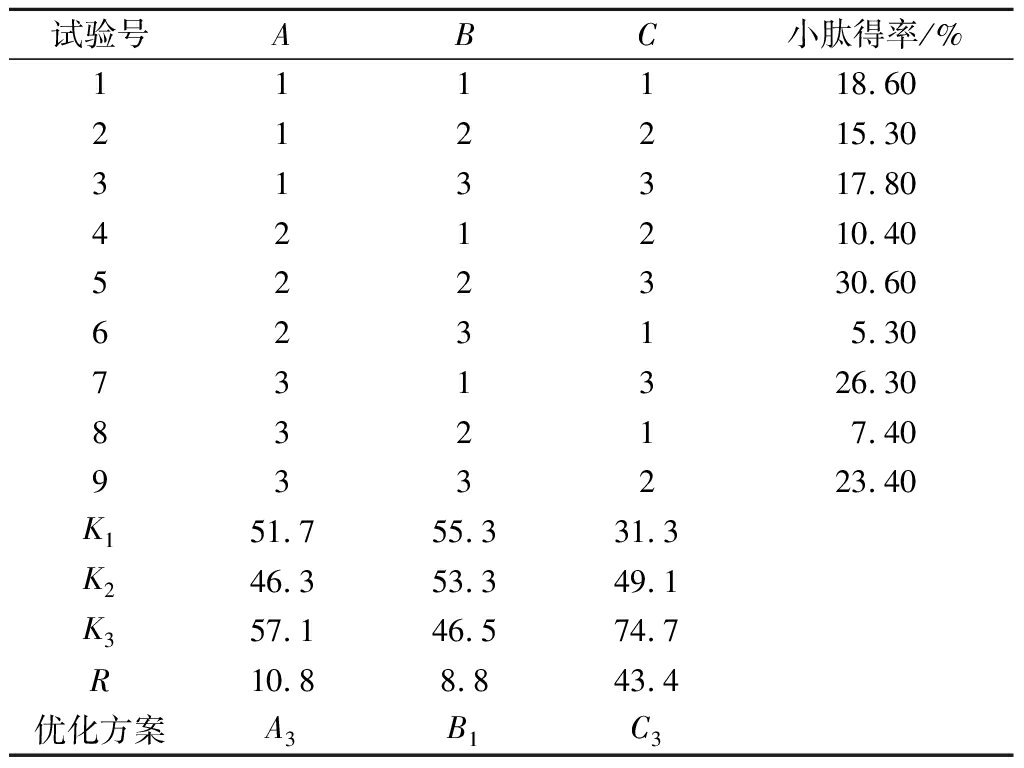
试验号ABC小肽得率/%111118.60212215.30313317.80421210.40522330.6062315.30731326.3083217.40933223.40K151.755.331.3K246.353.349.1K357.146.574.7R10.88.843.4优化方案A3B1C3
2.1.3 验证试验及结果
将正交试验所得的最佳工艺条件组合进行验证,在酶解时间210 min,酶解温度45 ℃,底物质量分数5%的工艺条件下提取紫苏小肽,做3组平行试验进行验证,所得小肽得率平均值为(32.56±1.25)%。
2.2 紫苏小肽抗氧化活性结果与分析
2.2.1 紫苏小肽对DPPH自由基的清除能力
DPPH自由基是一种相对比较稳定的自由基,若小肽能抑制其活性,则说明小肽可以终止过氧化链反应,即能清除油溶性自由基[13, 22]。小肽清除自由基的能力可能与小肽的氨基酸顺序和种类存在一定关系[23]。由图5可知,发酵后的紫苏小肽与未发酵的紫苏小肽对DPPH自由基的清除率均随着小肽浓度的增加而提高,且未发酵紫苏小肽与发酵紫苏小肽随着质量浓度的增加对DPPH自由基清除率都有先急剧增加然后缓慢增加的趋势,当紫苏小肽质量浓度为5 mg/mL时,DPPH自由基清除率最高,分别为(84.00±2.65)%、(90.00±4.58)%,且发酵后紫苏小肽清除率始终比未发酵紫苏小肽高,发酵后DPPH自由基清除率最大提高了6%。
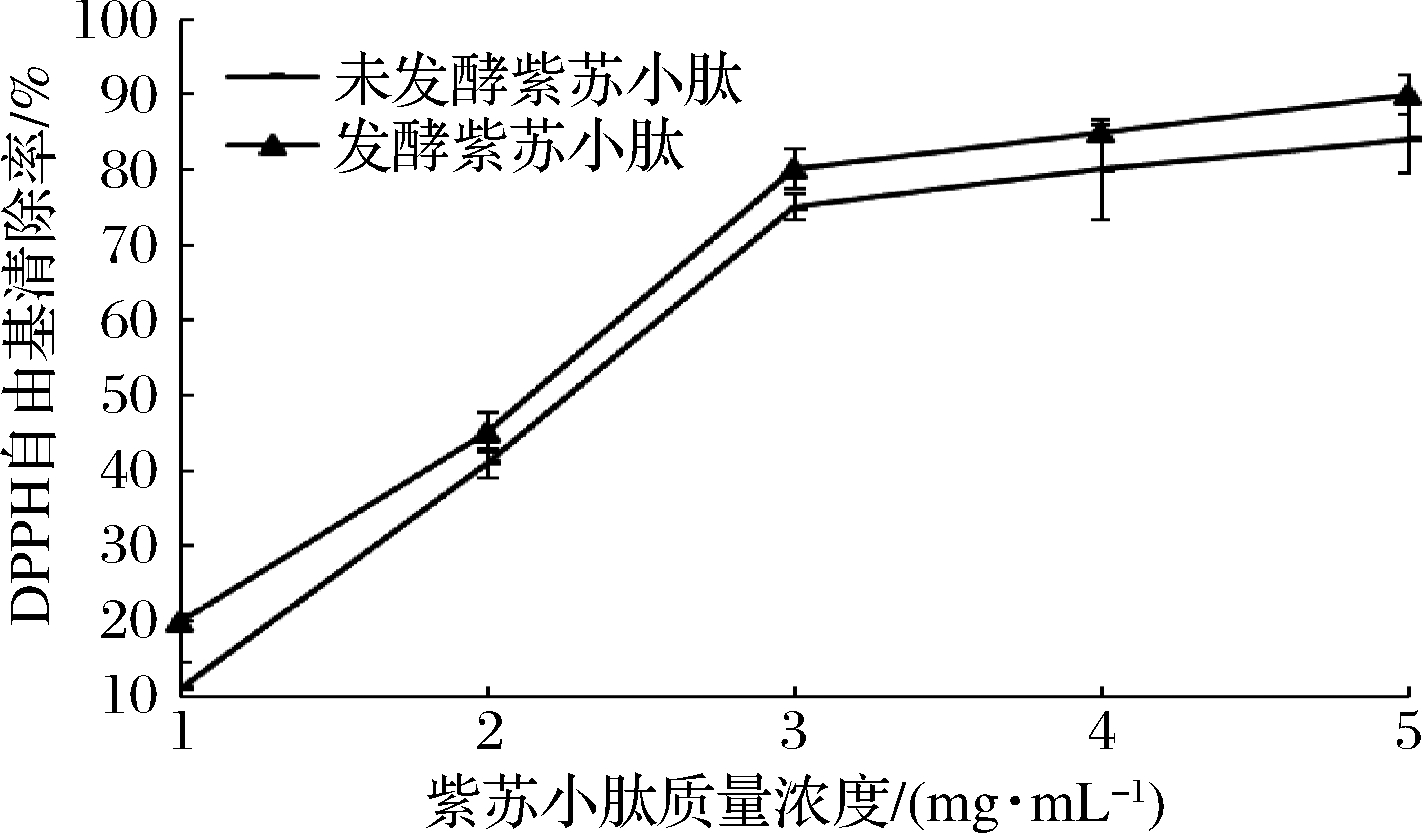
图5 不同质量浓度紫苏小肽对清除 DPPH自由基的影响
Fig.5 The effect of different concentration small peptide of Perilla meal on DPPH radical clearance
2.2.2 紫苏小肽对·OH的清除能力
由图6可知,发酵紫苏小肽和未发酵紫苏小肽随着质量浓度的增加对·OH的清除率先急剧增加然后平缓增加,当紫苏小肽质量浓度为5 mg/mL时,清除率最高分别为(96.00±2.00)%、(100.00±0)%。且发酵后紫苏小肽的清除率始终比未发酵的紫苏小肽高,发酵后清除率最大可提高4%。小肽中的供氢体在自由基连锁反应中,可以还原氧化性很高的自由基,从而使反应终止,当小肽质量浓度增加时,供氢体会变多,能提供的质子也就更多[14]。

图6 不同质量浓度紫苏小肽清除·OH的效果
Fig.6 The effect of different concentration small peptide of Perilla meal on ·OH clearance
2.2.3 紫苏小肽还原力结果与分析
紫苏小肽还原力的大小与其在特征波长700 nm下吸光度的大小成正比,即紫苏小肽的吸光度越大,紫苏小肽的还原力就越强。由图7可知,发酵紫苏小肽还原力随着小肽浓度增加先缓慢增加然后急剧增加,而未发酵紫苏小肽还原力先急剧增加后缓慢增加,在试验范围(1~5 mg/mL)内最大吸光度分别为2.49±0.09、1.87±0.10,发酵后还原力最大可提高33%。抗氧化剂凭借其较强的还原作用给出电子,进而消除存在的自由基以达到抗氧化的目的[24],因此还原力与抗氧化性呈正相关。
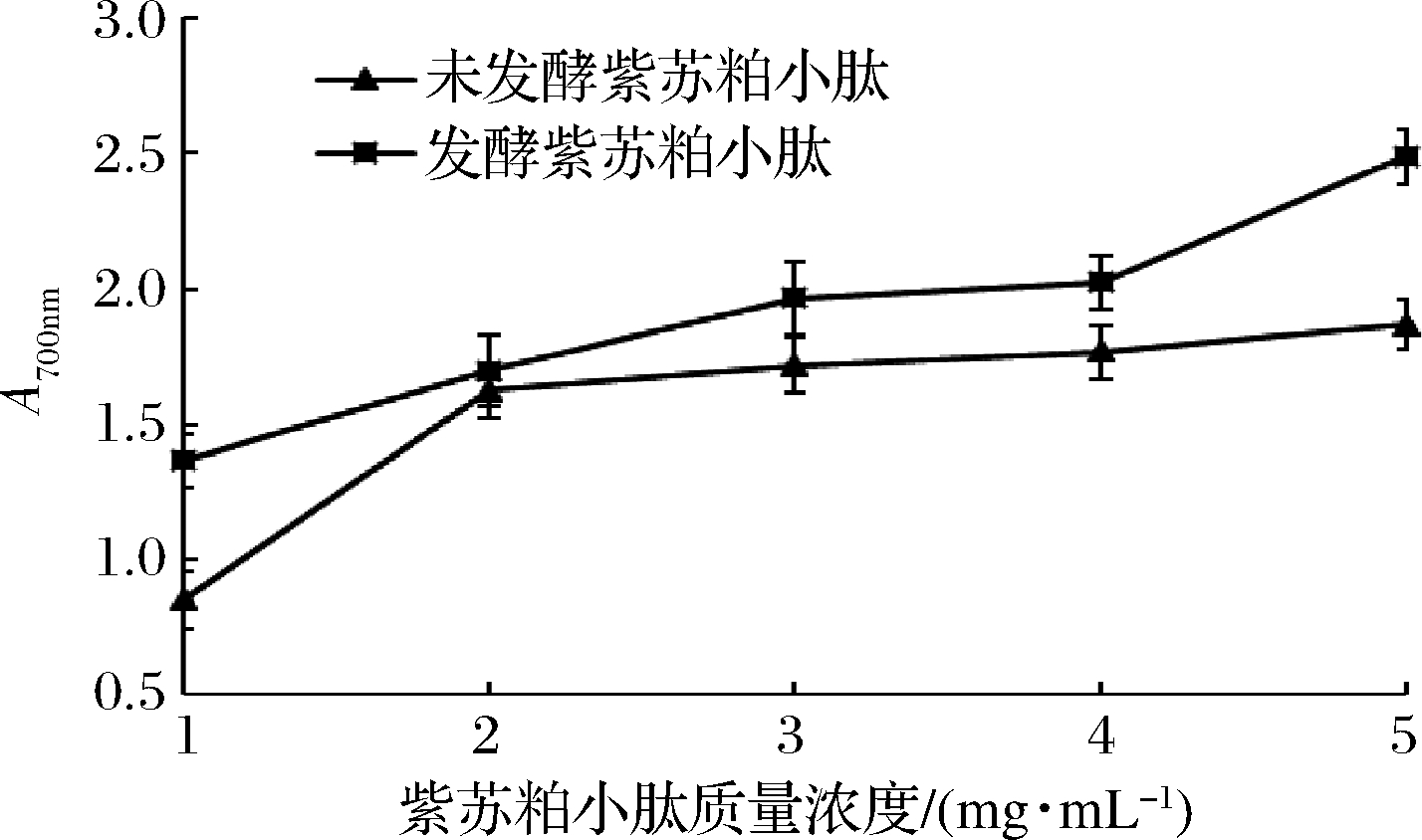
图7 不同质量浓度紫苏小肽还原力
Fig.7 The effect of different concentration small peptide of Perilla meal on the reducing capacity
3 结论
以紫苏籽粕为原料,紫苏小肽得率为衡量指标,试验结果表明当碱性蛋白酶添加量为5%(质量分数),pH值为8.5时的最佳提取工艺条件为:酶水解温度45 ℃,酶解时间210 min,底物质量分数5%,此条件下小肽得率为(32.56±1.25)%;发酵紫苏粕小肽的DPPH自由基清除率、·OH清除率和还原力最高分别为(90.00±4.58)%、(100.00±0)%和2.49±0.09,未发酵紫苏粕小肽的DPPH自由基清除率、·OH清除率和还原力最高值分别为(84.00±2.65)%、(96.00±2.00)%和1.87±0.10,发酵后紫苏粕中小肽比未发酵紫苏粕小肽还原力、DPPH自由基清除率、·OH的清除率最大分别提高了6%、4%、33%。
[1] 刘大川, 余华峰.乙醇浸提紫苏籽压榨饼中油脂的工艺[J].农业工程学报, 2008,24(11):242-246.
LIU D C, YU H F.Technology for extraction of perilla seed oil from pressed Perilla seed cake with ethanol[J].Transactions of the China Society of Agricultural Engineering, 2008,24(11):242-246.
[2] 王楠,冯志彪.两种油料蛋白制备及其功能性研究[J].中国油脂, 2012, 37(3):18-22.
WANG N, FENG Z B.Preparation and functional properties of two kinds of oilseed proteins[J].China Oils and Fats, 2012, 37(3):18-22.
[3] 石玮婷, 李荣, 姜子涛.紫苏籽蛋白的提取及纯化研究[J].中国食品添加剂, 2013(4):68-74.
SHI W T, LI R, JIANG Z T.Study on preparation and purification of protein from Pefilla seeds[J].China Food Additives, 2013(4):68-74.
[4] 刘大川, 童波, 周海军.紫苏粕中粗多糖提取工艺的研究[J].油脂工程技术, 2008(9):71-73.
LIU D C, TONG B, ZHOU H J.Study on polysaccharides extraction from Perilla seed meal[J].Oil & Fat Engineering Technology, 2008(9):71-73.
[5] ZHU J F, YANG Y Y, WEN Y, et al.An improved ultrasound-assisted alkali extracting process of Perilla seed meal polysaccharide[J].Separation Science and Technology, 2013, 48(18):2 771-2 778.
[6] 朱建飞, 白绍文, 陈楠, 等.紫苏饼粕多糖的水提工艺研究[J].安徽农业科学, 2011, 39(1):266-267.
ZHU J F, BAI S W, CHEN N, et al.Study on water extraction technology of polysaccharides from Perilla meal[J].Journal of Anhui Agricultural Sciences, 2011, 39(1):266-267.
[7] 朱建飞, 杨嗦啦, 陈岗, 等.碱提紫苏饼粕多糖的工艺优化[J].食品研究与开发, 2011, 32(2):69-71.
ZHU J F, YANG S L, CHEN G, et al.Optimization of extractifor technology of polysaccharide for Perilla meal by alkali[J].Food Research and Development, 2011, 32(2):69-71.
[8] 朱建飞, 肖怡, 唐春红, 等.酸提紫苏粕多糖工艺研究[J].重庆工商大学学报 (自然科学版), 2012, 29(11):50-54.
ZHU J F, XIAO Y, TANG C H, et al.Study on acid extraction technology of polysaccharides from Perilla meal[J].Journal of Chongqing Technology and Business University (Natural Science Edition), 2012, 29(11):50-54.
[9] ZHANG H J, LI H Z, ZHANG, Z J, et al.Optimization of ultrasound-assisted extraction of polysaccharides from Perilla seed meal by response surface methodology:Characterization and in vitro antioxidant activities[J].Journal of Food Science, 2021, 86(2):306-318.
[10] KIM J M, YOON K Y.Functional properties and biological activities of Perilla seed meal protein hydrolysates obtained by using different proteolytic enzymes[J].Food Science and Biotechnology, 2020, 29(11):1 553-1 562.
[11] JA M K, KYUNG Y Y.Functional properties and biological activities of Perilla seed meal protein hydrolysates obtained by using different proteolytic enzymes[J].Food Science and Biotechnology, 2020, 29(11):1 553-1 562.
[12] 田海娟, 覃明月, 谢黎明, 等.混菌发酵对紫苏粕小肽含量的影响[J].粮油食品科技, 2018, 26(4):55-58.
TIAN H J, QIN M Y, XIE L M, et al.Study on the effect of mixed fermentation on the content of small peptide of Perilla seed meal[J].Science and Technology of Creals, Oils and Foods, 2018, 26(4):55-58.
[13] 曾何华, 曾永明.花生蛋白酶解活性肽抗氧化特性的研究[J].食品工业, 2014, 35(7):20-24.
ZENG H H, ZENG Y M.Study on the antioxidant activity of enzymatic hydrolysis bioactive peptide from peanut meal powder[J].The Food Industry, 2014, 35(7):20-24.
[14] 彭惠惠,李吕木,钱坤,等.发酵芝麻粕中芝麻小肽的分离纯化及其体外抗氧化活性[J].食品科,学2012, 34(9):66-69.
PENG H H, LI L M, QIAN K, et al.Isolation, purification and antioxidant activity of sesame peptide from solid-state fermentation[J].Food Science, 2013, 34(9):66-69.
[15] 殷军, 葛青, 毛建卫, 等.竹叶多糖的组分及抗氧化活性分析[J].食品工业科技, 2013, 34(2):100-103.
YIN J, GE Q, MAO J W, et al.Analysis of composition and antioxidant activities of polysaccharide extracted from Moso bamboo-leaf[J].Science and Technology of Food Industry, 2013, 34(2):100-103.
[16] 王莉娟,陶文沂.大豆肽体外抗氧化活性研究[J].生物加工过程,2008, 6(4):69-73.
WANG L J, TAO W Y.Anti-oxidative effect of soybean peptides in vitro[J].Bioprocessing Technology, 2008, 6(4):69-73.
[17] 程诗韔,孙倩,王林,等.草莓酒发酵过程中组分和抗氧化性的变化[J].农业工程技术, 2017, 37(20):19-22.
CHENG S C, SUN Q, WANG L, et al.Changes of components and antioxidant activity in strawberry wine during fermentation[J].Agricultural Engineering Technology, 2017, 37(20):19-22.
[18] WANG L J, TAO W Y.Study on antioxidant activity of soybean peptide in vitro[J].Biological Processing, 2008, 4(6):69-73.
[19] 彭志英. 食品酶学导论[M].北京:中国轻工业出版社, 2002:124-126.
PENG Z Y.Food Enzymology[M].Beijing:China Light Industry Press, 2002:124-126.
[20] TUCKER G A, WOODS L J.酶在食品加工中的应用[M].李雁群, 肖功年(译).第2版.北京:中国轻工业出版社, 2002:36-48.
TUCKER G A, WOODS L J.Application of Enzyme in Food Processing[M].LI Y Q, XIAO G N(translated).2nd ed.Beijing:China Light Industry Press, 2002:36-48.
[21] 史军,王金水,蔡凤英, 等.花生蛋白酶解条件及活性肽抗氧化特性研究[J].河南工业大学学报(自然科学版),2006,27(6):29-33.
SHI J, WANG J S, CAI F Y, et al.Study on enzymatic hydrolysis of peanut protein and antioxygenic property of active peptides [J] Journal of Henan University of Technology (Natural Science Edition),2006,27(6):29-33.
[22] 崔剑, 李兆陇, 洪啸吟.自由基生物抗氧化与疾病[J].清华大学学报, 2000, 40(6):9-12.
CUI J, LI Z L, HONG X Y.Bio-antioxidants with ill thrapy[J].Journal of Tsinghua University, 2000, 40(6):9-12.
[23] 胡蓉. 绿茶中茶多酚的提取工艺及体外抗氧化活性研究[J].食品界, 2017,40(6):138-139.
HU R.Study on extraction technology and antioxidant activity of tea polyphenols from green tea[J].Food Industry, 2017,40(6):138-139.
[24] SIDDHURAJU P, MOHAN P S, BECKER K.Studies on the antioxidant activity of Indian Laburnum (Cassia fistula L.):A preliminary assessment of crude extracts from stem bark, leaves, flowers and fruit pulp[J].Food Chemistry, 2002, 79(1):61-67.