藜麦,被联合国粮油及农业组织列为唯一可以满足人体基本营养的单体作物[1],广泛种植于山西忻州、吉林长春和甘肃兰州等地[2],藜麦蛋白含量较高,酚类和黄酮类等功能成分远高于其他谷物[3-4];沙棘[5]、黄桃[6]和胡萝卜[7]均富含多种维生素和活性物质,具有降压、降脂和美容等功效。近年来,研究人员均对藜麦浓浆的制作工艺及发酵工艺进行了探究,如王雨等[8]、BHINDER等[9]和![]() 等[10]发现,藜麦通过萌发后,其营养成分会有所改变;邢慧雅[11]发现经过糊化、液化和糖化后,藜麦中的还原糖成分含量上升;向藜麦浓浆中接入乳杆菌后[12],抗氧化特性与未发酵的藜麦浓浆相比明显提高,故认为经过对藜麦浓浆的前期处理及发酵过程,进一步改善了藜麦的营养价值。目前,市场上现有的藜麦乳产品仅通过干酪乳杆菌和植物乳杆菌发酵而形成,还存在菌种来源单一和口味苦涩等诸多问题,且开菲尔乳杆菌发酵藜麦浓浆的研究尚属空白。本研究是将藜麦种子经过萌发、磨浆、糊化、液化、糖化、开菲尔发酵[13]后,向发酵乳中加入沙棘原浆、黄桃浓浆和胡萝卜浓浆调节口味,最后经过真空冷冻干燥后得到产品,既保留了藜麦的营养成分,同时又具有酸甜的口感,符合当前市场需求,有着很好的发展前景。
等[10]发现,藜麦通过萌发后,其营养成分会有所改变;邢慧雅[11]发现经过糊化、液化和糖化后,藜麦中的还原糖成分含量上升;向藜麦浓浆中接入乳杆菌后[12],抗氧化特性与未发酵的藜麦浓浆相比明显提高,故认为经过对藜麦浓浆的前期处理及发酵过程,进一步改善了藜麦的营养价值。目前,市场上现有的藜麦乳产品仅通过干酪乳杆菌和植物乳杆菌发酵而形成,还存在菌种来源单一和口味苦涩等诸多问题,且开菲尔乳杆菌发酵藜麦浓浆的研究尚属空白。本研究是将藜麦种子经过萌发、磨浆、糊化、液化、糖化、开菲尔发酵[13]后,向发酵乳中加入沙棘原浆、黄桃浓浆和胡萝卜浓浆调节口味,最后经过真空冷冻干燥后得到产品,既保留了藜麦的营养成分,同时又具有酸甜的口感,符合当前市场需求,有着很好的发展前景。
1 材料与方法
1.1 材料与试剂
藜麦,山西静乐;沙棘原浆,山西厦普赛尔食品饮料股份有限公司;黄桃浓浆、胡萝卜浓浆,福建臻富果汁食品有限公司;开菲尔乳杆菌(ZKCC-378),北京中科质检生物技术有限公司;α淀粉酶(3 700 U/g)、β淀粉酶(102 000 U/g)、胃蛋白酶(3 000 U/mg)、胰蛋白酶(250 U/mg),北京索莱宝生物科技有限公司;DPPH等试剂均为分析纯。
1.2 仪器与设备
JYL-C010料理机,九阳股份有限公司;XL-600B多功能粉碎机,小宝电器有限公司;DHG-9240A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;HHS-11-6电热恒温水浴锅、YXQ-LS-75Ⅱ全自动高压灭菌锅,上海博讯实业有限公司医疗设备厂;HPS-250生化培养箱,哈尔滨市东明医疗仪器厂;SW-CJ-1FD超净工作台,苏净集团安泰公司;FE20实验室pH计,上海梅特勒托利多仪器有限公司;SCIENTZ-10 N冷冻干燥机,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 实验流程
实验流程如下:
藜麦种子→萌发→磨浆→糊化→液化→糖化→杀菌→发酵→藜麦发酵乳、混合果蔬汁调配后,真空冷冻干燥→体外胃肠消化模拟→抗氧化分析
1.3.2 藜麦浆的制备
藜麦种子在22 ℃的恒温培养箱中萌发34 h,期间每6 h浇1次蒸馏水[14],结束后在-20 ℃保存24 h,在45 ℃烘干11 h,粉碎过筛,得到藜麦芽粉;藜麦粉以1∶5(g∶mL)的料液比进行磨浆(保证藜麦浓浆的蛋白质质量分数>2.5%);糊化的实验条件为80 ℃、30 min,使其达到糊化的终点;通过正交试验确定液化和糖化过程的实验条件分别为75 ℃、55 min、α淀粉酶18 U/g和55 ℃、90 min、β淀粉酶240 U/g,从而制得藜麦浓浆。
1.3.3 发酵
1.3.3.1 杀菌、冷却
将制好的藜麦浓浆,90 ℃杀菌20 min后冷却[15]。
1.3.3.2 菌种活化稀释
将开菲尔乳杆菌冻干粉用少量无菌水稀释后,滴加至平板培养基,37 ℃培养48 h。活化后用接种环取少量菌至液体培养基中,反复接种活化后至活菌总数约为109CFU/mL,作为菌种接种液备用。
1.3.3.3 接种、发酵
藜麦浓浆杀菌后,接入开菲尔乳杆菌,在恒温培养箱中培养一定时间后,测其酸度和活菌数。
1.3.4 单因素试验
以酸度和活菌数为评价指标,考察接种量(2%、3%、4%、5%、6%、7%、8%)、发酵时间(9、10、11、12、13、14、15 h)、发酵温度(34、35、36、37、38、39、40 ℃)对藜麦浓浆发酵效果的影响。
1.3.5 响应面优化试验
基于单因素试验结果,依据Box-Behnken试验设计原理,考察3因素之间的交互作用并得到开菲尔发酵藜麦的最优条件。以活菌数和酸度为响应值,设计3因素3水平的试验见表1。
表1 响应面试验因素及水平
Table 1 Codes and levels of response surface test

水平A(接种量)/%B(发酵时间)/hC(发酵温度)/℃-141136051237161338
1.3.6 果蔬发酵乳的复配
以感官评分和固形物含量为评价指标,确定果蔬-开菲尔藜麦发酵混合乳的比例为藜麦发酵乳50 g、沙棘原浆13 g、黄桃浓浆30 g和胡萝卜浓浆10 g。
1.3.7 真空冷冻干燥工艺
将藜麦浓浆、开菲尔藜麦发酵乳和果蔬-开菲尔藜麦发酵混合乳3组在-43 ℃的条件下冷冻2 h后脱模,设置加热板温度为45 ℃、干燥仓内真空度10 Pa。
1.3.8 体外胃肠消化模拟试验
胃消化模拟试验[16-17]:将藜麦浓浆、开菲尔藜麦发酵乳和果蔬-开菲尔藜麦发酵混合乳进行适度稀释,加入1 mol/L HCl溶液使pH至2.0,加入200 U胃蛋白酶进行胃消化过程,每隔1 h取样、共4次,离心后测定消化及抗氧化指标。
肠消化模拟试验:取胃消化4 h的样品,缓慢加入1 mol/L NaHCO3溶液调pH至7.8,加入200 U胰蛋白酶进行肠消化过程,每隔1 h取样、共5次,离心后测定消化及抗氧化指标。
1.3.9 相关指标测定
1.3.9.1 活菌数和酸度的测定
参照标准[18-19],分别进行活菌数和酸度的测定。
1.3.9.2 黄酮和多酚的测定
依据参考文献[20-21],分别在510和765 nm 处对黄酮和多酚进行测定。
1.3.9.3 抗氧化能力的测定
依据参考文献[22],在517和320 nm处分别进行DPPH自由基和超氧阴离子自由基清除率的测定;依据参考文献[23],在510和700 nm处分别进行羟自由基清除率和铁还原力的测定。
1.4 数据处理
每组试验重复3次,数据均为平均值。实验图表用Origin 8.0绘制,使用SPSS 17.0和Design-Expert 8.0.6进行显著性统计分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 接种量对开菲尔发酵藜麦效果的影响
接种量对发酵效果的影响见图1,随着接种量的增加,酸度、活菌数均先上升后趋于平缓,原因可能是接种量的大小与开菲尔菌在藜麦浆体系中的生长有很大的关系,当开菲尔菌的接种量<5%时,藜麦浆中的活菌数随之减少,导致藜麦浆没有充分发酵,造成藜麦浆原料的浪费;当开菲尔菌的接种量>5%时,藜麦浆所能利用的活菌数是有限的,造成酸度几乎无明显变化。所以,综合接种量对酸度和活菌数的影响程度,选择接种量为5%进行后续试验。
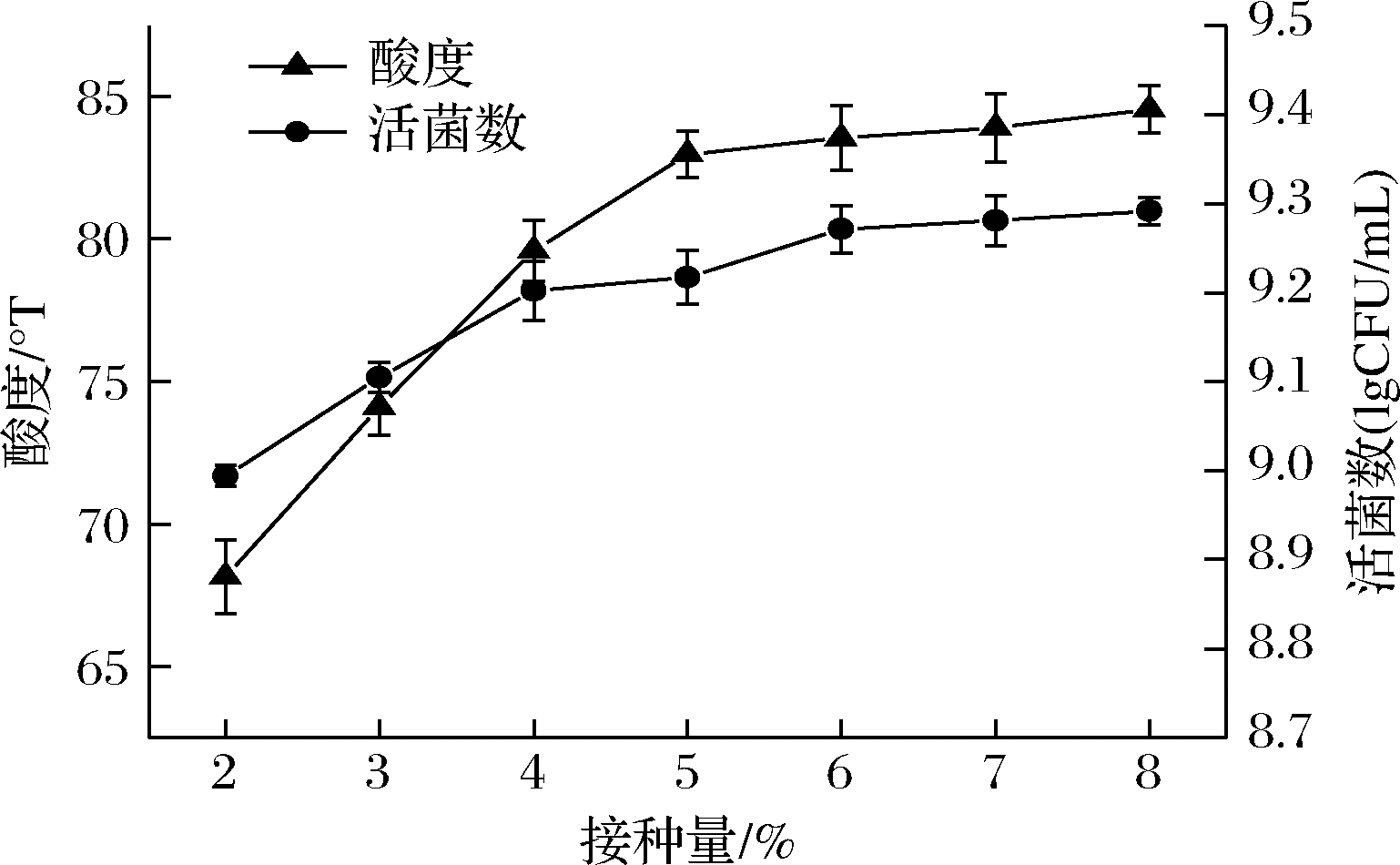
图1 接种量对酸度和活菌数的影响
Fig.1 Effect of inoculation amount on acidity and the number of viable bacteria
2.1.2 发酵时间对开菲尔发酵藜麦效果的影响
发酵时间对发酵效果的影响见图2,随着发酵时间的延长,活菌数、酸度变化均先上升后趋于平缓,原因可能是将开菲尔菌加入到藜麦浓浆后,菌体大量生长繁殖产酸,使得藜麦芽浓浆环境酸化,适宜的酸度有利于提高活菌数,使酸度增大。当发酵到12 h时,碳源的大量消耗和乳酸的堆积阻碍了开菲尔菌的生长,从而形成活菌数变化不明显的现象。所以,综合发酵时间对酸度和活菌数的影响程度,选择发酵时间为12 h进行后续试验。
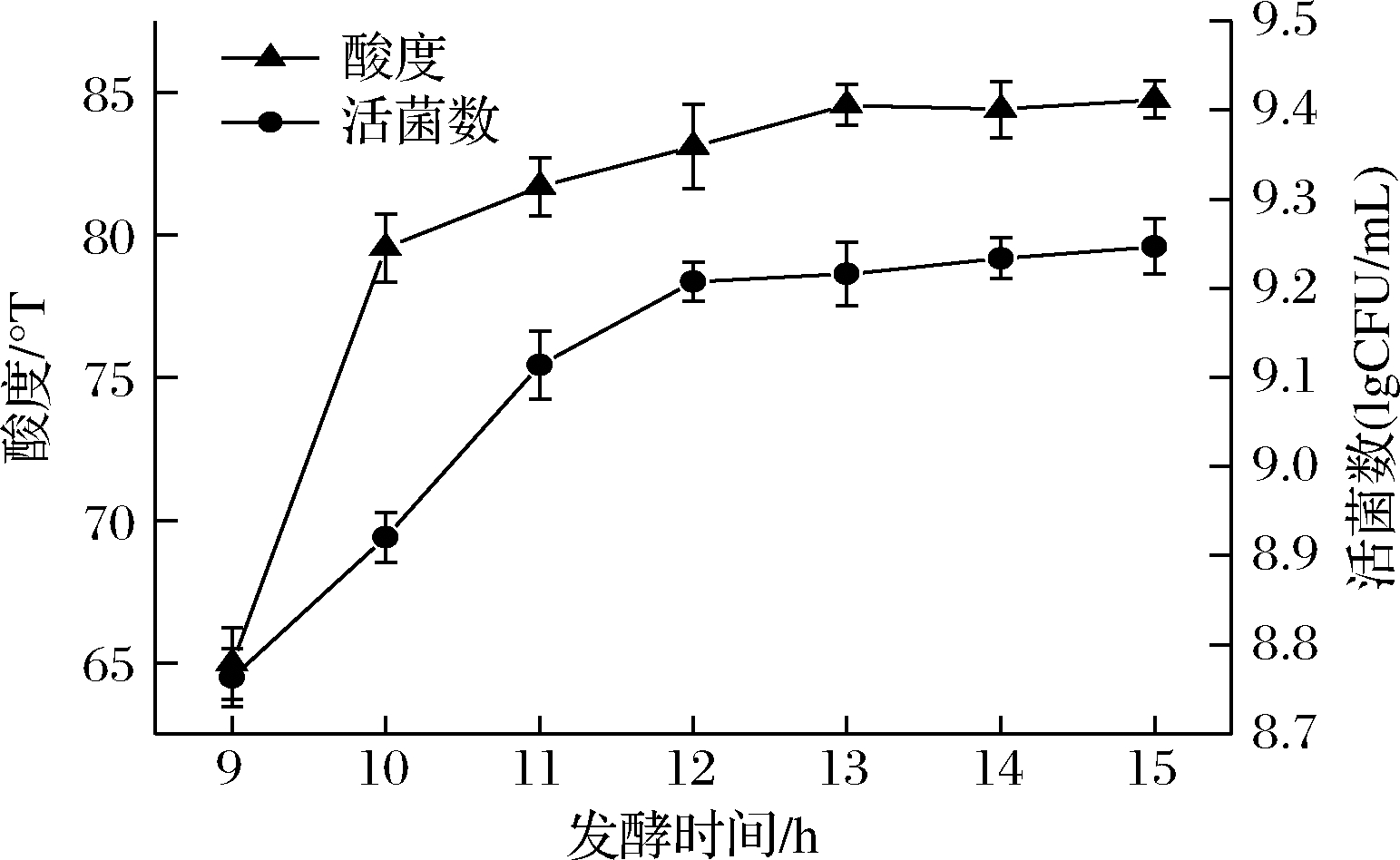
图2 发酵时间对酸度和活菌数的影响
Fig.2 Effect of fermentation time on acidity and the number of viable bacteria
2.1.3 发酵温度对开菲尔发酵藜麦效果的影响
发酵温度对发酵效果的影响见图3,当发酵温度为 34~37 ℃时,开菲尔菌的活菌数和酸度增长较快,当发酵温度高于37 ℃,开菲尔菌的活菌数和酸度几乎无明显变化,原因可能是温度的影响对于开菲尔发酵来说是至关重要的,温度的持续增加不利于开菲尔菌的生长,而开菲尔菌活菌数的稳定进而会影响产酸效果。所以,综合发酵温度对酸度和活菌数的影响程度,选择发酵温度为37 ℃进行后续试验。
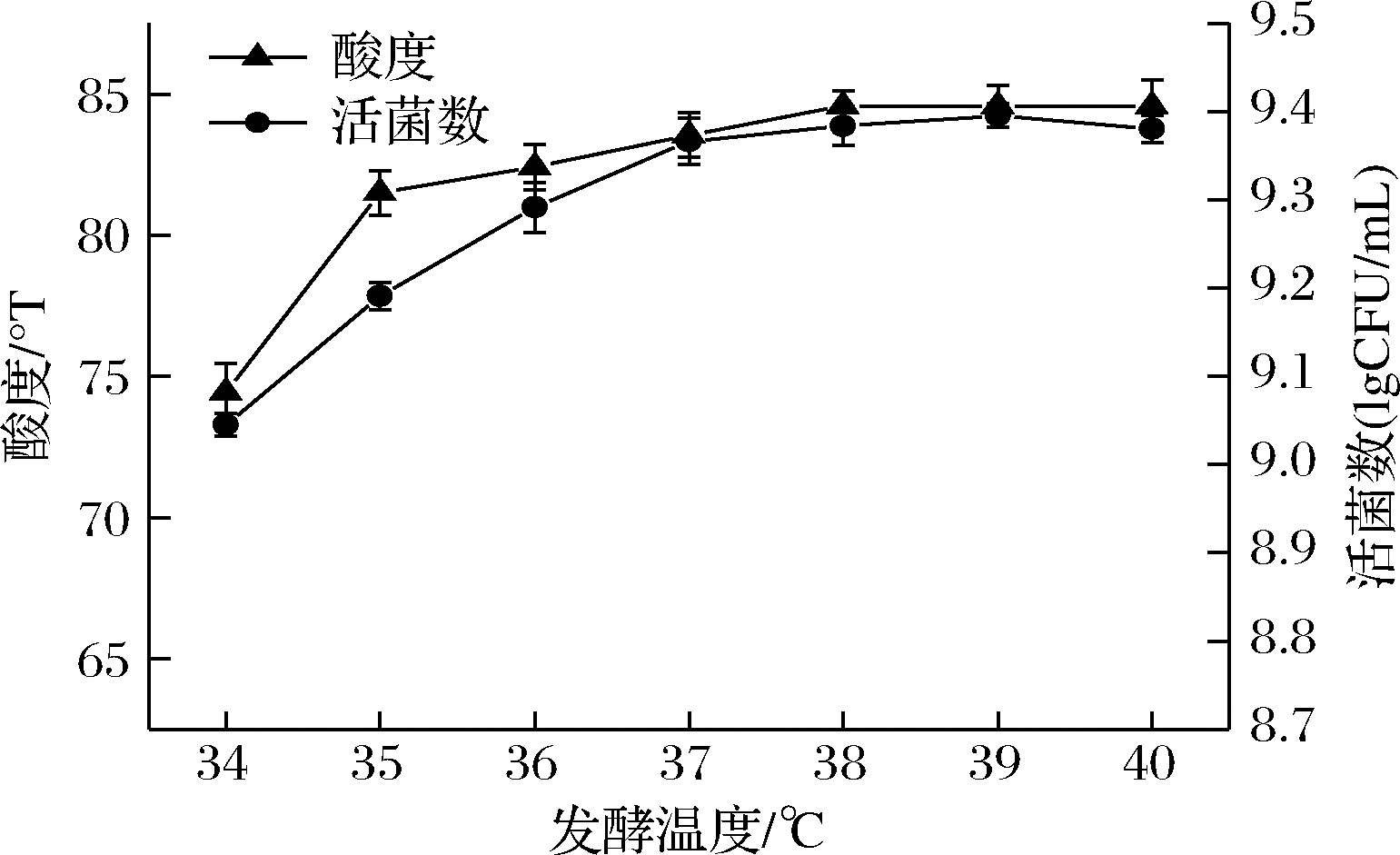
图3 发酵温度对酸度和活菌数的影响
Fig.3 Effect of fermentation temperature on acidity and the number of viable bacteria
2.2 开菲尔发酵藜麦浓浆响应面优化结果
2.2.1 响应面试验设计及结果
依据表2的实验数据,利用Design-Expert 8.0.6软件进行回归分析,建立开菲尔发酵藜麦乳酸度和活菌数的二次多项回归方程如下:
Y1=85.25+0.54A+0.74B+1.09C+0.33AB+0.17AC+0.60BC-1.50A2-1.36B2-1.72C2(R12=96.47%)
Y2=9.28+0.075A+0.17B+0.29C+0.025AB-0.050AC+0.050BC-0.22A2-0.30B2-0.38C2(R22=99.24%)
试验方差结果如表3所示,模型均极显著(P<0.000 1),F值为1.36和0.87,P值为 0.375 8和0.527 1(P>0.05),表示失拟项不显著;R12为 96.47%、R22为99.24%,表示模型拟合度较高,可用于预测试验结果。根据F值大小,表明3个因素对藜麦乳发酵效果影响的主次顺序均为C>B>A。由P值可得,B、C、A2、B2和C2对酸度和活菌数均极显著(P<0.01),A对酸度和活菌数影响分别为显著(P<0.05)和极显著(P<0.01),BC对活菌数影响极显著(P<0.01)。
3个因素交互作用对酸度和活菌数的影响如图4所示,以开菲尔菌接种量、发酵时间和发酵温度分别为中心水平时,酸度和活菌数均呈先上升后趋于平缓的趋势,发酵温度的大幅度升高致使产生大量乳酸,使得发酵体系的pH降低,不利于开菲尔菌的生长,故发酵过程趋于稳定,酸度无明显变化、活菌数略有所降低。由图4-a、图4-c、图4-d和4-f可知,发酵温度响应面曲面陡于其余两因素曲面,说明发酵温度对发酵效果的影响最大,与方差分析结果一致。
表2 响应面试验设计及结果
Table 2 Design and results of response surface test
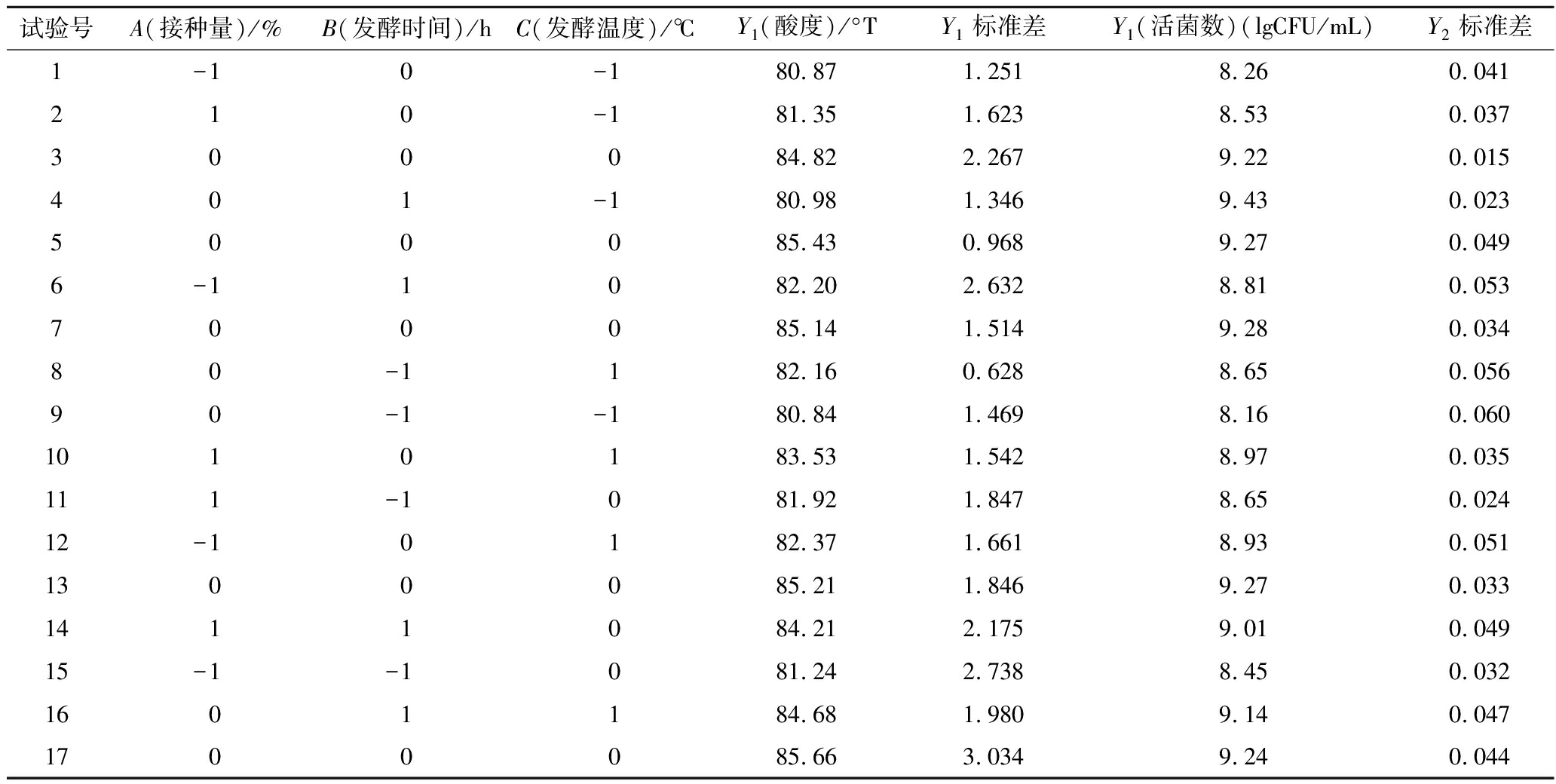
试验号A(接种量)/%B(发酵时间)/hC(发酵温度)/℃Y1(酸度)/°TY1标准差Y1(活菌数)(lgCFU/mL)Y2标准差1-10-180.871.2518.260.041210-181.351.6238.530.037300084.822.2679.220.015401-180.981.3469.430.023500085.430.9689.270.0496-11082.202.6328.810.053700085.141.5149.280.03480-1182.160.6288.650.05690-1-180.841.4698.160.0601010183.531.5428.970.035111-1081.921.8478.650.02412-10182.371.6618.930.0511300085.211.8469.270.0331411084.212.1759.010.04915-1-1081.242.7388.450.0321601184.681.9809.140.0471700085.663.0349.240.044
表3 方差分析结果
Table 3 The results of variance analysis
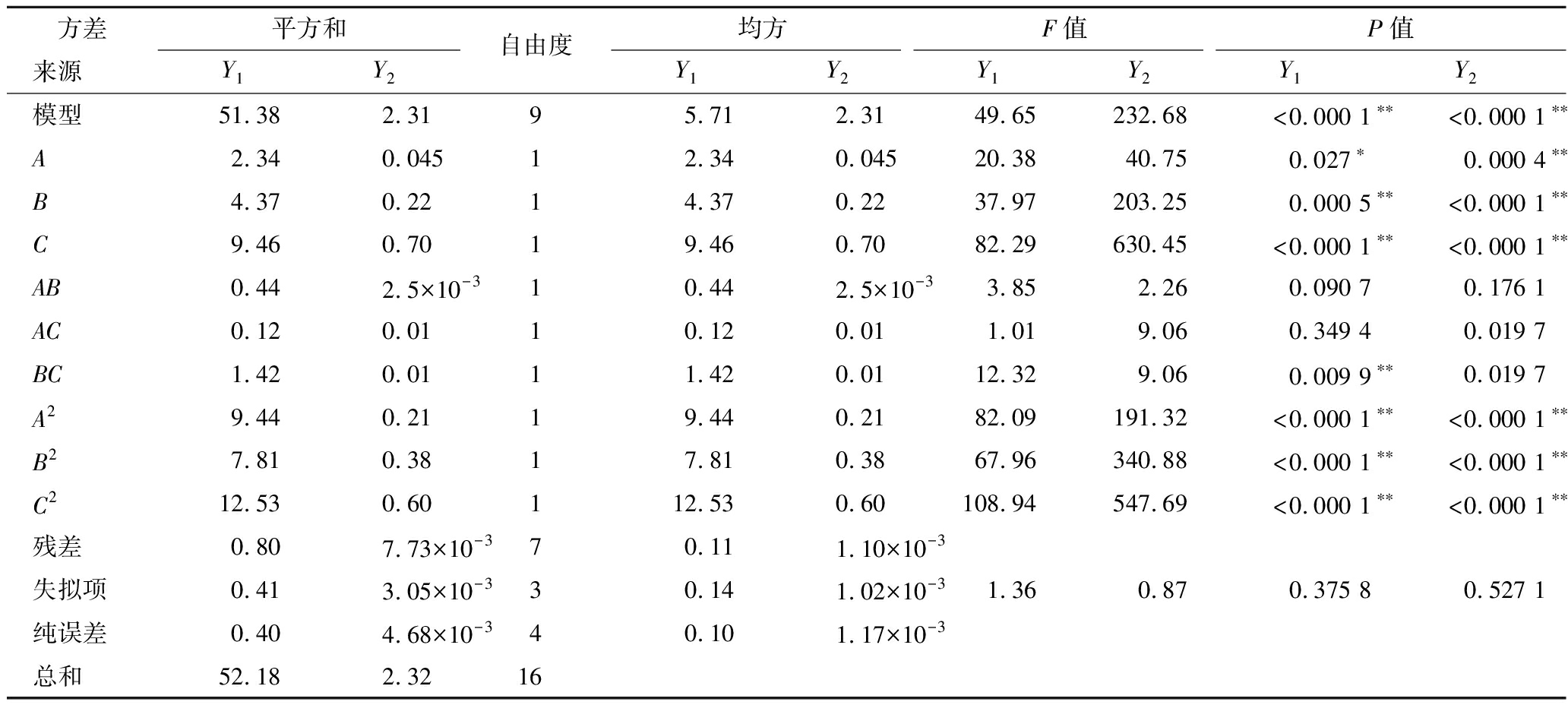
方差平方和自由度均方F值P值来源Y1Y2Y1Y2Y1Y2Y1Y2模型51.382.3195.712.3149.65232.68<0.000 1∗∗<0.000 1∗∗A2.340.04512.340.04520.3840.750.027∗0.000 4∗∗B4.370.2214.370.2237.97203.250.000 5∗∗<0.000 1∗∗C9.460.7019.460.7082.29630.45<0.000 1∗∗<0.000 1∗∗AB0.442.5×10-310.442.5×10-33.852.260.090 70.176 1AC0.120.0110.120.011.019.060.349 40.019 7BC1.420.0111.420.0112.329.060.009 9∗∗0.019 7A29.440.2119.440.2182.09191.32<0.000 1∗∗<0.000 1∗∗B27.810.3817.810.3867.96340.88<0.000 1∗∗<0.000 1∗∗C212.530.60112.530.60108.94547.69<0.000 1∗∗<0.000 1∗∗残差0.807.73×10-370.111.10×10-3失拟项0.413.05×10-330.141.02×10-31.360.870.375 80.527 1纯误差0.404.68×10-340.101.17×10-3总和52.182.3216
注:*表示显著相关,P<0.05;**表示极显著相关,P<0.01

a-发酵温度与发酵时间对酸度的影响;b-发酵时间 与接种量对酸度的影响;c-发酵温度与接种量对酸度 的影响;d-发酵温度与发酵时间对活菌数的影响;e-发酵 时间与接种量对活菌数的影响;f-发酵温度与接种量对 活菌数的影响
图4 三因素交互作用对酸度和活菌数的影响
Fig.4 Effect of interaction of three factors on acidity and the number of viable bacteria
2.2.2 最佳发酵工艺的确定
通过Design-Expert 8.0.6 软件分析可得,发酵温度37.39 ℃、接种量5.21%、发酵时间12.35 h为最佳开菲尔发酵工艺条件。在此条件下,开菲尔藜麦发酵乳的酸度理论值为85.672 4 °T,活菌数对数值为9.367 93 lgCFU/mL。以试验可操作性为前提,设置工艺条件为发酵温度 37.4 ℃、接种量 5.2%、发酵时间12.4 h。为了检验响应面优化实验结果的准确性与可靠性,利用最优发酵条件进行3次重复性试验,实际测得藜麦浆的发酵酸度为85.62 °T(标准差值为1.394),活菌数对数值为9.33 lgCFU/mL(标准差值为0.027),其相对误差<0.05,说明该回归模型的拟合度较高,可以利用其优化藜麦浆的开菲尔发酵工艺。
2.3 体外消化模拟试验结果
2.3.1 黄酮和多酚含量的动态分析
消化过程中藜麦浓浆未发酵组、开菲尔藜麦发酵乳组和果蔬-开菲尔藜麦发酵乳混合组的黄酮和多酚变化如图5所示,由图5-a可知,藜麦浓浆未发酵组、开菲尔藜麦发酵乳组、果蔬-开菲尔藜麦发酵乳混合组消化后的黄酮含量分别为0.748、0.779、0.853 mg/mL,较消化前分别提高了0.605、0.555、0.515 mg/mL,存在显著性差异(P<0.05);由图5-b可知,藜麦浓浆未发酵组、开菲尔藜麦发酵乳组、果蔬-开菲尔藜麦发酵乳混合组消化后的多酚含量分别为3.256、8.487、10.361 mg/mL,较消化前分别提高了2.760、7.498、8.438 mg/mL,存在显著性差异(P<0.05)。发酵和消化过程促进样品黄酮和多酚的释放使得其含量有所增加,主要原因可能是发酵产生的代谢产物进一步形成酚类物质[24];蛋白酶和胰蛋白酶通过影响共价键的生成与断裂,使得黄酮类物质含量有所提高[25]。

a-黄酮含量;b-多酚含量
图5 体外消化过程中黄酮和多酚含量的动态分析
Fig.5 Dynamic analysis of flavonoids and polyphenols content during in vitro digestion
2.3.2 抗氧化结果分析
由图6可知,藜麦浓浆未发酵组、开菲尔藜麦发酵乳组和果蔬-开菲尔藜麦发酵乳混合组的DPPH自由基、羟自由基和超氧阴离子自由基清除率及铁还原力随时间的变化呈增长趋势。对于藜麦浓浆未发酵组而言,经过消化后其DPPH自由基、羟自由基和超氧阴离子自由基清除率及铁还原力为74.7%、53.5%、53.3%和0.602,较消化前分别提高了15.6%、15.1%、10.1%和0.152,存在显著性差异(P<0.05);对于开菲尔藜麦发酵乳组而言,经过消化后其DPPH自由基、羟自由基和超氧阴离子自由基清除率及铁还原力为80.8%、59.2%、61.0%和0.689,较消化前分别提高了15.7%、16.9%、11.6%和0.171,存在显著性差异(P<0.05);对于果蔬-开菲尔藜麦发酵乳混合组而言,经过消化后其DPPH自由基、羟自由基和超氧阴离子自由基清除率及铁还原力为85.6%、61.1%、65.1%和0.711,较消化前分别提高了13.8%、15.7%、11.4%和0.153,存在显著性差异(P<0.05)。在消化过程中,自由基清除率强弱顺序为果蔬-开菲尔藜麦发酵乳混合组、开菲尔藜麦发酵乳组、藜麦浓浆未发酵组,且各自抗氧化性均有所增强,原因可能是在发酵过程中,乳酸菌产生的代谢产物使得酚类物质由结合状态转变为游离状态,且有机酸的生成有效阻止了酚类物质的进一步分解[26];在消化过程中,酶通过水解蛋白质,从而使得与其结合的黄酮类物质进一步增多,而酚类和黄酮类物质是影响抗氧化特性的重要活性物质,故其抗氧化特性有所增加。
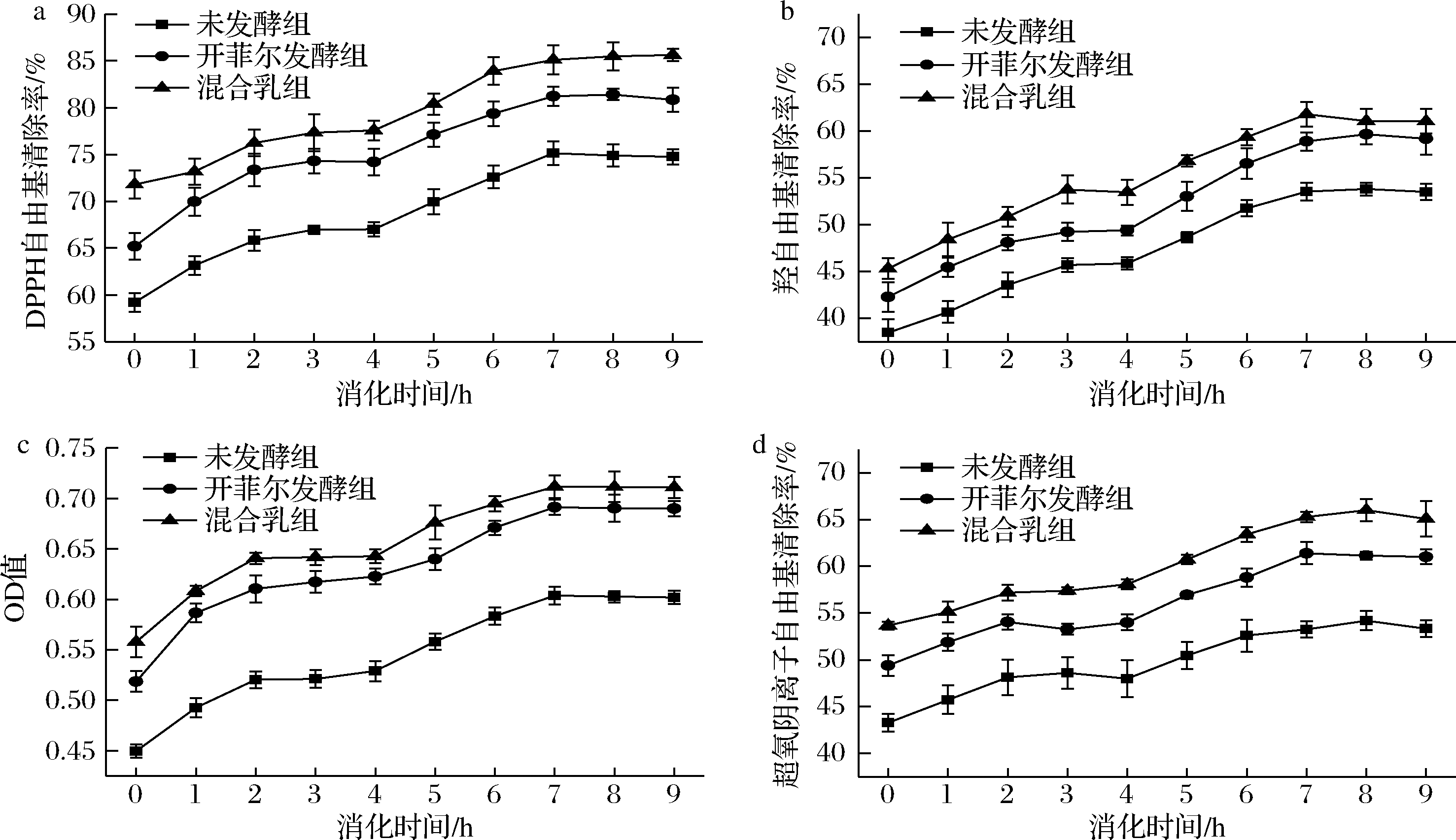
a-DPPH自由基清除率;b-羟自由基清除率;c-铁还原力;d-超氧阴离子自由基清除率
图6 体外消化过程中抗氧化能力的动态分析
Fig.6 Dynamic analysis of antioxidant capacity during in vitro digestion
3 结论
在单因素试验的基础上,通过响应面优化得出接种量5.2%、发酵时间12.4 h和发酵温度37.4 ℃为最佳工艺条件。通过体外消化模拟,对藜麦浓浆未发酵组、开菲尔藜麦发酵乳组和果蔬-开菲尔藜麦发酵乳混合组的多酚含量、黄酮含量和抗氧化性的动态变化进行分析,结果表明,经过消化后,3组的黄酮含量和多酚含量明显升高;果蔬-开菲尔藜麦发酵乳混合组的DPPH自由基、羟自由基和超氧阴离子自由基清除率及铁还原力比藜麦浆未发酵组分别高10.9%、7.6%、11.8%、0.190,比开菲尔藜麦发酵乳组分别高4.8%、1.9%、4.1%、0.022,且果蔬-开菲尔藜麦发酵乳混合组>开菲尔藜麦发酵乳组>藜麦浓浆未发酵组,故可知发酵和果蔬汁的加入均提高了藜麦浓浆的抗氧化特性,为开菲尔菌在谷物、果蔬领域的进一步研究应用奠定了扎实的基础。
[1] 崔蓉,王艳萍.藜麦及其他谷物的常规营养成分测定[J].现代食品,2019(16):111-113.
CUI R, WANG Y P. Determination of conventional nutritional components of quinoa and other grains[J]. Modern Food, 2019(16):111-113.
[2] 任贵兴,杨修仕,么杨.中国藜麦产业现状[J].作物杂志,2015(5):1-5.
REN G X, YANG X S, YAO Y. Current situation of quinoa industry in China[J]. Crops, 2015(5):1-5.
[3] 王艳萍,任婷,王童童.藜麦与燕麦、糙米等5种谷物营养成分的测定与比较[J].现代食品,2019(22):164-166.
WANG Y P, REN T, WANG T T.Determination and comparison of nutritive components of quinoa and other granis[J].Modern Food, 2019 (22):164-166.
[4] NAVRUZ-VARLI S N, SANLIER N.Nutritional and health benefits of quinoa (Chenopodium quinoa Willd.)[J].Journal of Cereal Science, 2016, 69:371-376.
[5] CIESAROV Z, MURKOVIC M,CEJPEK K,et al.Why is sea buckthorn (Hippophae rhamnoides L.) so exceptional? A review[J].Food Research International, 2020, 133:109170.
Z, MURKOVIC M,CEJPEK K,et al.Why is sea buckthorn (Hippophae rhamnoides L.) so exceptional? A review[J].Food Research International, 2020, 133:109170.
[6] 李春来.富含类胡萝卜素的黄桃脆片变温压差膨化干燥工艺优化及其贮藏稳定性研究[D].南京:南京师范大学,2018.
LI C L. Process optimization and storage stability of carotenoid-rich explosion-puffed yellow-fleshed peach crisps[D]. Nanjing: Nanjing Normal University, 2018.
[7] AGIRMAN B, SETTANNI L, ERTEN H.Effect of different mineral salt mixtures and dough extraction procedure on the physical, chemical and microbiological composition of Salgam:A black carrot fermented beverage[J].Food Chemistry,2021, 344:128618.
[8] 王雨,左永梅,周学永,等.藜麦萌发促进其活性成分的释放[J].现代食品科技,2020,36(8):126-133.
WANG Y, ZUO Y M, ZHOU X Y, et al. Quinoa germination promoted the release of its active ingredients[J]. Modern Food Science and Technology, 2020, 36(8):126-133.
[9] BHINDER S,KUMARI S,SINGH B, et al.Impact of germination on phenolic composition, antioxidant properties, antinutritional factors, mineral content and Maillard reaction products of malted quinoa flour[J].Food Chemistry,2021, 346:128915.
[10] ![]()
![]() H,ZAGRODZKI P, et al.Anthocyanins,total polyphenols and antioxidant activity in amaranth and quinoa seeds and sprouts during their growth[J].Food Chemistry,2009,115(3):994-998.
H,ZAGRODZKI P, et al.Anthocyanins,total polyphenols and antioxidant activity in amaranth and quinoa seeds and sprouts during their growth[J].Food Chemistry,2009,115(3):994-998.
[11] 邢慧雅. 响应面法优化藜麦发酵浓浆发酵工艺研究[D].太原:山西大学,2019.
XING H Y.Optimization of the fermentation process of quinoa fermented thick pulp by response surface methodology [D].Taiyuan:Shanxi University, 2019.
[12] 陈树俊,石玥,胡洁,等.响应面法优化萌发藜麦芽乳发酵工艺[J].食品科学,2017,38(16):64-70.
CHEN S J, SHI Y, HU J, et al. Process optimization by response surface methodology for the development of a beverage based on lactic acid fermentation of quinoa malt[J]. Food Science, 2017, 38(16):64-70.
[13] BOURRIE B C T, WILLING B P, COTTER P D.The microbiota and health promoting characteristics of the fermented beverage kefir[J].Frontiers in Microbiology, 2016,7:647.
[14] 付荣霞,周学永,肖建中,等.萌发温度与萌发时间对藜麦营养成分的影响[J].食品工业,2020,41(5):341-345.
FU R X, ZHOU X Y, XIAO J Z, et al.Effects of germination temperature and germination time on nutritional components of quinoa[J].The Food Industry, 2020,41 (5):341-345.
[15] 陈树俊,郑婕.响应面优化开菲尔粒发酵复合果蔬汁工艺及体外消化特性分析[J].食品研究与开发,2020,41(3):150-158.
CHEN S J, ZHENG J.Optimization of compound fruit and vegetable juice fermentation with kefir grain by response surface and analysis of digestion characteristics in vitro[J].Food Research and Development,2020,41(3):150-158.
[16] 李红艳,邓泽元,单斌.决明子蛋白质提取工艺研究及其体外消化率的测定[J].食品科技,2008,33(5):72-74.
LI H Y, DENG Z Y, SHAN B. Semen Cassiae′s protein extraction and its digestibility determination in vitro[J]. Food Science and Technology, 2008, 33(5):72-74.
[17] 王兴,黄忠明,王莉,等.苦荞蛋白模拟消化产物抗氧化活性及组成研究[J].中国食品学报,2009,9(6):10-15.
WANG X, HUANG Z M, WANG L, et al. The antioxidation activity and composition of Tartary buckwheat protein products produced by simulating gastrointestinal digestion[J]. Journal of Chinese Institute of Food Science and Technology, 2009, 9(6):10-15.
[18] 国家食品药品监督管理总局,国家卫生和计划生育委员会.GB 4789.35—2016 食品微生物学检验 乳酸菌检验[S].北京:中国标准出版社,2016.
State Food and Drug Administration, National Health and Family Planning Commission.GB 4789.35—2016 Food microbiology inspection and lactic acid bacteria inspection[S].Beijing:China Standards Press, 2016.
[19] 国家卫生和计划生育委员会.GB 5009.239—2016食品酸度的测定[S].北京:中国标准出版社,2016.
National Health and Family Planning Commission.GB 5009.239—2016 Determination of food acidity [S].Beijing:China Standard Press, 2016.
[20] 马艺超,路飞,马凤鸣,等.体外模拟消化对苦荞面包黄酮及抗氧化的影响[J].中国粮油学报,2019,34(9):20-27.
MA Y C, LU F, MA F M, et al. Effects of in vitro simulated digestion on flavonoids and antioxidants in Tartary buckwheat bread[J]. Journal of the Chinese Cereals and Oils Association, 2019, 34(9):20-27.
[21] 游新勇,崔利华,周亚丽,等.响应面法优化藜麦种子中多酚提取工艺[J].食品工业,2020,41(10):118-122.
YOU X Y, CUI L H, ZHOU Y L, et al. The optimization of extraction process of quinoa seeds polyphenols by response surface methodology[J]. The Food Industry, 2020, 41(10):118-122.
[22] 田建华,张春媛,魏璐.沙棘果渣总黄酮提取工艺优化及抗氧化活性研究[J].天然产物研究与开发,2021,33(1):65-72.
TIAN J H,ZHANG C Y,WEI L.Optimization of extraction process and antioxidant activity of total flavonoids from seabuckthorn pomace [J].Research and Development of Natural Products,2021,33(1):65-72.
[23] 陈树俊,罗佳.开菲尔发酵复合果蔬固体饮品的制备及体外功能研究[J].食品与机械,2020,36(4):196-201.
CHEN S J, LUO J. Preparation of solid drink with kefir fermented compound fruits and vegetables and its functions in vitro[J]. Food & Machinery, 2020, 36(4):196-201.
[24] SHAHATA N E, AZEEMA M A, MEKAWEY H M S, et al.Studying the effect of g-irradiated celery leaves on antioxidant status and cardiac enzymes in hypercholesterolemic rats[J].Indian Journal of Animal Research, 2018, 52(4):502-507.
[25] SUO H Y, QIAN Y, FENG X, et al.Free radical scavenging activity and cytoprotective effect of soybean milk fermented with Lactobacillus Fermentum[J].Journal of Food Biochemistry, 2016, 40(3):294-303.
[26] 赖婷,刘汉伟,张名位,等.乳酸菌发酵对果蔬中主要活性物质及其生理功能的影响研究进展[J].中国酿造,2015,34(3):1-4.
LAI T, LIU H W, ZHANG M W, et al. Effect of lactic acid bacteria fermentation on active components and physiological function of fruit and vegetable[J]. China Brewing, 2015, 34(3):1-4.