硒(Se)作为微量营养元素是多种蛋白质和酶必不可少的重要组成部分[1]。现代流行病学研究表明,低Se水平与癌症发病率增加之间存在关联,缺乏一定量Se的摄入会导致心脏病、甲状腺功能减退和免疫系统减弱[2]。联合国粮食和农业组织(Food and Agriculture Organization of the United Nations,FAO)/世界卫生组织(World Health Organization,WHO)制定了成年人的膳食Se供给量为50~250 μg/d[3],而我国有72%的地区处于缺Se状态,因此,开发富Se农产品具有广阔的发展前景和应用价值。然而,FAO/WHO也同时制定了成年人膳食Se的最高安全摄入量为400 μg/d。大量摄入Se将产生剧毒已受到关注[4],尽管确切的分子和生理机制尚未被完全揭示,但Se摄入过量可能会对造血系统、肺、肾、肝、膀胱和中枢神经系统产生致癌作用[5]。为避免低浓度Se和高浓度Se产生的不利影响,准确测定富Se农产品中总Se含量具有重要意义。
目前,测定食品中Se含量的分析方法主要有原子荧光光谱(atomic fluorescence spectrometry,AFS)法[6-8]、原子吸收光谱(atomic absorption spectroscopy,AAS)法[9-11]、电感耦合等离子体发射光谱(inductively coupled plasma optical emission spectrometer,ICP-OES)法和电感耦合等离子体质谱(inductively coupled plasma massspectrometry,ICP-MS)法[12-15]。Se具有较高的第一电离能(9.75 eV),即使在高温电感耦合等离子体(inductively coupled plasma,ICP)中其电离度也不高,虽然采用ICP-MS可以直接测定食品中的Se,但Se的所有同位素均会受到多种质谱干扰,必须使用碰撞/反应池的反应模式并选择合适的同位素才能获得较好的准确度和灵敏度[16];采用AFS、AAS和电感耦合等离子体-原子发射光谱(inductively coupled plasma-atomic emission spectrometry,ICP-AES)直接测定富Se农产品中总Se含量通常不能获得足够的灵敏度,由于Se的氢化物能更加有效地运输、雾化和激发,与传统的液体雾化进样技术相比,能大幅度降低Se的检出限(limit of detection,LOD)。因此,采用AFS、AAS和ICP-AES进行Se的测定,最有效的方法是利用氢化物发生(hydride generation,HG)将Se还原为挥发性氢化物H2Se后进行测定。然而,与使用高纯Ar气的ICP-OES、ICP-MS和AFS以及使用可燃性气体的AAS相比,采用N2为等离子体气源的微波等离子体原子发射光谱(microwave plasma atomic emission spectrometry,MP-AES)具有低成本优势,此外,MP-AES可提供与ICP-OES相媲美的分析性能,并且可避免使用可燃和氧化性气体带来的风险[17-19],更适合气体购买困难或运输不便的偏远地区实验室使用。本研究采用MP-AES测定富Se农产品中总Se含量,利用多模式样品导入系统(multimode sample introduction system,MSIS)的氢化物发生模式使Se发生氢化反应,提出了在线使用L-半胱氨酸/酒石酸为预还原剂提高Se(Ⅳ)还原效率从而提高氢化物发生效率的新策略,以期为富Se农产品中总Se含量的低成本准确测定提供高灵敏分析方法。
1 材料与方法
1.1 材料和试剂
100 mg/L的Se单元素标准储备溶液,国家标准物质中心;NaOH(AR)、NaBH4(AR)、L-半胱氨酸(BR)、酒石酸(AR),国药集团化学试剂有限公司;65%(质量分数)硝酸(亚沸蒸馏提纯)、30%(质量分数)双氧水、37%(体积分数)盐酸,德国Merck公司;柑橘叶成分分析标准物质(GBW10020)、蒜粉成分分析标准物质(GBW10022)、扇贝成分分析标准物质(GBW10024),中国地质科学院地球物理地球化学勘查研究所;富Se农产品样品(大米(产地重庆)、小麦(产地重庆)、茶叶(产地重庆)、玉米(产地重庆)、大蒜(产地山东)、小米(产地青海)、大豆(产地黑龙江)、黑木耳(产地黑龙江),大型超市;实验用水为电阻率大于18.2 MΩ·cm的超纯水。
1.2 仪器与设备
Agilent 4200微波等离子体原子发射光谱仪(配备MSIS雾化室、4107 氮气发生器和SPS 3自动进样器),美国Agilent公司;MARs 5微波消解系统,美国CEM公司;泰斯特FZ102微型植物粉碎机,天津泰斯特仪器有限公司;Milli-Q超纯水机,美国Millipore公司。
1.3 实验方法
1.3.1 工作条件
MP-AES工作条件:雾化气流量,0.35 L/min;等离子体观测位置,0;泵速,20 r/min;读数时间,5 s;重复次数,3次;样品吸入延迟时间,20 s;冲洗时间,40 s;稳定时间,30 s;Se分析波长,196.026 nm;背景校正,FLIC。
微波消解系统工作条件:(1)最大输出功率1 600 W,爬升时间3 min,控制温度100 ℃,保持时间3 min;(2)最大输出功率1 600 W,爬升时间7 min,控制温度150 ℃,保持时间3 min;(3)最大输出功率1 600 W,爬升时间5 min,控制温度170 ℃,保持时间3 min;(4)最大输出功率1 600 W,爬升时间5 min,控制温度190 ℃,保持时间10 min。
1.3.2 样品前处理
将收集的8种富Se农产品(大米、小麦、茶叶、玉米、大蒜、小米、大豆、黑木耳)用超纯水清洗干净,沥干水分后于80 ℃烘干至恒重,用微型植物粉碎机粉碎过40目筛,密封保存于干燥器中待用。
准确称取0.5 g样品于微波消解系统反应罐内,加入少量超纯水润湿后,依次加入65%(质量分数)硝酸5 mL和30%(质量分数)双氧水2 mL,浸泡过夜,按微波消解系统工作条件消解后,转入锥形烧瓶中在电热板上低温赶酸至近干,用35%(体积分数)的盐酸将消解液转移至25 mL容量瓶中定容,摇匀后待测。采用与样品相同的处理方式对标准溶液、标准参考物质和空白溶液进行处理。
1.3.3 MP-AES分析
MSIS雾化室的氢化物模式见图1。由于仅需分析氢化物元素Se,将分析非氢化物元素的进样通道用堵头密封,样品溶液与预还原剂2%(质量分数,下同)L-半胱氨酸/4%(质量分数,下同)酒石酸在进入MSIS雾化室之前利用三通接头混合,经制成线圈的毛细管均匀混合后进入MSIS底部,还原剂1.5%(质量分数,下同)NaBH4/0.5%(质量分数,下同)NaOH溶液经蠕动泵顶部通道进入MSIS顶部,在雾化室中样品中的Se与NaBH4反应生成H2Se后进入MP-AES,采用标准加入法进行分析。
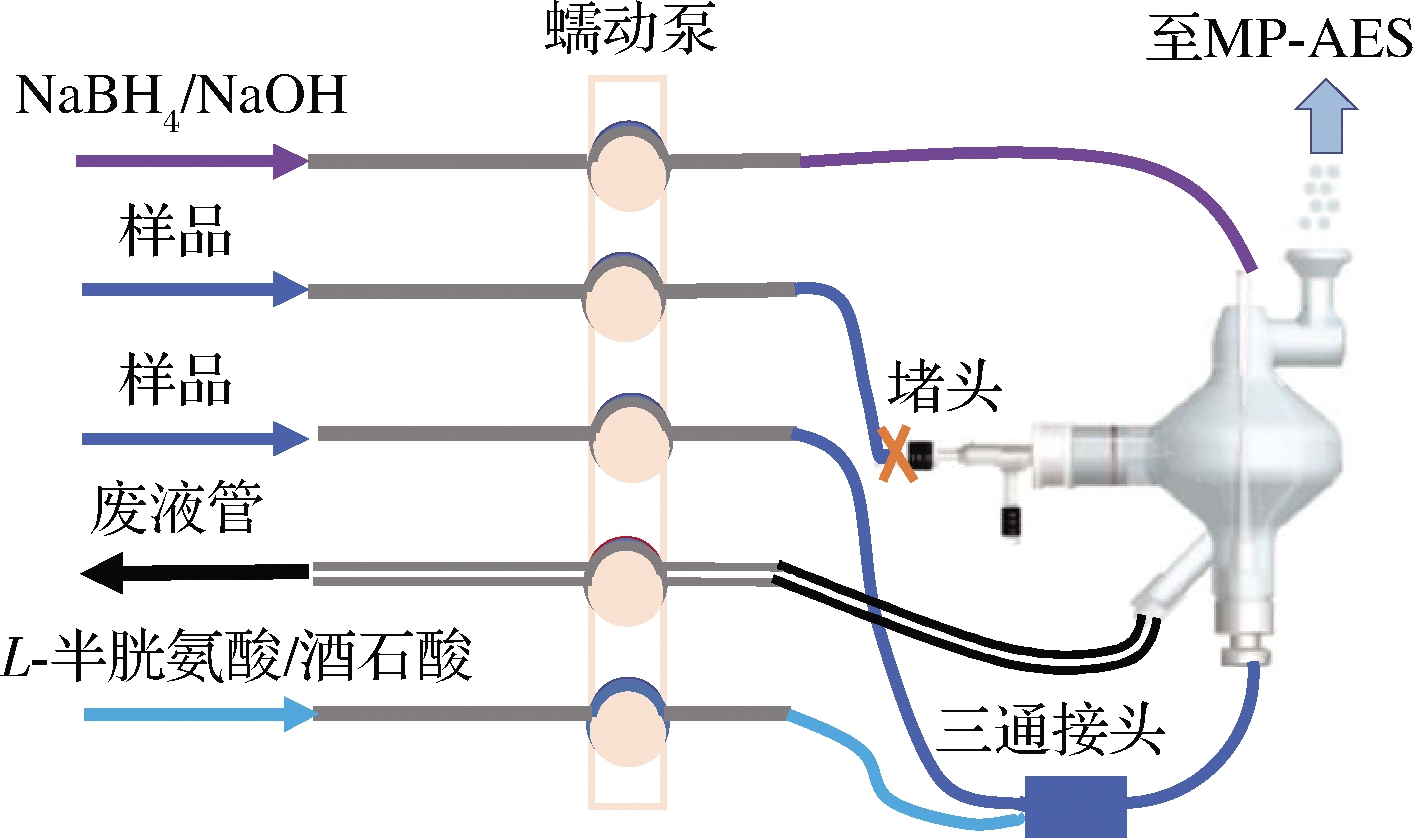
图1 用于氢化物模式的多模式样品导入系统
Fig.1 Multimode sample introduction system for hydride mode
1.3.4 数据处理
所有实验数据均采用MP-AES自带的MP Expert 软件进行处理。
2 结果与分析
2.1 氢化物发生条件优化
元素Se的氢化产物H2Se含2对孤对电子,为四面体结构的极性分子,需产生于较强酸性的极性溶液中[20]。Se通常以稳定的高价态Se(Ⅵ)而存在,Se(Ⅵ)不易形成H2Se,需先将Se(Ⅵ)还原为低价Se(Ⅳ),然后采用NaBH4与Se(Ⅳ)反应生成![]() 盐酸兼具酸化和还原双重作用,成为Se(Ⅵ)还原为Se(Ⅳ)的常用试剂。本实验考察了不同盐酸添加量对发射信号强度的影响,结果见图2-a。由图2-a可以看出,低添加量盐酸(10%~25%,体积分数,下同)对于提高Se的信号强度不明显,随着盐酸添加量在25%~50%范围内变化,受H+同离子效应的作用抑制了H2Se的电离分解,Se的信号强度逐渐增大;当盐酸添加量超过50%后,由于酸碱反应及NaBH4分解加剧生成大量水蒸气,而H2Se非常活泼,具有极强的还原性,能还原水蒸气产生H2(H2Se+H2O → H2↑+H2O2+Se↓)从而导致信号强度下降。同时,高浓度盐酸具有腐蚀性,影响仪器的使用寿命。因此,本实验选择35%盐酸作为样品酸化和预还原介质。为补偿信号损失,通过在线加入由2% L-半胱氨酸和4%酒石酸组成的预还原剂,使样品中的Se始终处于稳定的还原态,提高Se的氢化效率,改善测定灵敏度。
盐酸兼具酸化和还原双重作用,成为Se(Ⅵ)还原为Se(Ⅳ)的常用试剂。本实验考察了不同盐酸添加量对发射信号强度的影响,结果见图2-a。由图2-a可以看出,低添加量盐酸(10%~25%,体积分数,下同)对于提高Se的信号强度不明显,随着盐酸添加量在25%~50%范围内变化,受H+同离子效应的作用抑制了H2Se的电离分解,Se的信号强度逐渐增大;当盐酸添加量超过50%后,由于酸碱反应及NaBH4分解加剧生成大量水蒸气,而H2Se非常活泼,具有极强的还原性,能还原水蒸气产生H2(H2Se+H2O → H2↑+H2O2+Se↓)从而导致信号强度下降。同时,高浓度盐酸具有腐蚀性,影响仪器的使用寿命。因此,本实验选择35%盐酸作为样品酸化和预还原介质。为补偿信号损失,通过在线加入由2% L-半胱氨酸和4%酒石酸组成的预还原剂,使样品中的Se始终处于稳定的还原态,提高Se的氢化效率,改善测定灵敏度。
在酸性条件下,NaBH4作为还原剂与酸反应为氢化物发生提供氢源,考察了不同NaBH4添加量对发射信号强度的影响,结果见图2-b。由图2-b可以看出,随着NaBH4添加量的增大,Se的信号强度也逐渐增大,当NaBH4添加量超过1.0%后,Se的信号强度趋于稳定,当NaBH4添加量达到2.0%后,Se的信号强度开始下降。因此,本实验选择1.5% NaBH4溶液为还原介质,并加入0.5%的NaOH作稳定剂。
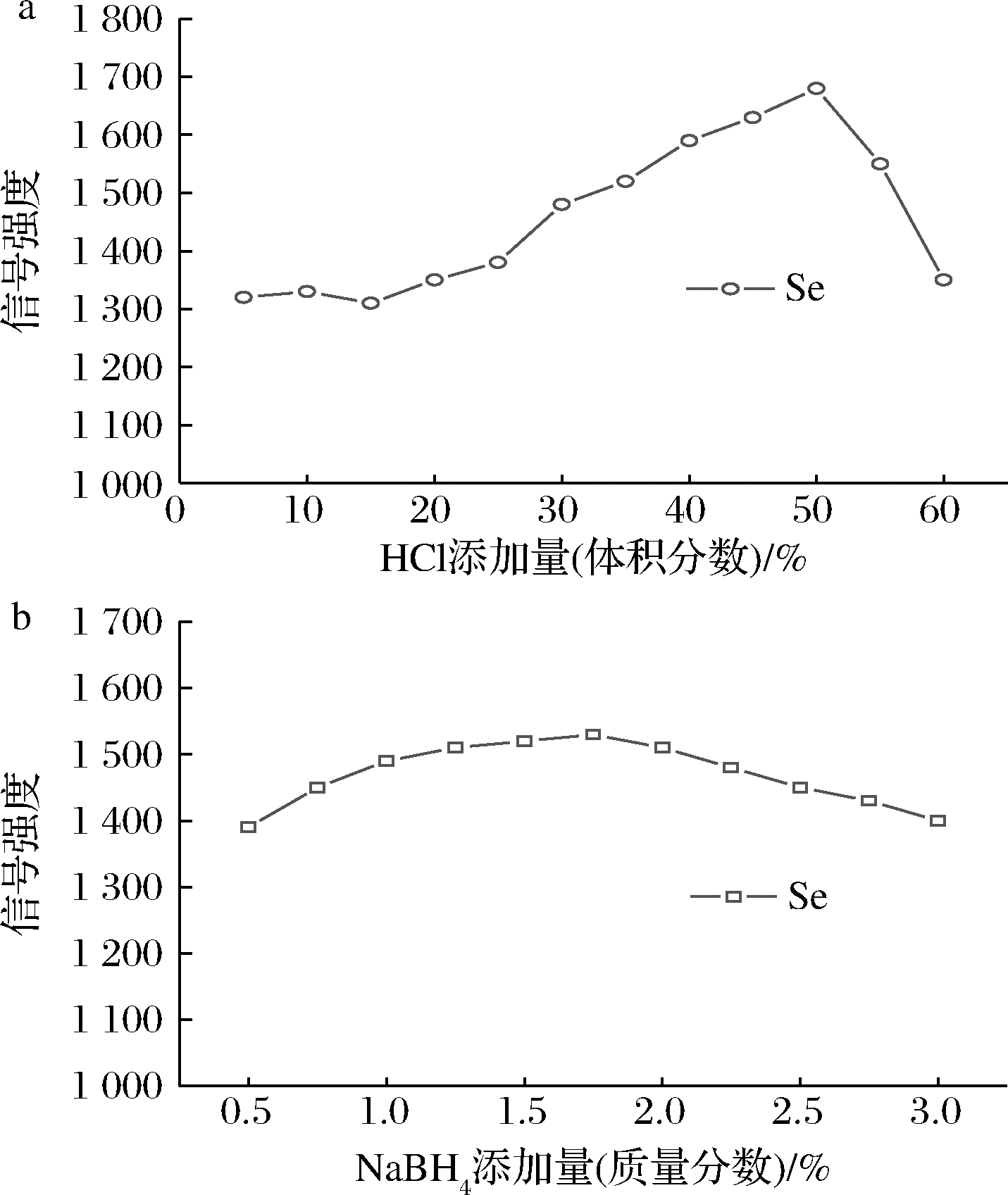
图2 氢化物发生反应条件对Se信号强度的影响
Fig.2 Effect of hydride generation reaction conditions on Se signal intensity
2.2 MP-AES工作条件优化
为适应复杂基质体系的分析,MP-AES采用垂直观测方式,不同分析元素的观测位置可能会偏离中心观测点以获得更高的灵敏度和更好的检出限。本实验考察了Se在不同观测位置信背比(分析信号强度与背景信号强度的比值,SBR)的变化情况,通过选择最大SBR来确定等离子体观测位置。由图3-a可以看出,Se的最大SBR位于等离子体中心观测位置,表明Se的观测位置没有发生偏移,本实验选择Se的观测位置为中心观测点0的位置。Se属于难电离元素,而微波等离子体(microwave plasma,MP)的工作温度比ICP低,意味着Se在MP中的电离效率比ICP更低,需要优化雾化气流量来提高Se的分析灵敏度,不同雾化气流量下Se的SBR见图3-b。由图3-b可以看出,当雾化气流量为0.35 L/min时所对应的SBR值最大。因此,本实验确定Se的最佳雾化气流量为0.35 L/min。
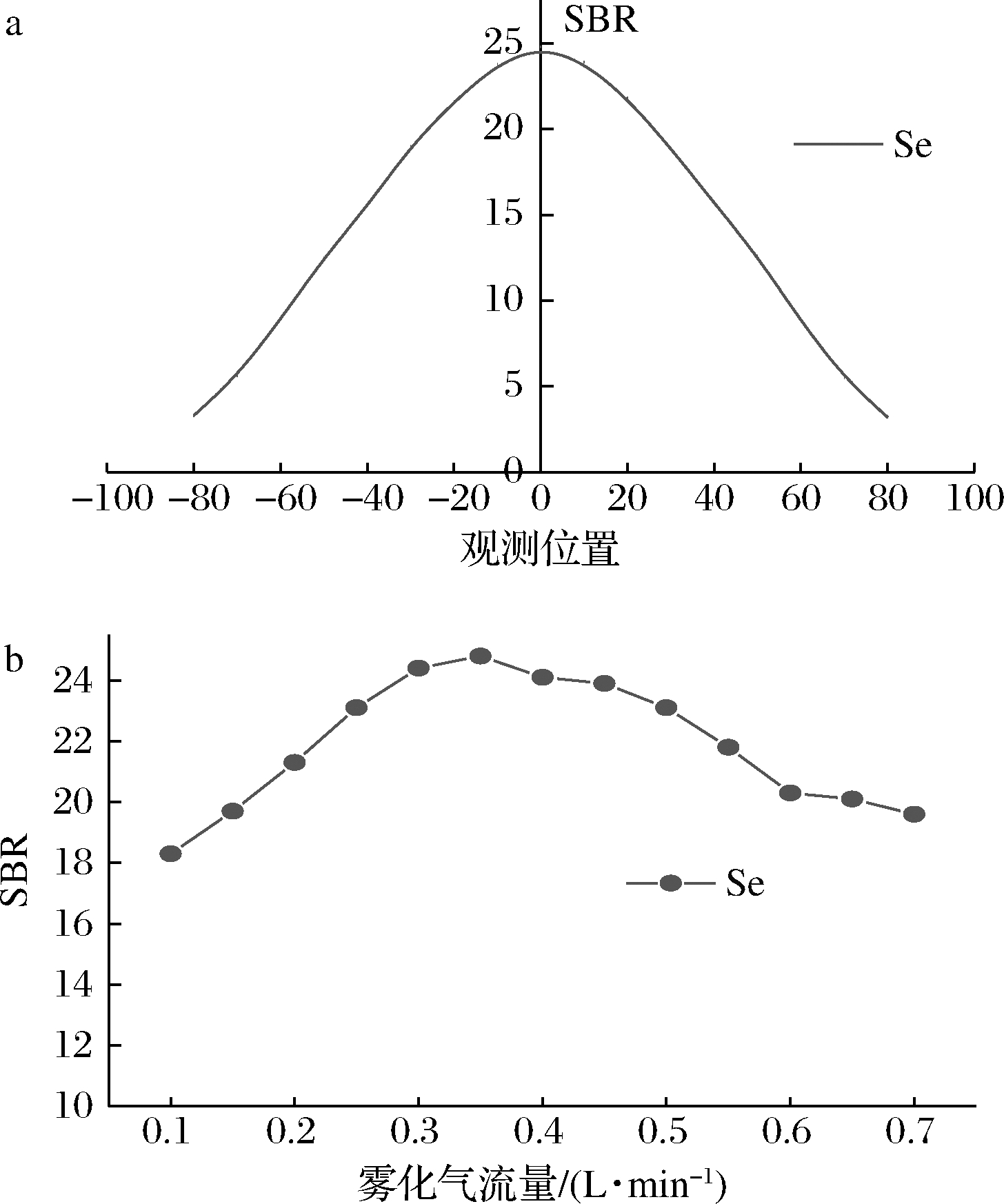
图3 MP-AES的观测位置和雾化气流量对Se信背比 的影响
Fig.3 Effect of viewing position and nebulizer gas flow in MPAES on signal to background ratio of Se
2.3 光谱干扰与校正
MP-AES采用N2为气源的磁激发等离子体,其等离子体温度为5 000 K左右,远低于ICP温度。因此,MP不能诱导Se完全电离,所产生发射光谱线的数量比ICP-OES少很多,可供选择用于测定食品中Se元素分析特征的光谱线非常有限。通过自动调用Se的预设波长,扫描不同浓度的Se标准溶液和样品溶液发现,在196.026 nm处得到了对称且无干扰的Se峰。因此,本实验选择196.026 nm为Se的分析波长,不仅保证了分析灵敏度,而且避开了谱线重叠干扰。
由于Se经氢化物发生反应与基质分离,所受到的基体效应以及基质成分影响所产生的背景干扰均可以忽略不计。然而,受MP光源本身所发射强烈杂散光的影响所产生的背景干扰仍然影响分析结果的准确性。本实验选择快速线性干扰校正(fast linear interference correction,FLIC)技术,分别测定空白溶液、Se标准溶液的响应信号,通过高级光谱建模技术从原始光谱中自动分离出Se信号,从而校正背景干扰。
2.4 方法的分析性能评价
2.4.1 方法线性关系与检出限
采用100 mg/L的Se单元素标准储备溶液配制0、5、20、50、100 μg/L的系列工作标准溶液,经MP-AES进行测定,得到Se的校准曲线方程为Y = 41.3X +0.15[其中:Y为信号强度,X为Se浓度(μg/L)],线性相关系数为0.999 8,表明方法具有良好的线性关系。取连续测定11次空白溶液信号强度的3倍标准偏差所对应的浓度得到Se的LOD为0.58 μg/L,明显低于已有类似研究的文献报道[21]。
2.4.2 方法准确性与精密度
为考察本方法的准确性和精密度,分别采用本法和国标GB 5009.93—2017的ICP-MS法[22]对国家标准参考物质柑橘叶(GBW10020)、蒜粉(GBW10022)、扇贝(GBW10024)进行测定,每个样品重复测定6次,计算相对标准偏差(RSD),结果见表1。采用本方法测定值与国家标准参考物质的认证值基本一致,并且与国标法的测定结果相吻合,RSD为2.3%~5.6%,验证了本方法具有良好的准确度和精密度。
表1 国家标准参考物质的分析结果(n=6)
Table 1 Analysis results of national standard reference materials (n=6)
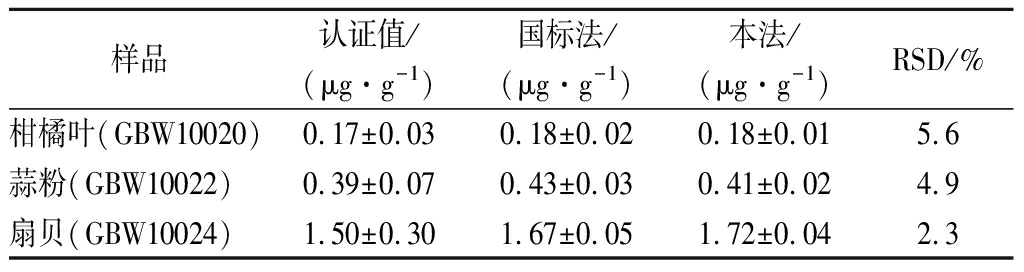
样品认证值/(μg·g-1)国标法/(μg·g-1)本法/(μg·g-1)RSD/%柑橘叶(GBW10020)0.17±0.030.18±0.020.18±0.015.6蒜粉(GBW10022)0.39±0.070.43±0.030.41±0.024.9扇贝(GBW10024)1.50±0.301.67±0.051.72±0.042.3
2.5 富硒农产品分析
采用本方法和GB 5009.93—2017的ICP-MS法[22]分别测定了8种富Se农产品(大米、小麦、茶叶、玉米、大蒜、小米、大豆、黑木耳)中总Se含量,每个样品重复测定6次。由表2可见,本法与国标法的测定结果基本一致,不同富Se农产品中总Se含量差别很大,农产品中总Se含量主要取决于其生长的富Se环境。本实验8个富Se农产品中总Se含量为0.11~1.84 μg/g,总Se含量从大到小的排列顺序为:富Se茶叶>富Se玉米>富Se大豆>富Se大蒜>富Se小米>富Se黑木耳>富Se小麦>富Se大米。采用本方法测定富Se大米、富Se小麦、富Se茶叶、富Se小米、富Se黑木耳中Se含量与采用ICP-MS法的测定结果处于同一数量级[23-27],富Se大蒜、富Se大豆中Se含量与采用HG-AFS法的测定结果处于同一数量级[28-29],富Se玉米中Se含量与AAS法的测定结果处于同一数量级[30],表明本方法完全能替代ICP-MS、HG-AFS和AAS法用于富Se农产品中总Se的测定。
表2 富硒农产品中Se的分析结果(n=6)
Table 2 Results obtained for analytes selenium-enriched agricultural products (n=6)
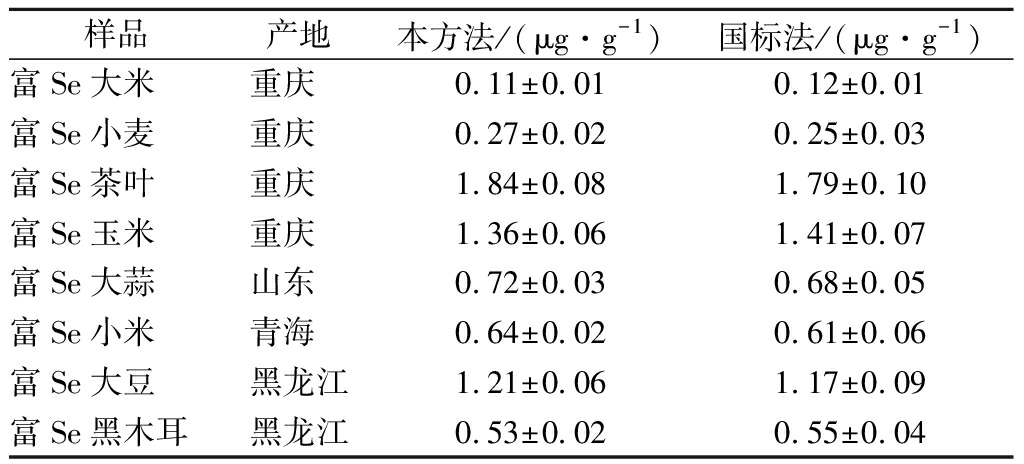
样品产地本方法/(μg·g-1)国标法/(μg·g-1)富Se大米重庆 0.11±0.010.12±0.01富Se小麦重庆 0.27±0.020.25±0.03富Se茶叶重庆 1.84±0.081.79±0.10富Se玉米重庆 1.36±0.061.41±0.07富Se大蒜山东 0.72±0.030.68±0.05富Se小米青海 0.64±0.020.61±0.06富Se大豆黑龙江1.21±0.061.17±0.09富Se黑木耳黑龙江0.53±0.020.55±0.04
3 结论
利用MP-AES法准确测定了富Se农产品中总Se的含量。富Se农产品经微波消解后在MSIS的氢化物模式下将Se转化为H2Se进行测定。通过在线加入预还原剂L-半胱氨酸/酒石酸,提高了Se的氢化效率,选择Se在196.026 nm的光谱线为分析线并结合FLIC技术校正了光谱干扰,Se的LOD为0.58 μg/L。采用所建立的方法分析了八类富Se农产品,总Se的含量为0.11~1.84 μg/g。本研究利用MSIS替代专用氢化物发生装置,使用自带的N2发生器为MP提供气源,方法具有灵敏度高、安全可靠和运行成本低的优势,大批量样品连续快速测量的分析特性,为富Se农产品中总Se含量的测定提供了高通量分析方法。
[1] CARDOSO B R, HARE D J, BUSH A I, et al.Selenium levels in serum, red blood cells, and cerebrospinal fluid of Alzheimer′s disease patients:A report from the Australian imaging, biomarker & lifestyle flagship study of ageing (AIBL)[J].Journal of Alzheimer’s Disease, 2017, 57:183-193.
[2] RAYMAN M P.Selenium and human health[J].Lancet, 2012, 379:1 256-1 268.
[3] Food and Nutrition Board, Institute of Medicine.Dietary Reference Intakes from Vitamin C, Vitamin E, Selenium and Carcinoids[M].New York:National Academic Press, 2000.
[4] LIU L, YUN Z, HE B, et al.Efficient interface for online coupling of capillary electrophoresis with inductively coupled plasma-mass spectrometry and its application in simultaneous speciation analysis of arsenic and selenium[J].Analytical Chemistry, 2014, 86(16):8 167-8 175.
[5] MICKE O, SCHOMBURG L, BUENTZEL J, et al.Selenium in oncology:From chemistry to clinics[J].Molecules, 2009, 14:3 975-3 988.
[6] 施怡, 胡兴锁, 潘亚璐, 等.富硒双孢蘑菇硒形态分布及其营养品质和抗氧化特性[J].食品科学, 2017, 38(9):99-105.
SHI Y, HU X S, PAN Y L, et al.Selenium speciation distribution, nutritional quality and antioxidant activity of Se-enriched Agaricus bisporus[J].Food Science, 2017, 38(9):99-105.
[7] DA SILVA D L F, DA COSTA M A P, SILVA L O B, et al.Simultaneous determination of mercury and selenium in fish by CVG AFS[J].Food Chemistry, 2019, 273:24-30.
[8] MAZEJ D, FALNOGA I, VEBER M, et al.Determination of selenium species in plant leaves by HPLC-UV-HG-AFS[J].Talanta, 2006, 68(3):558-568.
[9] SHALTOUT A A, BOUSLIMI J, BESBES H.The challenges of Se quantification in bean samples using line and continuum sources atomic absorption spectrometry[J].Food Chemistry, 2020, 328:127 124.
[10] 邓世林, 李新凤, 郭小林.流动注射氢化物发生原子吸收光谱法测定禽蛋中的硒[J].光谱学与光谱分析, 2010, 30(3):809-811.
DENG S L, LI X F, GUO X L.Determination of selenium in poultry eggs by flow injection-hydride generation-atomic absorption spectrometry[J].Spectroscopy and Spectral Analysis, 2010, 30(3):809-811.
[11] GHASEMI E, NAJAFI N M, RAOFIE F, et al.Simultaneous speciation and preconcentration of ultra traces of inorganic tellurium and selenium in environmental samples by hollow fiber liquid phase microextraction prior to electrothermal atomic absorption spectroscopy determination[J].Journal of Hazardous Materials, 2010, 181(1-3):491-496.
[12] ESCUDERO L A, PACHECO P H, GASQQUEZ J A, et al.Development of a FI-HG-ICP-OES solid phase preconcentration system for inorganic selenium speciation in Argentinean beverages[J].Food Chemistry, 2015, 169:73-79.
[13] 黄小兰, 何旭峰, 周祥德, 等.不同产地地参中22种元素的测定与分析[J].食品与发酵工业, 2020, 46(20):229-235.
HUANG X L, HE X F, ZHOU X D, et al.Determination and analysis of 22 elements in Lycopus lucidus var.hirtus Regel from different habitats[J].Food and Fermentation Industries, 2020, 46(20):229-235.
[14] ALTUNAY N, GURKAN L R.Determination of sub-ng g-1 levels of total inorganic arsenic and selenium in foods by hydride-generation atomic absorption spectrometry after pre-concentration[J].Food Additives & Contaminants:Part A, 2017, 34(3):390-403.
[15] BAMONTI L, THEINER S, ROHR-UDILOVA N, et al.Accurate high throughput quantification of selenium in biological samples-the potential of combining isotope dilution ICP-tandem mass spectrometry with flow injection[J].Journal of Analytical Atomic Spectrometry, 2016, 31(11):2 227-2 232.
[16] HU X, CAO Z, SUN W, et al.Accurate determination of arsenic and selenium in plant food samples by using ICP-MS/MS[J].Analytical Methods, 2016, 8(32):6 150-6 157.
[17] TANABE C K, HOPFER H, GILLELANG G, et al.Total arsenic analysis in Californian wines with hydride generation-microwave plasma-atomic emission spectroscopy (HG-MP-AES)[J].Journal of Analytical Atomic Spectrometry, 2016, 31(6):1 223-1 227.
[18] ZHAO Y, LI Z, ROSS A, et al.Determination of heavy metals in leather and fur by microwave plasma-atomic emission spectrometry[J].Spectrochimica Acta Part B:Atomic Spectroscopy, 2015, 112:6-9.
[19] 张萍, 刘宏伟.微波等离子体原子发射光谱法测定食用坚果油中的金属元素[J].食品与发酵工业, 2020, 46(18):215-218.
ZHANG P, LIU H W.Determination of metal elements in edible nut oil by microwave plasma atomic emission spectroscopy[J].Food and Fermentation Industries, 2020, 46(18):215-218.
[20] 戴亚明. 硒、碲氢化物发生的反应机理和反应条件[J].理化检验-化学分册, 2007, 43(11):901-905.
DAI Y M.Mechanism and conditions for the hydride formation reactions of selenium and tellurium[J].Physical Testing and Chemical Analysis Part B:Chemical Analysis, 2007, 43(11):901-905.
[21] 杨熙, 潘佳钏, 雷永乾, 等.微波等离子体发射光谱法同时测定特色南药中多种元素[J].分析测试学报, 2015, 34(2):227-231.
YANG X, PAN J C, LEI Y Q, et al.Simultaneous determination of multiple elements in characteristic south China herbal medicine by microwave plasma atomic emission spectrometry[J].Journal of Instrumental Analysis, 2015, 34(2):227-231.
[22] 中华人民共和国国家卫生和计划生育委员会. GB 5009.93—2017 食品安全国家标准 食品中硒的测定[S].北京:中国标准出版社, 2017.
National Health and Family Planning Commission of the People′s Republic of China.GB 5009.93—2017 National food safety standard Determination of selenium in foods[S].Beijing:Standards Press of China, 2017.
[23] 邹春苗, 刘静晶, 廖雪, 等.电感耦合等离子体质谱法和氢化物原子荧光光谱法测定富硒大米中硒含量的对比分析[J].食品安全质量检测学报, 2020, 11(4):1 231-1 234.
ZOU C M, LIU J J, LIAO X, et al.Comparative analysis of determination of selenium in selenium-enriched rice by inductively coupled plasma mass spectrometry and hydride generation-atomic fluorescence spectrometry[J].Journal of Food Safety & Quality, 2020, 11(4):1 231-1 234.
[24] 赵萍, 刘笑笑, 王雅, 等.富硒小麦提取物中硒含量及其抗氧化特性[J].食品科学, 2014, 35(15):94-98.
ZHAO P, LIU X X, WANG Y, et al.Selenium content and antioxidant activity of selenium-enriched wheat[J].Food Science, 2014, 35(15):94-98.
[25] 梁克红, 卢林纲, 朱大洲, 等.我国小米硒含量情况及富硒化研究进展[J].中国食品学报, 2020, 20(7):337-343.
LIANG K H, LU L G, ZHU D Z, et al.Research progress of selenium content and selenium enrichment in millet of China[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(7):337-343.
[26] 孙向东, 兰静, 张瑞英, 等.我国普通和富硒黑木耳及香菇硒含量分析[J].农产品质量与安全, 2021(1):38-41.
SUN X D, LAN J, ZHANG R Y, et al.Analysis of selemium content in common and selenium enriched Auricularia auricular and Lentinus edodes in China[J].Quality and Safety of Agro-Products, 2021(1):38-41.
[27] 林毅韵, 李琼, 朱家俊, 等.超级微波-电感耦合等离子体质谱法鉴定富硒茶叶真伪[J].食品安全质量检测学报, 2019, 10(13):4 256-4 260.
LIN Y Y, LI Q, ZHU J J, et al.Identification of rich-selenium tea authenticity by ultra-microwave digestion-inductively coupled plasma mass spectrometry[J].Journal of Food Safety & Quality, 2019, 10(13):4 256-4 260.
[28] 唐荣, 李亚妮, 王鸿赋, 等.三个不同省份富硒大蒜硒含量分析[J].中国食物与营养, 2020, 26(9):26-31.
TANG R, LI Y N, WANG H F, et al.Analysis on selenium content of selenium-enriched garlic in three different provinces[J].Food and Nutrition in China, 2020, 26(9):26-31.
[29] 杨玉玲, 刘元英.富硒大豆中硒的分布研究[J].大豆科学, 2014, 33(4):610-612.
YANG Y L, LIU Y Y.Study on the distribution of selenium in selenite-enrich soybean[J].Soybean Science, 2014, 33(4):610-612.
[30] 张驰, 刘信平, 周大寨, 等.营养元素硒在富硒玉米中的赋存形态及分布研究[J].食品研究与开发, 2007, 28(9):25-27.
ZHANG C, LIU X P, ZHOU D Z, et al.Study on the distribution and combined forms of microelement selenium in corn[J].Food Research and Development, 2007, 28(9):25-27.