二元羧酸在工业领域有着极其重要的地位和作用,包括有机物的合成、化工制造、工业生产、食品医药、农业生产等方面都具有广泛的应用价值,以二元羧酸为原料生产的各种产品也为我们的日常生活带来诸多便利[1-4]。目前,直链二元羧酸产品大多是由石油基经化学工艺生产的,尽管这些工艺能够以相对较低的成本生产出各种各样日常所需的化工产品,但这种生产方法的原料来源有限并且对环境存在不利影响,本质上不能长久维持,从长远来看不具有可持续性[5-6]。随着二元羧酸的全球需求量日益增加,国内国际上对自然环境保护力度日益加大,利用微生物合成过程取代石油生产过程的理念逐渐得到广泛关注。微生物合成法旨在利用可再生资源高效绿色源源不断地生产人类所需产品,具有广阔的发展前景。
根据二元羧酸碳链的长短可将其分为短链二元羧酸(C2~C3)、中链二元羧酸(C4~C10)和长链二元羧酸(C11~C18)。目前国内外对中链二元羧酸发酵法生产的研究中,丁二酸合成的研究最为深入,对于戊二酸、己二酸的全生物合成法报道较少,而碳原子数更多的庚二酸、辛二酸、壬二酸、癸二酸基本没有关于生物法合成的研究。本文对中链二元羧酸的应用价值、生产方式、国内外研究进展等进行了综述,并对其全生物法合成进行了重点探讨,以期为发酵法合成中链二元羧酸的研究提供有益的借鉴。
1 中链二元羧酸的应用价值
1.1 丁二酸的应用价值
丁二酸,因最初从琥珀中蒸馏获得也被称为琥珀酸,是参与三羧酸循环的天然二元羧酸,在食品医药、日化用品等领域有着广泛的应用前景[1]。作为性能优异的表面活性剂,常常被用于去垢清洁剂、肥皂等去污产品的生产,在日用化工品行业可用于脱毛剂、牙膏、清洗剂的生产。丁二酸具有酸味,除在食品添加剂中常被用作酸化剂外,还可作为抗菌剂和风味物质参与肉制品、水产品、调味料等的生产过程。在医药工业可用于生产解毒剂、镇静剂、止血药、维生素以及抗生素等。
1.2 戊二酸的应用价值
戊二酸为C5直链饱和二元羧酸,可用于生产尼龙5,5(戊二胺和戊二酸的聚合物)及其他C5聚酯类衍生物[2]。作为化工行业常见的一种原料,戊二酸可添加到化工塑料中作增塑剂,也可用作去垢剂、消毒剂等。过氧戊二酸是一种重要的戊二酸衍生物,可以用作有机物反应的催化剂,利用其自身具有的强氧化性可作为一种杀菌剂直接使用。
1.3 己二酸的应用价值
中链二元羧酸中最重要的一种是己二酸,作为在有机合成工业中占据重要地位的一种化合物,其全球的市场价值可达到60亿美元(2018年)[7]。己二酸是合成己二腈和己二胺的基础原料,己二酸与己二胺发生脱水缩合反应后生成的锦纶6,6(即尼龙6,6)是最主要的工程塑料之一;己二酸与多元醇发生缩合反应生成聚酯多元醇,可用于各种聚氨酯类产品的生产,例如聚氨基甲酸酯制品、泡沫塑料、胶黏剂等;参与精细化工行业众多产品的生产,如增塑剂、润滑油、染料香料、杀虫剂及农药等各类工业产品;作为国内批准可使用的一种酸味剂,具有酸味持久柔和的优势,是一种优良的酸度调节剂,在食品工业如果冻、软糖、果酱、饮品等产品生产中广泛使用,具有调节酸度、防止腐败(抑菌)及褐变、稳定护色、缓冲螯合等作用。
1.4 其他中链二元羧酸
中链二元羧酸中碳原子数更多的庚二酸、辛二酸、壬二酸、癸二酸也在化工、医药、食品等方面应用广泛。庚二酸俗称蒲桃酸,在有机化工领域是一种常用原料[3],可用于生产涂料树脂、高分子共聚体、黏合剂、杀虫剂、消毒剂、塑化剂、润滑油、合成纤维、表面活性剂等工业常用产品;此外,庚二酸在生物制药、配合物的配体制备中也有应用。辛二酸俗称软木酸,主要用于工程塑料的制取(主要是尼龙6,8)、合成高分子聚合物、制备工业树脂、医学药物及染色染料等。壬二酸俗称杜鹃花酸,目前工业上大多用于生产塑化剂(增塑剂)来增加塑料韧性以方便后续加工,也常用于高分子树脂、香精香料以及润滑油等的制备,同时壬二酸优良的抑菌功能被应用于食物防腐中。癸二酸俗称皮脂酸,目前工业上主要用于癸二酸酯的制备,其酯类在生产生活中用途广泛,如邻居苯二甲酸二异癸酯、邻苯二甲酸二异壬酯可用作树脂或者塑料的增塑剂,尤其在对高温条件和绝缘性要求高的材料中运用广泛,也可作为其他有机聚合物的制备原料(例如聚酰胺、聚氨酯等),还可以用于制备香精香料、润滑油、有机涂料等,此外,癸二酸也是生产尼龙10系列材料的原料[4]。
2 现有中链二元羧酸的生产方式
2.1 丁二酸的合成
2.1.1 丁二酸的合成方法
丁二酸目前主要的制备方法有电解法、化学法(从碳原子数目较少且相对常见价廉的烯烃、烷烃出发,通过化学手段制备得到)、生物法(酶转化法和微生物发酵法)。目前我国生产丁二酸的厂家除少数使用顺酐加氢化学法外,其他厂家几乎都使用电解法。电解法[5]是对马来酸或马来酸酐(顺酐)进行电解反应,还原得到丁二酸。电解法利用电子的转移,使阴极上马来酸中的烯键发生加成反应,生成饱和丁二酸,阳极电解出的H+转移至阴极。电解法早在20世纪30年代就在生产实践中发展成熟,到目前为止我国工业规模的丁二酸生产仍停留在该技术阶段。但丁二酸的电化学法还存在一些问题,比如能耗大、离子膜不能长期重复使用、电极容易被腐蚀、电解槽维修难度大、污水的回收利用困难、生产规模小等。顺酐催化加氢法具备高转化率、高纯度、副产物少等优势,目前我国已有部分企业采用该方法进行丁二酸的工业化生产。其技术在实际操作中有两种路径:(1)熔融状态的顺酐直接进行催化加氢,或者以有机溶剂为载体进行催化加氢从而生成丁二酸酐,再将丁二酸酐进行水解从而得到丁二酸,该方法被称为非水相法;(2)将顺酐水解制备马来酸,然后在负载型贵金属催化剂条件下一步加氢制备丁二酸,该方法因此被称为水相法。
2.1.2 丁二酸的生物合成方法
目前生物转化法是拥有较高转化率的方法之一,其利用微生物体内制造的富马酸还原酶将富马酸(反式丁二烯)转换成丁二酸,这种方法以富马酸为原料,使用量大且价格较贵,这种生产方式的性价比还有待进一步提高,目前世界上仅日本三井化学一家丁二酸生产商使用该制备方法[6]。天然存在的某些厌氧或兼性厌氧微生物(胃肠中的细菌和一些真菌),其本身可以依靠自身代谢积累丁二酸[8]。但未经改造的天然菌株不具备很强的丁二酸生产能力,同时伴随发酵过程发生的副反应较杂、副产物较多,对于糖酸的耐受性差,并不适用于工业上大规模的生产[9]。所以生物合成法的研究重点集中放在选育和培养高效的丁二酸发酵菌种,其中产琥珀酸厌氧螺菌、产琥珀酸放线杆菌、产琥珀酸曼氏杆菌和大肠杆菌等是目前研究的热门菌株。GLASSNER等[10]筛选菌株得到1株发生了自发突变的厌氧螺菌FA-10可以直接生产琥珀酸,其发酵产物的琥珀酸比例和耐糖浓度均明显提高,发酵条件优化后丁二酸产量高于30 g/L,得率超过70%。GUETTLER等[11]筛选出更为优秀的变异菌株,该琥珀酸放线杆菌变异菌株不仅能够抗氟代乙酸,而且在优化发酵条件后丁二酸产量高达110 g/L,发酵时间48 h得率约为97%。LEE等[12]筛选出产琥珀酸曼式杆菌LPK7,在丁二酸的生产过程中几乎没有甲酸、乙酸、乳酸等其他有机酸的生成,丁二酸产量达到52.49 g/L,收率约为1.16 mol/mol,生产强度约为1.8 g/(L·h)。除了筛选高产丁二酸的突变菌株之外,研究者们还通过基因工程手段对微生物进行改造以提高其产丁二酸的能力,例如敲除或失活竞争途径中的酶、增强丁二酸代谢途径中的关键酶、改造还原型辅酶合成途径以及构建丁二酸有氧生产体系等[13]。
微生物发酵法生产丁二酸在其他国家已经可以实施工业化生产,例如法国 Bioamber 公司。而国内此法起步晚发展慢,尚未有成功应用于工业生产的相关报道。发酵法制备丁二酸旨在使用价格相对便宜的材料,以更为简洁高效的加工过程获得高产量、高浓度的产品。使用秸秆、玉米等低廉的农产品为原料,不仅可得到与化学方法相比更为安全的医药食品级产品,同时还能为农产品深加工产业提供出路,使低廉的农产品转化为拥有高附加值的产品,因此发酵法制备丁二酸是一条具有前景的绿色途径,具有巨大的发展潜力。
2.2 戊二酸的合成
2.2.1 戊二酸的合成方法
目前戊二酸的工业生产主要是依靠回收法,在凭借环己酮的氧化作用得到己二酸的工业生产过程中,常常伴有戊二酸、丁二酸等混合二元羧酸副产物,其中一半左右为戊二酸。因此研究者们不断探索二元羧酸的分离技术,以期将混合物分离成单个组分后回收,获得经济效益。最常见的一种回收方法是成盐酸化法。该工艺在二元混合羧酸水溶液中按照理论反应配比加入氧化镁,反应生成的戊二酸镁盐、丁二酸镁盐、己二酸镁盐的溶解度不同,其中戊二酸镁在水中溶解度小,大部分以结晶物析出,而丁二酸镁、己二酸镁大部分溶解在水中,以滤液的形式存在。过滤得到的戊二酸镁滤渣中加入浓硫酸,分层溶液上层主要成分为粗戊二酸(95%以上)。整个过程没有有机溶液的引入以及“三废”的产生,工艺过程简单,操作容易,收率较高,已实现了工业化生产,是目前戊二酸生产最主要方式[14]。
2.2.2 戊二酸的生物合成方法
2013年,ADKINS等[2]发现在一些细菌如恶臭假单胞菌(Pseudomonas putida)中存在天然氨基戊酸途径,在大肠杆菌中表达恶臭假单胞菌体内的davA、davB、gabT、gabD基因,从而构建了从L-赖氨酸生产戊二酸的代谢途径,最终产生0.82 g/L的戊二酸。同年,PARK等[15]在大肠杆菌中构建了相同的途径——氨基戊酸途径,将L-赖氨酸经过5-氨基戊酰胺,5-氨基戊酸和戊二酸半醛最终转化为戊二酸,经过优化的菌株WL3110最终的戊二酸产量为1.7 g/L(图1)。2017年,YU等[16]报道了在重组大肠杆菌中生产戊二酸的新途径,其中包含部分已知的戊烯酸生物合成途径以及填空模块采用的trans-enoyl-CoA还原酶(Ter),该人造途径先将中心碳代谢物α-酮戊二酸还原成2-羟基戊二酸,活化成2-羟基戊二酰-CoA后将其脱水成反式戊烯二酰-CoA,通过trans-enoyl-CoA还原酶和硫酯水解将其氢化成戊二酰-CoA,最终在厌氧培养模式下该重组大肠杆菌产生了3.8 mg/L戊二酸和27.7 mg/L戊烯二酸(图2)。LI等[17]基于大肠杆菌天然赖氨酸分解代谢途径,通过补充谷氨酸和还原型辅酶强化赖氨酸生物合成,释放赖氨酸反馈抑制和促进草酰乙酸供应,从而最大化碳通量向戊二醛生物合成,同时使用天然转运蛋白来克服尸胺和5-氨基戊酸的细胞外积累,最终在补料分批条件下戊二酸的产量达到54.5 g/L。

图1 L-赖氨酸生产戊二酸的代谢途径
Fig.1 Metabolic pathways for the production of glutarate from L-lysine
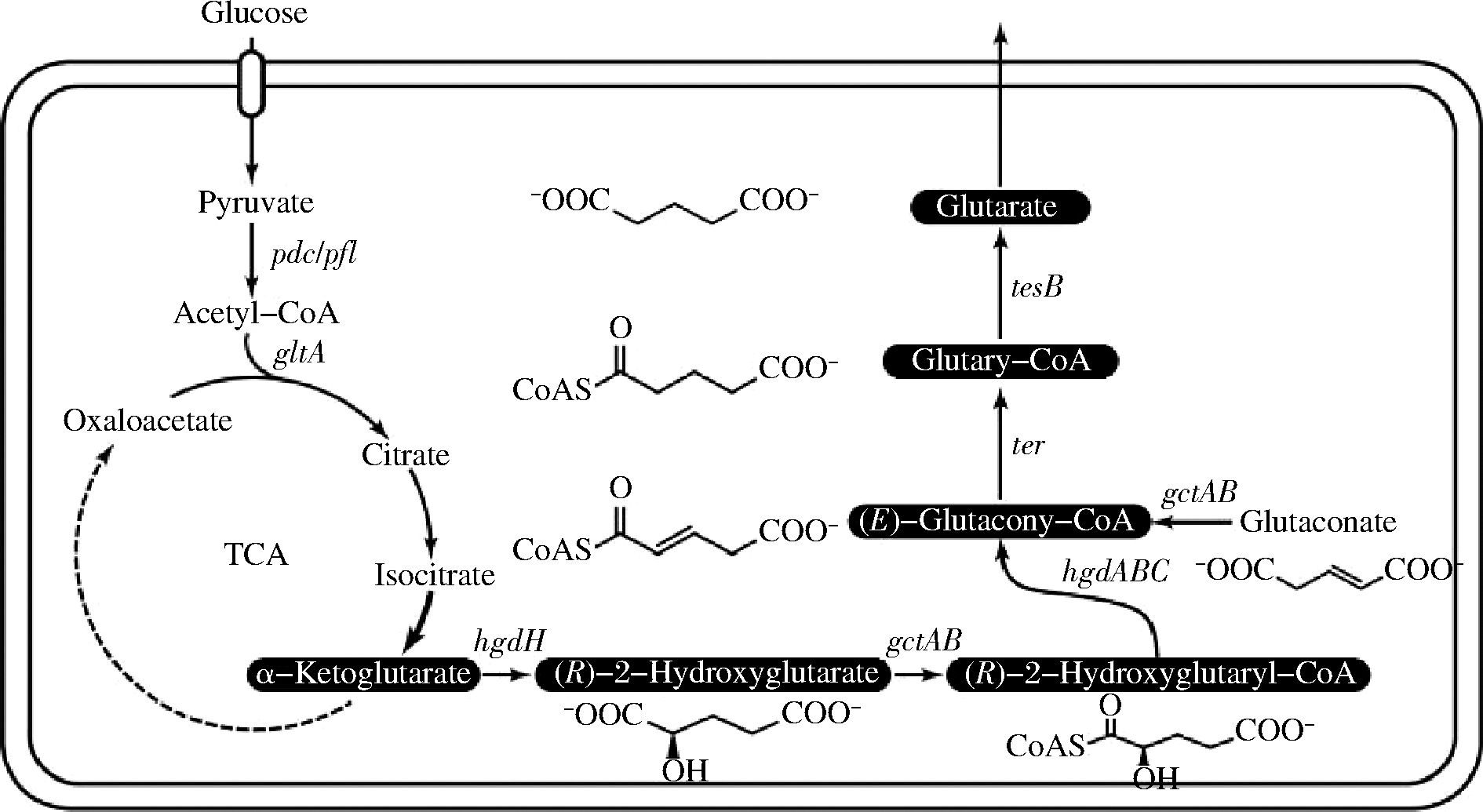
图2 重组大肠杆菌中戊二酸的生物合成途径
Fig.2 Metabolic pathway for glutarate biosynthesis in recombinant Escherichia coli
2.3 己二酸的合成
2.3.1 己二酸的化学合成方法
现有的工业化生产己二酸的工艺以化学方法为主,主要有环己醇氧化法、环己烷氧化法和环己烯水合法等3种方式[18]。20世纪30年代,美国杜邦已开始了己二酸的工业制备,通过利用苯酚与氢气在催化剂作用下反应生成环己醇后经硝酸氧化即可生成己二酸,但因为原料苯酚的来源受限,该法仅适用于苯酚原料相对丰富的地区。环己烷氧化法是目前企业生产己二酸最常用的方法,具有效率高、污染小且回收率好等优势,但是由于使用硝酸氧化,会产生大量的氮氧化物从而对环境产生严重影响。而环己烯水合法是利用高纯度苯与充足氢气在催化剂钌的作用下发生加成反应得到部分加氢产物环己烯,而后者可与水生成环己醇并最终氧化后生成己二酸。
在化学法工业生产己二酸的工艺中,硝酸的大量使用对环境造成严重影响。化学法中常采用硝酸作为氧化剂制得己二酸,实际生产过程中产生的蒸气和废酸很难处理,并且导致氮氧化物(特别是氧化亚氮)的大量释放。氧化亚氮是《京都议定书》中规定需减排的温室气体之一,它可参与光化学反应,破坏臭氧层,导致全球变暖[19],是国家制定有严格排放标准的大气污染物[20]。而将氮氧化物还原为氮气的成本很高,无疑会大大增加己二酸的生产成本。其次,化学法合成己二酸中使用到的生产原料均来源于不具有再生性和可持续性的石油资源,无法实现可持续地生产也是现有的化学法生产己二酸中的一大难题。随着己二酸需求的增长、环境污染的加剧以及石油等不可再生资源的短缺,寻找一种高效环保地生产己二酸的生产方式成为大势所趋。随着现代生物技术的发展,基于基因工程学、代谢工程学、合成生物学等众多学科的生物合成方式被视为化学方法合成己二酸的一种有益补充。
2.3.2 己二酸的半生物合成方法
由于微生物中不存在天然的己二酸合成途径,研究者们首先想到的是利用生物合成方法获得己二酸的前体物质,再利用化学方法将前体物质转化为己二酸。顺,顺-粘康酸属于不饱和二元羧酸,其含有的共轭双键能够在金属铂的催化下加氢生成己二酸。利用生物合成法获得顺,顺-粘康酸有以下两种方式[21]:一种是利用芳香族化合物生物合成顺,顺-粘康酸,一些微生物如假单胞菌、短杆菌、不动杆菌以及黄色杆菌可将苯甲酸、环己烷、环己醇、儿茶酚、苯酚等芳香族化合物转化为顺,顺-粘康酸,但是该途径的原料芳香族化合物仍主要来源于石油资源,不能从根本上解决原料不可再生的问题;另一种方式是利用可再生的葡萄糖生物合成顺,顺-粘康酸,研究发现将来源于Klebsiella pneumonia的2个基因aroZ和aroY以及来源于Acinetobacter calcoaceticus的基因catA引入工程菌株中进行表达,可以实现直接从葡萄糖合成顺,顺-粘康酸,另外通过菌种诱变、阻断反馈抑制、更换表达质粒等方式还可提高顺,顺-粘康酸的产量和产率。
利用葡萄糖为原料合成顺,顺-粘康酸这一生物合成途径的成功构建,使得间接生物合成己二酸成为可能,原料从有限的石油资源变成了无毒无害的葡萄糖,实现了原料的可再生性和可持续性。然而,从己二酸前体物质顺,顺-粘康酸合成己二酸的这一步骤使用的仍是化学方法,需要贵重金属铂作为催化剂来催化加氢反应,这势必增加了己二酸的生产成本,且前体物质相比于己二酸其市场价值更高,这种方法不具有经济优势。因此研究者们开始将目光转向对己二酸全生物合成途径的研究。
2.3.3 己二酸的全生物合成方法
20世纪初,研究者在土壤棒杆菌基因中发现可以氧化环己醇的基因簇,能够利用环己烷生物合成己二酸。但是以环烃类化合物作为底物,其来源仍旧受限,不符合原料的可持续性[22]。另外,生物体内含有一种称为ω 氧化的脂肪酸代谢途径[23],可以对脂肪酸进行三次氧化生成己二酸。美国加利福尼亚州的工业生物技术公司Verdezyne于2012年获得生物基己二酸生产的美国专利[24],他们将工程酵母菌作为宿主菌,利用烷烃类、糖类物质生产己二酸。此外,葡萄糖经α-酮己二酸也可以合成己二酸[25],该方法以葡萄糖为底物,经过α-酮戊二酸、α-酮己二酸、α-酮庚二酸以及5-甲酰基戊酸这几种物质最终转化为己二酸。
近些年来利用逆己二酸降解途径合成己二酸得到了广泛的报道[26]。逆己二酸降解途径可利用乙酰辅酶A和琥珀酰辅酶A(图3),在一系列酶的作用下,将两者聚合逐步合成己二酸。途径中的关键酶包括琥珀酰辅酶A:乙酰辅酶A酰基转移酶、3-羟酰辅酶A脱氢酶和3-羟基己二酰辅酶A脱氢酶、5-羰基-2-戊烯酰辅酶A还原酶、电子转移黄素蛋白以及己二酰辅酶A合成酶。美国加利福尼亚州Genomatica公司在大肠杆菌中成功构建了逆己二酸降解的合成途径,但并没有报道己二酸实际的产量和效价[18]。YU等[27]在大肠杆菌中表达逆己二酸降解途径中的基因,经过优化的菌株AA1己二酸产量达到(639±34) μg/L。CHEONG等[28]基于逆己二酸降解途径,通过敲除ldhA、poxB、pta、adhE、sucD基因使己二酸产量提高到2.5 g/L。DENG等[29]发现在褐色嗜热裂孢菌(Thermobifida fusca)中存在天然的逆己二酸降解途径(图3),且共有6种编码基因进行编码,其中Tfu_0875编码β-酮硫解酶,Tfu_2399编码3-羟酰基辅酶A脱氢酶,Tfu_0067编码3-羟基己二酰辅酶A脱氢酶,Tfu_1647编码5-羰基-2-戊烯酰辅酶A还原酶,Tfu_2576及Tfu_2577共同编码己二酰辅酶A合成酶。DENG等[29]将逆己二酸降解途径导入到大肠杆菌中表达,通过模块化重构上述代谢途径,发现5-羰基-2-戊烯酰-CoA还原酶(Tfu_1647)是该途径高效积累己二酸的关键步骤。通过优化启动子,实现了上述酶的高效表达。之后,对阻碍己二酸合成的竞争性途径进行理性预测和调整,最终以甘油为底物,己二酸产量提高到了68 g/L[30]。

图3 己二酸全生物合成途径
Fig.3 Biosynthesis pathway of adipic acid
2.4 其他二元羧酸的合成
对于碳原子较多的中链二元羧酸,目前工业上多采用化学方法生产。庚二酸的制备有氧化环酮法、烯烃类化合物合成法、金属钠还原异戊醇法等[31]。辛二酸可由蓖麻油或环辛烷经氧化制得,壬二酸主要由不饱和脂肪酸发生氧化裂解反应制得,其中最为常见原料是油酸,除此之外还可使用蓖麻油为原料[32]。癸二酸的化学法合成也依赖于蓖麻油为原料[33],而微生物法则是利用石油馏分中分离制得的正癸烷,经过热带假丝酵母氧化发酵,最终制得癸二酸[34]。以上碳链较长的二元羧酸均难以在微生物体内直接由便宜易得的常见发酵原料直接合成,目前国内外几乎没有关于全生物发酵法合成的相关报道。随着微生物领域基因工程、代谢工程、生物反应工程等学科的不断发展,发酵法将会是未来中链二元羧酸合成研究的一个可行方向。
3 总结与展望
目前,国内外研究人员利用代谢工程手段改造工程菌株生产己二酸、戊二酸的研究虽然有一定进展,但与琥珀酸相比还不够成熟,远不能达到工业生产的需求。而碳数更多的中链二元羧酸更加难以由微生物合成,因此相关报道更加稀少。现已有的化学法、回收法等生产中链二元羧酸的方法相对成熟且生产价格便宜、存在利润空间,在大规模工业生产中发酵法还远远不能取代化学法,但发酵法作为更加绿色环保的一种生产方式具有广阔的前景,是未来大宗化学原料生产的大势所趋。此外,相比于化学法,利用发酵法生产的中链二元羧酸应用于食品、医药、日化等与人类生活息息相关的产业相对更加安全,更易被消费者所认可和接受。因此,对于微生物发酵法生产中链二元羧酸的研究还需进一步的深入,例如对现有途径进行改造,进一步提高目的产物产量;分离耐受低pH的大肠杆菌突变菌株,或者使用酵母作为表达生产基因的宿主;采用多种方法增加宿主微生物对中链二元羧酸的耐受性,如适应性进化、直接进化和基因工程手段等;寻找一条高效生产中链二元羧酸的通用代谢途径,利用中链二元羧酸的结构共性找到通用的特异性酶系,通过构建通用平台使中链二元羧酸的生物合成更加高效便捷。
[1] MILLARD C S, CHAO Y P, LIAO J C, et al.Enhanced production of succinic acid by overexpression of phosphoenolpyruvate carboxylase in Escherichia coli[J].Applied and Environmental Microbiology, 1996, 62(5):1 808-1 810.
[2] ADKINS J, JORDAN J, NIELSEN D R.Engineering Escherichia coli for renewable production of the 5-carbon polyamide building-blocks 5-aminovalerate and glutarate[J].Biotechnology & Bioengineering, 2013, 110(6):1 726-1 734.
[3] VERA M, ADMETLLA M, RODR GUEZ-GAL
GUEZ-GAL N A, et al.Synthesis, characterization and degradation studies on the series of sequential poly(ester amide)s derived from glycolic acid 1,6-hexanediamine and aliphatic dicarboxylic acids[J].Polymer Degradation & Stability, 2005, 89(1):21-32.
N A, et al.Synthesis, characterization and degradation studies on the series of sequential poly(ester amide)s derived from glycolic acid 1,6-hexanediamine and aliphatic dicarboxylic acids[J].Polymer Degradation & Stability, 2005, 89(1):21-32.
[4] SHENDE P G, JADHAV A B, DABHADE S B.Polyesteramide resins from dehydrated Castor oil and various dibasic acids[J].Pigment & Resin Technology, 2002, 31(5):310-314.
[5] 李春丽, 陈新志, 赵新丽.丁二酸的制备及用途[J].青海大学学报, 1999,17(6):22-24.
LI C L, CHEN X Z, ZHAO X L.Preparation and uses of succinic acid[J].Journal of Qinghai University, 1999,17(6):22-24.
[6] 张方, 孙凯, 周振鹏.丁二酸的合成研究现状及发展[J].聚酯工业, 2016, 29(1):3-6.
ZHANG F, SUN K, ZHOU Z P. The synthesis research present situation and development of succinic acid[J]. Polyester Industry, 2016, 29(1):3-6.
[7] YANG J, LIU J W, GE Y, et al.Direct and selective synthesis of adipic and other dicarboxylic acids by palladium-catalyzed carbonylation of allylic alcohols[J].Angewandte Chemie International Edition, 2020, 59(46):20 394-20 398.
[8] 詹晓北, 朱一晖, WANG D H.琥珀酸发酵生产工艺及其产品市场[J].食品科技, 2003(2):44-49.
ZHAN X B, ZHU Y H, WANG D H.Succinic acid production and potential market[J].Food Science and Technology, 2003(2):44-49.
[9] SONG H, LEE S Y.Production of succinic acid by bacterial fermentation[J].Enzyme & Microbial Technology, 2006, 39(3):352-361.
[10] GLASSNER D A, DATTA R.Process for the production and purification of succinic acid:US5143834[P].1992-09-01.
[11] GUETTLER M V, JAIN M K, RUMLER D.Method for making succinic acid, bacterial variants for use in the process,and methods for obtaining variants:US5573931[P].1996-11-12.
[12] LEE S J, SONG H, LEE S Y.Genome-based metabolic engineering of Mannheimia succiniciproducens for succinic acid production[J].Applied & Environmental Microbiology, 2006, 72(3):1 939-1 948.
[13] 王乐, 倪子富, 惠明, 等.代谢控制发酵产琥珀酸研究进展[J].化工学报, 2015, 66(4):1 243-1 251.
WANG L, NI Z F, HUI M, et al. Research advances in metabolic control of succinic acid fermentation[J]. CIESC Journal, 2015, 66(4):1 243-1 251.
[14] 江镇海. 戊二酸的分离技术和经济效益评述[J].精细化工原料及中间体,2012(6):35-36.
JIANG Z H.Separation and economic benefits of glutaric acid[J].Fine Chemicals and Intermediates, 2012(6):35-36.
[15] PARK S J, KIM E Y, NOH W, et al.Metabolic engineering of Escherichia coli for the production of 5-aminovalerate and glutarate as C5 platform chemicals[J].Metabolic Engineering, 2013, 16:42-47.
[16] YU J L, XIA X X, ZHONG J J, et al.A novel synthetic pathway for glutarate production in recombinant Escherichia coli[J].Process Biochemistry, 2017, 59:161-171.
[17] LI W N, MA L, SHEN X L, et al.Targeting metabolic driving and intermediate influx in lysine catabolism for high-level glutarate production[J].Nature Communications, 2019, 10:3337.
[18] BURGARD A P, PHARKYA P, OSTERHOUT R E.Microorganisms for the production of adipic acid and other compounds:US9382556[P].2016-07-05.
[19] DICKINSON, R E, CICERONE R J.Future global warming from atmospheric trace gases[J].Nature, 1986, 319(6 049):109-115.
[20] 陈银生, 周亚明, 王霞.己二酸的各种生产工艺及污染物处理[J].皮革化工, 2005(3):30-34.
CHEN Y S, ZHOU Y M, WANG X. Producing processes of adipic acid and its pollutants treatment[J]. Leather Chemicals, 2005(3):30-34.
[21] 吴元庆. 产顺, 顺—粘康酸大肠杆菌遗传改造研究[D].天津:天津科技大学, 2013.
WU Y Q.The study modification of Escherichia coli for CIS,CIS-muconic acid production[D].Tianjin:Tianjin University of Science & Technology, 2013.
[22] CHENG Q, THOMAS S M, KOSTICHKA K, et al.Genetic analysis of a gene cluster for cyclohexanol oxidation in Acinetobacter sp.strain SE19 by in vitro transposition[J].Journal of Bacteriology, 2000, 182(17):4 744-4 751.
[23] BEARDSLEE T, PICATAGGIO S.Bio-based adipic acid from renewable oils[J].Lipid Technology, 2012, 24(10):223-225.
[24] PICATAGGIO S, BEARDSLEE T.Biological methods for preparing adipic acid:US8241879[P].2012-08-14.
[25] KUMMER R, MERGER F, BERTLEFF W, et al. Preparation of adipic acid: US4931590[P]. 1990-06-05.
[26] THYKAER J, CHRISTENSEN B,NIELSEN J.Metabolic network analysis of an adipoyl-7-ADCA-producing strain of Penicillium chrysogenum:Elucidation of adipate degradation[J].Metabolic Engineering, 2002, 4(2):151-158.
[27] YU J L, XIA X X, ZHONG J J, et al.Direct biosynthesis of adipic acid from a synthetic pathway in recombinant Escherichia coli[J].Biotechnology & Bioengineering, 2014, 111(12):2 580-2 586.
[28] CHEONG S, CLOMBURG J M, GONZALEZ R.Energy-and carbon-efficient synthesis of functionalized small molecules in bacteria using non-decarboxylative Claisen condensation reactions[J].Nature Biotechnology, 2016, 34(5):556-561.
[29] DENG Y, MAO Y.Production of adipic acid by the native-occurring pathway in Thermobifida fusca B6[J].Journal of Applied Microbiology, 2015, 119(4):1 057-1 063.
[30] ZHAO M, HUANG D X, ZHANG X J, et al.Metabolic engineering of Escherichia coli for producing adipic acid through the reverse adipate-degradation pathway[J].Metabolic Engineering, 2018,47:254-262.
[31] 林晓霖, 袁斌, 段博.庚二酸的研究进展[J].化工中间体, 2007(11):16-19.
LIN X L, YUAN B, DUAN B. Study on the development of the application of pimelic acid[J]. Chemical Intermediates, 2007(11):16-19.
[32] 谷志勇, 胡望明.壬二酸的制备及应用[J].精细石油化工, 1998(6):40-44.
GU Z Y, HU W M.Preperation and application of azelaic acid[J].Speciality Petrochemicals, 1998(6):40-44.
[33] 马建成, 夏清, 张凤宝, 等.蓖麻油裂解制癸二酸生产工艺研究进展[J].化学工业与工程, 2007(4):362-366.
MA J C, XIA Q, ZHANG F B, et al. Progress in the production of sebacic acid from Castor oil[J]. Chemical Industry and Engineering, 2007(4):362-366.
[34] ULEZLO I V, ROGOZIN I S.Search for yeast producers of brassylic and sebacic fatty acids[J].Applied Biochemistry and Microbiology, 2004, 40(5):460-462.