氨基酸是构成蛋白质的基本单位,是生物体不可缺少的营养物质之一,与生命活动有着密切的关系[1]。氨基酸可作为有机氮源,促进食用菌的生长,也可作为功能性物质对机体生命活动产生调节作用[2]。MEMMOTT等[3]研究发现,添加脯氨酸可以促进炭疽菌产生孢子。LEUNG等[4]通过在培养基中添加谷氨酰胺,有效提高了冬虫夏草中虫草素和胞外多糖的含量。贲松彬等[5]在蛹虫草液体培养基中添加精氨酸可显著增加菌丝体的生物量及虫草素产量。马元伟等[6]通过在培养基中添加组氨酸和赖氨酸,使绿僵菌退化菌株的产孢及产色素能力恢复明显。
草菇(Volvariella volvacea)又称稻草菇、中国蘑菇,是世界上最早人工栽培的大宗食用菌之一,子实体味道鲜美、营养丰富且富含多种生物活性物质,深受消费者喜爱。同其他食用菌一样,菌种退化是制约草菇产业快速发展的重要原因之一。草菇不耐低温的特性使其无法像其他食用菌菌种一样长期低温保藏,故退化现象尤为严重。寻找一种简单高效的退化菌株复壮方法是草菇产业亟需解决的关键问题。
课题组前期研究表明,草菇菌种在退化过程中,子实体中的多种氨基酸含量均呈现不同程度的下降趋势[7]。通过改变培养基的碳源,可有效复壮草菇退化菌种[8]。添加外源氨基酸能否对草菇退化菌种有复壮作用,目前尚未见报道。本研究以草菇V844及其退化菌株为实验材料,在马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)中等量添加20种L-型氨基酸,考察不同氨基酸对退化菌种的影响;筛选出5种复壮效果较好的氨基酸进行外源添加,测定草菇菌丝体的生理特性、营养成分、活性氧含量、抗氧化酶活力等指标,为草菇及其他食用菌退化菌种的复壮研究提供理论依据和技术支持。
1 材料与方法
1.1 材料、培养基
1.1.1 供试菌株
草菇菌株V844原种(D0),退化菌株(D1~D3):由课题组前期通过组织分离继代方式获得[7],D1:连续组织分离继代6次,产量较D0降低18%;D2:连续组织分离继代12次,产量较D0降低35%;D3:组织分离继代18次,产量较D0降低67%。
1.1.2 培养基与试剂
对照组PDA:马铃薯20%,葡萄糖2%,KH2PO4 0.1%,MgSO4 0.1%,琼脂粉2%,pH自然。处理组PDA:参照陈长兰等[9]的方法,在PDA中分别添加20种L型氨基酸[丙氨酸(Ala)、精氨酸(Arg)、天冬酰胺(Asn)、天冬氨酸(Asp)、半胱氨酸(Cys)、谷氨酰胺(Gln)、谷氨酸(Glu)、甘氨酸(Gly)、组氨酸(His)、异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)、甲硫氨酸(Met)、苯丙氨酸(Phe)、脯氨酸(Pro)、丝氨酸(Ser)、苏氨酸(Thr)、色氨酸(Trp)、酪氨酸(Tyr)及缬氨酸(Val)],每种氨基酸的添加量为0.2%。
1.2 生理指标测定
1.2.1 气生菌丝密度
观察记录D0~D3在不同培养基中第3天的气生菌丝生长状况。
1.2.2 菌丝生长速度
参考安学明等[7]的方法测定。
1.2.3 菌丝生物量
参照宗元元[10]的方法:将玻璃纸裁剪成9 mm培养皿大小的圆形并灭菌处理,接种前将其覆盖在凝固的PDA表面,待菌丝长满平皿后小心将其取出,60 ℃ 烘干至恒重并称重。
1.3 营养成分测定
将菌丝体进行冻干粉碎,测定各营养成分时,精确称取菌丝体粉末0.5 g。
1.3.1 粗多糖含量
加入10 mL蒸馏水,90 ℃水浴3 h;4 000 r/min离心15 min,取上清液,沉淀部分按上述方法再次浸提,合并2次上清液,浓缩至2 mL;加入10 mL 80%乙醇溶液,4 ℃在超声波清洗机中以100%功率处理60 min,8 000 r/min离心15 min,取沉淀部分,采用苯酚-硫酸法测定[11]。
1.3.2 粗蛋白质含量
加入10 mL PBS,4 ℃在超声波清洗机中以100%功率处理60 min,8 000 r/min离心15 min,取上清液,采用考马斯亮蓝法测定[12]。
1.3.3 黄酮含量
加入10 mL 80%乙醇溶液,25 ℃在超声波清洗机中以100%功率处理60 min,8 000 r/min离心15 min,取上清液,采用NaNO2-Al(NO3)3比色法测定量[13]。
1.3.4 多酚含量
加入10 mL 80%乙醇溶液,25 ℃在超声波清洗机中以100%功率处理60 min,8 000 r/min离心15 min,取上清液,采用福林酚法测定[14]。
1.4 活性氧含量及抗氧化酶活力测定
1.4.1 超氧阴离子自由基![]() 含量
含量
采用羟胺反应法测定[15]。
1.4.2 H2O2含量
采用分光光度计比色法测定[16]。
1.4.3 过氧化物酶(peroxidase,POD)活力
采用愈创木酚法测定[17]。
1.4.4 超氧化物歧化酶(superoxide dismutase,SOD)活力
采用氮蓝四唑(nitro-blue tetrazolium,NBT)法测定[18]。
1.4.5 过氧化氢酶(catalase,CAT)活力
参照KATO等[19]的方法测定。
1.4.6 谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活力
采用二硫代双硝基苯甲酸直接法测定[20]。
1.5 数据分析
以上试验均重复3次,取平均值。采用Origin 2018软件绘图;SPSS 19.0进行方差分析。
2 结果与分析
2.1 20种氨基酸对草菇菌丝体生理指标的影响
以D2作为初筛菌株,在PDA中分别添加20种氨基酸进行退化菌种复壮试验,结果如图1、图2所示。从气生菌丝密度、菌丝生长速度和菌丝生物量3个指标上看,Ser、Ala、Val、Leu、Pro的对菌丝生长有明显的促进效果,Gly、Phe、Trp、Asn、Asp、Arg、Met、Ile、Thr、Gln的3个生理指标均优于对照组;His、Glu、Cys、Lys、Tyr对菌丝生长有抑制作用,其中Cys、Lys、Tyr的抑制作用尤为明显。
通过初筛,选择5种(Ser、Ala、Val、Leu、Pro)复壮效果最佳的氨基酸对不同退化程度的草菇菌株D1~D3作进一步的研究。
2.2 五种氨基酸对菌丝生长速度及生物量的影响
测定D0~D3的菌丝体生长性状,结果如图3所示。菌丝生长速度、菌丝生物量均随菌种退化程度的增加而逐渐降低;D3的菌丝生长速度、生物量较D0分别下降了36%、40%。外源添加5种氨基酸后,退化菌株D1~D3的菌丝生长速度、生物量均优于对照组。5种氨基酸对草菇菌种生长性状的影响由大到小依次是Ser>Ala>Val>Leu>Pro。Ser的复壮效果最佳,外源添加Ser后,相较于对照组,D1的菌丝生长速度和生物量分别增加了7%、10%,D2分别增加了24%、15%,D3分别增加了33%、30%。Ser对退化最严重菌株D3的复壮效果最佳。
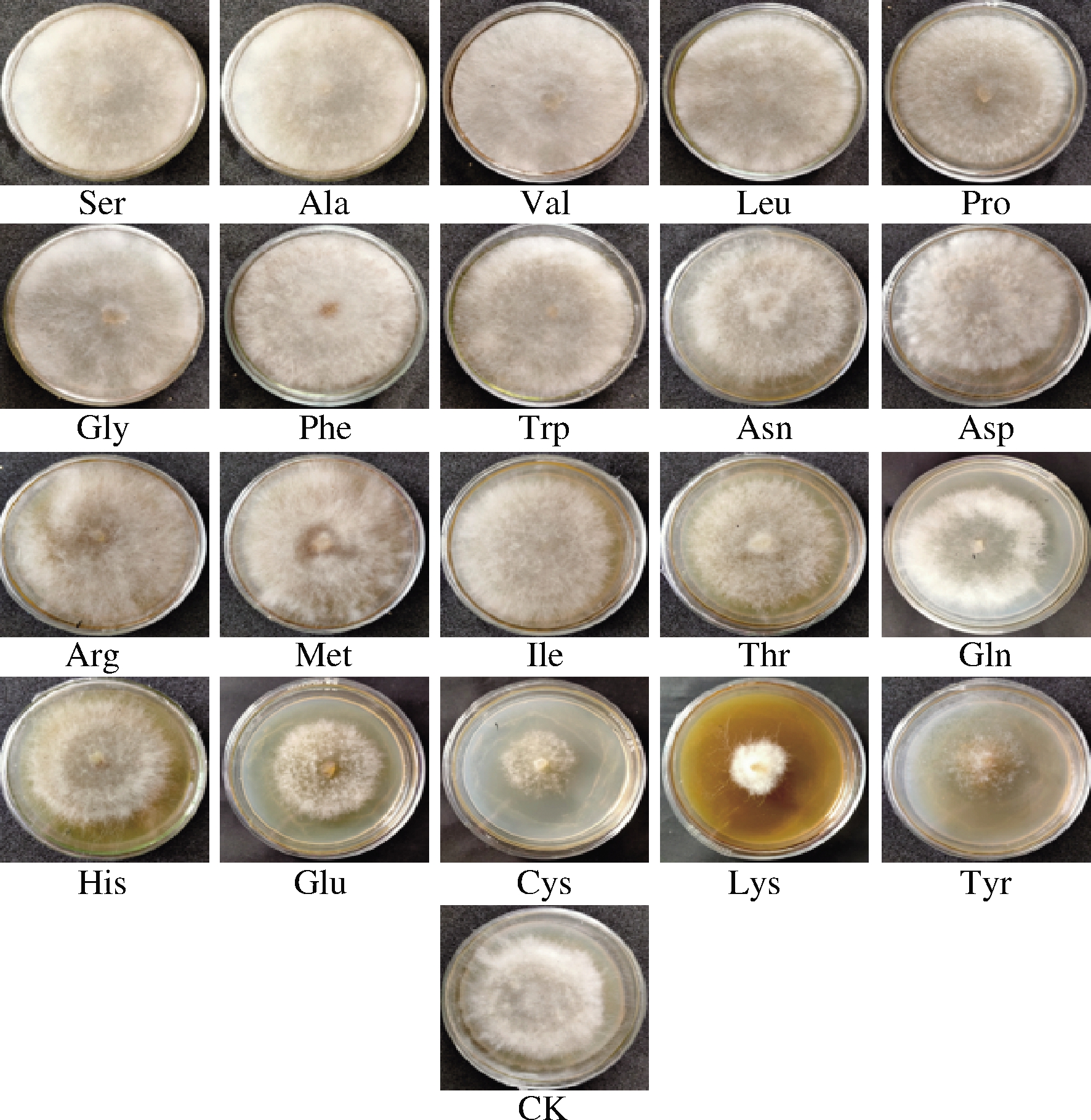
图1 20种外源氨基酸对草菇气生菌丝密度的影响
Fig.1 Effects of 20 kinds of exogenous amino acids on the mycelial density of Volvariella volvacea
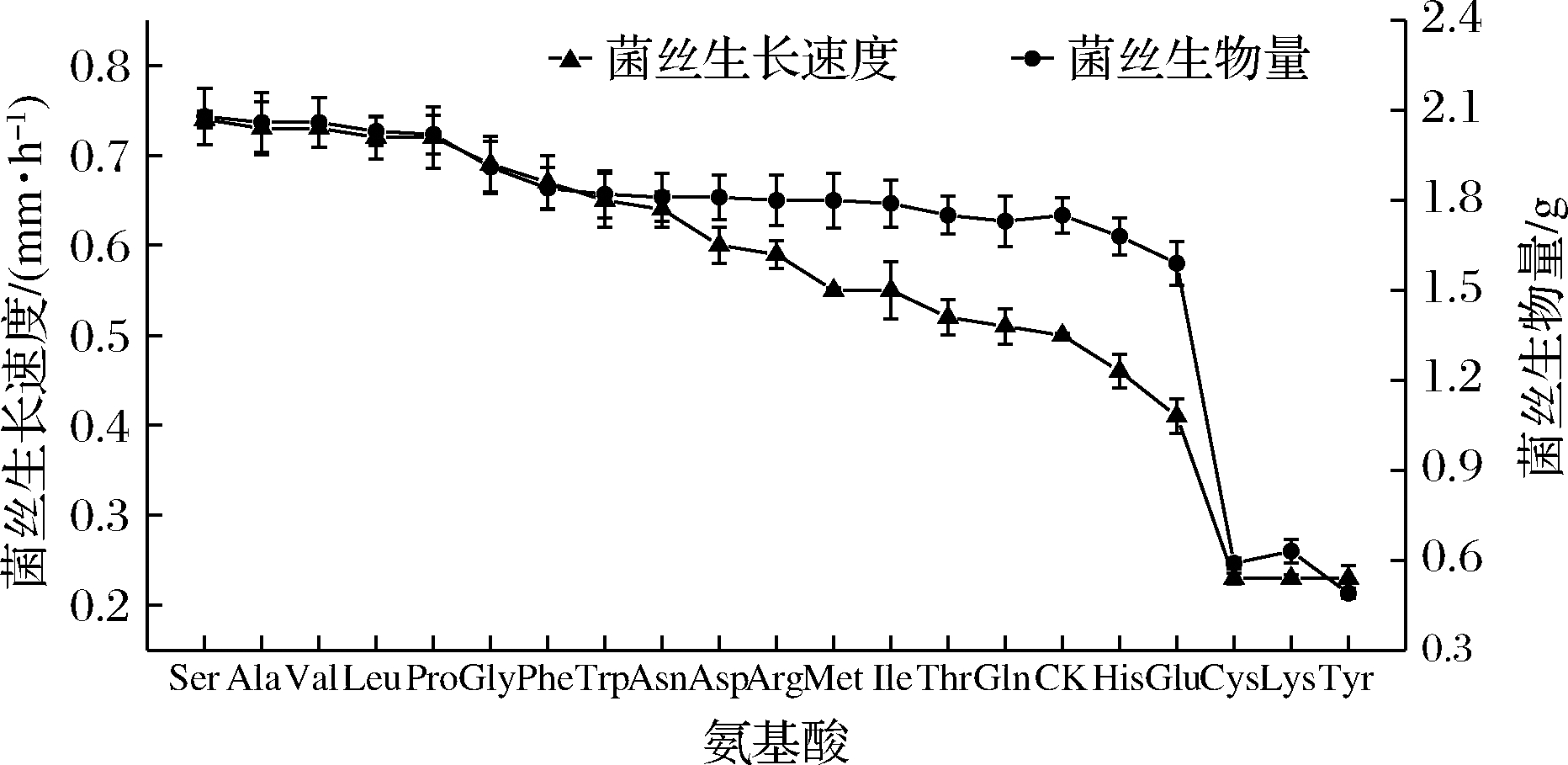
图2 20种外源氨基酸对草菇菌丝生长速度、生物量的影响
Fig.2 Effects of 20 kinds of exogenous amino acids on growth rate and biomass of Volvariella volvacea
2.3 五种氨基酸对草菇菌丝体营养指标的影响
测定D0~D3菌丝体的营养成分,结果如图4所示。随着退化程度增加,草菇菌丝各营养成分含量均逐渐降低。D3的粗多糖、粗蛋白质、多酚、黄酮含量比D0分别降低了43%、14%、15%、28%。外源添加5种氨基酸后,D0~D3的各营养成分含量均呈现不同程度的升高,Ser的促进作用最明显。外源添加Ser后,D3的粗多糖、粗蛋白质、多酚、黄酮含量较对照分别提高了17%、40%、3%、14%。
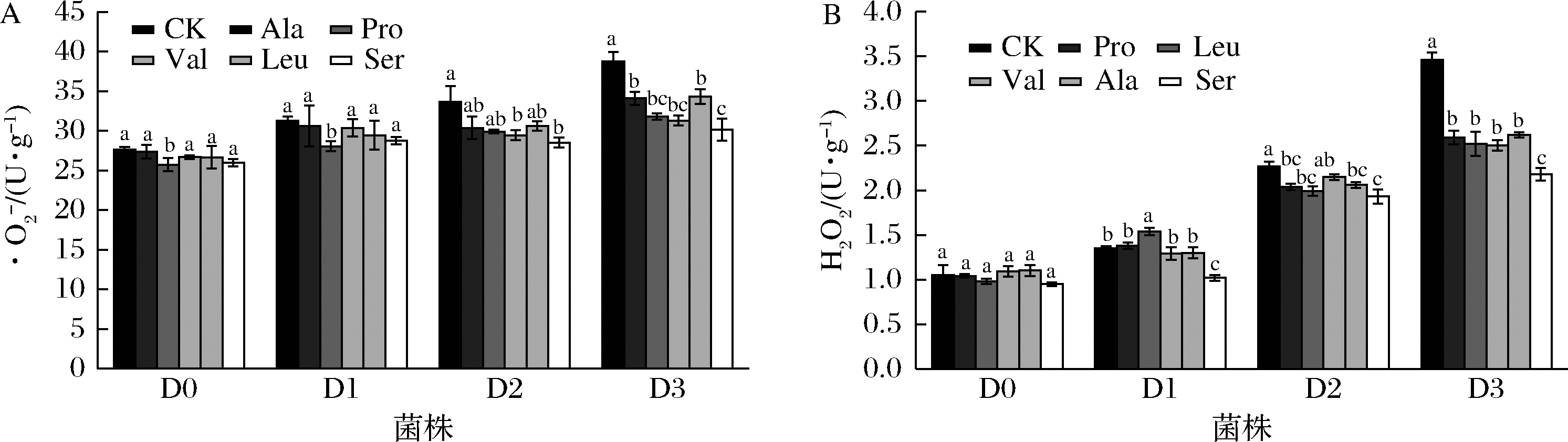
2.4 五种氨基酸对草菇菌丝体活性氧含量的影响
测定D0~D3菌丝体内活性氧含量,结果如图5所示,D0菌株![]() 含量最低,随着菌种退化程度的增加,活性氧在菌丝体内积累程度提高。相较于D0,D3菌丝体内
含量最低,随着菌种退化程度的增加,活性氧在菌丝体内积累程度提高。相较于D0,D3菌丝体内![]() 含量分别增加了40%、231%。外源添加5种氨基酸后,与对照组相比,活性氧含量出现不同程度的降低。外源添加Ser后,D3的
含量分别增加了40%、231%。外源添加5种氨基酸后,与对照组相比,活性氧含量出现不同程度的降低。外源添加Ser后,D3的![]() 含量分别降低了22%、37%,且差异显著(P<0.05)。
含量分别降低了22%、37%,且差异显著(P<0.05)。
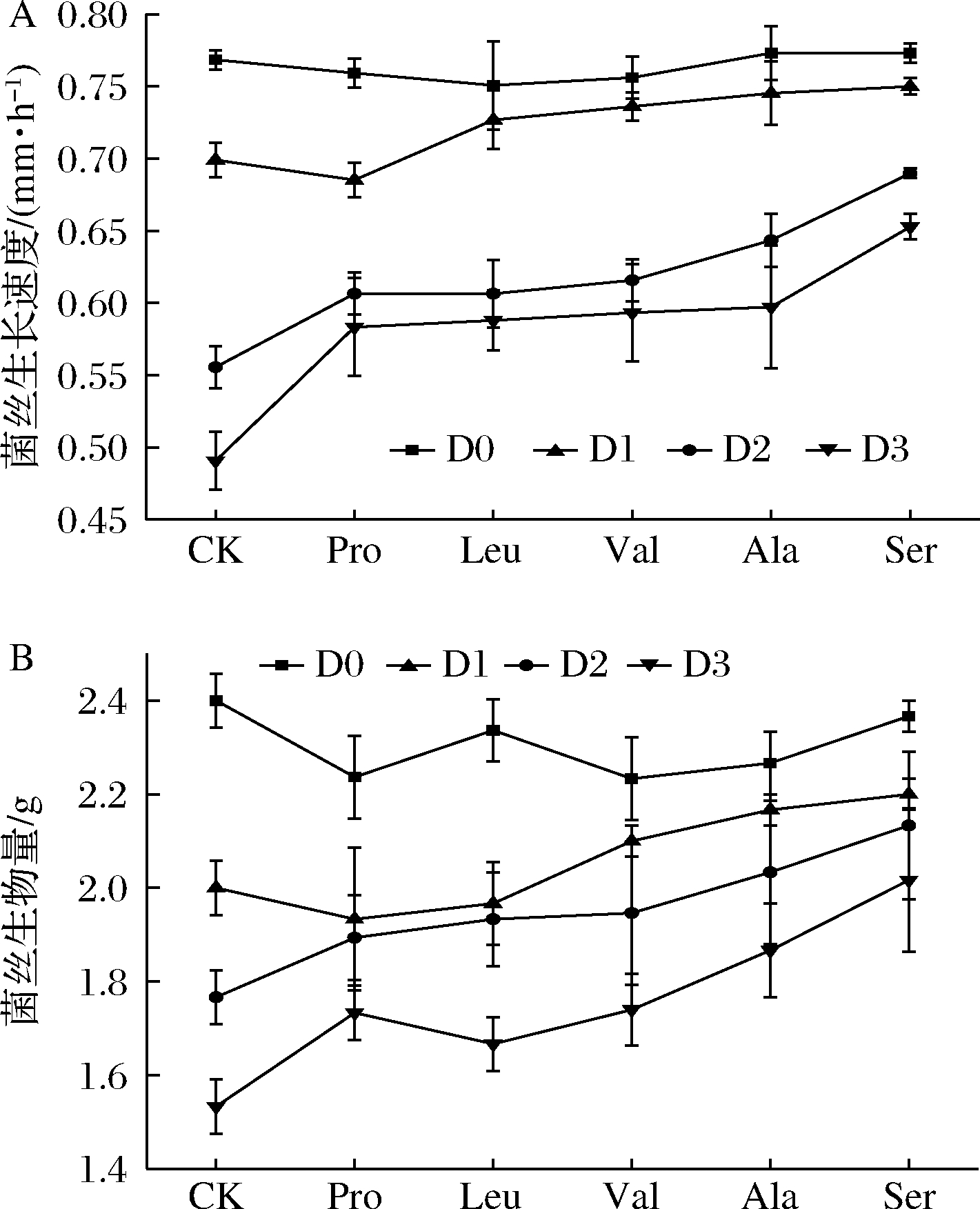
A-生长速度;B-生物量
图3 外源氨基酸对草菇菌丝生长速度和生物量的影响
Fig.3 Effects of exogenous amino acids on growth rate and biomass of Volvariella volvacea
2.5 五种氨基酸对草菇菌丝体抗氧化酶活性的影响
测定D0~D3菌丝体内抗氧化酶活力,结果如图6所示。随菌种退化程度的增加,抗氧化酶活力逐渐下降。与对照组相比,D3的POD、SOD、CAT、GPX活力分别降低了42%、84%、79%、59%。外源添加5种氨基酸后,D0的4种抗氧化酶活力没有显著变化(P>0.05),而D1~D3呈现不同程度的增长。添加Ser后,D3菌株的POD、SOD、CAT、GPX活力分别提高了46%、60%、167%、92%。
3 结论与讨论
食用菌菌种相当于作物的种子,菌种的质量直接影响着食用菌的产量,但菌种退化是众多食用菌共同存在的问题。目前,食用菌菌种复壮主要有尖端菌丝分离、单孢分离、分子选育、更换培养基配方等方法。食用菌培养一般选用PDA培养基,长期不更换培养基营养物质的组成,可能导致菌株对营养物质的吸收率降低,加速菌种退化。研究表明,适当更换培养基配方可有效复壮食用菌菌种。ROYSE等[21]在香菇培养基中添加0.6% CaCO3溶液,使其产量提高了24.9%;RODRIGUEZ ESTEADA等[22]在棉籽壳/锯末基质中添加150 μg/g Mn和250 μg/g Cu显著提高了杏鲍菇产量;HOU等[23]在草菇栽培的喷水期用0.02% NaAc处理基质,使得产量增加了16.25%。REN等[24]在发酵培养基中添加Na2SeO3(7 mg/L),使得蛹虫草的菌丝体生物量提高了35.1%。外源氨基酸作为有机氮源,能在一定程度上刺激菌丝的代谢,促进草菇菌株的生长。除此之外,氨基酸在生物体抗衰老方面也发挥着重要作用[2]。草菇中的氨基酸含量较高,是其主要的鲜味物质。本研究拟在不引入其他外源物质的前提下,复壮草菇退化菌种。结果表明,通过外源添加Ser,可显著改良草菇退化菌株的菌丝体生理指标(图1~图3),增加菌体营养成分(图4),降低了活性氧的积累(图5)并提高了抗氧化酶的活性(图6)。
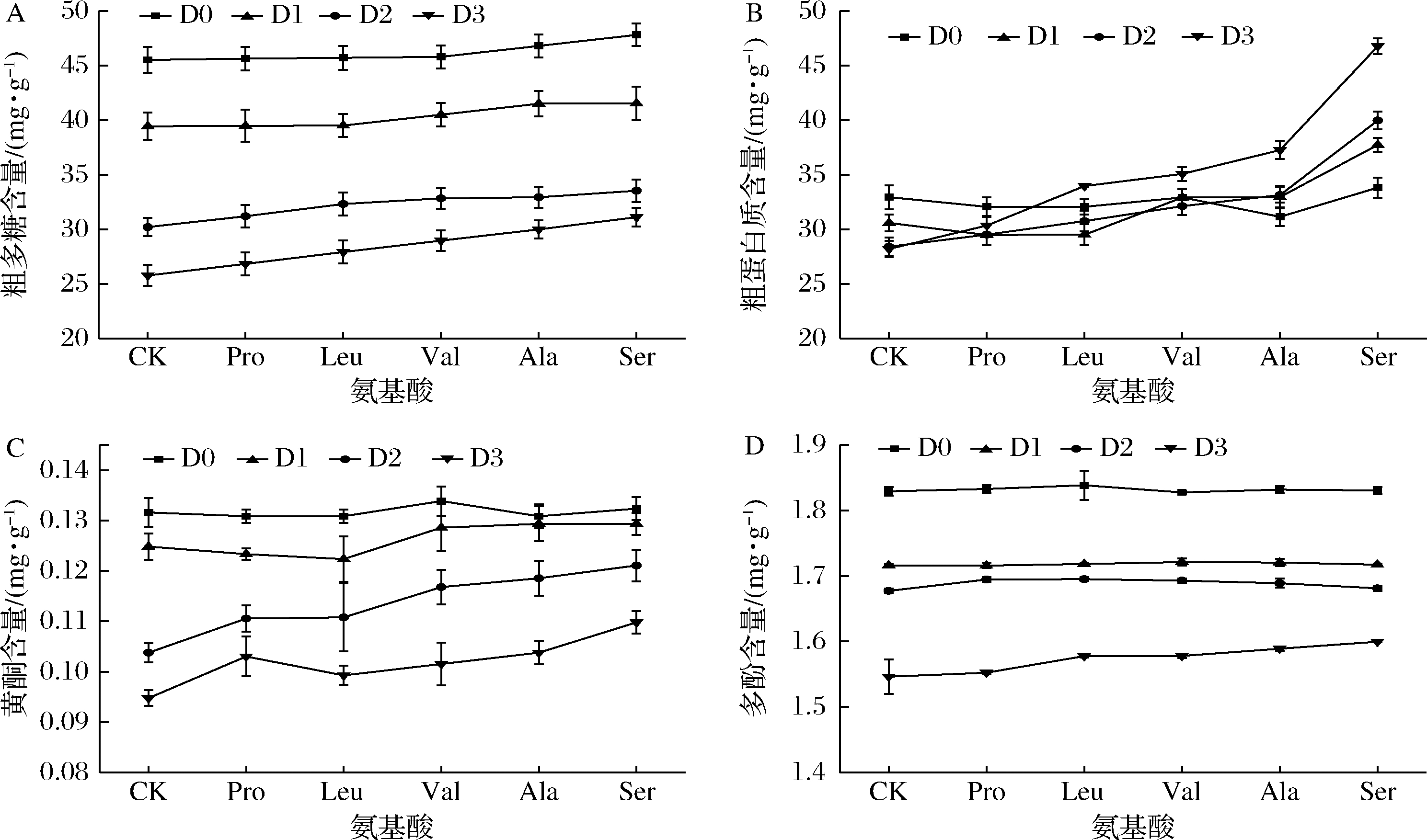
A-粗多糖;B-粗蛋白质;C-黄酮;D-多酚
图4 外源氨基酸对草菇菌丝体粗多糖、粗蛋白质、黄酮、多酚含量的影响
Fig.4 Effects of exogenous amino acids on polysaccharide, protein content, flavonoid content and polyphenol content of Volvariella volvacea mycelium
![]()
图5 外源氨基酸对草菇菌丝![]() 含量的影响
含量的影响
Fig.5 Effects of exogenous amino acids on ![]() and H2O2 content of Volvariella volvacea mycelia
and H2O2 content of Volvariella volvacea mycelia
注:不同小写字母表示差异显著(P<0.05)(下同)
自然界中发现或人工分离的氨基酸有300多种。构成蛋白质一级结构的氨基酸只有20种,且均为L-型氨基酸。本研究在培养基中等量添加20种L-型氨基酸以复壮草菇退化菌种。20种氨基酸的含氮量为7.7%~32.2%,理论上都能作为氮源促进草菇的生长。但实验结果表明,有5种氨基酸(His、Glu、Cys、Lys、Tyr)反而抑制了草菇菌丝体的生长性状。特别是培养基中添加了Cys、Lys、Tyr后,草菇菌丝生长极为缓慢,说明氨基酸在草菇生长发育过程中可能担负着复杂的生理功能。His在组氨酸脱羧酶的催化下易脱羧产生组胺,组胺对细胞具有毒性[25],组胺的积累可能导致草菇菌丝细胞的增殖能力下降,从而抑制草菇菌丝的生长。Cys极易氧化,外源添加Cys后,可能会导致培养基中溶解氧的含量下降,抑制菌体生长。林必桂等[26]研究发现Lys可以通过抑制铜绿微囊藻细胞的 Ca2+Mg2+-ATPase活性以抑制铜绿微囊藻的生长。潘凯等[27]研究发现Tyr对黄瓜枯萎病病原菌有明显抑制作用。Lys和Tyr对草菇菌丝生长抑制作用的具体机理,还有待进一步研究。

A-POD;B-SOD;C-CAT;D-GPX
图6 外源氨基酸对草菇菌丝体POD、SOD、CAT、GPX活性的影响
Fig.6 Effects of exogenous amino acids on POD, SOD, CAT and GPX activities of Volvariella volvacea mycelium
L-丝氨酸是哺乳动物的非必需氨基酸,在氨基酸代谢中处于中间位置,是机体内甘氨酸和半胱氨酸的前体,具有许多重要的生物学功能[28]。Ser能够进入一碳循环,生成一碳单位,一碳单位如甲基能够参与嘌呤等重要物质的合成,而嘌呤能够促进香菇菌丝生长[29]。Ser在本研究中也显著提高了草菇退化菌株的菌丝生长速度和菌丝生物量(图3)。有研究表明,Ser可以转化为甘氨酸,进入一碳代谢,调节甲硫氨酸通路[30],同时为细胞提供还原力,产生还原型辅酶Ⅱ和谷胱甘肽[31]。Ser是连接糖酵解、谷胱甘肽合成循环的中间节点,补充Ser可改善谷胱甘肽抗氧化系统,减少氧化自由基的产生,防止自由基对细胞的损伤,从而降低氧化应激水平[32]。本研究发现在培养基中添加Ser后,退化菌株的活性氧含量积累减少(图5),抗氧化酶如POD、SOD、CAT、GPX的活力增加(图6),有效复壮了草菇退化菌种的菌丝特性。本研究为草菇及其他食用菌退化菌种的复壮研究提供理论依据和技术支持。
[1] 吴显荣. 氨基酸营养[J].氨基酸杂志, 1988,10(2):21-28.
WU X R.Amino acid nutrition[J].Journal of Amino Acids, 1988,10(2):21-28.
[2] SZABADOS L, SAVOURÉ A.Proline:A multifunctional amino acid[J].Trends in Plant Science, 2010,15(2):89-97.
[3] MEMMOTT S D, HA Y S, DICKMAN M B.Proline reverses the abnormal phenotypes of Colletotrichum trifolii associated with expression of endogenous constitutively active Ras[J].Applied and Environmental Microbiology, 2002, 68(4):1 647-1 651.
[4] LEUNG P H, WU J Y.Effects of ammonium feeding on the production of bioactive metabolites (cordycepin and exopolysaccharides) in mycelial culture of a Cordyceps sinensis fungus[J].Journal of Applied Microbiology, 2007, 103(5):1 942-1 949.
[5] 贲松彬, 李惠娇, 黄子琪, 等.蛹虫草菌丝体发酵培养过程中氨基酸添加技术研究[J].食品科学, 2010, 31(23):233-237.
BEN S B, LI H J, HUANG Z Q, et al.Amino acid addition technology during mycelium fermentation of Cordyceps militaris[J].Food Science, 2010, 31(23):233-237.
[6] 马元伟, 王荣, 高强, 等.外源氨基酸的添加对恢复或预防丝状真菌退化的研究[J].生物学杂志, 2017, 34(2):108-111.
MA Y W, WANG R, GAO Q, et al.Rejuvenation and preventing degradation of filamentous fungi by adding exogenous amino acids[J].Journal of Biology, 2017, 34(2):108-111.
[7] 安学明, 陈超, 刘小霞, 等.草菇继代培养中菌种退化对子实体营养成分的影响[J].菌物学报, 2020, 39(2):390-397.
AN X M, CHEN C, LIU X X, et al.Effects of degeneration of cultivated strains on fruiting body nutrients of Volvariella volvacea during subculture[J].Mycosystema, 2020, 39(2):390-397.
[8] 刘小霞, 安学明, 贠建民, 等.改变培养基碳源复壮草菇退化菌种[J].菌物学报, 2020, 39(7):1 312-1 321.
LIU X X, AN X M, YUN J M, et al.Rejuvenation of Volvariella volvacea degeneration strains by changing medium carbon source[J].Mycosystema, 2020.39(7):1 312-1 321.
[9] 陈长兰, 孟程程, 佟丽, 等.不同种类氨基酸对蛹虫草菌丝体生长和虫草素含量的影响[J].食品科学, 2012, 33(23):236-239.
CHEN C L, MENG C C, TONG L, et al.Effects of different kinds of amino acids on mycelial growth and cordycepin content in Cordyceps militaris[J].Food Science, 2012, 33(23):236-239.
[10] 宗元元. 病原真菌Penicillium expansum棒曲霉素生物合成的分子基础及调控机制[D].北京:中国科学院大学, 2015.
ZONG Y Y.Molecular basis and regulatory mechanism of patulin biosynthesis in pathogenic fungus Penicillium expansum [D].Beijing:University of Chinese Academy of Sciences, 2015.
[11] 陶美华, 潘清灵, 章卫民.药用真菌多糖含量测定方法研究[J].中国食用菌, 2005,24(5):37-38.
TAO M H, PAN Q L, ZHANG W M.Study on the determination method of polysaccharides in medicinal fungi[J].Edible Fungi of China, 2005,24(5):37-38.
[12] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1-2):248-254.
[13] 陈文英, 叶建中, 王成章, 等.高品质竹叶黄酮的筛选及测定方法的比较[J].现代化工, 2008, 28(S2):355-358.
CHEN W Y, YE J Z, WANG C Z, et al.Screening of high quality bamboo leaf flavonoids and comparison of its determination methods[J].Modern Chemical Industry, 2008, 28(S2):355-358.
[14] 吴澎, 贾朝爽, 李向阳, 等.响应面分析优化福林酚法测定樱桃酒中总酚的含量[J].食品工业科技, 2018, 39(20):200-206;211.
WU P, JIA C S, LI X Y, et al.Determination of the total phenolic content from cherry wine by Folin-ciocalteu method optimized by response surface methodology[J].Science and Technology of Food Industry, 2018, 39(20):200-206;211.
[15] 朱广廉, 钟海文.植物生理学实验[M].北京:北京大学出版社, 1990.
ZHU G L, ZHONG H W.Plant Physiology Experiment[M].Beijing:Peking University Press, 1990.
[16] 田平平, 王杰, 秦晓艺, 等.采后处理对杏鲍菇贮藏品质及抗氧化酶系统的影响[J].中国农业科学, 2015, 48(5):941-951.
TIAN P P, WANG J, QIN X Y, et al.Effect of postharvest treatment on the storage quality and antioxidant enzyme system of Pleurotus eryngii[J].Scientia Agricultura Sinica, 2015, 48(5):941-951.
[17] 吕蔷, 朱继英, 王相友.双孢蘑菇POD酶学特性及其与褐变的关系[J].园艺学报, 2016, 43(3):595-602.
LYU Q, ZHU J Y, WANG X Y.Characteristics of peroxidase from Agaricus bisporus and its relationship with browning[J].Acta Horticulturae Sinica, 2016, 43(3):595-602.
[18] 周葆初, 徐柏芬, 于敬海.红细胞中超氧化物歧化酶活性测定[J].中国地方病学杂志, 1992,11(2):46-48.
ZHOU B C, XU B F, YU J H.Determination of superoxide dismutase activity in erythrocytes[J].Chinese Journal of Endemiology, 1992,11(2):46-48.
[19] KATO M, SHIMIZU S.Chlorophyll metabolism in higher plants.Ⅶ.Chlorophyll degradation in senescing tobacco leaves:Phenolic-dependent peroxidative degradation[J].Canidian Journal of,Botany, 1987, 65(4):729-735.
[20] 张恩芬, 查飞, 周建宝, 等.酶标仪法测定发酵液中谷胱甘肽的含量[J].滁州学院学报, 2019, 21(5):31-34.
ZHANG E F, ZHA F, ZHOU J B, et al.Determination of glutathione in fermentation broth by enzyme-linked immunosorbent assay[J].Journal of Chuzhou University, 2019, 21(5):31-34.
[21] ROYSE D J, SANCHEZ-VAZQUEZ J E.Influence of precipitated calcium carbonate (CaCO3) on shiitake (Lentinula edodes) yield and mushroom size[J].Bioresource Technology, 2003, 90(2):225-228.
[22] RODRIGUEZ ESTEADA A E,ROYSE D J.Yield, size and bacterial blotch resistance of Pleurotus eryngii grown on cottonseed hulls/oak sawdust supplemented with manganese, copper and whole ground soybean[J].Bioresource Technology, 2007, 98(10):1 898-1 906.
[23] HOU L J, LI Y, CHEN M J, et al.Improved fruiting of the straw mushroom (Volvariella volvacea) on cotton waste supplemented with sodium acetate[J].Applied Microbiology and Biotechnology, 2017, 101(23-24):8 533-8 541.
[24] REN Y Y, SUN P P, LI H R, et al.Effects of Na2SeO3 on growth, metabolism, antioxidase and enzymes involved in polysaccharide synthesis of Cordyceps militaris[J].Process Biochemistry, 2020, 97:64-71.
[25] MUNSHI A, SHAFI G, ALIYA N, et al.Histone modifications dictate specific biological readouts[J].Journal of Genetics and Genoimics, 2009, 36(2):75-88.
[26] 林必桂, 杨柳燕, 肖琳, 等.赖氨酸抑制铜绿微囊藻生长的机理研究[J].农业环境科学学报, 2008,27(4):1 561-1 565.
LIN B G, YANG L Y, XIAO L, et al.Mechanism of the inhibition effect of lysine on Microcystis aeruginosa[J].Journal of Agro-environment Science, 2008,27(4):1 561-1 565.
[27] 潘凯, 吴凤芝.氨基酸对黄瓜枯萎病病原菌生长发育的影响[J].北方园艺, 2008(2):228-231.
PAN K, WU F Z.Effects of amino acids on growth and development of Fusarium oxysporum f.sp.cucumerinum[J].Northern Horticulture, 2008(2):228-231.
[28] 何流琴, 金顺顺, 周锡红, 等.丝氨酸对动物机体健康的影响研究进展[J].动物营养学报, 2020, 32(10):4 480-4 490.
HE L Q, JIN S S, ZHOU X H, et al.Research progress on effects of serine on animal health[J].Chinese Journal of Animal Nutrition, 2020, 32(10):4 480-4 490.
[29] 邱昌恩, 江涓.6-苄基腺嘌呤促进香菇菌丝体生长的作用机理研究[J].食用菌, 2002,24(5):5-6.
QIU C E, JIANG J.Study on the mechanism of 6-benzyladenine promoting the growth of Lentinus edodes mycelium[J].Edible Fungi, 2002,24(5):5-6.
[30] DESCHOEMAEKER S, DI CONZA G,LILLA S, et al.PHD1 regulates p53-mediated colorectal cancer chemoresistance[J].EMBO Molecular Medicine, 2015, 7(10):1 350-1 365.
[31] 赵开亮. Mdm2-p53信号通路调控及p53抑制肿瘤转移的机制研究[D].合肥:中国科学技术大学, 2020.
ZHAO K L.Machanistic inverstigation of the regulation of the Mdm2-p53 pathway and p53-suppressed tumor metastasic[D].Hefei:University of science and technology of China, 2020.
[32] ZHOU X H, HE L Q, ZUO S N, et al.Serine prevented high-fat diet-induced oxidative stress by activating AMPK and epigenetically modulating the expression of glutathione synthesis-related genes[J].Biochim Biophys Acta, 2018, 1 864(2):488-498.