丙烯酰胺(acrylamide, AM, C3H5 NO)是一种食品高温加工时生成的有害物质,常见于煎炸、烧烤、烘焙食品,如薯片、面包、咖啡、饼干、油条、油炸坚果及谷类等[1]。AM也是一种常用的工业原料,长期以来被广泛应用于饮用水和工业废水处理、石油开采、造纸、纺织、黏合剂、染料、化妆品生产等领域。现实生活中,人们暴露于AM主要是通过接触AM污染的大气、水源、物品,以及食用含有AM的食品等[2]。AM可通过消化道、呼吸道、皮肤黏膜等多种途径进入生物体内产生致癌性、神经毒性、遗传毒性、生殖毒性及心脏发育毒性,还能干扰内分泌系统[3-4]。不仅如此,近年来有研究显示AM对免疫系统也有潜在危害。AM染毒后,大鼠的阳性外周血淋巴细胞数、胸腺细胞数和脾细胞减少,Th/Ts比例失调,自然杀伤细胞失活。染毒小鼠的腹腔巨噬细胞的吞噬功能下降,脾脏丙二醛(malondialdehyde,MDA)含量、超氧化物歧化酶(superoxide dismutase,SOD)活性降低。AM还可以通过线粒体氧化应激诱导小鼠脾细胞凋亡[5-7]。美国流行病学研究指出AM诱导的哮喘、发烧、打喷嚏和湿疹等过敏类似反应可能也与AM导致的免疫缺陷有关[8]。免疫系统功能与人类健康息息相关。因此,控制AM的免疫毒性对维持机体健康具有重大意义。
活性多糖被誉为人体“第七营养素”,大量研究证实其具有优良的调节免疫、抗肿瘤、抗病毒、降血压、降血脂、降血糖、抗衰老、抗辐射、保护肝肾等作用。多糖的安全性高,在食品和保健品等领域具有极高的应用价值。活性多糖的研究开发一直受到国内外各行业的密切关注,是学界的热门领域。而多糖在免疫机制方面的研究进展迅速,已由一般性的观察发展到分子水平,其中以多糖免疫功能对巨噬细胞的影响尤为突出[9]。山药是一种食用和保健价值很高的天然食品资源。我国山药资源丰富,在陕西、河南等省份广泛种植。近来,在农业科技强农和脱贫致富政策的带动下,许多地区也开始了大面积种植。山药营养价值丰富,山药多糖(Rhizoma dioscoreae polysaccharides, RDPS)是山药的重要功能活性成分,目前已有报道显示山药多糖具有良好抑菌活性[10]和降脂、降血糖作用[11-13],能抑制肿瘤细胞的增殖[14],促进正常细胞如人子宫内膜上皮细胞的生长[15]。此外,山药多糖还可以增强巨噬细胞的吞噬功能[16],发挥免疫调节活性,但山药多糖能否有效干预AM诱导的巨噬细胞损伤,未见报道。因此,本研究以AM诱导小鼠免疫细胞-巨噬细胞损伤,山药多糖干预AM的毒性,探究山药多糖对小鼠巨噬细胞的保护作用,研究结果将为揭示山药多糖调节免疫的作用机制提供理论依据;对促进山药多糖的深入开发应用,以及控制AM毒性都具有积极意义。
1 材料与方法
1.1 材料与试剂
小鼠巨噬细胞株RAW264.7细胞,中国科学院细胞库。
山药多糖(UV≥90%),武汉琼格生物科技有限公司;AM,美国Amresco公司;DMEM 培养基,美国Gibco公司;胎牛血清,美国Zeta Life公司;青链霉素混合液(100×)、EDTA-胰蛋白酶消化液、中性红染液(1 mg/mL),美国Solarbio公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、牛血清白蛋白(bovine albumin,BSA)、小牛胸腺DNA、卵磷脂,北京索莱宝科技有限公司;DAPI染色液,碧云天生物技术研究所;SOD、活性氧(reactive oxygen species,ROS)、MDA测定试剂盒,南京建成生物工程研究所;1,10-邻菲罗啉盐酸盐(Phen),天津市科密欧化学试剂有限公司;三氯乙酸(trichloroacetic acid,TCA),上海山浦化工有限公司;2-硫代巴比妥酸(thiobarbituric acid,TBA),上海源叶生物有限公司;其余试剂均为分析纯。
1.2 仪器与设备
Varioskan flash全波长扫描式多功能酶标仪、CO2细胞培养箱,美国Thermo公司;IX71荧光倒置显微镜,日本OLYMPUS公司;小型垂直电泳仪,美国Bio-Rad公司;KQ3200E 超声清洗仪,苏州昆山市超声仪器有限公司;5415D 离心机,德国Eppendorf公司。
1.3 实验方法
1.3.1 细胞培养
将小鼠巨噬细胞株RAW264.7细胞培养于DMEM完全培养基(含胎牛血清10%、双抗1%,均为体积分数),在37 ℃、5%(体积分数)CO2细胞培养箱中培养。
1.3.2 AM诱导RAW264.7细胞氧化损伤模型的建立
取对数生长期的细胞接种于96孔板中,以8×103个/孔接种于96孔板中,过夜培养。细胞贴壁后,AM诱导试验组每孔加入100 μL以无血清培养基配制的AM溶液(2.0、3.0、4.0、5.0、6.0 mmol/L),空白组加入等体积无血清培养基,每组设6个重复。培养结束后,吸出旧培养基,每孔中加入100 μL MTT工作液(0.5 mg/mL),继续培养4 h弃上清液,加入200 μL DMSO,置于100 r/min摇床,10 min。用酶标仪在490 nm处测定OD值。细胞活力按公式(1)计算:
细胞活力![]()
(1)
式中:A0为空白组平均OD值,A1为试验组平均OD值。
1.3.3 山药多糖对AM诱导的巨噬细胞生长活力的影响
选取对数生长期的RAW264.7细胞,以8×103 个/孔接种于96孔板中,过夜培养。细胞贴壁后,弃去上清液,空白组及AM诱导试验组,每孔加入100 μL无血清培养基;山药多糖预处理试验组,山药多糖单独处理试验组加入等体积无血清培养基配置的多糖溶液(25.0、50.0、100.0、200.0、500.0 μg/mL)。细胞置培养箱孵育4 h后,山药多糖预处理试验组及AM诱导试验组弃上清液加入100 μL AM溶液(4.0 mmol/L),继续培养24 h。培养结束后,按1.3.2方法计算细胞活力。
1.3.4 山药多糖对AM诱导的巨噬细胞吞噬活力的影响
RAW264.7的吞噬能力可以通过其吞噬中性红的能力进行衡量。按1.3.3对细胞培养及处理。培养结束后,弃去培养基并向孔中加入100 μL的中性红试剂(1 mg/mL)。10 min后,去除多余中性红并用 PBS洗涤2遍,加入200 μL细胞裂解液[V(乙醇)∶V(冰乙酸)=1∶1]在室温下裂解1 h后利用酶标仪测定540 nm处的OD值。吞噬活性按公式(2)计算:
吞噬指数![]()
(2)
式中:A0为空白组平均OD值,A1为试验组平均OD值。
1.3.5 山药多糖对AM诱导的巨噬细胞氧化应激的影响
细胞培养基中SOD及MDA水平的测定:按1.3.3对细胞培养及处理后,依据相应试剂盒方法测定细胞培养基中的SOD及MDA含量。
细胞中ROS水平的测定:按1.3.2处理细胞后,细胞以PBS洗涤2次,加入10 μmol/L的DCFH-DA(用无血清培养基配制)37 ℃孵育20 min,弃去培养基并用无血清细胞培养液洗涤细胞3次,加入200 μL/孔无血清培养基,用荧光显微镜观察并拍照。
1.3.6 山药多糖对生物大分子氧化损伤的影响
参照WANG等[17]的方法分别建立BSA损伤模型,DNA损伤模型及脂质氧化损伤模型。
山药多糖对BSA氧化损伤保护活性的测定:采用SDS-PAGE检测不同质量浓度的山药多糖对蛋白氧化损伤的抑制作用。于1.5 mL离心管中加入40 μL BSA (0.5 mg/mL)与10 μL不同质量浓度的山药多糖溶液(2.5、5.0、25.0、50.0 μg/mL)混合,37 ℃水浴10 min。后加入10 μL CuSO4(1.0 mmol/L),10 μL H2O2溶液(2.5 mmol/L)并设置正常对照组,损伤对照组。继续37 ℃处理90 min,加上样缓冲液处理后,即可上样电泳。电泳条件:浓缩胶中电压80 V、10 min;分离胶中电流电压120 V、2 h。电泳完成后,凝胶以考马斯亮蓝法染色,染色后于脱色液中脱色30 min,利用Scion Image软件拍照并分析条带。
山药多糖对羟自由基(·OH)引发的DNA损伤的防护作用:于1.5 mL离心管中加入100 μL不同质量浓度的山药多糖溶液(2.5、5.0、25.0、50.0 μg/mL)及20 μL DNA(3.0 mg/mL)混匀,37 ℃水浴处理10 min。10 min试验组后依次加入10 μL CuSO4(1.0 mmol/L)、22.8 μL Phen(1.75 mmol/L)、20 μL 维生素C(17.5 mmol/L),用Tris-HCl(pH 7.0, 10.0 mmol/L)缓冲液补足200 μL同时设损伤对照组(无山药多糖)、空白组(无山药多糖和诱导损伤试剂),37 ℃水浴30 min,然后加入200 μL TBA(1 g/100mL)和200 μL TCA(28 g/100mL),100 ℃加热10 min,冷却后利用酶标仪测定532 nm处OD值。抑制率按公式(3)计算:
抑制率![]()
(3)
式中:A0为空白组平均OD值,A1为试验组平均OD值,A2为损伤对照组平均OD值。
山药多糖对脂质氧化损伤保护活性的测定:在1.5 mL离心管中依次加入40 μL脂质体液体,80 μL不同质量浓度山药多糖溶液,混匀,加入10 μL FeSO4(50.0 mmol/L),设置损伤组,空白对照组,以PB缓冲液补足600 μL。3组同时置于37 ℃水浴中温育40 min,每5 min振摇1次。温育完成后,每管加入TCA (10 g/100mL)、TBA(0.8 g/100mL)各200 μL,混匀,于100 ℃水浴15 min,冷却后取上清液用酶标仪测定532 nm处OD值。抑制率同按公式(3)计算。
1.4 数据处理方法
使用Origin 9.0和SPSS 11软件对数据进行统计学分析,所有实验均重复3次,结果以平均值±标准差表示,用组间方差分析进行统计分析,采用最小差异显著法进行显著性比较(P<0.05)。
2 结果与分析
2.1 山药多糖对AM诱导的巨噬细胞生长活力的影响
首先以不同浓度AM(0.0、2.0、3.0、4.0、5.0、6.0 mmol/L)处理RAW264.7巨噬细胞24 h,构建AM诱导损伤模型,结果如图1所示,与未加AM的对照组相比,不同浓度AM作用下的巨噬细胞活力明显下降,并且随AM浓度的增加,巨噬细胞活力呈逐步递减趋势。以2.0 mmol/L的AM处理后细胞活力和对照组相比即有显著差异。当AM浓度增加至4.0 mmol/L时,细胞活力降至55.3%,6.0 mmol/L浓度处理后,细胞活力不足30.0%。AM的半数抑制浓度为4.9 mmol/L(y=-10.551 27x+101.616 82,R2= 0.938 77)。结果表明,AM对巨噬细胞活力的抑制作用具有浓度依赖性,模型构建成功,但是考虑到后续试验的干预效果,结合半数致死量,选择4.0 mmol/L构建巨噬细胞损伤模型,进行后续研究。
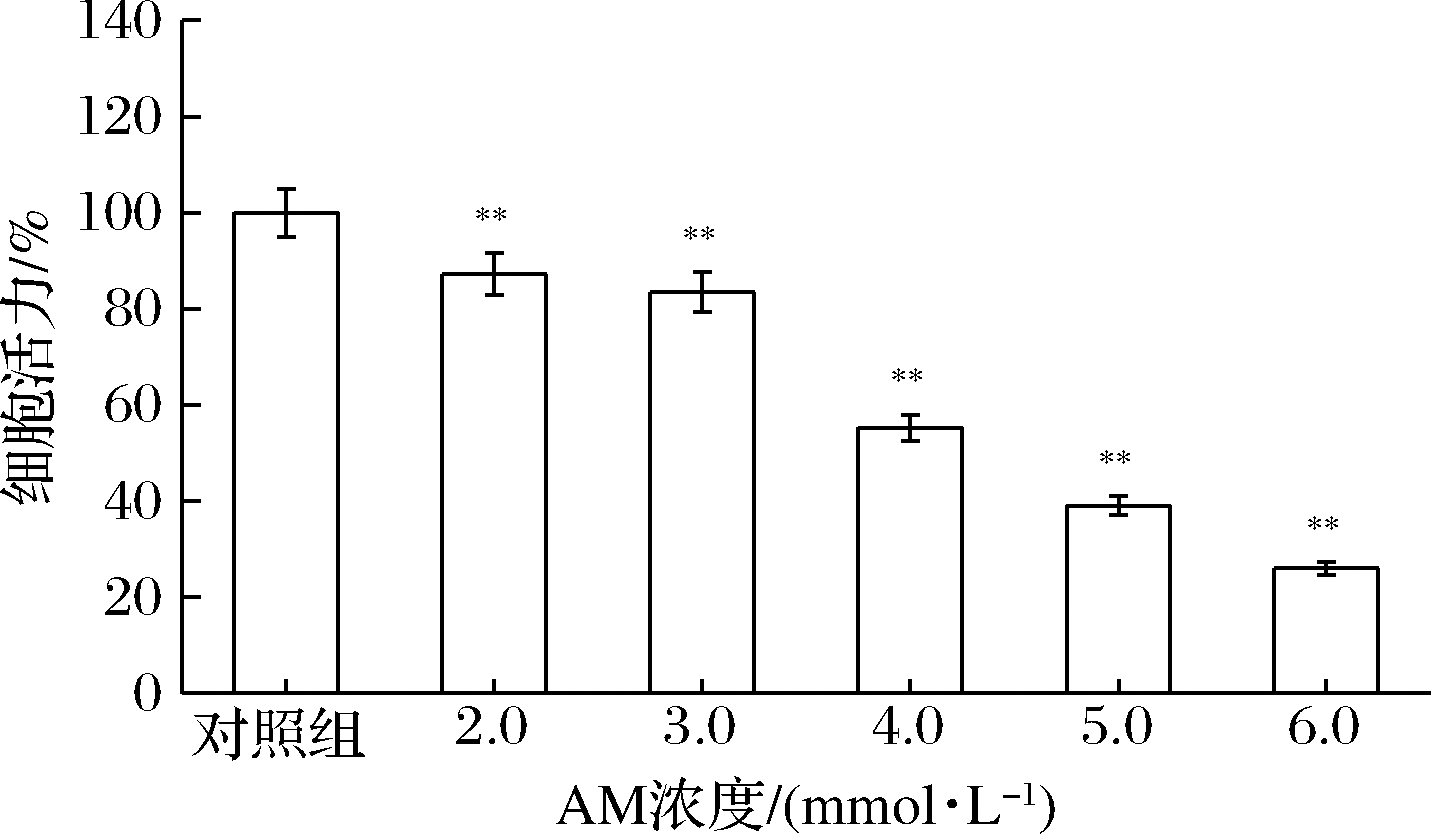
图1 AM对巨噬细胞活力的影响
Fig.1 The effect of acrylamide on RWA264.7 cell viability
注:**表示与空白组相比差异极显著(P<0.01)
其次,以不同质量浓度山药多糖处理巨噬细胞24 h,以评价山药多糖的细胞毒性,并确定合适的作用浓度,结果如图2所示。一定质量浓度山药多糖质量作用后巨噬细胞活力与未加山药多糖的对照组相比无显著差异,表明山药多糖在一定浓度范围内不影响巨噬细胞的正常生长和活力。因此,选取合适质量浓度(25.0、50.0、100.0、200.0、500.0 μg/mL)的山药多糖进行保护巨噬细胞的研究。图3显示,与只加AM(4.0 mmol/L)的对照组相比,25.0 μg/mL山药多糖预处理组,巨噬细胞活力仅能提高10%左右,而山药多糖质量浓度增加至50.0 μg/mL时,巨噬细胞活力大幅度升高,达到97.8%;而后随着山药多糖质量浓度的增加,细胞活力有小幅度波动,但细胞活力始终维持在90.0%以上。结果表明,山药多糖能够抑制AM诱导的巨噬细胞损伤,在质量浓度为50.0~500.0 μg/mL范围内均能有效恢复细胞活力。
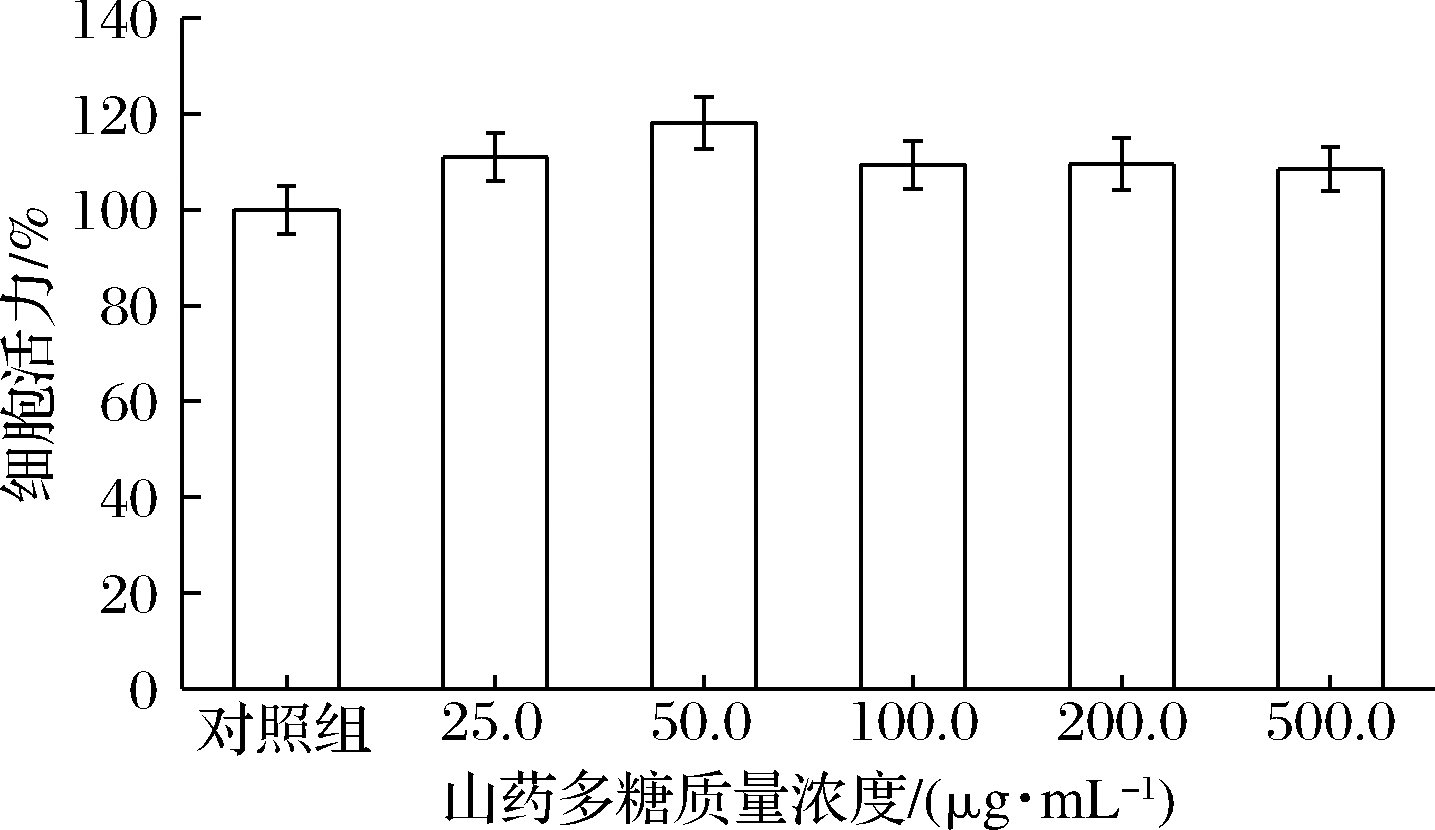
图2 山药多糖对巨噬细胞活力的影响
Fig.2 The effect of Rhizoma dioscoreae polysaccharides on RWA264.7 cell viability

图3 山药多糖对AM诱导的巨噬细胞活力的影响
Fig.3 The effect of Rhizoma dioscoreae polysaccharides on acrylamide-induced cell viability
注:*表示与空白组相比差异显著(P<0.05);**表示 与空白组相比差异极显著(P<0.01);#表示与AM(4.0 mmol/L) 相比差异显著(P<0.05);##表示与AM组(4.0 mmol/L)相比 差异极显著(P<0.01)(下同)
2.2 山药多糖对AM诱导的巨噬细胞吞噬活力的影响
巨噬细胞具有非特异性吞噬功能,其吞噬与清除能力是机体启动免疫的重要途径之一[18]。山药多糖对AM诱导的巨噬细胞吞噬活力的影响如图4所示,4.0 mmol/L的AM诱导损伤后,细胞吞噬活力下降至80.0%左右,与正常对照组相比,有显著差异;而不同质量浓度的山药多糖干预组,细胞吞噬活力较诱导损伤组相比有大幅度提升,100.0、200.0 μg/mL的山药多糖预处理组,细胞吞噬活力提高了30.0%左右。500.0 μg/mL的山药多糖预处理组吞噬活力有所下降,但仍显著高于诱导组。结果表明,山药多糖能够抑制AM诱导的巨噬细胞损伤,显著提高巨噬细胞的吞噬活力。
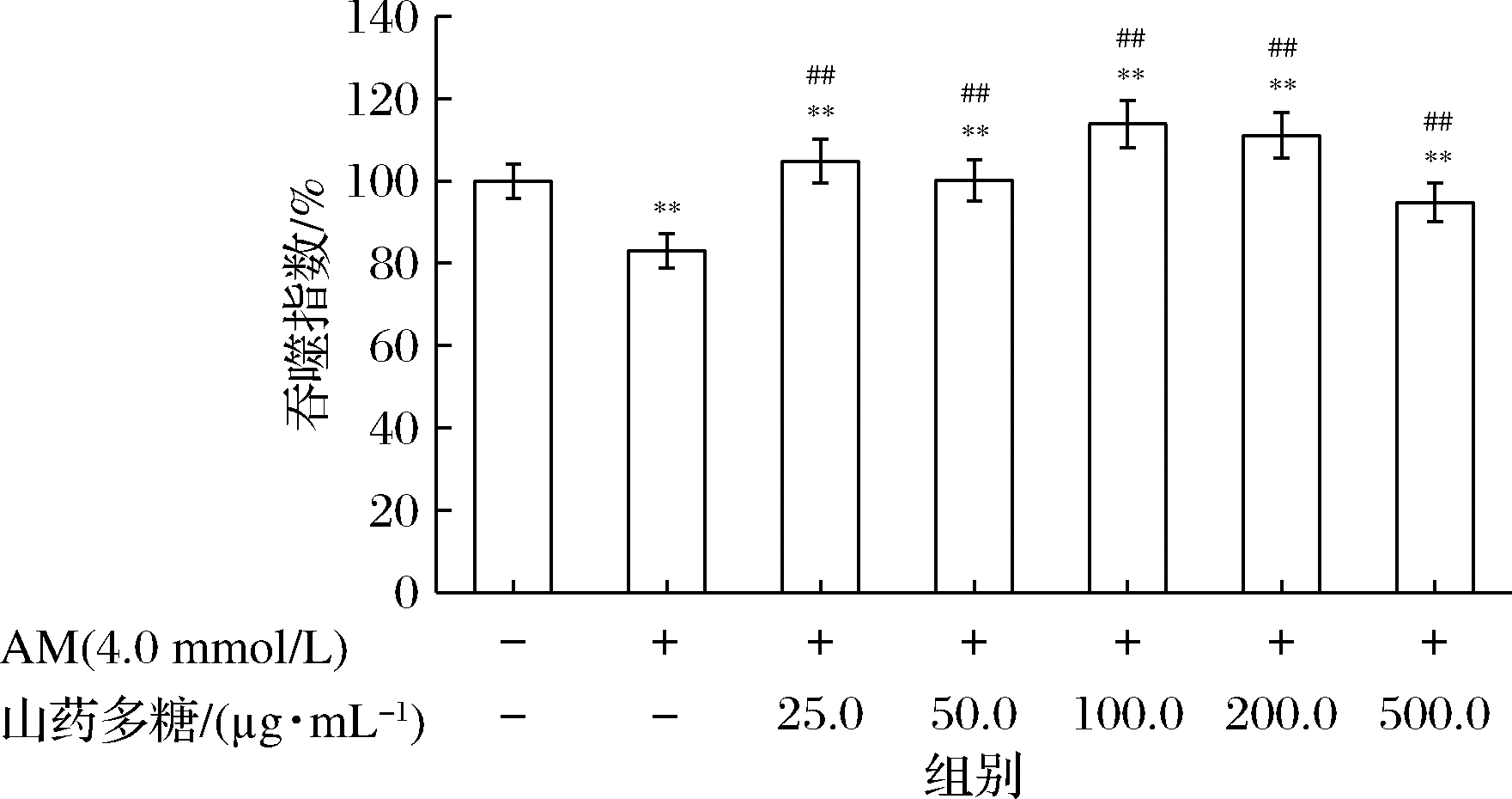
图4 山药多糖对AM诱导的巨噬细胞吞噬活力的影响
Fig.4 The effect of Rhizoma dioscoreae polysaccharides on acrylamide-induced cell phagocytic activity
2.3 山药多糖对AM诱导的巨噬细胞氧化应激的影响
研究证明氧化应激是AM诱导细胞损伤的关键机制之一[19],山药多糖具有良好的抗氧化作用,本研究探究了干预AM诱导细胞损伤后,细胞氧化水平的变化趋势,图5和图6显示山药多糖对AM诱导的巨噬细胞氧化损伤的影响。与正常对照组比较,4.0 mmol/L AM处理后,反映细胞脂质氧化程度的MDA水平显著增加,反映细胞抗氧化能力的SOD酶活力显著降低;而不同质量浓度的山药多糖预处理组,与诱导损伤组相比,MDA含量有不同程度的降低,SOD活性也不同程度的增加,且山药多糖的干预效果与多糖质量浓度呈依赖性变化。
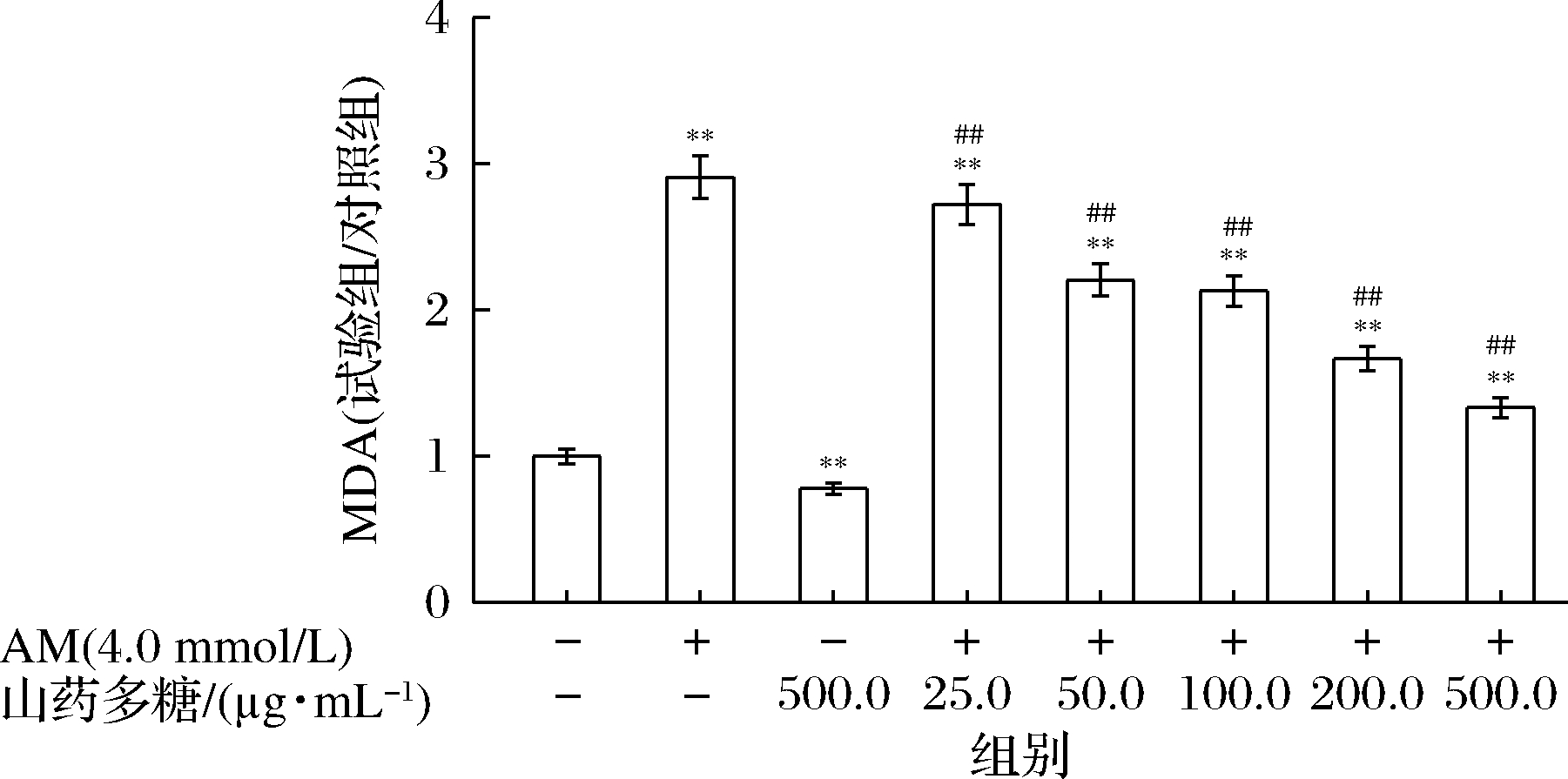
图5 山药多糖对AM诱导的细胞MDA水平的影响
Fig.5 The effect of Rhizoma dioscoreae polysaccharides on the level of MDA under acrylamide damage
ROS是生命活动中的重要信号分子,但是大量产生的活性氧一旦扰乱机体氧化还原稳态,便会加重细胞损伤,甚至诱导细胞死亡[20]。山药多糖对AM诱导的巨噬细胞活性氧产生的影响如图7所示,与正常对照组相比,AM(4.0 mmol/L)诱导组,细胞内ROS水平显著增加;山药多糖单独处理对细胞内ROS水平无显著影响;相比AM诱导组,25.0 μg/mL山药多糖预处理组ROS水平有所降低,但是500.0 μg/mL山药多糖预处理组的ROS产生明显减少,效果更好。研究表明山药多糖可以提高细胞抗氧化能力,抑制AM导致的巨噬细胞氧化损伤。
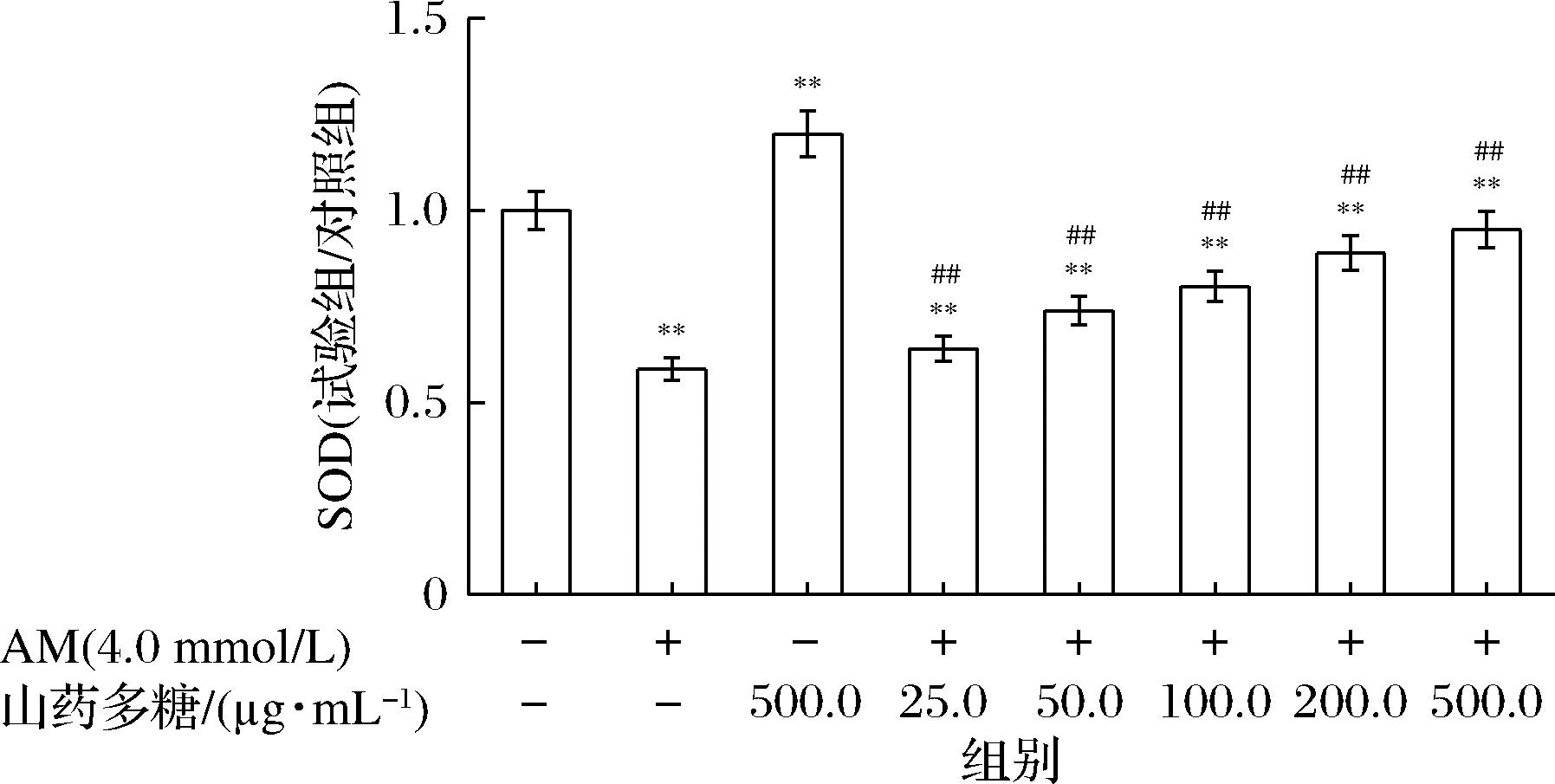
图6 山药多糖对AM诱导的细胞SOD活力的影响
Fig.6 The effect of Rhizoma dioscoreae polysaccharides on the activity of SOD under acrylamide damage

a-山药多糖对AM诱导的细胞ROS荧光图;b-平均荧光强度量化柱形图
图7 山药多糖对AM诱导的细胞ROS产生的影响
Fig.7 The effect of Rhizoma dioscoreae polysaccharides on the production of ROS under acrylamide damage
2.4 山药多糖对生物大分子氧化损伤的影响
细胞实验结果显示,山药多糖可以显著恢复细胞活力和吞噬功能,抑制AM诱导的活性氧产生。ROS是一类由氧形成的、具有未配对电子的氧原子或原子团的总称。生物机体内的ROS主要有超氧阴离子自由基![]() 单线态氧(1O2)以及由此衍生的烷过氧自由基(ROO·)、烷氧自由基(RO·)等[21],其中·OH占据机体自由基80%以上,最为活跃。在机体内,因具有很强的氧化反应能力,过量产生的·OH等活性氧易与蛋白质、DNA、脂膜等各种生物大分子发生反应而导致细胞和组织氧化损伤[21]。因此,本研究以生物大分子(蛋白质、DNA、脂类)氧化损伤为模型,以山药多糖进行干预,进一步评价山药多糖的保护作用。
单线态氧(1O2)以及由此衍生的烷过氧自由基(ROO·)、烷氧自由基(RO·)等[21],其中·OH占据机体自由基80%以上,最为活跃。在机体内,因具有很强的氧化反应能力,过量产生的·OH等活性氧易与蛋白质、DNA、脂膜等各种生物大分子发生反应而导致细胞和组织氧化损伤[21]。因此,本研究以生物大分子(蛋白质、DNA、脂类)氧化损伤为模型,以山药多糖进行干预,进一步评价山药多糖的保护作用。
Cu2+/H2O2反应体系可通过类Fenton反应产生·OH,而·OH可攻击蛋白质的肽链和氨基酸残基,导致蛋白质的氧化损伤。首先以Cu2+/H2O2诱导体系构建BSA损伤模型,以山药多糖进行保护,结果如图8所示,与正常对照组相比,诱导损伤组的蛋白残留量明显减少,表明蛋白被氧化降解;与诱导损伤组相比,不同质量浓度山药多糖作用下,蛋白残留量有不同程度的增加,表明山药多糖对蛋白有一定的保护作用。在2.5~50.0 μg/mL,蛋白残留量呈先增加后减少的趋势,当山药多糖质量浓度为5.0 μg/mL时,蛋白残留量明显增加,而50.0 μg/mL的山药多糖预处理后,保护效果开始变差。山药多糖质量浓度为5.0和25.0 μg/mL时,对蛋白氧化具有最佳的抑制效果。
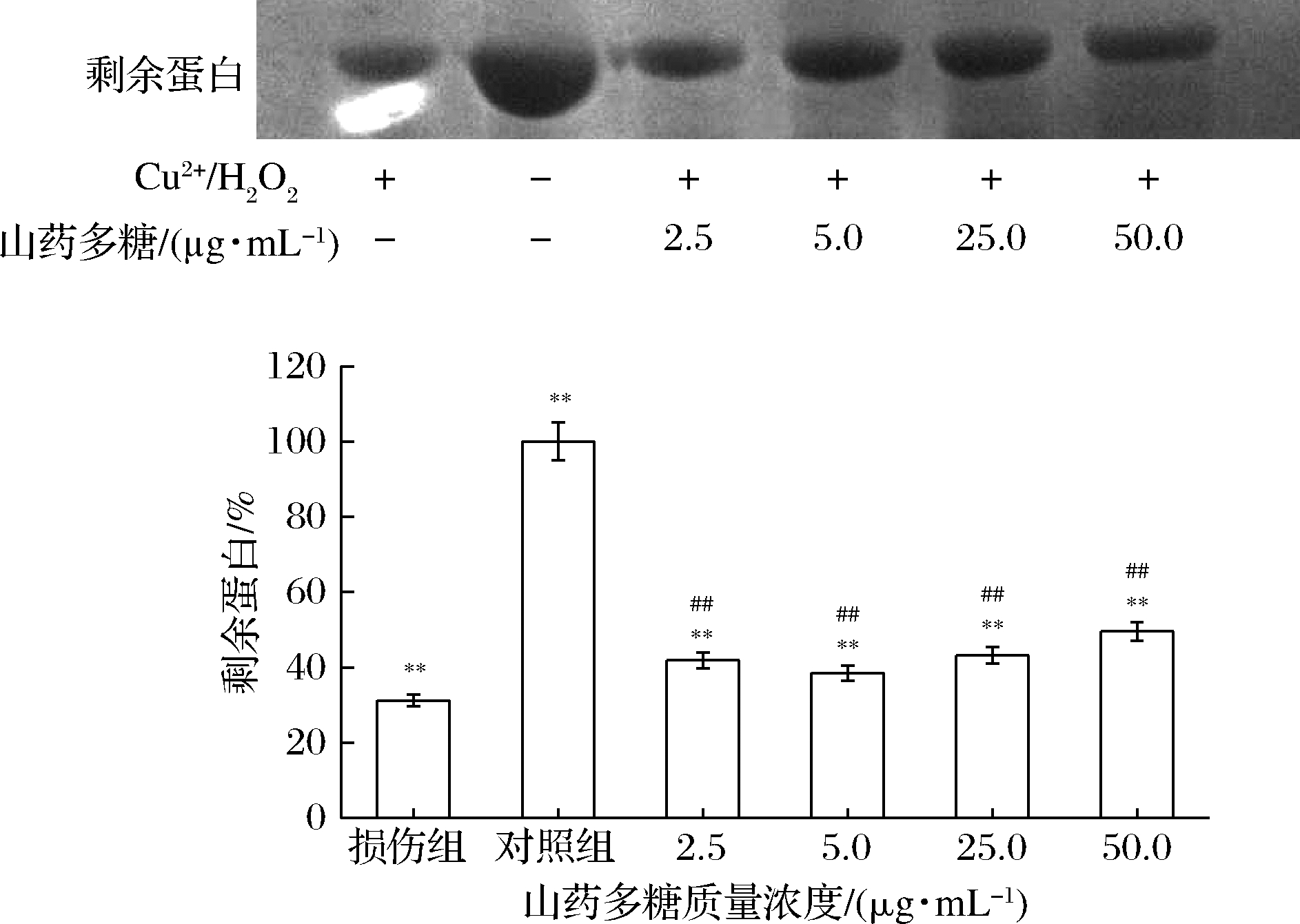
图8 山药多糖对BSA蛋白氧化损伤的影响
Fig.8 The effect of Rhizoma dioscoreae polysaccharides on oxidative damage of BSA protein
有机体内广泛存在着铜、铁等金属离子,维生素C可将Fe3+还原为Fe2+,在有H2O2存在时,可通过Fenton反应产生·OH,对机体造成损害。·OH作用于DNA致使脱氧核糖环断裂,生成MDA及其类似物。MDA及其类似物在酸性条件下与TBA反应生成1种粉红色化合物,该化合物在532 nm处有最大吸光度,因此,可用MDA-TBA反应检测DNA的损伤程度。以Phen-CuSO4-维生素C体系诱导DNA损伤,山药多糖进行保护,结果如图9所示。不同质量浓度(0.5~50.0 μg/mL)的山药多糖能够显著抑制DNA的氧化损伤,质量浓度为0.5 μg/mL的山药多糖保护组,DNA的氧化程度降至诱导组(多糖未保护组)的54.3%。随着多糖质量浓度的升高,DNA损伤氧化程度呈缓慢降低趋势,在多糖质量浓度为5.0 μg/mL时,DNA氧化程度最低(41.9%),山药多糖保护作用最佳;而后随山药多糖质量浓度的升高,其对DNA损伤的抑制效果变差。当山药多糖质量浓度达到50.0 μg/mL时,氧化程度高于50%。
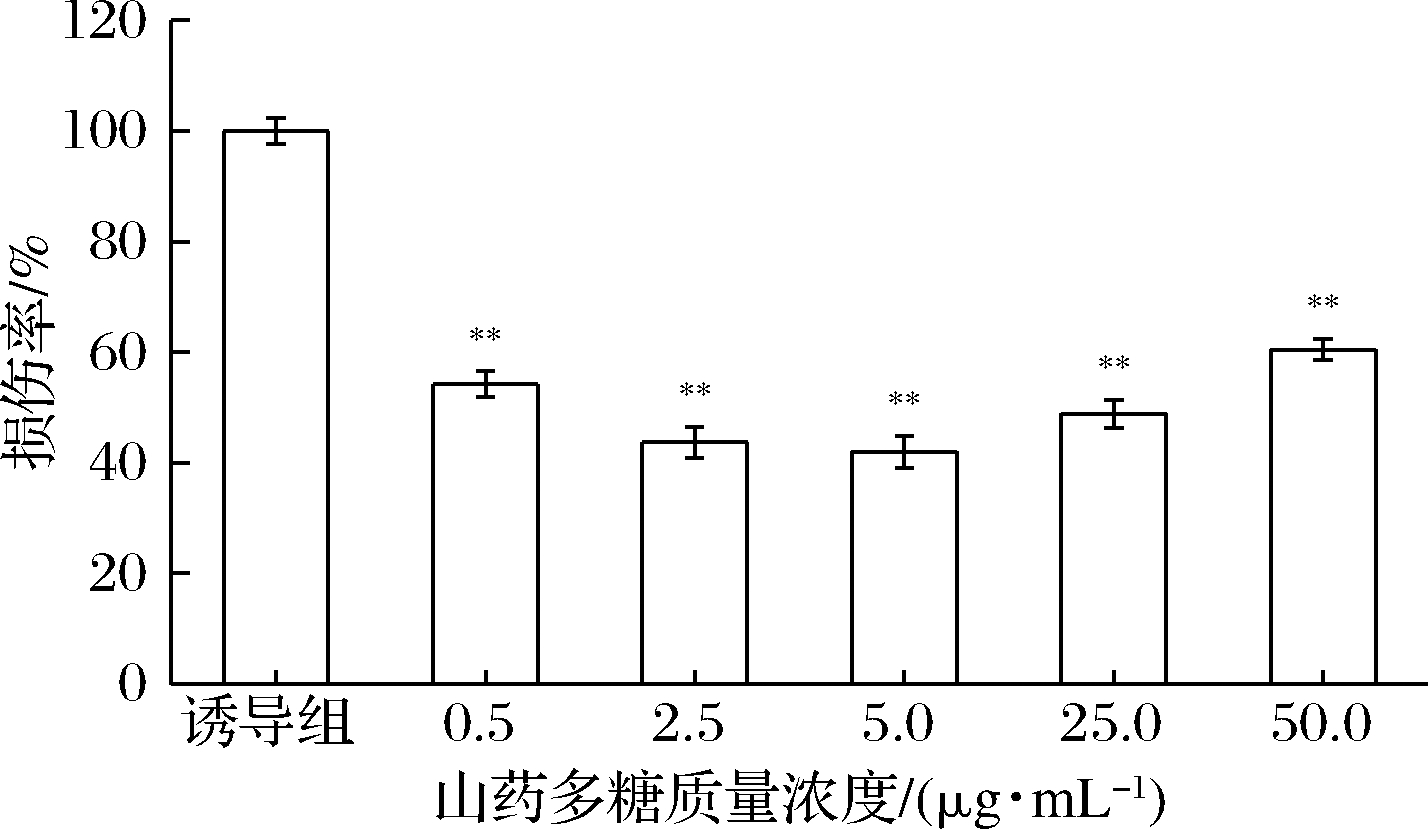
图9 山药多糖对DNA氧化损伤的影响
Fig.9 The effect of Rhizoma dioscoreae polysaccharides on oxidative damage of DNA
不同质量浓度的山药多糖对脂类氧化损伤的抑制效果如图10所示。不同浓度的山药多糖控制脂质过氧化的效果存在不同程度的差异,且在一定浓度范围内,随山药多糖浓度的增加,脂质过氧化程度整体呈现先下降后上升的趋势,与图8、图9的变化趋势基本一致。当山药多糖质量浓度为0.5 μg/mL时,脂质过氧化程度降至诱导组的53.9%,氧化程度明显减轻;多糖质量浓度为5.0 μg/mL时,脂质过氧化仅为诱导组的42.0%;山药多糖质量浓度为50.0 μg/mL的保护组,其氧化程度又略有升高,为诱导组的51.8%,但与诱导组相比,仍有极显著差异。结果表明,在一定浓度范围内,山药多糖对脂质过氧化有一定的抑制作用,且质量浓度为5.0 μg/mL时的抑制作用最佳。
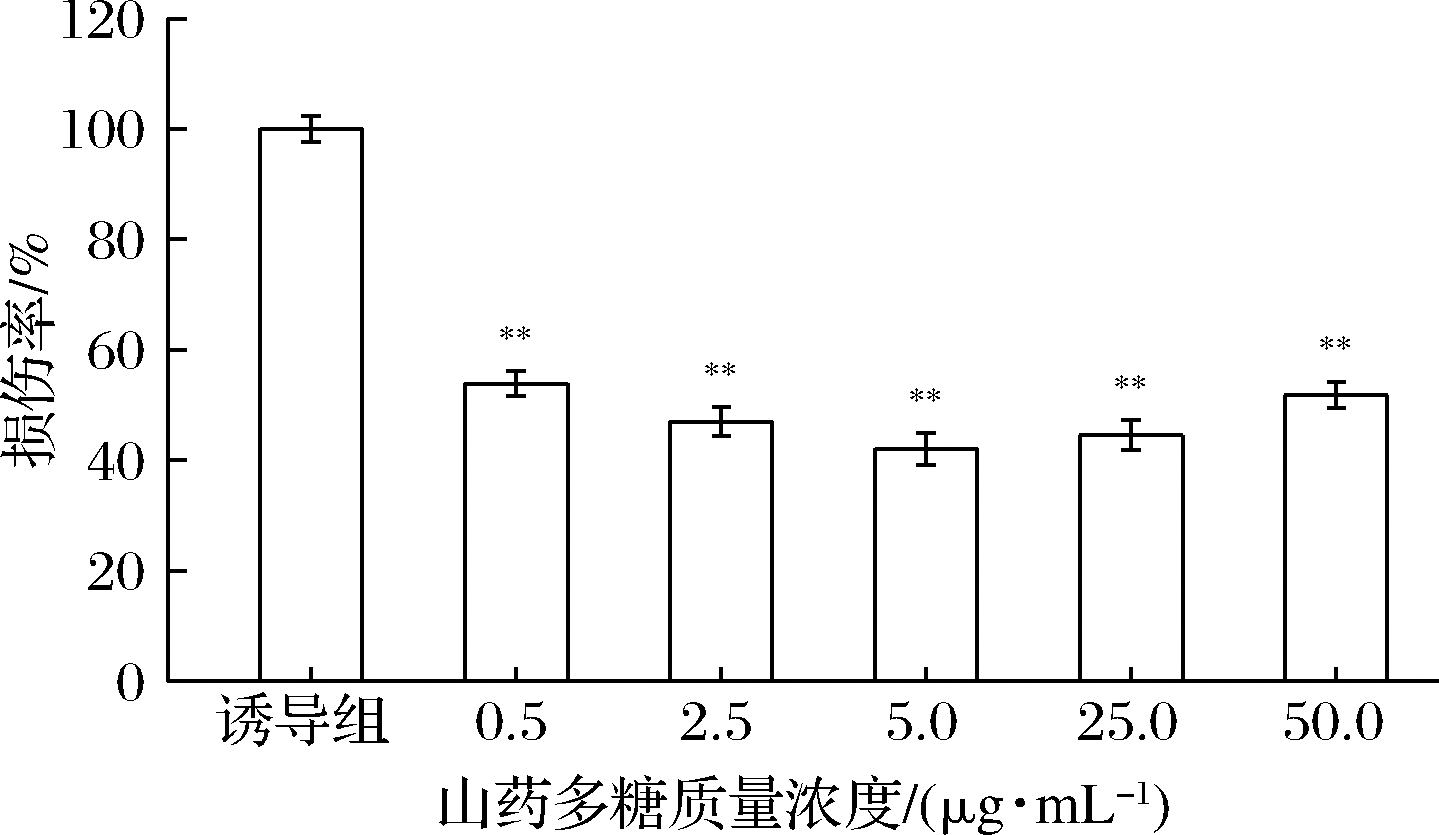
图10 山药多糖对脂质过氧化的影响
Fig.10 The effect of Rhizoma dioscoreae polysaccharides on lipid peroxidation
3 讨论与结论
研究报道AM能抑制小鼠的体液免疫和细胞免疫系统[5]。巨噬细胞是机体重要的固有免疫细胞,是确保机体产生适当免疫,维持免疫平衡的关键组成部分。巨噬细胞在免疫调节、抗感染和抗肿瘤等方面起重要作用。例如,在机体特异性免疫应答中,大部分胸腺依赖抗原必须经吞噬细胞的吞噬处理,才能呈递给T淋巴细胞,巨噬细胞还会释放多种细胞因子,共同参与免疫的调节;在非特异性免疫过程中,单核细胞和巨噬细胞非特异性吞噬病原微生物;活化的巨噬细胞还能识别、杀伤并及时清除体内肿瘤或变异细胞[18]。巨噬细胞的吞噬作用是先天免疫中最基本的防御机制。本研究发现,AM处理后,巨噬细胞的吞噬功能显著下降,但与对照相比,仅下降了20.0%左右,而细胞活力结果显示,在同样诱导浓度下,细胞活力下降达40.0%,说明AM虽然一定程度上损害了巨噬细胞的吞噬功能,但是诱导细胞死亡的毒性效应更突出。山药多糖干预AM组,不仅恢复了细胞的生长活力,吞噬能力也大幅度被提升,但与正常组对比发现,细胞的活力虽然有一定程度提高,但基本维持在90.0%左右,而吞噬指数却高于对照组,这些结果表明,山药多糖能保护巨噬细胞,但改善巨噬细胞免疫作用的效果更显著。这与LI等[16]报道的山药多糖可通过TLR4-NF-κB信号通路增强巨噬细胞的吞噬功能结果一致,但在AM诱导巨噬损伤过程中,山药多糖是如何调控TLR4-NF-κB通路,抑制损伤,仍需进一步研究。
研究报道AM对多种机体细胞有毒性作用,且产生毒性的机制主要是诱导细胞发生氧化应激,AM也被证实能刺激多种细胞发生凋亡、坏死[19]。研究证明山药多糖具有良好的抗氧化作用,本研究发现,山药多糖干预AM诱导的巨噬细胞损伤的机制也是控制氧化应激。如抑制脂质过氧化、提高SOD酶活力,减少ROS生成;同时,大分子损伤模型研究也证实,山药多糖对活性氧引起的DNA、蛋白损伤等具有很好的保护作用。然而,其是否能有效干预AM诱导的细胞凋亡等,有待进一步研究。
研究中发现,在实验浓度范围内,山药多糖都表现出良好的保护作用,但细胞实验最佳作用质量浓度是500.0 μg/mL,而大分子模型研究最佳作用质量浓度为5.0 μg/mL,二者最佳作用浓度并不一致,这可能是因为细胞模型和单纯的分子模型存在一定的差异。但是分析比较图8、图9、图10结果,整体来看,随山药多糖质量浓度的升高,抑制率变化趋势呈现出高度统一性和规律性。山药多糖对生物大分子的最佳保护质量浓度均为5.0 μg/mL。
多糖活性优越,安全性高,已受到越来越多学者的青睐。如前期报道,黑灵芝多糖和黑枸杞多糖也可以有效提高细胞内抗氧化物质含量和抗氧化酶活性,抑制AM诱导的小肠上皮细胞氧化损伤,有效改善AM染毒大鼠的肝损伤[22-24]。AM的毒性广泛,危害大。然而,除有效控制AM的产生外,针对性的控制其危害,进行科学合理膳食干预,也非常重要。本研究为控制AM危害,以及合理开发应用多糖资源和山药资源都提供了科学依据。
综上所述,山药多糖可以有效控制AM诱导的巨噬细胞毒性作用,主要是通过提高抗氧化能力,抑制细胞的氧化应激,抑制生物大分子氧化损伤,维持细胞的正常生长和吞噬活力。研究结果为山药多糖控制AM的免疫毒性提供了一定的科学依据。但本实验结果仅限于细胞水平的体外研究,对山药多糖干预AM损伤过程中的具体的信号通路,多糖的相关作用受体,以及体内的保护作用及机制等还需进一步深入探究。
[1] PUNDIR C S, YADAV N, CHHILLAR A K.Occurrence, synthesis, toxicity and detection methods for acrylamide determination in processed foods with special reference to biosensors:A review[J].Trends in Food Science & Technology, 2019, 85:211-225.
[2] 解瑞丽, 周启星.丙烯酰胺的环境暴露、生态行为与毒理效应研究进展[J].生态学杂志, 2013, 32(5):1 347-1 354.
XIE R L, ZHOU Q X.Environmental exposure, ecological behavior, and toxicological effect of acrylamide:A review[J].Chinese Journal of Ecology, 2013, 32(5):1 347-1 354.
[3] MATOSO V, BARGI-SOUZA P, IVANSKI F, et al.Acrylamide:A review about its toxic effects in the light of developmental origin of health and disease (DOHaD) concept[J].Food Chemistry, 2019, 283:422-430.
[4] HUANG M M, JIAO J J, WANG J, et al.Exposure to acrylamide induces cardiac developmental toxicity in zebrafish during cardiogenesis[J].Environmental Pollution, 2018, 234:656-666.
[5] 方瑾. 丙烯酰胺及苦瓜提取物对小鼠的免疫毒性研究[D].北京:中国疾病预防控制中心, 2014.
FANG J.Immunotoxicological evaluation of acrylamide and Momordica charantia extract[D].Beijing:Chinese Doctoral Dissertations Full-text Database, 2014.
[6] ZAMANI E, SHAKI F, ABEDIANKENARI S, et al.Acrylamide induces immunotoxicity through reactive oxygen species production and caspase-dependent apoptosis in mice splenocytes via the mitochondria-dependent signaling pathways[J].Biomedicine & Pharmacotherapy, 2017, 94:523-530.
[7] KOMOIKE Y, NOMURA-KOMOIKE K, MATSUOKA M.Intake of acrylamide at the dietary relevant concentration causes splenic toxicity in adult zebrafish[J].Environmental Research, 2020, 189:109977.
[8] GUO J, YU D D, LYU N, et al.Relationships between acrylamide and glycidamide hemoglobin adduct levels and allergy-related outcomes in general US population, NHANES 2005—2006[J].Environmental Pollution, 2017, 225:506-513.
[9] 吴鑫平, 李佳, 郝艳艳, 等.植物多糖对巨噬细胞的调控及机制研究进展[J].细胞与分子免疫学杂志, 2019, 35(5):473-478.
WU X P, LI J, HAO Y Y, et al.Research progress in the regulation and mechanism of plant polysaccharides on macrophages[J].Chinese Journal of Cellular and Molecular Immunology, 2019, 35(5):473-478.
[10] YANG W F, WANG Y, LI X P, et al.Purification and structural characterization of Chinese yam polysaccharide and its activities[J].Carbohydrate Polymers, 2015, 117:1 021-1 027.
[11] LI Q, LI W Z, GAO Q Y, et al.Hypoglycemic effect of Chinese yam (Dioscorea opposita rhizoma) polysaccharide in different structure and molecular weight[J].Journal of Food Science, 2017, 82(10):2 487-2 494.
[12] CHENG Z Y, HU M, TAO J, et al.The protective effects of Chinese yam polysaccharide against obesity-induced insulin resistance[J].Journal of Functional Foods, 2019, 55:238-247.
[13] YU L, ZHANG J, JIAO J, et al.Effect of nano yam polysaccharide on the blood glucose and blood lipid in rats[J].Pakistan Journal of Pharmaceutical Sciences, 2020, 33(1):481-487.
[14] XUE H Y, LI J R, LIU Y G, et al.Optimization of the ultrafiltration-assisted extraction of Chinese yam polysaccharide using response surface methodology and its biological activity[J].International Journal of Biological Macromolecules, 2019, 121:1 186-1 193.
[15] JU Y, XUE Y, HUANG J L, et al.Antioxidant Chinese yam polysaccharides and its pro-proliferative effect on endometrial epithelial cells[J].International Journal of Biological Macromolecules, 2014, 66:81-85.
[16] LI M, CHEN L X, CHEN S R, et al.Non-starch polysaccharide from Chinese yam activated RAW 264.7 macrophages through the Toll-like receptor 4 (TLR4)-NF-κB signaling pathway[J].Journal of Functional Foods, 2017, 37:491-500.
[17] WANG J Y, YUAN L, CHENG B, et al.Antioxidant capacity and antitumor activity of Fructus Kochiae extracts[J].Quality Assurance and Safety of Crops & Foods, 2014, 6(4):383-393.
[18] 林颖韬, 陈伶莉, 胡雪峰.免疫细胞的种类、功能及相关疾病概述[J].生物学教学, 2020, 45(4):77-80.
LIN Y T, CHEN L L, HU X F.The types, functions and related diseases of immune cells:A review [J].Biology Teaching, 2020, 45(4):77-80.
[19] NAN B, YANG C Y, LI L, et al.Allicin alleviated acrylamide-induced NLRP3 inflammasome activation via oxidative stress and endoplasmic reticulum stress in Kupffer cells and SD rats liver[J].Food and Chemical Toxicology, 2021, 148:111937.
[20] BARTOSZ G.Reactive oxygen species:Destroyers or messengers?[J].Biochemical Pharmacology, 2009, 77(8):1 303-1 315.
[21] 柯跃斌, 郑荣梁.自由基毒理学[M].北京:人民卫生出版社, 2012:16-20.
KE Y B, ZHENG R L.Free Radical Toxicology[M].Beijing:People′s Medical Publishing House, 2012:16-20.
[22] 张路路, 石婷, 朱梦婷, 等.黑灵芝多糖对丙烯酰胺诱导小肠上皮细胞氧化损伤的保护作用[J].食品科学, 2017, 38(3):170-175.
ZHANG L L, SHI T, ZHU M T, et al.Protective effect of Ganoderma atrum polysaccharides on oxidative damage induced by acrylamide in IEC-6 cells[J].Food Science, 2017, 38(3):170-175.
[23] 王莉, 叶维佳, 吴红静, 等.黑果枸杞多糖对大鼠肝损伤的保护研究[J].食品工业科技, 2020, 41(14):287-290;296.
WANG L, YE W J, WU H J, et al.Protective effect of Lycium barbarum polysaccharide on hepatic injury by acrylamide in rats[J].Science and Technology of Food Industry, 2020, 41(14):287-290;296.
[24] 江国勇, 雷艾彤, 杨莹, 等.黑灵芝多糖对丙烯酰胺致大鼠肝脏氧化损伤的保护作用[J].食品科学, 2020, 41(1):121-126.
JIANG G Y, LEI A T, YANG Y, et al.Protective effect of Ganoderma atrum polysaccharides against acrylamide-induced liver injury in rats[J].Food Science, 2020, 41(1):121-126.