风干牛肉是哈萨克族传统美食,以牛肉为原料,短时腌制后再经风干后熟制作而成。牛肉在风干过程中,蛋白质适度降解产生的非蛋白质化合物(多肽、肽、游离氨基酸及其衍生化合物),能够改善产品表面色泽、提高产品营养价值[1]。但牛肉蛋白质发生热变性、氧化和其他蛋白质修饰会导致蛋白质的物理和化学性质发生重大变化,包括侧链基团的氧化、骨架断裂、交联、解折叠、疏水性和构象变化[2],改变对蛋白水解酶的敏感性并形成新的反应性基团[3],对牛肉加工特性和食用品质产生消极作用[3]。因此,在发酵肉制品加工及流通过程中,如何抑制蛋白质的过度氧化受到人们的广泛关注。
蛋白水解是牛肉制品发酵过程中最重要的反应之一,由肉类组织中存在的内源酶或添加的发酵剂的微生物源催化。在肉制品发酵过程中,葡萄球菌、微球菌、乳酸菌均能产生蛋白酶,被认为是导致肉制品中蛋白水解现象的主要微生物[4]。尽管发酵肉制品负责蛋白质降解的主要是内源酶,但细菌蛋白酶和肽酶能够显著促进肌原纤维和肌浆蛋白的分解以及小肽和氨基酸的释放[5]。肉制品中蛋白质水解产生的非蛋白质化合物,除了有利于增进风味外,还具有一定的抗氧化作用[6]。最近的研究证实,从发酵肉制品中提取的肽具有抗氧化活性,可以替代食品系统中的合成抗氧化剂[7]。此外,CAO 等[8]发现,用产蛋白酶活力较高的植物乳杆菌CD101发酵香肠,其肽抗氧化活性显著提高。因此,研究具有较高蛋白酶活性的发酵剂培养物对于抑制蛋白质氧化、生产优质风干牛肉非常重要。
课题组前期从新疆传统风干肉中分离出了3株具有较强蛋白酶水解活性的乳酸菌,乳酸乳球菌(Lactococcus lactis)(S-1)、格式乳球菌(Lactococcus gracilis)(S-2)和戊糖片球菌(Pediococcus pentosaceus)(S-3)。本研究将 S-1、S-2、S-3作为发酵剂接种到牛肉中制作风干肉,以自然风干牛肉作为对照组,利用化学方法检测蛋白氧化变性,探究不同产蛋白酶乳酸菌对风干牛肉蛋白质氧化的影响;并利用拉曼光谱技术对牛肉蛋白进行扫描,尝试在分子水平上阐明牛肉蛋白质的氧化变性,为抑制牛肉蛋白质氧化提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜牛后腿肉, 市购;Na2HPO4、NaH2PO4、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine, DNPH), 北京百奥莱博科技有限公司;三氯乙酸、盐酸胍、乙酸乙酯、Tris, 北京索莱宝科技有限公司;尿素、溴酚蓝、β-巯基乙醇(β-mercaptoethanol)、十二烷基硫酸钠(sodium dodecyl sulfate, SDS), 上海泽叶生物科技有限公司;实验所用试剂均为分析纯或生化级。
1.2 仪器与设备
SPX-250C恒温恒湿箱、101型电热鼓风干燥箱, 北京市永光明医疗仪器有限公司;DZ-40C2SA 多功能真空包装机, 南通成盛机械有限公司;HENC实验室搅拌机, 上海恒川机械设备有限公司;UV-1800紫外分光光度计, 北京世纪科信科学仪器有限公司;TGL16A高速冷冻离心机, 湖南凯达科学仪器有限公司;HH-6数显恒温水浴锅, 常州澳华仪器有限公司;Bruker SENTERRAII智能显微共聚焦拉曼光谱仪,重庆浩纳科技有限公司。
1.3 实验方法
1.3.1 风干肉的制备
前处理:选择新鲜的牛肉后腿,去除骨、筋腱,用冷水淋洗,切割修整为长条状(200 g);腌制期:加入糖1%、盐2.5%(均为质量分数)以及亚硝酸钠100 mg/kg(腌制温度4 ℃、腌制时间12 h);发酵期:在肉中接种不同产蛋白酶乳酸菌发酵剂(浓度1.0×107CFU/g,温度15 ℃、湿度70%、发酵时间24 h);风干期:温度40 ℃,时间48 h;贮藏期:温度4 ℃,贮藏14 d。分别在前处理结束、腌制结束、风干0、1、2 d以及贮藏第7、14天取样。每个采样点各取5份样品(约200 g),将样品迅速保存于-20 ℃冰箱内备用。
1.3.2 肌原纤维蛋白的提取
取一定量肉样切块后绞碎,取5 g放入离心管中,加入20 mL分离缓冲液I (10 mmol/L、pH 7.0的PBS缓冲液,含2 mmol/L MgCI2·6H2O、1 mmol/L EGTA),在10 000×g条件冰浴下匀浆1 min。然后在4 ℃条件下,7 500×g离心10 min,除上清液取沉淀,再加入分离缓冲液I,相同操作重复3次,制得粗蛋白。再加入20 mL分离缓冲液Ⅱ(10 mmol/L、pH 7.0的PBS缓冲液),用磁力搅拌器慢速混匀20 min。然后在4 ℃、7 500×g条件下离心10 min,去除上清液,取沉淀,相同操作重复3次,得到肌原纤维蛋白质。
1.3.3 羰基含量测定
参考段丽菊等[9]的方法进行测定。用0.1 mol/L PBS(pH 7.4,0.6 mol/L NaCl)将肌原纤维蛋白稀释至2 mg/mL,吸取500 μL 2 mg/mL的蛋白液分装至2个10 mL离心管,其中一份加入2 mL 2 mol/L HCl溶液处理(对照),另一份用2 mL含0.2%DNPH的2 mol/L HCl溶液处理。再加入4 mL 200 g/L三氯乙酸(trichloroacetic acid solution, TCA)沉淀蛋白,置于恒温水浴锅中,37 ℃条件下避光保温30 min。随后在10 000×g条件下离心15 min,沉淀用2 mL V(乙醇)∶V(乙酸乙酯)=1∶1洗涤3次。洗涤结束后加入3 mL TCA溶液,10 000×g离心15 min后取沉淀,用2 mL 6 mol/L盐酸胍溶液(含20 mmol/L,pH 6.5的磷酸盐缓冲液)溶解,10 000×g离心15 min,在370 nm 处测定上清液的吸光度。羰基浓度用摩尔消光系数22 000 L/(mol·cm)来计算,将总羰基浓度表示为每毫克蛋白质羰基的纳摩尔浓度。
1.3.4 巯基含量测定
测定参照ELLMAN[10]的方法,略作修改。吸取1 mL 2 mg/mL的肌原纤维蛋白溶液与8 mL PBS缓冲液(pH 8.0,0.086 mmol/L Tris-HCl、0.09 mol/L甘氨酸、4 mmol/L EDTA、8 mol/L尿素)置于10 mL离心管中,并以10 000×g离心15 min。取4.5 mL上清液与0.5 mL Ellman试剂(10 mmol/L DTNB)混合,在黑暗中于40 ℃条件下放置25 min,然后冷却至室温,在412 nm处测量其吸光度。巯基浓度用摩尔消光系数13 600 L/(mol·cm)来计算,结果表示为每毫克蛋白质总巯基的纳摩尔浓度。对照组除不加蛋白溶液外,其他处理方法均如上所述。
1.3.5 表面疏水性测定
表面疏水性的测定参照CHELH 等[11]的方法。吸取1 mL 2 mg/mL的蛋白液悬浮液分装至2个10 mL离心管,其中一份加入0.1 mol/L的PBS缓冲液(对照组),另一份加入200 μL 1 mg/mL的溴酚蓝溶液,涡旋混匀15 min。混合液4 000×g 离心15 min后取上清液,测定上清液595 nm处的吸光度。表面疏水性以溴酚蓝结合量表示,按公式(1)计算:
(1)
式中:BPB表示溴酚蓝结合量(μg),用以表征肌原纤维蛋白表面疏水性;Ac表示空白组的吸光值;As表示样品的吸光值。
1.3.6 蛋白质相互分子作用力测定
参考VISESSANGUAN等[12]的方法。溶液包括:B1:0.6 mol/L KCl;B2:20 mmol/L Tris,pH 8.0;B3:20 mmol/L Tris、10 g/L SDS,pH 8.0;B4:20 mmol/L Tris、10 g/L SDS、8 mol/L尿素,pH 8.0;B5:20 mmol/L Tris、10 g/L SDS、8 mol/L尿素、2% (体积分数)β-巯基乙醇,pH 8.0;B6:0.5 mol/L NaOH,pH 8.0。取2 g绞碎肉样置于20 mL冷冻离心管,分别加入20 mL上述溶液,在10 000×g条件下冰浴匀浆1 min。随后以10 000×g离心30 min,吸取4 mL上清液置于10 mL离心管中并加入1 mL 50% TCA溶液,在4 ℃条件下放置12 h后以4 000×g离心20 min,去上清液,用4 mL 0.5 mol/L NaOH溶液溶解沉淀1 h,采用双缩脲法测定溶解液的蛋白含量。结果以各部分的蛋白溶解量与B6的蛋白溶解量的百分比表示。
1.3.7 拉曼光谱扫描
将少量牛肉蛋白样品铺在载玻片上,将其置于拉曼光谱仪样品载物台上进行扫描。氩离子激光器用作扫描光源,激光波长为532 nm,拉曼位移波数为50~4 500 cm-1,采集时间为10 s,累积2次。每个样品取3个点扫描,最终拉曼光谱曲线取3次结果的平均值。采用LabSpec 6光谱软件进行基点校正并去除荧光背景,以(1 004±2)cm-1处峰位为内标进行归一化。
1.4 数据处理
通过Peakfit 4.12软件进行峰分离和曲线拟合,以对蛋白质的二级结构进行定量分析,并使用Origin Pro 2020软件对数据进行分析和绘图。
2 结果与分析
2.1 羰基含量变化
蛋白质羰基的产生是自由基对蛋白质分子进行氧化修饰的重要标志,通过测量羰基含量可以确定蛋白质是否受到氧化损伤[13]。牛肉样品中羰基含量的变化如图1所示。
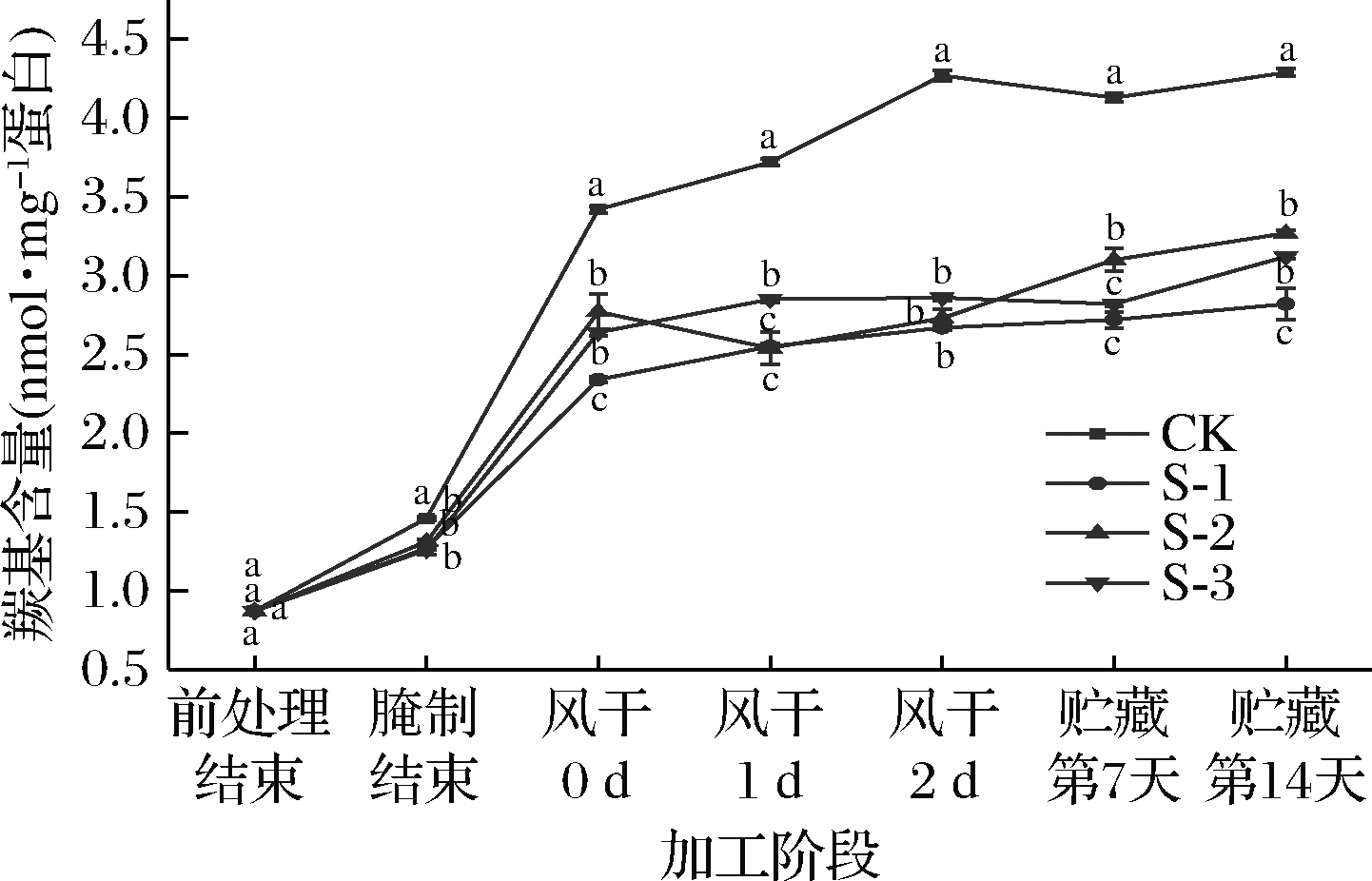
图1 不同加工阶段及贮藏过程中产蛋白酶乳酸菌 对风干牛肉羰基含量的影响
Fig.1 Effect of protease-producing lactic acid bacteria on the carbonyl value of air-dried beef during different processing stages and storage
注:图中相同字母表示同一阶段数据差异不显著(P>0.05), 不同字母表示同一阶段数据差异显著(P<0.05)(下同)
由图1可知,在整个加工阶段肌原纤维蛋白羰基含量呈上升趋势,且差异显著(P<0.05)。这种氧化可能是由于肌原纤维蛋白中一些氨基酸受到自由基的攻击转变成了羰基衍生物[14]。风干0 d时,4组的肌原纤维蛋白羰基含量分别为3.42 nmol/mg蛋白(CK组)、2.54 nmol/mg蛋白(S-1组)、2.77 nmol/mg蛋白(S-2组)、2.64 nmol/mg蛋白(S-3组),CK组羰基含量增加最大。风干结束时,S-1、S-2、S-3组之间差异不显著(P>0.05),但仍显著高于CK组(P<0.05),说明接种的产蛋白酶乳酸菌起到了一定的抗氧化作用,可能是由于蛋白酶将蛋白质降解为许多具有抗氧化活性的多肽等小分子物质,从而提高风干牛肉的氧化稳定性[15]。贮藏期间S-1、S-3组的羰基含量显著低于CK组和S-2组,可能与菌种产蛋白酶的能力不同有关。
2.2 巯基含量变化
半胱氨酸残基中的巯基是所有蛋白质氨基酸残基中最活泼的基团,具有一定的抗氧化作用[16]。牛肉样品中巯基含量的变化如图2所示。发酵期4组风干肉总巯基含量均显著下降(P<0.05),说明此阶段蛋白氧化较为严重[17]。在风干2 d后,4组的总巯基含量分别减少了31.61 nmol/mg蛋白(CK组、P>0.05)、24.13 nmol/mg蛋白(S-1组、P>0.05)、24.71 nmol/mg蛋白(S-2组、P>0.05)、12.06 nmol/mg蛋白(S-3组、P<0.05)。贮藏14 d后,S-1、S-2、S-3组巯基含量明显高于CK组(P<0.05)。可见经产蛋白酶乳酸菌发酵的牛肉在一定程度上能够抑制蛋白氧化,抗氧化能力可能与蛋白酶增加的抗氧化活性肽和游离氨基酸的数量有关[18]。
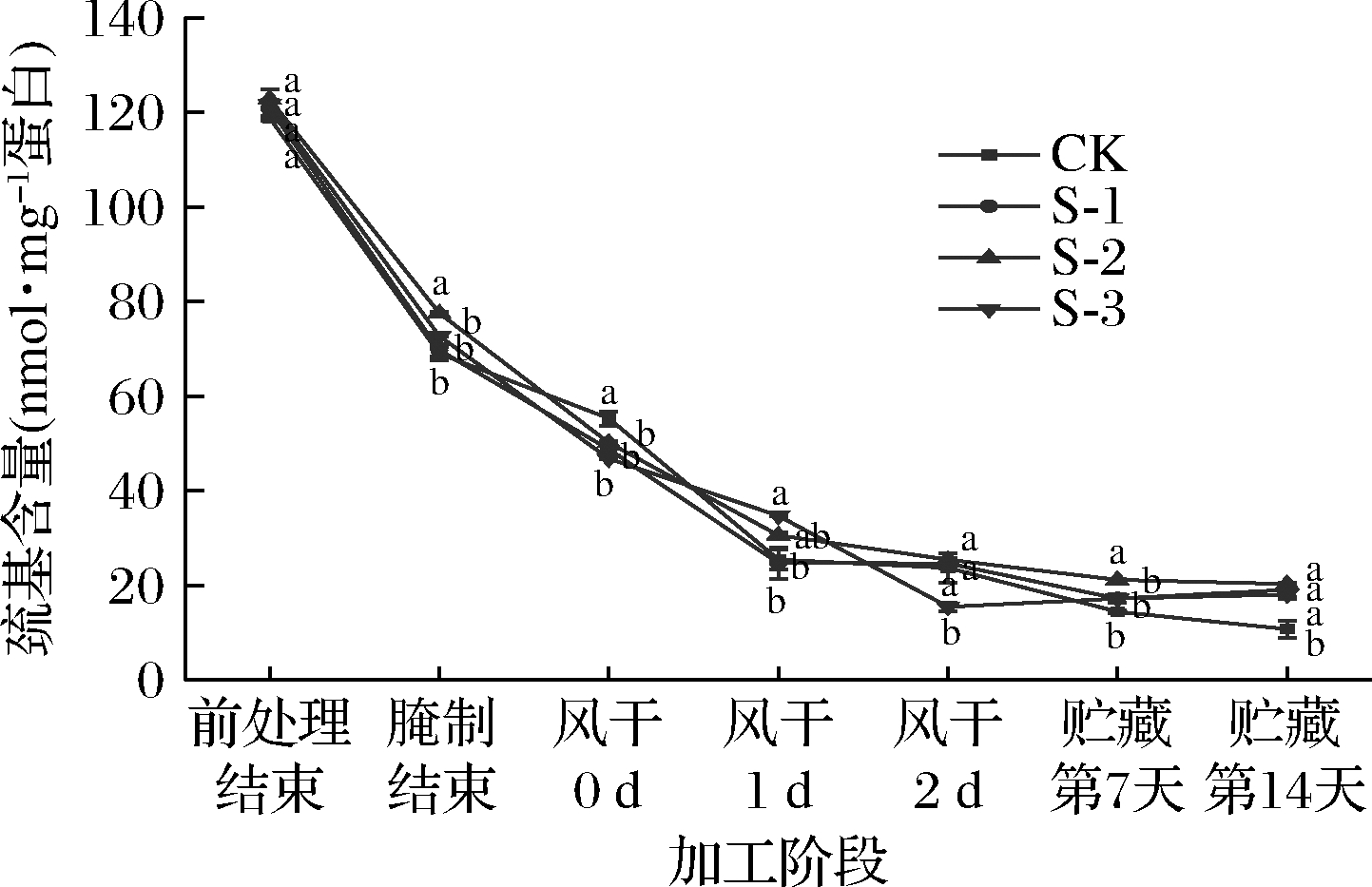
图2 不同加工阶段及贮藏过程产蛋白酶乳酸菌对 风干牛肉巯基含量的影响
Fig.2 Effect of protease-producing lactic acid bacteria on the sulfhydryl content of air-dried beef in different processing stages and storage
2.3 表面疏水性的变化
疏水相互作用能够对蛋白构象结构稳定性以及蛋白的功能特性起到重要作用,可用于监测蛋白质的物理和化学状态的细微变化[19]。牛肉样品表面疏水性含量变化如图3所示。
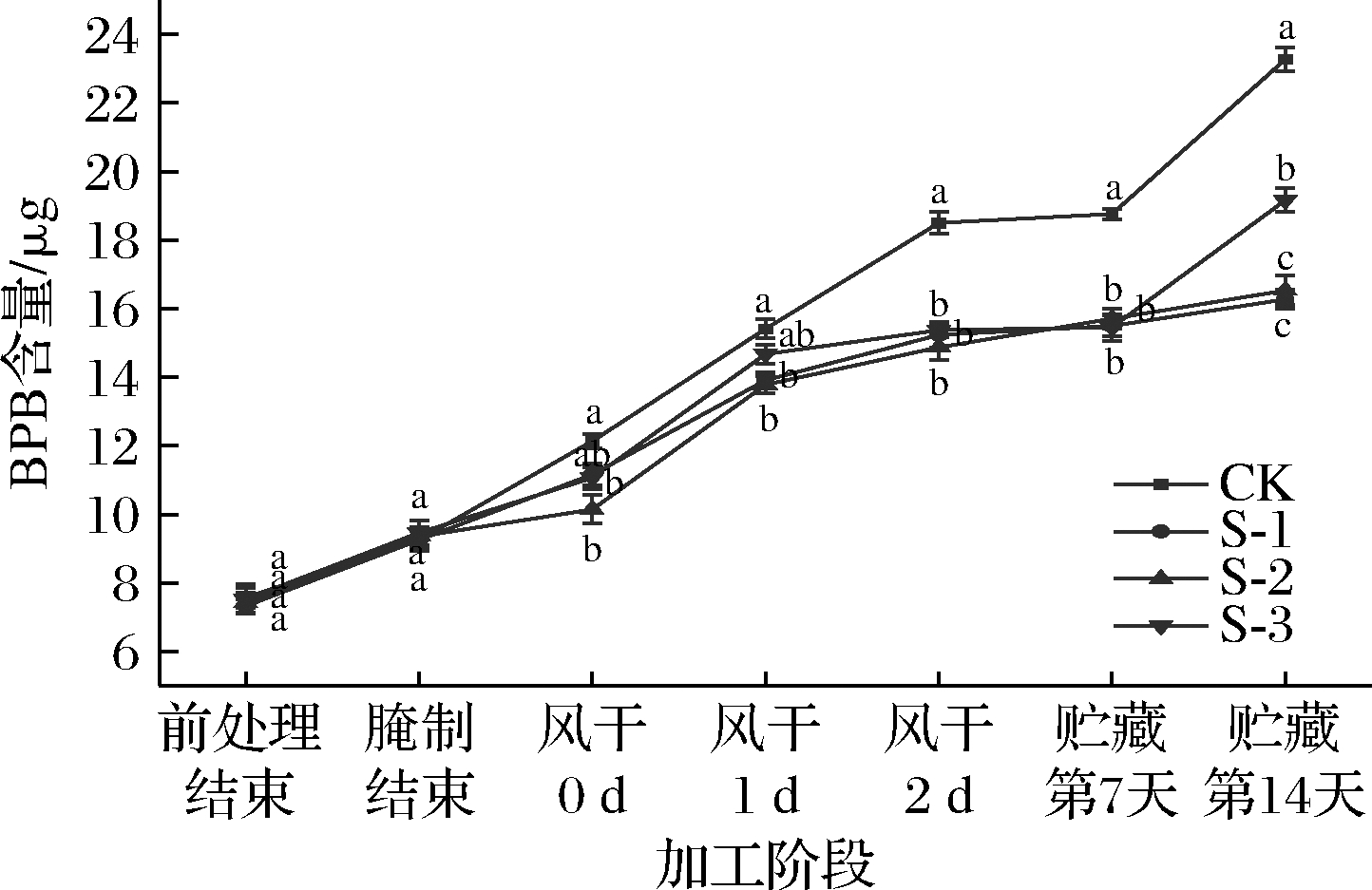
图3 不同加工阶段及贮藏过程中产蛋白酶乳酸菌 对风干牛肉表面疏水性的影响
Fig.3 Effect of protease-producing lactic acid bacteria on the surface hydrophobicity of air-dried beef in different processing stages and storage
如图3所示,表面疏水性受到风干时间的显著影响(P<0.05)。CK组肌原纤维蛋白表面疏水性从风干0 d开始急剧上升,贮藏7 d增长趋势减缓,14 d后又开始缓慢上升;S-1组肌原纤维蛋白表面疏水性在风干1 d后开始逐渐上升,与S-2组趋势相似,且最终与S-2组无明显差异。在风干以及贮藏期间,CK组的蛋白质表面疏水性显著高于其他组(P<0.05)。在风干结束后,S-1、S-2的表面疏水性显著低于CK组和S-3组的表面疏水性(P<0.05),说明CK组和S-3组蛋白质构象更趋向于无序松散状态。可能是由于CK组和S-3组维持蛋白质空间构象的作用力较弱,疏水残基暴露,从而增加了蛋白质的变性程度[20]。有研究表明,蛋白质的表面疏水性与α-螺旋含量呈线性负相关,同时也与β-折叠含量密切相关[21]。
2.4 蛋白质分子相互作用力在牛肉发酵中的变化
蛋白质在不同溶剂中的溶解度分别代表静电相互作用、氢键、疏水相互作用和二硫键对蛋白三级结构的贡献,结果见表1。
表1 不同加工阶段及贮藏过程中产蛋白酶乳酸菌对风干牛肉蛋白质分子相互作用力的影响 单位:%
Table 1 Effect of protease-producing lactic acid bacteria on the molecular interaction of air-dried beef protein in different processing stages and storage
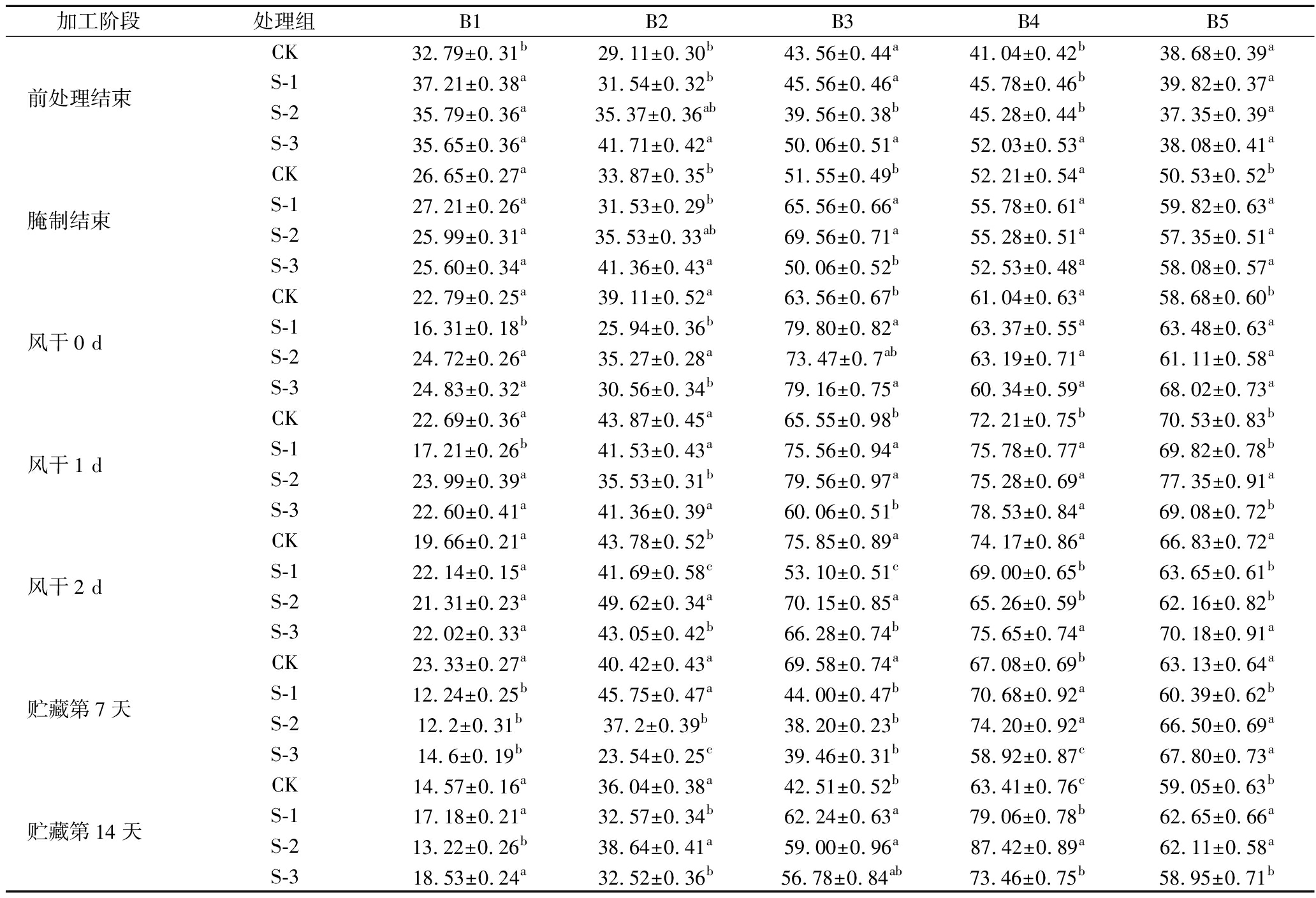
加工阶段处理组B1B2B3B4B5CK32.79±0.31b29.11±0.30b43.56±0.44a41.04±0.42b38.68±0.39a前处理结束S-137.21±0.38a31.54±0.32b45.56±0.46a45.78±0.46b39.82±0.37aS-235.79±0.36a35.37±0.36ab39.56±0.38b45.28±0.44b37.35±0.39aS-335.65±0.36a41.71±0.42a50.06±0.51a52.03±0.53a38.08±0.41aCK26.65±0.27a33.87±0.35b51.55±0.49b52.21±0.54a50.53±0.52b腌制结束S-127.21±0.26a31.53±0.29b65.56±0.66a55.78±0.61a59.82±0.63aS-225.99±0.31a35.53±0.33ab69.56±0.71a55.28±0.51a57.35±0.51aS-325.60±0.34a41.36±0.43a50.06±0.52b52.53±0.48a58.08±0.57aCK22.79±0.25a39.11±0.52a63.56±0.67b61.04±0.63a58.68±0.60b风干0 dS-116.31±0.18b25.94±0.36b79.80±0.82a63.37±0.55a63.48±0.63aS-224.72±0.26a35.27±0.28a73.47±0.7ab63.19±0.71a61.11±0.58aS-324.83±0.32a30.56±0.34b79.16±0.75a60.34±0.59a68.02±0.73aCK22.69±0.36a43.87±0.45a65.55±0.98b72.21±0.75b70.53±0.83b风干1 dS-117.21±0.26b41.53±0.43a75.56±0.94a75.78±0.77a69.82±0.78bS-223.99±0.39a35.53±0.31b79.56±0.97a75.28±0.69a77.35±0.91aS-322.60±0.41a41.36±0.39a60.06±0.51b78.53±0.84a69.08±0.72bCK19.66±0.21a43.78±0.52b75.85±0.89a74.17±0.86a66.83±0.72a风干2 dS-122.14±0.15a41.69±0.58c53.10±0.51c69.00±0.65b63.65±0.61bS-221.31±0.23a49.62±0.34a70.15±0.85a65.26±0.59b62.16±0.82bS-322.02±0.33a43.05±0.42b66.28±0.74b75.65±0.74a70.18±0.91aCK23.33±0.27a40.42±0.43a69.58±0.74a67.08±0.69b63.13±0.64a贮藏第7天S-112.24±0.25b45.75±0.47a44.00±0.47b70.68±0.92a60.39±0.62bS-212.2±0.31b37.2±0.39b38.20±0.23b74.20±0.92a66.50±0.69aS-314.6±0.19b23.54±0.25c39.46±0.31b58.92±0.87c67.80±0.73aCK14.57±0.16a36.04±0.38a42.51±0.52b63.41±0.76c59.05±0.63b贮藏第14天S-117.18±0.21a32.57±0.34b62.24±0.63a79.06±0.78b62.65±0.66aS-213.22±0.26b38.64±0.41a59.00±0.96a87.42±0.89a62.11±0.58aS-318.53±0.24a32.52±0.36b56.78±0.84ab73.46±0.75b58.95±0.71b
注:表中相同字母表示同列数据差异不显著(P>0.05),不同字母表示同列数据差异显著(P<0.05);B1和B2分别表示肌原纤维蛋白和肌浆蛋白三级结构中的静电相互作用;B3表示氢键;B4表示疏水相互作用;B5表示二硫键
从量的角度看,在整个加工阶段 B3、B4、B5 含量均较高,说明牛肉蛋白的结构通过氢键、疏水相互作用力和二硫键得以维持,而静电相互作用力影响较小;风干后这几种作用力对蛋白三维结构的贡献发生了改变。蛋白质在B1中的溶解度有所降低但未显示出规律性的变化;B3溶解度在风干期间逐渐增加,贮藏期间保持稳定略降;B4在加工前期不断增加,风干2 d后趋于平稳。贮藏结束时B4 > B5> B3,表明疏水相互作用和二硫键在贮藏结束的牛肉蛋白三维结构中起主导作用;二硫键可以稳定蛋白质的折叠构象并降低构象熵,从而改善其热力学稳定性[22],S-2、S-3在B5中的溶解度显著高于CK组,说明S-2、S-3蛋白质中形成二硫键较多,空间结构较稳定。这些变化对牛肉蛋白凝胶结构的形成和稳定性具有重要影响,可以影响风干牛肉感官品质和营养特性[23]。
2.5 风干牛肉肌原纤维蛋白拉曼光谱图
拉曼光谱技术可以通过反射氨基酸或者肽链的不同种振动模式获得响应信号,从而提供包含蛋白质分子二级和三级结构信息的光谱信息图。由图4可知,用不同产蛋白酶乳酸菌处理的风干牛肉拉曼光谱基本一致,4组风干牛肉蛋白的空间构象与氨基酸残基微环境的变化主要体现在500~1 800 cm-1和2 850~3 050 cm-1两部分。通过比较上述2条重要拉曼谱带的特征峰位置和相对峰强度,可以阐释不同产蛋白酶乳酸菌处理对风干牛肉蛋白结构变化的具体影响[24]。风干牛肉蛋白肽键骨架和氨基酸侧链的拉曼光谱区带指认结果如表2所示。

图4 不同产蛋白酶乳酸菌处理的风干牛肉肌 原纤维蛋白拉曼光谱
Fig.4 Raman spectra of air-dried beef myofibrillar protein treated with different protease-producing lactic acid bacteria
2.6 用酰胺I谱带分析风干牛肉肌原纤维蛋白二级结构的变化
用于表征肉蛋白二级结构的酰胺Ⅰ谱带的拉曼光谱通常集中在1 645~1 685 cm-1,包括α-螺旋、β-折叠、β-转角以及无规卷曲,归属的拉曼谱带分别为1 650~1 658 cm-1、1 660~1 665 cm-1、1 665~1 680 cm-1和1 680~1 690 cm-1。通过肌原纤维蛋白特征吸收峰的移动以及肌原纤维蛋白吸光度强度的不同,能够显示肌原纤维蛋白氨基酸残基总吸光度以及蛋白质二级结构的改变[25]。如图5所示,加工结束后,CK组、S-1组、S-2组、S-3组主导峰分别为1 643.5、1 654.5、1 648.5、1 652 cm-1,说明S-1、S-2、S-3组的α-螺旋结构含量较高,可能与乳酸菌蛋白酶促进蛋白降解从而引起蛋白质结构、蛋白等电点和疏水性改变有关[26]。
表2 风干牛肉肌原纤维蛋白拉曼光谱条带的指认
Table 2 Identification of Raman spectral bands of air-dried beef myofibrillar protein

波数/cm-1峰的指认构象信息500S—S的伸缩振动扭式-扭式-扭式构型545S—S的伸缩振动存在反式-扭式-反式构象610~650C—S 伸缩振动存在扭式构象750色氨酸伸缩振动强度增强表示残基埋藏,对环境敏感830 850酪氨酸的基频和泛频费米共振暴露式氢键及埋藏式氢键的供体或受体935酰胺ⅢC==C伸缩振动1 003苯丙氨酸的呼吸振动对构象变化不敏感(可作蛋白质拉曼光谱内标)1 311酰胺Ⅱ带1 338色氨酸或脂肪族CH弯曲振动可能用于指示脂肪族残基间的疏水相互作用1 457CH3、CH2、CH的弯曲振动1 645~1 690酰胺I 带1 650 α-螺旋, 1 660无规则卷曲, 1 671 β-折叠, 1 685 β-转角2 850~3 050脂肪族C—H伸缩振动指示微环境的极性和蛋白变性
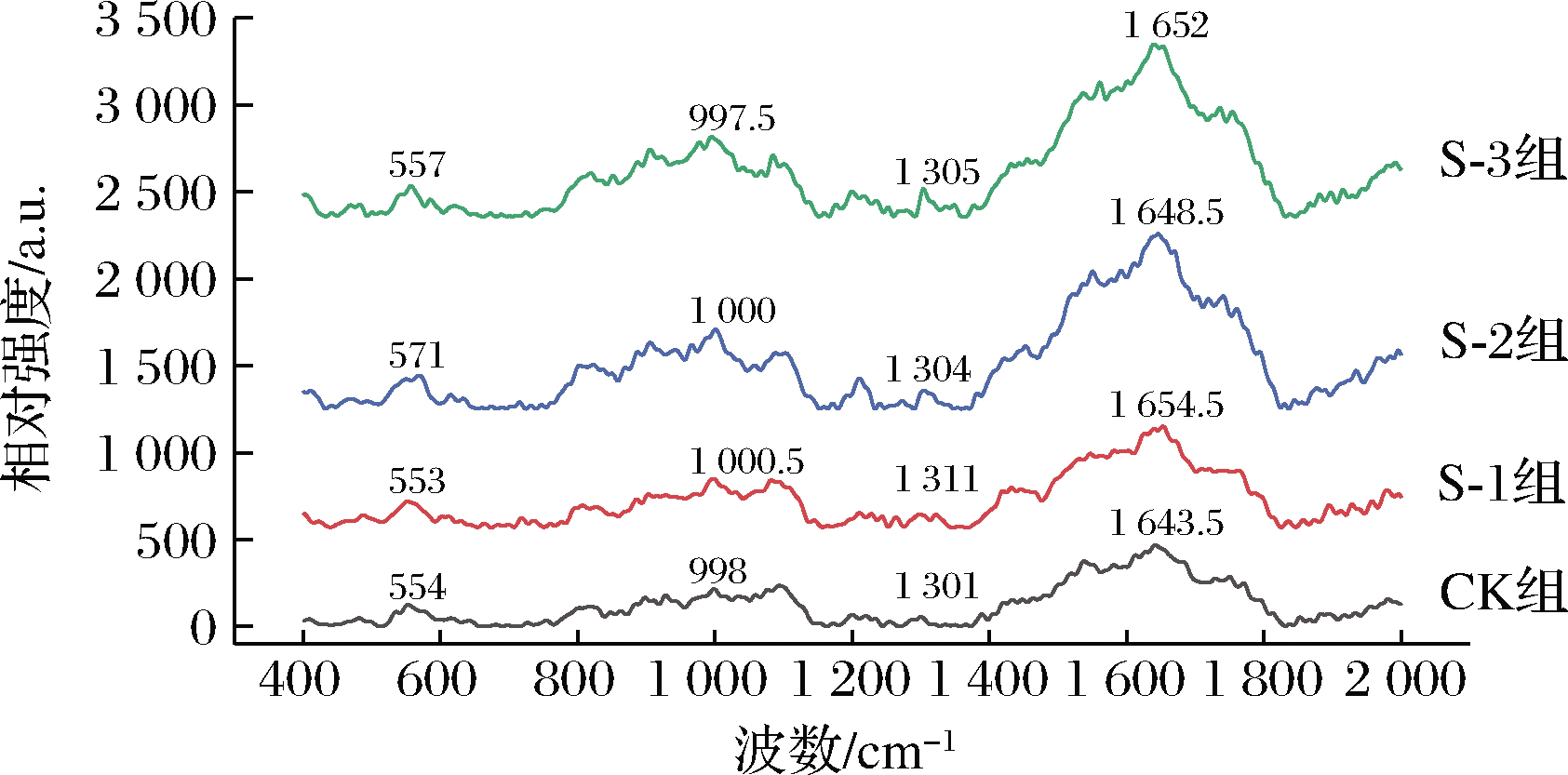
图5 不同产蛋白酶乳酸菌处理的风干牛肉肌 原纤维蛋白的拉曼光谱
Fig.5 Raman spectra of air-dried beef myofibrillar protein treated with different protease-producing lactic acid bacteria
2.7 肌原纤维蛋白二级结构的定量分析
用ALIX等[27]的方法对蛋白质二级结构进行定量分析,结果见图6,与CK组相比,添加产蛋白酶乳酸菌明显降低了β-折叠含量,α-螺旋含量有明显增加(P<0.05),其中S-1组比S-2 (22.23%)、S-3 (25.36%)处理的样品和CK组的样品(20.03%)保持更高的α-螺旋比例(33.37%)(P<0.05)。此外,添加S-2、S-3的样品与CK组相比,无规卷曲含量无明显差异(P>0.05)。有研究表明,蛋白质中的α-螺旋含量与硬度呈负相关,无规卷曲与弹性呈正相关[28]。由此可以推断,添加产蛋白酶乳酸菌能够降低风干牛肉硬度,提高牛肉的嫩度,而对弹性无明显作用。
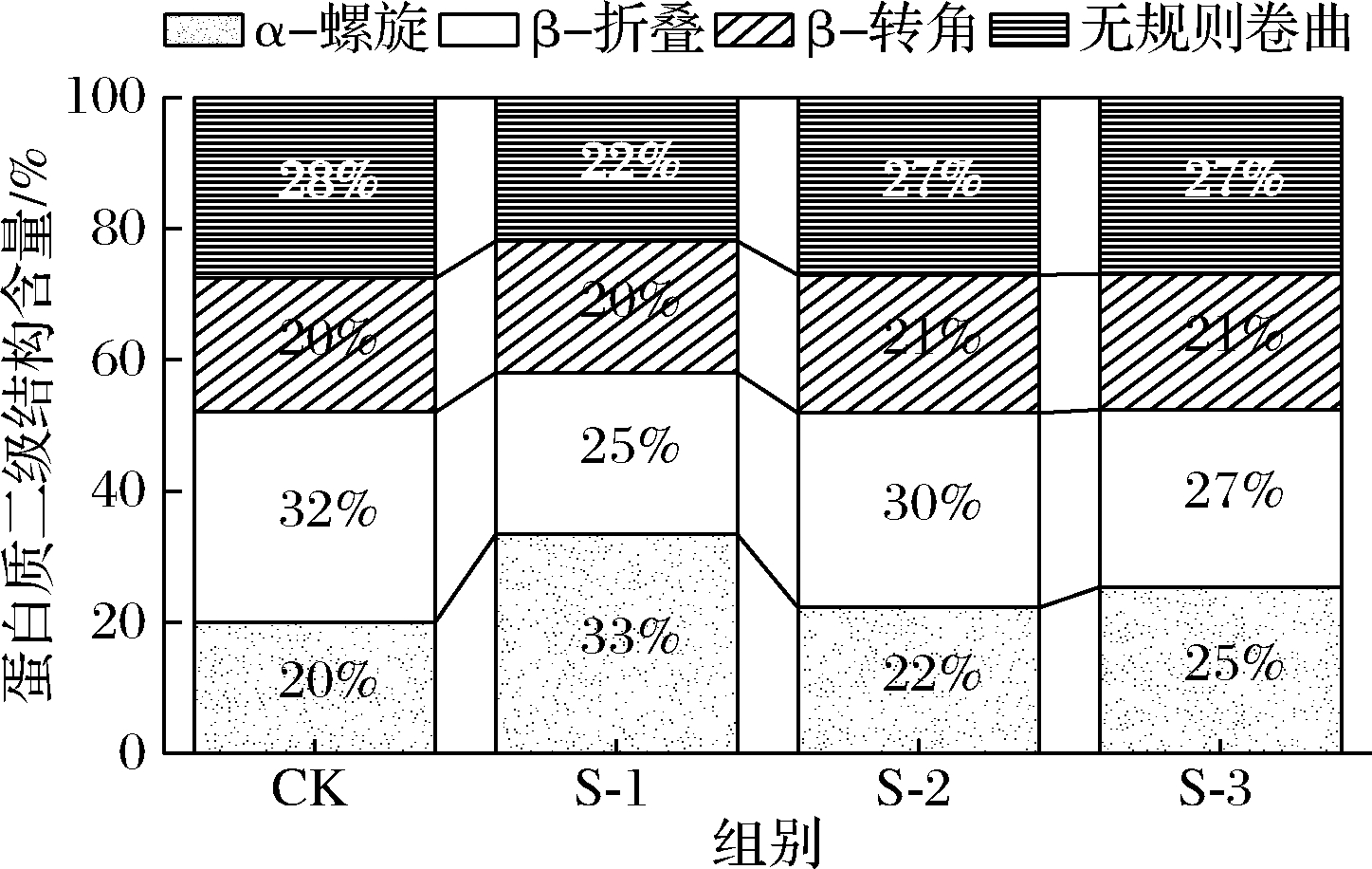
图6 拉曼光谱定量风干牛肉肌原纤维蛋白二级结构
Fig.6 Raman spectroscopy to quantify the secondary structure of air-dried beef myofibril protein
3 结论
不同产蛋白酶乳酸菌处理的风干牛肉在不同加工阶段,蛋白质氧化变化比较一致。3组样品中肌原纤维蛋白的羰基含量降低、巯基含量增加、表面疏水性降低,这表明产蛋白酶乳酸菌对牛肉风干过程中的蛋白质氧化具有一定的抑制作用,其中S-1组对蛋白质氧化的抑制作用最强。拉曼光谱对风干牛肉中蛋白质二级结构的分析结果表明,与对照组相比,添加产蛋白酶乳酸菌的风干牛肉α-螺旋相对含量显著增加,β-折叠的相对含量显著降低,表明产蛋白酶乳酸菌发酵能够降低蛋白质聚集程度,显著提高传统风干牛肉的嫩度。
[1] 王敏, 李梦璐, 葛庆丰, 等.微生物外源酶对发酵肉制品品质的影响[J].食品与发酵工业,2012,38(10):134-139.
WANG M, LI M L, GE Q F, et al.The influence of microbial enzymes on the quality of fermented meat products[J].Food and Fermentation Industries, 2012, 38(10):134-139.
[2] SHEN H, STEPHEN ELMORE J, ZHAO M M, et al.Effect of oxidation on the gel properties of porcine myofibrillar proteins and their binding abilities with selected flavour compounds[J].Food Chemistry,2020,329:127032.
[3] 韦诚,朱丽娟,谢月英, 等.蛋白质在肉类加工保藏中的氧化及其不利影响的研究进展[J].食品科学,2017,38(9):314-321.
WEI C, ZHU L J, XIE Y Y, et al.Progress in protein oxidation during meat processing and preservation and its adverse health effects[J].Food Science,2017,38(9):314-321.
[4] 韩爽,张健,井月欣, 等.微生物源蛋白酶研究进展[J].食品工业科技,2020,41(13):321-327.
HAN S, ZHANG J, JING Y X, et al.Progress in research about the protease extracted from microorganisms[J].Science and Technology of Food Industry,2020,41(13):321-327.
[5] FERN NDEZ M, BENITO M J, MART
NDEZ M, BENITO M J, MART N A, et al.Influence of starter culture and a protease on the generation of ACE-inhibitory and antioxidant bioactive nitrogen compounds in Iberian dry-fermented sausage “salchichón”[J].Heliyon,2016,2(3).DOI:10.1016/j.heliyon.2016.e00093.
N A, et al.Influence of starter culture and a protease on the generation of ACE-inhibitory and antioxidant bioactive nitrogen compounds in Iberian dry-fermented sausage “salchichón”[J].Heliyon,2016,2(3).DOI:10.1016/j.heliyon.2016.e00093.
[6] SUN W Z, ZHAO H F, ZHAO Q Z, et al.Structural characteristics of peptides extracted from Cantonese sausage during drying and their antioxidant activities[J].Innovative Food Science & Emerging Technologies, 2009, 10(4):558-563.
[7] XING L J,GE Q F,JIANG D L, et al.Caco-2 cell-based electrochemical biosensor for evaluating the antioxidant capacity of Asp-Leu-Glu-Glu isolated from dry-cured Xuanwei ham[J].Biosensors and Bioelectronics,2018,105:81-89.
[8] CAO C C, FENG M Q, SUN J, et al.Screening of lactic acid bacteria with high protease activity from fermented sausages and antioxidant activity assessment of its fermented sausages[J].CyTA-Journal of Food,2019,17(1):374-354.
[9] 段丽菊,刘英帅,朱燕, 等.DNPH比色法:一种简单的蛋白质羰基含量测定方法[J].毒理学杂志,2005,19(4):320-322.
DUAN L J, LIU Y S, ZHU Y, et al.DNPH colorimetry:A simple method for the determination of protein carbonyl content[J].Journal of Toxicology,2005,19(4):320-322.
[10] ELLMAN G L.Tissue sulfhydryl groups[J].Archives of Biochemistry & Biophysics, 1959, 82(1):70-77.
[11] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4):681-683.
[12] VISESSANGUAN W, BENJAKUL S, RIEBROY S, et al.Changes in composition and functional properties of proteins and their contributions to Nham characteristics[J].Meat Science, 2004, 66(3):579-588.
[13] ZHANG W G, XIAO S, AHN D U.Protein oxidation:Basic principles and implications for meat quality[J].Critical Reviews in Food Science & Nutrition, 2013, 53(11):1 191-1 201.
[14] 任锐,颜铃,王浩东, 等.肉及肉制品蛋白质氧化机理及其抑制途径的研究进展[J].肉类工业,2020(8):50-53;56.
REN R, YAN L, WANG H D, et al.Research progress of oxidation mechanism of protein in meat and meat products and its inhibition pathway[J].Meat Industry,2020(8):50-53;56.
[15] PETR N M J, BRONCANO J M, OTTE J, et al.Effect of commercial proteases on shelf-life extension of Iberian dry-cured sausage[J].LWT-Food Science and Technology, 2013, 53(1):191-197.
N M J, BRONCANO J M, OTTE J, et al.Effect of commercial proteases on shelf-life extension of Iberian dry-cured sausage[J].LWT-Food Science and Technology, 2013, 53(1):191-197.
[16] 田悦,杜军保.二硫键和巯基在蛋白质结构功能中的作用及分析方法[J].实用儿科临床杂志, 2007,22(19):1 499-1 501.
TIAN Y, DU J B.Effect of disulfide bond and mercapto-group on structure and function of protein and analytical method[J].Journal of Applied Clinical Pediatrics, 2007,22(19):1 499-1 501.
[17] 袁凯, 张龙, 谷东陈, 等.肉品中的蛋白质氧化机制及其影响因素[J].食品科学, 2018, 39(5):329-335.
YUAN K, ZHANG L, GU D C, et al.A review of mechanisms and factors affecting protein oxidation in meat[J].Food Science, 2018, 39(5):329-335.
[18] WU H C, CHEN H M, SHIAU C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J].Food Research International, 2003, 36(9-10):949-957.
[19] QU C,HE Z F,WANG Z M, et al.Effects of NaCl content and drying temperature on lipid oxidation, protein oxidation, and physical properties of dry-cured chicken[J].Journal of Food Science,2020,85(6):1 651-1 660.
[20] 张洪超,薛张芝,徐晓蓉, 等.羟基自由基氧化对乌贼蛋白分子间作用力及结构的影响[J].核农学报,2020,34(1):131-138.
ZHANG H C, XUE Z Z, XU X R, et al.Effect of hydroxyl radical oxidation on myofibrillar protein intermolecular force and structural of Sepia esculenta[J].Journal of Nuclear Agricultural Sciences,2020,34(1):131-138.
[21] 齐宝坤,赵城彬,江连洲,等.大豆分离蛋白组成及二级结构对表面疏水性的影响[J].中国食品学报,2018,18(5):288-293.
QI B K, ZHAO C B, JIANG L Z, et al.Effect of composition and secondary structure of soybean protein isolate on surface hydrophobicity[J].Journal of Chinese Institute of Food Science and Technology,2018,18(5):288-293.
[22] BULAJ G.Formation of disulfide bonds in proteins and peptides[J].Biotechnology Advances, 2005, 23(1):87-92.
[23] XU Y S, XIA W S, YANG F, et al.Protein molecular interactions involved in the gel network formation of fermented silver carp mince inoculated with Pediococcus pentosaceus[J].Food Chemistry, 2010, 120(3):717-723.
[24] 高文宏,叶瑞森,潘廷跳, 等.基于拉曼光谱解析冻藏过程中鱼糜蛋白的结构变化[J].食品科学,2018,39(24):71-77.
GAO W H, YE R S, PAN T T, et al.Analysis of structural changes of surimi proteins during frozen storage by Roman spectroscopy[J].Food Science,2018,39(24):71-77.
[25] MAITI N C, APETRI M M, ZAGORSKI M G, et al.Raman spectroscopic characterization of secondary structure in natively unfolded proteins:α-synuclein [J].Journal of the American Chemical Society, 2004, 126(8):2 399-2 408.
[26] 孙为正. 广式腊肠加工过程中脂质水解、蛋白质降解及风味成分变化研究[D].广州:华南理工大学, 2011.
SUN W Z.Studies on lipolysis, protelysis and flavor compounds during processing of Cantonese sausage[D].Guangzhou:South China University of Technology, 2011.
[27] ALIX A J P, PEDANOU G, BERJOT M.Fast determination of the quantitative secondary structure of proteins by using some parameters of the raman amide I band[J].Journal of Molecular Structure, 1988, 174:159-164.
[28] 童今柱, 娄鹏祥, 吴晓龄,等.肌原纤维蛋白结构变化对鸭肉品质的影响[J].安徽农业科学, 2019, 47(8):162-167.
TONG J Z, LOU P X, WU X L, et al.Effects of structural changes of myofibrillar proteins on meat quality in duck[J].Journal of Anhui Agricultural Sciences, 2019, 47(8):162-167.