糖尿病是一种由胰岛素分泌不足、糖脂代谢失衡而导致的以高血糖为特征,且具有遗传倾向的内分泌代谢性疾病[1-2],其中以2型糖尿病(type 2 diabetes mellitus,T2DM)居多,占糖尿病病例的90%以上[3-4],该病还会引发多种并发症,如心血管疾病、糖尿病、肾病、冠心病等[5]。目前,对T2DM的治疗通常采用口服或注射胰岛素等药物治疗的方式,但其存在严重的副作用[6-7]。因此,从天然植物中寻找具有显著疗效和低副作用的活性成分已成为当前糖尿病治疗领域的研究热点。
果桑是桑科桑属以结果为主、果叶兼用的落叶木本植物桑树的统称[8],是一种“药食同源”植物。其叶、枝、果、根中均含有多种营养成分及黄酮、多糖、生物碱类等已被证实具有降糖功效的生物活性物质[9-11]。研究表明,果桑中存在天然的α-葡萄糖苷酶、α,β淀粉酶抑制剂1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)和荞麦碱,桑叶DNJ可通过激活db/db小鼠骨骼肌中的胰岛素信号PI3K/AKT途径来提高胰岛素敏感性,从而达到降血糖的效果[12]。
肠道菌群是人体最大的微生态系统,人体肠道内居住着超过1014个的微生物[13],它们在调节机体能量摄取、肠道通透性、维持肠道免疫屏障等方面发挥着重要作用[14]。近年来,很多研究表明T2DM与肠道菌群失调有关[15-17]。LARSEN等[18]研究T2DM和非T2DM人体肠道菌群组成的差异发现,与非糖尿病人相比,糖尿病人的厚壁菌门(Firmicutes)和梭状体类的比例明显降低;SEDIGHI等[19]研究发现,在T2DM患者中,乳酸菌水平明显较高,而双歧杆菌在健康人中明显较多。何雪冬等[20]通过Meta分析发现,与健康人群相比,糖尿病患者乳杆菌、拟杆菌、梭菌数量有不同程度的增加,双歧杆菌数量下降。基于之前的研究成果,本研究以桑叶、桑枝皮、桑根皮为原料,按62∶19∶19的质量比制成袋泡茶,以链脲佐菌素(streptozocin, STZ)诱导联合高脂饮食饲养建立2型糖尿病模型小鼠为对象,通过高通量测序方法,从小鼠肠道菌群方面探究果桑茶对T2DM模型小鼠肠道菌群的调整作用,为果桑降糖保健产品的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
体重(20±2) g清洁级5周龄雄性C57BL/6J小鼠购于贵州医科大学实验动物中心,使用许可证号SCXX(京)2014-0004;桑叶、桑枝皮、桑根皮采自贵州开阳某桑葚基地,按62∶19∶19的质量比制成袋泡茶;STZ(纯度≥98%),Sigma公司;羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)(纯度≥98%),阿拉丁化学试剂有限公司;0.1 mol/L柠檬酸钠缓冲液(pH 4.5)(分析纯),索莱宝生物试剂有限公司。
1.2 仪器与设备
FA2004N分析电子天平,上海菁海仪器有限公司;FW-80万能粉碎机,上海仕元科学器材有限公司;VaCo 5-Ⅱ-D真空冷冻干燥机,Zirbus technology GmbH Hilfe Gottes;SW-CJ-1FD无菌操作台,上海苏净实业有限公司;鱼跃580型血糖仪,江苏鱼跃医疗设备有限公司。
1.3 实验方法
1.3.1 试剂制备
果桑复配袋泡茶浸提液冻干粉:将袋泡茶在水温75 ℃,茶水比1∶100(g∶mL),冲泡时间50 min的条件下冲泡1次,取其浸提液置于真空冷冻干燥机中冻干备用。
10%果桑复配茶高脂饲料:将果桑复配茶添加10%(质量分数)到高脂饮食饲料中,并压制成复合饲料备用。
STZ溶液:现用现配,临用时使用0.1 mol/L、pH 4.5柠檬酸缓冲液配制,按照给药剂量35 mg/kg配制成质量浓度为3.5 mg/mL的STZ溶液。
0.5%(质量分数)CMC-Na:称取CMC-Na 0.5 g,加入双蒸馏水至100 mL,并加热溶解至澄清溶液,置于4 ℃冰箱中保存备用。
1.3.2 动物分组及处理
小鼠进入实验室稳定喂养7 d后禁食不禁水过夜12 h,次日通过剪尾取血法测定小鼠空腹血糖和体重,剔除极值后随机选取10只小鼠作为正常对照组给予普通饲料喂养,其余小鼠采用高脂饮食饲养16周致小鼠呈肥胖状态,按小鼠体重注射35 mg/kg STZ溶液,给药量为0.1 mL/10g,7 d后血糖水平高于11.1 mmoL/L即为建模成功。
将血糖水平高于11.1 mmoL/L的小鼠稳定性饲养4周后,按照空腹血糖水平随机分组为4组,每组10只,分别为正常对照组(Control)、模型对照组(Model)、阳性对照组(Metformin)及果桑茶试药组GD-2组、GD-3组,共5组。GD-2受试组采用小鼠自由摄食的方式,正常对照组、模型对照组及GD-3受试组采取灌胃方式进行给药,给药剂量依据《药理实验方法学》中“标准体重动物剂量换算表”来确定,水提物灌胃剂量为200 mg/kg,具体分组及给药情况见表1。灌胃开始后,根据小鼠体重变化调整小鼠灌胃剂量,持续28 d。
表1 试验小鼠分组及给药情况
Table 1 Grouping and administration of experimental mice
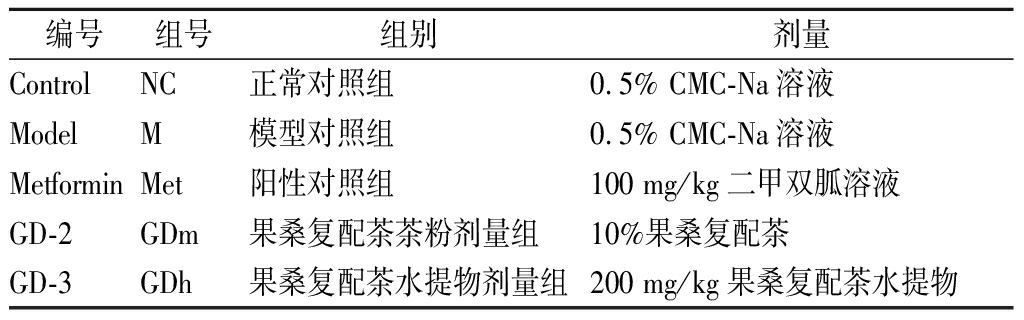
编号组号组别剂量ControlNC正常对照组0.5% CMC-Na溶液ModelM模型对照组0.5% CMC-Na溶液MetforminMet阳性对照组100 mg/kg二甲双胍溶液GD-2GDm果桑复配茶茶粉剂量组10%果桑复配茶GD-3GDh果桑复配茶水提物剂量组200 mg/kg果桑复配茶水提物
1.3.3 样品采集
连续给药28 d后禁食12 h,每组随机选3只小鼠收集粪便并于液氮中贮存。
1.3.4 DNA提取及测序
样本DNA提取并进行高可变区PCR扩增后,使用Nova Seq PE250 测序平台对各组小鼠肠道内容物16S rDNA V3+V4区进行测序。细菌16S rDNA V3+V4区的通用引物名称为341F(5′-CCTACGGGNGGCWGCAG-3′,)、805R(5′-GACTACHVGGGTATCTAATCC-3′)。测序数据使用最新的性能更优的QIIME 2分析流程,调用DADA2[21]对数据进行去噪,相当于以100%的相似度聚类,去冗余后得到特征(Feature),然后基于Feature数据进行菌群结构组成及菌群多样性分析。
1.4 数据分析
将高通量测序得到的原始数据进行优化,得到有效数据,基于有效数据按97%相似性进行操作分类单元(operational taxonomic unit, OTU)聚类分析,对OTU序列进行物种注释。基于OTU结果,通过α多样性分析小鼠肠道菌群多样性、β多样性分析小鼠肠道菌群间的组成差异,根据绘制的样品各分类水平下的群落结构图、热图分析菌群结构组成,根据线性判别分析(linear discriminant analysis,LDA)值分布柱状图和进化分支图进行LEfSe(LDA effect size)多级物种差异判别分析,采用SPSS 19.0进行显著性差异分析,P<0.05认为差异显著。
2 结果与分析
2.1 果桑茶对T2DM模型小鼠空腹血糖值影响
如表2所示,当连续给药后,与模型组相比,其他各组小鼠的空腹血糖值明显降低,差异极显著(P<0.01),阳性组的降糖幅度为43.60%,GDm组的降糖幅度为40.05%,其降糖作用与阳性组相比无明显差异;GDh组其降幅为25.83%。以上结果说明,果桑茶具有和二甲双胍药物一样的降血糖功效,其中GDm组降糖效果最明显。
表2 果桑茶对T2DM模型小鼠空腹血糖值影响
Table 2 Effect of fruit mulberry tea on fasting blood glucose in T2DM model mice
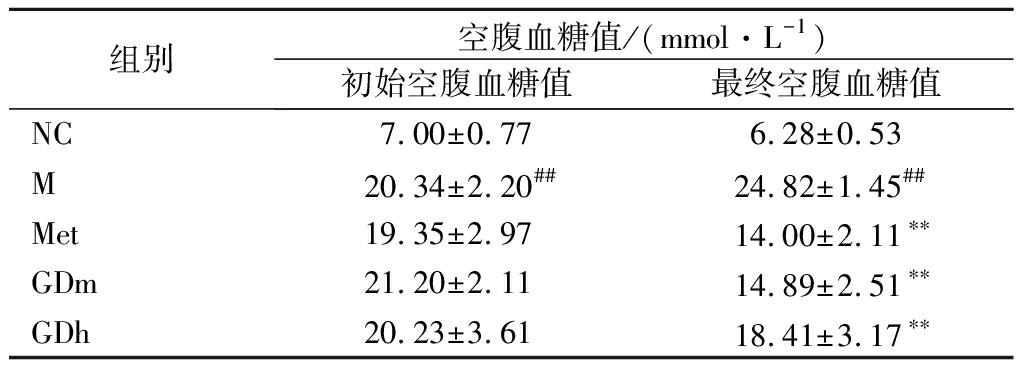
组别空腹血糖值/(mmol·L-1)初始空腹血糖值最终空腹血糖值NC7.00±0.776.28±0.53M20.34±2.20##24.82±1.45##Met19.35±2.9714.00±2.11∗∗GDm21.20±2.1114.89±2.51∗∗GDh20.23±3.6118.41±3.17∗∗
注:模型组与正常组比较,#表示P<0.05,差异性显著,##表示P<0.01,差异性极显著;模型组与其他组比较,*表示P<0.05,差异性显著,**表示P<0.01,差异性极显著
2.2 菌群多样性分析
2.2.1 α多样性分析
本研究采用Chao1、Shannon及Simpson指数来评估小鼠肠道菌群的丰富度和多样性,Good′s Coverage反映样本的测序深度。由表3可知,5个组的Good′s Coverage值均为1,说明测序深度已饱和,实验数据合理可用。Chao1指数反映菌群的总数,Chao1值越大,菌群数越多,所测定样品中,果桑茶给药组(GDh组、GDm组)菌群的多样性均高于模型对照组和阳性对照组,但低于正常对照组。Shannon和Simpson指数反映菌群的多样性,Shannon值越大,菌群多样性越高,5组样品中正常对照组的Shannon值最大,模型对照组最小,其余3个组差别不大,均小于正常对照组,大于模型对照组;Simpson值越大,菌群多样性越低,GDh组的Simpson值最小,阳性对照组次之,其余3个组的值为0.96~0.98。以上结果表明,长期持续的高脂高糖饮食会很大程度地降低小鼠肠道菌群的多样性,而果桑茶产品对调节小鼠肠道菌群多样性有显著效果,这可能是果桑茶中的降糖成分发挥了积极作用。
表3 α多样性比较结果
Table 3 α diversity comparison results

组别OTUShannonSimpsonChao1Good′s CoverageNC741±34a7.05±0.25a0.98±0.01a743±34a1.00M518±106b5.66±0.27ab0.96±0.00a519±107b1.00Met478±110b6.02±0.53b0.94±0.02a478±109b1.00GDm529±80b6.11±0.75ab0.97±0.04a530±81b1.00GDh532±81b5.97±0.33ab0.93±0.03a532±81b1.00
注:同一列中不同字母表示样品之间有显著性差异(P<0.05)
2.2.2 β多样性分析
β多样性分析可反映不同样本菌群间是否存在差异性。本试验采用主成分分析(principal component analysis,PCA)分析样本间的多样性。
如图1所示,横坐标为PCA1,贡献率为40.44%,纵坐标为PCA2,贡献率为14.04%,可以代表大部分变量信息,是样品菌群结构组成差异的主要因子。分析可知,果桑茶给药组、模型对照组和阳性对照组肠道菌群组成结构较正常对照组发生了偏移,模型对照组和阳性对照组均与GDh组在物种组成上有一定程度的相似,而GDm组与正常对照组最接近,说明GDm组在调节小鼠肠道菌群方面效果较为显著。
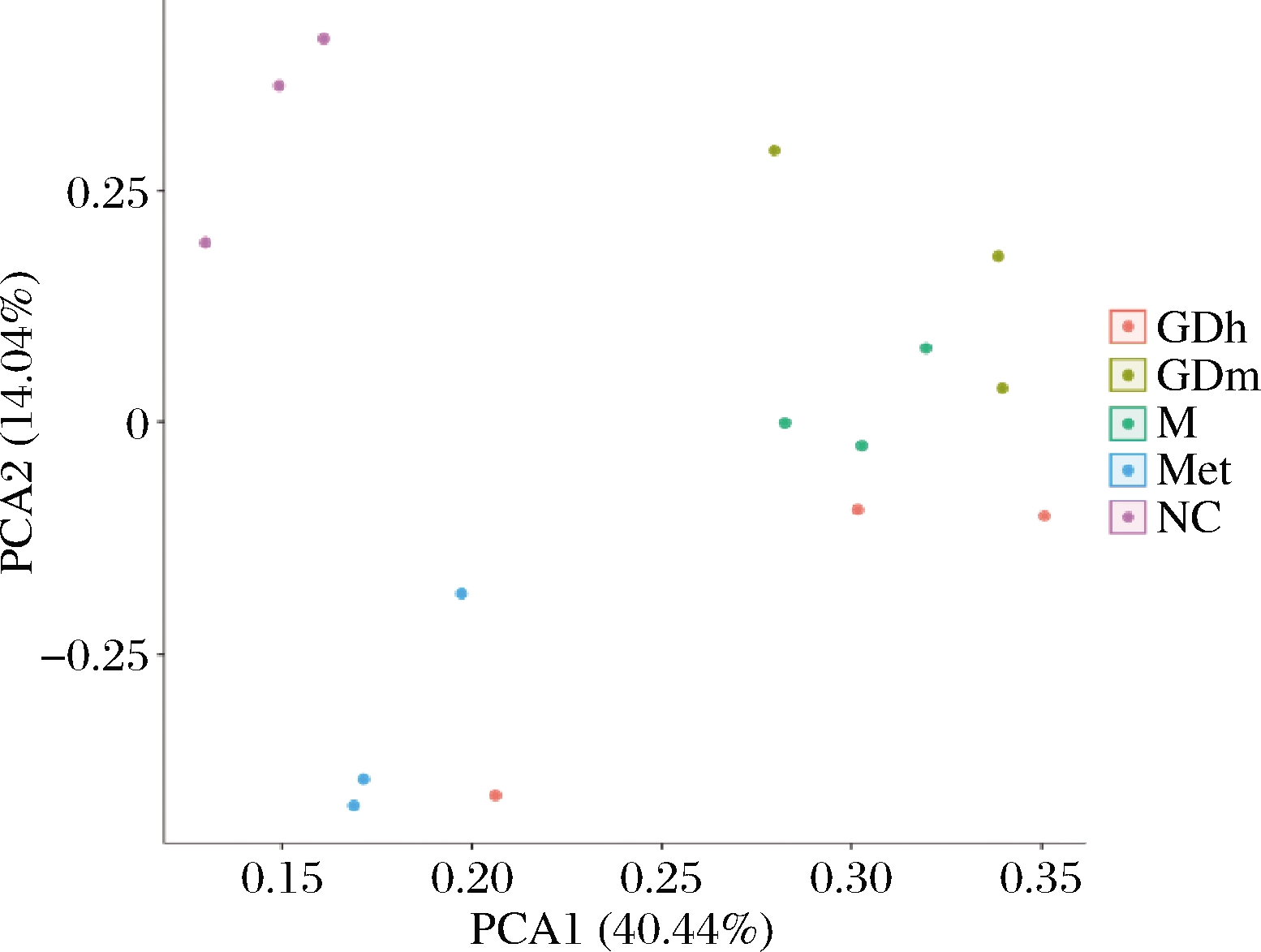
图1 样本细菌主成分分析
Fig.1 Principal component analysis of bacteria in samples
2.3 菌群构成分析
2.3.1 菌群组成分析
各组小鼠肠道中相对丰度较高的菌群比较如表4所示。由图2、图3可知,在门水平上5个样品肠道菌群以厚壁菌门、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)等为主。其中,拟杆菌门是正常对照组的绝对优势菌门,其相对丰度为47.89%,与其他组差异显著(P<0.05),模型对照组中拟杆菌门的相对丰度为15.86%,比正常对照组少32.03%,GDm组拟杆菌门的相对丰度为21.06%;厚壁菌门为正常对照组的次要优势菌门,相对丰度为39.10%,在模型对照组中其相对丰度达到了54.49%,成为绝对优势菌门,经果桑茶给药喂养后,给药组厚壁菌门数量有不同幅度降低,逐渐接近正常对照组水平,其中GDm组效果最明显,与正常对照组相比差异不显著(P<0.05);变形菌门在正常对照组中的相对丰度为4.72%,而在模型对照组中增加至20.35%,经药物治疗后,该菌群涨幅不大,与模型对照组无显著差异(P<0.05),说明果桑茶对此菌群的调节作用不明显。
属水平上的物种相对丰度如图4所示。Muribaculaceae_unclassified是一种有益菌属[22],由图4、图5可知,其是正常对照组的优势菌属,相对丰度为28.89%,在模型对照组、阳性对照组、GDm组、GDh组的相对丰度分别为2.79%、0.20%、6.63%和4.25%,说明果桑茶能在一定程度上抑制有益菌属Muribaculaceae_unclassified的下降。嗜胆菌属(Bilophila)为模型对照组的优势菌属,其相对丰度为11.23%,而在正常对照组中仅占0.06%,阳性对照组、果桑茶给药组均有效地抑制了这种现象,其中以阳性对照组的效果最为显著,嗜胆菌属的相对丰度为1.56%,其次是GDh组,嗜胆菌属的相对丰度为7.86%。阳性对照组、GDm组和GDh组的优势菌属分别为Lachnospiraceae_unclassified、艾克曼菌属(Akkermansia)和毛螺菌科NK4A136群(Lachnospiraceae_NK4A136_group)。
以上结果表明T2DM模型组小鼠与正常组小鼠肠道微生物群落结构存在明显差异,果桑茶可增加糖尿病小鼠中有益菌群的相对丰度,具有调节糖尿病小鼠肠道菌群失调的效果[23]。
表4 各组小鼠丰度较高的微生物比较
Table 4 Microbe comparison of mice with higher abundance in each group

MNCMetGDmGDh嗜胆菌属(Bilophila)Muribaculaceae_unclassifiedLachnospiraceae_unclassified毛螺菌科NK4A136群(Lachnospir-aceae_NK4A136_group)毛螺菌科NK4A136群(Lachnospi-raceae_NK4A136_group)毛螺菌科NK4A136群(Lachno-spiraceae_NK4A136_group)毛螺菌科NK4A136群(Lachnospir-aceae_NK4A136_group)Ruminiclostridium_9嗜胆菌属(Bilophila)Lachnospiraceae_unclassifiedRuminiclostridium_9梭菌属(Clostridiales_unclassified)乳杆菌属(Lactobacillus)艾克曼菌属(Akkermansia)Eisenbergiella另枝菌属(Alistipes)艾克曼菌属(Akkermansia)EisenbergiellaLachnospiraceae_unclassified嗜胆菌属(Bilophila)

图2 门水平上的物种相对丰度
Fig.2 Relative abundance of species at the phylum level
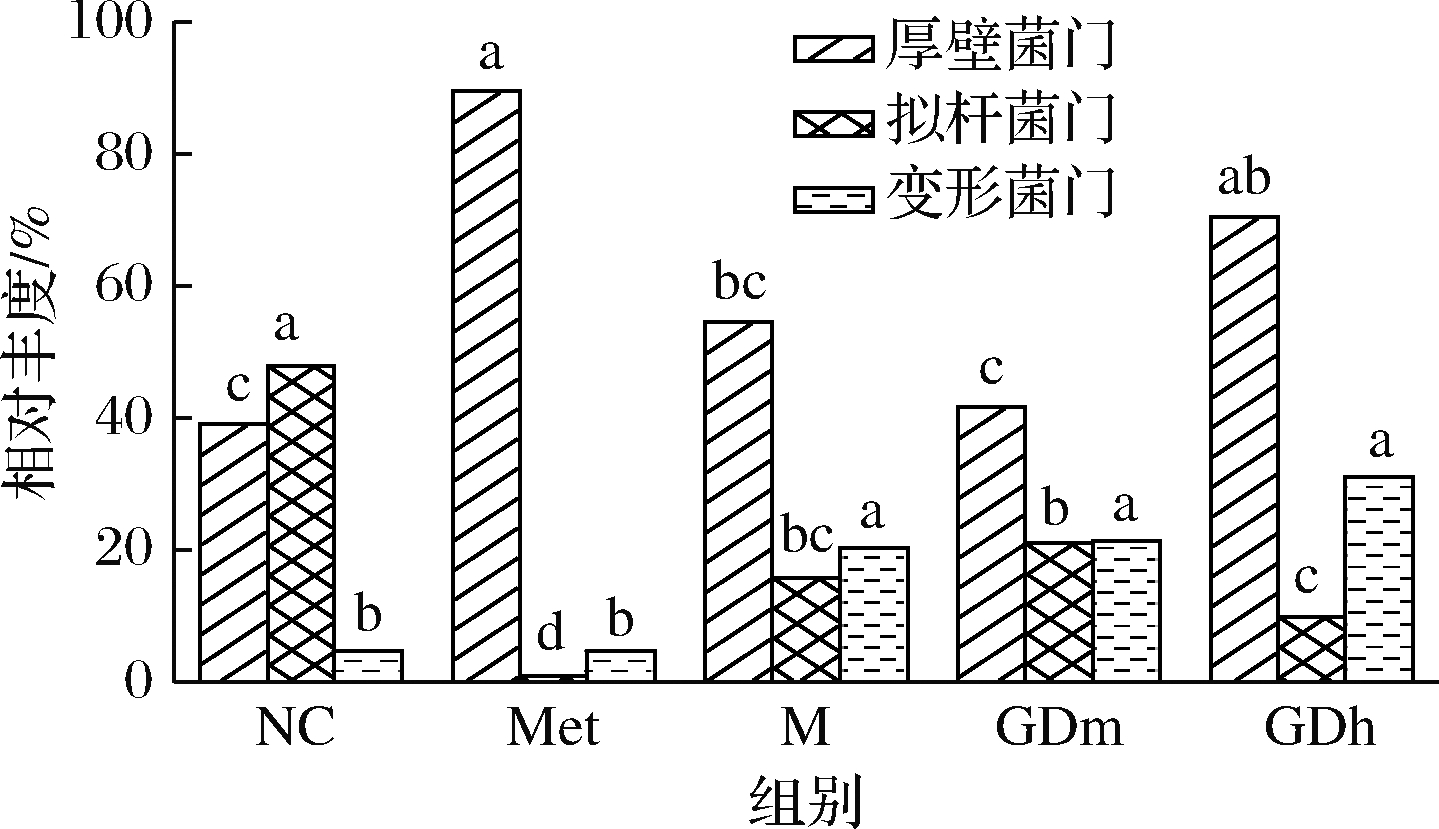
图3 门水平上有显著性差异的主要物种
Fig.3 The main species with significant difference at the phylum level
注:图中不同字母表示不同样品间物种差异显著(P<0.05)(下同)
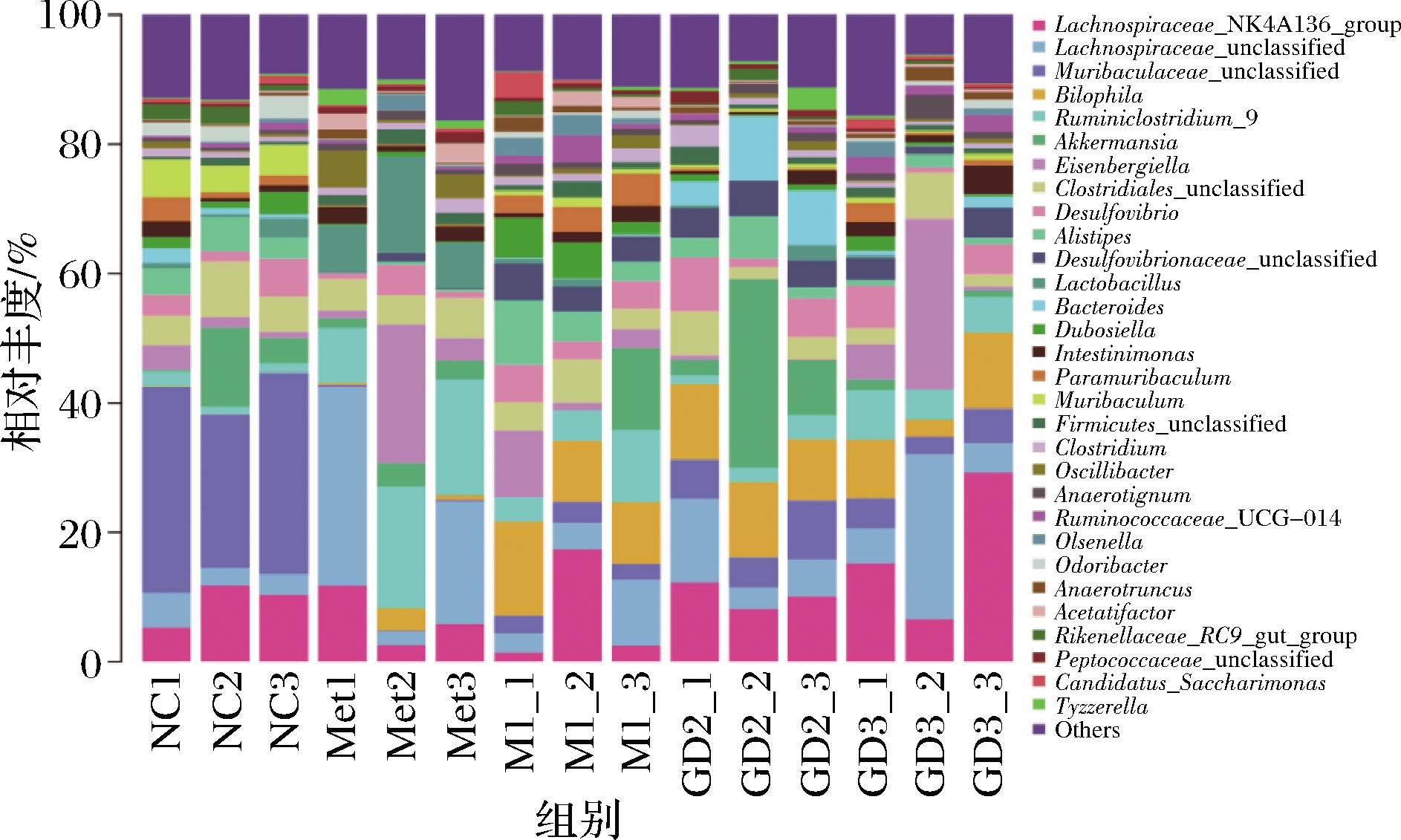
图4 属水平上的物种相对丰度
Fig.4 Relative abundance of species at the genus level
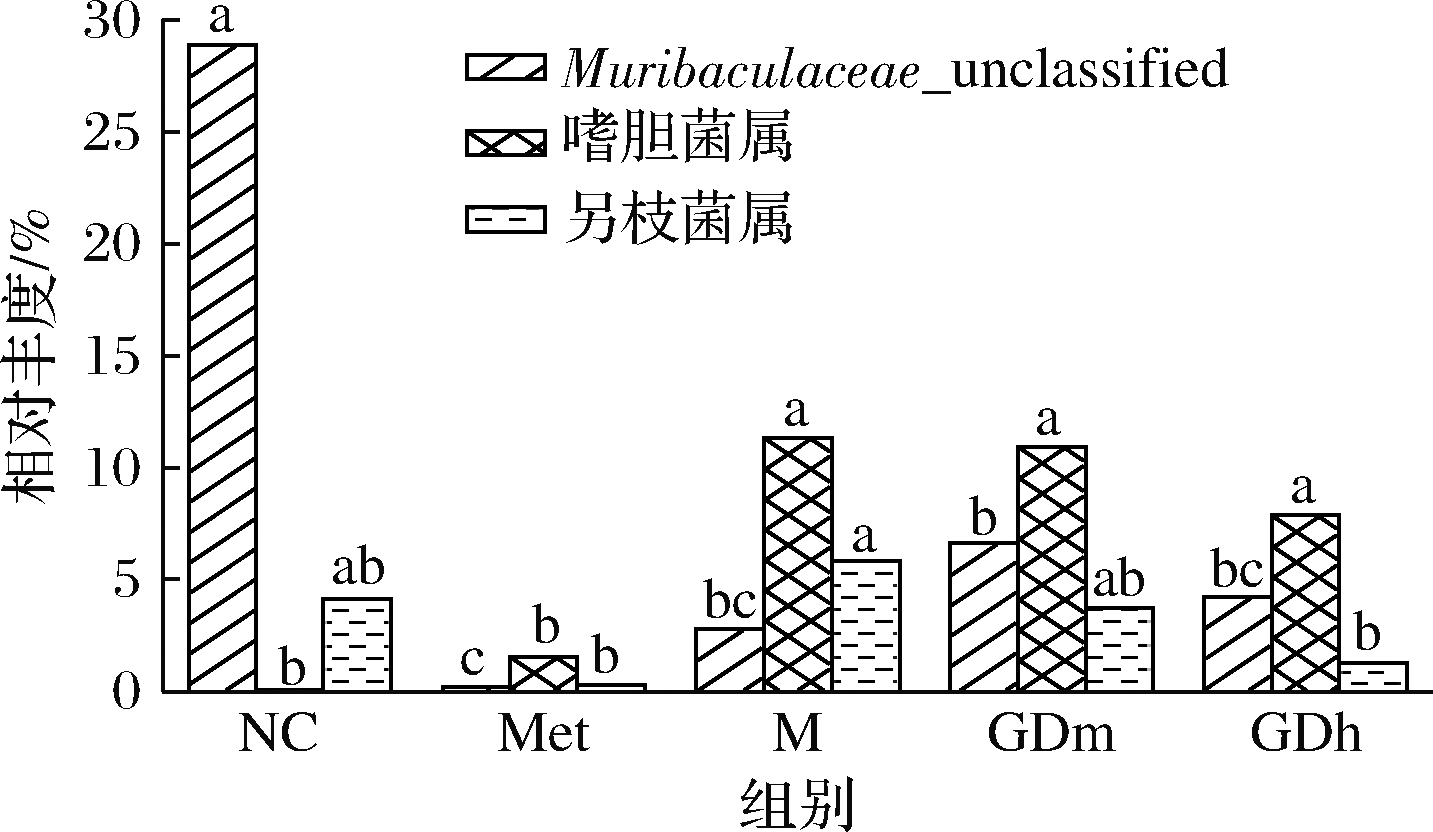
图5 属水平上有显著性差异的主要物种
Fig.5 The main species with significant difference at the genus level
2.3.2 菌群结构差异性分析
将属水平丰度排名在前30的菌群,以不同组间丰度相似性聚类的方式绘制热图,根据颜色的深浅定义数值的大小,通过颜色的不同来反映各组小鼠肠道菌群结构组成的相似性及差异性。由图6分析可知,GDh组和模型对照组归为一类,GDh组中毛螺菌科NK4A136群(Lachnospiraceae_NK4A136_group)相对丰度极高,相关研究表明人体肠道共生菌群中的毛螺菌科成员可表达2种“超级抗原”,这类超级抗原可激活体内的免疫球蛋白A(immunoglobulin A,IgA)应答,在肠道稳态中发挥重要作用[24],说明果桑茶能促进高脂饮食小鼠体内有益菌群的增长。GDm组和正常对照组归为一类,表明GDm组小鼠肠道菌群聚类分析结果与正常小鼠最为接近,GDm组调节小鼠肠道菌群的效果最好。
由以上分析可知,不同组小鼠的肠道菌群具有相似性的同时也存在一定差异性,高脂饮食造模致糖尿病的过程中小鼠肠道菌群逐渐偏离正常,而果桑茶对小鼠肠道菌群的调节具有积极作用。
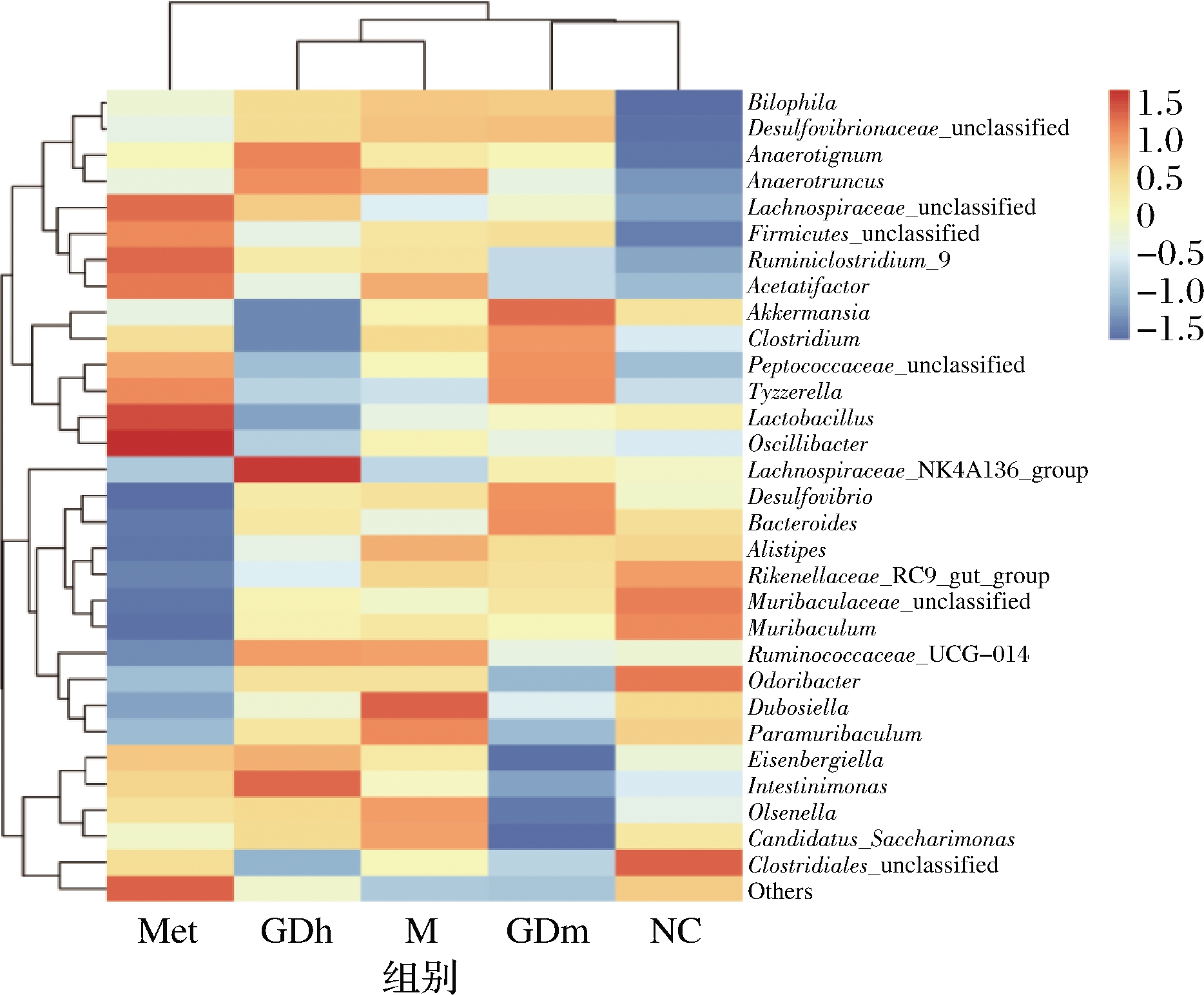
图6 属水平上的相对丰度聚类热图
Fig.6 Cluster heatmap of relative abundance at the genus level
2.4 LEfSe多级物种差异判别分析
LEfSe是一种用于发现和解释高维度数据生物标识的分析工具,能够在组与组之间寻找具有统计学差异的生物标志物 (biomarker)。图7是从门到种水平下各组样本的LDA值分布柱状图,物种的LDA得分用横坐标来表示,LDA值>3的物种为具有统计学差异的biomarker。图8是各组样本的进化分支图。
结合图7、图8分析可知,正常对照组中对群落结构影响较大的物种有拟杆菌纲(Bacteroidia)、拟杆菌门、拟杆菌目(Bacteroidales)、Muribaculaceae、Muribaculaceae-unclassfied、Muribaculum等。阳性对照组中对群落结构影响较大的物种有厚壁菌门、梭杆菌目(Clostridiales)、梭杆菌纲(Clostridia)、Bacteria、Ruminiciostridium-9-unclassfied、Ruminiciostridium-9等。模型对照组中对群落结构影响较大的有嗜胆菌属、unclassfied-Bilophila、理研菌科(Rikenellaceae)、另枝菌

图7 各组样本的LDA值分布柱状图
Fig.7 Histogram of LDA value distribution of each group of samples
属、Paramuribaculum、Paramuribaculum-intestinale、Alistipes-unclassfied,Alistipes是小鼠中细菌最丰富的属之一,它与调节胰岛素释放和逆转胰岛素抵抗的肠道激素的释放有关[25]。GDm组中对群落结构影响较大的物种有拟杆菌属(Bacteroides)、拟杆菌科(Bacteroidaceae)、unclassfied-Bacteroides-sp、Desulfovibrionaceae-unclassfied、副拟杆菌属(Parabcteroides)、Tannerellaceae、Parabcteroides-unclassfied。GDh组中对群落结构影响较大的物种有毛螺菌科(Lachnospiraceae)、瘤胃菌属UCG014(Ruminococcaceae-UGG-014)、Ruminococcaceae-UGG-014-unclassfied、消化链球菌科(Peptostreptococcaceae)、Romboutsia。
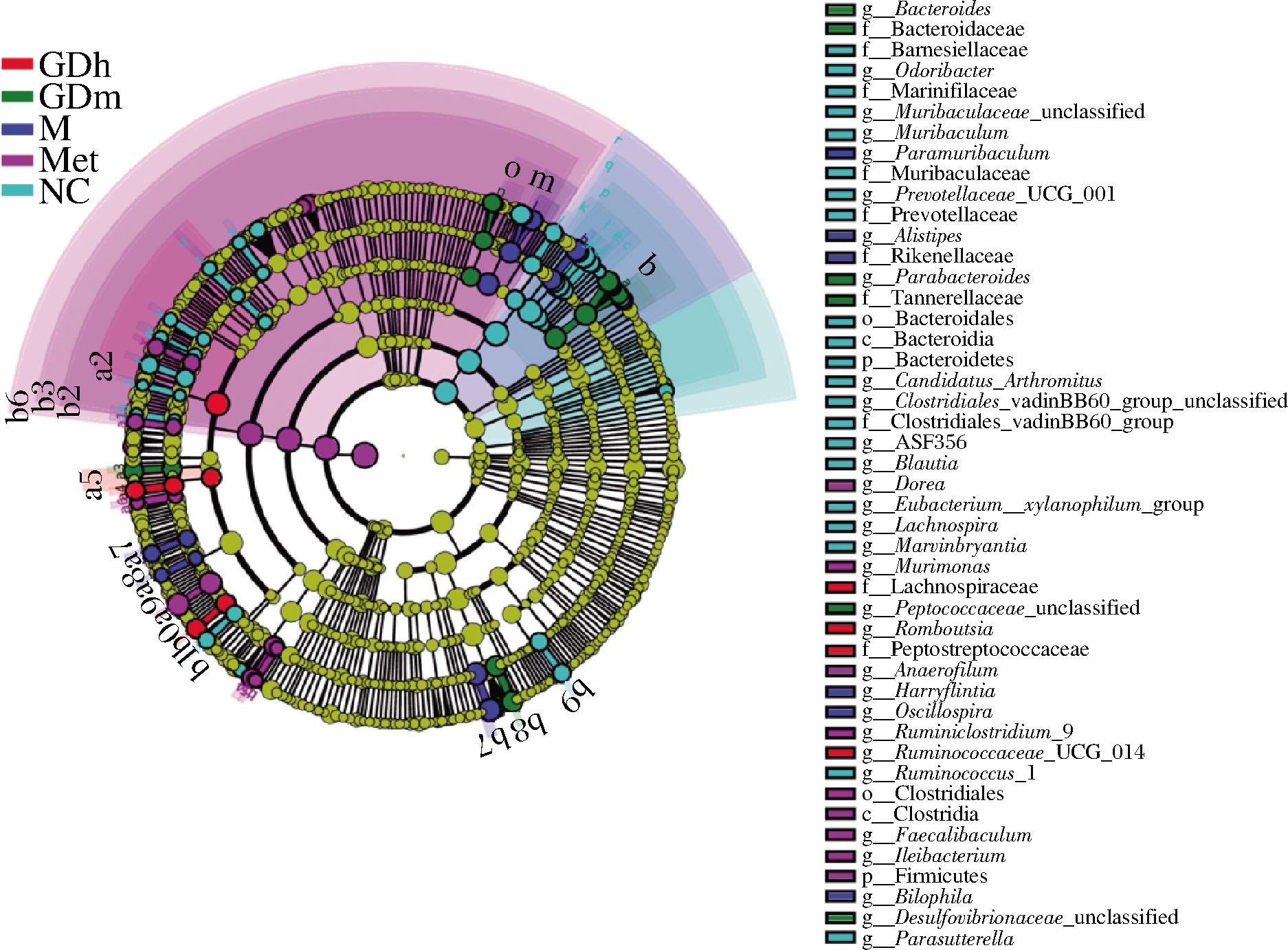
图8 各组样本的进化分支图
Fig.8 Evolutionary branch diagram of each group of samples
注:小圆圈:图中由内至外辐射的圆圈代表了由门至属的分类级别。 不同分类级别上的每一个小圆圈代表该水平下的一个分类,小圆圈 直径大小与相对丰度大小呈正比;颜色:无显著差异的物种统一着色 为黄色,差异显著的物种Biomarker跟随组别进行着色,红色节点表示 在红色组别中起到重要作用的微生物类群,绿色节点表示在绿色组别中 起到重要作用的微生物类群;未能在图中显示的Biomarker对应的物种 名会展示在右侧,字母编号与图中对应
3 讨论
肠道菌群的状态可以通过粪便菌群的变化反映出来,高通量测序技术现已广泛应用于肠道菌群研究等多个领域,与传统检测方法相比,具有更准确定量、实时检测的优势。本研究通过高通量测序技术对小鼠粪便进行检测,分析探讨果桑茶对2型糖尿病模型小鼠肠道菌群的调节效果。
菌群α多样性分析表明,模型对照组小鼠肠道菌群的多样性与正常对照组相差较大,正常对照组与给药组的Chao1和Shannon值均大于模型对照组,模型对照组的Simpson值大于GDm组和正常组而小于GDh组和阳性对照组,说明糖尿病的产生会降低小鼠肠道菌群的多样性,而果桑茶可以提高肠道菌群的丰度,其中GDm组效果最好。β多样性分析发现正常对照组与GDm组、GDh组与阳性对照组群落构成差异较小,GDm组小鼠的肠道菌群构成最接近正常对照组。
菌群构成分析发现,在门和属水平上,各组小鼠肠道菌群存在明显差异。在门分类水平上,拟杆菌门和厚壁菌门是正常对照组小鼠肠道菌群中的优势菌门,这与BEZIRTZOGLOU等[26],QIN等[27]的研究结果相似,厚壁菌门和拟杆菌门能共同促进对糖的分解利用[28],相关研究表明厚壁菌门与拟杆菌门比值与个体体重呈正相关,经高脂饮食后,模型对照组中厚壁菌门相对丰度升高而拟杆菌门相对丰度降低,给药治疗后,拟杆菌门相对丰度有所增加,GDm组效果最显著。在属分类水平上,Muribaculaceae_unclassified是正常组中的优势菌属,其在模型对照组和阳性对照组中的丰度最低,与之相比在果桑茶给药组中其丰度有明显提高。嗜胆菌属是一种2型糖尿病的标志物,其中的沃氏嗜胆菌Bilophila wadsworthia能引起和加重炎症[29],与正常对照组相比,模型对照组中嗜胆菌属呈明显上升趋势,而给药组有效地抑制了这种现象。GDm组中的优势菌属艾克曼菌属可降解黏蛋白生成短链脂肪酸,与肥胖、糖尿病等疾病呈负相关[30]。GDh组优势菌属毛螺菌科NK4A136群对肠道黏膜损伤具有一定的修复作用,在调节和稳定肠道菌群方面发挥着重要作用[31]。说明果桑茶能在调节2型小鼠糖尿病肠道菌群方面发挥积极作用。
LEfSe多级物种差异判别分析表明,与模型对照组相比,GDm组中的嗜胆菌属等有害菌群的丰度降低,而有益菌群拟杆菌属等的丰度增高;此外,GDm组小鼠的肠道菌群多样性和物种丰富度较模型对照组显著提高,与正常对照组小鼠接近,这些结果表明果桑茶在将糖尿病小鼠肠道菌群紊乱调节到接近正常状态方面具有一定的功效,这可能与果桑茶中的多糖、黄酮等生物活性物质有关[32]。
4 结论
本研究采用高通量测序对果桑茶对2型糖尿病模型小鼠肠道菌群的影响进行研究。结果不仅验证了2型糖尿病会破坏小鼠肠道菌群平衡,降低菌群丰度,同时证明了果桑茶能提高小鼠肠道菌群的丰度,并在一定程度上增加有益菌群的数量,降低高血糖特征菌群及有害菌群的影响,促进肠道菌群良性发展。本研究的结果可为果桑资源的综合应用奠定理论基础,同时为果桑茶应用于2型糖尿病的干预治疗提供一定的科学依据。
[1] 王娜, 林彩霞, 徐李玲, 等.青钱柳双瓜袋泡茶对2型糖尿病小鼠血糖、血脂与肝肾功能的影响及机制研究[J].广西医科大学学报, 2019, 36(12):1 889-1 894.
WANG N, LIN C X, XU L L, et al.Effects and mechanisms of Paliurus Duplex Cucumis tea bags on blood glucose, serum lipid and liver and kidney function in type 2 diabetic mice[J].Journal of Guangxi Medical University, 2019, 36(12):1 889-1 894.
[2] 何静, 高婉婷, 海勒, 等.驼乳对2型糖尿病小鼠肝脏损伤的保护作用[J].中国食品学报, 2019, 19(7):36-41.
HE J, GAO W T, HAI L, et al.Protective effect of camel milk on liver injury in type 2 diabetic mice[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(7):36-41.
[3] WANG L M, GAO P, ZHANG M, et al.Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J].JAMA, 2017, 317(24):2 515-2 523.
[4] HOLMAN N, YOUNG B, GADSBY R.Current prevalence of type 1 and type 2 diabetes in adults and children in the UK[J].Diabetic Medicine, 2015, 32(9):1 119-1 120.
[5] MOUSTAFA P E, ABDELKADER N F, AWDAN S A, et al.Extracellular matrix remodeling and modulation of inflammation and oxidative stress by sulforaphane in experimental diabetic peripheral neuropathy[J].Inflammation, 2018, 41(4):1 460-1 476.
[6] 焦丹, 李浩霞, 吴丹丹, 等.魔芋低聚糖缓解高糖水平诱发的大鼠代谢综合征及相关机制[J].食品科学, 2019,40(13):137-142.
JIAO D, LI H X, WU D D, et al.Alleviatory effect and underlying mechanism of konjac oligosaccharides on high glucose induced-metabolic syndrome in rats[J].Food Science, 2019, 40(13):137-142.
[7] SAGBO I J, VAN DE VENTER M, KOEKEMOER T, et al.In vitro antidiabetic activity and mechanism of action of Brachylaena elliptica (thunb.) DC[J].Evidence-based Complementary and Alternative Medicine:ECAM, 2018.DOI:10.1155/2018/4170372.
[8] 亓桂成, 王翠香, 韩朝晖, 等.不同处理方法对台湾果桑硬枝扦插的影响[J].山东林业科技, 2018, 48(3):49-51;56.
QI G C, WANG C X, HAN Z H, et al.Effects of different treatment methods on hardwood cutting of mulberry in Taiwan[J].Journal of Shandong Forestry Science and Technology, 2018, 48(3):49-51;56.
[9] 姜贝贝, 罗阳, 王洪荣.桑叶的营养价值及作为畜禽饲料的研究进展[J].饲料工业, 2017, 38(5):51-54.
JIANG B B, LUO Y, WANG H R.The nutritional value of mulberry leaf and its application in the livestock feed[J].Feed Industry, 2017, 38(5):51-54.
[10] 余婉莎. 桑枝多糖提取与结构分析及生物活性探究[D].重庆:西南大学, 2018.
YU W S.Extraction, structure analysis and biological activity of polysaccharides from ramulus mori[D].Chongqing:Southwest University, 2018.
[11] 段志涛. 桑白皮有效部位工艺、质控及药效学研究[D].广州:广州中医药大学, 2013.
DUAN Z T.Study on extraction, purification and quality standard research of the total effective parts of cortex mori and discussing on lowering blood sugar and blood lipid[D].Guangzhou:Guangzhou University of Chinese Medicine, 2013.
[12] LIU Q P, LI X, LI C Y, et al.1-deoxynojirimycin alleviates insulin resistance via activation of insulin signaling PI3K/AKT pathway in skeletal muscle of db/db mice[J].Molecules, 2015, 20(12):21 700-21 714.
[13] 郭丽璇, 胡琼英, 熊大迁.肠道菌群调控2型糖尿病发生发展的研究进展[J].实用医学杂志, 2020, 36(9):1 142-1 147.
GUO L X, HU Q Y, XIONG D Q.Research progresses of intestinal flora regulating the occurrence and the development of type 2 diabetes mellitus[J].The Journal of Practical Medicine, 2020, 36(9):1 142-1 147.
[14] PRAKASH S, RODES L, COUSSA-CHARLEY M, et al.Gut microbiota:Next frontier in understanding human health and development of biotherapeutics[J].Biologics, 2011, 5:71-86.
[15] 李沫. 普洱茶通过作用于肠道菌群从而对糖尿病前期患者糖脂代谢影响的机制研究[D].长春:吉林大学, 2020.
LI M.Mechanism of Puer tea improving glucose and lipid metabolism in pre-diabetic patients by effecting on intestinal microflora[D].Changchun:Jilin University, 2020.
[16] ZHAO L P, ZHANG F, DING X Y, et al.Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes[J].Science, 2018, 359(6 380):1 151-1 156.
[17] MORENO-INDIAS I, CARDONA F, TINAHONES F J, et al.Impact of the gut microbiota on the development of obesity and type 2 diabetes mellitus[J].Frontiers in Microbiology, 2014, 5:190.
[18] LARSEN N, VOGENSEN F K, VAN D BERG F W J, et al.Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J].PloS One, 2010, 5(2):e9085.
[19] SEDIGHI M, RAZAVI S, NAVAB-MOGHADAM F, et al.Comparison of gut microbiota in adult patients with type 2 diabetes and healthy individuals[J].Microbial Pathogenesis,2017, 111:362-369.
[20] 何雪冬, 王芳, 王瑶, 等.糖尿病患者肠道菌群特征及其相关性的系统评价[J].中国微生态学杂志, 2020, 32(4):397-403.
HE X D, WANG F, WANG Y, et al.Characteristics of intestinal flora in diabetic patients and their correlation:A systematic review[J].Chinese Journal of Microecology, 2020, 32(4):397-403.
[21] CALLAHAN B J, MCMURDIE P J, ROSEN M J, et al.DADA2:High-resolution sample inference from illumina amplicon data[J].Nature Methods, 2016, 13(7):581-583.
[22] 孙鹏鹏. 益生菌发酵枇杷提取物的功效学研究[D].济南:山东大学, 2019.
SUN P P.Study on the efficacies of probiotics fermented loquat extracts[D].Jinan:Shandong University, 2019.
[23] SHENG Y,ZHENG S J,ZHANG C H, et al.Mulberry leaf tea alleviates diabetic nephropathy by inhibiting PKC signaling and modulating intestinal flora[J].Journal of Functional Foods, 2018, 46:118-127.
[24] BUNKER J J, DREES C, WATSON A R, et al.B cell superantigens in the human intestinal microbiota[J].Science Translational Medicine, 2019, 11(507):e9356.
[25] YAN X, YANG C F, LIN G P, et al.Antidiabetic potential of green seaweed enteromorpha prolifera flavonoids regulating insulin signaling pathway and gut microbiota in type 2 diabetic mice[J].Journal of Food Science, 2019,84(1):165-173.
[26] BEZIRTZOGLOU E,TSIOTSIAS A,WELLING G W.Microbiota profile in feces of breast and formula-fed newborns by using fluorescence in situ hybridization (FISH)[J].Anaerobe, 2011, 17(6):478-482.
[27] QIN J J, LI R Q, RAES J, et al.A human gut microbial gene catalogue established by metagenomic sequencing[J].Nature, 2010, 464(7 285):59-65.
[28] 刘尔卓, 吴忠坤, 赵紫薇, 等.基于高通量测序分析鲜槟榔水提液对于小鼠肠道菌群及免疫指标的影响[J].食品研究与开发, 2020, 41(10):28-33;166.
LIU E Z, WU Z K, ZHAO Z W, et al.High-throughput sequencing analysis of fresh Areca nut extract on intestinal flora and immune indexes of mice[J].Food Research and Development, 2020, 41(10):28-33;166.
[29] FENG Z, LONG W M, HAO B H, et al.A human stool-derived bilophila wadsworthia strain caused systemic inflammation in specific-pathogen-free mice[J].Gut Pathogens, 2017, 9(1):59.
[30] CAN I P D,DE VOS W M.Next-generation beneficial microbes:The case of Akkermansia muciniphila[J].Frontiers in Microbiology, 2017, 8:1 765.
[31] 杨莉, 杨卫星, 张智芳, 等.高通量测序研究德昂酸茶对高脂饮食小鼠肠道微生物的影响[J].扬州大学学报(农业与生命科学版), 2020, 41(2):100-106.
YANG L, YANG W X, ZHANG Z F, et al.Effect of De′ang pickled tea on intestinal microorganisms in mice with high- fat diet based on high-throughput sequencing[J].Journal of Yangzhou University(Agricultural and Life Science Edition), 2020, 41(2):100-106.
[32] GUO X J, CHENG M, ZHANG X, et al.Green tea polyphenols reduce obesity in high-fat diet-induced mice by modulating intestinal microbiota composition[J].International Journal of Food Science & Technology, 2017,52(8):1 723-1 730.