针对目标产物选育具有突出性状的酿酒酵母是生产优质葡萄酒重要的基础和关键[1],其中乙醇和甘油分别为酿酒酵母乙醇发酵的主产物和主要副产物,是葡萄酒酿酒酵母选育最重要的性状之一[2],二者的产量常受酵母的生长及发酵过程中产生的有机酸的影响[3-4]。近年来对优良酿酒酵母筛选的研究较为丰富,目前常用的方法仍为锥形瓶筛选,其设备要求简便、操作难度低。然而随着对优良酿酒酵母需求的日益增加,锥形瓶筛选费时费力、成本较高等固有缺陷逐渐成为制约菌株筛选效率的一大瓶颈[5]。因此,亟需通过高通量筛选技术如微孔板(microtiter plates,MTP)培养、微规模生物反应器,并行发酵系统等方式缩短菌株筛选时间[6-7]。
基于MTP的高通量筛选高效快速等特点,广泛应用于细胞筛选领域。已有的研究表明,MTP与锥形瓶2种模型在细胞的培养、生长代谢检测等方面具有高度一致性[8-9],且基于MTP的全自动细胞筛选装置的开发极大地提升了筛选效率,为传统的基于锥形瓶发酵的检测方法提供了一种互补性的筛选方案[10]。在酵母的相关研究中,基于MTP的试验方法也开始引发研究者的关注。LICCIOLI等[11]证明酿酒酵母的MTP发酵与自身诱导的锥形瓶厌氧发酵在甘油与乙酸酯产量上具有一致性。程艳等[12]使用96孔板培养酿酒酵母菌株,并联用HPLC检测发酵液,成功筛选出低产尿素的酿酒酵母。与此同时,酵母的MTP筛选也暴露出一定问题,例如MTP发酵体积较小,实时监控发酵难度更大[13],且缩小的体系更易受外界环境影响,对实验精度的要求更高[14]。已有的研究表明,静置发酵过程中,溶氧会影响酵母的代谢路径,最终会导致产物含量的巨大差异[15],且MTP有限通气的情况下酿酒酵母生长较慢,但有助于延缓酵母老化[16],因此设计实验方案时需加以慎重考虑。
基于上述原因,本研究选择乙醇、甘油、残糖作为酿酒酵母MTP筛选条件的衡量指标,通过与传统锥形瓶静置发酵进行对比,首先探究了乙醇发酵产物MTP筛选的最佳条件,随后通过差异性检验、聚类分析及多因素方差分析探究了菌株、装液量及覆膜情况对酿酒酵母相关性状筛选的影响。为建立适用于酿酒酵母的快速筛选方法、推动本土微生物资源的开发与利用、加快产业的发展提供了理论支持。
1 材料与方法
1.1 菌株
选取不同遗传背景,发酵能力有差异的酿酒酵母单倍体N2、N3、N5、N7、N10、L9、L12及L13作为不同发酵能力的菌株代表,用以测定不同条件MTP筛选与锥形瓶筛选的差异。所选单倍体均源自西北农林科技大学葡萄酒学院微生物种质资源室。
1.2 试剂及仪器
MJX智能霉菌培养箱,宁波江南仪器厂;Y15全自动葡萄酒检测仪,西班牙Biosystems公司;生物传感分析仪,山东省科学院生物研究所;Elx800酶标仪,美国BioTek公司;微孔板,美国Costar公司;SF-300微透氧封板膜、SF-501封板膜,北京BioTss公司;液相色谱-质谱联用仪,美国Agilent公司。
酵母基础培养基(yeast extract protein dextrose,YEPD)[17]:葡萄糖2%,蛋白胨2%,酵母浸粉1%,固体培养基中加入2%琼脂。
MS300培养基:参照BELY等[18]的配方,调整含糖量为350 g/L,其中葡萄糖与果糖的质量比为1∶1。
1.3 实验方法
1.3.1 酵母种子液制备
取-80 ℃冰箱保藏的甘油管冻存菌株,于YEPD固体培养基上划线,挑取形态整齐的单菌落转接于50 mL YEPD液体培养基中,28 ℃、150 r/min培养24 h制备种子液。对制备的种子液进行血球板计数,以5×105 cells/mL接种至不同发酵方案组使用的MS300模拟汁。
1.3.2 发酵方案
使用150 mL锥形瓶(erlenmeyer flask fermentation,EF)100 mL装液量、24孔板2 mL及1 mL装液量、48孔板0.5 mL装液量及96孔板0.2 mL装液量,进行不同装液量的MTP发酵试验。由于不同溶氧浓度对乙醇发酵的终产物有重要的影响,实验使用了2种不同氧气通透性的MTP封板膜:其中SF-300密封膜为医用透气性微孔软膜,可实现二氧化碳和氧气的自由交换,阻止水蒸气蒸发,发酵环境视为微透氧环境(microaerobic fermentation,MF);而SF-501密封膜为非渗透性软膜,不具有气体通透性,可完全阻隔发酵过程中MTP内外的物质交换,其发酵环境视为严格厌氧(anaerobic fermentation,AF)。9组实验处理均使用MS300模拟汁,于25 ℃条件下静置发酵,每组3个生物学重复。
1.3.3 理化指标检测
待发酵液残糖含量近乎停止下降时视为发酵停滞,取剩余发酵液12 000 r/min离心5 min取上清液,于-20 ℃冰箱冻存待检。理化指标检测前使用蒸馏水将发酵液稀释至目标产物检测范围内。使用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法进行残糖检测[19];参考杜青等[20]的方法,使用生物传感分析仪对样品进行乙醇含量测定;使用Y15全自动葡萄酒分析仪及配套的甘油检测试剂盒(GPO-POD法)进行甘油含量检测;参考WANG等[21]的方法使用HPLC进行有机酸含量检测。
1.4 数据分析
使用Excel 2016进行理化指标的数据处理,使用SPSS 20.0软件进行显著性分析及多因素方差分析(P<0.05表示具有统计学意义),使用R 3.5.0及Graphpad Prism 8.0绘制图表。
2 结果与分析
2.1 不同发酵体系对酿酒酵母产乙醇和甘油性状影响
首先以锥形瓶静置组(EF-100)为参照,探究了不同的MTP筛选体系(MF-2MTP、MF-1MTP、MF-0.5MTP、MF-0.2MTP、AF-2MTP、AF-1MTP、AF-0.5MTP、AF-0.2MTP)对菌株乙醇发酵的影响。不同发酵体系对主要物质(乙醇、甘油、残糖)产量具有极显著的影响(图1),绝大部分MTP发酵条件与锥形瓶静置筛选结果具有较大差异,且这一现象在不同菌株的发酵产物中均普遍存在。综合对比各菌株筛选结果可知,使用严格厌氧覆膜的实验组(AF)与锥形瓶组(EF)在残糖、乙醇、甘油含量上更为接近,且均与使用透氧性覆膜的实验组(MF)具有较大差异。MF组发酵产物符合酿酒酵母的有氧发酵模式,其产物中的残糖和乙醇含量更低,甘油含量更高,该发酵方式的主要目的往往是收集酵母菌体。而在实际生产中则主要依靠酿酒酵母的厌氧发酵模式以产生乙醇,因此在酵母筛选过程中也需贴近实际应用环境进行筛选,使用与锥形瓶静置发酵更为接近的AF组作为筛选条件更为适宜。若不考虑筛选条件对终产物的影响,采用未经优化的MTP筛选方案,其结果可能与传统的锥形瓶静置筛选具有很大出入,对后续研究造成影响。

A-乙醇;B-甘油;C-残糖
图1 不同菌株发酵液中乙醇、甘油和残糖的含量
Fig.1 Content of ethanol, glycerol l and sugar in the fermented broth produced/consumed by each strain
2.2 MTP替代锥形瓶筛选酿酒酵母产乙醇和甘油性状效果的评估
为找出筛选效果与锥形瓶最为接近的MTP筛选条件,本研究首先将各组MTP发酵条件下不同菌株同一产物的含量视为一组数据,对其离散程度进行了比较,并对其均值进行差异性检验。随后通过比较锥形瓶与最优替代条件下不同产物的菌株排序,对该最优条件的实际替代效果进行评价。
综合对比EF组与各MTP组筛选结果可知,EF-100组与AF-2MTP、AF-1MTP、AF-0.5MTP间在乙醇、甘油、乙酸的平均值间不存在显著差异。其中AF-2MTP(24孔板,完全厌氧覆膜,2 mL装液量)组的发酵产物含量及菌株间离散程度与EF-100组最为接近。对二者进行不同产物的菌株排序,结果证明AF-2MTP具有在以产乙醇、甘油能力为目标的酿酒酵母筛选中替代锥形瓶筛选的良好潜力(数据未列出)。但在本实验条件下仍无法达到完美替代锥形瓶静置筛选残糖及乙酸的效果。同时由于乙酸产量较低,挥发性强,感官阈值低等特性,需根据其产物特征进一步优化筛选条件,提高检测精度,方可应用于以产乙酸能力为目标的酿酒酵母筛选。
EF与AF组的乙醇含量显著高于有氧发酵的MF组:AF-2MTP组乙醇平均值最高,为11.34%(体积分数),MF-0.5MTP组乙醇平均值最低,为1.94%(体积分数)(图2-A)。甘油产量与乙醇产量呈负相关:EF与AF组的甘油产量接近,均显著低于MF组,且EF组与AF组内菌株间差异较小,均小于MF组。MF-0.5MTP组甘油平均值最高,为26.42 g/L,AF-2MTP组甘油平均值最低,为9.43 g/L(图2-B)。MF组残糖相较于EF与AF组更低,发酵更为彻底。EF-100组残糖平均值最高,为55.11 g/L,MF-0.2MTP组残糖平均值最低,为17.41 g/L(图2-C)。MF组部分菌株的残糖与其他菌株间均存在较大差异,这可能是有氧发酵过程中菌株间渗透压耐受性差异所导致的。EF组乙酸产量低于MF组与大部分AF组,且EF组与AF组间差异较小,MF组间菌株差异较大。MF-0.5MTP组乙酸平均值最高,为7.58 g/L,EF-100组乙酸平均值最低,为0.95 g/L(图2-D)。整体而言,MF组间发酵产物含量差异巨大,这可能与含氧量对酿酒酵母生长代谢的影响有关。根据谭俊[13]的研究,筛选过程中使用的MTP类型与装液量会影响筛选体系的气体交换速率,因此各MF组间含氧量可能存在一定差异,而酿酒酵母菌株在不同含氧量条件下的生长代谢水平差异显著,并最终导致了MF组间巨大的代谢物差异。

A-乙醇;B-甘油;C-残糖;D-乙酸
图2 不同处理中乙醇、甘油、残糖和乙酸均值比较
Fig.2 Mean values of ethanol, glycerol, sugar and acetic acid in the fermented broth under different treatments
注:不同小写字母表示显著(P<0.05)
大多数MTP组离散程度较锥形瓶组更大,体现出MTP筛选发酵液体积少,易受到外界影响的特点。这与周剑等[22]筛选高产Rakicidin B1的海洋小单孢菌时得出的结论具有一致性。因此基于MTP的菌株筛选更适合应用于初筛阶段,并通过优化筛选条件,联用高通量检测设备,增加生物学重复数量等方式优化筛选效果[23-24]。
2.3 影响终产物含量的主要因素探究
为探究微孔板筛选过程中的主要影响因素,即覆膜条件,装液量和菌株特异性对发酵终产物的影响,使用R对发酵产物进行聚类分析并绘制热图(图3)。由聚类树及色条分布情况可知,覆膜是影响聚类的最显著因素,其次为不同装液量,且二者较菌株特异性的影响更为明显。MF组在发酵结果上极显著区别于EF组和AF组,其发酵产物含有更低的残糖、乙醇和更高的甘油、乙酸,发酵的状况接近于有氧发酵。这表明使用MTP体系进行酿酒酵母筛选时,应慎重考虑覆膜对发酵结果的影响,以免遮盖菌株特异性而造成结果差异。装液量也会对发酵结果产生显著影响,且随着装液量的减少系统的不稳定性也随之增大[25]。为了确保结果的准确性,可视具体情况增加生物学重复[24]。不难发现,乙醇和甘油产量间呈现明显的负相关,这与二者同为酿酒酵母碳代谢产物,在通路上存在底物竞争有关。随着通氧量的加大,发酵结果的甘油产量显著提高,同时伴随着乙醇产量的下降,这与目前普遍的研究结果一致[26]。
由于发酵液中的有机酸也会随乙醇发酵的进行不断积累,逐渐对酿酒酵母细胞产生胁迫[27],影响其正常的生理活动,并最终影响终产物中乙醇和甘油的最大累积量。为更全面的探究覆膜、装液量对乙醇发酵终产物的影响,我们还检测了不同实验组的主要有机酸含量,如图3所示。终产物中柠檬酸,琥珀酸及乙酸含量与覆膜显著相关:与EF组相比,AF组发酵结果的有机酸含量与EF组差异较小,除乙酸外其他有机酸不存在显著差异;而MF组的柠檬酸,琥珀酸及乙酸含量均有所增加,而苹果酸产量略有下降。由于柠檬酸、苹果酸、琥珀酸均为三羧酸循环的中间产物,这样的结果差异或许是不同覆膜条件下糖酵解及三羧酸循环代谢、氧化还原平衡差异的直观体现。高氧化还原电位下有氧呼吸途径具有较强的活性,糖酵解及三羧酸循环途径活跃,从而产生较多的还原型辅酶。在有氧条件下,累积的还原型辅酶可以通过甘油途径及多种其他途径重新氧化,从而造成了甘油及多种有机酸的产量增加[28]。此外,发酵液溶氧水平的升高也提升了酿酒酵母的综合耐受能力,包括对有机酸毒性的耐受极限[27],客观上促进了终产物有机酸含量的增加[29]。这一结果反映出MTP发酵的覆膜选择对实验结果的决定性作用,若使用MTP体系取代锥形瓶作为菌株筛选的主要方式,则须针对二者不同的通氧特性进行覆膜优化,保证实验结果的准确性。
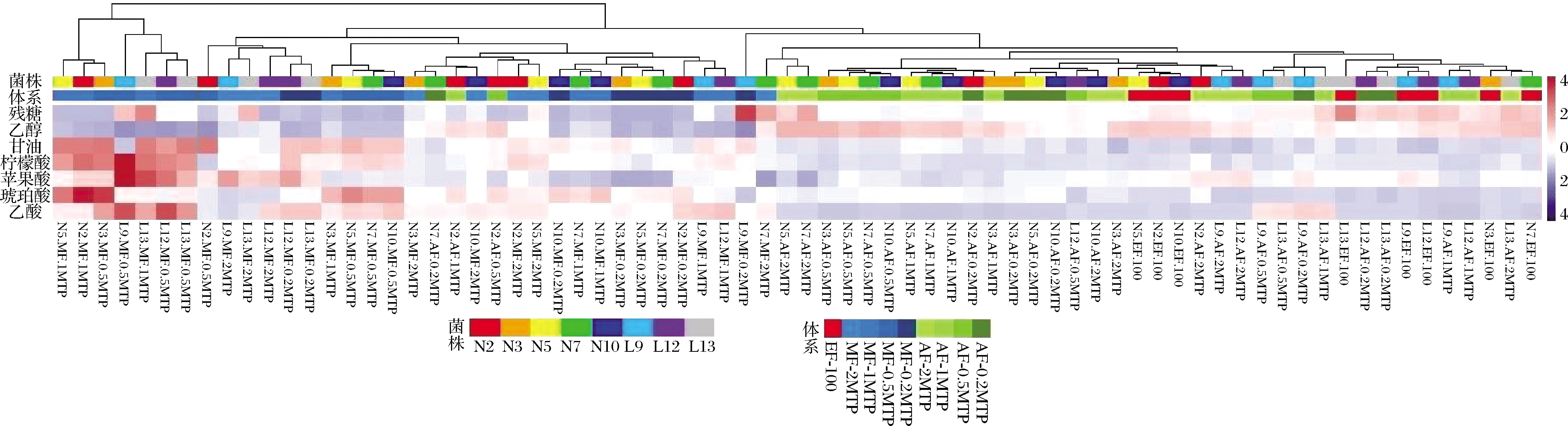
图3 终产物聚类分析
Fig.3 Clustering analysis of the main final products
为探寻菌株、覆膜、装液量之间可能存在相互作用,本研究还对三者进行了多因素方差分析(表1)。结果表明残糖、乙醇、苹果酸及琥珀酸受菌株差异性的显著影响;覆膜条件对除苹果酸外的关键物质影响显著;装液量对除残糖、苹果酸外的关键物质均有显著影响。此外菌株与覆膜在苹果酸产量存在显著交互作用,装液量与覆膜在乙醇、甘油、柠檬酸、琥珀酸产量存在显著交互作用,菌株与装液量间不存在交互作用。该分析结果与热图呈现出一致的趋势,即覆膜>装液量>菌株特异性。
表1 菌株、覆膜、装液量间多因素方差分析
Table 1 Analysis of the association between strains, coating membranes, and culture volumes via MANOVA
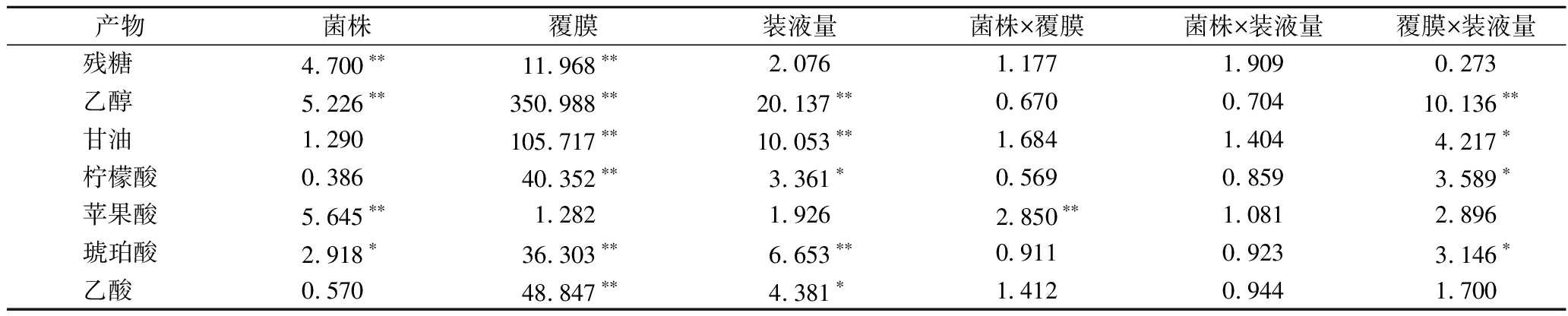
产物菌株覆膜装液量菌株×覆膜菌株×装液量覆膜×装液量残糖 4.700∗∗11.968∗∗2.0761.1771.9090.273乙醇 5.226∗∗350.988∗∗20.137∗∗0.6700.70410.136∗∗甘油 1.290105.717∗∗10.053∗∗1.6841.4044.217∗柠檬酸0.38640.352∗∗3.361∗0.5690.8593.589∗苹果酸5.645∗∗1.2821.9262.850∗∗1.0812.896琥珀酸2.918∗36.303∗∗6.653∗∗0.9110.9233.146∗乙酸 0.57048.847∗∗4.381∗1.4120.9441.700
注:*代表P<0.05;**代表P<0.01
3 结论与讨论
本研究对8株菌株9种发酵体系的发酵结果进行综合分析发现,乙醇发酵中不同发酵体系对主要物质产量具有极显著影响。主要影响因素排序为覆膜>装液量>菌株。覆膜对乙醇发酵的残糖、乙醇、甘油及部分有机酸产量均具有极显著影响,装液量对乙醇及甘油产量及部分有机酸具有显著影响,菌株对乙醇及苹果酸产量影响显著。同时覆膜及装液量间存在着一定的相关关系。以锥形瓶静置发酵结果为参照和各组MTP发酵结果进行了两两比较,结果表明24孔板、完全厌氧覆膜、2 mL装液量实验组(AF-2MTP)在各个维度上与锥形瓶静置实验组(EF)均不存在显著差异,且在应用于乙醇及甘油产量筛选时效果良好。
优化MTP发酵条件以代替传统的锥形瓶发酵为高效进行菌株筛选提供了新的思路,但其依然存在局限性。本实验中优化的方案可以较好满足酿酒酵母在乙醇和甘油产量筛选方面的需求,但若要更深入的筛选其他发酵产物如残糖、挥发酸、香气物质等,仍需进行针对性的调整。
[1] 刘宁. 本土酿酒酵母对葡萄酒质量的影响及优良菌株的筛选[D].杨凌:西北农林科技大学, 2015.
LIU N.Effect of indigenous Saccharomyces cerevisiae strains on wine quality and strain selection[D].Yangling:Northwest A & F University, 2015.
[2] 李华. 葡萄酒品尝学[M].北京:科学出版社, 2010.
LI H.Wine Tasting[M].Beijing:Science Press, 2010.
[3] FAN S Q, CHEN S P, TANG X Y, et al.Kinetic model of continuous ethanol fermentation in closed-circulating process with pervaporation membrane bioreactor by Saccharomyces cerevisiae[J].Bioresource Technology, 2015, 177:169-175.
[4] 袁林, 赵红玉, 李华, 等.公酿一号混酿葡萄酒降酸效果及多酚组分评价[J].食品与发酵工业, 2019, 45(23):66-72.
YUAN L, ZHAO H Y, LI H, et al.Evaluation of the effect on the deacidification and polyphenol component of Gongniang No.1 blend wine[J].Food and Fermentation Industries, 2019, 45(23):66-72.
[5] 孙杨, 聂简琪, 白仲虎, 等.高通量培养技术在生物过程研发中的应用进展[J].生物产业技术, 2015(1):24-31.
SUN Y, NIE J Q, BAI Z H, et al.Development of high-throughput culture technology in biological process research and application[J].Biotechnology and Business, 2015(1):24-31.
[6] 崔金明, 刘陈立.合成生物学中的高通量筛选与测量技术[J].中国细胞生物学学报, 2019, 41(11):2 084-2 090.
CUI J M, LIU C L.High-throughput screening and measurement techniques in synthetic biology[J].Chinese Journal of Cell Biology, 2019, 41(11):2 083-2 090.
[7] 郭玉蕾, 唐亮, 孙瑞强,等.高通量微型生物反应器的研究进展[J].中国生物工程杂志, 2018, 38(8):69-75.
GUO Y L, TANG L, SUN R Q, et al.High-throughput micro bioreactor development for biopharmaceuticals[J].China Biotechnology, 2018, 38(8):69-75.
[8] HUANG Y M, KWIATKOWSKI C.The role of high-throughput mini-bioreactors in process development and process optimization for mammalian cell culture[J].Pharmaceutical Bioprocessing, 2015, 3(6):397-410.
[9] LE PAGE G, GUNNARSSON L, SNAPE J,et al.Development and application of a microplate assay for toxicity testing on aquatic cyanobacteria[J].Environmental Toxicology and Chemistry,2020, 39(3):705-720.
[10] CORNEL A M, SZANTO C L, VAN TIL N, et al.A “no-touch” antibody-staining method of adherent cells for high-throughput flow cytometry in 384-well microplate format for cell-based drug library screening[J].Journal of Quantitative Cell Science,2020, 97(8):845-851.
[11] LICCIOLI T, TRAN T M T,COZZOLINO D, et al.Microvinification:How small can we go?[J].Applied Microbiology and Biotechnology, 2011, 89:1 621-1 628.
[12] 程艳, 堵国成, 周景文,等.高通量筛选诱变菌株降低黄酒发酵氨基甲酸乙酯前体积累[J].微生物学报, 2017, 57(10):1 517-1 526.
CHENG Y, DU G C, ZHOU J W, et al.High-throughput screening of mutant strain to reduce the accumulation of ethyl carbamate precursor in rice wine fermentation[J].Acta Microbiologica Sinica, 2017, 57(10):1 517-1 526.
[13] 谭俊. 基于多尺度创新原理的工业微生物高通量筛选平台构建及应用研究[D].上海:华东理工大学, 2013.
TAN J.Construction of high-throughput screening platform based on multi-scale study approach for high yield industry microorganism and its practical applications[D].Shanghai:East China University of Science and Technology, 2013.
[14] 李光, 唐小玲, 韦璇,等.Surfactin高产菌株的等离子体诱变及其高通量筛选[J].食品与发酵工业.2017, 43(2):67-72.
LI G, TANG X L, WEI X, et al.High-throughput screening of Bacillus subtilis mutants with high yield of surfactinby ARTP[J].Food and Fermentation Industries, 2017, 43(2):67-72.
[15] KENSY F, ZIMMERMANN H F, KNABBEN I, et al.Oxygen transfer phenomena in 48-well microtiter plates:Determination by optical monitoring of sulfite oxidation and verification by real-time measurement during microbial growth[J].Biotechnology and Bioengineering, 2005, 89(6):698-708.
[16] KWONG M M Y, LEE J W,SAMIAN M R, et al.Comparison of microplate-and bottle-based methods to age yeast for chronological life span assays[J].Journal of Microbiological Methods, 2019,167:105743.
[17] 刘延琳, 李华.mleA基因在酿酒酵母中的整合型表达[J].中国农业科学, 2009, 42(4):1 372-1 377.
LIU Y L, LI H.Integrated expression of mleA gene in Saccharomyces cerevisiae[J].Scientia Agricultura Sinica, 2009, 42(4):1 372-1 377.
[18] BELY M,SABLAYROLLES J M,BARRE P.Automatic detection of assimilable nitrogen deficiencies during alcoholic fermentation in oenological conditions[J].Journal of Fermentation and Bioengineering, 1990, 70(4):246-252.
[19] 王春晓, 江璐, 刘延琳.DNS法监控葡萄酒发酵进程的应用研究[J].中国酿造, 2012, 31(9):24-27.
WANG C X, JIANG L, LIU Y L.Application study on monitoring wine fermentation process by DNS method[J].China Brewing, 2012, 31(9):24-27.
[20] 杜青, 刘延琳, 贾鹤,等.基于生物量产率的低产乙醇酿酒酵母的筛选[J].中国食品学报, 2018, 18(4):30-36.
DU Q, LIU Y L, JIA H et al.Screening of low-ethanol Saccharomyces cerevisiae based on the biomass yield[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(4):30-36.
[21] WANG Y Q, YE D Q, LIU P T, et al.Synergistic effects of branched-chain amino acids and phenylalanine addition on major volatile compounds in wine during alcoholic fermentation[J].South African Journal of Enology and Viticulture, 2016, 37(2):169-175.
[22] 周剑, 江红, 林风.基于深孔板培养高通量筛选rakicidin B1高产菌的研究[J].中国抗生素杂志, 2019, 44(12):1 352-1 355.
ZHOU J, JIANG H, LIN F.Studies on high throughput screening for high rakicidin B1-producing strains with deep-well plates[J].Chinese Journal of Antibiotics, 2019, 44(12):1 352-1 355.
[23] 朱旭东. 基于微孔板技术及微流控技术的工业微生物高通量筛选平台构建及应用研究[D].上海:华东理工大学, 2017.
ZHU X D.Construction and application of high-throughput screening platforms for development of industrial microorganism based on microplate technology and microfluidic technology[D].Shanghai:East China University of Science and Technology, 2017.
[24] FLITSCH D,KRABBE S,LADNER T,et al.Respiration activity monitoring system for any individual well of a 48-well microtiter plate[J].Journal of Biological Engineering,2016, 10(1):14.
[25] WÖLCKE J,ULLMANN D.Miniaturized HTS technologies-UTS[J].Drug Discovery Services Screening Operations, 2001, 6(12):637-646.
[26] 蒋凯, 伍时华, 赵东玲, 等.通气量对酿酒酵母GGSF16高浓度乙醇发酵的影响[J].食品与发酵工业, 2015, 41(5):35-40.
JIANG K, WU S H, ZHAO D L,et al.Effect of aeration on very high gravity ethanol fermentation using Saccharomyces cerevisiae GGSF16[J].Food and Fermentation Industries, 2015, 41(5):35-40.
[27] 喻扬, 王永红, 储炬, 等.控制发酵过程氧化还原电位优化酿酒酵母乙醇生产[J].生物工程学报, 2007, 23(5):878-884.
YU Y, WANG Y H, CHU J, et al.The influence of controlling redox potential on ethanol production by Saccharomyces cerevisiae[J].Chinese Journal of Biotechnology, 2007,23(5):878-884.
[28] FORSTER J, FAMILI I, FU P, et al.Genome-scale reconstruction of the Saccharomyces cerevisiae metabolic network[J].Genome Research, 2003, 13(2):244-253.
[29] 郝学密, 杜斌, 刘黎阳, 等.ORP对酿酒酵母在木质纤维素水解液抑制物中发酵的影响[J].化工学报, 2015, 66(3):1 066-1 071.
HAO X M, DU B, LIU L Y, et al.Effect of ORP regulation on yeast fermentation with inhibitors of lignocellulose hydrolysate[J].CIESC Journal, 2015, 66(3):1 066-1 071.