保宁醋是四川麸醋的典型代表,作为我国四大名醋中唯一的药醋,中药制曲是其生产工艺中较为重要的一环[1]。保宁醋“中药醋曲”传承白酒大曲的制作工艺,以麸皮、玉米、小麦、大米及药食同源的中草药等为原料,通过自然固态发酵方式富集多种微生物,使菌群在醋曲中代谢产生食醋发酵需要的酶类及风味物质或风味前体物质。
大曲是食醋酿造过程中不可或缺的糖化发酵剂。传统食醋大曲的固态发酵过程可分为卧曲、上霉、晾霉、潮火、大火、后火、养曲等7个阶段,整个过程菌系、物系、酶系复杂多变[2],其中菌系几乎囊括了食醋酿造所需的全部微生物,如细菌、酵母菌、霉菌等[3-4]。微生物、理化以及生化特性是表征大曲品质的重要指标[5-6]。目前,对食醋大曲特性的研究主要针对其发酵过程中微生物菌系、关键理化指标以及风味物质等内容。王佳丽[7]采用Illumina Miseq高通量测序技术对山西老陈醋大曲发酵过程中的微生物群落多样性及其与基础理化指标、风味物质的关系进行了研究,发现芽孢杆菌属、乳杆菌属、泛菌属、假丝酵母属、曲霉属等为大曲优势菌,相关性分析表明,乳杆菌属、片球菌属、假丝酵母属、威克汉姆酵母属与水分、总酸、还原糖含量呈正相关,芽孢杆菌属、泛菌属、曲霉属与室温及曲心温度呈正相关,同时微生物群落对大曲制备过程中有机酸、挥发性风味物质的形成具有重要作用。NIE等[8]采用PCR-DGGE技术对天津独流醋大曲的微生物群落结构进行了探究,发现Bacillus, Streptomyces cacaoi, Streptomyces albus, Lactococcus garvieae, Weissella confuse为主要优势细菌,Aspergillus niger, Saccharomycopsis fibuligera, Pichia kudriavzevii为大曲优势真菌。GAN等[9]通过对岐山醋曲3个发酵阶段中细菌菌群与理化指标进行相关性分析,揭示了环境因子是各发酵阶段微生物差异性的影响因素,说明在大曲发酵过程中,菌群与环境因子、物料相互作用,共同制约大曲发酵过程中关键指标的演替。此外,ZHENG等[10]采用传统可培养与分子生物学的方法,探究了汾酒大曲中优势菌群的动态变化,表明不同种类的微生物群体在不同发酵阶段占主导地位,pH值、水分、酸度以及温度是影响微生物演替的重要环境因子。因此,监测大曲发酵过程中的指标,可为大曲质量的评价、规范大曲生产工艺提供理论依据。
为系统揭示保宁醋中药醋曲固态发酵过程中关键微生物数量与理化性质的动态变化,分析大曲中可培养微生物与环境因子间的互作关系,本试验以保宁醋中药醋曲为研究对象,对其发酵过程中微生物及理化性质的动态变化以及不同醅层间的差异进行分析,初步阐明大曲中理化指标对微生物数量的影响及对关键生化指标的影响,为保宁醋中药醋曲品质的评价及制曲工艺的改良提供基础数据。
1 材料与方法
1.1 材料与仪器
1.1.1 样品来源
保宁醋“中药醋曲”,采集自四川保宁醋有限公司制曲车间(四川 阆中)。
1.1.2 培养基及试剂
平板计数琼脂(g/L):胰蛋白胨5、酵母浸粉2.5、葡萄糖1、琼脂粉15。
LB固体培养基(g/L):胰蛋白胨10、酵母浸粉5、NaCl 10、琼脂粉20。
马铃薯葡萄糖琼脂(含氯霉素)(g/L):马铃薯浸出粉6、葡萄糖20、氯霉素0.1、琼脂粉20。
NaOH、邻苯二甲酸氢钾、酚酞、盐酸、KI、碘等试剂均为国产分析纯。
1.1.3 仪器与设备
1300 Series A2生物安全柜,美国Thermo Fisher Scientific公司;HWS24电热恒温水浴锅、DHG-9126电热恒温培养箱,上海一恒科技有限公司;TE412-L精密电子天平,北京赛多利斯仪器系统有限公司。
1.2 实验方法
1.2.1 样品的采集
采样时间:2019年1~2月。
五点采样法采集中药醋曲发酵第1、3、5、7、9、11、13、15、20、25、30、35、40、45、50 天的样品,每一发酵时间采集3份平行样品,并在无菌条件下将各大曲样品切分为曲表样品(距曲块边缘0~4 cm处)与曲心样品(除曲表样品剩余部分),分别粉碎后收集至无菌均质袋中,进行实验室分析。
1.2.2 理化指标分析
1.2.2.1 大曲温度的测定
温度的监测包括曲房温度和曲块醅温,曲房温度由曲房内的温湿表测定,醅温测定是将温度计插入曲块中心(10 cm左右)的方式进行测量。
1.2.2.2 pH值测定
参照 GB 5009.237—2016《食品安全国家标准 食品pH值的测定》[11]。准确称取大曲样品10 g于无菌均质袋中,精确至0.01 g,再加入100 mL超纯水,均质后浸泡30 min,再次混匀后用校准好的pH计直接测量。每份样品重复测定3次。
1.2.2.3 水分的测定
采用水分快速测定仪直接测定。每份样品重复测定3次。
1.2.2.4 淀粉与还原糖含量的测定
参照GB 5009.9—2016《食品安全国家标准 食品中淀粉的测定》[12]测定淀粉的含量。
参照GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》[13]测定还原糖的含量。每份样品重复测定3次。
1.2.3 微生物指标计数
1.2.3.1 菌落总数计数
无菌条件下称取25 g 样品,加入225 mL无菌生理盐水,充分均质混匀后,参照GB 4789.2—2016《食品微生物学检验 菌落总数测定》[14]方法,进行菌落总数的计数,每一稀释度做2个平行,同时吸取1 mL无菌生理盐水于无菌平皿内作空白对照。
1.2.3.2 霉菌及酵母菌计数
参照GB 4789.15—2016《食品微生物学检验 霉菌和酵母菌计数》[15]方法,于28 ℃下培养2~3 d,每隔12 h计数1次,并记录最终霉菌和酵母菌总数的计数结果。同时吸取1 mL无菌生理盐水于无菌平皿内作空白对照。
1.2.3.3 芽孢杆菌计数
在上述梯度稀释后的样液中,选择3个适宜稀释梯度的样品匀液,将其置于85 ℃水浴锅中保温30 min,冷却后取样液参照菌落总数计数方法,于37 ℃下培养2 d,计数,同时吸取1 mL无菌生理盐水于无菌平皿内作空白对照。
1.2.4 关键生化指标的测定
糖化力、液化力、酯化力的测定方法均参照QB/T 4257—2011《酿酒大曲通用分析方法》[16],每份样品重复测定3次。
1.3 数据处理及分析
通过GraphPad Prism 8软件进行数据简单处理及绘图,采用SPSS 25软件进行显著性分析,P<0.05表示差异显著,并计算Spearman相关性系数。
2 结果与分析
2.1 中药醋曲发酵过程中理化指标的动态分析
2.1.1 曲醅温度
由图1可知,在整个发酵过程中最高醅温55 ℃,因此判断保宁醋中药醋曲为中温型大曲[17]。根据温度变化情况,结合固态发酵过程的温度变化特点,将保宁醋中药醋曲的整个发酵过程划分为3个时期、7个阶段。3个时期分别为发酵前期(1~5 d),发酵中期(5~11 d),发酵后期(11~50 d);7个阶段时间为卧曲(0~1 d)、上霉(1~3 d)、晾霉(3~5 d)、潮火(5~9 d)、大火(9~13 d)、后火(13~25 d)和养曲(25~50 d)。
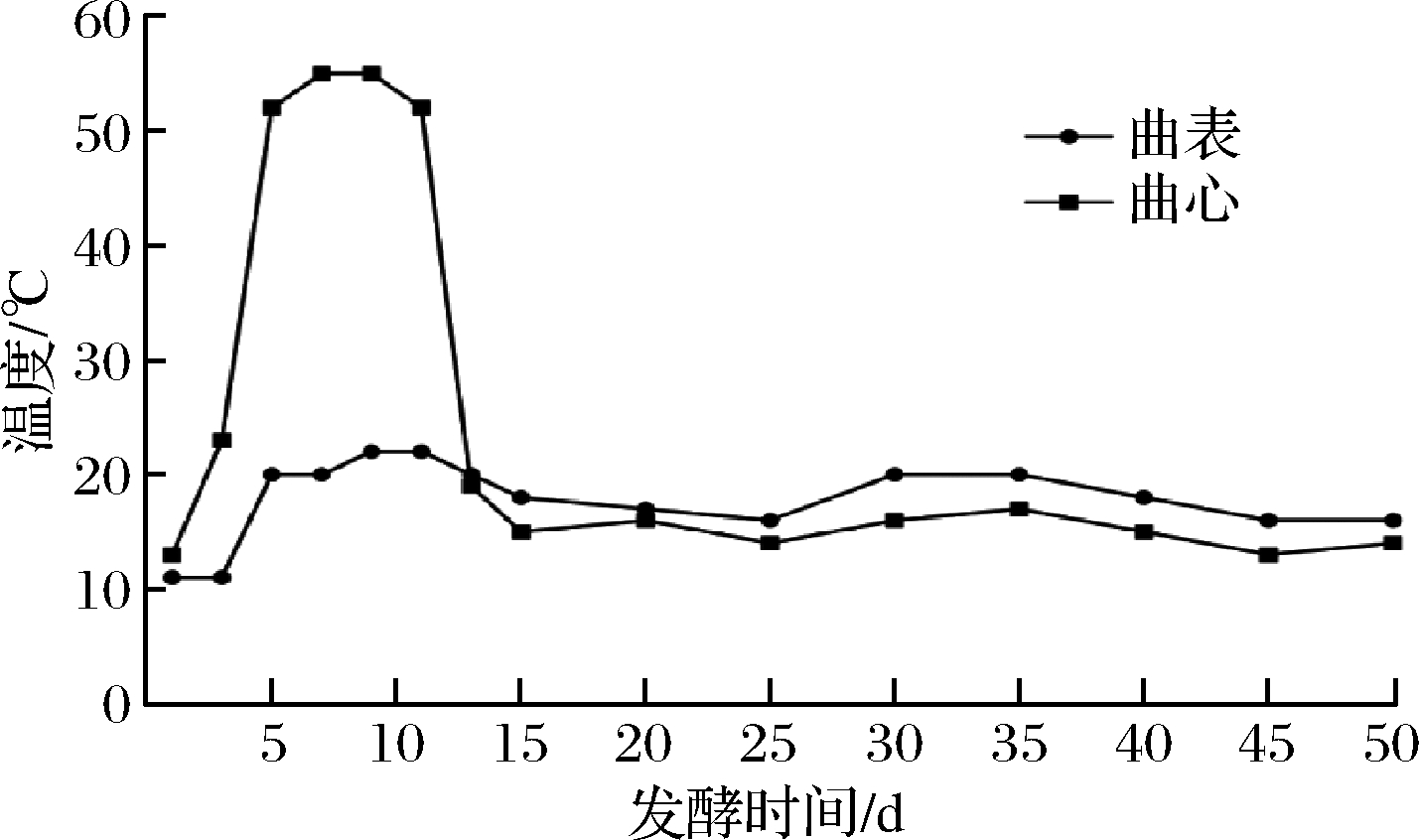
图1 中药醋曲不同醅层发酵过程中温度的动态变化
Fig.1 The dynamic changes of temperature of different layers in the fermentation process of herb Daqu starter
2.1.2 曲醅基础理化指标的动态变化
中药醋曲发酵过程中pH值的测定结果如图2-a所示,在发酵前期,曲表和曲心的pH值均呈下降趋势,均于第7天达到最低值,最低值分别为5.15和4.60,推测可能是由于部分产酸菌的繁殖,pH值在发酵中期出现回升并一直持续到发酵后期均在7.00附近波动,在发酵结束时(第50 天),曲表和曲心的pH值分别为7.00和7.47;中药醋曲在发酵中、后期pH值在中性附近波动变化,是醋曲微生物菌群演替的作用结果,同时也避免了中药醋曲的酸化,对成品曲的品质具有一定的积极作用。对不同醅层的pH值对比分析,除第1 天外,其余发酵时间的pH值均呈显著性差异(P<0.05)。
中药醋曲发酵过程中水分含量的动态变化如图2-b所示。在整个发酵过程中,水分含量呈整体下降的趋势,且由于发酵前期、中期醅温上升较快,导致水分下降速度较快,发酵后期水分含量随温度的降低而维持在较低水平。曲表和曲心样品均于第35 天达到最低值,分别为13.03%和16.50%。在达到最低值后,水分含量有些许回升,可能是因为样品之间的差异性或醋曲样品水分低于环境湿度,导致样品吸湿。在发酵结束时(第50 天),曲表和曲心的水分含量分别为13.46%和16.78%,对比分析不同醅层样品的水分含量可知,除第1天与第3天外,其余发酵时间曲表样品的水分含量显著高于曲心(P<0.05)。
中药醋曲发酵过程中淀粉含量的监测结果如图2-c所示,在整个发酵过程中淀粉含量均在70 g/100g左右波动,可能在这个过程中微生物代谢产生淀粉酶对淀粉的降解作用与其代谢产生的纤维素酶降解原料中的纤维素,释放被纤维细胞结构中包裹的淀粉颗粒的作用处于动态的平衡之中[18-19]。在发酵结束时(第50 天),曲表和曲心淀粉含量分别为61.80和68.48 g/100g,整个发酵过程的高淀粉含量也佐证了大曲的投粮作用[20]。对不同醅层样品淀粉含量的差异性进行分析可知,除第3、30 天外,样品差异不显著。
保宁醋中药醋曲发酵过程中还原糖含量的动态变化如图2-d所示,在发酵前期,还原糖含量呈波动变化,但整体呈下降趋势。一方面微生物在发酵前期利用还原糖大量生长繁殖,另一方面微生物产生淀粉酶将淀粉转化为还原糖[20]。在发酵中、后期还原糖含量有所回升后呈下降的波动趋势,可能是由于微生物代谢分解原料中的淀粉、纤维素与利用还原糖处于动态变化中。在发酵结束时(第50 天),曲表和曲心的还原糖含量分别为3.34和1.78 g/100g。对比不同醅层样品的还原糖含量可知,除第9、11、13、25、30天外,曲心的还原糖含量均显著低于曲表样品(P<0.05)。
2.2 大曲发酵过程中的关键微生物类群数量分析
大曲中微生物种类丰富,是食醋发酵中功能菌种的来源之一。对大曲发酵过程中菌落总数的计数结果如图3-a所示,在整个发酵过程中,由于环境及原料中的微生物富集,且发酵前期曲块温度、水分等条件适宜,微生物得以利用原料中的营养物质迅速生长繁殖,曲表和曲心分别于第7、9 天达到峰值(菌落总数lg值分别为9.9和9.0 CFU/g);达峰值之后,大曲经潮火和大火阶段,温度达到55 ℃,许多微生物在该温度下生长会受到抑制甚至死亡,菌落总数降低,并在此后呈波动变化;在发酵后期,因某些耐低水分含量的微生物的生长繁殖导致菌落总数呈现稍稍回升的趋势,但此后可能由于水分含量再次降低,低水分的环境胁迫致使微生物含量再次下降,在发酵结束时(第50 天),曲表和曲心菌落总数的lg值分别为9.3和7.0 CFU/g,相对较高的微生物量佐证了中药醋曲具有为食醋发酵提供菌源的作用。对不同醅层的菌落总数进行对比分析,相较于曲表而言,曲心菌落总数到达峰值时间略微延迟,推测可能是曲表的环境条件(如氧气浓度、温度、水分含量等)更适宜微生物的生长,微生物生长繁殖较快所致。除第1、3、9 天外,在其余发酵时间曲表菌落总数均显著高于曲心,这可能是由于曲心是一个相对厌氧的环境且曲心的温度高于曲表,不利于曲块中部分微生物的生长[21]。
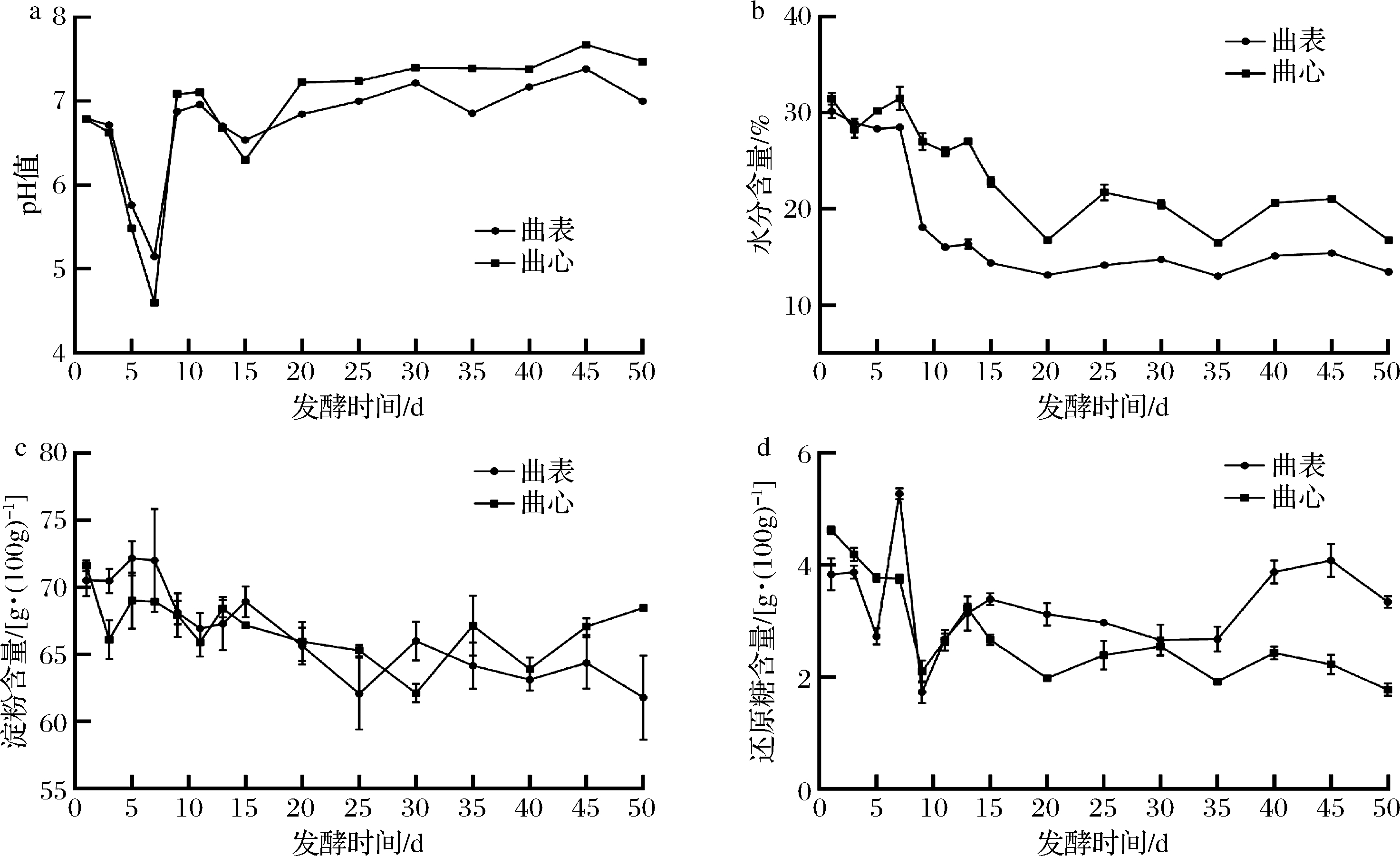
a-pH值;b-水分含量;c-淀粉含量;d-还原糖含量
图2 中药醋曲不同醅层在发酵过程中基础理化指标的动态变化
Fig.2 The dynamic changes of basic physicochemical indexes of different layers in the fermentation process of herb Daqu starter
中药醋曲发酵过程中霉菌及酵母菌的计数结果与菌落总数的结果类似,如图3-b所示。在整个发酵过程中,发酵前期微生物利用原料中的营养物质迅速生长繁殖,曲表和曲心分别于第7、9 天达到峰值(菌落总数lg值分别为8.4和8.0 CFU/g);随着温度的升高及水分含量的降低,霉菌及酵母菌在高温环境下生长受到抑制甚至死亡,数量明显降低;在发酵后期,霉菌及酵母菌数量呈波动变化。在发酵结束时(第50天),曲表和曲心菌落总数的lg值分别为7.2和6.6 CFU/g,说明大曲微生态环境中的霉菌和酵母菌不断被低水分含量这一环境因子进行驯化。对不同醅层的霉菌及酵母菌进行对比分析可知,曲表菌落总数到达峰值时间比曲心晚。除第1、3、9 天外,在其余发酵时间曲表霉菌及酵母菌数量均明显高于曲心,这可能是因为曲心是一个相对厌氧的环境且曲心的温度高于曲表,不利于曲块中霉菌及酵母菌的生长[21]。
由芽孢杆菌的计数结果(图3-c)可知,发酵前期芽孢杆菌在波动变化中呈上升趋势,曲表和曲心分别于第7、20天达到峰值(菌落总数lg值分别为7.3和7.2 CFU/g)。达峰值后经潮火和大火阶段,温度达到55 ℃,部分芽孢杆菌在该温度下生长会受到抑制甚至其未形成芽孢的细胞出现死亡现象,导致芽孢杆菌数量明显降低,并在此后呈波动变化。在发酵后期,芽孢杆菌数量出现回升的趋势,但此后可能由于水分含量降低,该环境胁迫因子致使微生物含量再次下降,在发酵结束时(第50天),曲表和曲心菌落总数的lg值分别为8.3和7.0 CFU/g,芽孢杆菌数量相对较高,能为后续食醋发酵提供菌源。对不同醅层的芽孢杆菌进行对比分析可知,曲心芽孢杆菌数到达峰值时间晚于曲表,这可能是曲表的环境条件(如氧气浓度、温度、水分含量等)更适宜芽孢杆菌的生长,芽孢杆菌生长繁殖较快所致。同时,由于曲心温度较高且相对厌氧,因此除第20、35 天外,其余发酵时间曲表芽孢杆菌数量均高于曲心[21]。
2.3 中药醋曲发酵过程中关键生化指标的动态分析
对中药醋曲发酵过程中糖化力的监测结果如图4-a所示,在发酵前期,曲表的糖化力整体呈上升趋势,并在第7 天达到峰值[1 245 mg/(g·h)]。达到峰值后,由于温度升高导致部分糖化菌数量减少,糖化力降低;在发酵后期,糖化力回升后呈现平稳变化,在发酵的最后阶段,可能因为水分含量的降低引起微生物代谢产糖化酶活力降低,糖化力进一步下降,在发酵结束时(第50 天),糖化力值为1 017 mg/ (g·h)。曲心样品的糖化力整体呈下降趋势,在发酵开始时(第1 天)糖化力为1 432.38 mg/(g·h),可能是由于原料的内源性酶带入所致;在发酵中期,经潮火和大火之后,糖化力显著降低;在发酵后期,糖化力处于平缓的变化趋势,在第35 天稍有回升,可能是因为部分抗逆性强的微生物适应环境条件后生长代谢所致,之后可能由于水分含量的降低引起微生物死亡,从而导致糖化力再次下降,在发酵第50天,糖化力大小降为107.11 mg/(g·h)。对比分析不同醅层样品的糖化力水平,除第1、3、5 天外,曲心的糖化力均显著低于曲表(P<0.05)。

a-菌落总数;b-霉菌与酵母菌总数;c-芽孢杆菌数
图3 中药醋曲不同醅层在发酵过程中关键微生物数量的动态变化
Fig.3 The dynamic changes of microbial quantity of different layers in the fermentation process of herb Daqu starter
保宁醋中药醋曲发酵过程中液化力的测定结果如图4-b所示,发酵前期,曲表和曲心的液化力均处于极低的水平;第7 天之后,曲表和曲心的液化力急剧上升,并在发酵中、后期呈波动变化,但整体呈上升趋势,可能是因为在中后期产淀粉酶的霉菌和芽孢杆菌处于一个较高的数量级或是产淀粉酶活力较高;在发酵末期,液化力下降,可能由于水分含量的降低,导致微生物数量级降低,以致液化力降低。在发酵结束时(第50 天),曲表和曲心的液化力分别为1.26和0.40 g/(g·h)。对比分析不同醅层样品的液化力可知,除第1、3、5 天外,曲心的液化力均显著低于曲表(P<0.05)。
保宁醋中药醋曲发酵过程中酯化力的动态变化如图4-c所示,在发酵前期,曲表和曲心的酯化力处于较低的水平,随后显著升高(P<0.05),冬季曲表和曲心均于第13天达到最大值,分别为1 442.49 和1 709.12 mg/(50g·7d);在发酵中期,因经历潮火和大火阶段,温度较高导致微生物数量级降低从而导致酯化力下降;在发酵后期由于微生物处于消长变化的动态过程之中,酯化力也在该过程中不断变化,在发酵结束时(第50天),曲表和曲心的酯化力分别为1 273.09和1 152.85 mg/(50g·7d)。对比分析曲表与曲心样品的酯化力可知,除1、5、9、13 d外,曲心的酯化力均显著低于曲表(P<0.05)。
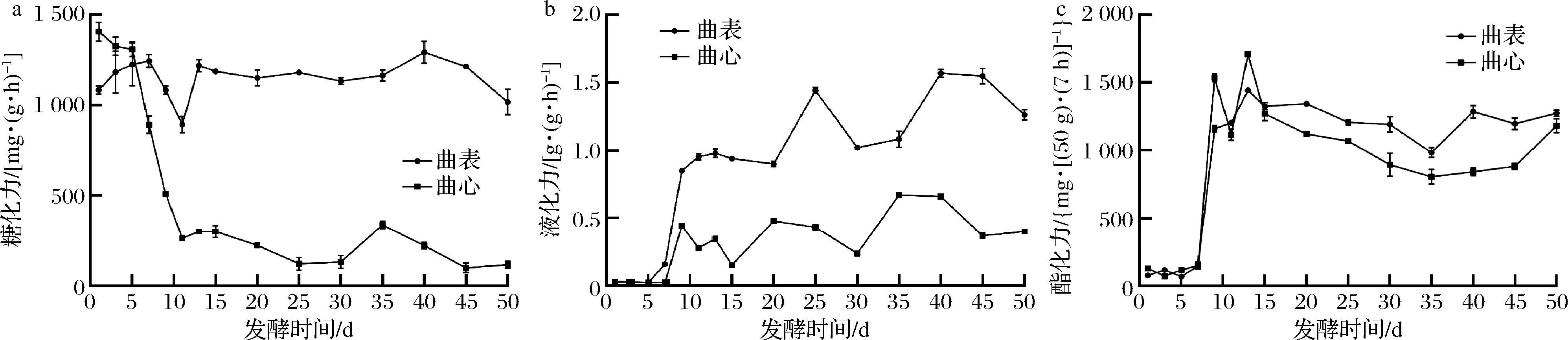
a-糖化力;b-液化力;c-酯化力
图4 中药醋曲不同醅层在发酵过程中关键生化指标的动态变化
Fig.4 The dynamic changes of key biochemical properties of different layers in the fermentation process of herb Daqu starter
2.4 保宁醋中药醋曲微生物数量和理化指标变化的相关性分析
对中药醋曲微生物数量与理化指标基于Spearman相关性系数的分析可知(图5),温度是影响菌落总数和霉菌及酵母菌总数的重要环境因子,而影响芽孢杆菌数变化的因子主要为水分含量,此外,菌落总数、霉菌与酵母菌总数与糖化力水平强相关,芽孢杆菌数量则与液化力水平强相关。中药醋曲固态发酵过程中,微生物菌群与各项理化指标相互关联。环境因子的变化及差异会影响微生物类群数量的变化及差异,从而对其他理化指标以及酶活性产生影响。

图5 醋曲中微生物数量与理化指标的相关性热图
Fig.5 Correlation heatmap of the microbial quantity and physicochemical properties of herb Daqu starter
3 讨论
目前食醋大曲仍沿用开放式发酵的传统生产模式,其品质易受环境影响,加之对大曲发酵过程中理化指标、微生物与酶系的动态变化研究甚少,从而导致在生产工艺优化及品质评价方面缺乏基础数据。本试验分析了中药醋曲整个发酵过程不同醅层关键微生物类群数量以及理化性质的动态变化及差异,并初步探究导致变化及差异的原因。微生物平板计数表明,曲表高于曲心,这一结果与LI等[18]的研究结果一致,霉菌和酵母菌总数低于岐山醋大曲;保宁醋中药醋曲为中温型大曲,其温度变化符合固态发酵过程的特点[17];在整个发酵过程中醋曲理化指标呈波动变化,在发酵结束时,水分含量与糖化力均高于岐山醋大曲[18, 22]。不同醅层间的微生物与理化指标有明显差异。温度和水分含量是影响中药醋曲微生物数量呈动态变化的主导环境因子。发酵前期,温度与pH值较为适宜,微生物数量呈逐渐上升的趋势;发酵中期,由于醅温的升高以及水分含量的降低,微生物数量整体下降,但部分芽孢杆菌继续生长,产生相关酶类,其中糖化酶因不耐高温,活力逐渐降低;在发酵后期,由于环境因子处于动态稳定,微生物数量变化趋于平稳。不同醅层之间的温度、水分含量以及溶氧量的差异导致了微生物数量的变化,从而导致生化指标的差异,说明了大曲固态发酵过程是其向具有耐热、抗低水分等特性的微生物群落演变的过程[23]。
食醋大曲发酵体系中的微生物菌群复杂、存在不可培养类群,因此,采用传统微生物培养的手段对其发酵过程中的微生物进行动态解析具有一定的局限性,且本研究尚未对部分特定的功能微生物进行计数分析。今后的研究可在现有研究的基础上结合高通量测序技术和特定微生物的传统培养技术进行微生物菌群解析,同时对发酵过程中大曲的风味物质演替进行监测与分析,更为全面地诠释在食醋大曲固态发酵过程中微生物群落动态变化的原因及其可能产生的影响,为食醋大曲的品质改良提供基础数据。
[1] 刘阳, 邓静, 姜元华, 等.保宁醋醋曲中产多糖乳酸菌的筛选及其代谢产物分析[J].现代食品科技, 2018, 34(3):184-190.
LIU Y, DENG J, JIANG Y H, et al.Screening of polysaccharide-producing lactic acid bacteria in Baoning vinegar koji and analysis of its metabolites[J].Modern Food Science and Technology, 2018, 34(3):184-190.
[2] ZHENG X W, HAN B Z.Baijiu, Chinese liquor:History, classification and manufacture[J].Journal of Ethnic Foods, 2016, 3(1):19-25.
[3] ZHENG X W, YAN Z, ROBERT NOUT M J, et al.Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J].World Journal of Microbiology and Biotechnology, 2015, 31(1):199-208.
[4] ZHANG Q, HUO N R, WANG Y H, et al.Aroma-enhancing role of Pichia manshurica isolated from Daqu in the brewing of Shanxi Aged Vinegar[J].International Journal of Food Properties, 2017, 20(9):2 169-2 179.
[5] 涂荣坤, 钱志伟, 秦辉, 等.大曲检测指标研究进展[J].酿酒科技, 2016(1):110-115.
TU R K, QIAN Z W, QIN H, et al.Research progress in Daqu detection indexes[J].Liquor-Making Science & Technology, 2016(1):110-115.
[6] FAN G S, SUN B G, FU Z L, et al.Analysis of physicochemical indices, volatile flavor components, and microbial community of a light-flavor Daqu[J].Journal of the American Society of Brewing Chemists, 2018, 76(3):209-218.
[7] 王佳丽. 山西老陈醋大曲制备过程中微生物群落动态变化及优良霉菌的筛选[D].太原:山西农业大学,2019.
WANG J L.Dynamic changes of microbial communities and screening of dominant mold during the preparation of Daqu of Shanxi aged vinegar[D].Taiyuan:Shanxi Agricultural University, 2019.
[8] NIE Z Q, ZHENG Y, WANG M, et al.Exploring microbial succession and diversity during solid-state fermentation of Tianjin Duliu mature vinegar[J].Bioresource Technology, 2013, 148:325-333.
[9] GAN X, TANG H L, YE D D, et al.Diversity and dynamics stability of bacterial community in traditional solid-state fermentation of Qishan vinegar[J].Annals of Microbiology, 2017, 67(10):703-713.
[10] ZHENG X W, YAN Z, ROBERT NOUT M J, et al.Microbiota dynamics related to environmental conditions during the fermentative production of Fen-Daqu, a Chinese industrial fermentation starter[J].International Journal of Food Microbiology, 2014, 182-183:57-62.
[11] 中华人民共和国国家卫生和计划生育委员会. GB 5009.237—2016 食品pH值的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China.GB 5009.237—2016 Determination of the pH value of foods[S].Beijing:Standards Press of China, 2016.
[12] 中华人民共和国国家卫生和计划生育委员会. GB 5009.9—2016 食品中淀粉的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China.GB 5009.9—2016 Determination of starch in foods[S].Beijing:Standards press of China, 2016.
[13] 中华人民共和国国家卫生和计划生育委员会. GB 5009.7—2016 食品中还原糖的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China.GB 5009.7—2016 Determination of reducing sugars in foods[S].Beijing:Standards Press of China, 2016.
[14] 中华人民共和国国家卫生和计划生育委员会. GB 4789.2—2016 食品微生物学检验, 菌落总数测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China.GB 4789.2—2016 Food microbiology analysis, determination of aerobic plate count[S].Beijing:Standards Press of China, 2016.
[15] 中华人民共和国国家卫生和计划生育委员会. GB 4789.15—2016 食品微生物学检验, 霉菌和酵母菌计数[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China.GB 4789.15—2016 Food microbiology analysis, determination of moulds and yeasts count[S].Beijing:Standards Press of China, 2016.
[16] 中华人民共和国工业和信息化部. QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国轻工业出版社, 2011.
Ministry of Industry and Information of the People′s Republic of China.QB/T 4257—2011 General analytical method for brewing Daqu[S].Beijing:Light industry press of China, 2011.
[17] LIU J J, CHEN J Y, FAN Y, et al.Biochemical characterization and dominance of different hydrolases in different types of Daqu-a Chinese industrial fermentation starter[J].Journal of the Science of Food and Agriculture, 2018, 98(1):113-121.
[18] LI P, LIANG H B, LIN W T, et al.Microbiota dynamics associated with environmental conditions and potential roles of cellulolytic communities in traditional Chinese cereal starter solid-state fermentation[J].Applied & Environmental Microbiology, 2015, 81(15):5 144-5 156.
[19] DIVYANAIR M P, PADMAJA G, MOORTHY S N.Biodegradation of cassava starch factory residue using a combination of cellulases, xylanases and hemicellulases [J].Biomass and Bioenergy, 2011, 35(3):1 211-1 218.
[20] 李中正. 山河陈醋大曲糖化力强化技术研究[D].太原:山西农业大学, 2018.
LI Z Z.Research on strengthening technology of diastatic power in Daqu of Shanhe mature vinegar[D].Taiyuan:Shanxi Agricultural University, 2018.
[21] 胡晓龙, 王康丽, 牛广杰, 等.基于高通量测序技术的中温大曲中微生物群落多样性解析[J].轻工学报, 2019, 34(4):21-29.
HU X L, WANG K L, NIU G J, et al.Analysis of microbial community diversity in medium temperature Daqu based on high-throughput sequencing technology[J].Journal of Light Industry, 2019, 34(4):21-29.
[22] TANG H L, LIANG H B, SONG J K, et al.Comparison of microbial community and metabolites in spontaneous fermentation of two types Daqu starter for traditional Chinese vinegar production[J].Journal of Bioscience and Bioengineering, 2019, 128(3):307-315.
[23] 黎攀. 环境因子胁迫下传统岐山醋大曲固态发酵过程中微生物群落演变规律的研究[D].广州:华南理工大学, 2017.
LI P.Effect of environmental factors on microbiota dynamics during traditional solid-state fermentation of Daqu starter for Chinese Qishan vinegar[D].Guangzhou:South China University of Technology, 2017.