肌原纤维蛋白(myofibrillar protein,MP)是一类肌肉中重要的盐溶性蛋白,占猪肉总蛋白的50%~55%,其主要成分包括肌球蛋白、肌动蛋白、原肌球蛋白和肌动球蛋白等[1]。MP的结构和功能性质与肉制品的加工特性密切相关,能够影响肉制品的最终品质[2]。使用包括物理、化学、酶等技术对MP进行修饰[3],可以有效地改变MP的功能性质进而满足食品工业的相应需求。然而,这些修饰方法尚存在不足,包括修饰程度有限、食品安全性低以及成本较高[4]。蛋白质糖基化反应(美拉德反应),是指通过还原糖的羰基与蛋白质游离赖氨酸的ε-氨基共价连接而形成糖蛋白[5],是一种绿色的蛋白质修饰方法。有研究表明,糖基化修饰可以提高蛋白质的乳化性、溶解性、热稳定性的功能特性[3, 6-7]。一些蛋白质如蛋清蛋白[8]、鲢鱼肌球蛋白[9]、黑米谷蛋白[10]、大豆分离蛋白[11]通过糖基化反应修饰能够显著改善其功能性质[12]。此外,美拉德反应能够有效改善蛋白质抗氧化性[13-14],其主要原因在于美拉德反应过程中产生类黑精等高级糖基化终末产物(advanced glycation end products,AGEs)。有研究发现,鸡肉MP与不同还原糖(葡萄糖和麦芽糖)的美拉德反应产物,具有超氧阴离子自由基清除活性[13]。核糖作为一种五碳醛糖具有极强的还原性,可以作为糖基化反应的良好羰基供体。因此,利用核糖对MP进行糖基化修饰,有望获得具有良好功能特性和抗氧化活性的产物。然而,核糖糖基化修饰对猪肉MP的功能特性和抗氧化活性有何影响,仍然需要深入研究,例如糖基化修饰时间对这些性质影响尚未见相关的研究报道。本研究从提高MP的功能特性和抗氧化活性角度出发,采用核糖对猪肉MP进行糖基化改性修饰,探究不同反应时间对糖基化产物的功能特性和抗氧化活性的影响,从而为有效改善MP功能特性和抗氧化性提供理论依据。
1 材料与方法
1.1 材料与试剂
猪里脊肉、金龙鱼食用大豆油,重庆市北碚区永辉超市;食品级D-核糖(纯度98%),深圳一诺食品配料有限公司。
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、DPPH、邻二氮菲、邻苯三酚,上海阿拉丁生化科技股份有限公司;本研究所用其他试剂均为分析纯。
1.2 仪器与设备
XHF-DY高速匀浆机,宁波新芝生物科技股份有限公司;85-2型磁力搅拌器,郑州长城科工贸有限公司;Synergy多功能酶标仪,美国伯腾仪器有限公司;电热恒温水浴锅,上海齐欣科学仪器有限公司;UV-6100紫外分光光度计,上海元析仪器有限公司。
1.3 实验方法
1.3.1 MP的提取以及糖基化产物的制备
MP提取参照文献方法[15]在4 ℃进行。取100 g 猪里脊肉糜,加入4倍体积10 mmol/L的磷酸盐缓冲液(含0.1 mmol/L NaCl, 2 mmol/L MgCl2, pH 7.0),匀浆后浸提30 min,在4 ℃、8 000 r/min条件下离心15 min,弃上清液;沉淀用4倍体积磷酸盐缓冲液溶解、离心;重复操作3次,获得MP。采用双缩脲法测定MP含量,以牛血清白蛋白为标准蛋白。
MP溶解于0.1 mol/L、pH 7.0的磷酸盐缓冲溶液,质量浓度为10 mg/mL。核糖溶解于0.1 mol/L、pH 7.0的磷酸盐缓冲溶液,浓度为10 mg/mL。MP溶液100 mL与核糖溶液100 mL混合,并在85 ℃下反应0、1、3、6、24 h,反应后的样品置于冰浴中,冷却后进行分析。
1.3.2 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析
采用Laemmli方法对糖基化产物进行电泳分析。5 mg/mL的样品溶液与4倍上样缓冲液混合,沸水浴加热2 min;取10 μL样品加入泳道,在80 V恒压条件下进行电泳2 h。浓缩胶质量分数为5%,分离胶质量分数为12%。电泳结束后,用考马斯亮蓝R-250染色,漂洗、脱色后拍摄电泳图像。
1.3.3 褐变指数和高级糖基化终末产物测定
不同反应时间下的糖基化样品溶解于10%质量分数(下同) SDS溶液中,蛋白质终质量浓度为5 mg/mL。由于褐变产物在420 nm处具有最大的吸光值,通过紫外分光光度计测定420 nm下的吸光值,进而测定糖基化样品的褐变指数[16]。
采用文献方法分析AGEs[17]。样品用8 mol/L尿素稀释50倍,向1 mL样品中加入10 μL的1 mol/L二硫苏糖醇,旋涡混匀,荧光分光光度计检测,激发波长为350 nm,发射波长为450 nm,在500 nm 处读取荧光强度。分析结果以荧光单位表示。
1.3.4 溶解性测定
参照NISHIMURA等[13]的方法,并稍作修改。称取一定量的肌原纤维蛋白,溶解于Tris-HCl 缓冲溶液(40 mmol/L,pH 7.5,0.05 mol/L的NaCl)中,其终质量浓度为1.5 mg/mL。离心(10 000×g,4 ℃,15 min)后,通过双缩脲法测定蛋白质浓度。糖基化肌原纤维蛋白的溶解性通过计算上清液蛋白质含量与样品中的蛋白质含量的比值来表示。
1.3.5 乳化活性和乳化稳定性测定
乳化活性和乳化稳定性的测定采用AGYARE等[18]的方法。采用0.1 mol/L的磷酸盐缓冲溶液(pH 7.0)稀释待测样品(蛋白质质量浓度1 mg/mL);然后蛋白溶液与精炼大豆油混合(体积比,3∶1),10 000 r/min条件下均质1 min;在0 min和静止10 min,分别从样品底部取出50 μL乳液于试管中,随后加入0.1%的SDS溶液5 mL,混合均匀后,利用紫外分光光度计测定其500 nm波长处的吸光度(A0)。以0.1% SDS溶液作为空白,重复3次。乳浊液的乳化活性指数(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI)分别按公式(1)和公式(2)计算:
(1)
(2)
式中:A0,0 min时的吸光度;ρ,乳化前蛋白样品的质量浓度(g/mL);φ,溶液中油的体积分数,0.25;ESI,乳化稳定性;A10,乳液静置10 min后的吸光度;N,稀释倍数。
1.3.6 抗氧化活性分析
1.3.6.1 DPPH自由基清除活性的测定
配制浓度为20 μmol/L 的DPPH乙醇溶液,存于暗处待用。取1 mL DPPH乙醇溶液与2 mL样品溶液(5 mg/mL,溶于0.1 mol/L、pH 7.0的磷酸盐缓冲溶液)混合,迅速置于暗处,室温反应30 min,以无水乙醇作为空白对照,在517 nm处测定吸光值[19]。DPPH自由基清除活性的计算如公式(3)所示:
DPPH自由基清除活性![]()
(3)
式中:ΔA空白,空白溶液吸光度;ΔA样品,样品溶液的吸光值。
1.3.6.2 羟自由基清除活性的测定
2 mL、0.75 mmol/L 的邻二氮菲(溶于0.15 mol/L,pH 7.4磷酸盐缓冲液)与2 mL、0.75 mmol/L 的FeSO4(溶于0.15 mol/L,pH 7.4磷酸盐缓冲液)充分混合,随后加入1 mL样品(5 mg/mL,溶于0.1 mol/L、pH 7.0的磷酸盐缓冲溶液)和1 mL、0.01%(体积分数)的H2O2。混合物在37 ℃保温60 min,在536 nm下测定吸收率[19]。计算如公式(4)所示:
羟自由基清除活性![]()
(4)
式中:AS,样品的吸光值;A1,邻二氮菲、FeSO4和H2O2的对照溶液的吸光值;A0,邻二氮菲和FeSO4的空白溶液的吸光值。
1.3.6.3 超氧阴离子自由基清除活性的测定
1.0 mL样品(5 mg/mL,溶于0.1 mol/L、pH 7.0的磷酸盐缓冲溶液)与1.8 mL、50 mmol/L Tris-HCl(pH 8.2)缓冲液混合。25 ℃下孵育10 min,加入0.1 mL、10 mmol/L的邻苯三酚。在320 nm处测定吸光值,每隔0.5 min记录吸光值,总观测时间为4 min。样品的邻苯三酚氧化速率由吸收率曲线的斜率(A1)计算[19]。空白邻苯三酚自氧化速率通过1.0 mL 双蒸水代替样品(ΔA0)来测定。计算如公式(5)所示:
超氧阴离子自由基清除活性![]()
(5)
1.3.7 数据处理
每个试验重复3次,结果表示为平均值±标准差。采用SPSS 22.0对实验数据进行单因素方差分析和Pearson相关性分析,并用Duncan法进行事后多重比较。
2 结果与分析
2.1 反应时间对糖基化反应程度的影响
褐变强度可以反映出美拉德反应的进行程度。美拉德反应终末阶段所产生的类黑精等褐色物质,可以通过测定420 nm处的吸光值来表示。在本研究中,MP糖基化产物的褐变强度随反应时间的变化情况如图1所示。在反应1 h时,褐变强度仅为0.098,表明美拉德反应仍处于初始阶段。在3、6、24 h之后,MP糖基化产物的褐变强度显著提高(P<0.05),其褐变强度分别为0.295、0.708和1.977,所以随着美拉德反应的进行,MP糖基化产物的褐变强度逐渐增强,反应时间为24 h时达到最高值。该结果与之前研究工作的报道结果一致,即MP通过美拉德反应进行糖基化修饰时,美拉德反应的高级产物的生成量不断增加[20-21]。
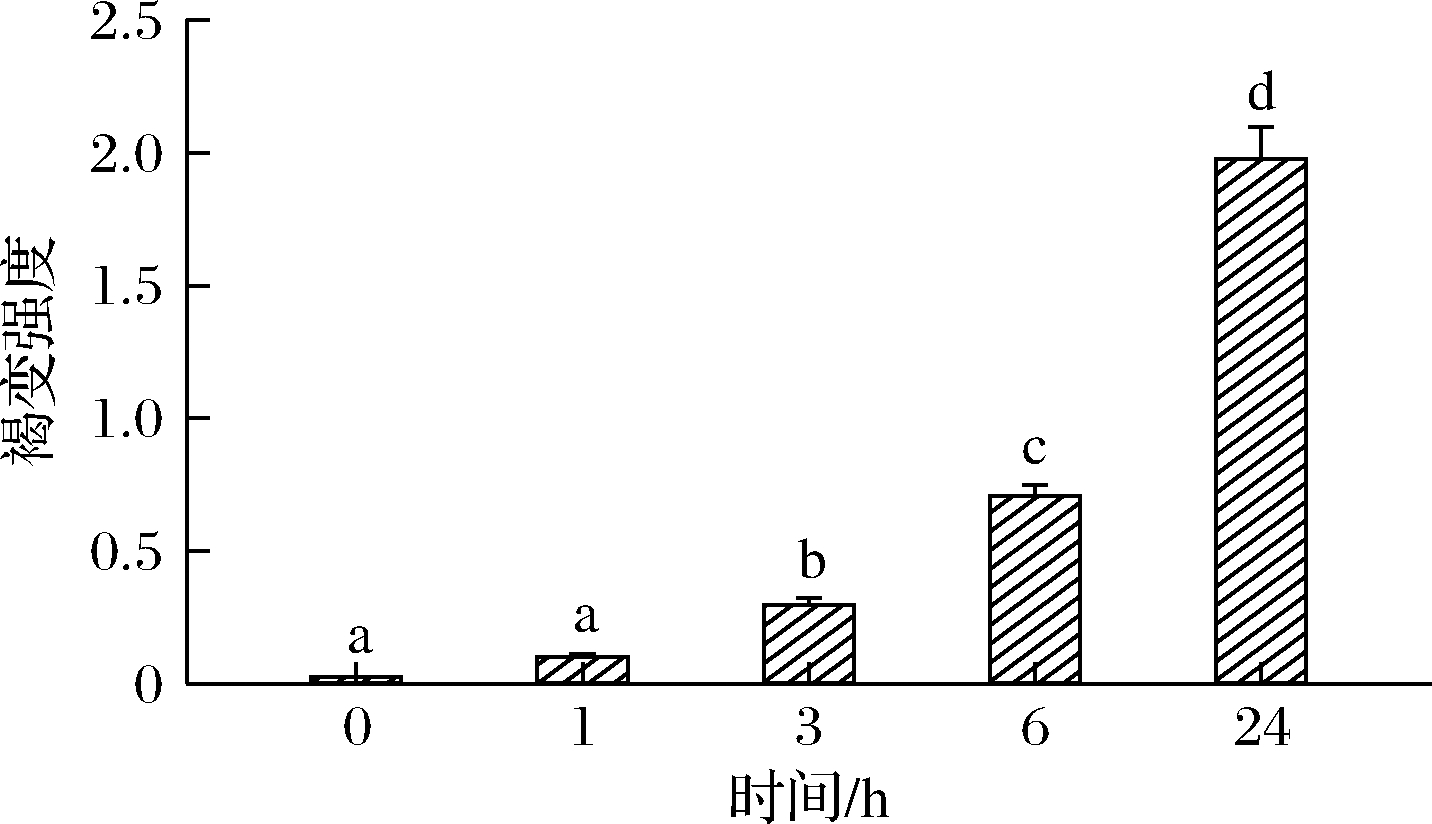
图1 不同反应时间下MP糖基化产物的褐变强度
Fig.1 Browning intensity of glycosylated MP products at different reaction times
注:不同字母代表各处理组之间具有显著性差异(P<0.05)(下同)
AGEs具有荧光特性,因此也可以通过测定MP糖基化产物的荧光强度来评估糖基化反应的程度[17]。本研究中,不同反应时间下MP糖基化产物的荧光强度变化如图2所示。在反应初期1 h时,荧光强度较低。在3、6、24 h之后,MP糖基化产物的荧光强度显著提高(P<0.05)。总体来看,MP糖基化产物荧光强度随着反应时间的延长呈逐渐增加趋势。VILLAVERDE等[17]发现,在MP与葡萄糖糖基化反应中,随着糖基化反应时间的延长,荧光强度逐渐增大。
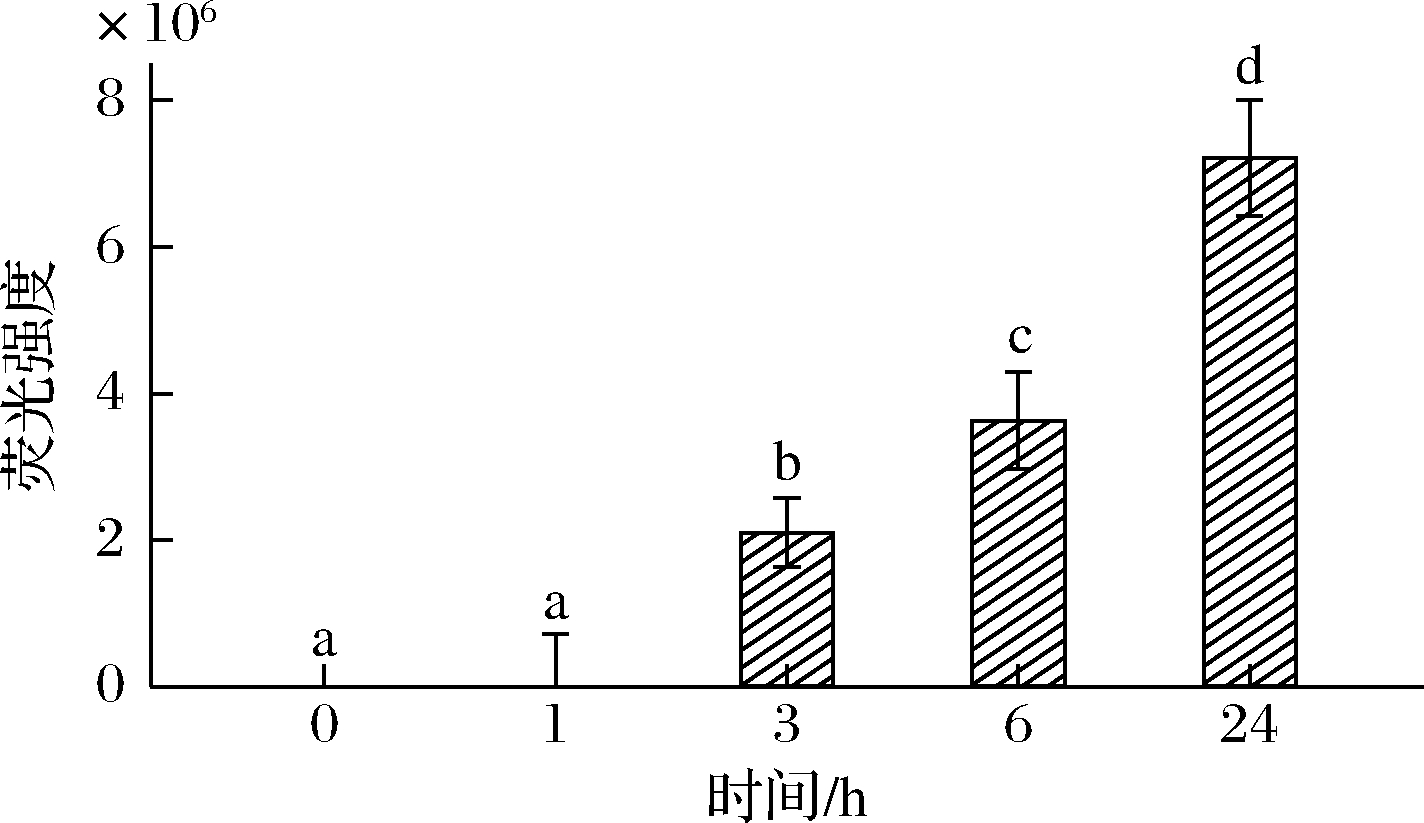
图2 不同反应时间下MP糖基化产物的荧光强度
Fig.2 Fluorescence intensity of glycosylated MP products at different reaction times
2.2 反应时间对糖基化产物分子质量的影响
SDS-PAGE分析常用于分析蛋白质亚基及分子质量变化情况[6]。本研究中,不同反应时间得到的MP糖基化产物的电泳图如图3所示。电泳分析表明,有分子质量更高的糖基化产物生成。此外,与未修饰的MP相比,随着反应时间的延长,糖基化反应产物的各个亚基条带逐渐减弱。在高温糖基化反应过程中,蛋白质的交联反应和热降解反应可能同时发生[22],而长时间高温加热会导致肌原纤维蛋白的部分降解[23]。有研究表明,明胶与葡萄糖糖基化产物在长时间高温加热条件下,导致明胶的热降解,并释放出一些低分子质量肽[24]。因此,推测长时间高温热处理可能会导致MP的部分亚基降解,表现为蛋白条带减弱。这些结果暗示MP与核糖发生糖基化反应,反应产物分子质量增大。本研究发现,肌球蛋白、肌动蛋白、肌钙蛋白等分子质量增加,这与前人报道的研究结果一致,即糖基化反应中参与的蛋白主要为肌球蛋白重链与肌动蛋白[6]。LIU等[6]研究鲢鱼MP与葡萄糖和麦芽糖糊精的糖基化反应产物,电泳结果表明交联后的反应产物分子质量增大,同时糖基化反应也导致MP的部分降解。

图3 不同反应时间下MP糖基化产物的电泳图
Fig.3 Electropherogram of glycosylated MP products at different reaction times
注:M-标准蛋白Marker;0、1、3、6、24 h-不同反应时间下 MP-核糖糖基化产物
2.3 反应时间对糖基化产物的溶解度的影响
作为蛋白质最重要的功能性质之一,溶解性与蛋白质的许多功能特性密切相关。有研究表明,糖基化改性修饰能够提高肌原纤维蛋白的溶解性和利用效率[16]。不同反应时间下MP糖基化产物在低离子强度介质中(0.05 mol/L NaCl)的溶解度如图4所示。与未糖基化的MP相比,糖基化反应1、3、6 h后,MP糖基化产物的溶解度随着反应时间的延长呈逐渐增加趋势(P<0.05)。类似地,SAEKI等[16]发现,在MP与葡萄糖糖基化反应中,在低离子强度下,随着糖基化反应时间的延长,糖基化产物的溶解度呈增加趋势。然而,在反应24 h时,MP糖基化产物的溶解度未显著提高(P>0.05),可能是由于较长的高温处理引起MP的部分亚基降解,导致其溶解度降低。

图4 不同反应时间下MP糖基化产物的溶解度
Fig.4 The solubility of glycosylated MP products at different reaction times
2.4 反应时间对糖基化产物的乳化活性和稳定性的影响
乳化活性是衡量蛋白质促进水包油型乳状液形成能力的指标[27]。不同反应时间下MP糖基化产物的乳化活性如表1所示。总体而言,糖基化产物的乳化活性略高于未糖基化MP,由3.68 m2/g(0 h)上升到4.41 m2/g(1 h),然而统计学上无显著性差异(P>0.05)。在反应初始阶段,接入少量的核糖使得糖基化反应产物具有两亲性,表面活性增大,从而提高乳化活性。然而,反应时间过长造成糖基化反应产物的亲水能力进一步提高,进而削弱了其在油-水界面上的吸附能力,最终导致乳化能力未能显著提高。
表1 不同反应时间下MP糖基化产物的乳化活性 和乳化稳定性
Table 1 Emulsifying activity and stability of glycosylated MP products at different reaction times

反应时间/h乳化活性/(m2·g-1)乳化稳定性/min03.69±0.20a53.26±1.64a14.41±0.27a98.25±22.90b34.36±0.37a75.17±29.97ab64.33±0.92a63.59±6.12ab244.27±0.09a62.78±21.16ab
注:不同字母代表糖基化产物之间具有显著性差异(P<0.05)
乳化稳定性是指蛋白质维持乳化体系稳定的能力,不同糖基化反应时间对MP乳化稳定性的影响见表1。糖基化MP的乳化稳定性呈现出先增加后降低的趋势,在1 h后达到最高值98.25 min(P<0.05)。该现象的主要原因是糖基化MP增加了混合体系的黏度,导致油水界面上蛋白的吸附层厚度增加,进而阻止油滴聚集,最终使体系乳化稳定性提高。但当糖基化程度过高时,蛋白亲水能力的提高,削弱了其界面吸附能力且降低了界面张力,进而导致乳化稳定性降低[4]。因此,糖基化的反应程度能够影响MP的乳化性能,而糖基化早期阶段能够改善MP的乳化性能。然而,过高的糖基化反应程度会导致乳化性能的降低。因此,有必要将糖基化反应控制在初级阶段,有利于改善MP的乳化性能的作用。
2.5 反应时间对糖基化产物抗氧化性的影响
2.5.1 DPPH自由基清除活性
当DPPH自由基与抗氧化物接触后,抗氧化物可以提供氢原子与DPPH自由基结合,进而形成更加稳定的分子[19]。在本研究中,前期预实验的全波长扫描(200~600 nm)结果证明,美拉德反应产物的A420nm吸光值对3种自由基(DPPH自由基、羟自由基和超氧阴离子自由基)清除活性评估影响可忽略。以未修饰的MP为对照,不同反应时间下MP糖基化产物的DPPH自由基清除活性如图5所示。经过核糖糖基化修饰后,MP糖基化产物的DPPH自由基清除活性显著提高(P<0.05)。在质量浓度为5 mg/mL时,反应6 h后,DPPH自由基清除活性达到最高(16.21%)。随着反应时间的延长,一些具有抗氧化性的美拉德反应终末产物逐渐积累,进而抗氧化活性逐渐提高[28]。

图5 不同反应时间下MP糖基化产物的DPPH 自由基清除活性
Fig.5 DPPH radical scavenging activity of glycosylated MP products at different reaction times
2.5.2 羟自由基清除活性
羟自由基属于活性氧的一种,是最活泼的自由基,能够引起生物大分子损伤[19]。不同反应时间下MP糖基化产物的羟自由基清除活性如图6所示。总的来说,MP及其糖基化产物对羟自由基的清除活性较低,该结果表明糖基化反应产物对羟自由基的清除能力有限。在5 mg/mL质量浓度下,不同反应时间的MP糖基化的羟基自由基清除率均高于MP。反应24 h后,羟自由基清除活性达到最高(10.07%)。其主要原因是美拉德反应过程中的中间产物和终末产物可以作为良好的供氢体,具有羟自由基清除能力。随着美拉德反应时间延长,羟自由基清除能力也随之增强[25]。
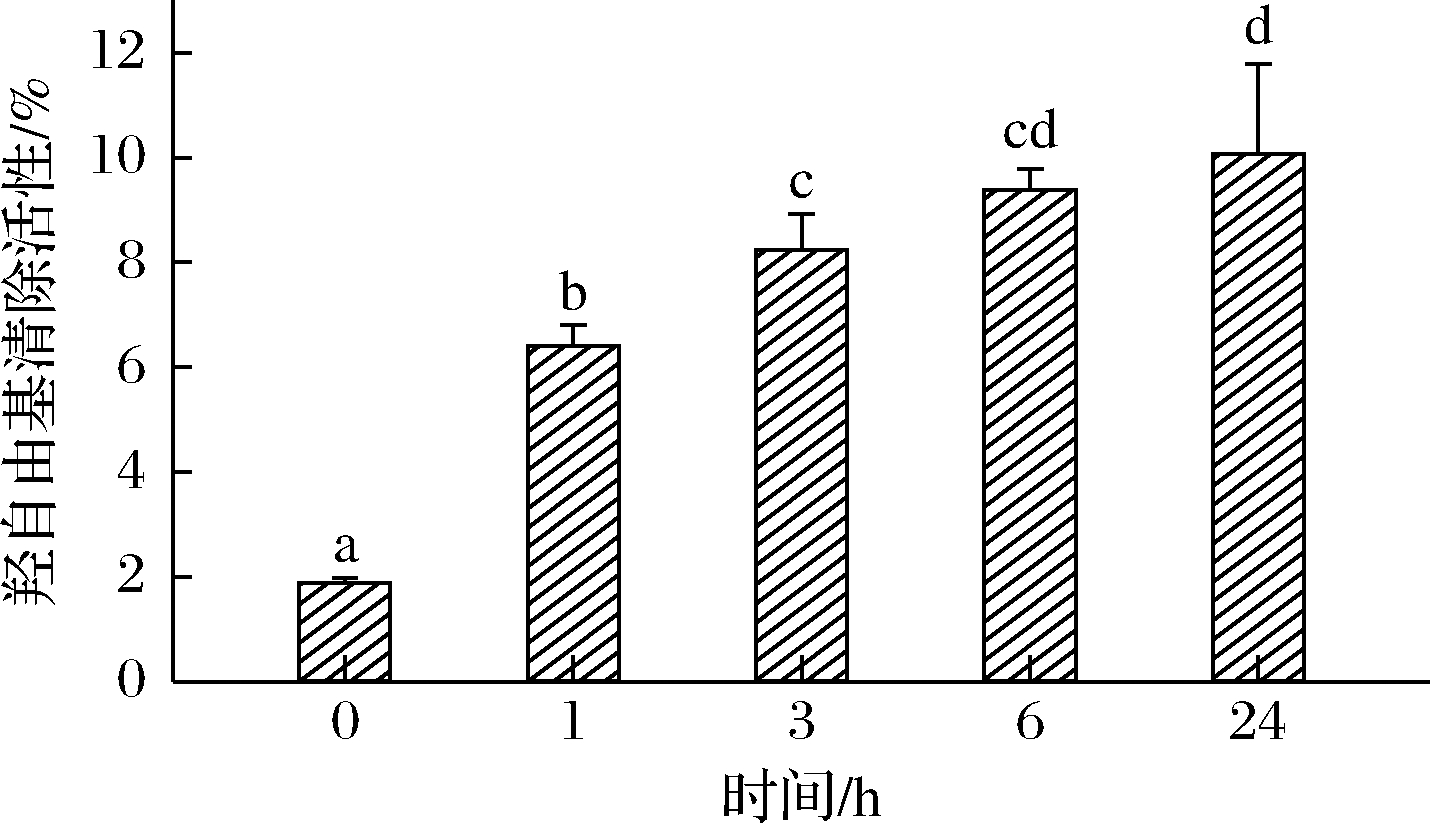
图6 不同反应时间下MP糖基化产物的羟自由基清除活性
Fig.6 Hydroxyl radical scavenging activity of glycosylated MP products at different reaction times
2.5.3 超氧阴离子自由基清除活性
超氧阴离子自由基清除能力可以用来评估MP糖基化产物的抗氧化性的强弱[26]。不同反应时间下MP糖基化产物的超氧阴离子自由基清除能力见图7。与未糖基化修饰的MP相比,糖基化修饰后的反应产物具有较高的超氧阴离子自由基的清除活性。随着糖基化反应的进行,超氧阴离子自由基的清除活性显著提高(P<0.05)。在质量浓度为5 mg/mL时,不同反应时间的糖基化产物的清除率分别为38.60%(1 h),42.39%(3 h),44.94%(6 h)和45.32%(24 h)。这主要由于美拉德反应的高级阶段形成的类黑精等AGEs具有超氧阴离子自由基的清除能力[29]。随着糖基化反应的延长,具有抗氧化能力的美拉德反应产物不断积累,进而在24 h之后达到最高。
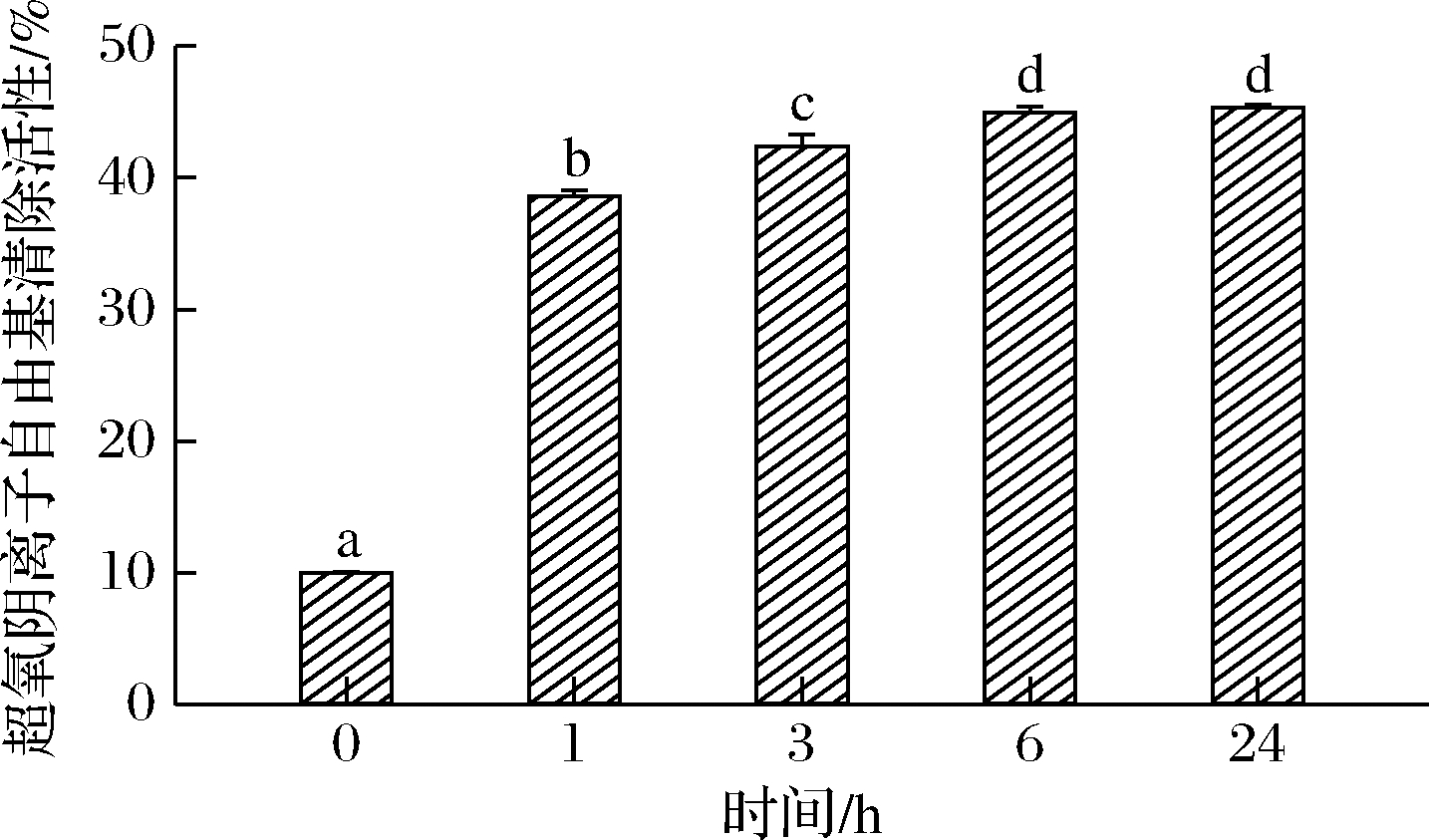
图7 不同反应时间下MP糖基化产物的超氧阴离子 自由基清除活性
Fig.7 Superoxide anion scavenging activity of glycosylated MP products at different reaction times
2.6 相关性分析结果
由上述的结果可以发现,不同反应时间的MP糖基化产物具有不同的糖基化反应程度、乳化特性以及抗氧化活性,因此有必要进一步剖析糖基化反应程度与功能特性和抗氧化活性之间的相关性。Pearson相关性分析结果和相关性系数详见表2。糖基化反应时间与褐变强度(r=0.994)和荧光强度(r=0.946)呈极显著正相关,说明随着反应时间的延长,糖基化反应程度逐渐加大。同时,褐变强度和荧光强度与抗氧化活性指标呈一定的正相关性(r >0.5),主要是由于更多具有抗氧化活性的美拉德反应产物生成,进而造成其抗氧化活性提高。值得注意的是,MP的溶解度与其抗氧化性呈现极显著正相关性(r>0.9),主要是随着MP糖基化的进行,形成了更多的糖蛋白,导致其溶解性提高。同时,随着反应时间的延长,有更多的美拉德反应产物生成,进而其抗氧化活性提高。此外,MP糖基化产物的乳化活性与抗氧化活性指标呈显著的正相关性(r>0.8),由此可知,一定程度糖基化修饰可以同时改善MP的乳化活性和抗氧化活性。此外,抗氧化活性指标之间呈极显著正相关(r>0.9),说明MP糖基化产物对多种自由基均具有清除能力。
表2 反应时间、糖基化反应程度、溶解性、乳化特性以及抗氧化活性之间的相关性分析
Table 2 Correlation among reaction time, degree of glycosylation reaction, solubility, emulsifying property and antioxidant activity
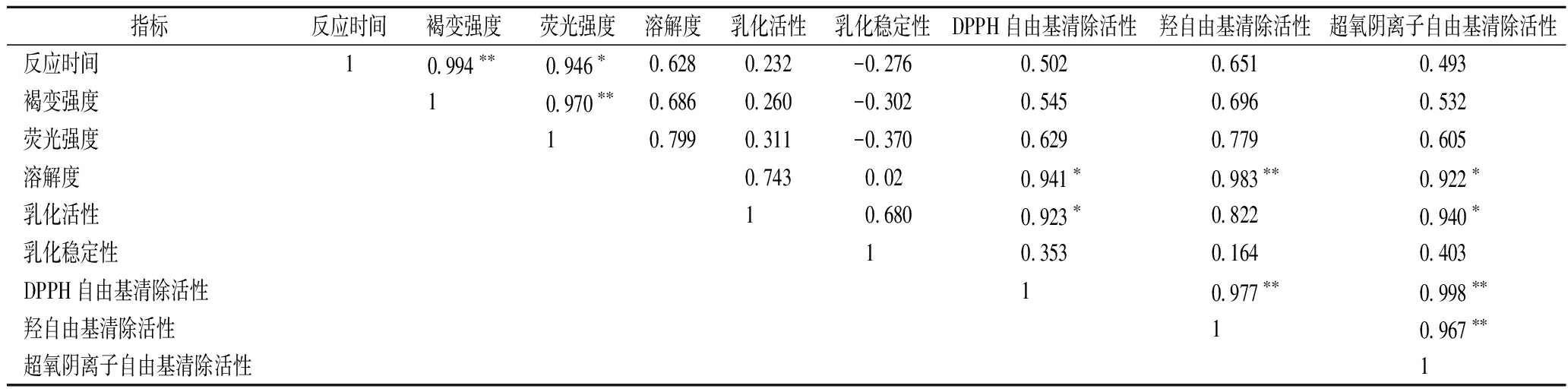
指标反应时间褐变强度荧光强度溶解度乳化活性乳化稳定性DPPH自由基清除活性羟自由基清除活性超氧阴离子自由基清除活性反应时间10.994∗∗0.946∗0.6280.232-0.2760.5020.6510.493褐变强度10.970∗∗0.686 0.260-0.3020.5450.6960.532荧光强度10.7990.311-0.3700.6290.7790.605溶解度0.7430.020.941∗0.983∗∗0.922∗乳化活性10.6800.923∗0.8220.940∗乳化稳定性10.3530.1640.403DPPH自由基清除活性10.977∗∗0.998∗∗羟自由基清除活性10.967∗∗超氧阴离子自由基清除活性1
注:*代表显著相关(P<0.05);**代表极显著相关(P<0.01)
3 结论
通过探究不同反应时间对猪肉肌原纤维蛋白-核糖糖基化产物的糖基化反应程度、溶解性、乳化活性、乳化稳定和抗氧化活性的影响,发现随着时间的延长,MP糖基化反应程度增加,有高分子质量美拉德反应产物的生成,同时MP的部分亚基可能会发生降解。糖基化反应初级阶段,可以有效地改善MP的溶解性、乳化性和乳化稳定性;然而,长时间的糖基化反应会导致乳化性能的下降;随着糖基化反应时间的延长,修饰产物的抗氧化活性逐渐提高,这主要归因于产生了更多具有抗氧化活性的美拉德反应产物。因此,糖基化反应时间对MP产物的功能特性和抗氧化活性具有调控作用,可以据此进行精准糖基化修饰,以实现糖基化修饰后MP的应用目的。此外,糖基化产物的构效关系及产物的应用特性有待进一步研究。本研究为糖基化修饰MP改善其功能特性和抗氧化性提供理论依据。
[1] XU Y J, DONG M, TANG C B, et al.Glycation-induced structural modification of myofibrillar protein and its relation to emulsifying properties[J].LWT, 2020, 117: 108664.
[2] 刘旺, 冯美琴, 孙健, 等.超高压条件下亚麻籽胶对猪肉肌原纤维蛋白凝胶特性的影响[J].食品科学, 2019, 40(7):101-107.
LIU W, FENG M Q, SUN J, et al.Influence of ultra high pressure treatment on the effect of flaxseed gum on the properties of pork myofibrillar protein gel [J].Food Science, 2019, 40(7):101-107.
[3] LIU J H, RU Q M, DING Y T.Glycation a promising method for food protein modification:Physicochemical properties and structure, a review [J].Food Research International, 2012, 49(1):170-183.
[4] 杨宇鸿, 董士远, 靳卫亚, 等.草鱼肌原纤维蛋白-葡萄糖糖基化产物的理化特性及乳化特性研究[J].食品工业科技, 2018, 39(18):77-82;142.
YANG Y H, DONG S Y, JIN W Y, et al.Chemical characterization and emulsifying properties of grass carp myofibrillar protein glycated with glucose[J].Science and Technology of Food Industry, 2018, 39(18):77-82;142.
[5] 宋春丽, 赵新淮.食品蛋白质的糖基化反应:美拉德反应或转谷氨酰胺酶途径[J].食品科学, 2013, 34(9):369-374.
SONG C L, ZHAO X H.A review on the glycosylation of food proteins by Maillard reaction or transglutaminase-catalyzed reaction[J].Food Science, 2013, 34(9):369-374.
[6] LIU S L, ZHAO P C, ZHANG J T, et al.A comparative study of physicochemical and functional properties of silver carp myofibrillar protein glycated with glucose and maltodextrin[J].RSC Advances, 2017, 7(2):1 008-1 015.
[7] NISHIMURA K, SAEKI H.Preparation of chicken myofibrillar protein-maltose conjugate having multi-food functions using random-centroid optimization[J].Food Science and Technology Research, 2016, 22(6):801-810.
[8] WANG C Y, LI J H, LI X, et al.Emulsifying properties of glycation or glycation-heat modified egg white protein[J].Food Research International, 2019, 119:227-235.
[9] LIU J H, LUO Y H, GU S Q, et al.Physicochemical, conformational and functional properties of silver carp myosin glycated with konjac oligo-glucomannan:Implications for structure-function relationships[J].Food Hydrocolloids, 2017, 72:136-144.
[10] LIU P, LI Y L, GAO L, et al.Effect of different carbohydrates on the functional properties of black rice glutelin (BRG) modified by the Maillard reaction [J].Journal of Cereal Science, 2020, 93:102979.
[11] LI R, CUI Q, WANG G R, et al.Relationship between surface functional properties and flexibility of soy protein isolate-glucose conjugates [J].Food Hydrocolloids, 2019, 95:349-357.
[12] BIAN G L, XUE S W, XU Y J, et al.Improved gelation functionalities of myofibrillar protein from pale, soft and exudative chicken breast meat by nonenzymatic glycation with glucosamine [J].International Journal of Food Science & Technology, 2018, 53(8):2 006-2 014.
[13] NISHIMURA K, SAEKI H.Random-centroid optimization reveals the strongest superoxide anion radical scavenging activity of maltose- and ribose-conjugated chicken myofibrillar protein [J].Food Science and Technology Research, 2018, 24(3):551-557.
[14] ISONO M, SAEKI H, NISHIMURA K.Properties of glycated chicken myofibrillar proteins with enhanced antioxidant abilities [J].Journal of Home Economics of Japan, 2012, 63(8):461-467.
[15] PARK D, XIONG Y L, ALDERTON A L.Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein [J].Food Chemistry, 2007, 101(3):1 239-1 246.
[16] SAEKI H, INOUE K.Improved solubility of carp myofibrillar proteins in low ionic strength medium by glycosylation [J].Journal of Agricultural and Food Chemistry, 1997, 45(9):3 419-3 422.
[17] VILLAVERDE A, ESTÉVEZ M.Carbonylation of myofibrillar proteins through the Maillard pathway:Effect of reducing sugars and reaction temperature [J].Journal of Agricultural and Food Chemistry, 2013, 61(12):3 140-3 147.
[18] AGYARE K K, ADDO K, XIONG Y L.Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt [J].Food Hydrocolloids, 2009, 23(1):72-81.
[19] FU Y, ZHAO X H.Utilization of chum salmon (Oncorhynchus keta) skin gelatin hydrolysates to attenuate hydrogen peroxide-induced oxidative injury in rat hepatocyte BRL cell model [J].Journal of Aquatic Food Product Technology, 2015, 24(7):648-660.
[20] HRYNETS Y, NDAGIJIMANA M, BETTI M.Non-enzymatic glycation of natural actomyosin (NAM) with glucosamine in a liquid system at moderate temperatures [J].Food Chemistry, 2013, 139(1-4):1 062-1 072.
[21] LIU Q, LI J, KONG B H, et al.Physicochemical and antioxidant properties of Maillard reaction products formed by heating whey protein isolate and reducing sugars [J].International Journal of Dairy Technology, 2014, 67(2):220-228.
[22] LAN X H, LIU P, XIA S Q, et al.Temperature effect on the non-volatile compounds of Maillard reaction products derived from xylose-soybean peptide system:Further insights into thermal degradation and cross-linking [J].Food Chemistry, 2010, 120(4):967-972.
[23] 邹良亮, 康怀彬, 张慧芸, 等.高温处理对牛肉蛋白质组分及其降解的影响[J].食品与机械, 2017, 33(11):18-22;27.
ZOU L L, KANG H B, ZHANG H Y, et al.Effects of high temperature treatment on protein components and their degradation in beef [J].Food & Machinery, 2017, 33(11):18-22;27.
[24] KCHAOU H, BENBETTAIEB N, JRIDI M, et al.Influence of Maillard reaction and temperature on functional, structure and bioactive properties of fish gelatin films [J].Food Hydrocolloids, 2019, 97:105196.
[25] LI R Q, HETTIARACHCHY N, RAYAPROLU S, et al.Improved functional properties of glycosylated soy protein isolate using D-glucose and xanthan gum [J].Journal of Food Science and Technology, 2015, 52(9):6 067-6 072.
[26] FU Y, ZHANG Y H, SOLADOYE O P, et al.Maillard reaction products derived from food protein-derived peptides:Insights into flavor and bioactivity [J].Critical Reviews in Food Science and Nutrition, 2020, 60(20):3 429-3 442.
[27] ZHANG Q, WU C E, FAN G J, et al.Characteristics and enhanced antioxidant activity of glycated Morchella esculenta protein isolate [J].Food Science and Technology, 2017, 38(1):126-133.
[28] NISHIMURA K, MURAKOSHI M, KATAYAMA S, et al.Antioxidative ability of chicken myofibrillar protein developed by glycosylation and changes in the solubility and thermal stability[J].Bioscience, Biotechnology, and Biochemistry, 2011, 75(2):247-254.
[29] VAN LANCKER F, ADAMS A, DE KIMPE N.Chemical modifications of peptides and their impact on food properties [J].Chemical Reviews, 2011, 111(12):7 876-7 903.