酱油是一种受欢迎的东方发酵调味品,由豆粕、麸皮与米曲霉、酵母菌和乳酸菌混合,经过制曲(固态发酵)和酱醪(盐水发酵)两步发酵而成[1]。酱油生产过程中,米曲霉产生的蛋白酶不仅可以分解原料,决定酱油的氨基酸态氮含量,而且通过降解原料蛋白释放出氨基酸或多肽,改善酱油的风味、色泽和口感。因此,蛋白酶的酶活力高低是米曲霉菌种的衡量指标。蛋白酶活性的高低决定了蛋白质的利用率,高酶活力不仅可以更好地分解原料,提升酱油的氨基酸态氮含量,进而决定了最终产品的风味、色泽和口感[2]。目前,获得高蛋白酶活性菌株以提高原料氮利用率的育种技术[3]主要包括物理化学诱变[4]和原生质体融合技术[5]等。与传统的诱变方法相比,近年来兴起的常压室温等离子体(atmospheric room temperature plasma, ARTP)诱变对遗传物质的损伤机制多样,获得突变型的多样性可能性增大,且操作简单安全[6],广泛应用于丝状菌的育种。
在丝状菌的诱变后初筛中,传统的平板培养技术存在通量低、耗时多、劳动强度大且商业生产成本高的弊端。因此,构建一种高效、快速、高通量的筛选方法来获得目标菌株有助于缩减丝状菌的育种周期。流式细胞术是一种快速、准确、客观的技术,可同时检测单个粒子的多种特征,识别细胞或颗粒所携带的荧光染料,并对特定群体进行分选[7]。本研究通过ARTP和基于碘化丙啶和荧光素二乙酸酯双染色的流式分选初筛获得了1株高酶活力的米曲霉突变株,并对其在酱油生产中的应用进行模拟分析,以期为丝状菌的高通量诱变育种和酱油现代酿造品质的提升提供借鉴。
1 材料与方法
1.1 材料
1.1.1 菌株及主要试剂
菌株:米曲霉(Aspergillus oryzae)沪酿3.042,绍兴至味食品有限公司。
主要试剂:荧光素二乙酸酯(fluorescein diacetate, FDA)、碘化丙啶(propidium iodide, PI)、福林酚试剂、干酪素等。
1.1.2 培养基及培养条件
PD培养基(g/L):新鲜去皮土豆(去离子水煮沸30 min) 200,葡萄糖20,K2HPO4 3,MgSO4·7H2O 1.5。固体培养基在以上基础上加入20 g/L琼脂。
种子培养基(g/L):葡萄糖30,胰蛋白酶6,K2HPO4 0.56,NaH2PO4·2H2O 0.75,Na2HPO4 0.75。
种曲培养基(质量分数):80%麸皮,20%面粉,向上述固体中加水至含水量80%~85%,分装入250 mL三角瓶,1 cm厚。
48深孔板液态培养基(g/L):麸皮浸提液64,面粉浸提液16, (NH4)2HPO4 16, K2HPO4 0.32, MgSO4·7H2O 0.16。
1.2 实验方法
1.2.1 ARTP诱变文库的构建
培养成熟后的米曲霉用无菌水洗涤,经200目筛网过滤后获得孢子悬液,离心后洗涤、悬浮备用。ARTP诱变中,诱变条件设为:通气量10 SLM、功率100 W、时间分别设为0、20、40、60、80、100、120 s。诱变处理后的载片于PBS中洗脱,将洗脱液稀释不同倍数后涂布,0 s计数为A,其他时刻计数为B[8]。致死率按公式(1)计算:
致死率![]()
(1)
式中:A,诱变后存活孢子数;B,诱变前总孢子数。
将诱变后的样品放入含有无菌等离子水的新试管中悬浮备用。
1.2.2 基于流式细胞术的高通量筛选
FDA单染:将不同体积的FDA染料与不同质量浓度的孢子悬浮液混合,使每个样品的最终质量浓度为50、100、150、200、250 μg/mL,室温下暗箱孵育5、10、15、20 min后涂布平板,计算致死率[9]。
PI单染:将不同体积的PI染料与不同质量浓度的孢子悬浮液混合,使每个样品的最终质量浓度为1、3、5、7、9 μg/mL,4 ℃暗箱孵育5、10、15、20 min后涂布平板,计算致死率[10]。
将处理好的样品上流式细胞仪进行检测。没有经过染色的样品设置为阴性对照,与FDA染料结合的活性样品发绿荧光由FITC-Log通道检测,与PI染料结合的无活性样品发红荧光由RPE-TR-Log通道检测。以单细胞模式将单个活性孢子分选入48孔板发酵培养基中,而后于30 ℃,220 r/min在多孔板摇床上发酵,24 h后系统地转移至48深孔板中,在高速振荡培养箱中相同发酵条件下继续发酵48 h。然后采用高通量移液技术将发酵上清液转移至另一个48深孔板里进行蛋白酶活力测定。最后将反应液转移至96孔酶标板上,于660 nm处进行吸光度检测。至此,基于以上实验方法构建了一套完整的筛选高产蛋白酶米曲霉菌株的方法,如图1所示。

图1 高产蛋白酶米曲霉菌株的筛选流程
Fig.1 Screening process of Aspergillus oryzae with high-productive proteaso
1.2.3 种曲胞外蛋白分析
固态培养基中胞外蛋白的提取遵循ODA等[11]的方法。将提取出的蛋白沉淀在室温下溶于1×NuPAGE LDS样品缓冲液中1 h以上,得到蛋白质溶液。采用Bradford法测定蛋白质溶液的浓度,调整样品浓度至相同,最终确定每泳道的上样量为10 μL,凝胶电泳后用考马斯亮蓝染色。
将需要鉴定的条带切成约1 mm大小的胶粒于离心管中,加入测序级胰蛋白酶溶液于37 ℃反应过夜,吸出酶解液,转移至新离心管。原管加入100 μL 0.1%三氟乙酸溶液,超声15 min后合并酶解液并冻干。此时样品制备完成,加3 μL 0.1%三氟乙酸溶液复溶,点样,进行质谱分析[10]。
串联飞行时间质谱仪型号为AB SCIEX 5800 MALDI-TOF/TOF,激光源为349 nm波长的Nd:YAG激光器,加速电压为2 kV,采集数据模式为正离子模式和自动获取数据的模式。用Mascot 2.2软件对质谱检测的原始文件进行相应的数据库检索,最终确定了蛋白鉴定结果。
1.2.4 RNA收集、cDNA合成和实时荧光定量PCR分析
利用布氏漏斗抽滤收集发酵液中的菌体,无菌水洗涤菌体2次后提取总RNA。将收集的菌体于液氮中研磨至白色细腻粉末状,按照植物RNA提取试剂盒方法提取目标RNA。提取完的 RNA 使用 Nanodrop ND-2000分光光度计在 260 nm/280 nm 条件下进行定量。使用 DNA 酶处理所有的总 RNA 样品,以去除残留的基因组 DNA。
使用PrimeScript®RT reagent Kit with gDNA Eraser Perfect Real Time试剂盒法将提取的RNA逆转录成cDNA。根据基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)鉴定结果,在NCBI上查询米曲霉甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因序列、pepA(aspergillopepsin-1)基因序列、ALP(alkaline protease,partial)基因序列和AO090001000135(neutral protease 2 homolog AO090001000135)基因序列。使用SYBR Premix Ex Taq试剂盒法配制反应体系并在StepOnePlus实时定量PCR仪上进行反应。以米曲霉GAPDH基因作为参比基因,所用引物如表1所示。
表1 实时荧光定量 PCR 所用引物
Table 1 Primers for RT-qpcr
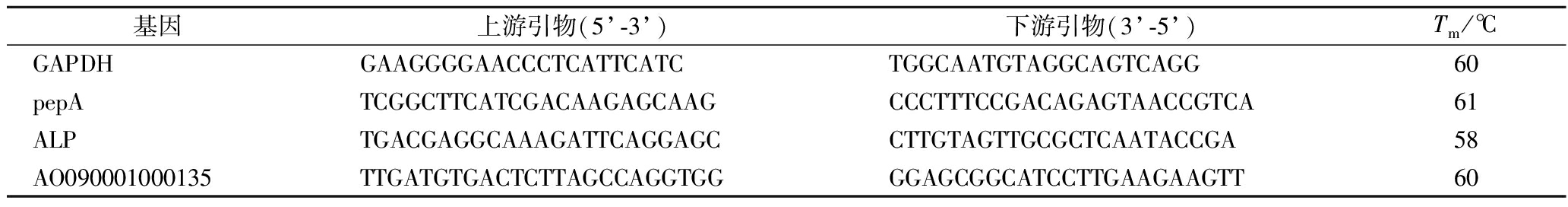
基因上游引物(5’-3’)下游引物(3’-5’)Tm /℃GAPDHGAAGGGGAACCCTCATTCATCTGGCAATGTAGGCAGTCAGG60pepATCGGCTTCATCGACAAGAGCAAGCCCTTTCCGACAGAGTAACCGTCA61ALPTGACGAGGCAAAGATTCAGGAGCCTTGTAGTTGCGCTCAATACCGA58AO090001000135TTGATGTGACTCTTAGCCAGGTGGGGAGCGGCATCCTTGAAGAAGTT60
1.2.5 实验室酱油模拟发酵工艺
制曲工艺:将豆粕与麸皮按4∶1的体积比混合均匀,121 ℃灭菌15 min,冷却至室温。接入质量分数0.2%,浓度107 CFU/mL的米曲霉孢子悬液,30 ℃恒温培养,保持湿度,适时翻曲直至曲料表面长满黄绿色菌丝即可[12]。
发酵工艺:成曲按照1∶1.7的质量比加入13 °Bé、50 ℃的盐水于40 ℃发酵25 d[13]。工艺流程如图2所示。

图2 酱油模拟工艺
Fig.2 Simulation producing technology of soy sauce
酱醪理化指标的测定:在第5、10、15、20、25 天进行取样。酱醪样品于12 000 r/min离心后取上清液并经孔径为0.22 μm的滤膜过滤。氨基酸态氮的含量测定采用甲醛滴定法[14],总氮的测定采用凯氏定氮法[15],游离氨基酸的测定采用高效液相法[16],有机酸的测定采用高效液相色谱法[17],挥发性物质的测定采用固相微萃取联合气质联用技术(solid phase microextraction-gas chromatography-mass spectrometry,SPME-GC-MS)[18]。
2 结果与分析
2.1 ARTP诱变及高通量筛选
控制诱变时间为唯一变量,获得致死率与诱变时间的关系曲线(图3-a)。随机挑取一定数量的单菌落于48深孔板发酵,统计发酵48 h后蛋白酶酶活力,获得正突变率与致死率的关系。如图3-b所示,孢子的致死率与诱变时间呈正相关,正突变率整体呈现先上升后下降的趋势,考虑到高致死率有利于缩小突变库,故诱变条件确定为:通气量10 SLM、功率100 W、时间100 s。
FDA通过活细胞的细胞膜,被细胞中的非特异性酯酶分解产生荧光素并积蓄在活细胞中产生荧光[19]。PI可以透过死细胞的细胞膜使细胞核红染[20]。根据2种染料的特性将诱变后的活孢子与死孢子区分开来。通常染料浓度越高、染色时间越长,染色效果越明显。然而,相应地,染料对细胞的致死作用也越严重。所以考察了2种染料的毒性以及染色时间对米曲霉孢子的影响。结果表明,质量浓度为100 μg/mL FDA在室温下染色20 min,PI质量浓度为6 μg/mL在4 ℃下染色10 min效果最佳,当致死率低于10%时,染色效果与染料浓度和染色时间呈正相关关系(表2)。

a-致死率;b-正突变率
图3 ARTP诱变的致死率和正突变率
Fig.3 Lethality rate and positive mutation rate of ARTP mutagenesis
根据优化后的最优染色条件,对诱变后的样品进行FDA-PI双荧光复染,上流式细胞仪检测。建立双对数坐标轴,将没有进行染色操作的孢子悬液作为阴性对照(图4-a);活孢子经FDA单染后,主要集中于FDA+区域(图4-b);死孢子经PI单染后,主要集中于PI+区域(图4-c);样品经FDA-PI双染后,死活孢子各自分布于PI+区域和FDA+区域(图4-d)。
表2 染料的浓度和染色时间对孢子的致死率单位:%
Table 2 The mortality of spores under different dye concentration and dyeing time
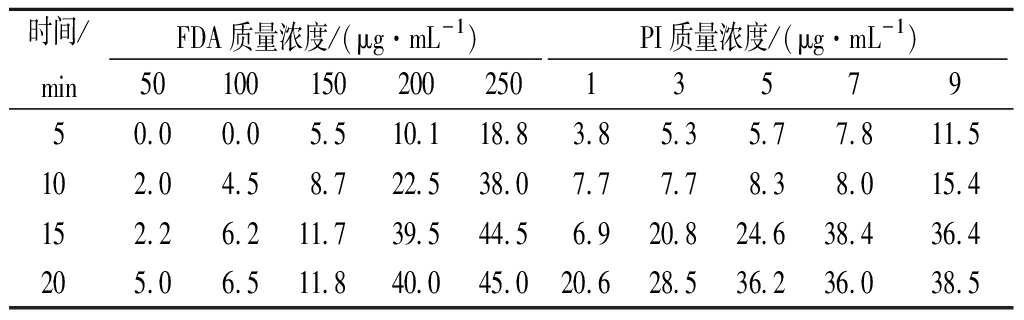
时间/minFDA质量浓度/(μg·mL-1)PI质量浓度/(μg·mL-1)501001502002501357950.00.05.510.118.83.85.35.77.811.5102.04.58.722.538.07.77.78.38.015.4152.26.211.739.544.56.920.824.638.436.4205.06.511.840.045.020.628.536.236.038.5
经流式细胞仪分选后,借助高通量孔板培养、酶标仪检测器等高通量设备,构建好初筛方法,测定孔板内蛋白酶反应液的OD值(图5-a)。经过4轮诱变,总共获得4 032株突变菌株,初筛选出16株产量较高的菌株。如图5-b所示,将初筛得到的高产的16株突变菌株和出发菌株制曲72 h的中性蛋白酶活性进行再测试,突变菌株H34的中性蛋白酶活性达到3 684.3 U/g,较出发菌株的酶活力提高了145.6%。为了验证突变株H34传代过程中的遗传稳定性,将该菌株定期传代7次,在传代培养过程中,突变株H34蛋白酶活性波动较小且稳定,遗传稳定性较好(图5-c)。
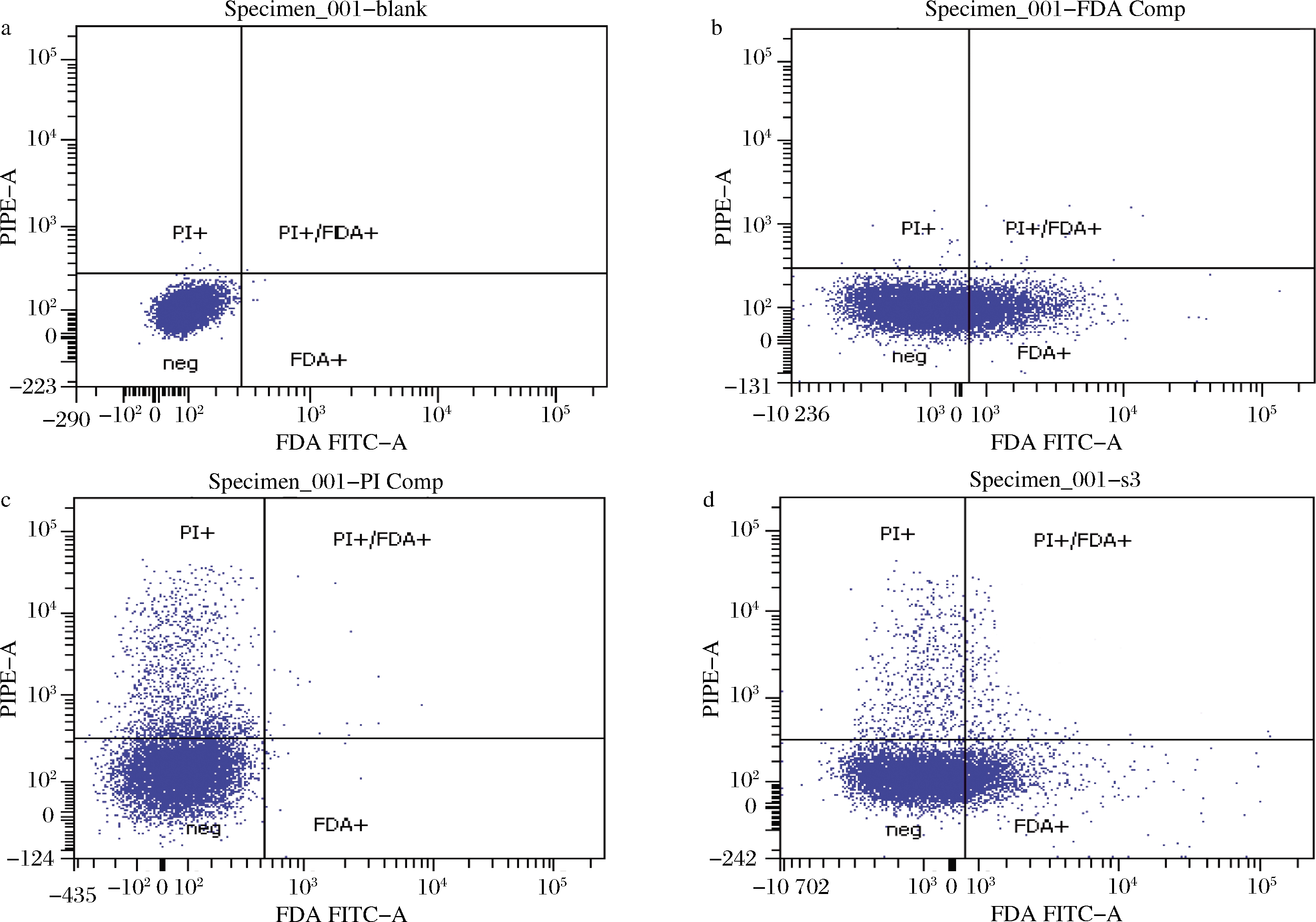
a-对照;b-FDA单染;c-PI单染;d-FDA-PI双染
图4 荧光染色流式细胞仪检测分析
Fig.4 Sorting based on flow cytometry
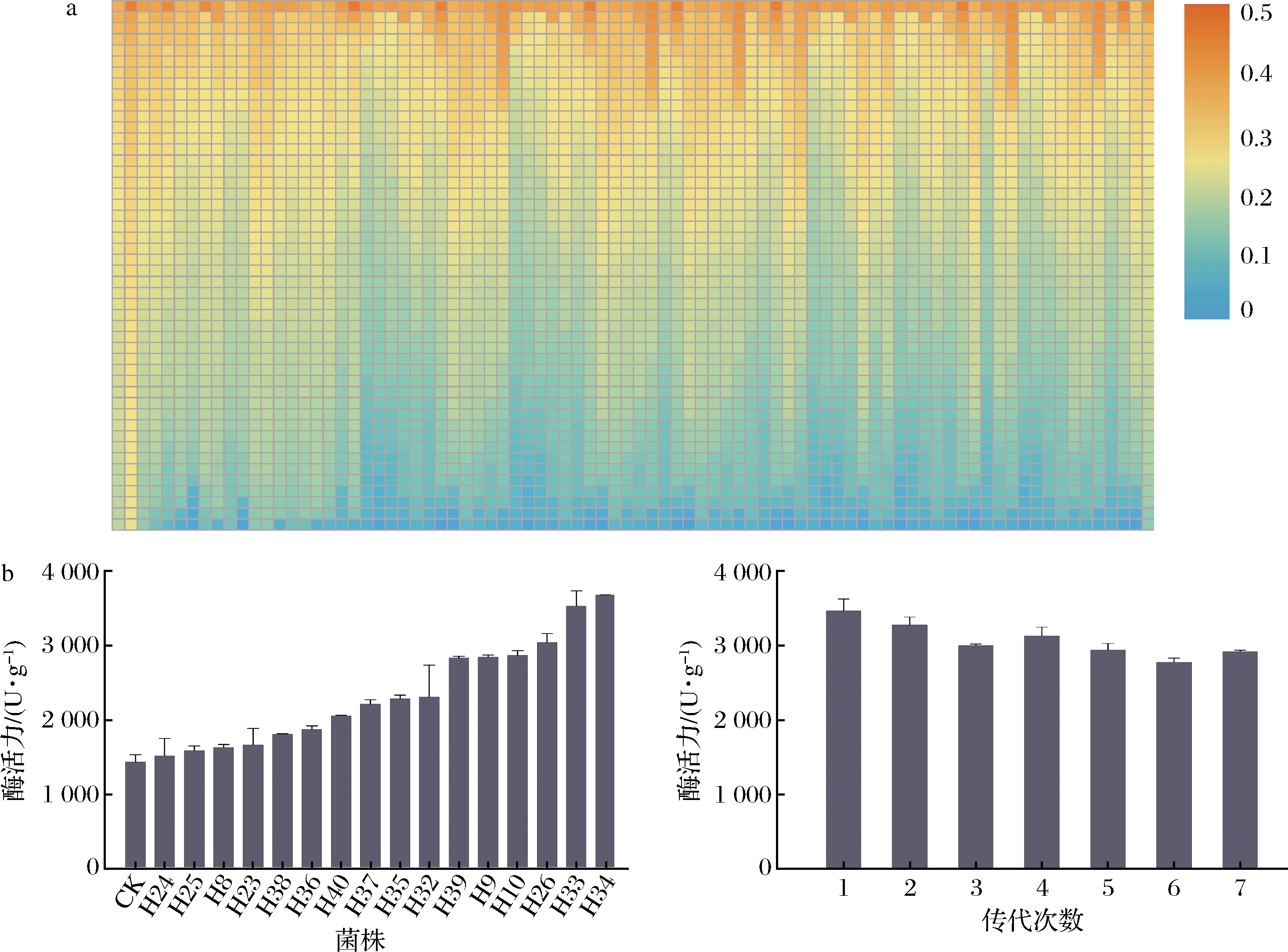
a-初筛结果;b-复筛结果;c-遗传稳定性验证结果
图5 筛选结果
Fig.5 Screening results
2.2 种曲胞外蛋白鉴定与基因转录表达水平分析
通过SDS-PAGE,获得了米曲霉3.042和高产菌株H34在制曲条件下的胞外蛋白谱(图6-a)。选取蛋白含量相差明显的条带(条带1、2和3),对其进行MALDI-TOF/TOF比对分析。其中条带1被鉴定为酸性蛋白酶(aspergillopepsin-1),条带2被鉴定为碱性蛋白酶(alkaline protease,partial),条带3被鉴定为中性蛋白酶(neutral protease 2 homolog AO090001000135)。Aspergillopepsin-1,原名Aspergillus peptidase A,是从用于发酵日本传统清酒和烧酒的微生物中分离出来的[20]。由alp基因编码的碱性蛋白酶对酱油的品质至关重要,它的主要作用是水解大豆蛋白产生大量的多肽[21],中性蛋白酶是米曲霉分泌的一种重要蛋白酶。酱油企业常用中性蛋白酶的活性作为判断酱油曲品质的指标之一[13]。
如图6-b,高产蛋白酶菌株H34中ALP、pepA和AO090001000135的基因转录水平分别高于原始菌株米曲霉45%、233%、256%。说明ALP、pepA和AO090001000135基因转录水平的提高是引起种曲发酵酶活力提高的主要因素。ARTP处理可能加强了米曲霉ALP、pepA和AO090001000135基因的转录水平,进而提高了蛋白酶的酶活力。
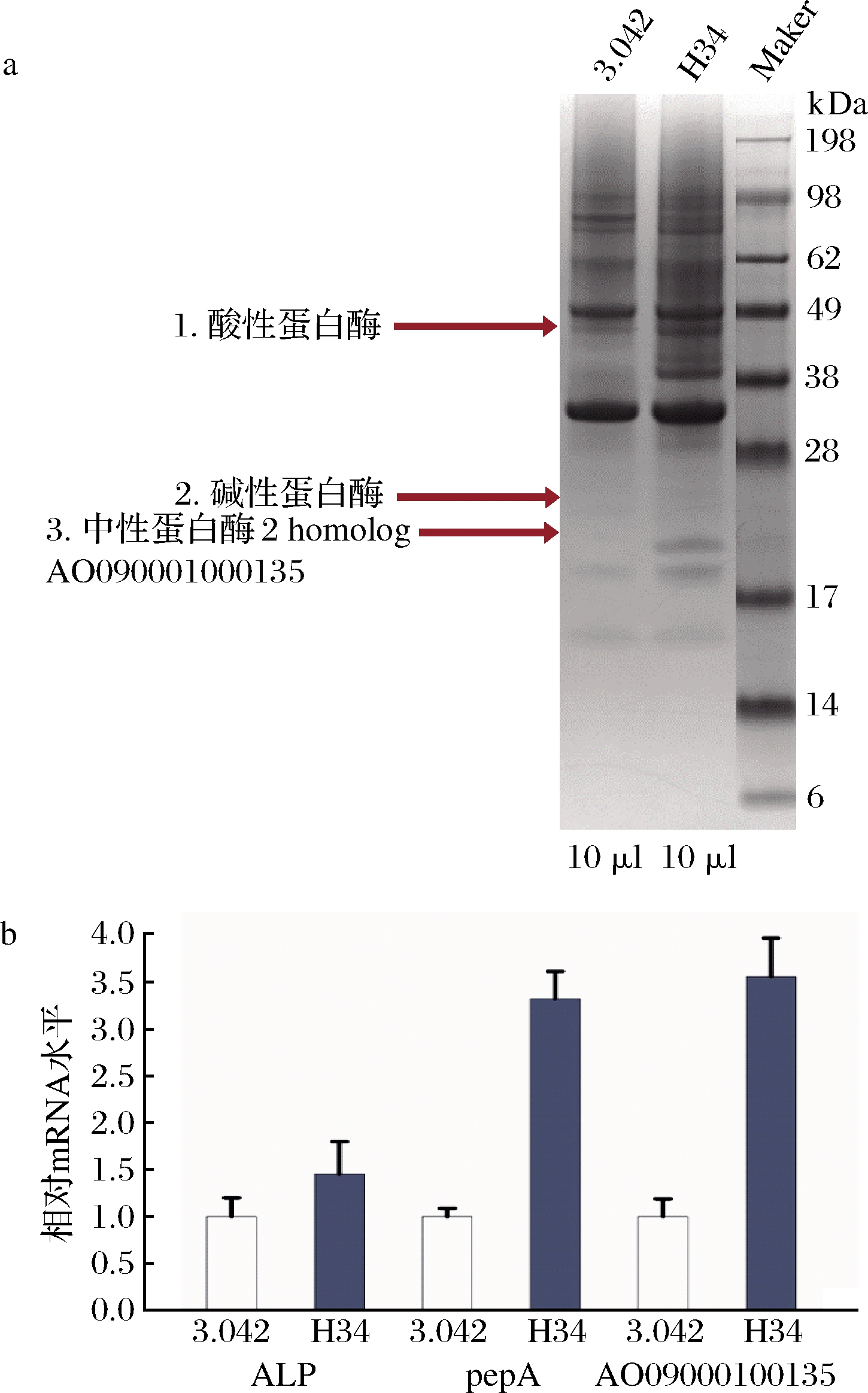
a-种曲胞外鉴定结果;b-基因转录表达水平分析
图6 种曲胞外蛋白鉴定与基因转录表达水平分析
Fig.6 Extracellular protein profiles and gene expression levels of two strains
2.3 两株米曲霉产酱油风味物质和理化指标的比较分析
氨基酸态氮和总氮2个指标越高,代表酱油中氨基酸的含量丰富,口感鲜美。2个发酵组酱醪中全氮的变化情况如图7-a所示,诱变菌株H34在发酵终点较出发菌株全氮的质量浓度提高了6%,总氮利用率较出发菌株提高了8.4%,在经济性方面应用诱变菌株H34将减少原料消耗并增加企业经济效益。如图7-b所示,2组酱醪中氨基酸态氮前期积累程度相似,但后期菌株H34的积累量缓慢升高,发酵终点较出发菌株3.042约提高了6.8%。
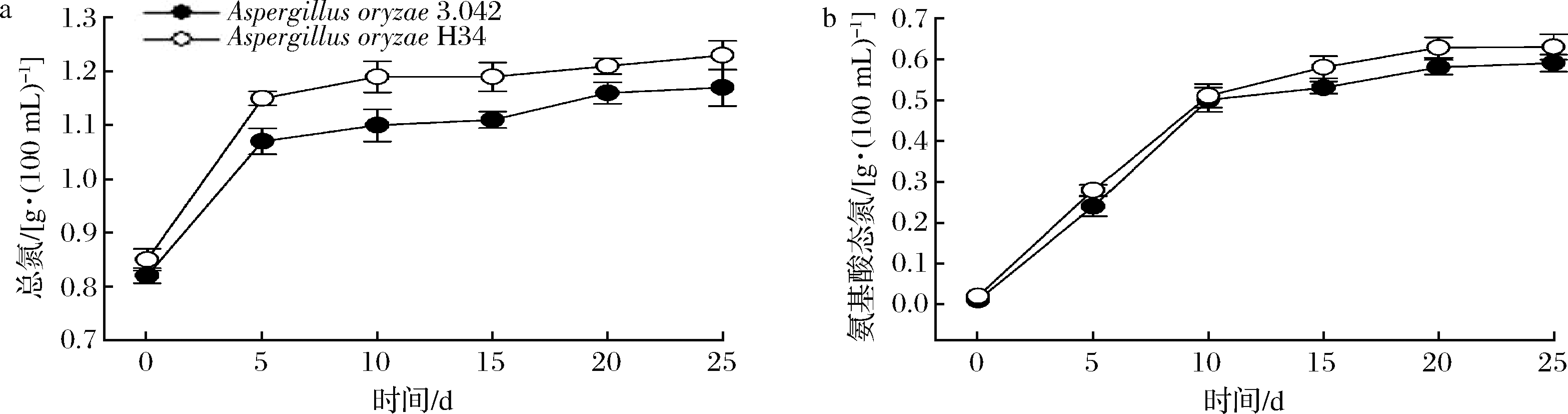
a-总氮;b-氨基酸态氮
图7 酱醪发酵阶段总氮和氨基酸态氮变化情况
Fig.7 Changes of total nitrogen and amino acid nitrogen during moromi period
游离氨基酸对以蛋白为主要发酵基质的大豆发酵食品独特滋味和香气的形成具有重要作用[22],不同的氨基酸可以提供不同的口味[23]。如图8所示,诱变菌株H34发酵酱油中鲜味、甜味、苦味氨基酸总量相对有所增加,但总体上呈味氨基酸并没有太大变化。由此推测,米曲霉H34所分泌的蛋白酶更加具有优势且酿造出的酱油在呈味方面没有太大变化,可以投入实际生产应用中。
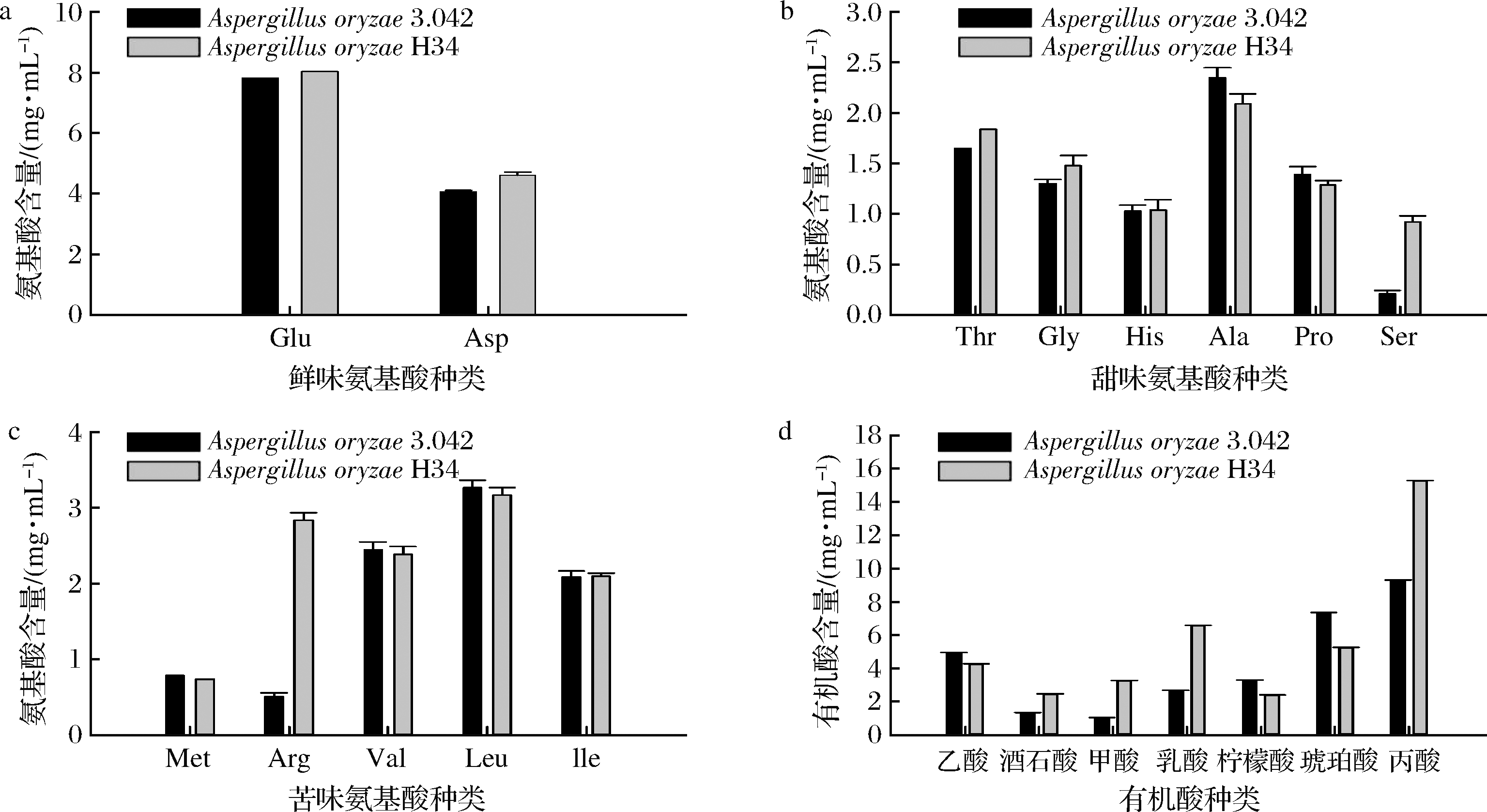
a-鲜味氨基酸;b-甜味氨基酸;c-苦味氨基酸;d-有机酸
图8 酱油样品中呈味氨基酸含量和有机酸含量
Fig.8 Content of flavor amino acids and organic acids in soy sauce samples
利用HPLC法对2个发酵组进行有机酸检测分析,结果如图8-d所示。发酵终期H34较出发菌株产酱油中酒石酸、甲酸、乳酸、丙酸含量均增高。且乳酸作为脂类物质前体,乳酸的增多也导致了脂类香气物质的增多[24]。酒石酸主要是食品中酸味成分的主要来源,构成了食品中的酸性口味[25]。
通过SPME-GC-MS分析方法共检测出49种挥发性化合物(表3),米曲霉H34发酵的酱油中,醇、酮、醛、酯类物质成分含量均有所提高。醇类主要是在酵母作用下生成,有机酸与醇类作为脂类物质的前体,其含量增多又相应地带动了脂类物质含量的提高[26]。酯类物质具有香味清、散逸快、远、突出的特点;醇类物质是醇香和助香剂的来源,是构成脂类物质的前提;醛类通常具有刺激性气味,适当含量的醛类物质具有调和香气的作用,并且能与醇类物质反应,形成一系列复杂的风味化合物使酱油风味更加丰富[27]。
表3 酱醪中的挥发性物质成分分析 单位:μg/mL
Table 3 Volatile compounds in moromi fermentation
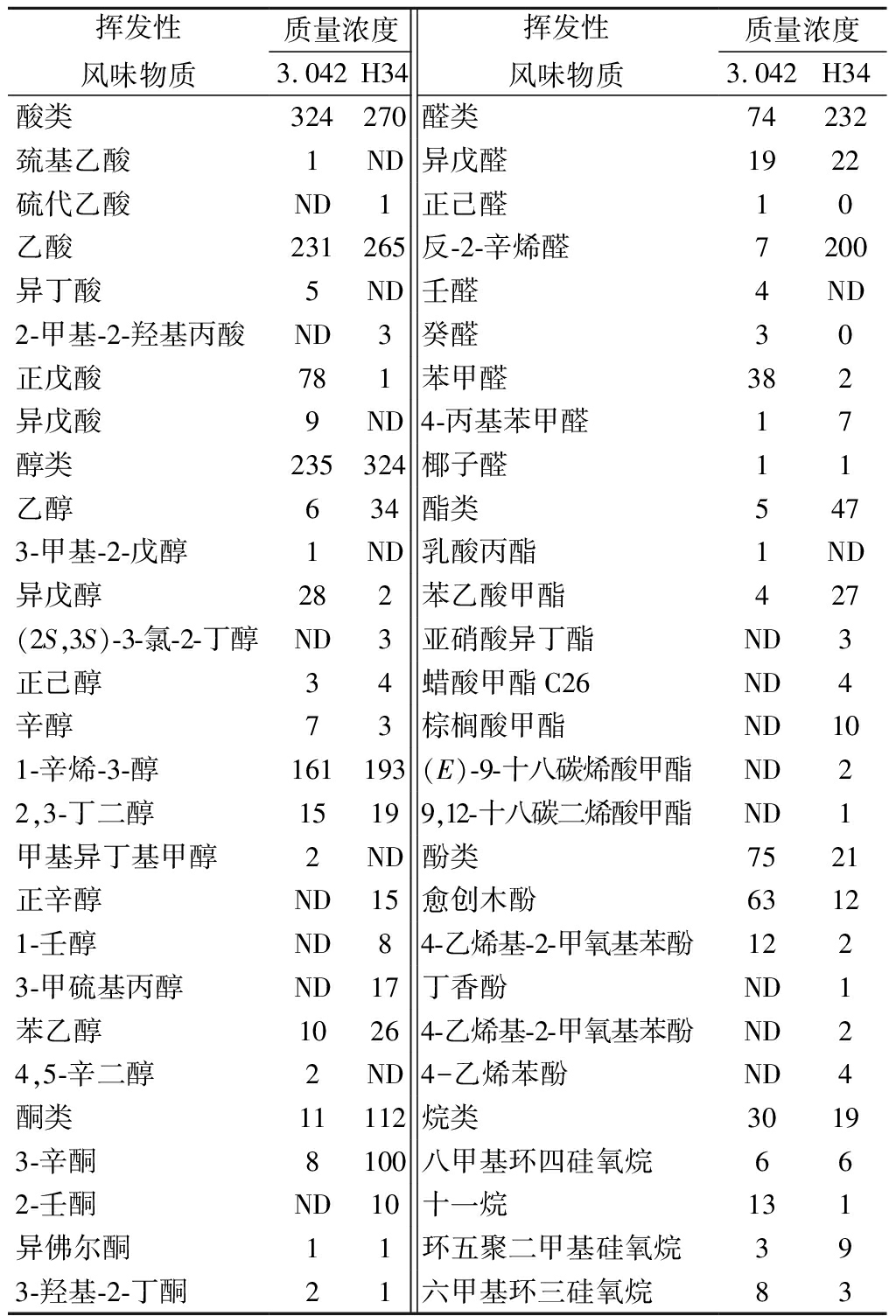
挥发性风味物质质量浓度3.042H34挥发性风味物质质量浓度3.042H34酸类324270醛类74232巯基乙酸1ND异戊醛1922硫代乙酸ND1正己醛10乙酸231265反-2-辛烯醛7200异丁酸5ND壬醛4ND2-甲基-2-羟基丙酸ND3癸醛30正戊酸781苯甲醛382异戊酸9ND4-丙基苯甲醛17醇类235324椰子醛11乙醇634酯类5473-甲基-2-戊醇1ND乳酸丙酯1ND异戊醇282苯乙酸甲酯427(2S,3S)-3-氯-2-丁醇ND3亚硝酸异丁酯ND3正己醇34蜡酸甲酯C26ND4辛醇73棕榈酸甲酯ND101-辛烯-3-醇161193(E)-9-十八碳烯酸甲酯ND22,3-丁二醇15199,12-十八碳二烯酸甲酯ND1甲基异丁基甲醇2ND酚类7521正辛醇ND15愈创木酚63121-壬醇ND84-乙烯基-2-甲氧基苯酚1223-甲硫基丙醇ND17丁香酚ND1苯乙醇10264-乙烯基-2-甲氧基苯酚ND24,5-辛二醇2ND4-乙烯苯酚 ND4酮类11112烷类30193-辛酮8100八甲基环四硅氧烷662-壬酮ND10十一烷131异佛尔酮11环五聚二甲基硅氧烷393-羟基-2-丁酮21六甲基环三硅氧烷83
注:ND表示未检出
3 结论
本研究建立了一种基于流式细胞术的高通量筛选高产蛋白酶米曲霉菌株的方法,以提高米曲霉分泌中性蛋白酶的酶活力,进而提高酿造酱油的全氮利用率和蛋白质利用率,改善最终产品的风味、口感。米曲霉的传统筛选方法受限于自身单个菌落直径较大的问题,从而分选通量极小,且对人力的依赖性很强,本研究中流式细胞术的应用使单次通量提高了11倍。
与米曲霉3.042相比,通过诱变育种高通量筛选所筛选的H34菌株使中性蛋白酶的活性增加了2倍以上,酸性蛋白酶和碱性蛋白酶的分泌也相应增加。重要的是,具有优良蛋白酶活性的菌株,可以在酱油酿造过程中一定程度上提高原料的蛋白质利用率。通过实验室酱油模拟酿造实验,对米曲霉H34和3.042产酱油的理化指标、氨基酸、有机酸、挥发性物质进行了测定和比较分析,确定了米曲霉H34在实际应用中的优势。研究结果为改进传统酱油技术和促进现代生物技术在酱油生产中的应用提供了参考,也对流式细胞术在丝状真菌选育中的应用具有指导和借鉴作用。
[1] DEVANTHI P V P,GKATZIONIS K.Soy sauce fermentation:Microorganisms,aroma formation,and process modification[J].Food Research International,2019,120:364-374.
[2] XU Y,WANG D,FAN W L,et al.Traditional Chinese biotechnology[J].Advances in Biochemical Engineering/Biotechnology,2010,122:189-233.
[3] 潘力, 李立风,彭昶,等.酱油曲霉孢子原生质体的制备与紫外诱变育种[J].食品与发酵工业,2006,32(8):1-4.
PAN L,LI L F,PENG C,et al.Protoplast preparation and regeneration of Aspergillus sojae spore and improvement of its protease activity by UV treatment[J].Food and Fermentation Industries,2006,32(8):1-4.
[4] ZHAO G Z,HOU L H,LU M F,et al.Construction of the mutant strain in Aspergillus oryzae 3.042 for abundant proteinase production by the N+ ion implantation mutagenesis[J].International Journal of Food Science & Technology,2012,47(3):504-510.
[5] XU D F,PAN L,ZHAO H F,et al.Breeding and identification of novel koji molds with high activity of acid protease by genome recombination between Aspergillus oryzae and Aspergillus niger[J].Journal of Industrial Microbiology & Biotechnology,2011,38(9):1 255-1 265.
[6] 舒冬梅, 王德良,宋绪磊,等.常压室温等离子体诱变(ARTP)及高通量筛选高产蛋白酶米曲霉的初探[J].中国调味品,2016,41(12):67-73.
SHU D M,WANG D L,SONG X L,et al.Initial study on high proteinase-producing Aspergillus oryzae with ARTP mutation and high-throughput screening[J].China Condiment,2016,41(12):67-73.
[7] ADAN A,ALIZADA G,KIRAZ Y,et al.Flow cytometry:Basic principles and applications[J].Critical Reviews in Biotechnology,2017,37(2):163-176.
[8] OTTENHEIM C,NAWRATH M,WU J C.Microbial mutagenesis by atmospheric and room-temperature plasma (ARTP):The latest development[J].Bioresources & Bioprocessing,2018,5(1):1-14.
[9] 柴阿丽, 韩云,武军,等.基于FDA-PI双荧光复染法的茄病镰刀菌孢子活性检测[J].中国农业科学,2015,48(14):2 757-2 766.
CHAI A L,HAN Y,WU J,et al.Determination of spore viability of Fusarium solani based on dual fluorescence assay[J].Scientia Agricultura Sinica,2015,48(14):2 757-2 766.
[10] 朱金勇, 黄河清.MALDI-TOF质谱技术分析细胞与组织多肽组成的研究进展[J].分析仪器,2004(2):5-9.
ZHU J Y,HUANG H Q.Progress of research on analysis of peptide components in cell and tissue with MALDI-TOF mass spectrometry[J].Analytical Instrumentation,2004(2):5-9.
[11] ODA K,KAKIZONO D,YAMADA O,et al.Proteomic analysis of extracellular proteins from Aspergillus oryzae grown under submerged and solid-state culture conditions[J].Applied and Environmental Microbiology,2006,72(5):3 448-3 457.
[12] 房峻, 刘佳乐,彭玉慧,等.强化嗜盐四联球菌对模拟低盐酱油发酵的影响[J].中国酿造,2020,39(12):146-152.
FANG J,LIU J L,PENG Y H,et al.Effect of enrichment of Tetragenococcus halophilus on simulated fermentation of low-salt soy sauce[J].China Brewing,2020,39(12):146-152.
[13] 朱莉, 许长华.酱油关键风味物质及其功能与发酵工艺研究进展[J].食品与发酵工业,2018,44(6):287-292.
ZHU L,XU C H.Research advances on the key flavor substance of soy sauce and its functions and fermentation technology[J].Food and Fermentation Industries,2018,44 (6):287-292.
[14] 梁姚顺, 朱新贵,孙胜枚,等.几种含氮物质对酱油氨基酸态氮及全氮测定值的影响[J].中国调味品,2011,36(10):76-78.
LIANG Y S,ZHU X G,SUN S M,et al.Study on the effect of some nitrogenous compounds on the determination of amino acid nitrogen and total nitrogen in soy sauce[J].China Condiment,2011,36 (10):76-78.
[15] 陈智慧, 史梅,王秋香,等.用凯氏定氮法测定食品中的蛋白质含量.首届中国兽药大会动物药品学暨中国畜牧兽医学会动物药品学分会2008学术年会论文集[C].天津:中国动物保健品协会,2008.
CHEN Z H,SHI M,WANG Q X,et al.Determination of protein content in food by Kjeldahl nitrogen determination method.Proceedings of the 1 st Chinese Veterinary Drug Congress and the 2008 Academic Annual Meeting of the Chinese Society of Animal Science and Veterinary Medicine[C].Tianjin:China Animal Health Products Association, 2008.
[16] 仇钰莹. 浓香型白酒中氨基甲酸乙酯形成途径解析[D].无锡:江南大学,2016.
QIU Y Y.Analysis of ethyl carbamate formation during Luzhou-flavor spirits fermentation process[D].Wuxi:Jiangnan University,2016.
[17] 王银辉, 沈小梅,马雷,等.超高效液相色谱:三重四级杆串联质谱仪(UPLC-MS/MS)同时测定白酒中7种有机酸的分析研究[J].酿酒,2016,43(1):43-46.
WANG Y H,SHEN X M,MA L,et al.Ultra performance liquid chromatography-triple quadrupole tandem mass spectrometry(UPLC-MS/MS) simultaneously determine 7 kinds of organic acids in liquor[J].Liquor Making,2016,43(1):43-46.
[18] 童佳, 赵国忠,赵建新,等.米曲霉发酵高盐稀态酱油过程中典型挥发性风味物质的形成[J].中国酿造,2017,36(5):22-29.
TONG J,ZHAO G Z,ZHAO J X,et al.Formation of typical volatile flavor compounds in soy sauce with high salt liquid state fermentation by Aspergillus oryzae[J].China Brewing,2017,36(5):22-29.
[19] ROTMAN B,PAPERMASTER B W.Membrane properties of living mammalian cells as studied by enzymatic hydrolysis of fluorogenic esters[J].Proceedings of the National Academy of Sciences of the United States of America,1966,55(1):134-141.
[20] ICHISHIMA E.Aspergillopepsin I[M].Handbook of Proteolytic Enzymes.Amsterdam:Elsevier,2013.
[21] KOLATTUKUDY P E,LEE J D,ROGERS L M,et al.Evidence for possible involvement of an elastolytic serine protease in aspergillosis[J].Infection and Immunity,1993,61(6):2 357-2 368.
[22] 赵国忠, 姚云平,曹小红,等.2种米曲霉发酵酱油风味物质比较[J].食品科学,2014,35(24):249-253.
ZHAO G Z,YAO Y P,CAO X H,et al.Comparison of flavor compounds in soy sauces fermented by two Aspergillus oryzae strains[J].Food Science,2014,35(24):249-253.
[23] HAN B Z,ROMBOUTS F M,NOUT M J R.Amino acid profiles of sufu,a Chinese fermented soybean food[J].Journal of Food Composition & Analysis,2004,17(6):689-698.
[24] POTERA C.Making succinate more successful[J].Environmental Health Perspectives,2005,113(12):A832-A835.
[25] PERKINS-VEAZIE P,COLLINS J K.Contributions of nonvolatile phytochemicals to nutrition and flavor[J].Hort Technology,2001,11(4):539-546.
[26] 童佳. 米曲霉发酵高盐稀态酱油过程中挥发性风味物质及蛋白酶表达规律研究[D].无锡:江南大学,2017.
TONG J.Volatile flavor compounds and protease of high-salt liquid-state soy sauce fermentated by Aspergillus oryzae [D].Wuxi:Jiangnan University,2017.
[27] DIEZ-SIMON C,EICHELSHEIM C,MUMM R,et al.Chemical and sensory characteristics of soy sauce:A review[J]. Journal of Agricultural and Food Chemistry,2020,68(42),11 612-11 630.
 ow cytometry; mutagenesis; proteinase; soy sauce formation
ow cytometry; mutagenesis; proteinase; soy sauce formation