荷叶为莲科莲属植物莲(Nelumbo nucifera Gaertn)的叶子,其直径最大可达60 cm,盾状或圆形,表面深绿色、被蜡质白粉,背面灰绿色、呈波状,叶柄圆柱形、密生倒刺。荷叶自古以来就被应用于食品、药品方面,具有安全、无毒副作用的优点,主要分布在中亚、西亚、北美、东亚、南亚等亚热带和温带地区。黄酮类化合物是一类存在于自然界,具有2-苯基色原酮结构的化合物,在植物体中通常与糖结合成苷类,小部分以游离态(苷元)的形式存在。绝大多数植物体内都含有黄酮类化合物,它在植物的生长、发育、开花、结果以及抗菌防病等方面起着重要作用。近代研究表明,荷叶的生物活性和生理功能主要与其含有的生物碱、黄酮类等功能性成分有关[1],荷叶黄酮具有降脂减肥、抗自由基、抗氧化、抑菌、抗病毒等作用[2]。在生命活动的氧化代谢过程中,不断产生各种自由基。人体的有氧代谢离不开能量转换,而自由基在能量传递过程中起着载体的作用。自由基是具有未配对电子的独立化学物质,当自由基的数量超过抗氧化保护系统的范围时,会发生过度氧化[3],促使自由基攻击身体的细胞获取电子以维持自身的稳定性,对细胞的构象和功能造成损害,并引发炎症[4]、分子降解和其他类型的疾病,如心血管疾病、神经疾病和癌症。生物体对自由基损伤的防御体系中有一类非酶促防御体系,天然存在许多对自由基起作用的物质,有些可作为延缓衰老的良好佐剂,此类物质将具有广泛的开发背景。衰老是生命过程中的一个必然阶段,肝主疏泄、调节气机[5],是保持机体气机正常出入升降的重要脏器。因此,研究肝脏衰老的机制对延缓肝脏衰老具有重要意义。本实验采用D-半乳糖诱导的小鼠肝损伤模型[6],评价荷叶黄酮的保护作用,并测定其生物活性物质,旨在为荷叶的食用药用价值的开发提供实验依据。
1 材料与方法
1.1 材料与仪器
荷叶,采集于云南;DPPH,东京化成工业株式会社;二甲基亚砜(dimethyl sulfoxide,DMSO),美国Sigma公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽(glutathione,GSH)、NO试剂盒,南京建成生物工程研究所;白细胞介素-6(interleukin-6, IL-6)、白细胞介素-10(interleukin-10, IL-10)、脑肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-lβ(interleukin-1β, IL-1β)系列试剂盒,北京诚林生物科技有限公司;D-半乳糖,上海化工试剂有限公司;ABTS、芦丁、异槲皮苷、紫云英苷、槲皮素系列标准品,北京索莱宝科技有限公司;FL-3大孔树脂, 上海一基生物有限公司;无水乙醇, 重庆川东化工(集团)有限公司。
Ultimate 3 000型高效液相色谱系统、Varioskan LUX型多功能酶标仪,美国Thermo Scientific;KQ-250ES型超声波清洗器,昆山市超声仪器;EYELA N-1 001S型旋转蒸发仪,日本东京理化器械株式会社;Centrifuge 5 418R型冷冻离心机,德国Eppendorf公司;FLUOstar OPTIMA型荧光酶标仪,德国BMG公司;UPH-II-20T型 纯水机,四川优普超纯科技有限公司;HHW21·600AII 水浴锅,天津市泰斯特仪器有限公司;A0-80A型 干燥箱,施都凯仪器设备(上海)有限公司;BSA124S型 电子天平,赛多利斯科学仪器(北京)有限公司。
1.2 荷叶黄酮提取物制备
以荷叶为原料,采用乙醇水浴浸提对其中总黄酮进行提取[7]。荷叶经粉碎、干燥然后研磨成细粉。在粉末样品中加入20倍体积的体积分数为60%乙醇溶液,在水浴中提取2次(60 ℃/1 h),并将滤液合并。提取物用FL-3大孔树脂过滤,用体积分数为60%乙醇洗脱至无色,用旋转蒸发器蒸发[8]。去除水和乙醇;然后将得到的样品冷冻干燥,将样品封存于离心管中,放置于4 ℃环境中,备用。
1.3 体外抗氧化实验
1.3.1 DPPH自由基清除实验
DPPH自由基是以氮为中心的合成的稳定自由基,结构简单,反应条件易控制,已广泛应用于各种物质提取物或纯化合物的抗氧化活性的评价[9]和筛选中。
将0.5 mL不同质量浓度(0.2,0.4,0.6 mg/mL)的荷叶黄酮提取物添加到2 mL的DPPH乙醇溶液(0.309 mmol/L,该浓度通过预实验得到)中,混合后在室温、黑暗条件下静置30 min。在517 nm处测定溶液的吸光度,然后扣除样品和背景吸光度。以抗坏血酸(0.2 mg/mL)为阳性对照,每组3个平行[10]。DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:Ae,DPPH工作液+荷叶黄酮样液OD值;Af,空白校正,荷叶黄酮样液+乙醇OD值;Ag,空白对照,DPPH工作液+乙醇OD值。
1.3.2 ABTS阳离子自由基清除实验
ABTS经活性氧氧化后生成稳定的蓝绿色ABTS阳离子自由基,向其中加入被测物质,如果该物质中存在抗氧化成分[11],则该物质会与ABTS阳离子自由基发生反应而使反应体系褪色。
ABTS阳离子自由基工作液配制。A液:将3 mg ABTS加入0.8 mL双蒸水中,充分混合使其完全溶解;B液:将1 mg过硫酸钾加入1.5 mL双蒸水中,混合溶解;各取A液、B液0.2 mL,混合,黑暗放置氧化12 h,用无水乙醇稀释至A734的OD值为(0.7±0.02)[12]。结果表明,20倍稀释时可达要求。
取5 mL具塞试管,加入1 mL的ABTS自由基工作液,加入0.4 mL不同质量浓度(0.03,0.04,0.05 mg/mL)的荷叶黄酮提取物,补齐溶剂,黑暗放置30 min,于734 nm处测定OD值,然后扣除样品和背景吸光度。以抗坏血酸(0.2 mg/mL)为阳性对照,每组3个平行[13]。ABTS自由基清除率计算如公式(2)所示:
ABTS自由基清除率![]()
(2)
式中:Ai,ABTS工作液+荷叶黄酮样液OD值;Aj,空白校正,荷叶黄酮样液+乙醇OD值;Ao,空白对照,ABTS工作液+乙醇OD值。
1.4 动物实验
1.4.1 动物
40只昆明小鼠(6周龄,雄性),重庆医科大学实验动物中心。小鼠被安置在恒温(25±2)℃和相对湿度(50±5)%的控制设备中,光照/黑暗周期为12/12 h,灌胃期间可以自由地获得标准小鼠的饮食和水。每隔3 d更换1次垫料,光照充足。
1.4.2 小鼠肝损伤模型的诱导
小鼠适应环境1周后,分为4组(正常组、模型组、低剂量组、高剂量组),每组10只,以研究荷叶黄酮对D-半乳糖诱导的衰老模型的改善作用。所有组均正常饮食、饮水(2~6周);正常组不给予D-半乳糖,另外3组小鼠腹腔注射D-半乳糖120 mg/(kg·d)[14],同时低剂量组小鼠口服250 mg/(kg·d)荷叶黄酮,每日1次。高剂量组小鼠口服500 mg/(kg·d)荷叶黄酮,每日1次。通过预实验证明荷叶黄酮的剂量范围对小鼠无任何毒性作用。本研究经重庆市功能性食品协同创新中心伦理委员会批准实施(20200630B)。
1.4.3 样本的收集
6周后,最后1次灌胃并注射D-半乳糖,小鼠禁食18 h后处死。迅速分离肝脏,切除周围脂肪和结缔组织,用生理盐水清洗残余血液,准确称量器官质量,并做好记录。部分肝脏被固定在体积分数为10%福尔马林溶液中以制作切片。剩余组织液氮预冻后储存在-80 ℃冰箱以便后续实验。
1.4.4 荷叶黄酮对小鼠肝损伤细胞的MDA、SOD、GSH-Px、NO及GSH含量的影响
肝脏置冰生理盐水中洗净血液,用滤纸吸去水分称重剪碎,按照肝脏组织质量∶体积(g∶mL)=1∶9的比例加入质量分数为0.9%的生理盐水,冰水浴条件下机械匀浆,制备成质量分数为10%的匀浆液,4 000 r/min离心10 min,取上清液[15]按照相关试剂盒说明书测定肝组织细胞匀浆中MDA、SOD、NO、GSH-Px、GSH的含量。
1.4.5 小鼠肝脏组织中细胞因子的测定
取1.3.4中备用的匀浆液,按照酶联免疫吸附试剂盒说明书,测定细胞因子IL-6、IL-10、IL-1β、TNF-α的水平。
1.5 HPLC分析荷叶黄酮的主要有效成分
目前,荷叶中黄酮类化合物检测多采用紫外可见光光度法[16],但是该法适用于定量但无法分析黄酮类化合物的具体成分,为了解决该法无法定性以及定量不准确的缺点,采用HPLC法测定荷叶中黄酮类[17]的化合物,以此分析荷叶中具体黄酮类成分[18]。
(1)标准品溶液的配制。精密称取适量的芦丁[19]、紫云英苷[20]、异槲皮苷、槲皮素对照品,用甲醇溶液配制成质量浓度为1.5、1、2.8、1.3 mg/mL的标准品溶液。分别精密吸取0.05 mL,再用甲醇配制成混合标准品溶液。
(2)样品溶液的配制。精密称取20 mg荷叶黄酮提取物粉末于10 mL容量瓶中,再加入1 mL DMSO溶液,混匀30 s,用0.22 μm滤膜过滤至棕色小瓶中,待测。
(3)色谱条件。色谱柱:Accucore-C18(5 μm,4.6 mm×250 mm);流动相A为体积分数为0.5%乙酸水溶液;流动相B为乙腈;流速1.2 mL/min;柱温25 ℃;检测波长225 nm;进样体积10 μL;按照表1进行梯度洗脱。
表1 HPLC流动相梯度洗脱程序
Table 1 Gradient elution procedure of HPLC mobile phase

洗脱时间/min流动相A/%流动相B/%01090309010359010401090
1.6 方法学考察
(1)标准曲线的测定。精密量取标准品溶液,置于色谱瓶中,分别进样2、4、6、8、10 μL,按照1.5的色谱条件进行测定。以进样量(μg)为横坐标(x),以样品峰面积为纵坐标(y)进行线性回归。
(2)重现性实验。精密称取样品,按照1.5的方法配制成2 mg/mL的样品溶液,过滤,用移液枪吸取1 mL样品溶液,置于色谱样品瓶中,重复进样6次,每次进样10 μL,并按照1.5中的色谱条件进行测定,计算6次峰面积的相对标准偏差(relative standard deviation,RSD)值。
(3)回收率实验。精密称取荷叶黄酮试样,按照1.5的方法配制成2 mg/mL的样品溶液,取1 mL样品液于10 mL容量瓶中,用体积分数50%甲醇定容至10 mL。分别取1.5芦丁、紫云英苷、异槲皮苷、槲皮素标准品溶液50 μL于色谱样品瓶中,再分别加入0.5 mL样品溶液。按照1.5中的色谱条件进行测定,计算回收率。
1.7 数据处理
通过SPSS 20.0统计软件分析数据。所有实验数据重复3次,结果表示为平均值±标准偏差(standard deviation,SD)。采用Duncan多重范围检验的单因素方差分析(analysis of variance,ANOVA)对实验结果进行分析,P<0.05被认为具有统计学意义。
2 结果与分析
2.1 荷叶黄酮体外抗氧化实验结果
在0.2、0.4和0.6 mg/mL质量浓度下,评估了荷叶黄酮对DPPH自由基的清除能力。自由基清除活性值分别为19.4%、50.9%、93.1%(图1)。DPPH自由基是一种以氮为中心,十分稳定的自由基,其稳定性主要来自共振稳定作用以及3个苯环的空间障碍[21],而使其夹在中间的氮原子上的不成对电子不能发挥其应有的电子成对作用。DPPH自由基乙醇溶液呈紫色,最大吸收波长为517 nm,如果有其他物质提供1个电子使此孤电子被配对,吸收能力消失或者减弱,导致溶液颜色变浅,在517 nm处的吸光度变小,其变化程度与自由基清除程度呈线性关系。不同浓度荷叶黄酮清除DPPH自由基的能力见图1。随着荷叶黄酮浓度的增加,对DPPH自由基的清除能力逐渐增强,说明荷叶黄酮提取物对DPPH自由基清除能力与其浓度存在明显的剂量-效应关系。荷叶黄酮的清除能力与其中含有的抗氧化活性成分有关。
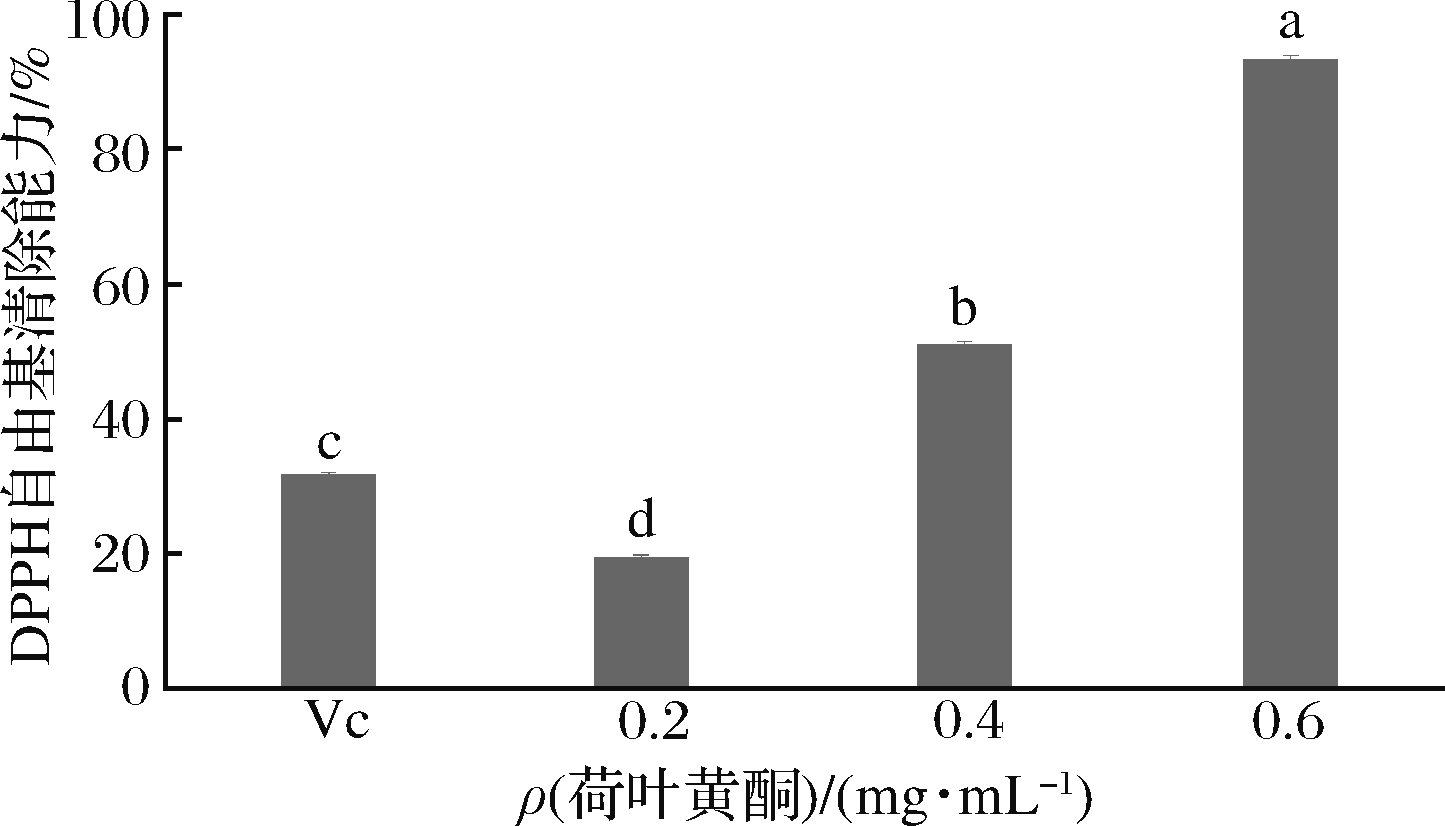
图1 不同浓度荷叶黄酮对DPPH自由基的清除率
Fig.1 DPPH free radical scavenging rates of flavonoids from lotus leaf at different concentrations
注:不同小写字母表示差异显著(P<0.05)(下同)
如图2所示,在质量浓度为0.03~0.05 mg/mL,荷叶黄酮提取物对ABTS自由基清除率在48.6%~92.3%,与维生素C对照组(31.6%)有显著差异(P<0.05)。综上,清除率随浓度的增加而增强,表明荷叶黄酮提取物对这2种自由基的清除能力具有剂量依赖关系。

图2 不同浓度荷叶黄酮对ABTS阳离子自由基的清除率
Fig.2 ABTS cation ion free radical scavenging rates of flavonoids from lotus leaf at different concentrations
当自由基数量超过抗氧化系统的承受范围后,会攻击机体细胞获得电子以保持自身的稳定性,对细胞的构象和功能造成损害。为了保护身体免受自由基损伤,人类可以通过增强自身抗氧化系统[22]和摄入外源抗氧化剂[23]来抵抗机体的氧化应激。
2.2 器官指数
由图3可知,小鼠体重未观察到明显的差异变化。器官系数可以直接反映器官的结构变化,间接反映器官功能的变化[24]。因此,观察小鼠器官系数的变化对判断小鼠衰老具有重要的参考价值。与正常组比较,衰老模型肝组织系数有一定程度的下降(表2)。不同剂量的荷叶黄酮治疗后,肝脏组织的系数在一定程度上有所增高,小鼠器官退化延迟,说明荷叶黄酮可以拮抗小鼠肝组织萎缩。与正常组相比,模型组、低剂量组和高剂量组P值均大于0.05,说明测定结果无显著性差异。

图3 小鼠体重变化
Fig.3 Weight change of mice
表2 不同浓度荷叶黄酮对D-半乳糖所致衰老小鼠 器官系数的影响 单位:mg/g
Table 2 Effects of flavonoids in lotus leaf at different concentrations on organ coefficients of D-galactose-induced aging mice
器官正常模型250 mg/(kg·d)500 mg/(kg·d)肝脏39.46±1.5838.64±0.7641.04±4.4042.22±2.96
注:器官系数/(mg·g-1)=器官质量(mg)/体重(g)
2.3 组织学分析
肝是最大的腺体,它产生的胆汁经胆管输入十二指肠,参与脂类物质的消化,肝列为消化腺。肝细胞是一种高度分化并具有多种功能的细胞,胞质内各种细胞器丰富而发达,并含有糖原、脂滴等内含物。小鼠可将刚消化的食物中的糖原快速存储在小叶中央的肝细胞中,使胞浆渗透压增高,增加水分摄入,胞浆因而变得透明。这是正常的变化,有时会被误称为“水变性”或“浊肿”[25]。观察结果表明,在小鼠衰老过程中,肝脏组织的形态也发生了变化。如图4所示,正常组肝细胞形态规则,大小和染色均匀,中央静脉结构正常[26],呈较为规则的圆形,肝窦、肝细胞和肝小叶结构正常[27],肝索排列有序、边界清晰。与正常组相比,模型组肝细胞排列不整齐,染色不均匀,中心静脉性状不规则,肝索排列杂乱无序,界限不清。此外,肝窦有明显扩张,细胞质疏松,细胞呈球囊样改变,炎性细胞浸润,细胞坏死[28]。分别用250、500 mg/kg荷叶黄酮进行治疗后,小鼠肝细胞再次排列有序,形态略有变化,肝细胞水肿、炎症有所缓解。由此可见,荷叶黄酮可以减缓细胞和组织结构的破坏程度,延缓肝细胞的衰老。

图4 荷叶黄酮对D-半乳糖诱导的衰老小鼠肝脏形态的影响
Fig.4 Effects of lotus leaf flavone on liver morphology in aged mice induced by D-galactose
2.4 小鼠肝损伤细胞中NO、MDA、SOD、GSH-Px及GSH含量变化
NO为血管内皮舒张因子[29],在生物体内作为反应性极强的自由基,兼有信使和神经递质作用,同时又是效应分子,在体内具有广泛的生理作用。NO本身半衰期极短,血液中的NO主要由血管内皮细胞、血管平滑肌细胞、血小板、巨噬细胞等产生以硝酸盐及亚硝酸盐的形式存在,通过其浓度可以间接测知NO浓度。
机体通过酶系统与非酶系统产生氧自由基,后者能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化,并因此形成MDA等脂质过氧化物。因而测试MDA的含量常常可以反应机体内脂质过氧化[30]的程度,间接地反映出细胞损伤的程度。通过黄嘌呤及黄嘌呤氧化酶反应系统产生![]() 后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,用可见光分光光度计测其吸光度。当被测样品中含SOD时,则对
后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,用可见光分光光度计测其吸光度。当被测样品中含SOD时,则对![]() 有专一性的抑制作用,使形成的亚硝酸盐减少,比色时测定管的吸光度值低于对照管,通过公式计算可求出被测样品中的SOD活力。MDA的测定常常与SOD的测定相互配合,SOD的酶活力间接反映了机体清除氧自由基的能力,而MDA含量又间接反映了机体细胞受自由基攻击的程度,通过SOD与MDA的结果分析有助于医学[31]、生物学、药理及工农业生产的发展。
有专一性的抑制作用,使形成的亚硝酸盐减少,比色时测定管的吸光度值低于对照管,通过公式计算可求出被测样品中的SOD活力。MDA的测定常常与SOD的测定相互配合,SOD的酶活力间接反映了机体清除氧自由基的能力,而MDA含量又间接反映了机体细胞受自由基攻击的程度,通过SOD与MDA的结果分析有助于医学[31]、生物学、药理及工农业生产的发展。
GSH是一种低分子清除剂,它可以清除![]() 脂质氢过氧化物。GSH是谷氨酸、甘氨酸和半胱氨酸组成的三肽,是组织中主要的非蛋白质的化合物,并且是GSH-Px和GST的底物,为这2种酶分解过氧化物所必须,研究证明,GSH也可使维生素E恢复到还原态,缺乏或耗竭GSH会促使许多化学物质或环境因素产生中毒现象或加重其中毒,这可能与增加氧化损伤有关,因而GSH含量是衡量机体抗氧化能力的因素。
脂质氢过氧化物。GSH是谷氨酸、甘氨酸和半胱氨酸组成的三肽,是组织中主要的非蛋白质的化合物,并且是GSH-Px和GST的底物,为这2种酶分解过氧化物所必须,研究证明,GSH也可使维生素E恢复到还原态,缺乏或耗竭GSH会促使许多化学物质或环境因素产生中毒现象或加重其中毒,这可能与增加氧化损伤有关,因而GSH含量是衡量机体抗氧化能力的因素。
GSH-Px是机体内广泛存在的重要的催化H2O2分解的酶。它特异地催化还原型GSH对H2O2的还原反应,可以起到保护细胞膜结构和功能完整的作用。GSH-Px的活性中心是硒半胱氨酸,硒是GSH-Px的必需部分,1 g分子酶含4 g分子硒。因此,测定GSH-Px的酶活力可以作为衡量机体硒水平的一项生化指标。
如图5所示,不同质量浓度(250、500 mg/kg)荷叶黄酮提取物处理后,细胞中GSH-Px、GSH、SOD的含量明显提高(P<0.05),细胞中NO和MDA含量有所降低(P<0.01),高剂量荷叶黄酮提取物效果最好。
2.5 细胞因子IL-6、IL-10、TNF-α和IL-1β的浓度变化
如图6所示,与正常组相比,模型组(D-半乳糖诱导)中促炎因子TNF-α、IL-6和IL-1β的表达增加(P<0.05),特别是TNF-α的增加,可促进T细胞产生各种炎症因子,它是各种信号通路的关键环节。相反,抗炎因子IL-10的表达降低(P<0.05)。与模型组相比,低剂量组250 mg/(kg·d)和高剂量组500 mg/(kg·d)对肿瘤坏死因子TNF-α、IL-6和IL-1β均有下调作用,但对IL-10有上调作用,高剂量组的影响更显著(P<0.05)。综上,荷叶黄酮能降低小鼠促炎因子的表达,促进抗炎因子的表达。

a-MDA;b-NO;c-SOD;d-GSH;e-GSH-Px
图5 荷叶黄酮对损伤小鼠肝细胞内MDA、NO、SOD、GSH、GSH-Px含量影响
Fig.5 Effects of lotus leaf flavonoids on MDA, NO, SOD, GSH and GSH-Px contents in hepatocytes of damaged mice
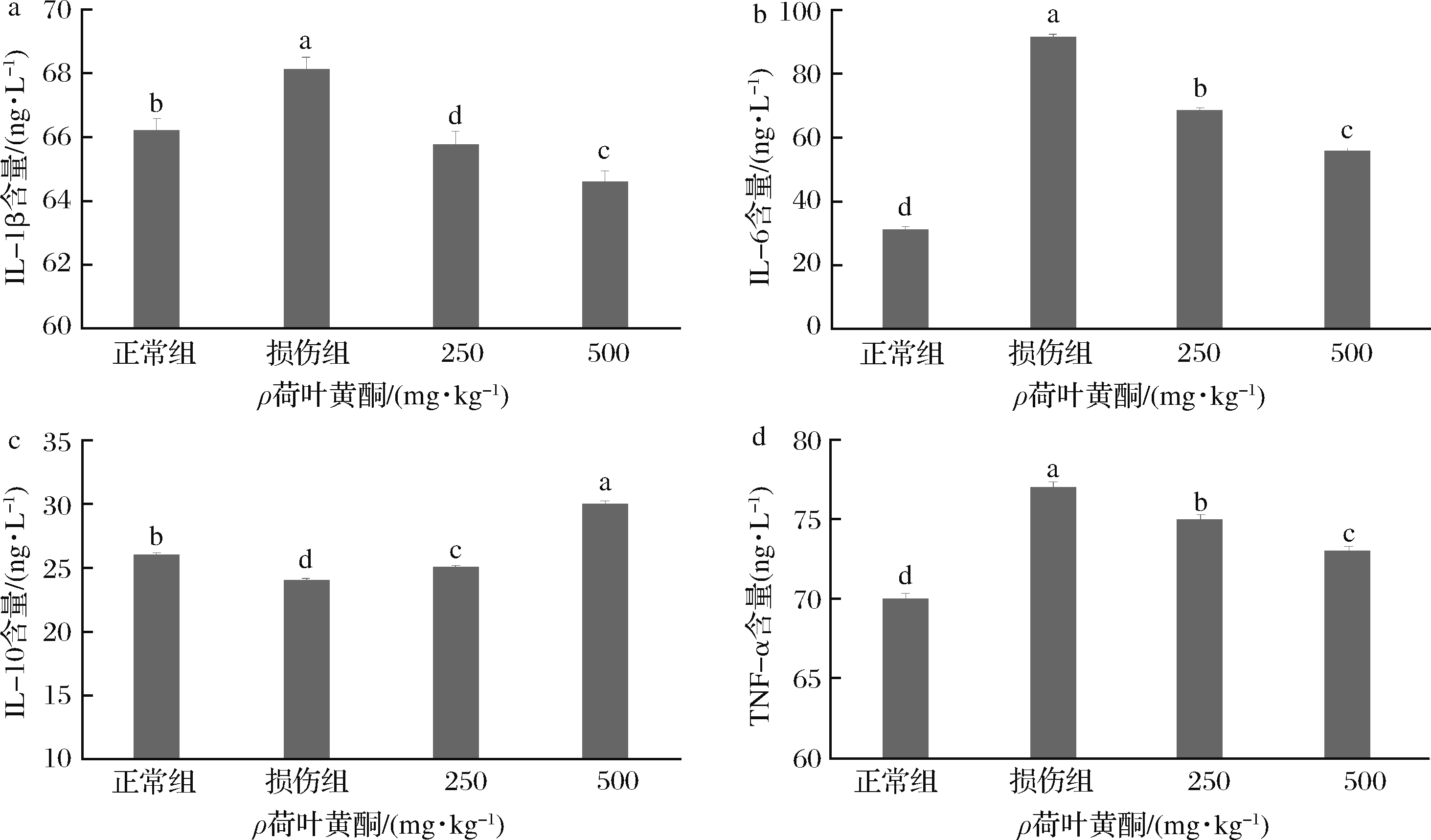
a-IL-1β;b-IL-6;c-IL-10;d-TNF-α
图6 荷叶黄酮对损伤小鼠细胞因子IL-6、IL-10、IL-1β及TNF-α含量的影响
Fig.6 Effects of lotus leaf flavonoids on IL-6,IL-10,IL-1β and TNF-α contents in hepatocytes of damaged mice
2.6 荷叶黄酮中主要成分的液相色谱分析
2.6.1 流动相的选择
实验选择乙腈-体积分数0.5%乙酸溶液作为流动相,该条件下芦丁、紫云英苷、异槲皮苷、槲皮素等洗脱效果最好,并且添加体积分数0.5%乙酸可以有效减少拖尾现象。
2.6.2 荷叶黄酮的化合物种类分析结果
荷叶黄酮样品的UV信号色谱图见图7,根据对比保留时间,荷叶中的黄酮类化合物有芦丁、紫云英苷、异槲皮苷、槲皮素。黄酮类的混合UV信号色谱图见图8,芦丁、紫云英苷、异槲皮苷、槲皮素在255 nm处分离效果较好,峰形也较好。
2.6.3 线性关系
通过实验可知,芦丁、异槲皮苷、紫云英苷、槲皮素的线性方程如表3,以进样量(μg)为横坐标(x),以样品峰面积为纵坐标(y)进行线性回归。
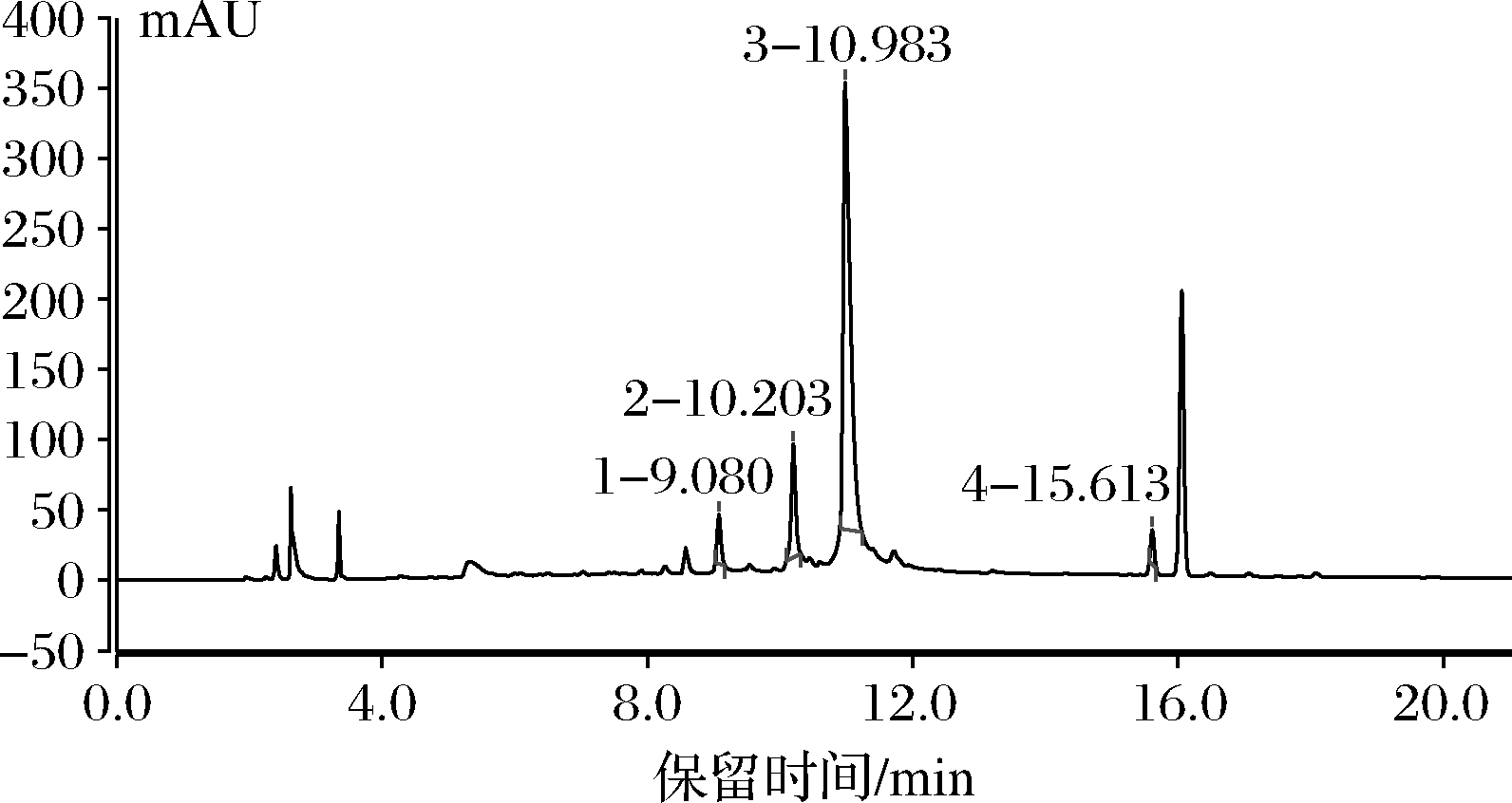
图7 荷叶黄酮样品溶液
Fig.7 Lotus leaf flavonoid sample solution

图8 芦丁、异槲皮苷、紫云英苷和槲皮素混合标准品溶液
Fig.8 Rutin, isoquercitrin, astragalin and quercetin mixed standard solution
表3 线性关系实验结果
Table 3 Experimental results for linear relationships

标准品线性方程拟合度R2芦丁 y=18.181x-0.152 50.998 4异槲皮苷y=34.005x-0.861 60.999 4紫云英苷y=22.657x+0.110 40.998 6槲皮素 y=30.988x-1.380 30.997 1
结果表明芦丁、异槲皮苷、紫云英苷、槲皮素的线性方程拟合度R2分别为0.998 4、0.999 4、0.998 6、0.997 1,呈现出良好的线性关系。
2.6.4 荷叶中黄酮类化合物的含量
由图7、图8以及表3可知,荷叶中的黄酮类化合物为芦丁、异槲皮苷、紫云英苷、槲皮素,其质量分数分别为12.401 4、14.778 0、111.513 9、5.673 8 mg/g,紫云英苷的含量较高,其次为异槲皮苷、芦丁、槲皮素。
2.6.5 加标回收率
由表4可知,芦丁、异槲皮苷、紫云英苷、槲皮素的加标回收率分别为103.58%、92.93%、110.89%、90.35%。说明高效液相色谱法对荷叶黄酮类化合物的质量控制有较好的准确性。
表4 回收率实验结果
Table 4 Recovery experimental results

测定对象样品峰面积加标峰面积回收率/%芦丁 4.356 9195.422 8103.58异槲皮苷9.188 990.073 092.93紫云英苷50.641 875.821 6110.89槲皮素 2.136 124.241 790.35
2.6.6 重现性实验
在重现性实验中,芦丁、异槲皮苷、紫云英苷、槲皮素的峰面积RSD值分别是2.28%、0.12%、2.34%、0.84%,表明此方法重现性良好。
3 结论
本实验初步分析了荷叶中潜在的生物活性成分,并对这些生物活性成分的体外抗氧化作用以及体内改善D-半乳糖诱导的小鼠肝损伤进行了评价。结果表明,荷叶黄酮对DPPH、ABTS阳离子自由基具有显著的清除作用,同时还能增强小鼠肝组织SOD、GSH-Px、GSH活性,降低MDA和NO含量。酶联免疫法实验结果表明,荷叶黄酮还可以抑制促炎因子TNF-α、IL-6和IL-1β的表达,促进抗炎因子IL-10的表达。利用高效液相色谱对其中的活性成分进行了分析,从中检测到芦丁、异槲皮苷、紫云英苷、槲皮素4种黄酮类化合物,芦丁及其衍生物具有抗氧化活性和广泛药理活性[32],异槲皮苷具有抗炎、抗氧化等生物活性,具有较大的应用价值[33],紫云英苷是一种天然的黄酮类化合物,具有多种生物活性药理作用[34],槲皮素因其生物活性强,药理作用广泛,具有抗肿瘤、血糖调节等多种作用[35]。这些黄酮类活性成分的存在可能是荷叶表现出诸多药理作用的主要原因。荷叶黄酮作为天然植物类黄酮化合物,对人类机体具有多种生理活性,具有较大的开发和应用前景。
[1] 柴金珍,蒋丽,韦经强,等.荷叶降脂、抗氧化作用研究进展[J].食品研究与开发,2016,37(8):209-212.
CHAI J Z,JIANG L,WEI J Q,et al.Research progress of fall fat and antioxidation effect of the lotus leaf[J].Food Research and Development,2016,37(8):209-212.
[2] 杨冀艳. 荷叶黄酮提取、分离及其对葡萄糖激酶作用的研究[D].南昌:南昌大学,2008.
YANG J Y.Study on the extraction,separation of flavonoids in lotus leaf and its enzymatic activity of glucokinase[D].Nanchang:Nanchang University,2008.
[3] 李兴太, 纪莹.线粒体氧化应激与天然抗氧化剂研究进展[J].食品科学,2015,36(7):268-277.
LI X T,JI Y.Recent advances in mitochondrial oxidative stress and natural antioxidants[J].Food Science,2015,36(7):268-277.
[4] 林洁华, 黄闰月,江泽波,等.补肾强督治偻方对脂多糖刺激的小鼠RAW264.7细胞炎性细胞因子表达的影响[J].广州中医药大学学报,2015,32(2):285-289.
LIN J H,HUANG R Y,JIANG Z B,et al.Effect of Bushen Qiangdu Zhilyu decoction on lipopolysaccharide-induced inflammatory cell factors expression in RAW264.7 cells[J].Journal of Guangzhou University of Traditional Chinese Medicine,2015,32(2):285-289.
[5] 秦亚东, 钟正灵,汪荣斌,等.白芍多糖对D-半乳糖胺/脂多糖诱导小鼠急性肝损伤的保护作用[J].中国临床药理学与治疗学,2015,20(8):854-858.
QIN Y D,ZHONG Z L,WANG R B,et al.Protective effect of Paeoniae radix Alba polysaccharide on acute liver injury induced by D-Gal N/LPS in mice[J].Chinese Journal of Clinical Pharmacology and Therapeutics,2015,20(8):854-858.
[6] 丁云录, 张莲珠,赵昱玮,等.卷柏总黄酮对D-半乳糖衰老模型小鼠的影响[J].中国老年学杂志,2016,36(2):293-294.
DING Y L,ZHANG L Z,ZHAO Y W,et al.Effects of total flavonoids of Selaginella tamariscina (P.Beauv.) Spring on of D-galactose aging mice[J].Chinese Journal of Gerontology,2016,36(2):293-294.
[7] 蔡敏, 李长春,毕宏光,等.荷叶黄酮的提取和纯化工艺研究[J].湖北农业科学,2015,54(22):5 691-5 693;5 697.
CAI M,LI C C,BI H G,et al.Study on extraction and purification process of flavonoids from lotus leaf[J].Hubei Agricultural Sciences,2015,54(22):5 691-5 693;5 697.
[8] 陈舒婉, 吴建国,吴锦忠,等.多指标单因素试验优选荷叶黄酮苷的提取工艺[J].海峡药学,2019,31(3):28-31.
CHEN S W,WU J G,WU J Z,et al.Optimization of extraction process for flavonoid glycosides from lotus leaf by multi-index single factor test[J].Strait Pharmaceutical Journal,2019,31(3):28-31.
[9] 徐彬人, 黄林艳,杨翠萍,等.淡豆豉异黄酮的提取分离及对DPPH自由基清除能力的研究[J].贵州中医药大学学报,2020,42(3):91-94;103.
XU B R,HUANG L Y,YANG C P,et al.The isoflavone extraction and separation of SSP and their capacity of DPPH radical scavenging[J].Journal of Guizhou University of Traditional Chinese Medicine,2020,42(3):91-94;103.
[10] ZHAO X,WANG Q,LI G J,et al.In vitro antioxidant,anti-mutagenic,anti-cancer and anti-angiogenic effects of Chinese Bowl tea[J].Journal of Functional Foods,2014,7:590-598.
[11] 包晓玮, 李建瑛,任薇,等.沙棘多糖对D-半乳糖致衰老小鼠的抗氧化作用[J].食品工业科技,2020,41(4):293-297;306.
BAO X W,LI J Y,REN W,et al.Antioxidant effects of Hippophae rhamnoides polysaccharide on aging mouse induced by D-galactose[J].Science and Technology of Food Industry,2020,41(4):293-297;306.
[12] SRIDHAR K,CHARLES A L.In vitro antioxidant activity of Kyoho grape extracts in DPPH and ABTS assays:Estimation methods for EC50 using advanced statistical programs[J].Food Chemistry,2019,275:41-49.
[13] ZHANG H,YANG Y F,ZHOU Z Q.Phenolic and flavonoid contents of mandarin (Citrus reticulata Blanco) fruit tissues and their antioxidant capacity as evaluated by DPPH and ABTS methods[J].Journal of Integrative Agriculture,2018,17(1):256-263.
[14] 张梦思. 1、当归多糖拮抗D-半乳糖致大鼠脑衰老及机制的研究 2、当归多糖对衰老模型大鼠脾脏结构与功能的影响[D].重庆:重庆医科大学,2015.
ZHANG M S.1.Anti-aging effects of ASP and it’s mechanisms on brain aging 2.Effect of Angelica sinensis polysaccharide on the spleen structure and function of aging model rats[D].Chongqing:Chongqing Medical University,2015.
[15] 刘华, 薛娟,唐振球,等.关黄柏对对乙酰氨基酚诱导大鼠急性肝损伤的保护作用[J].中医药信息,2017,34(2):1-4.
LIU H,XUE J,TANG Z Q,et al.Protective effect of phellodendri amurensis cortex on acetaminophen-induced acute hepatic injury in rats[J].Information on Traditional Chinese Medicine,2017,34(2):1-4.
[16] 罗晓梅, 张吟,黄丹丹,等.紫外可见分光光度法测定无花果叶提取物中总黄酮的含量[J].中国药房,2015,26(15):2 111-2 113.
LUO X M,ZHANG Y,HUANG D D,et al.Content determination of total flavonoids in extracts from Ficus carica leaves by UV-visible spectrophotometry[J].China Pharmacy,2015,26(15):2 111-2 113.
[17] 梁佳文, 刘艾洁,马冰馨,等.高效液相色谱法同时测定荷叶中6种黄酮类成分[J].植物科学学报,2015,33(6):861-866.
LIANG J W,LIU A J,MA B X,et al.Simultaneous determination of six flavonoid compounds in lotus leaves by high performance liquid chromatography[J].Plant Science Journal,2015,33(6):861-866.
[18] 夏伯候, 周亚敏,皮胜玲,等.UPLC测定桑叶中抗氧化活性成分异槲皮苷、芦丁和紫云英苷的含量[J].中药材,2016,39(3):586-589.
XIA B H,ZHOU Y M,PI S L,et al.UPLC determination of the contents of isoquercetin,rutin and astragalin in mulberry leaves[J].Journal of Chinese Medicinal Materials,2016,39(3):586-589.
[19] DA SILVA A B,CERQUEIRA COELHO P L,DAS NEVES OLIVEIRA M,et al.The flavonoid rutin and its aglycone quercetin modulate the microglia inflammatory profile improving antiglioma activity[J].Brain,Behavior and Immunity,2020,85:170-185.
[20] LI X,TANG Z C,FEI D Q,et al.Evaluation of the sedative and hypnotic effects of astragalin isolated from Eucommia ulmoides leaves in mice[J].Natural Product Research,2017,31(17):2 072-2 076.
[21] 袁园, 张潇,陈碧琼,等.草果总黄酮的提取及DPPH自由基清除活性研究[J].食品研究与开发,2017,38(15):63-68.
YUAN Y,ZHANG X,CHEN B Q,et al.Extraction method and DPPH radical scavenging activity of flavonoids from Amomum tsaoko[J].Food Research and Development,2017,38(15):63-68.
[22] 王新民. 人体抗氧化防御系统浅谈[J].卫生职业教育,2011,29(14):156-158.
WANG X M.Human antioxidant defense system[J].Health Vocational Education,2011,29(14):156-158.
[23] CHRISTIAN G A,ANA L,STEPHANIE S T,et al.Effect of natural exogenous antioxidants on aging and on neurodegenerative diseases[J].Free Radical Research,2013,47(6-7):451-462.
[24] 崔立坤, 姚静,李军,等.槐白皮水提物对免疫抑制小鼠的免疫作用[J].中国现代应用药学,2019,36(19):2 397-2 401.
CUI L K,YAO J,LI J,et al.Effects of Sophora japonica water extract on the immune functions of immunosuppressive mice[J].Chinese Journal of Modern Applied Pharmacy,2019,36(19):2 397-2 401.
[25] 陈克乐. 微囊藻毒素对人肝细胞系HL7702及小鼠肝组织胰岛素信号通路相关蛋白影响研究[D].杭州:浙江大学,2018.
CHEN K L.The effects of microcystin-LR on insulin signaling pathway both in HL7702 cell line and mouse liver[D].Hangzhou:Zhejiang University,2018.
[26] LI C,TAN F,YANG J J,et al.Antioxidant effects of Apocynum venetum tea extracts on D-galactose-induced aging model in mice[J].Antioxidants(Basel,Switzer land),2019,8(9):E381.
[27] 郑霖波, 白冬,虞舟,等.深海鲣鱼鱼油对D-半乳糖致衰老模型小鼠抗衰老的作用[J].食品科学,2019,40(5):202-206.
ZHENG L B,BAI D,YU Z,et al.Protective effect of Skipjack tuna oil against D-galactose-induced aging in mice[J].Food Science,2019,40(5):202-206.
[28] 李为, 刘娟,刘干,等.橙皮苷对急性化学性肝损伤小鼠的保护作用及机制[J].安徽医科大学学报,2010,45(3):346-350.
LI W,LIU J,LIU G,et al.Protective effects and mechanisms of Hesperidin on acute chemical liver injuries in mice[J].Acta Universitatis Medicinalis Anhui,2010,45(3):346-350.
[29] 白晓彦, 王淼,伍会健.一氧化氮相关的内皮功能障碍与高血压[J].生命的化学,2014,34(6):744-748.
BAI X Y,WANG M,WU H J.Relationship between endothelial dysfunction and hypertension:Focus on nitric oxide[J].Chemistry of Life,2014,34(6):744-748.
[30] 于瀚, 钟相根,李耘州,等.褪黑素对肝内胆汁淤积大鼠肝组织NO、MDA、GSH及NADPH的影响[J].中国临床药理学与治疗学,2019,24(11):1 221-1 226.
YU H,ZHONG X G,LI Y Z,et al.Effects of melatonin on NO,MDA,GSH and NADPH expression in liver tissues of intrahepatic cholestasis rats[J].Chinese Journal of Clinical Pharmacology and Therapeutics,2019,24(11):1 221-1 226.
[31] LEPARA Z,LEPARA ![]() A,et al.Serum malondialdehyde (MDA) level as a potential biomarker of cancer progression for patients with bladder cancer[J].Romanian Journal of Internal Medicine,2020,58(3):146-152.
A,et al.Serum malondialdehyde (MDA) level as a potential biomarker of cancer progression for patients with bladder cancer[J].Romanian Journal of Internal Medicine,2020,58(3):146-152.
[32] 贾贵东, 杨建雄,王莉,等.芦丁与绿原酸协同抗氧化活性研究[J].陕西师范大学学报(自然科学版),2010,38(5):61-64.
JIA G D,YANG J X,WANG L,et al.Synergistic antioxidative activities of rutin and chlorogenic acid(CGA)[J].Journal of Shaanxi Normal University (Natural Science Edition),2010,38(5):61-64.
[33] 陈燕, 詹羽姣,李晨阳,等.异槲皮苷的生物活性研究进展[J].中国现代中药,2018,20(12):1 579-1 582;1 592.
CHEN Y,ZHAN Y J,LI C Y,et al.Research progressin biological activity of isoquercitrin[J].Modern Chinese Medicine,2018,20(12):1 579-1 582;1 592.
[34] 聂龙, 彭磊,李钰芳,等.紫云英苷生物活性及其机制的研究进展[J].热带农业科学,2020,40(6):64-70.
NIE L,PENG L,LI Y F,et al.Research advances in the biological activities and mechanism of Astragalin[J].Chinese Journal of Tropical Agriculture,2020,40(6):64-70.
[35] 杨颖, 王芸芸,蒋琦辰.槲皮素药理作用的研究进展[J].特种经济动植物,2020,23(5):24-28.
YANG Y,WANG Y Y,JIANG Q C.Advances in pharmacological effects of quercetin[J].Special Economic Animal and Plant,2020,23(5):24-28.