食品加工中蛋白与糖类之间的美拉德反应在赋予食品独特风味与色泽的同时,也会产生一些潜在有害产物,如反应中级阶段产生的1,2-二羰基化合物乙二醛(glyoxal,GO)会抑制细胞中DNA的合成,引起线粒体功能紊乱[1];甲基乙二醛(methylglyoxal,MGO)通过产生凋亡物质诱导细胞死亡[2];赖氨酸或精氨酸与GO、MGO反应生成的晚期糖基化终末产物(advanced glycation end products,AGEs)与AGEs受体结合,诱导机体发生氧化应激与炎症反应[3]。LEVINE等[4]发现,过多地摄入热加工的食品可导致糖尿病和肾病,并且诱发炎症,增强氧化应激,促进动脉粥样硬化的发生。传统调控烘焙食品美拉德反应产物中AGEs的形成非常依赖于产品及加工参数,成分(如前体含量、pH值和含水量)的任何变化或抑制剂的添加都会影响食品的质量[5]。然而,在许多食品中,对其进行加热是保持味道和外观及提高消费者接受度必不可少的过程。加工过程会对美拉德反应中有害产物含量产生影响,因此,必须进行产品配方的优化以控制有害产物的产生。
根据面粉中谷朊蛋白的含量可将面粉分为3类,高筋面(12%~15%)、中筋面(9%~12%)和低筋面(7%~9%),根据其特性差异,可将其用于蛋糕、面包、饼干等不同烘焙产品[6]。然而,谷朊蛋白是水冲洗生面团后去除淀粉和水溶性蛋白之后剩下的复杂黏性蛋白[7],其氨基酸组成较齐全,是营养丰富的植物性蛋白源,内含40%~50%麦醇溶蛋白和30%~40%麦谷蛋白[8],在面制品加工中起决定性作用,影响面制品的结构、口感、色泽等。谷朊蛋白对面制品的结构与性质方面的影响研究比较广泛,谷朊蛋白的薄膜成型性、黏弹性、延伸性、乳化性和吸水性等,使其具有明显的应用和加工优势[9-10]。GO和MGO是表征1,2-二羰基化合物的最广泛的标志物[11]。AGEs的种类繁多,结构复杂,尚未有明确组成。目前加工因素对以羧甲基赖氨酸作为非荧光性AGEs组分的影响已有广泛研究[12]。但是,对AGEs中其他代表物质如戊糖素、精胺嘧啶、甲酰苏阿糖吡咯等未见系统研究。因此类物质均具有自发荧光性,可以测定其荧光强度变化来相对定量地分析AGEs的含量,且该方法简单、有效[13]。
本文以不同谷朊蛋白含量的面粉为研究对象,并通过气相色谱法和荧光光谱法(λex/λem=340 nm/465 nm)测定模拟体系中GO、MGO和荧光性AGEs生成量,研究不同配料(淀粉、卵白蛋白、玉米油)对美拉德反应中的GO、MGO以及荧光性AGEs产生量的影响。探讨美拉德反应中产物形成的各种原料因素相关性,为小麦谷朊蛋白的应用以及小麦制品安全化加工生产提供理论依据。
1 材料与方法
1.1 材料与试剂
甲基乙二醛(40%水溶液)、乙二醛(40%水溶液)、邻苯二胺、小麦谷朊蛋白、卵白蛋白,美国Sigma-Aldrich公司;二氯甲烷、盐酸、十二烷基硫酸钠、β-巯基乙醇、三羟甲基氨基甲烷、2,3-丁二酮、淀粉、无水葡萄糖、NaH2PO4、Na2HPO4,均为分析纯,甲醇(色谱纯),上海国药集团化学试剂有限公司提供;玉米油,邦基(南京)粮油有限公司。
7820A气相色谱仪(配有HP-5色谱柱和FID检测器),美国Agilent公司;Infinite 200 Pro TECAN酶标仪,瑞士Tecan公司;CentriVap 离心浓缩仪,美国Labconco公司;Biofuge Stratos离心机、ULT1 386-3V超低温冰箱,美国Thermo公司;KQ-300B超声波清洗器,昆山超声仪器有限公司;SHZ-82 水浴振荡器,常州华怡仪器制造有限公司;AUY220分析天平,日本岛津公司;PHS-3C数字式pH计,上海三信仪表厂;XW-80A微型漩涡混合仪,上海沪西分析仪器厂有限公司;DHG-9140型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;FW177高速万能粉碎机,天津市泰斯特仪器有限公司;JEM-2100F 扫描电子显微镜,日本JEOL公司;CHIRASCAN 数字式圆二色谱仪,英国Applied Photophysics公司。
1.2 实验方法
1.2.1 美拉德反应产物的制备
模拟传统烘焙条件,按照下列不同原料配方进行样品制备[14],具体反应条件如下:将准确称量的各原料混合均匀,加入pH为7.0、浓度为0.05 mol/L的磷酸盐缓冲溶液保持体系pH一致,最终揉成圆形面团。置于160 ℃烤箱中,反应30 min。冷却至室温,粉碎后储存于-20 ℃备用。
1.2.2 不同原料配方对GO、MGO和荧光性AGEs的影响
将4种主要成分,依据烘焙食品的配方,尽量降低各组分的添加量,设定:2.0 g谷朊蛋白、0.3 g葡萄糖分别与不同质量的淀粉(8.0、12.0、16.0 g)、卵白蛋白(0.02、0.1、0.2、0.4 g)或玉米油(0.1、0.2、0.4、0.6 g)混合,以获得不同配比的原料配方。将上述混合物体系按1.2.1操作。研究不同原料配方对GO、MGO生成量及荧光特性AGEs的影响规律。
1.2.3 不同原料配方与GO,MGO和荧光性AGEs的相关性分析
根据预实验结果,选择淀粉添加量、卵白蛋白添加量、玉米油添加量以及两两交互作用作为考察的因素,每个因素3个水平,依据1.2.1操作。以GO和MGO生成量、AGEs的相对荧光强度为考察指标,采用L27(313)正交试验表得出最佳配方条件。
表1 正交试验因素与水平
Table 1 Factors and levels of orthogonal array design
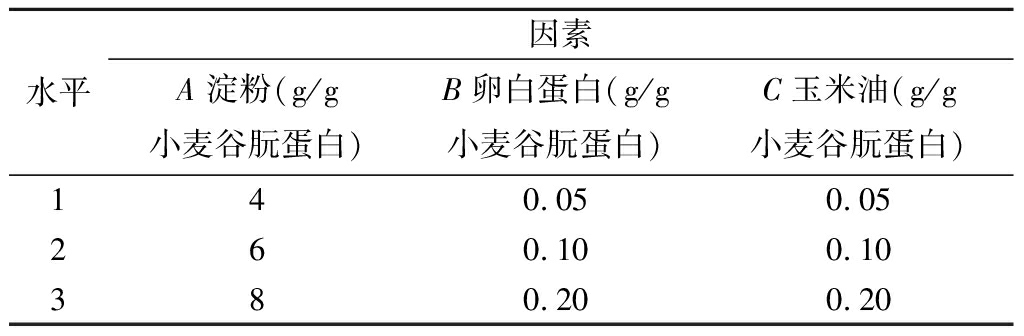
水平因素A 淀粉(g/g小麦谷朊蛋白)B卵白蛋白(g/g小麦谷朊蛋白)C玉米油(g/g小麦谷朊蛋白)140.050.05260.100.10380.200.20
1.2.4 GO和MGO含量的测定
参照王晨等[15]建立的气相色谱分析方法,以2,3-丁二酮为内标,邻苯二胺为衍生化试剂进行检测。样品用1 mL 100 mmol/L邻苯二胺衍生化10 min后,加入1 mL 2 mol/L乙醛混合均匀后置于60 ℃水浴锅内加热15 min,取出冰浴,加入2 mL二氯甲烷,超声波萃取15 min,重复萃取2次。氮吹后用二氯甲烷复溶,取1 μL进入GC检测。
待测样品前处理步骤如下:
称取0.500 0 g不同的样品于10 mL离心管中,加入5 mL蒸馏水,漩涡振荡混匀3 min,离心(8 000 r/min)30 min,保留上清液(A)。在剩余沉淀的离心管中加入5 mL体积分数为50%的甲醇水溶液,混匀后超声1 h,离心(8 000 r/min)30 min,保留上清液(B),将上清液A、B合并混匀,离心(8 000 r/min) 30 min,保留上清液。取2 mL上清液进行衍生化,根据上述方法,建立标准曲线。
MGO质量浓度在0~40 μg/mL有良好的线性关系,测得MGO的线性回归方程为:Y=0.031 13X-0.009 21(R2=0.999 6);GO的质量浓度在0~40 μg/mL有良好的线性关系,测得GO的线性回归方程为:Y=0.032 65X+0.012 98(R2=0.999 5)。
1.2.5 荧光性AGEs的含量
荧光性AGEs的含量测定参考SCHMITT等[16]的方法略有修改。称取0.250 0 g粉碎的样品,加入4.75 mL提取液(0.05% 吐温-20,1% 十二烷基硫酸钠,5% β-巯基乙醇,0.05 mol/L pH 7.4的Tris-HCl),混匀后置于30 ℃,100 r/min恒温振荡培养箱24 h。然后,离心(8 000 r/min)30 min,取200 μL上清液进行荧光光谱扫描,设置激发波长为340 nm,发射波长为380~465 nm,狭缝宽度为5 nm,测定上清液的荧光强度。经波长扫描可知在发射波长为425 nm处,待测样品具有最大吸收,因此,本研究在λex/λem=340 nm/465 nm处荧光值(荧光值以任意单位AU表示)表示样品中荧光性AGEs的含量。
1.2.6 扫描电镜分析
用导电胶将1 μg冷冻干燥好的样品粉末固定在载物台上,洗耳球轻吹掉粘结不牢固的粉末,用离子溅射仪对样品进行喷金处理,喷镀电流为3 mA,喷镀3次,每次时间为60 s,再用扫描电镜观察样品表面形貌。
1.2.7 圆二色谱分析
取1 mg冷冻样品于10 mL容量瓶中,溶解介质为0.01 mol/L NaOH溶液。样品溶液注入0.1 cm厚的椭圆形石英比色皿中,放入圆二色谱仪的比色光区,在 25 ℃和连续充氮的条件下,在远紫外区域(190~250 nm)扫描,速度为50 nm/min,狭缝为2 nm,光谱间隔1 nm,扫描3次取平均值。二级结构的含量按杨氏公式计算[17]。
1.2.8 数据分析与统计数据
分析采用ANOVA,通过SPSS Statistics 20.0 进行Duncan分析及交互分析。使用偏最小二乘回归分析不同原料之间的潜在相关性。每次实验重复3次,数据表示为平均值±标准偏差。
2 结果与分析
2.1 不同原料配方对GO,MGO和荧光性AGEs的影响
2.1.1 淀粉添加量对小麦谷朊蛋白中GO,MGO和荧光性AGEs形成的影响
谷朊蛋白-糖模拟体系中由不同淀粉添加量引起的GO,MGO和荧光性AGEs的含量变化如图1所示。GO的含量随着淀粉添加量的增加而显著降低(P<0.05),当m(谷朊蛋白):m(淀粉)=1∶4时,GO的生成量由14.40 μg/g降至6.75 μg/g,下降率约为53%。分析可能的原因是加热后淀粉为片状网状结构,颗粒表面存在一些不均匀的孔洞,增大了其包裹小分子物质的能力[18],不仅减少了谷朊蛋白与糖的接触机会,同时降低了初级代谢产物之间的反应机率,显著降低了美拉德反应程度,进而降低GO的生成量[19]。然而,当进一步增加淀粉的添加量(由1∶6增加至1∶8)时,GO的生成量没有显著性变化,分析可能是由于葡萄糖是小分子,而淀粉是生物大分子,具有一定的空间位阻不能够完全阻止谷朊蛋白与葡萄糖的反应,由此得出,随着淀粉添加量的增大,GO的生成量会逐渐趋于稳定[20]。
由图1可知,MGO的生产量随着淀粉的添加是显著降低的,尤其是当m(谷朊蛋白):m(淀粉)由1∶0增加为1∶4时,MGO的生成量由67.74 μg/g降至34.09 μg/g,下降率可达50%。且随着淀粉量的增加进一步降低,当m(谷朊蛋白):m(淀粉)=1∶8时,MGO产生量为11.85 μg/g,下降率可达82.5%。这与GO生成量的变化趋势有所不同,可能是因为除淀粉的空间位阻外,糊化后淀粉唯一的还原性末端还可以与谷朊蛋白的游离氨基发生美拉德反应,减少了参与和葡萄糖发生美拉德反应的谷朊蛋白的游离氨基,使反应产物中MGO的含量进一步减少。
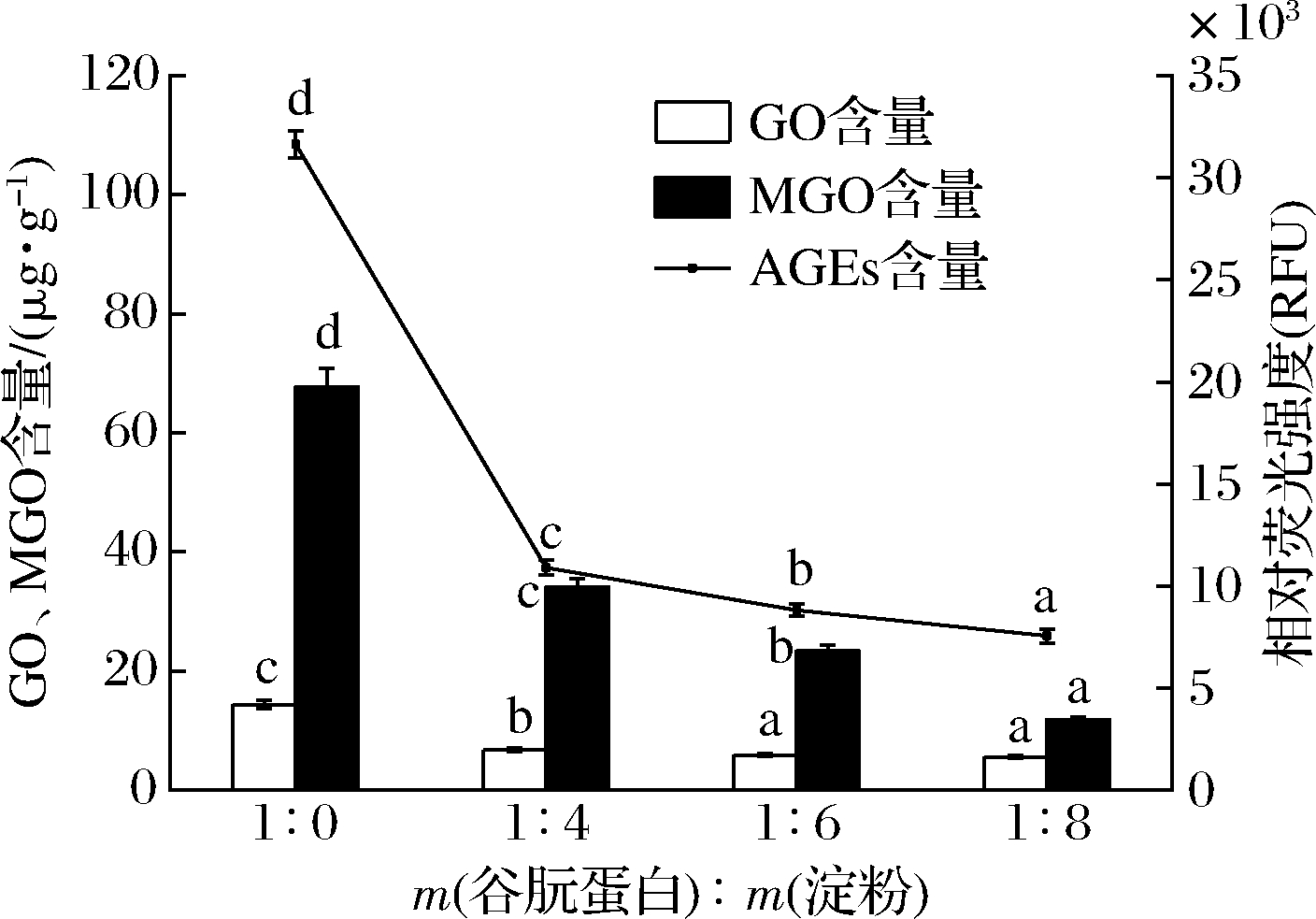
图1 淀粉对小麦谷朊蛋白-葡萄糖体系GO、MGO和 AGEs含量的影响
Fig.1 Effect of starch on the ontent of GO, MGO and AGEs in the gluten-glucose reaction system
注:不同小写字母表示数值间存在显著差异,P <0.05(下同)
随着淀粉添加量的增加,荧光性AGEs的含量显著降低,且当m(谷朊蛋白)∶m(淀粉)=1∶8时,下降率达到最大,约为76.2%,与MGO的变化趋势一致。由此,荧光性AGEs是美拉德反应的晚期终末产物的主要代表之一,它的主要前体物质为3-脱氧葡萄糖醛酮[21],虽然羧甲基赖氨酸(CML)的反应前体为GO,但是荧光性AGEs仍具有相似的变化趋势。有研究表明,在小麦面团中,谷朊蛋白通过二硫键和非共价键形成面筋网络结构[22],淀粉则填充在面筋网络结构之中,与谷朊蛋白间有相互作用,加固了蛋白的三维网状结构,减缓了蛋白糖基化的发生[23]。
2.1.2 卵白蛋白添加量对小麦谷朊蛋白中GO,MGO和荧光性AGEs形成的影响
根据烘焙制品常用配方选择卵白蛋白添加量为0.01~0.2 g/g。图2显示对照组的GO和MGO含量分别为19.52 μg/g和71.22 μg/g。随着卵白蛋白添加量增加,三类有害物的生成量有不同程度地降低。当卵白蛋白添加量在0.01~0.1 g/g时,MGO的生成量差异性不显著(P>0.05),推测其原因可能是加入少量的卵白蛋白,主要增加面团的黏性,对MGO产生量无多大影响。在卵白蛋白添加量为0.05~0.2 g/g时,GO生成量没有显著性变化,可能是因为少量卵白蛋白的加入仅与谷朊蛋白在美拉德反应过程中形成竞争作用。
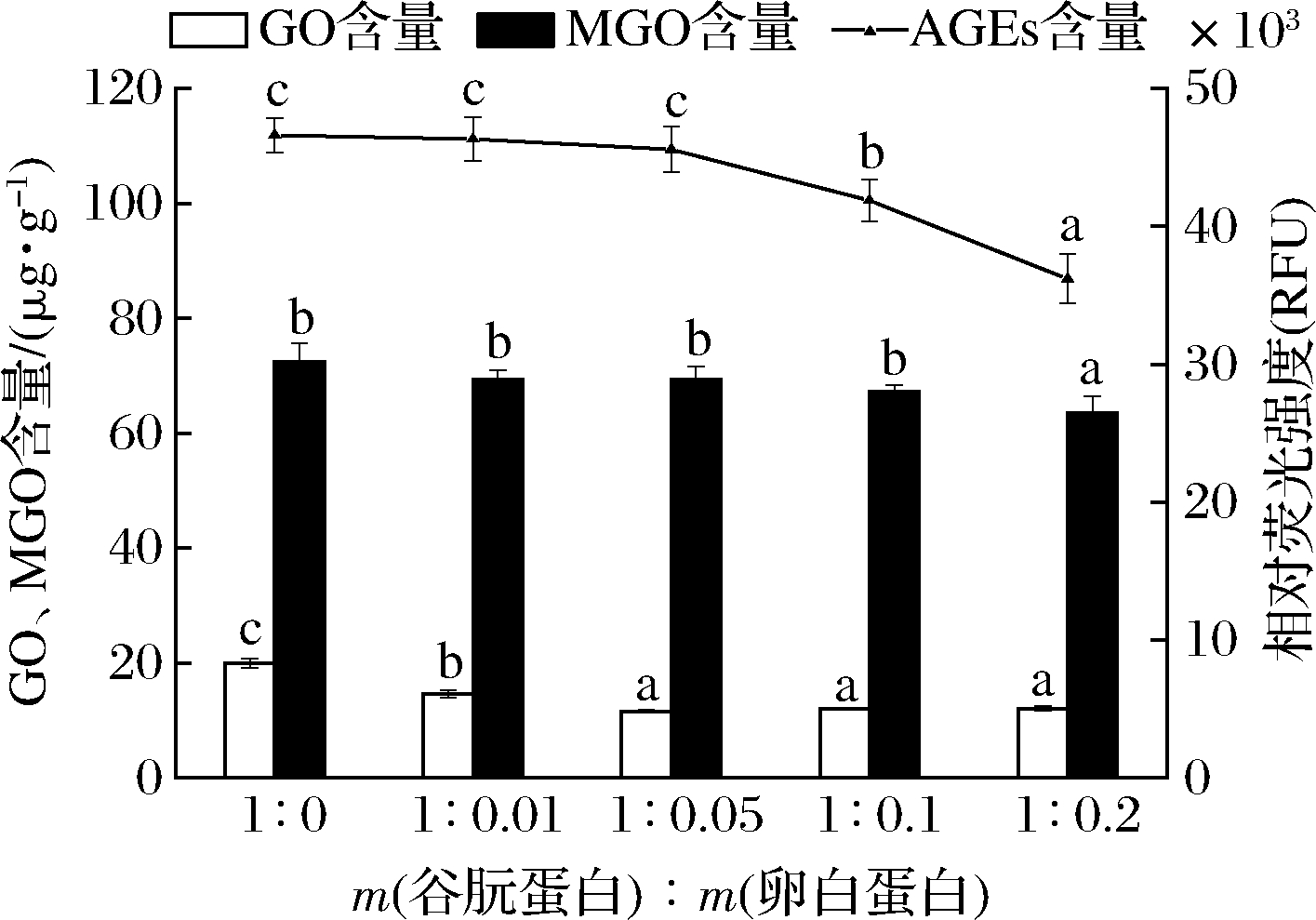
图2 卵白蛋白对小麦谷朊蛋白-葡萄糖体系GO、 MGO和AGEs含量的影响
Fig.2 Effect of ovalbumin on the content of GO, MGO and AGEs in the gluten-glucose reaction system
荧光性AGEs的产生量变化趋势与MGO变化趋势相似,推测该体系中产生的AGEs变化与中间产物MGO诱发的进一步糖基化反应相关。在卵白蛋白添加量为0.2 g/g时,荧光性AGEs降至最低,与RYDBERG等[24]的研究具有相似结果,在模拟饼干体系中直接加入酪蛋白可减少糖基化有害产物的生成量,推测其可能是由于蛋白质的保护作用,有害产物通过与氨基酸侧链上的亲核基团(—SH,—NH2)反应进而减少其产生量。
2.1.3 玉米油添加量对小麦谷朊蛋白中GO、MGO和荧光性AGEs形成的影响
图3为不同玉米油添加量对GO、MGO和荧光性AGEs含量的影响。当油脂添加量为0.01 g/g时,GO降低约36%,MGO降低约8%左右,AGEs降低2%;但是,继续增加油脂添加量(0.05~0.2 g/g),美拉德有害产物生成量却无明显差异(P>0.05)。脂肪自身氧化可产生GO、MGO等AGEs前体化合物,但与蛋白糖基化过程中产生的量相比,生成量相对比较低。LIMA等[25]研究证明在相同条件(95 ℃、8 h)下,酪蛋白和葡萄糖反应形成的AGEs比酪蛋白与花生四烯酸产生的AGEs高15倍。由此可推测当玉米油加入到谷朊蛋白-葡萄糖体系中,谷朊蛋白与玉米油相互作用,阻止少量谷朊蛋白不与葡萄糖进行美拉德反应,所以尽管玉米油添加量为0.01 g/g,但3种有害物质量均减少。

图3 玉米油对小麦谷朊蛋白-葡萄糖体系GO,MGO 和AGEs含量的影响
Fig.3 Effect of corn oil on the content of GO,MGO and AGEs in the gluten-glucose reaction system
此外,SREY等[26]发现在添加人造黄油的海绵蛋糕中,AGEs的生成量随人造黄油的使用量增减变化不太,无明显差异。而在海绵蛋糕中添加高含量的油(赖氨酸与油的摩尔比为1∶50)时产生的AGEs含量大约是低含量油(赖氨酸与油的摩尔比为1∶1)的3.8倍;但其所添加油脂量远远高于实际体系中油脂含量。因此,如果在烘焙食品中添加正常含量的油脂,可以对GO的生成量有显著性的降低,对MGO和AGEs影响不显著,而其作用机制有待进一步研究。
2.2 交互作用分析
为了进一步探讨影响糖基化过程中GO、MGO和荧光性AGEs的主要因素以及各因素之间是否存在交互作用[27],在单因素试验基础上,研究淀粉添加量、卵白蛋白添加量、玉米油添加量对模拟体系中GO、MGO和荧光性AGEs产生量的影响,以便可以根据应用的要求,选择更为安全的烘焙原料配比,结果如表2所示。
表2 正交试验设计与结果
Table 2 Design and experimental results of orthogonal array
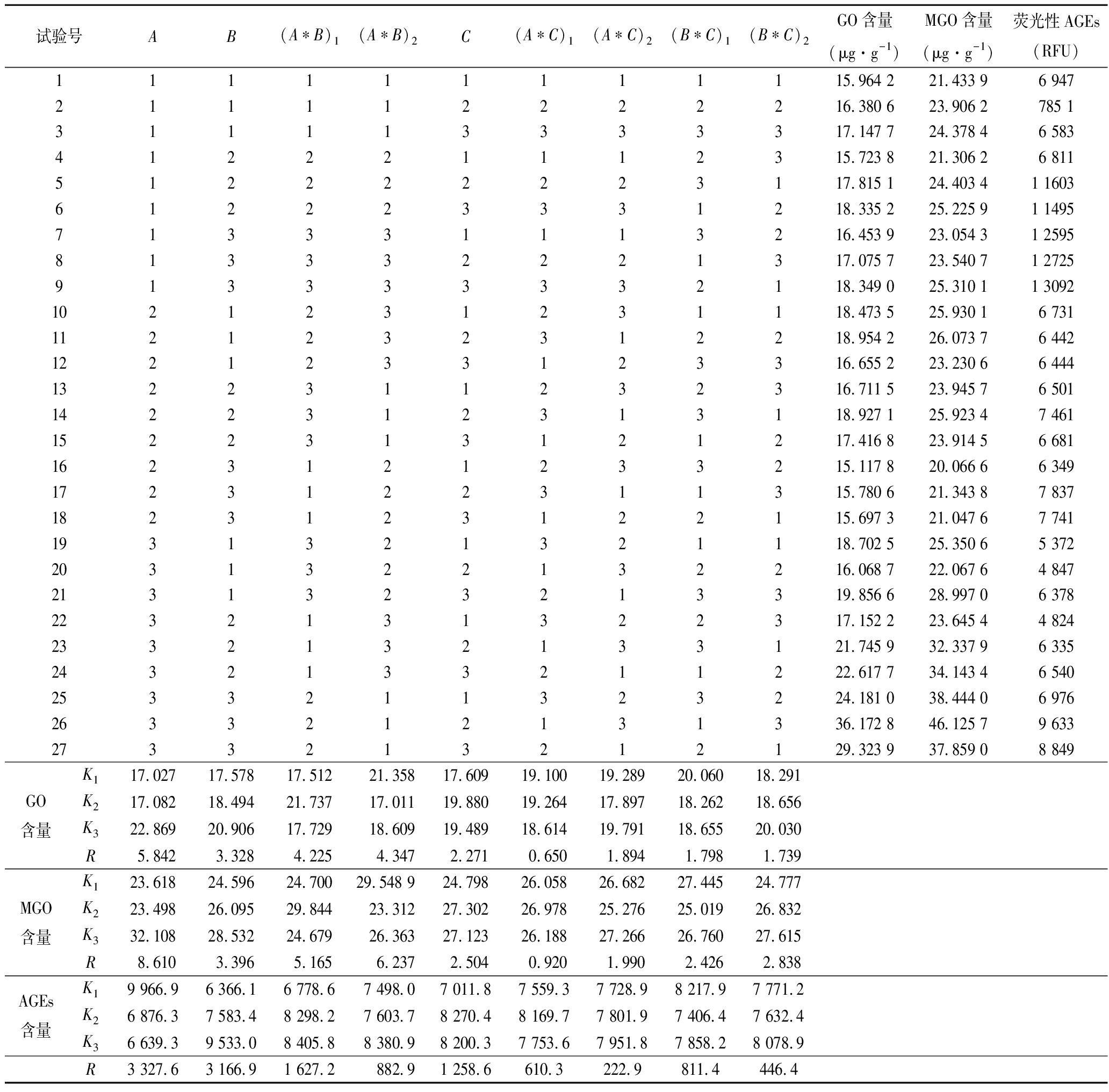
试验号AB(A∗B)1(A∗B)2C(A∗C)1(A∗C)2(B∗C)1(B∗C)2GO含量(μg·g-1)MGO含量(μg·g-1)荧光性AGEs(RFU)111111111115.964 221.433 96 947211112222216.380 623.906 2785 1311113333317.147 724.378 46 583412221112315.723 821.306 26 811512222223117.815 124.403 41 1603612223331218.335 225.225 91 1495713331113216.453 923.054 31 2595813332221317.075 723.540 71 2725913333332118.349 025.310 11 30921021231231118.473 525.930 16 7311121232312218.954 226.073 76 4421221233123316.655 223.230 66 4441322311232316.711 523.945 76 5011422312313118.927 125.923 47 4611522313121217.416 823.914 56 6811623121233215.117 820.066 66 3491723122311315.780 621.343 87 8371823123122115.697 321.047 67 7411931321321118.702 525.350 65 3722031322132216.068 722.067 64 8472131323213319.856 628.997 06 3782232131322317.152 223.645 44 8242332132133121.745 932.337 96 3352432133211222.617 734.143 46 5402533211323224.181 038.444 06 9762633212131336.172 846.125 79 6332733213212129.323 937.859 08 849GO含量K117.02717.57817.51221.35817.60919.10019.28920.06018.291K217.08218.49421.73717.01119.88019.26417.89718.26218.656K322.86920.90617.72918.60919.48918.61419.79118.65520.030R5.8423.3284.2254.3472.2710.6501.8941.7981.739MGO含量K123.61824.59624.70029.548 924.79826.05826.68227.44524.777K223.49826.09529.84423.31227.30226.97825.27625.01926.832K332.10828.53224.67926.36327.12326.18827.26626.76027.615R8.6103.3965.1656.2372.5040.9201.9902.4262.838AGEs含量K19 966.96 366.16 778.67 498.07 011.87 559.37 728.98 217.97 771.2K26 876.37 583.48 298.27 603.78 270.48 169.77 801.97 406.47 632.4K36 639.39 533.08 405.88 380.98 200.37 753.67 951.87 858.28 078.9R3 327.63 166.91 627.2882.91 258.6610.3222.9811.4446.4
考虑到小麦制品在加工过程中各组分对美拉德产物形成的影响,对淀粉、卵白蛋白、玉米油添加量及三者对谷朊蛋白-糖之间交互作用进行正交试验,经极差分析得到各因素对谷朊蛋白-葡萄糖体系产生糖基化产物的影响。直观分析结果表明,淀粉是影响GO、MGO和荧光性AGEs产生量的最主要因素,综合分析可知,体系中GO、MGO和荧光性AGEs产生量最低为最优,而对GO、MGO和荧光性AGEs产生量抑制最优条件均为A2B3C1,即淀粉添加量6 g、卵白蛋白添加量0.2 g、玉米油添加量0.05 g时,GO、MGO含量分别为15.117 8 μg/g、20.066 6 μg/g,荧光性AGEs为6 349 RFU,均为各组最低。
由表3可知,淀粉的添加量对GO、MGO和荧光性AGEs生成量的影响均为极显著(P<0.001),卵白蛋白的添加对GO和荧光性AGEs具有显著性影响(P<0.05);玉米油对3种有害物质均无显著性影响。同时淀粉添加量与卵白蛋白的交互作用也呈现显著性。此外,A3B3C2时,具有最高的GO和MGO生成量;A1B3C3时,具有最高的荧光性AGEs含量。有害产物生成量逐渐增加。结合前期数据,淀粉添加量增加将大幅降低体系中美拉德反应GO、MGO和荧光性AGEs含量。但仍需注意其他组分的添加量的影响。
表3 正交试验方差分析
Table 3 Analysis of variance of orthogonal test

源GOMGO荧光性AGEsⅢ型平方和df均方F值P值Ⅲ型平方和df均方F值P值Ⅲ型平方和df均方F值P值A202.8732101.43719.2900.001438.7152219.35726.0360.00062 040 985.85231 020 492.9329.7570.000B53.187226.5935.0570.03871.041235.5214.2160.05645 935 557.63222 967 778.8122.0320.001C26.535213.2682.5230.14135.147217.5732.0860.1879 005 464.9324 502 732.4814.3190.053A∗B188.950447.2388.9830.005334.456483.6149.9240.00319 090 619.25944 772 654.8154.5780.032A∗C19.38144.8450.9210.49723.27645.8190.6910.6191 982 557.9264495 639.4810.4750.753B∗C21.35945.3401.0150.45428.81547.2040.8550.5295 405 073.48141 351 268.3701.2960.349误差42.06885.25867.40288.4258 339 801.63081 042 475.204总计10 293.7742719 827.853271 806 091 307.00027
GO:R2=0.924(调整R2=0.753);MGO:R2=0.933(调整R2=0.781);荧光性AGEs:R2=0.945(调整R2=0.821)
2.3 扫描电镜分析
为表征淀粉在反应中的作用,研究了淀粉添加前后谷朊蛋白在反应中微观结构的变化,同时研究对照在非糖基化条件下,淀粉对小麦谷朊蛋白结构的影响。冷冻干燥后谷朊蛋白表面呈较均匀的片状结构(图4-a);添加葡萄糖后发生了糖基化反应,产物中结构发生明显变化,形成疏松的孔洞状结构(图4-b),这可能是在糖基化反应后,谷朊蛋白与糖分子共价结合时,蛋白质分子发生热聚集行为,糖分子结合在蛋白分子表面导致谷朊蛋白结构被破坏[28];谷朊蛋白-淀粉体系中,淀粉的添加改变了谷朊蛋白的表观形貌(图4-c),谷朊蛋白与淀粉之间的确发生了相互作用。

a-谷朊蛋白;b-谷朊蛋白+葡萄糖;c-谷朊蛋白+淀粉; d-谷朊蛋白+葡萄糖+淀粉
图4 小麦谷朊蛋白改性前后的扫描电子显微镜图
Fig.4 Scanning electron microscopy of gluten before and after modification
与淀粉共存的小麦谷朊蛋白-葡萄糖体系中,尽管也有部分孔洞出现,但孔洞数目明显减少(图4-d),推测淀粉加入后与谷朊蛋白进行相互作用形成复合物,阻挡了小麦谷朊蛋白与葡萄糖的反应,与前文推测一致。
2.4 圆二色谱分析蛋白质结构
由图5和表4可知,糖基化复合改性小麦谷朊蛋白样品中α-螺旋含量下降,这是由于稳定α-螺旋的作用力主要是多肽链的氢键,而糖基化改性影响了氢键的稳定;同时,二级结构中的β-折叠和β-转角及无规则卷曲结构的含量上升,进一步说明糖基化改变了谷朊蛋白的二级结构[24]。在谷朊蛋白中加入淀粉后,两者之间发生了交联作用,α-螺旋含量较原来有大幅度下降。而在谷朊蛋白中同时加入葡萄糖和淀粉,谷朊蛋白的α-螺旋含量并未发生变化,推测为淀粉与谷朊蛋白发生交联,占据蛋白发生糖基化反应的位点,使葡萄糖无法再与谷朊蛋白进行反应;进而再次证明加入淀粉可一定程度阻止谷朊蛋白与葡萄糖发生美拉德反应,从而降低美拉德产物GO、MGO和荧光性AGEs形成。

图5 圆二色谱研究不同条件下谷朊蛋白二级结构的变化
Fig.5 The effect of the different conditions on secondary structure of wheat glutenin by CD spectroscopy
表4 不同条件下谷朊蛋白二级结构的含量 单位:%
Table 4 Content of secondary structure of wheat glutenin under different conditions

结构谷朊蛋白谷朊蛋白+葡萄糖谷朊蛋白+淀粉谷朊蛋白+葡萄糖+淀粉α-螺旋8644β-折叠和β-转角41494848无规则卷曲51454848
3 结论
本文主要研究谷朊蛋白与葡萄糖模拟体系在加工过程中的美拉德反应潜在危害产物的生成量,受淀粉、卵白蛋白和玉米油三大主要配料的影响规律。通过正交试验进行交互分析,发现淀粉的添加量对GO,MGO和荧光性AGEs生成量的影响均为极显著;卵白蛋白的添加对GO和荧光性AGEs具有显著性影响;玉米油对3种有害物质均无显著性影响。由正交实验得出,可供参考的谷朊蛋白∶糖∶淀粉∶卵白蛋白∶玉米油最佳质量比例为1∶0.15∶6.0∶0.2∶0.05,此时3类有害产物生成量最低。通过微观结构和二级结构分析,证明了淀粉的影响原因在于其改变了蛋白质与单糖的接触机会,形成空间位阻;此外,淀粉的添加在一定程度上改变了谷朊蛋白结构,进而影响了美拉德反应。本文为烘焙小麦制品配方选择的安全性提供数据支持,并为如何减少美拉德反应潜在有害产物的生成提供了一定的理论依据。
[1] SLIMAN S M,EUBANK T D,KOTHA S R,et al.Hyperglycemic oxoaldehyde,glyoxal,causes barrier dysfunction,cytoskeletal alterations,and inhibition of angiogenesis in vascular endothelial cells:Aminoguanidine protection[J].Molecular and Cellular Biochemistry,2010,333(1-2):9-26.
[2] ZIZKOVA P,VISKUPICOVA J,HEGER V,et al.Dysfunction of SERCA pumps as novel mechanism of methylglyoxal cytotoxicity[J].Cell Calcium,2018,74:112-122.
[3] 申超. FPS-ZM1对晚期糖基化终末产物诱导的鼠小胶质细胞炎症和氧化应激的影响及机制[D].济南:山东大学,2016.
SHEN C.FPS-ZM1 attenuates advanced glycation end products induced inflammation and oxidative stress in rat primary microglia[D].Jinan:Shandong University,2016.
[4] LEVINE R A,SMITH R E.Sources of variability of acrylamide levels in a cracker model[J].Journal of Agricultural and Food Chemistry,2005,53(11):4 410-4 416.
[5] GOLDBERG T,CAI W J,PEPPA M,et al.Advanced glycoxidation end products in commonly consumed foods[J].Journal of the American Dietetic Association,2004,104(8):1 287-1 291.
[6] 张玲敏. 家庭装烘焙类面粉的品牌分析和适用场景[J].粮食加工,2019,44(6):15-25.
ZHANG L M.Brand analysis and application scenarios of home packaged baking flour[J].Grain Processing,2019,44(6):15-25.
[7] 张国治, 王慧洁,刘忠思,等.小麦面筋蛋白的组成、功能特性及产业化应用[J].粮食加工,2019,44(3):1-4.
ZHANG G Z,WANG H J,LIU Z S,et al.Composition,functional characteristics and industrial application of gluten protein in wheat[J].Grain Processing,2019,44(3):1-4.
[8] 王瑞红, 孙小红,王莺颖,等.大豆蛋白和小麦蛋白结构与功能对比研究[J].粮食加工,2016,41(3):32-36.
WANG R H,SUN X H,WANG Y Y,et al.Review on the difference of structure and function between soy protein and wheat protein[J].Grain Processing,2016,41(3):32-36.
[9] PRANDI B,TEDESCHI T,FOLLONI S,et al.Peptides from gluten digestion:A comparison between old and modern wheat varieties[J].Food Research International,2017,91:92-102.
[10] 王岸娜, 陈丛丛,吴立根.小麦面筋蛋白研究进展[J].粮油食品科技,2017,25(5):19-23.
WANG A N,CHEN C C,WU L G.Research progress of wheat gluten protein[J].Science and Technology of Cereals,Oils and Foods,2017,25(5):19-23.
[11] SMUDA M,GLOMB M A.Fragmentation pathways during Maillard-induced carbohydrate degradation[J].Journal of Agricultural and Food Chemistry,2013,61(43):10 198-10 208.
[12] MILDNER-SZKUDLARZ S,SIGER A,SZWENGIEL A,et al.Natural compounds from grape by-products enhance nutritive value and reduce formation of CML in model muffins[J].Food Chemistry,2015,172:78-85.
[13] 徐正华, 梁玉燊,朱克卫,等.食品中晚期糖基化中间产物及终末产物研究进展[J].食品安全质量检测学报,2020,11(5):1 496-1 501.
XU Z H,LIANG Y S,ZHU K W,et al.Research progress on advanced glycation end products and intermediate products in foods[J].Journal of Food Safety & Quality,2020,11(5):1 496-1 501.
[14] 李鑫宇. 挤压膨化对豆渣复配粉特性的影响及其应用[D].哈尔滨:哈尔滨商业大学,2020.
LI X Y.Effect of extrusion on the characteristics of soybean dregs compound powder and its application[D].Harbin:Harbin University of Commerce,2020.
[15] 王晨, 李晓明,卢永翎,等.气相色谱法检测饮料中二羰基化合物[J].食品科学,2015,36(24):235-241.
WANG C,LI X M,LU Y L,et al.Detection of dicarbonyl compounds in beverages by gas chromatography[J].Food Science,2015,36(24):235-241.
[16] SCHMITT A,SCHMITT J,MÜNCH G,et al.Characterization of advanced glycation end products for biochemical studies:Side chain modifications and fluorescence characteristics[J].Analytical Biochemistry,2005,338(2):201-215.
[17] 安志丛. 预处理对小麦面筋蛋白功能性质及酶解特性的影响研究[D].无锡:江南大学,2009.
AN Z C.Effect on the functional properties and enzymatic hydrolysis of wheat gluten by pretreatments[D].Wuxi:Jiangnan University,2009.
[18] 王娜, 肖云峰,钱新宇,等.丁香酚/淀粉包合物冻干粉的制备及表征[J].现代食品科技,2020,36(12):180-187.
WANG N,XIAO Y F,QIAN X Y,et al.Preparation and characterization of eugenol/starch inclusion compound freeze-dried powder[J].Modern Food Science and Technology,2020,36(12):180-187.
[19] 陆敏. 黄酮抑制蛋糕体系美拉德反应有害产物的研究[D].南京:南京师范大学,2016.
LU M.Study of inhibitory effect of flavonoids on harmful products from Maillard reaction in cakes[D].Nanjing:Nanjing Normal University,2016.
[20] 金征宇, 麻荣荣,田耀旗.方便米食中淀粉组分对风味形成的贡献[J].食品科学技术学报,2019,37(1):1-9.
JIN Z Y,MA R R,TIAN Y Q.Contribution of starch components to flavor formation in instant rice products[J].Journal of Food Science and Technology,2019,37(1):1-9.
[21] LI H,YU S J.Review of pentosidine and pyrraline in food and chemical models:Formation,potential risks and determination[J].Journal of the Science of Food and Agriculture,2018,98(9):3 225-3 233.
[22] 张政, 王晓曦,马森.大分子交互作用对小麦粉品质影响的研究进展[J].粮食与油脂,2019,32(1):13-15.
ZHANG Z,WANG X X,MA S.Research progress on the effect of macromolecule interaction on quality of wheat flour[J].Cereals & Oils,2019,32(1):13-15.
[23] 裴旭东. 小麦面筋蛋白的改性及其应用[D].上海:华东师范大学,2009.
PEI X D.Modification and application of wheat gluten[D].Shanghai:East China Normal University,2009.
[24] RYDBERG P,ERIKSSON S,TAREKE E,et al.Investigations of factors that influence the acrylamide content of heated foodstuffs[J].Journal of Agricultural and Food Chemistry,2003,51(24):7 012-7 018.
[25] LIMA M,ASSAR S H,AMES J M.Formation of nε-(carboxymethyl)lysine and loss of lysine in casein glucose-fatty acid model systems[J].Journal of Agricultural and Food Chemistry,2010,58(3):1 954-1 958.
[26] SREY C,HULL G L J,CONNOLLY L,et al.Effect of inhibitor compounds on Nε-(Carboxymethyl)lysine (CML) and Nε-(Carboxyethyl)lysine (CEL) formation in model foods[J].Journal of Agricultural and Food Chemistry,2010,58(22):12 036-12 041.
[27] 杨小勇. 方差分析法浅析:单因素的方差分析[J].实验科学与技术,2013,11(1):41-43.
YANG X Y.Discussion of variance analysis:The single factor variance analysis[J].Experiment Science and Technology,2013,11(1):41-43.
[28] 臧艳妮, 赵妍嫣,罗水忠,等.超声波和糖基化复合改性对小麦面筋蛋白性质和结构的影响[J].食品科学,2017,38(5):122-128.
ZANG Y N,ZHAO Y Y,LUO S Z,et al.Effect of ultrasonic treatment and glycosylation modification on characteristics and structure of wheat gluten[J].Food Science,2017,38(5):122-128.