可溶性大豆多糖(soybean soluble polysaccharide,SSPS)是从豆渣中提取出来的一种酸性多糖,结构类似果胶,由半乳糖醛酸主链和同型半乳糖基和阿拉伯糖基组成的中性侧链构成,主要由半乳糖、半乳糖醛酸、鼠李糖、阿拉伯糖、葡萄糖、岩藻糖和木糖等单糖组成,分子质量在5 k~1 000 kDa [1-2]。SSPS中膳食纤维的含量超过70%,不仅具有促进肠道蠕动、降血糖、降血压等常见的膳食纤维具有的功能特性,还具有乳化性、泡沫稳定性、成膜性等功能性质,且易溶于水、耐酸、黏度较低,常作为食品添加剂或膜材料应用于食品行业[3-4]。从世界市场的需求来看,SSPS发展前景良好。
多糖的结构与其理化性质和生物活性密切相关,利用化学方法可对多糖的结构进行修饰,从而改变其性质和活性。天然多糖是一种多羟基化合物,在适当条件下,这些羟基可发生亲核取代生成相应的多糖酯[5-6]。多糖的乙酰化是一种常用的多糖结构化学修饰方法,研究发现乙酰化修饰能使多糖表现出显著的抗氧化性、抗肿瘤及免疫调节等活性[7]。乙酰化修饰对多糖理化性质的影响主要体现在疏水性和硬度等方面,疏水的乙酰基团取代亲水的羟基从而改变多糖的亲水性[8]。研究表明,低度乙酰化的木聚糖有一定的亲水性,而高度乙酰化的木聚糖只能溶于有机溶剂[9];乙酰化修饰后的果胶构象发生变化,由于引入乙酰基造成的空间位阻影响了果胶和Ca2+的结合,使其硬度降低[10]。目前国内外对可溶性大豆多糖的改性研究主要集中在羧甲基化和磷酸化改性[11-12],对于乙酰化修饰可溶性大豆多糖的研究尚未见报道。
为进一步研究可溶性大豆多糖乙酰化修饰及其乳化性质,本文以SSPS为原料,通过乙酸酐法制备乙酰化可溶性大豆多糖(acetylated soybean soluble polysaccharide,Ac-SSPS),将疏水的乙酰基接入SSPS,使其具有两亲性,并对其进行超滤分离,得到高分子质量区间的Ac-SSPS(H)和低分子质量区间的Ac-SSPS(L)2种多糖组分,考察并研究超滤分离对Ac-SSPS乳化性质的影响,系统分析以Ac-SSPS作为乳化剂制备的O/W型纳米乳液稳定性,探讨温度和pH对乳液稳定性的影响并研究贮藏过程中相应乳液的流变特性、粒径分布、Zeta电位和微观形貌的变化,旨在为Ac-SSPS的生产制备及开发一种新型食品添加剂提供参考。
1 材料与方法
1.1 材料与试剂
可溶性大豆多糖,福建省泉州市味博食品有限公司;玉米油,金太阳粮油股份有限公司;乙酸酐、NaOH、HCl、乙醇、SDS(均为分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
AB104-N电子分析天平、FE28型pH计,梅特勒-托利多国际贸易(上海)有限公司;HH.S21-6恒温水浴锅,上海精密仪器厂;SJM-FHM-02陶瓷复合膜设备,合肥世杰膜工程有限公司;Scientz-18 N冷冻干燥机,新芝生物科技股份有限公司;ULTRA TURRAX T18数显型分散剂套装,广州仪科实验室技术有限公司;AMH-3高压微射流均质机,安拓思纳米技术(苏州)有限公司;1100高效液相色谱仪,美国安捷伦科技有限公司;DHR-3流变仪,美国沃特世公司;UV-2800A紫外可见光分光光度计,麦仪科学仪器(上海)有限公司;IS10傅里叶红外光谱仪,美国Nicolet公司;Avance Ⅲ 400 MHZ全数字化核磁共振波谱仪,德国布鲁克公司;Nano Brook Omni多角度粒度与高灵敏度Zeta电位分析仪,美国布鲁克海文仪器公司;LSM710型激光共聚焦显微镜,德国蔡司公司。
1.3 试验方法
1.3.1 Ac-SSPS的制备
将SSPS用去离子水充分溶解,制备质量浓度为20 mg/mL的SSPS溶液。用0.1 mol/L NaOH溶液调节溶液pH为8.0,在40 ℃下向溶液中交替加入0.5 mol/L NaOH溶液和乙酸酐,控制体系pH在8.0~10.0,按料液比1∶15(g∶mL)添加乙酸酐,直至加完。保持体系温度为40 ℃,搅拌反应1.5 h后,用0.1 mol/L的HCl溶液调节体系pH为7.0以终止反应。将反应液用截留分子质量为3 500 Da的透析袋蒸馏水透析48 h,透析液用旋转蒸发仪在真空度为0.08 M~0.095 MPa、60 ℃下减压浓缩至原体积的1/4,加入4倍体积的无水乙醇于4 ℃醇沉过夜,冷冻干燥后即得Ac-SSPS。
1.3.2 Ac-SSPS的超滤分离
将1.3.1中所述透析之后的反应液加入超滤装置的料桶中进行超滤,超滤膜为孔径为20 nm的陶瓷复合膜,工作压力为0.1 M~0.15 MPa。透过超滤膜的低分子质量Ac-SSPS在出料口被收集,而未被滤出的溶液则回到料桶中。当料桶中溶液降为初始溶液体积的25 %时,向料桶中加入去离子水使溶液体积为初始体积的50 %,重复3次后,当料桶中溶液降至初始溶液体积的25 %时结束超滤。将滤出液和未滤出液分别减压浓缩后48 h冷冻干燥,即得Ac-SSPS(H)和Ac-SSPS(L)。
1.3.3 乙酰化和超滤分离前后大豆多糖的结构表征
1.3.3.1 分子质量和均方旋转半径的测定
用高效凝胶渗透色谱仪(high performance gel permeation chromatography,HPSEC)与多角度激光散射和折射率检测器对样品进行分子质量和均方旋转半径的测定[13],使用Shodex OHpak SB-805 HQ色谱柱。分别将25 mg SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)样品溶于5 mL超纯水中,溶液用0.45 μm过滤器过滤后上柱,进样体积为150 μL,流动相为0.1 mol/L的NaNO3溶液,流速为0.5 mL/min,柱温50 ℃。
1.3.3.2 傅里叶红外光谱检测(Fourier transform infrared spectrometer,FT-IR)
分别精确称取1 mg SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)样品,加入100 mg KBr于玛瑙研钵中在干燥灯照射下轻轻研磨均匀,经压片机压成透明薄片,在4 000~400 cm-1下扫描,扣除空气空白背景后得到样品多糖的红外扫描图谱。
1.3.3.3 核磁共振氢谱检测(1H nuclear magnetic resonance spectra,1H NMR)
分别称取10 mg SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)粉末于0.5 mL重水中完全溶解、冻干,重复3次完成氢氘交换后将样品溶于以四甲基硅烷(tetramethylsilane, TMS)作内标的重水中,将样品溶液装入核磁管放入核磁共振波谱仪中测量核磁共振光谱,化学位移为0,样本测定温度设为25 ℃。每分钟扫描64次。
1.3.4 乙酰化和超滤分离前后大豆多糖溶液静态流变学特性的测定
分别将SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)充分溶于去离子水中,配制质量分数为2%的多糖溶液,用DHR-3流变仪测定其静态学流变特性。实验夹具为40 mm的平板,测试间距为1 000 μm,设定剪切速率为0.1~1 000 s-1。测试温度为25 ℃。
1.3.5 乙酰化和超滤分离前后大豆多糖溶解性的测定
分别将0.5 g SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L),加入49.5 g pH为2、4、6、8、10、12的缓冲溶液中,室温下记录多糖完全溶解所需的时间。
1.3.6 乙酰化和超滤分离前后大豆多糖乳化性能的测定
1.3.6.1 乳化活性(emulsifying activities,EAI)和乳化稳定性(emulsifying stabilities,ES)的测定
参照TANG等[14]的方法稍作修改,称取0.15 g的多糖样品,充分溶于15 mL去离子水中,加入5 mL玉米油,以15 000 r/min的速度高速分散5 min后,分别取100 μL静置0和10 min的乳液底层样品加入到10 mL的0.1% SDS溶液中,振荡直至混均,以0.1% SDS溶液为空白对照,在500 nm处测其吸光度。乳化活性及乳化稳定性计算如公式(1)(2)所示:
乳化活性![]()
(1)
乳化稳定性![]()
(2)
式中:EAI,单位质量多糖的乳化表面积,m2/g;A,500 nm波长处的吸光度值;DF,乳液在0.1% SDS溶液中的稀释倍数,100;ρ,样品溶液中多糖的质量浓度,10 000 g/m3;φ,油相在乳液中所占比例,0.25;L,比色皿的光径,0.01 m;ES,乳液静置10 min后的稳定值。
1.3.6.2 纳米乳液的制备
分别称取2.0 g SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)多糖样品,充分溶于80 mL去离子水中,再向多糖溶液中加入20.0 g玉米油,用T18型高速分散均质机以15 000 r/min高速剪切2 min,得到O/W型初乳液。将初乳液经高压微射流均质机50 MPa均质2次,得到相应纳米乳液,4 ℃储存。
1.3.6.3 静态流变学特性的测定
参照1.3.4的方法测定4种纳米乳液的静态流变学特性。
1.3.6.4 乳析指数(creaming index,CI)的测定
参照LU等[15]的方法稍作修改,利用CI表示乳液的贮藏稳定性。取25 mL新鲜乳液置于透明带盖玻璃瓶中,在4 ℃下静态储存。用游标卡尺测量乳液初始高度和贮藏过程中下层清液的高度。CI计算如公式(3)所示:
(3)
式中:Hc,下层清液高度,cm;Ht,乳液总高度,cm。
1.3.6.5 动态光散射(dynamic light scattering,DLS)粒度的测定
将乳液稀释100倍,利用多角度纳米粒度仪在90°散射角处测粒径分布,测量温度设为25 ℃,单次测量时间为120 s。
1.3.6.6 Zeta电位的测定
将乳液稀释100倍,利用多角度粒度与高灵敏Zeta电位分析仪测定体系的Zeta电位,设定平衡时间为30 s,测量温度为25 ℃。
1.3.6.7 激光共聚焦显微镜(confocal laser scanning microscope,CLSM)观察
将乳液中的油脂用尼罗红(无水丙酮,0.5%)标记,取适量染色后的乳液置于载玻片上,盖上盖玻片,用激光共聚焦显微镜观察乳液的微观状态,激发波长为543 nm[16]。使用LSM 710 ZEN软件处理图像。
1.3.7 数据统计与分析
每组实验数据至少重复测定3次,利用Excel 2016软件初步处理数据,用Origin 2018软件根据数据作图,用SPSS 16软件进行方差分析和显著性分析,并以P<0.05为标准进行显著性分析。
2 结果与分析
2.1 乙酰化和超滤分离对可溶性大豆多糖结构的影响
2.1.1 分子质量和均方回转半径分析
SSPS和Ac-SSPS的HPSEC多角度激光散射信号色谱图如图1所示,其出峰时间分别为15.35和15.21 min,且Ac-SSPS的峰分布更宽。由表1可知,乙酰化改性后SSPS的分子质量增大,且孔径为20 nm的陶瓷复合膜可成功将Ac-SSPS分离为Ac-SSPS(H)和Ac-SSPS(L),其重均分子质量分别为868.6 k和56.8 kDa。均方回转半径表示高分子链在空间的伸展程度,Ac-SSPS的均方回转半径明显比SSPS大,这可能是相邻链的取代基之间的静电排斥作用导致的。超滤分离之后所得的Ac-SSPS(H)和Ac-SSPS(L)的多分散指数显著减小,可见超滤分离使得乙酰化后的大豆多糖分子质量分布更均匀[17]。

a-SSPS;b-Ac-SSPS
图1 SSPS和Ac-SSPS的HPSEC色谱图
Fig.1 HPSEC of SSPS and Ac-SSPS
表1 SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)的分子质量及均方回转半径
Table 1 Molecular weight and z-average radius of gyration of SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L)

样品重均分子质量(Mw)/kDa数均分子质量(Mn)/kDa多分散指数(Mw/Mn)均方回转半径(Rz)/nmSSPS516.9±0.8c91.9±0.6c5.62±0.05a36.5±0.05cAc-SSPS860.6±0.9b168.1±0.9b5.12±0.03b41.4±0.04bAc-SSPS(H)868.6±0.9a256.2±0.8a3.39±0.01c56.1±0.05aAc-SSPS(L)56.8±0.8d24.4±0.8d2.33±0.04d28.8±0.05d
注:同列不同小写字母表示差异性显著(下同)
2.1.2 FT-IR分析
由图2可知,3 430 cm-1处的宽吸收峰表示O—H的伸缩振动,2 927 cm-1处的弱吸收表示C―H的特征峰。SSPS经乙酰化修饰后出现了2个特征吸收峰:1 740 cm-1左右出现的峰,推断为乙酰酯基C![]() O的伸缩振动峰;1 245 cm-1左右出现的弱峰,推断为酯基的C—O伸缩振动峰,分离后的Ac-SSPS(H)和Ac-SSPS(L)的红外光谱也出现这2个特征吸收峰。以上结果证实乙酰基团存在于Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)中。此外,4种多糖的红外吸收光谱非常接近,这说明乙酰化修饰和超滤分离并未改变SSPS的大体结构。
O的伸缩振动峰;1 245 cm-1左右出现的弱峰,推断为酯基的C—O伸缩振动峰,分离后的Ac-SSPS(H)和Ac-SSPS(L)的红外光谱也出现这2个特征吸收峰。以上结果证实乙酰基团存在于Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)中。此外,4种多糖的红外吸收光谱非常接近,这说明乙酰化修饰和超滤分离并未改变SSPS的大体结构。
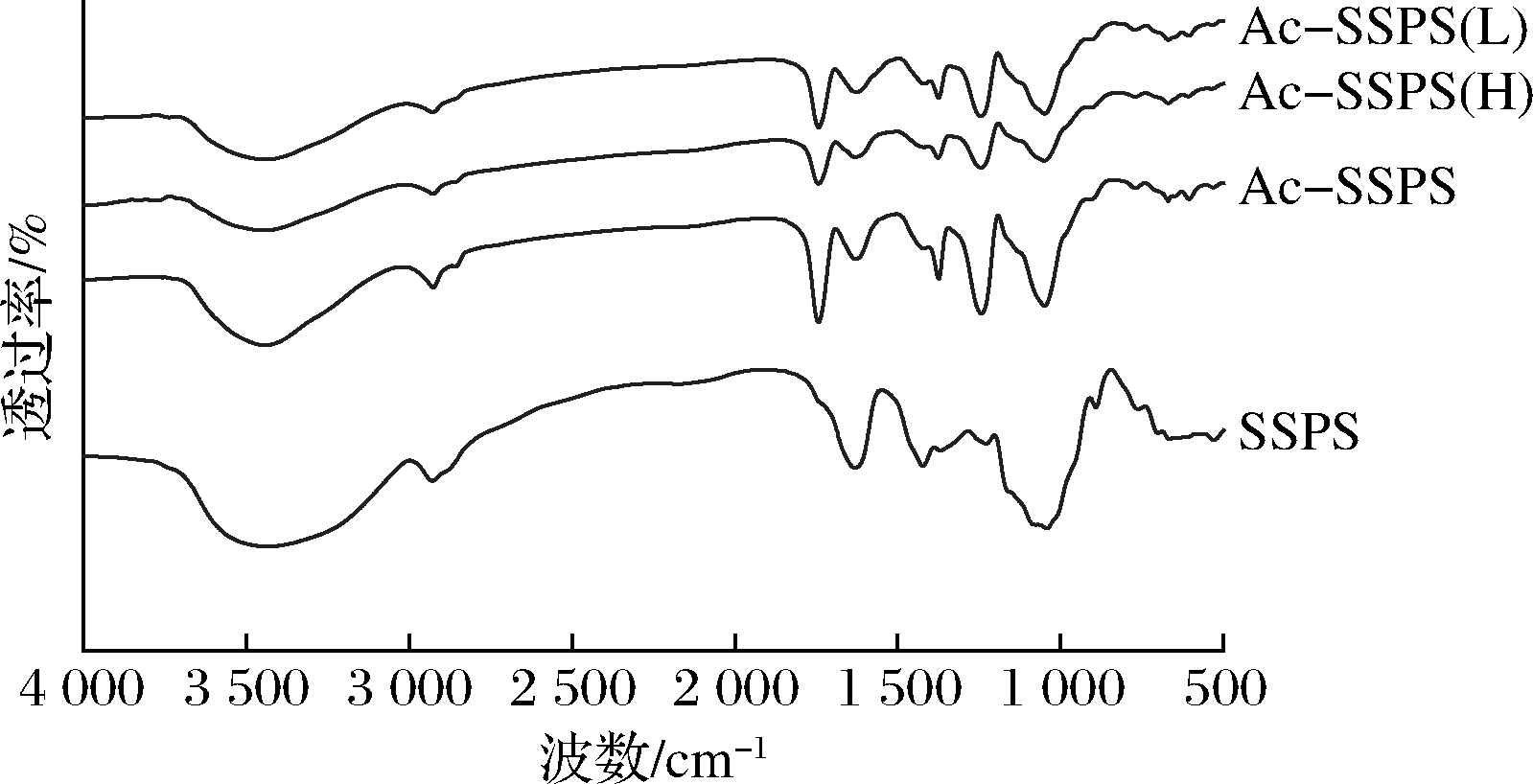
图2 SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)的 红外光谱图
Fig.2 FT-IR of SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L)
2.1.3 1H NMR分析
SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)4种多糖的1H NMR如图3所示,与SSPS相比,Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)均在δ 1.2~2.2处检出乙酰基特征峰[18-19]。δ=2.15处对应糖环上的羟基质子被乙酰基取代后的质子吸收峰,Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)的峰面积比为1∶3.10∶0.24, δ=1.92处对应糖环侧链脂肪族醋酸盐的质子吸收峰,三者的峰面积比为1∶1.13∶0.92。以上结果表明SSPS和乙酸酐在本实验条件下成功地发生了乙酰化反应,与上述红外图谱解析结果一致,且进一步表明乙酰化改性更多地发生在高分子质量的可溶性大豆多糖中。
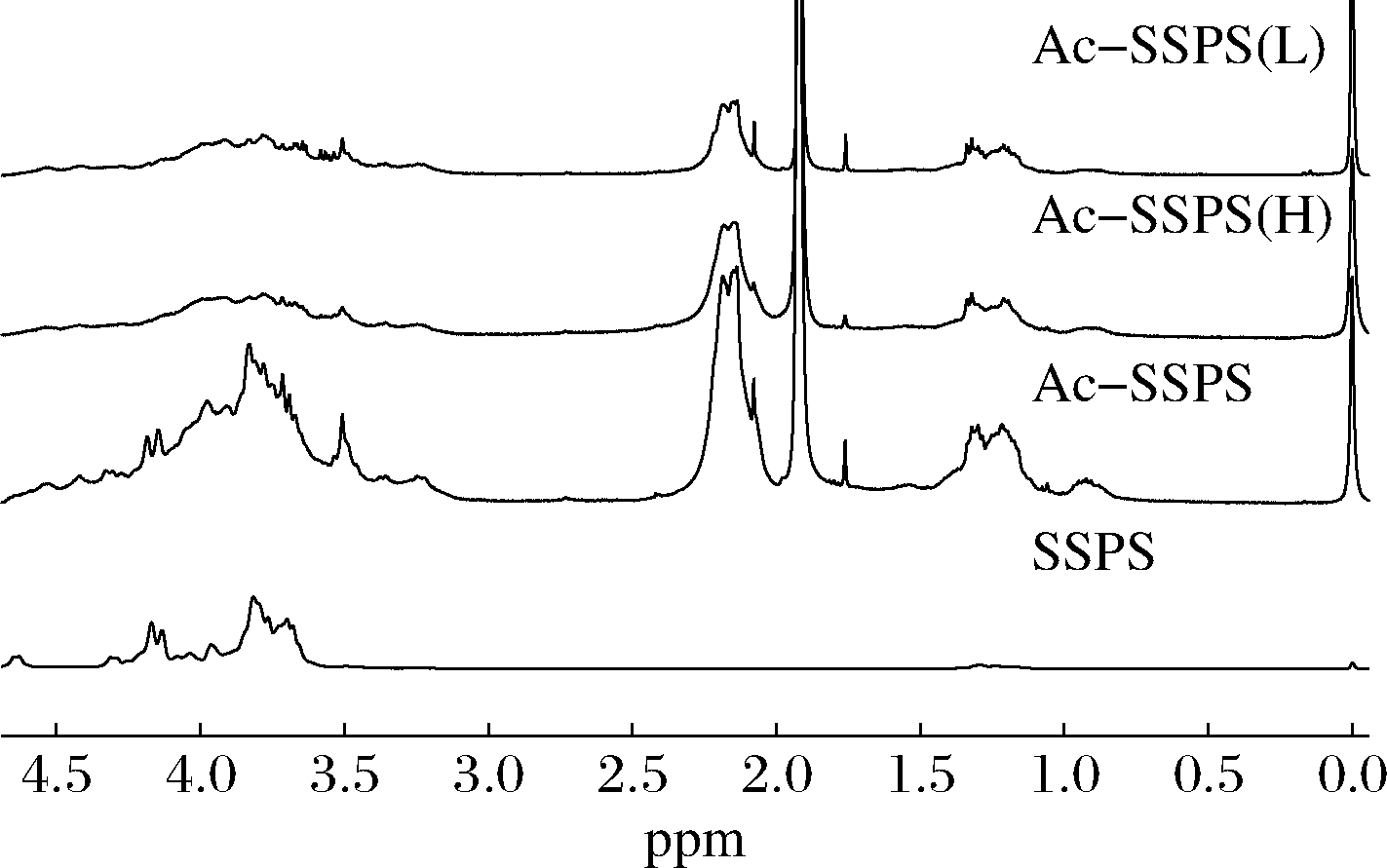
图3 SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)的 核磁共振氢谱图
Fig.3 1H NMR of SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L)
2.2 乙酰化和超滤分离对可溶性大豆多糖静态学流变特性的影响
质量分数为2%的SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)溶液黏度随剪切速率变化如图4所示,其黏度大小顺序为Ac-SSPS(H)>Ac-SSPS>Ac-SPPS(L)>SSPS。SSPS溶液黏度不随剪切速率变化,表现出牛顿流体特性,而Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)溶液均表现出剪切变稀的非牛顿流体特性。这是因为SSPS经乙酰化改性后,其侧链接入乙酰基,使得分子结构更为舒展,在水溶液中呈相互缠结的网状结构,该结构随着剪切速率的增大而逐步被破坏,导致黏度逐渐降低。
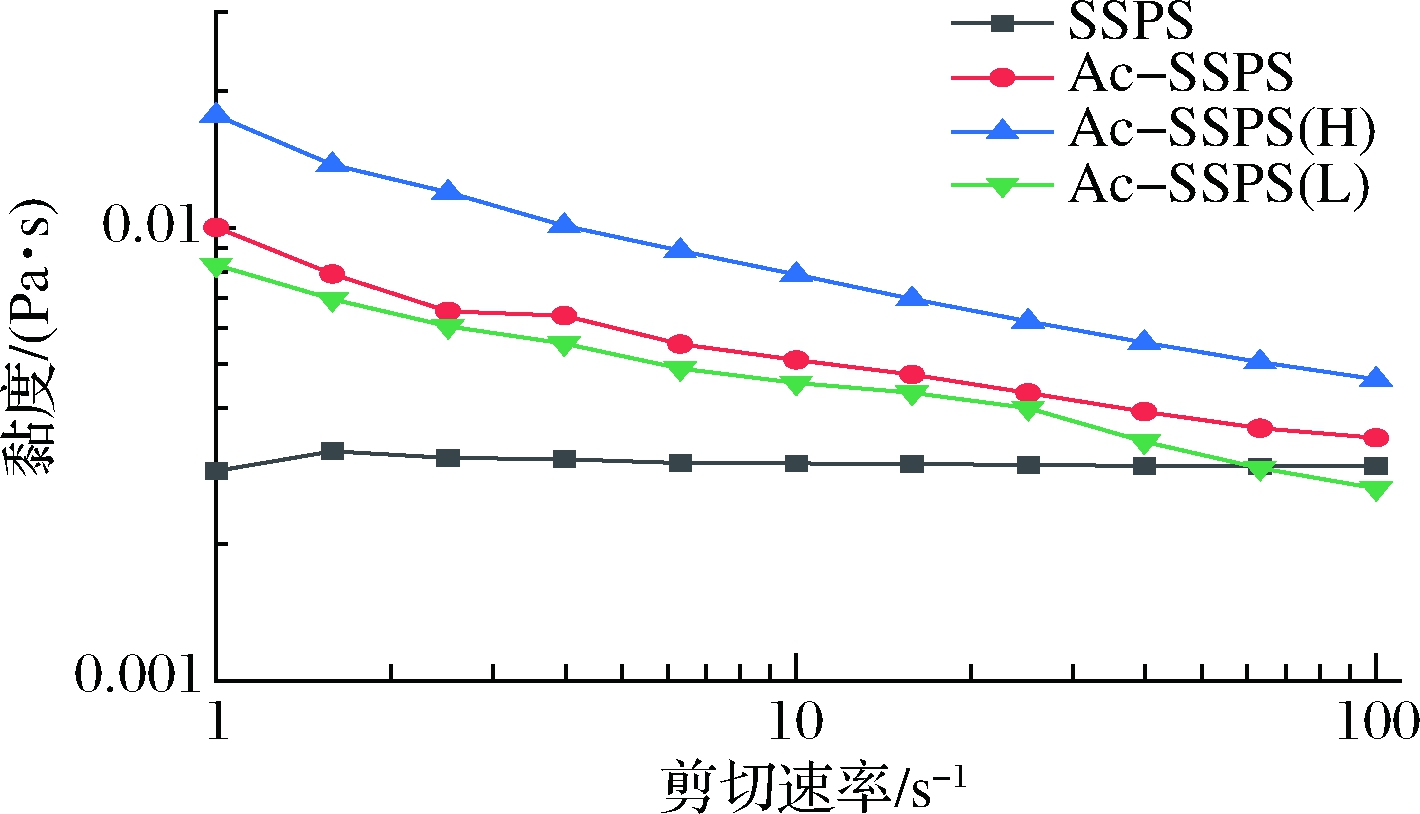
图4 SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)溶液的 静态流变学变化
Fig.4 Static rheological changes of SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L) solutions
一般多糖分子质量越大黏度越大,而Ac-SSPS(L)溶液黏度却高于SSPS且接近Ac-SSPS,这是因为Ac-SSPS(L)虽然分子质量小,但相互靠近的分子间仍能发生分子链的缠结,同时,SSPS在改性时发生副反应生成的小分子糖留在Ac-SSPS(L)中,使得其黏度较大。
2.3 乙酰化和超滤分离对可溶性大豆多糖溶解性的影响
将SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)分别溶于不同pH的水溶液中,对比其完全溶解所需时间,结果如图5所示。可见SSPS经乙酰化改性后,虽仍能完全溶解在不同pH的水溶液中,但其所需溶解时间更多,且超滤分离对Ac-SSPS所需的溶解时间影响不大。结合2.2中流变学特性分析可知,Ac-SSPS能完全溶解于水溶液中是因为其分子结构更为舒展,同时,乙酰化前后的SSPS结构中都存在大量的半乳糖醛酸,独特的结构使其在溶于水时产生净结构形成效应,在水中呈网状结构,形成疏水腔将部分水分子包裹其中[20],仍表现出良好的溶解性。Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)在pH为6~8时所需的溶解时间较少,这可能与其偏碱性的制备环境有关。
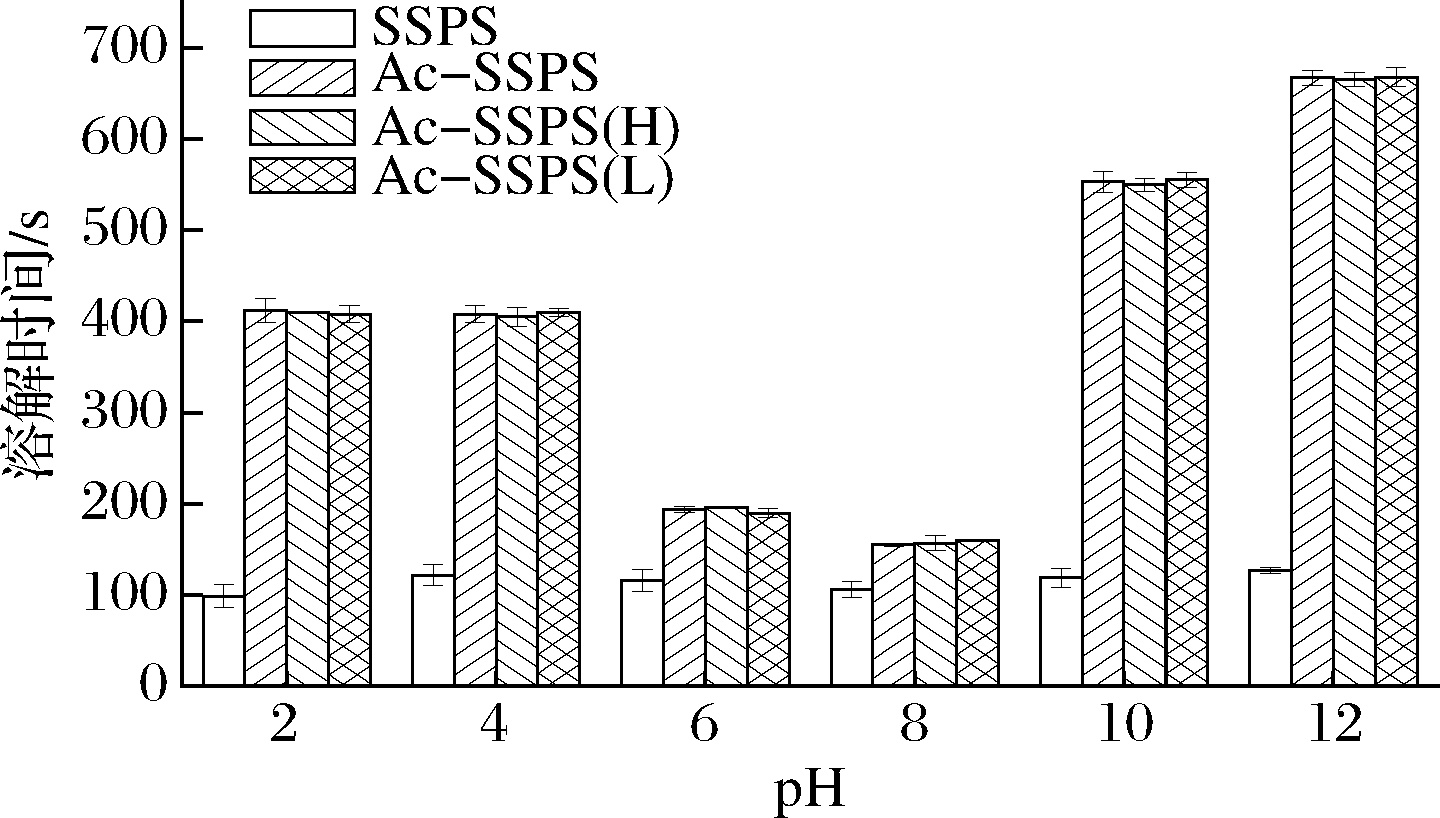
图5 SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L) 在不同pH水溶液中的溶解时间
Fig.5 Dissolution time of SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L) in different pH aqueous solutions
2.4 乙酰化和超滤分离对可溶性大豆多糖乳化性能的影响
2.4.1 EAI和ES分析
SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)4种多糖的EAI和 ES如表2所示,可以看出两者成正相关关系,其强弱顺序均表现为Ac-SSPS(H)>Ac-SSPS>Ac-SPPS(L)>SSPS。SSPS经乙酰化改性后,其EAI和 ES都明显提高,其乳化性的改善可能是因为可溶性大豆多糖上接入疏水的乙酰基,提高了其两亲性,而Ac-SSPS(H)具有高分子质量和高乙酰度,表现出更高的EAI和ES。
表2 SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)的 乳化活性和乳化稳定性
Table 2 Emulsifying activities and emulsifying stabilities of SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L)

样品EAI/(m2·g-1)ES(10-2)SSPS5.341±0.264d2.772±0.005dAc-SSPS12.046±0.574b57.004±0.878bAc-SSPS(H)15.974±0.769a76.587±0.654aAc-SSPS(L)11.099±0.853c49.551±0.618c
2.4.2 纳米乳液的静态流变特性
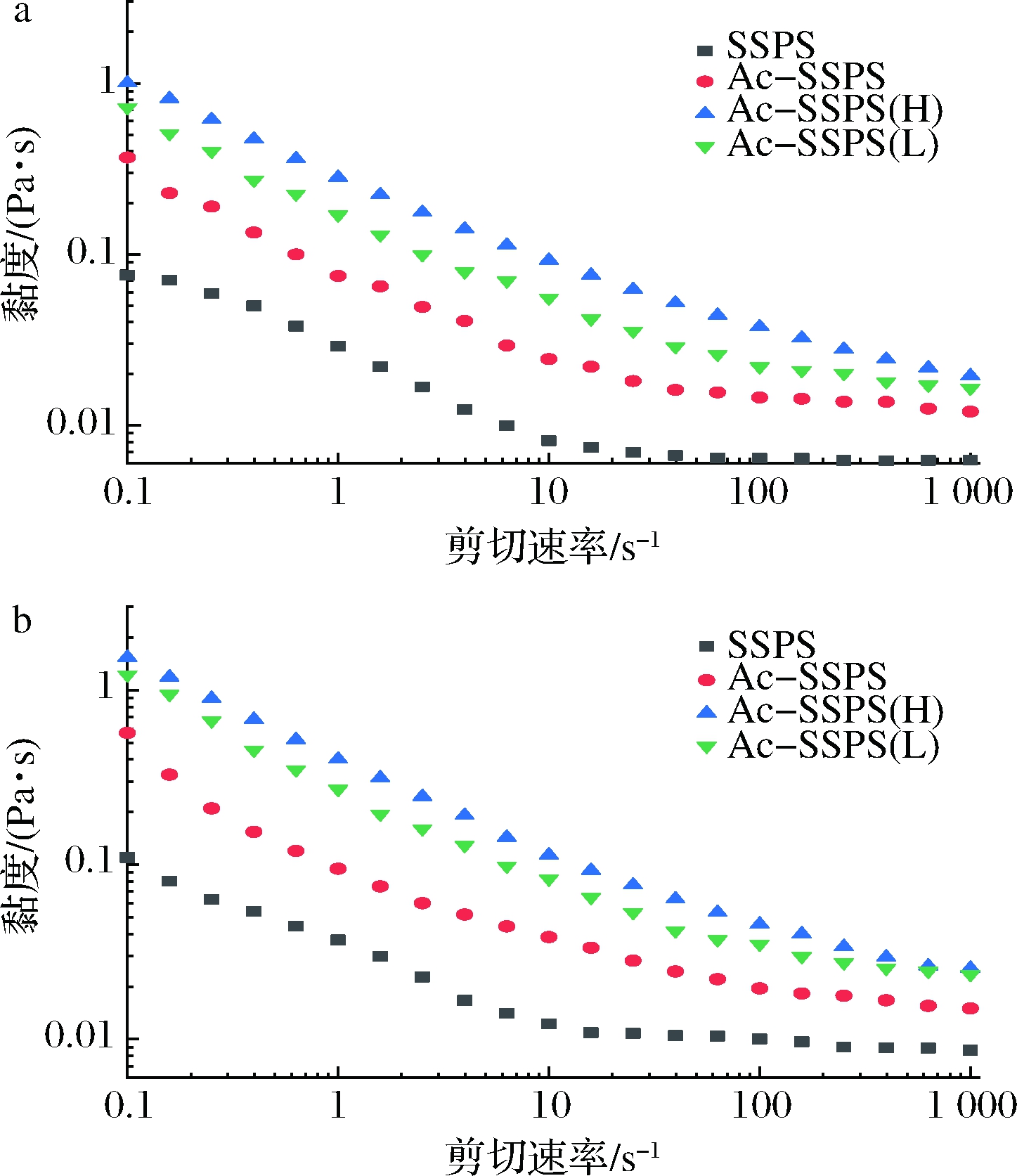
通过对乳液的静态流变学特性进行比较,探讨可溶性大豆多糖乙酰化改性和超滤分离对所得乳液黏度的影响。如图6所示,贮藏1和14 d时,SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)所稳定的乳液黏度都随着剪切速率的增大而略有降低,均出现剪切变稀现象,具有非牛顿流体特性,说明乳液体系中的网络结构逐步被破坏。
a-贮藏1 d时的黏度变化;b-贮藏14 d时的黏度变化
图6 SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)的 纳米乳液在贮藏过程中静态流变学变化
Fig.6 Static rheological changes of nano-emulsions stabilized by SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L) during storage
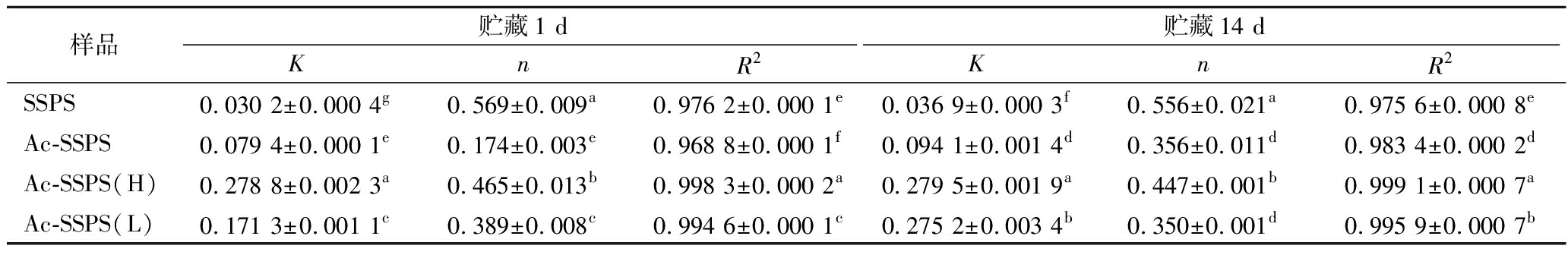
表3为4种乳液分别在贮藏1和14 d时的黏度与剪切速率的幂律函数拟合参数,R2均>0.96,说明该方程适用于实验乳液的拟合,乳液的流体指数n均<1,证实乳液为非牛顿流体。黏稠系数K反应乳液黏度的大小,在相同浓度下,4种乳液的黏度大小顺序均为Ac-SSPS(H)>Ac-SSPS(L)>Ac-SPPS>SSPS,说明乙酰基的接入使得SSPS具有两亲性,增强了多糖在油-水界面的乳化作用,同时多糖的分子链之间发生缠结,体系的网络结构增强。Ac-SSPS(H)的分子质量最大,高分子链较多,故其乳化作用较强,结合其自身在水相较高的黏度,使得Ac-SSPS(H)所稳定的乳液的黏度最大。Ac-SSPS(L)溶液的黏度较Ac-SSPS低,但其所稳定的乳液黏度却更高,这可能是因为Ac-SSPS(L)的分子大小分布较为集中,使得其在乳化过程中能更好地吸附在油滴上,同时,在碱性环境中改性时,部分SSPS水解生成的小分子糖经超滤分离留在Ac-SSPS(L)中,这部分小分子糖存在于乳液的连续相中,贡献了较高的黏度[21-22]。乳液贮藏14 d时,黏度均较贮藏1 d时有所增加,这是由于乳液中的油滴在贮藏过程中发生聚集[23-24],而Ac-SSPS(H)乳液的黏度变化最小,表现出更好的稳定性。
表3 贮藏1、14 d时SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)的纳米乳液流变参数
Table 3 Rheological parameters of nano-emulsions stabilized by SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L) when stored for 1 day and 14 days
样品贮藏1 d贮藏14 dKnR2KnR2SSPS0.030 2±0.000 4g0.569±0.009a0.976 2±0.000 1e0.036 9±0.000 3f0.556±0.021a0.975 6±0.000 8eAc-SSPS0.079 4±0.000 1e0.174±0.003e0.968 8±0.000 1f0.094 1±0.001 4d0.356±0.011d0.983 4±0.000 2dAc-SSPS(H)0.278 8±0.002 3a0.465±0.013b0.998 3±0.000 2a0.279 5±0.001 9a0.447±0.001b0.999 1±0.000 7aAc-SSPS(L)0.171 3±0.001 1c0.389±0.008c0.994 6±0.000 1c0.275 2±0.003 4b0.350±0.001d0.995 9±0.000 7b
2.4.3 温度对纳米乳液稳定性的影响
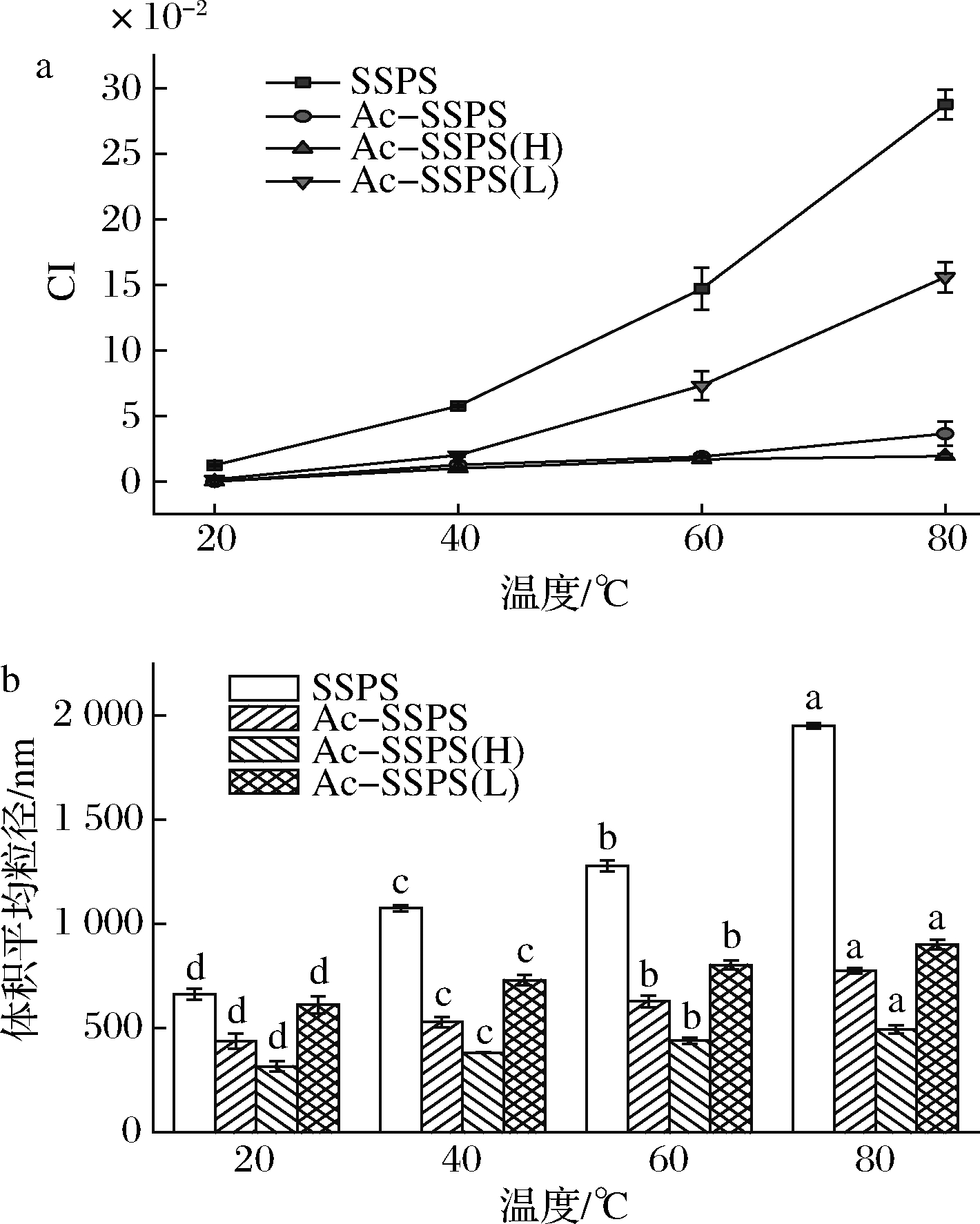
为探究温度对纳米乳液稳定性的影响,分别测定了由SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)稳定的O/W型新鲜乳液经20、40、60、80 ℃保温1 h并静置24 h后的CI和粒径变化,结果如图7所示。SSPS经不同温度的热处理后,CI随着温度的升高显著增加,粒径也随之增加,这是因为随着温度的升高,乳滴之间的碰撞加剧,乳滴发生不同程度的聚集。而SSPS经乙酰化改性后其乳液稳定性受温度影响较小,乳液粒径仍能维持在纳米级,由Ac-SSPS(H)稳定的乳液经80 ℃热处理后,未出现明显乳析现象且粒径仍在500 nm以内。在不同温度的热处理下,乳液CI和粒径的大小顺序均为SSPS>Ac-SSPS(L)>Ac-SSPS>Ac-SSPS(H),这是因为SSPS依靠结构中蛋白质的疏水作用起到乳化和稳定乳液的作用,蛋白质易受温度影响而变性,从而影响了SSPS的乳化性。而SSPS经乙酰化改性后,主要依靠接入的乙酰基为疏水基团与亲水的糖链共同作用来稳定油-水界面,乙酰基受温度影响小,故经乙酰化改性后的SSPS所稳定的乳液耐热性更好。Ac-SSPS(L)中主要是小分子糖,糖链较短,经热处理后体系分子间碰撞加剧,连续相中的水分子较易从其稳定的网络结构中析出,出现了明显的乳析现象,乳液中油滴逐渐聚集,乳滴粒径随之增大。而Ac-SSPS(H)分子质量大、高分子长链较多,且乙酰基含量较多故其受温度影响小,表现出出色的耐热稳定性。
a-乳析指数变化;b-粒径变化
图7 温度对SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L) 纳米乳液的乳析指数和粒径影响
Fig.7 Effect of temperature on the CI and particle sizes of nano-emulsions stabilized by SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L)
注:同一图例下不同小写字母表示差异性显著(下同)
2.4.4 pH对纳米乳液稳定性的影响
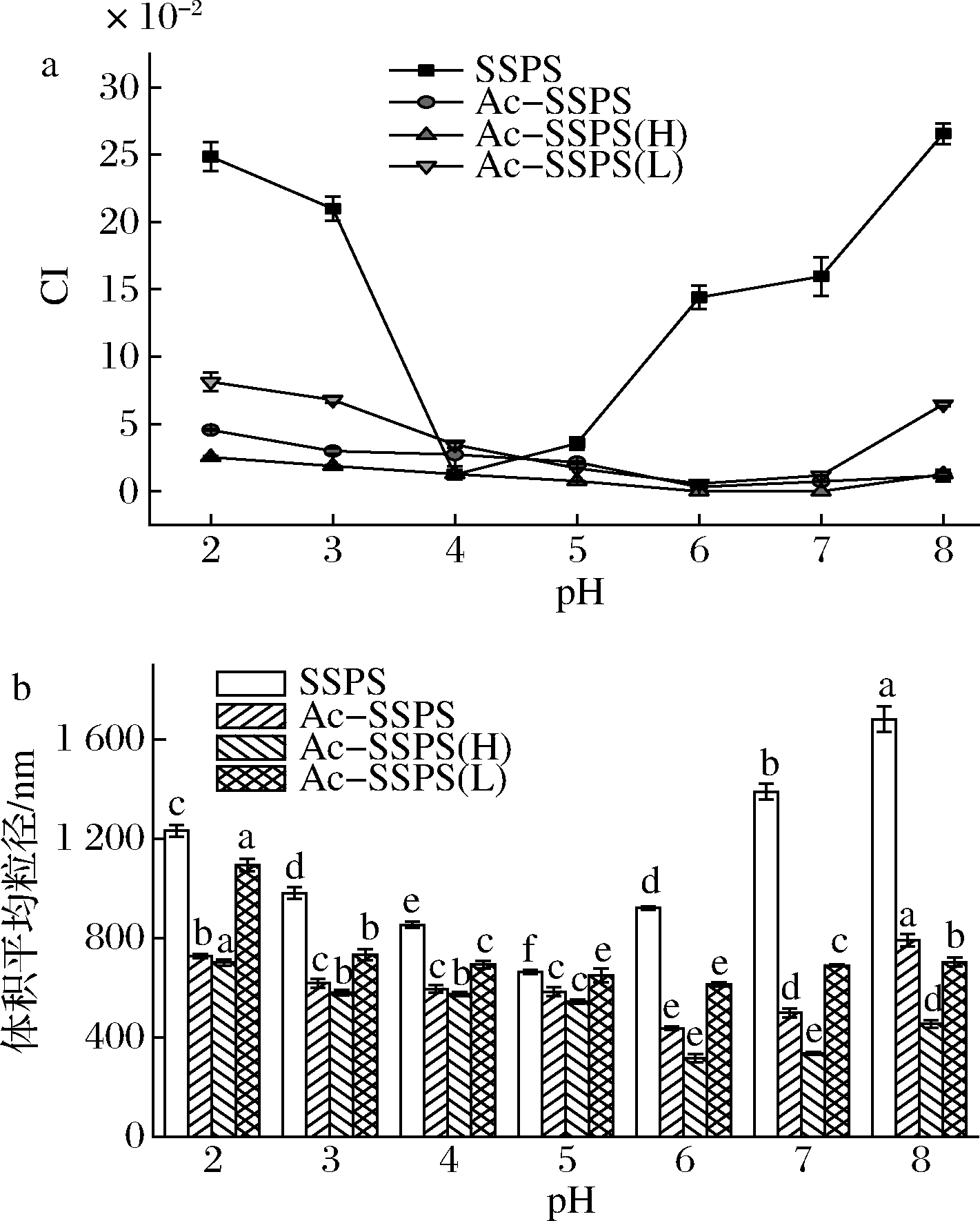
为探究pH对乳液稳定性的影响,分别将由SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)稳定的新鲜纳米乳液调至不同pH并静置24 h后测定CI和粒径变化,结果如图8所示。可见SSPS稳定的乳液在pH为4~5的偏酸性环境中稳定性较好,这可能与SSPS是阴离子多糖有关。但其受pH变化的影响较大,因为SSPS主要依靠结构中的蛋白质发挥疏水作用吸附在油滴表面,而蛋白质受pH影响较大,故pH值的变化影响了蛋白对油滴的吸附作用,破坏了SSPS在油-水界面的平衡,使得油滴聚集。相比之下,经乙酰化改性后SSPS的乳液稳定性受pH的影响较小,其CI和粒径大小在不同pH条件下均表现为Ac-SSPS(L)>Ac-SSPS>Ac-SSPS(H),且均在pH 6~7的中性环境中稳定效果更好。pH的变化会导致体系中游离的半乳糖醛酸发生解离或质子化,使得乳滴间的静电作用力发生变化,而Ac-SSPS(H)稳定的乳液受pH变化的影响较小,说明其高分子链在油-水界面舒展产生的空间位阻作用足以达到阻止油滴聚集从而稳定乳液的作用,对多糖的静电作用力依赖性较小。而Ac-SSPS(L)由于分子质量小、糖链较短,故其主要依靠糖链的空间位阻效应和静电作用力协同作用来稳定乳液,当体系pH值过酸或过碱时,其静电作用力被破坏,仅靠空间位阻作用难以维持乳液的稳定,所以出现了一定程度的乳析现象和粒径的增大。
a-乳析指数变化;b-粒径变化
图8 pH对SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L) 纳米乳液的乳析指数和粒径影响
Fig.8 Effect of pH on the CI and particle sizes of nano-emulsions stabilized by SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L)
2.4.5 纳米乳液的贮藏稳定性分析
由图9可知,在28 d的贮藏时间中,由Ac-SSPS(H)稳定的纳米乳液未出现明显的乳析现象,粒径也未出现显著变化,表现出较好的贮藏稳定性。由SSPS稳定的乳液在贮藏7 d时出现乳析现象,粒径也显著增大到微米级,且在整个贮藏过程中CI和粒径都明显高于乙酰化改性多糖所形成的乳液。对于乙酰化改性后的大豆多糖,其CI和粒径呈现随着分子质量的增大而减小的趋势。其原因在于乙酰基团的接入增大了SSPS的两亲性,与结构中蛋白质共同作用于油滴表面,而多糖的亲水基团则存在于水相中,在水-油界面形成水化层,Ac-SSPS(H)分子质量大,乙酰基含量高、侧链较长,使得其在水-油界面的吸附更为稳定,且乳液较高的黏度也能更好地阻止体系内油滴的聚集而失稳。以上多种因素的协同作用,使得由Ac-SSPS(H)稳定的纳米乳液表现出更好的贮藏稳定性。
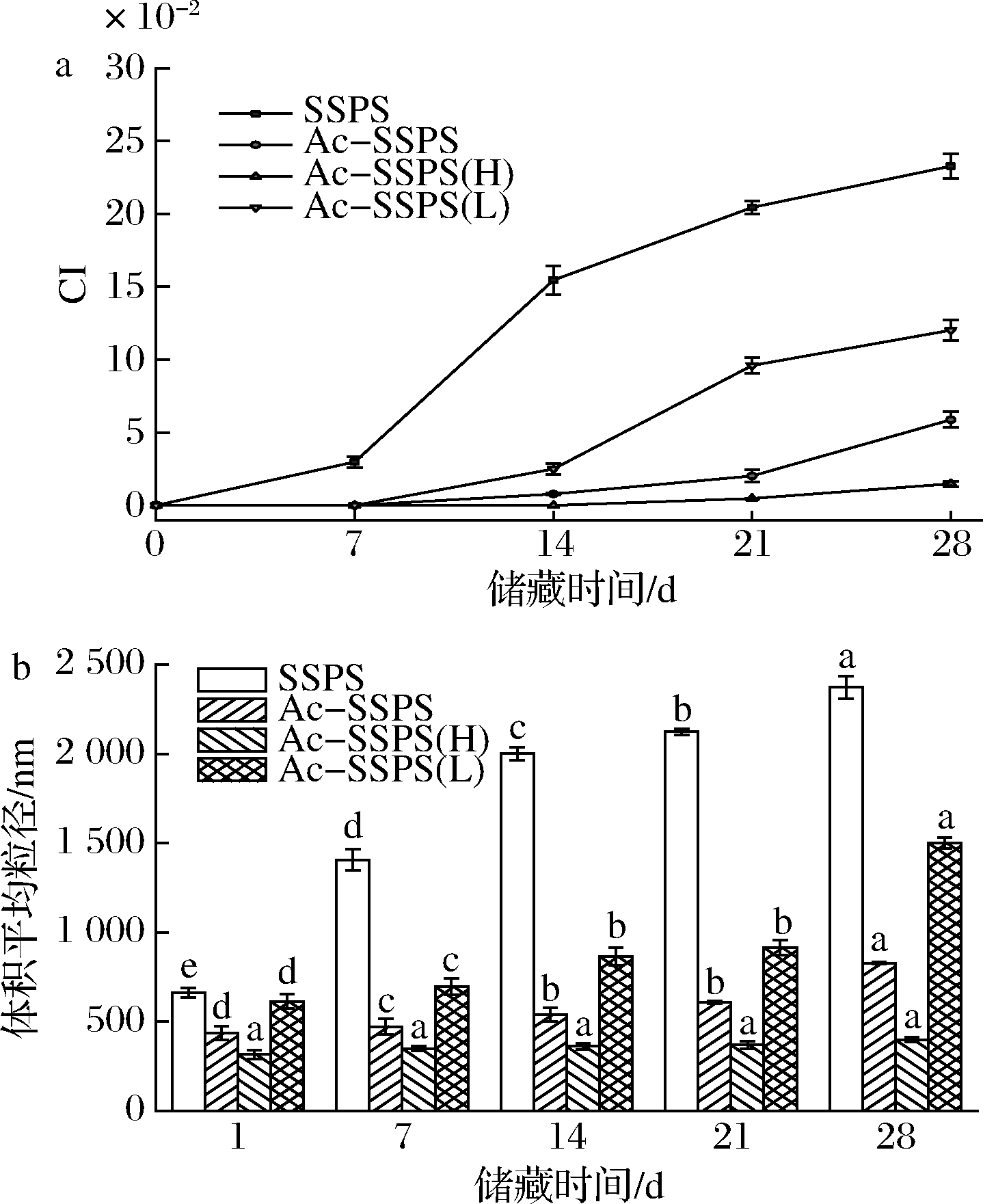
a-乳析指数变化;b-粒径变化
图9 SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)的 纳米乳液在贮藏过程中乳析指数变化
Fig.9 CI and particle sizes of nano-emulsions stabilized by SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L) during storage
2.4.6 纳米乳液的Zeta电位分析
图10为4种乳液体系在28 d贮藏期内的电位值变化,在不同贮藏时间,SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)稳定的纳米乳液Zeta电位绝对值均>30 mV,可知静电斥力对稳定乳液有一定作用[23]。4种乳液体系的电位绝对值在贮藏过程中均逐渐增大,主要是因为乳液中的多糖分子在贮藏过程中负电荷逐步裸露,使体系负电荷增加[25]。SSPS稳定的乳液电位绝对值最大,且在贮藏过程中增长最明显,但其稳定效果最差,在贮藏过程中出现明显的黄色油层上浮,可能是SSPS分子间的静电作用力太强,破坏油水界面的平衡,油滴发生聚集而上浮,且Zeta电位的大小表示保持个体胶束的稳定程度,无法表示体系内较大的油滴的上浮情况[26]。
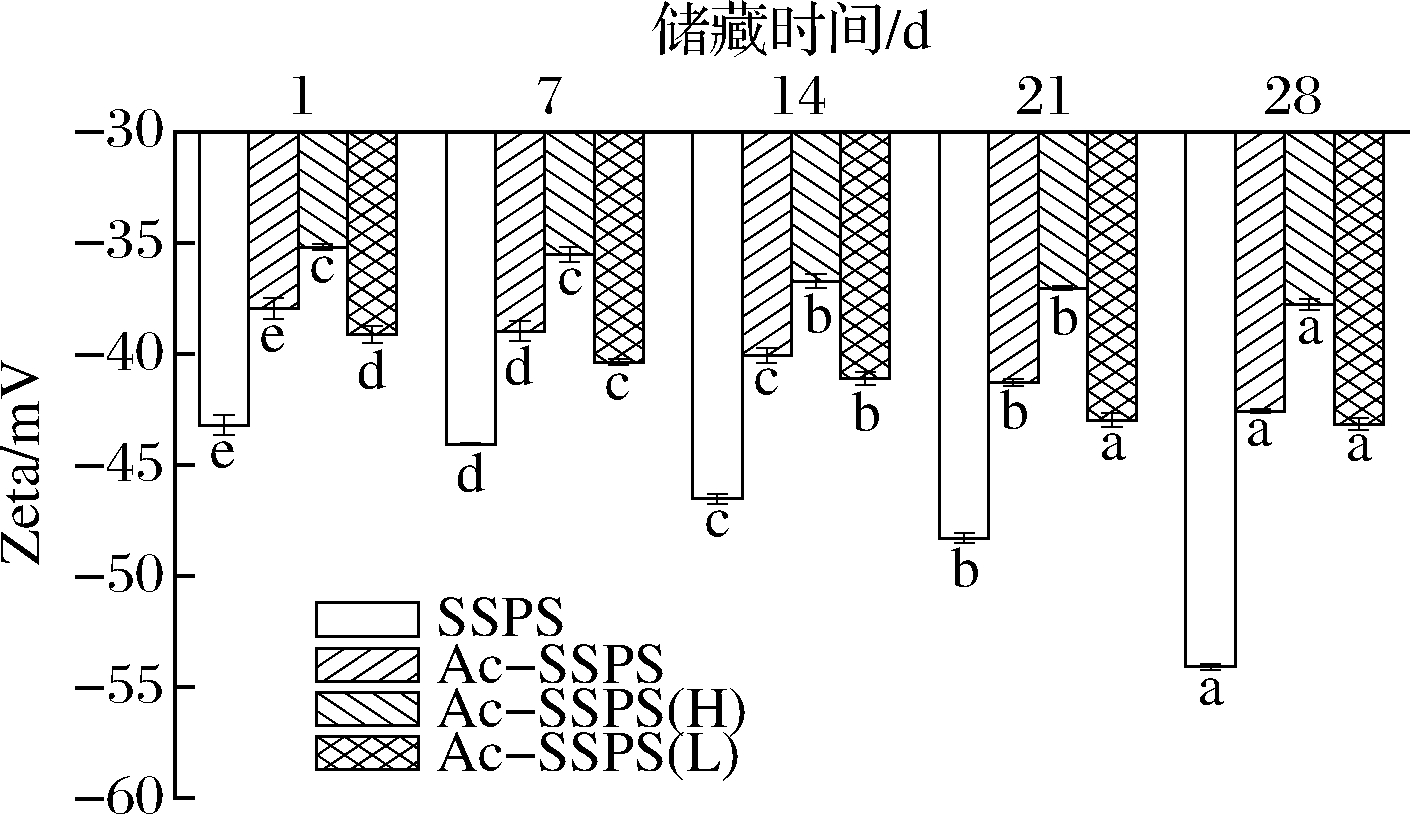
图10 SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L) 稳定的纳米乳液在贮藏过程中Zeta电位变化
Fig.10 Zeta-potentials of nano-emulsions stabilized by SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L) during storage
Ac-SSPS(H)稳定的乳液的电位值较小,且在贮藏过程中变化小,说明较低的静电斥力有利于多糖分子在油水界面的有序排列,且Ac-SSPS(H)乙酰化度高、分子质量大,大部分乙酰基存在于油相。
2.4.7 CLSM分析
用CLSM技术观察乳液中油滴的分布状态,如图11所示,由SSPS稳定的乳液中油滴尺寸大、均匀度低,且在贮藏1 d时就出现油滴聚集状态,在贮藏14 d时聚集更明显,出现更大颗粒的油滴。相比之下,乙酰化改性之后的多糖所稳定的乳液在贮藏过程中,油滴尺寸小、体系均一性较高,说明乙酰化改性能有效提高SSPS的乳化稳定性。三者中,由Ac-SSPS(H)稳定的乳液液滴尺寸最小,体系均匀度最高,Ac-SSPS次之,而Ac-SSPS(L)由于其分子质量小、链长较短,难以较好地包裹住油滴,阻止其聚集,故由Ac-SSPS(L)稳定的乳液稳定性欠佳。
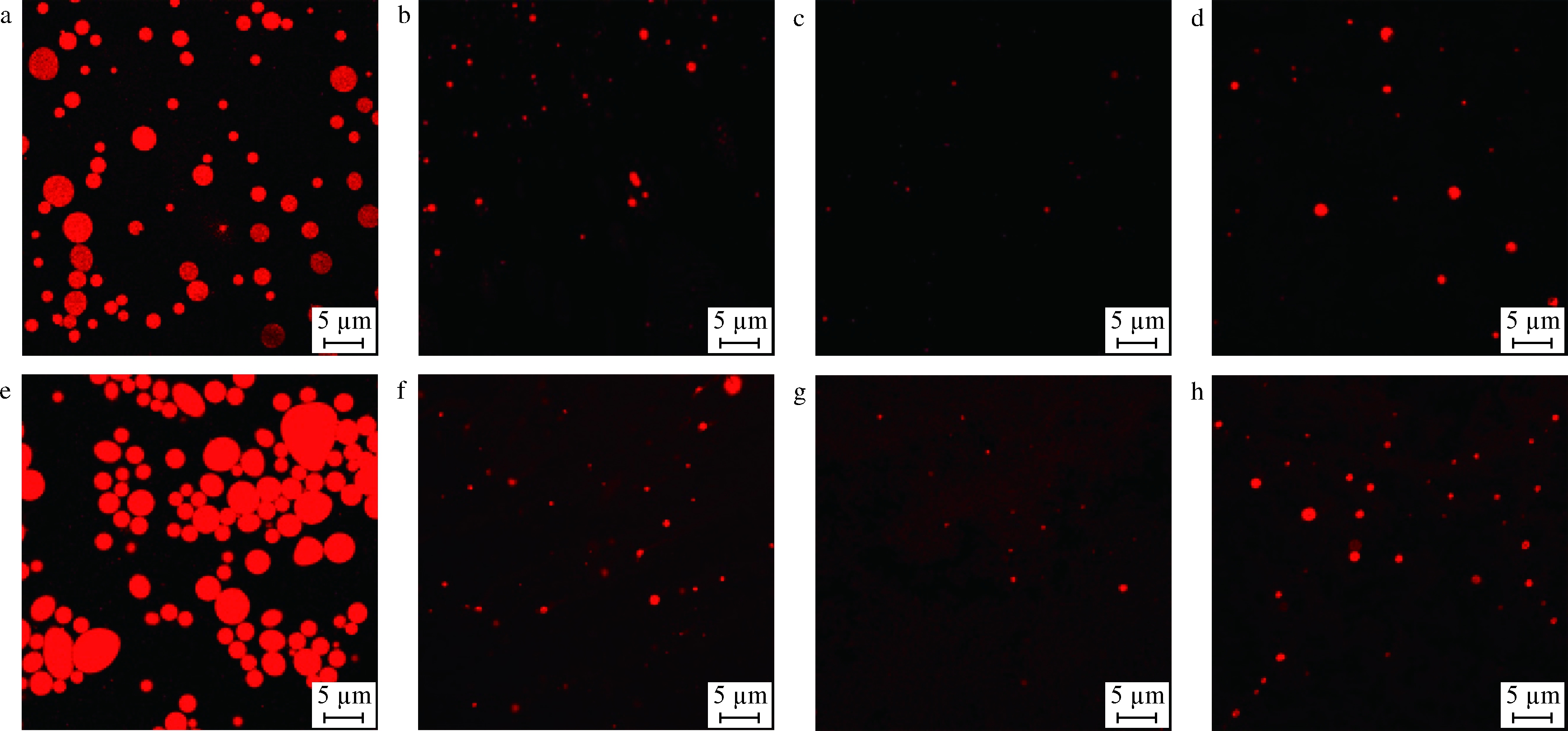
a-SSPS稳定的纳米乳液贮藏1 d;b-Ac-SSPS稳定的纳米乳液贮藏1 d;c-Ac-SSPS(H)稳定的纳米乳液贮藏1 d; d-Ac-SSPS(L)稳定的纳米乳液贮藏1 d;e-SSPS稳定的纳米乳液贮藏14 d;f-Ac-SSPS稳定的纳米乳液贮藏14 d; g-Ac-SSPS(H)稳定的纳米乳液贮藏14 d;h-Ac-SSPS(L)稳定的纳米乳液贮藏14 d
图11 SSPS、Ac-SSPS、Ac-SSPS(H)和Ac-SSPS(L)的纳米乳液在贮藏过程中激光共聚焦图像
Fig.11 The CLSM images of nano-emulsions stabilized by SSPS, Ac-SSPS, Ac-SSPS(H) and Ac-SSPS(L) during storage
3 结论
利用乙酸酐和SSPS在碱性水溶液中反应制备乙酰化可溶性大豆多糖,并将其进行超滤分离,得到2种分子质量范围的改性多糖。通过FT-IR和1H NMR光谱表征超滤分离前后乙酰化可溶性大豆多糖的结构,表明SSPS成功引入乙酰基团,且不同分子质量范围内均有乙酰基团的接入。与未改性的大豆多糖相比,乙酰化可溶性大豆多糖表现出更好的乳化活性和乳化稳定性,其稳定的纳米乳液稳定性受温度和pH影响较小,且在贮藏过程中黏度、CI、粒径、Zeta电位和乳滴聚集程度变化较小,表现出更好的贮藏稳定性。相对而言,经超滤分离得到的大分子质量乙酰化可溶性大豆多糖表现出最为出色的乳化性能。因此,乙酰化可溶性大豆多糖作为乳化剂、乳液稳定剂或活性成分的载体应用于食品生产中有良好的发展前景。
[1] NAKAMURA A,FURUTA H,MAEDA H,et al.Analysis of structural components and molecular construction of soybean soluble polysaccharides by stepwise enzymatic degradation[J].Bioscience Biotechnology and Biochemistry,2001,65(10):2 249-2 258.
[2] NAKAMURA A,FURUTA H,MAEDA H,et al.Structural studies by stepwise enzymatic degradation of the main backbone of soybean soluble polysaccharides consisting of galacturonan and rhamnogalacturonan[J].Bioscience,Biotechnology,and Biochemistry,2002,66(6):1 301-1 313.
[3] LIN D R,LONG X M,XIAO L J,et al.Study on the functional properties and structural characteristics of soybean soluble polysaccharides by mixed bacteria fermentation and microwave treatment[J].International Journal of Biological Macromolecules,2020,157:561-568.
[4] WU J E,LIN J,ZHONG Q X.Physical and antimicrobial characteristics of thyme oil emulsified with soluble soybean polysaccharide[J].Food Hydrocolloids,2014,39:144-150.
[5] LI H,ZHAO H,GAO Z,et al.The antioxidant and anti-aging effects of acetylated mycelia polysaccharides from Pleurotus djamor[J].Molecules (Basel,Switzerland),2019,24(15).DOI:10.3390/molecules24152698.
[6] SONG X L,ZHANG J J,LI J,et al.Acetylated polysaccharides from Pleurotus geesteranus alleviate lung injury via regulating NF-κB signal pathway[J].International Journal of Molecular Sciences,2020,21(8):2 810.
[7] 房芳, 柳春燕,陈靠山,等.多糖乙酰化修饰的最新研究进展[J].黑龙江八一农垦大学学报,2017,29(2):42-47.
FANG F,LIU C Y,CHEN K S,et al.Latest research progress on acetylation modification of polysaccharide[J].Journal of Heilongjiang Bayi Agricultural University,2017,29(2):42-47.
[8] TSERKI V,ZAFEIROPOULOS N E,SIMON F,et al.A study of the effect of acetylation and propionylation surface treatments on natural fibres[J].Composites Part A:Applied Science and Manufacturing,2005,36(8):1 110-1 118.
[9] GRONDAHL M,TELEMAN A,GATENHOLM P.Effect of acetylation on the material properties of glucuronoxylan from aspen wood[J].Carbohydrate Polymers,2003,52(4):359-366.
[10] RALET M C,CREPEAU M J,BUCHHOLT H C,et al.Polyelectrolyte behaviour and calcium binding properties of sugar beet pectins differing in their degrees of methylation and acetylation[J].Biochemical Engineering Journal,2003,16(2):191-201.
[11] NTAZINDA A,CHESEREK M J,SHENG L X,et al.Combination effect of sodium carboxymethyl cellulose and soybean soluble polysaccharides on stability of acidified skimmed milk drinks[J].Dairy Science & Technology,2014,94(3):283-295.
[12] XIONG X H,ZHAO L P,CHEN Y M,et al.Effects of alkali treatment and subsequent acidic extraction on the properties of soybean soluble polysaccharides[J].Food and Bioproducts Processing,2015,94:239-247.
[13] LEE J H,HAN J-A,LIM S-T.Effect of pH on aqueous structure of maize starches analyzed by HPSEC-MALLS-RI system[J].Food Hydrocolloids,2009,23(7):1 935-1 939.
[14] TANG C H,YANG X Q,CHEN Z,et al.Physicochemical and structural characteristics of sodium caseinate biopolymers induced by microbial transglutaminase[J].Journal of Food Biochemistry,2005,29(4):402-421.
[15] LU W,ZHENG B D,MIAO S.Improved emulsion stability and modified nutrient release by structuring O/W emulsions using konjac glucomannan[J].Food Hydrocolloids,2018,81:120-128.
[16] ZHAO Y G,KHALID N,SHU G F,et al.Formulation and characterization of O/W emulsions stabilized using octenyl succinic anhydride modified kudzu starch[J].Carbohydrate Polymers,2017,176:91-98.
[17] ZHAO L,TONG Q Y,WANG H N,et al.Emulsifying properties and structure characteristics of octenyl succinic anhydride-modified pullulans with different degree of substitution[J].Carbohydrate Polymers,2020,250:116 844.
[18] 于培玲. 水溶性大豆多糖的提取、纯化及其结构性质的测定研究[D].广州:华南理工大学,2018.
YU P L.Extraction and purification of water-soluble soybean polysaccharides and determination of their structural properties[D].Guangzhou:South China University of Technology,2018.
[19] JU-NAM Y,LEAD J R.Manufactured nanoparticles:An overview of their chemistry,interactions and potential environmental implications[J].The Science of the Total Environment,2008,400(1-3):396-414.
[20] 杨玉红. 食品化学[M].北京:中国轻工业出版社,2012.
YANG H Y.Food Chemistry[M].Beijing:China Light Industry Press,2012.
[21] GESTRANIUS M,STENIUS P,KONTTURI E,et al.Phase behaviour and droplet size of oil-in-water Pickering emulsions stabilised with plant-derived nanocellulosic materials[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2017,519:60-70.
[22] NECHYPORCHUK O,BELGACEM M N,PIGNON F.Current progress in rheology of cellulose nanofibril suspensions[J].Biomacromolecules,2016,17(7):2 311-2 320.
[23] 丁萍, 汪明明,迟坤蕊,等.果胶甲酯化反应及应用高甲氧基果胶制备纳米乳液[J].食品与发酵工业,2018,44(8):188-195.
DING P,WANG M M,CHI K R,et al.Pectin methoxylation and its application in preparation high methoxyl pectin nano-emulsion[J].Food and Fermentation Industries,2018,44(8):188-195.
[24] GUERRA-ROSAS M I,MORALES-CASTRO J,OCHOA-MARTINEZ L A,et al.Long-term stability of food-grade nanoemulsions from high methoxyl pectin containing essential oils[J].Food Hydrocolloids,2016,52:438-446.
[25] LE B,PHAM T N A,YANG S H.Prebiotic potential and anti-inflammatory activity of soluble polysaccharides obtained from soybean residue[J].Foods (Basel,Switzerland),2020,9(12):1 808.
[26] 孙鹏飞, 邓卫星,彭锦雯.阴离子型有机硅乳液的乳胶粒粒径分布及ζ电位的研究[J].有机硅材料,2009,23(1):13-16.
SUN P F,DENG W X,PENG J W.Particle size distribution and the ζ potential of anionic polysilicone emulsion[J].Silicone Material,2009,23(1):13-16.