氧化作用以及由病原微生物引起的微生物变质会缩短食品的货架期已成为全球关注的主要问题,而旨在控制食品氧化和微生物生长的食品包装材料为延长货架期提供了一种有效的解决办法[1-2]。当前使用的活性包装材料大多在与食品直接接触后才发挥作用[3],对固体食品有限的功效以及安全性是限制其普遍使用的主要因素[4-5]。精油是掺入固体食品包装材料中的极具吸引力的化合物,因为它们是天然且高效的抗菌剂和抗氧化剂,可以挥发到包装的顶部空间,对食品表面和顶部空间环境进行杀菌[6-7],而且已获得美国食品药品监督管理局(Food and Drug Administration, FDA)批准,通常被认为是安全的,可用于食品用途[8]。大量研究致力于将这些敏感活性物质掺入包装材料中,同时最大程度地减少它们在加工过程中的损失并保持其抗菌抗氧化功能[9]。
与将精油直接加入聚合物中相比,将其封装在纳米载体中可以更好地控制释放速率,提供有效且持久的抗菌抗氧化性能[13]。埃洛石纳米管(halloysite nanotube,HNT)是一种天然且廉价的纳米粒子,分子式为A12Si2O5(OH)·nH2O,具有较大的中空管腔结构,长度在0.2~1.5 μm,外径为50~75 nm,管腔内径为10~30 nm,能够有效负载活性物质,延长作用时间,且在聚合物包装材料中有较好的分散性,能够改善包装材料的阻隔性能与力学性能,在活性包装材料研究中具有极大的应用潜力[16]。尽管HNT确实延长了精油作用时间,但是精油在HNT中的负载量较低以及初期的快速释放在一定程度上限制了其在活性包装中进一步发展。
本文选用牛至精油主要活性成分香芹酚作为精油模型,使用4 mol/L盐酸对HNT内壁氧化铝层进行刻蚀,增大了其比表面积,利用真空负载法将香芹酚封装在经4 mol/L盐酸刻蚀后的HNT中,制备了埃洛石纳米管-香芹酚复合物,提高了香芹酚的负载量,再通过吸附正负聚电解质对埃洛石纳米管-香芹酚复合物进行包封,显著降低了香芹酚初期释放速率,具有明显的控释效果,为精油在抗菌抗氧化食品包装材料中的开发和应用积累数据。
1 材料与方法
1.1 试验材料
HNT、香芹酚、聚乙烯亚胺(polyethyleneimine,PEI,Mw≈10 000 Da)、聚苯乙烯磺酸钠(polystyrene sulfonate, PSS,Mw≈70 000 Da),分析纯,上海阿拉丁生化科技股份有限公司;盐酸、无水乙醇,分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
WH220-HT磁力搅拌器,德国Wiggens;Q700超声波破碎仪,美国QSONICA;RJ-DTL-50A低速台式离心机,无锡瑞江分析仪器有限公司;Autosorb-IQ氮气吸附仪,美国康塔仪器公司;Alpha红外光谱仪,布鲁克公司;JEM-2100F透射电子显微镜,日本电子株式会社(JEOL);TA Q500热重分析仪,美国TA仪器公司;UV-1800紫外分光光度计,日本岛津公司;Zeta SIZER2000电位测定仪,美国MALVERN公司。
1.3 试验方法
1.3.1 HNT酸刻蚀
称取5 g HNT置于100 mL三口烧瓶中,接着加入80 mL的4 mol/L盐酸溶液。80 ℃下水浴加热,磁力搅拌反应8 h。反应结束后,将埃洛石悬浮液离心5 min分离出固体物质,去离子水洗涤后烘干研磨,得到4 mol/L盐酸刻蚀后的HNT,并命名为HNT-4M。
1.3.2 香芹酚负载
分别将HNT、HNT-4M与香芹酚以固液比为0.1∶1(g∶mL)的比例混合。将混合后的悬浮液在冰浴中超声处理30 min(超声2 s,关闭3 s)。然后将悬浮液转移至连接了真空泵的真空干燥器中,开启真空泵进行抽真空,当干燥器内的真空度达到-0.1 MPa后,保持30 min,然后恢复至常压(抽真空过程中除去了管腔内部空气,恢复常压过程中香芹酚通过空气压力被加载到管腔内部),重复该操作2次以增加负载效率。5 000 r/min离心5 min,分离出悬浮液中的固相,再用乙醇离心洗涤2次,除去外表面吸附的香芹酚分子,真空干燥24 h后研磨成粉状,得到HNT负载香芹酚的复合物与HNT-4M负载香芹酚的复合物,分别命名为HNT/carvacrol、HNT-4M/carvacrol。
1.3.3 聚电解质封装
用去离子水配制质量浓度为2 mg/mL的PEI和PSS聚电解质溶液。将一定量的HNT-4M/carvacrol复合物按质量比2∶8加入PEI溶液,室温下搅拌混合10 min,离心分离出固相,去离子水洗涤,完成第一层包封;再加入与PEI溶液等体积的PSS溶液,搅拌10 min,再进行分离和洗涤,完成第二层包封。重复上述步骤,依次完成第三层、第四层包封,最后将不同包封层数的HNT-4M/carvacrol复合物真空干燥24 h,研磨成粉状。
1.3.4 香芹酚释放速率测定
在23 ℃、相对湿度50%的恒温恒湿箱中进行释放试验,每隔5 d准确称取0.05 g复合物于离心管中,加入10 mL无水乙醇,超声25 min,4 ℃下放置24 h后,以5 000 r/min离心15 min,取上清液,无水乙醇稀释,用紫外分光光度计测量稀释溶液的吸光度,代入香芹酚标准曲线中,计算出稀释溶液中的香芹酚浓度并推算出复合物中香芹酚的剩余含量,通过公式(1)计算香芹酚的释放率:
(1)
式中:V,香芹酚的释放率,%;n1,放置一定时间后复合物中香芹酚含量,mg/g;n2,复合物中香芹酚初始含量,mg/g。
1.3.5 性能测试
利用傅里叶变换红外光谱仪测定样品的官能团振动吸收峰来判定物质的变化(扫描400~4 000 cm-1);利用透射电子显微镜观测埃洛石纳米管酸刻蚀前后的形貌特征,测试加速电压为300 kV;利用氮气吸附仪(脱气温度150 ℃,脱气时间10 h)测定样品的在液氮恒温下的氮气吸附-脱附等温曲线,采用BET(brunauer-emett-teller)模型[19]计算埃洛石纳米管的比表面积;利用热重分析仪测定样品的热失重(氮气气氛下从30 ℃升至800 ℃,升温速度10 ℃/min);采用SIZER2000型Zeta电位测试仪,对不同包封层数后复合物悬浮液的Zeta电位进行分析。
2 结果与分析
2.1 埃洛石纳米管成分及结构形貌特征
2.1.1 成分分析
图1为HNT和HNT-4M的红外光谱图,3 621和3 693 cm-1处的吸收峰归属于Al—OH的—OH伸缩振动,1 029 cm-1处的吸收峰归属于Si—O的伸缩振动,913 cm-1处的吸收峰归属于Si—OAl的伸缩振动;与HNT相比,由于HNT-4M管腔内表面的氧化铝层被破坏,大量Al原子在酸刻蚀过程中被氢原子所取代,导致Al—OH减少,Si—OAl转变为Si—OH,HNT-4M在3 621和3 693 cm-1的Al—OH的—OH振动吸收峰以及913 cm-1处的吸收峰都出现了减弱的现象[20]。
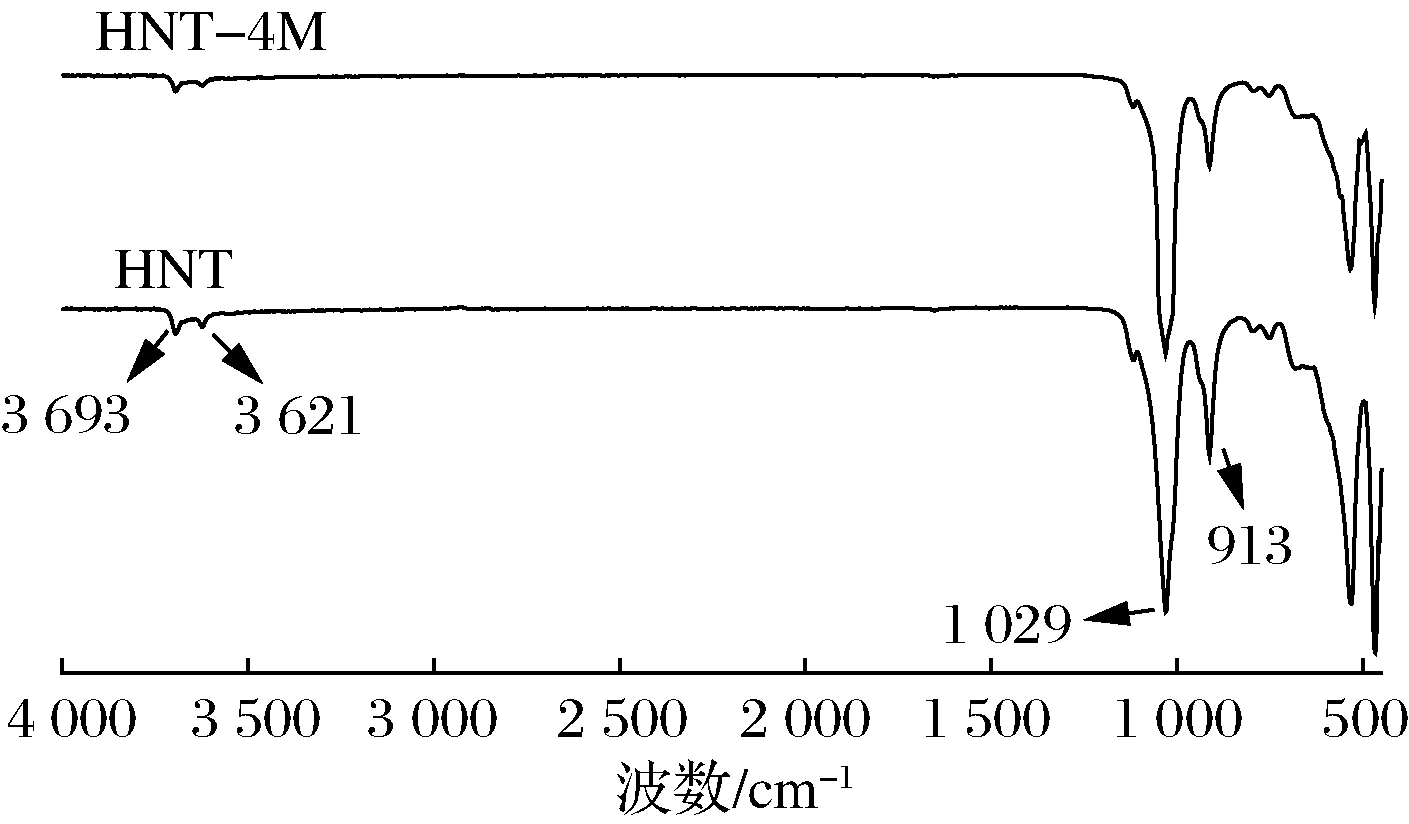
图1 HNT和HNT-4M的红外光谱图
Fig.1 FT-IR spectra of mesoporous HNT and HNT-4M
2.1.2 形貌结构分析
图2为HNT与HNT-4M的透射电镜图,从图2-a和图2-c中可以清晰看到HNT中空的管状形态,内外管壁平整光滑,管口并不整齐。从图2-b和图2-d中可以看到HNT-4M的外管壁形态并未发生变化,管口处以及内管壁有刻蚀痕迹,内表面变得凹凸不平,并能够观察到残留的纳米SiO2颗粒[21]。

a-未处理HNT;b-HNT-4M;c-未处理HNT(管口);d-HNT-4M(管口)
图2 HNT与HNT-4M的透射电镜图
Fig.2 Transmission electron microscopy images of HNT and HNT-4M
图3为HNT与HNT-4M的氮气吸附脱附等温线。该吸附脱附曲线类似于Ⅳ型,在较低的P/P0区域,吸附气体的量随P/P0的增加而缓慢增加,在0.4<P/P0<1.0的范围内观察到了回滞环,这是由HNT的介孔孔隙在吸、脱附时出现了毛细管凝聚导致的,且孔径增大的HNT-4M的回滞环也随之变大[22];通过BJH模型分析计算得出HNT与HNT-4M的比表面积如表1所示,HNT-4M的比表面积由29.506 m2/g增加到95.577 m2/g,孔容由0.196 cm3/g增加到0.329 cm3/g,这与通过TEM图像揭示的微观结构变化是一致的,由于HNT内管壁被酸刻蚀,[AlO6]八面体被溶解,形成的微孔扩大了管腔内径,增大了比表面积与孔容。
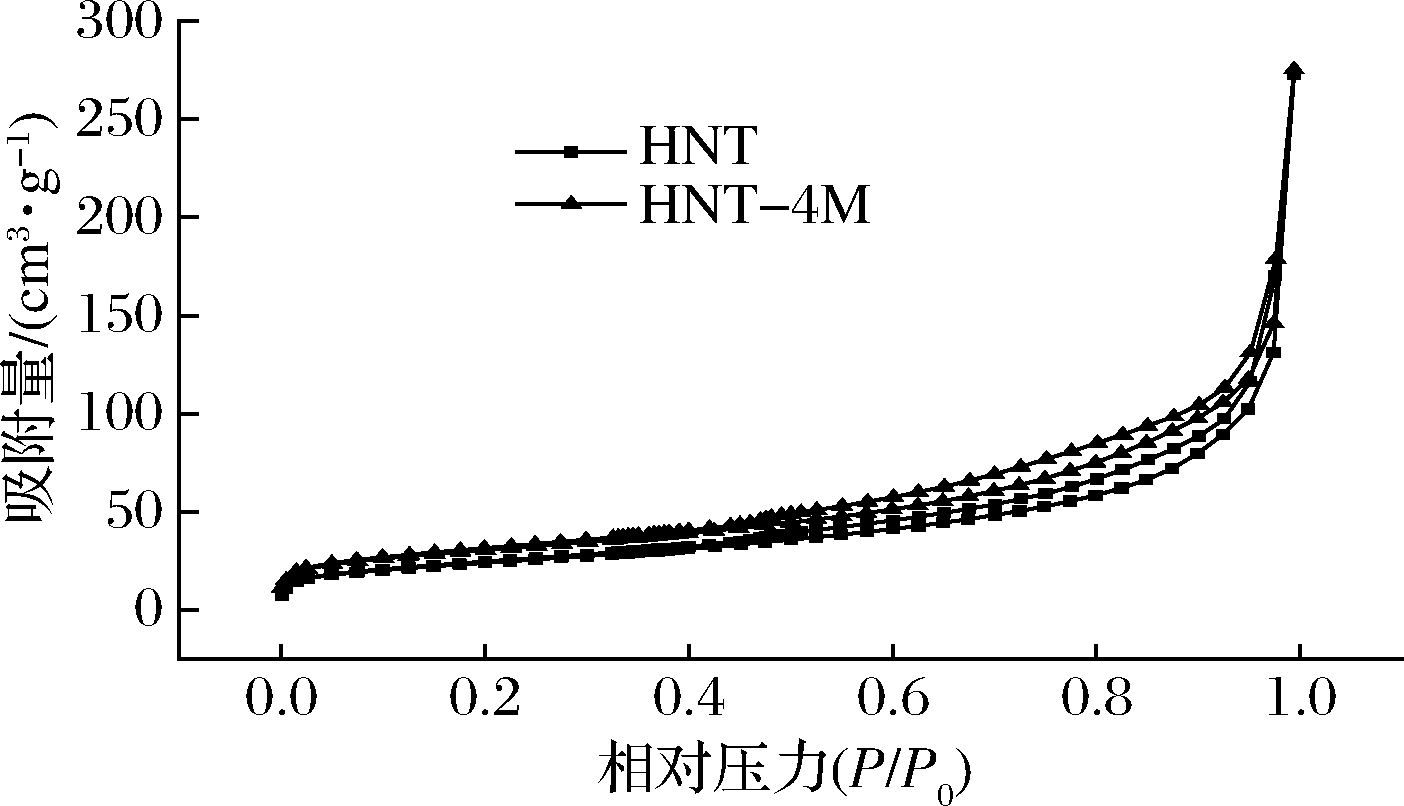
图3 HNT和 HNT-4M的氮气吸附-脱附等温曲线
Fig.3 Nitrogen adsorption-desorption isotherm of HNT and HNT-4M
表1 HNT and HNT-4M的比表面积与孔容数据
Table 1 Specific surface area and pore volume of HNT and HNT-4M

样品比表面积/(m2·g﹣1)孔容/(cm3·g﹣1)HNT29.5060.196HNT-4M95.5770.329
2.2 热稳定性与香芹酚负载量分析
图4为HNT、HNT/carvacrol和HNT-4M/carvacrol的热重分析图,HNT的热重曲线显示405~516 ℃时发生了约14%的质量损失,这是由于HNT的羟基脱失产生的,而HNT-4M/carvacrol在405~516 ℃失重量明显比HNT/carvacrol有所降低,说明羟基减少,这也与红外光谱图数据一致;与HNT相比,HNT/carvacrol与HNT-4M/carvacrol还在95~180 ℃出现了失重现象,这主要是负载在管腔内的香芹酚热分解脱失,通过这一阶段的失重率可间接推算出香芹酚在HNT上的负载量,计算得出HNT/carvacrol,HNT-4M/carvacrol的香芹酚负载量分别为6.7%,24.2%。由此可见,HNT经4 mol/L盐酸酸刻蚀后,将香芹酚的负载量提高了近4倍。
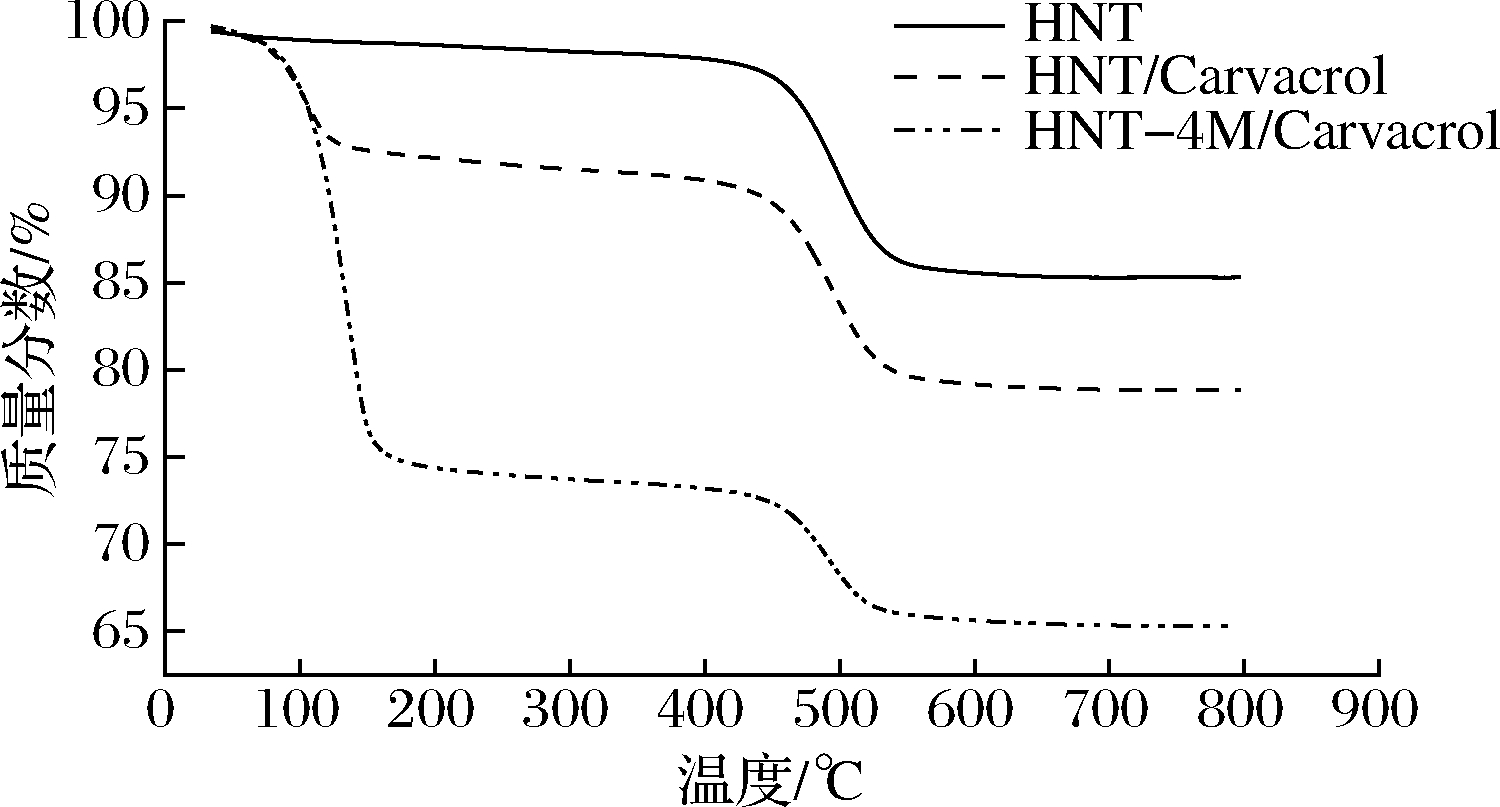
图4 HNT、HNT/carvacrol和HNT-4M/carvacrol的热重分析图
Fig.4 Thermogravimetric plots of HNT、HNT/carvacrol and HNT-4M/carvacrol
2.3 Zeta电位分析
如图5所示,HNT-4M/carvacrol复合物呈负电性,其电位值为-23.5 mV,这是因为HNT外表面具有丰富的羟基,在水中呈负电性。利用静电力作用,依次吸附带正电的PEI聚电解质和带负电的PSS聚电解质可以有效地包封HNT[23]。包封一层PEI聚电解质后,HNT-4M/carvacrol复合物电位值变为+30.2 mV,继续包封PSS后电位值变为-35.6 mV。随着正负聚电解质的包封,HNT-4M/carvacrol复合物的电位值出现正负交替变化。
2.4 HNT-4M/carvacrol包封后的热稳定性分析
图6是HNT-4M/carvacrol复合物包封后的热重分析图,包封后的HNT-4M/carvacrol复合物有3个失重阶段,比之未包封的HNT-4M/carvacrol复合物多出了250~450 ℃的失重阶段,且包封层数越大,失重越多,这主要是包封的PEI、PSS聚电解质的热分解脱失。另一方面,HNT内部负载的香芹酚也随着封装层数的增加而减少,这应该是HNT-4M/carvacrol复合物在封装过程中搅拌离心等操作造成香芹酚的流失所致,所以封装层数需要控制在2层以下,能够保留较高的香芹酚负载量。
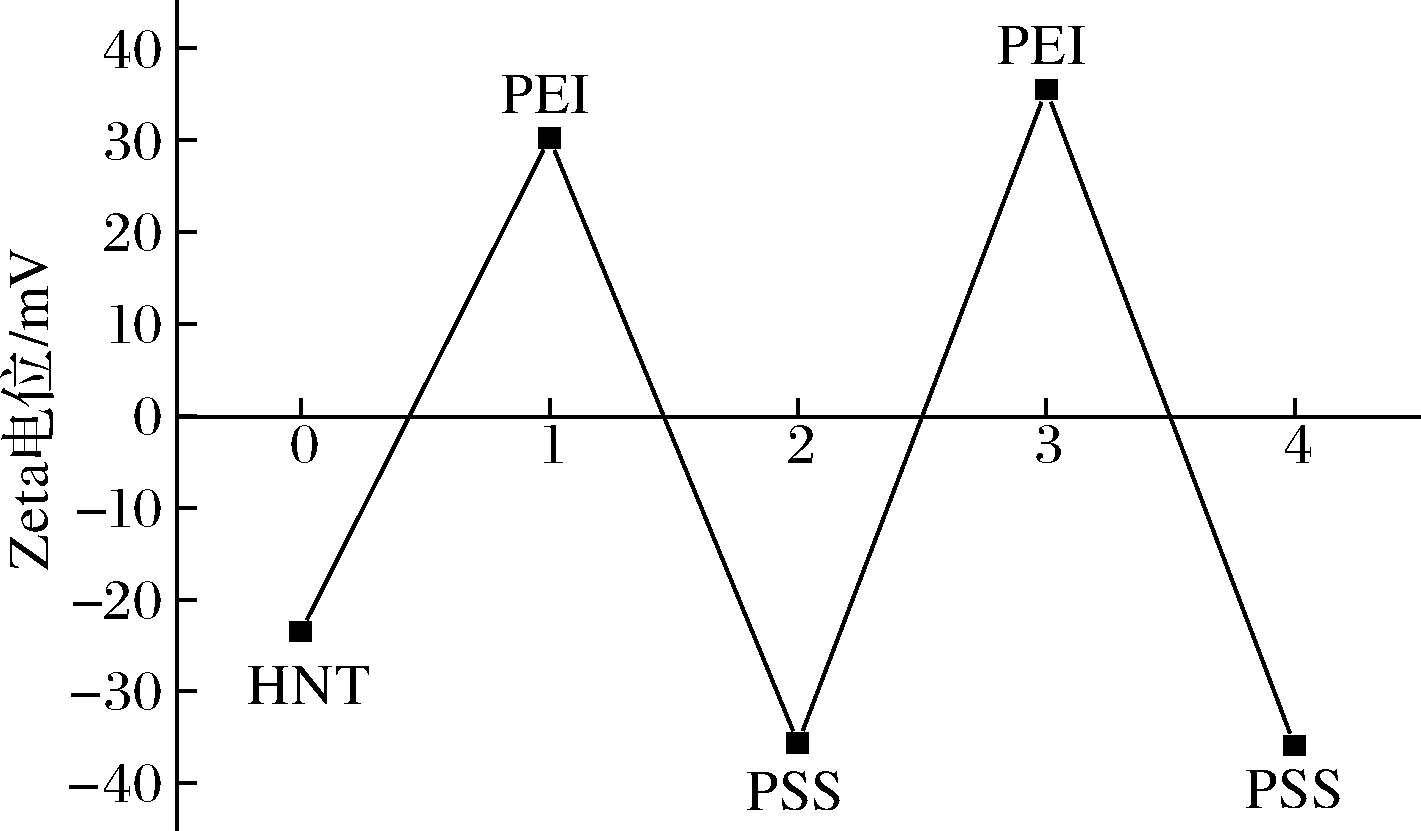
图5 HNT-4M/carvacrol复合物的Zeta电位
Fig.5 The Zeta potential of HNT-4M/carvacrol composites
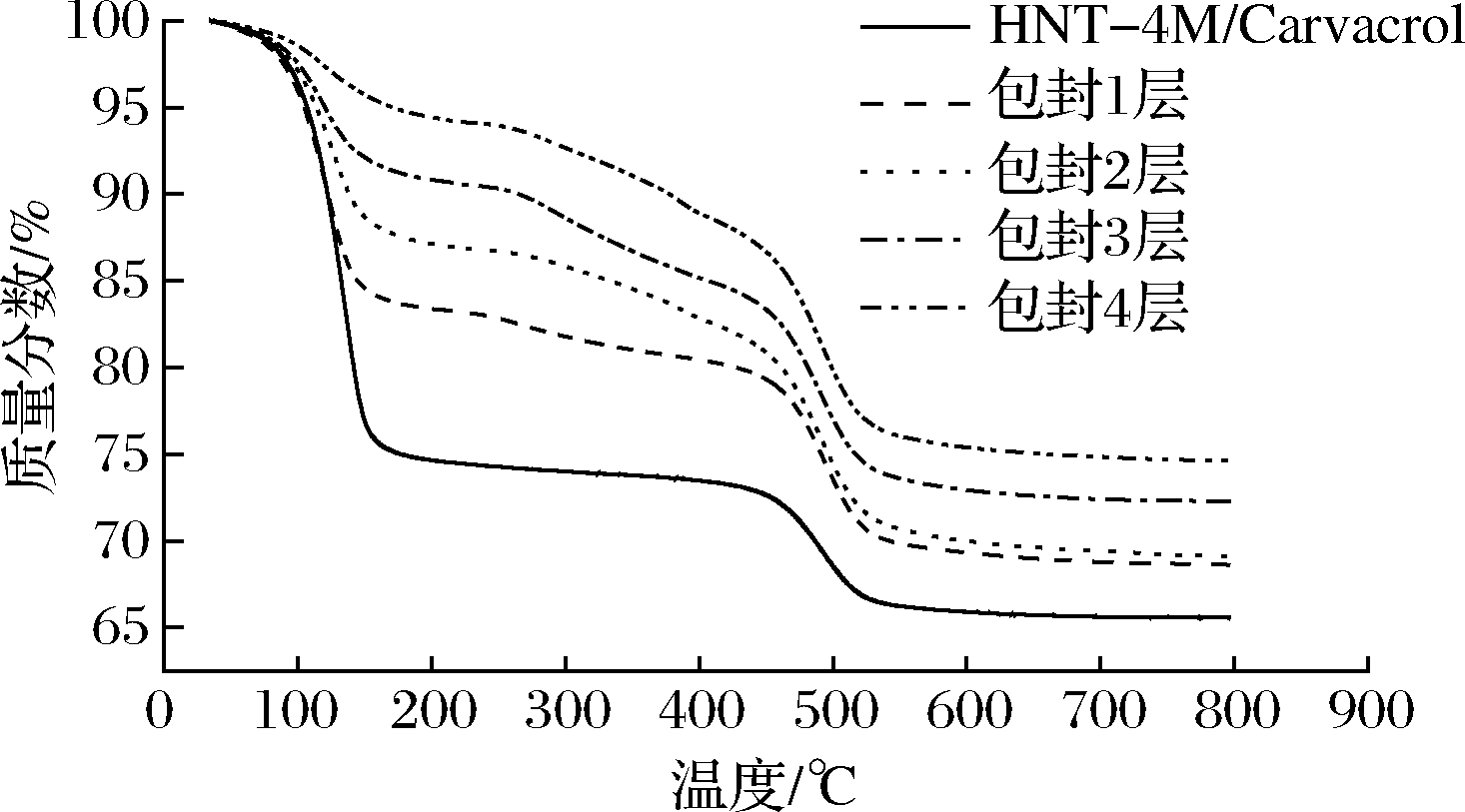
图6 HNT-4M/carvacrol复合物封装后的热重分析图
Fig.6 Thermogravimetric plots of HNT-4M/carvacrol with different layers
2.5 香芹酚的释放性能分析
2.5.1 香芹酚标准曲线绘制
用无水乙醇配制不同浓度的香芹酚溶液,再用紫外分光计在276 nm下测定不同浓度香芹酚溶液的吸光度,绘制吸光度-浓度的标准曲线,y=14.608 63x-0.004 76,R2=0.999 08,香芹酚溶液在0.01~0.08 mg/mL浓度下呈现良好的线性关系。
2.5.2 香芹酚的释放速率
图7是包封前后HNT-4M/carvacrol复合物中香芹酚的释放曲线,在23 ℃、50%相对湿度下,未包封的HNT-4M/carvacrol复合物在前期表现为快速释放,香芹酚的释放率几乎与时间成正比,20 d释放量达到67.4%后,释放速率开始变缓慢。而包封后的HNT-4M/carvacrol复合物中香芹酚的前期释放速率明显减缓,20 d后,包封1层与包封2层的HNT-4M/carvacrol复合物香芹酚的释放量分别为48.8%和38.7%。香芹酚初期释放速率的下降主要是因为正负聚电解质在纳米管外部和管口处形成了良好的包封层,提供了扩散屏障,减缓了香芹酚的释放,而且包封层数越多,缓释效果越明显。因此,聚电解质层在减缓香芹酚释放速率方面是有效可行的。
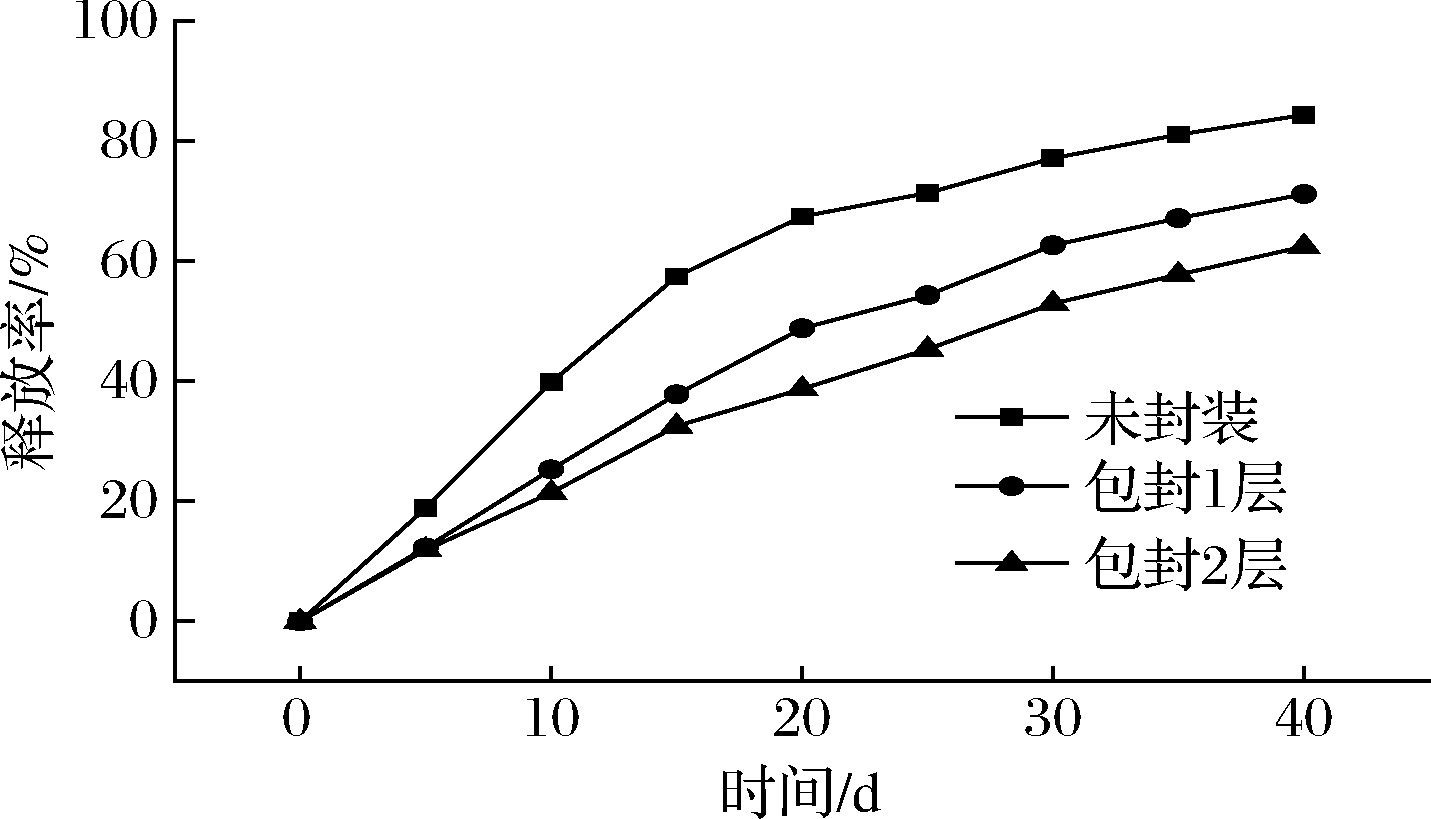
图7 不同封装层数HNT-4M/carvacrol复合物的释放曲线
Fig.7 The release profiles of HNT-4M/carvacrol composites with different layers
3 结论与讨论
本研究以4 mol/L盐酸刻蚀后的HNT作为香芹酚的缓释载体,将香芹酚的负载量由6.7%提高到24.2%。利用静电力作用依次吸附带正电的PEI聚电解质和带负电的PSS聚电解质,对HNT-4M/carvacrol复合物进行包封,结果表明,未包封的HNT-4M/carvacrol复合物20 d释放量达到67.4%,经聚电解质层包封1层与包封2层后,香芹酚的释放量降低为48.8%和38.7%,有效减缓了香芹酚从HNT中的释放速率。因此,酸刻蚀HNT与聚电解质包封为解决精油在HNT中的负载量较低以及初期的快速释放问题提供了有效可行的方法。
[1] IRKIN R,ESMER O K.Novel food packaging systems with natural antimicrobial agents[J].Journal of Food Science and Technology,2015,52(10):6 095-6 111.
[2] VILELA C,KUREK M,HAYOUKA Z,et al.A concise guide to active agents for active food packaging[J].Trends in Food Science & Technology,2018,80:212-222.
[3] OTONI C G,ESPITIA P J P,AVENA-BUSTILLOS R J,et al.Trends in antimicrobial food packaging systems:Emitting sachets and absorbent pads[J].Food Research International,2016,83:60-73.
[4] LLORENS A,LLORET E,PICOUET P A,et al.Metallic-based micro and nanocomposites in food contact materials and active food packaging[J].Trends in Food Science & Technology,2012,24(1):19-29.
[5] SYLVIE,GAILLET,JEAN-MAX,et al.Silver nanoparticles:Their potential toxic effects after oral exposure and underlying mechanisms-A review[J].Food and Chemical Toxicology,2015,77:58-63.
[6] HYLDGAARD M,MYGIND T,MEYER R L.Essential oils in food preservation:Mode of action,synergies,and interactions with food matrix components[J].Frontiers in Microbiology,2012,3(12):12.
[7] MURIELl-GALET V,CRAN M J,BIGGER S W,et al.Antioxidant and antimicrobial properties of ethylene vinyl alcohol copolymer films based on the release of oregano essential oil and green tea extract components[J].Journal of Food Engineering,2015,149:9-16.
[8] CALO J R,CRANDALL P G,O″BRYAN C A,et al.Essential oils as antimicrobials in food systems-A review[J].Food Control,2015,54:111-119.
[9] 李鑫玲,康怀彬,张慧芸.肉桂精油纳米胶囊制备表征及体外抗菌抗氧化能力[J].食品与发酵工业,2019,45(23):121-127.
LI X L,KANG H B,ZHANG H Y.Preparation and characterization of cinnamon essential oil-loaded and its antibacterial and antioxidant activities[J].Food and Fermentation Industry,2019,45(23):121-127.
[10] HYEOCK L M,YEON K S,JIN P H.Effect of halloysite nanoclay on the physical,mechanical,and antioxidant properties of chitosan films incorporated with clove essential oil[J].Food Hydrocolloids,2018,84:58-67.
[11] BIDDECI G,CAVALLARO G,DI B F,et al.Halloysite nanotubes loaded with peppermint essential oil as filler for functional biopolymer film[J].Carbohydrate Polymers,2016,152:548-557.
[12] 宋文龙,李洋洋,郜海燕,等.生姜精油微胶囊薄膜包装对秋葵保鲜效果的影响[J].食品与发酵工业,2020,46(8):142-148.
SONG W L,LI Y Y,GAO H Y,et al.Effect of ginger essential oil microcapsule film packaging on okra preservation [J].Food and Fermentation Industry,2020,46(8):142-148.
[13] MIHINDUKULASURIYA S D F,LIM L T.Nanotechnology development in food packaging:A review[J].Trends in Food Science & Technology,2014,40(2):149-167.
[14] 党金贵,丘晓琳,唐亚丽,等.香豆素修饰介孔硅食品抗氧化膜的制备与表征[J].功能材料,2019,50(9):9 174-9 180.
DANG J G,QIU X L,TANG Y K,,et al.Preparation and characterization of coumarin-modified mesoporous silicon food anti-oxidation film[J].Functional Materials,2019,50(9):9 174-9 180.
[15] LEE M H,PARK H J.Preparation of halloysite nanotubes coated with Eudragit for a controlled release of thyme essential oil[J].Journal of Applied Polymer ence,2015,132(46).DOI:10.1002/app.42771
[16] SEVEN S A,TASTAN Ö F,TAS C E,et al.Insecticide-releasing LLDPE films as greenhouse cover materials[J].Materials Today Communications,2019,19:170-176.
[17] LVOV Y,ABDULLAYEV E.Functional polymer-clay nanotube composites with sustained release of chemical agents[J].Progress in Polymer Science,2013,38(10-11):1 690-1 719.
[18] LIU M,JIA Z,JIA D,et al.Recent advance in research on halloysite nanotubes-polymer nanocomposite[J].Progress in Polymer Science,2014,39(8):1 498-1 525.
[19] CONTI G N,BERNESCHI S,COSI F,et al.Coupling of angle polished waveguides to high-Q whispering gallery mode resonators[C] The European Conference on Lasers and Electro-Optics.Optical Society of America,2011.
[20] ABDULLAYEV E,JOSHI A,WEI W,et al.Enlargement of halloysite clay nanotube lumen by selective etching of aluminum oxide[J].ACS Nano,2012,6(8):7 216-7 226.
[21] ZHANG Y,FU L,YANG H.Insights into the physicochemical aspects from natural halloysite to silica nanotubes[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2012,414:115-119.
[22] PAPOULIS D,KOMARNENI S,NIKOLOPOULOU A,et al.Palygorskite-and halloysite-TiO2 nanocomposites:Synthesis and photocatalytic activity[J].Applied Clay Science,2010,50(1):118-124.
[23] LVOV Y,WANG W,ZHANG L,et al.Halloysite clay nanotubes for loading and sustained release of functional compounds[J].Advanced Materials,2016,28(6):1 227-1 250.