番茄是世界上最广泛食用的蔬菜之一[1]。番茄除了鲜食,还可以加工成各种形式的产品,如去皮整番茄、番茄罐头、番茄汁和番茄酱等,在番茄加工过程中则会产生大量皮渣副产物[2]。番茄皮渣中含有多种功能成分,如膳食纤维(dietary fiber,DF)、果胶、番茄红素等物质,其中最主要是膳食纤维,约占皮渣干质量的70%~90%[3]。番茄皮渣水分含量高,不易保存,目前主要被用作饲料低值化处理,造成资源浪费。
膳食纤维根据其在水中的溶解性通常分为可溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)。SDF在水中可以溶解,因而较IDF在食品中具有更好的可添加性[4]。总膳食纤维中SDF含量达10%以上时具有良好的食品加工学性质和功能性质[5]。未经处理的番茄皮渣中SDF含量偏低,无法直接在食品中添加,在食品领域的应用受到限制。因此需要对其进行改性处理增加SDF含量,以改善番茄皮渣的理化功能性质[3]。蒸汽爆破预处理技术近年来在农作物残渣及木质纤维素资源加工利用领域得到广泛应用,该技术主要通过将原料和蒸汽在高温高压下处理一定时间,使蒸汽润胀渗入纤维组织,然后将体系瞬间释压形成“爆破”效应,促进纤维素、半纤维素和木质素等组分分离和结构变化,从而改良原料物性,其被誉为最具前景的生物质预处理方法[6]。SHEN等[7]利用蒸汽爆破预处理黑大豆壳,在最优蒸汽爆破条件下(含水量15%,压力1.0 MPa,时间80 s)SDF含量从10.20%增加到17.49%。LI等[8]在1.5 MPa,30 s条件下蒸汽爆破预处理豆渣,可使SDF含量较未处理增加26倍。还有研究利用蒸汽爆破处理甘薯渣[9]、橘皮[10]也发现SDF含量显著提高,表明蒸汽爆破预处理是膳食纤维改性的有效方法。目前还没有关于蒸汽爆破改性番茄皮渣膳食纤维的报道,也缺乏蒸汽爆破预处理后番茄皮渣膳食纤维理化特性的研究。本研究采用蒸汽爆破技术对番茄皮渣进行预处理,探究蒸汽爆破预处理对番茄皮渣膳食纤维组成、理化特性及表观特性的影响,以期为番茄皮渣资源化利用提供参考。
1 材料与方法
1.1 材料与试剂
番茄皮渣,新疆天业股份有限公司提供,为去皮整番茄的加工废弃物;热稳定α-淀粉酶、胃蛋白酶、胰酶,上海源叶生物科技有限公司;没食子酸标准品、福林酚、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),美国Sigma公司;单糖(D-半乳糖醛酸、D-葡萄糖、D-甘露糖、L-鼠李糖、L-阿拉伯糖、L-岩藻糖)标准品、Trolox(水溶性维生素E)标准品,北京索莱宝科技有限公司;2,2’-联氨双(3-乙基苯并噻唑啉-6-磺酸)[2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS],如吉生物科技股份有限公司;无水乙醇、丙酮、浓盐酸、蒽酮、葡萄糖等其他试剂均为分析纯,成都科龙化工试剂有限公司。
1.2 主要仪器设备
QBS-8GB蒸汽爆破试验台,鹤壁正道生物能源有限公司;Phenom Pro扫描电子显微镜,荷兰飞纳公司;L6紫外/可见分光光度计,上海仪电分析仪器有限公司;LC-20A型HPLC色谱系统,岛津企业管理(中国)有限公司。
1.3 实验方法
1.3.1 蒸汽爆破预处理番茄皮渣
取400.0 g粉碎过60目筛的番茄皮渣于蒸汽爆破腔中,分别加压至1.0、1.5、2.0 MPa后维压60 s,距离爆破终点还有3 s时打开阀门瞬间泄压,收集样品在60 ℃烘干,过60目筛于干燥器备用。
1.3.2 番茄皮渣膳食纤维的提取及测定
SDF及IDF的提取和测定使用酶质量法,具体操作参照ASP等[11]的方法进行。取1.0 g番茄皮渣,加25 mL pH 6.0的PBS缓冲液,混合均匀后加入100 μL的热稳定α-淀粉酶溶液,在95~100 ℃的磁力搅拌水浴锅中水浴15 min,待溶液冷却后用4 mol/L HCl溶液调节pH至1.5,添加100 μL胃蛋白酶液40 ℃水浴搅拌60 min,待溶液冷却后用4 mol/L NaOH溶液调节pH至6.8,加100 μL的胰酶40 ℃水浴搅拌60 min,待溶液冷却后用4 mol/L HCl溶液调节溶液pH至4.5。酶解结束后,将酶解液离心过滤(4 000 r/min,10 min),并用蒸馏水洗涤沉淀物2次,收集滤液,依次用15 mL体积分数78%乙醇,15 mL体积分数95%乙醇和15 mL丙酮洗涤滤渣2次,滤渣在105 ℃烘箱中烘干至恒重,制得番茄皮渣IDF。将收集的滤液与预热至60 ℃ 95%乙醇按体积比1∶4混合,室温静置过夜,离心(4 000 r/min,10 min)除去上清液,依次用15 mL体积分数78%乙醇,15 mL体积分数95%乙醇和15 mL丙酮各洗涤滤渣2次,滤渣在105 ℃烘箱中烘干至恒重,制得番茄皮渣SDF。番茄皮渣IDF和SDF含量通过扣除各类膳食纤维残渣中蛋白质及灰分含量及空白对照进行校正。
水溶性果胶(water soluble pectin,WSP)、螯合可溶性果胶(chelating soluble pectin,CSP)、碱溶性果胶(alkali soluble pectin,ASP)提取按照ZHOU等[12]和HAPPI等[13]的方法稍作修改。称取20.0 g原料,以质量比1∶5加100 mL 95%乙醇,沸水浴20 min,过滤,滤渣用95%乙醇、甲醇、丙酮冲洗,60 ℃烘干得到醇不溶残渣备用,称取1.0 g醇不溶残渣,加入15 mL蒸馏水,25 ℃搅拌提取4 h,过滤,滤渣再重复提取1次,合并滤液,乙醇沉淀,60 ℃烘干,得到WSP;滤渣加入15 mL 0.01 mol/L环己烷二胺四乙酸溶液,25 ℃搅拌提取4 h,过滤,滤渣再重复提取1次,合并滤液,乙醇沉淀,60 ℃烘干,得到CSP;滤渣加入15 mL 0.05 mol/L Na2CO3溶液,4 ℃放置16 h,28 ℃搅拌提取6 h,过滤,滤液经乙醇沉淀,60 ℃烘干,得到ASP。
1.3.3 番茄皮渣膳食纤维单糖组成测定
参照QI等[14]的方法。分别准确称取5 mg SDF和IDF置于螺口刻度试管中,加入0.125 mL体积分数为72%的浓硫酸,再加入1.35 mL超纯水,螺盖旋紧后放于105 ℃烘箱中水解4 h,水解液按一定比例稀释(超纯水定容至2 mL)。水解液中单糖组成分析在配备RID-20A示差折光检测器的LC-20A型HPLC色谱系统上进行,色谱柱Aminex HPX-87 H(300 mm×7.8 mm),柱温65 ℃,0.5 mmol/L稀硫酸洗脱,洗脱流速0.6 mL/min,进样量10 μL[15]。各单糖的出峰时间分别为:D-半乳糖醛酸(8.353 min)、D-葡萄糖(8.745 min)、D-甘露糖(9.351 min)、L-鼠李糖(9.874 min)、L-阿拉伯糖(10.281 min)、L-岩藻糖(10.786 min)。
1.3.4 番茄皮渣膳食纤维理化特性测定
1.3.4.1 膨胀力、持水力、持油力和溶解度测定
膨胀力测定[16]:0.5 g样品加入到10 mL量筒中,记录体积,加5 mL蒸馏水,除去气泡,室温静置24 h,再次记录体积,膨胀力计算如公式(1)所示:
膨胀力![]()
(1)
式中:m,样品质量,g;V1,干样品体积,mL;V2,样品吸水后的样品体积,mL。
持水力测定[16]:0.5 g样品加入10 mL离心管,加5 mL蒸馏水,室温静置24 h,4 393×g离心15 min,去除上清液称重,持水力计算如公式(2)所示:
持水力![]()
(2)
式中:m1,空离心管质量,g;m2,除去上清液的湿样及离心管总质量,g;m,样品质量,g。
持油力测定[16]:0.5 g样品加到10 mL离心管,加5 mL菜籽油,37 ℃放置1 h,4 393×g离心10 min,去除上清液称重,持油力计算如公式(3)所示:
持油力![]()
(3)
式中:m1,空离心管质量,g;m2,除去上清液湿样及离心管总质量,g;m,样品质量,g。
溶解度[17]:取0.5 g样品加入50 mL离心管,加入20 mL蒸馏水,75 ℃水浴搅拌30 min,4 393×g离心10 min,上清液倒入恒重铝盒,105 ℃ 烘干至恒重,溶解度计算如公式(4)所示:
溶解度![]()
(4)
式中:m1,恒重铝盒质量,g;m2,上清液恒重质量,g。
1.3.4.2 亚硝酸根离子吸附特性测定
参照LUO等[17]的方法:0.1 g样品中加入25 mL 1 mmol/L亚硝酸钠溶液,37 ℃水浴反应2 h,取上清液0.5 mL,加入2.5 mL体积分数60%醋酸溶液,5 mL工作液(10 g/L磺胺酸溶液和1 g/L盐酸萘乙二胺,等体积混合),蒸馏水定容至25 mL,避光反应25 min,波长538 nm处测吸光度。配制不同质量浓度(0~60 μg/mL)的亚硝酸钠溶液,参照样品方法,以亚硝酸钠浓度为横坐标,吸光度为纵坐标得到标准曲线方程y=0.016 4x+0.006 9,R2=0.992。
1.3.4.3 抗氧化活性测定
(1)DPPH自由基清除活性
参照 VON GADOW等[18]的方法。称取8 mg番茄皮渣膳食纤维样品,加入3.5 mL DPPH甲醇溶液(6×10-5 mol/L),避光反应25 min,波长517 nm处测吸光度。配制不同浓度的Trolox标准溶液,线性范围是20~170 μmol/L,样品按照相同的反应步骤,以标准品Trolox浓度为横坐标,清除率为纵坐标得到标准曲线方程y=0.239 4x-0.715 7,R2=0.996 9。
(2)Fe3+还原能力(ferric ion reducing antioxidant power,FRAP)
参照BENZIE等[19]的方法。称取8 mg番茄皮渣膳食纤维样品,加入3.5 mL FRAP工作液,混合均匀后37 ℃水浴反应5 min,取出后4 507×g离心5 min。取上清液于593 nm处测吸光度。配制不同浓度的硫酸亚铁溶液(100~700 μmol/L),样品按照相同的反应步骤,以硫酸亚铁溶液浓度为横坐标,吸光度为纵坐标得到标准曲线方程:y=0.000 7x-0.013,R2=0.994 4。
(3)ABTS阳离子自由基清除活性
参照NENADIS等[20]的方法。首先配制ABTS工作液。利用纯水配制7 mmol/L ABTS水溶液和140 mmol/L过硫酸钾水溶液,将二者以体积比5 000∶88混匀形成ABTS阳离子自由基溶液,于避光处室温储存12~16 h,用pH 7.4磷酸盐缓冲液进一步稀释,使其在734 nm处吸光度值保持在(0.7±0.05),得到ABTS工作液。称取5 mg番茄皮渣膳食纤维样品,加入3.5 mL ABTS工作液,30 ℃水浴反应3 min,4 507×g离心3 min,波长734 nm处测吸光度。配制不同浓度的Trolox标准溶液(30~350 μmol/L),样品按照相同的反应步骤,以Trolox浓度为横坐标,清除率为纵坐标得到标准曲线方程y=0.175 5x-2.364 5,R2=0.995 0。
1.3.5 番茄皮渣膳食纤维表观特性测定
容重测定[21]:将样品缓慢地倒入10 mL的量筒中,并将量筒置于漩涡振荡器上不断振荡,直至粉末的上表面刚好稳定在10 mL的刻度线上,记录量筒质量和样品的质量,计算如公式(5)所示:
溶解度![]()
(5)
式中:m1, 空量筒质量,g;m2, 样品与量筒的质量,g。
滑角测定[21]:准确称取3.0 g干燥后的样品,置于长18.0 cm干净光滑的玻璃平板上,缓慢举起平板直至粉末表面开始滑动,读取此时玻璃平板的垂直高度,计算如公式(6)所示:
滑角![]()
(6)
式中:L,玻璃平板的长度,cm;H,倾斜玻璃平板的垂直高度,cm。
休止角测定[21]:将玻璃漏斗垂直固定于铁架台上,使漏斗最下端与坐标纸的垂直距离为3.0 cm。将干燥后的样品缓慢倒入漏斗中,直至坐标纸上的样品锥体的顶端刚好接触到漏斗的最下端,读取锥体直径,计算如公式(7)所示:
休止角![]()
(7)
式中:H,漏斗最下端距离坐标纸的高度,cm;R,粉末锥体半径,cm。
1.3.6 番茄皮渣显微结构表征
利用扫描电子显微镜对番茄皮渣结构进行表征,用导电胶将少量番茄皮渣固定在样品座上,再将样品座置于离子溅射仪中镀铂金膜约30 s后,利用扫描电镜在10 kV的加速电压条件下放大3 000倍观察样品的形态特征并拍照。
1.4 数据处理
实验结果以![]() 表示,并采用SPSS 19.0软件进行分析,显著性分析采用Duncan’s检验,P<0.05判定为差异显著。显著性差异采用多重比较法中的标记字母法表示。
表示,并采用SPSS 19.0软件进行分析,显著性分析采用Duncan’s检验,P<0.05判定为差异显著。显著性差异采用多重比较法中的标记字母法表示。
2 结果与分析
2.1 对番茄皮渣膳食纤维及果胶组分的影响
蒸汽爆破预处理前后番茄皮渣膳食纤维含量变化如表1所示。与原样相比,蒸汽爆破预处理后番茄皮渣SDF含量显著升高,且随蒸汽爆破预处理压力的增大呈先升高后降低的趋势,在1.0 MPa条件下达到最大值,较原样显著提高了26.43%,此时SDF在总膳食纤维的占比为11.38%,而IDF含量和DF含量(除1.0 MPa,60 s)随蒸汽爆破预处理压力的增加而显著降低,其中IDF在1.0、1.5和2.0 MPa蒸汽爆破预处理压力下分别较原样降低了2.92%、6.70%和7.43%;DF在1.5和2.0 MPa蒸汽爆破预处理压力下分别较原样降低了2.62%和4.91%。在蒸汽爆破预处理压力为1.0 MPa时,番茄皮渣DF含量无显著变化,而IDF含量与SDF含量变化呈相反趋势,推测在蒸汽爆破预处理过程中出现了部分IDF向SDF的转变。这种转变可能是由于蒸汽爆破预处理的热降解、氢键破坏和结构重排等协同作用,使纤维素、不溶性半纤维素等难溶大分子聚合物的糖苷键断裂形成更容易溶解的小分子片段,部分转化成SDF[22],除了IDF的部分转化外,蒸汽爆破预处理后SDF含量的增加还可能是由于物料结构的改变导致SDF的溶出增多[6]。在蒸汽爆破预处理压力高于1.0 MPa时,SDF、IDF及DF含量均显著降低,可能是由于更高的温度条件使部分纤维素、半纤维素发生降解,木质素重新排列并部分分解为低聚物[23]。
如表1所示,蒸汽爆破预处理后WSP及CSP提取率均增加,分别在1.5和2.0 MPa下达到最大值,而ASP和总果胶提取率较原样显著降低,且随蒸汽爆破预处理压力的增大而降低。研究表明,热处理可诱导ASP向WSP转化,伴随着细胞壁分离增加[24],而CSP也可以由WSP和钙通过交联反应转化生成。因此,推测蒸汽爆破预处理过程果胶成分的变化可能是由于水热反应及爆破瞬间产生的机械化学作用导致ASP部分转化成WSP、CSP。
表1 蒸汽爆破预处理对番茄皮渣膳食纤维组分的影响
Table 1 Effect of steam explosion pretreatment on dietary fiber components of tomato pomace
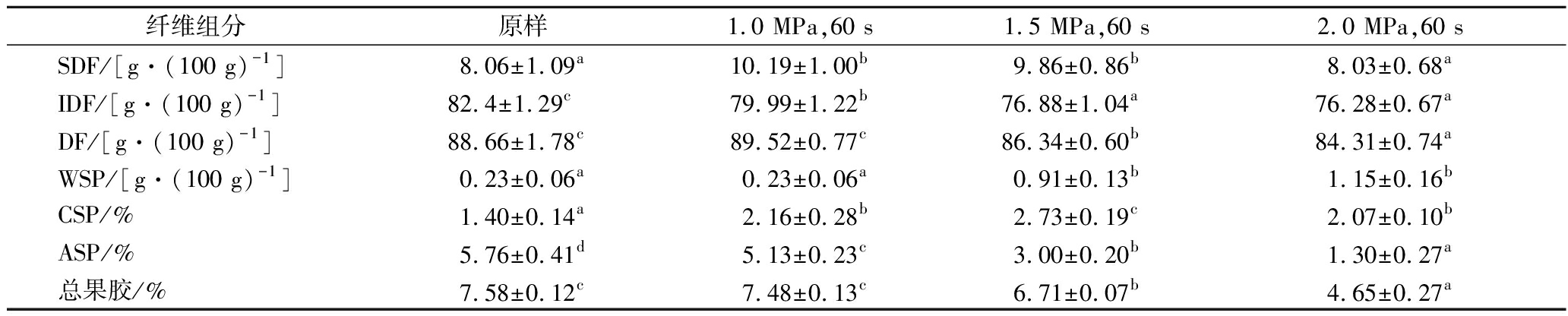
纤维组分原样1.0 MPa,60 s1.5 MPa,60 s2.0 MPa,60 sSDF/[g·(100 g)-1]8.06±1.09a10.19±1.00b9.86±0.86b8.03±0.68aIDF/[g·(100 g)-1]82.4±1.29c79.99±1.22b76.88±1.04a76.28±0.67aDF/[g·(100 g)-1]88.66±1.78c89.52±0.77c86.34±0.60b84.31±0.74aWSP/[g·(100 g)-1]0.23±0.06a0.23±0.06a0.91±0.13b1.15±0.16bCSP/%1.40±0.14a2.16±0.28b2.73±0.19c2.07±0.10bASP/%5.76±0.41d5.13±0.23c3.00±0.20b1.30±0.27a总果胶/%7.58±0.12c7.48±0.13c6.71±0.07b4.65±0.27a
注:同行数据上标不同小写字母表示有显著性差异(P<0.05)
2.2 对番茄皮渣膳食纤维单糖组成的影响
对蒸汽爆破预处理前后番茄皮渣膳食纤维的单糖组成进行测定,单糖标准品的标准方程如表2所示,实验结果如表3所示。番茄皮渣IDF主要由D-葡萄糖、D-甘露糖、D-半乳糖醛酸、L-鼠李糖和L-阿拉伯糖组成,且D-葡萄糖含量最高,表明纤维素是番茄皮渣IDF的主要成分;蒸汽爆破预处理后,IDF的单糖成分仅D-葡萄糖含量显著增加(由61.90增加至74.16 g/100 g),这可能来自于半纤维素和纤维素的降解[25]。IDF中D-半乳糖醛酸(由10.66降至0 g/100 g)、L-阿拉伯糖(由2.81降至1.58 g/100 g)含量随着爆破压力的增加而逐渐降低;L-鼠李糖未检测出,说明蒸汽爆破预处理可能使IDF中的半纤维素和不溶性果胶成分发生降解[26]。
表2 高效液相色谱法测膳食纤维单糖的标准方程
Table 2 Standard equation for determination of dietary fiber monosaccharide by HPLC

单糖标准方程R2线性范围/(μg·mL-1)D-半乳糖醛酸y=267.1x-1 370.90.998 750~600D-葡萄糖y=310.02x-1 395.60.998 850~600D-甘露糖y=258.83x-665.990.999 950~600L-鼠李糖y=227.46x+4.672 80.999 65~60L-阿拉伯糖y=279.25x-1 279.10.998 550~600L-岩藻糖y=272.18x+134.20.999 65~60
番茄皮渣SDF主要由D-半乳糖醛酸、D-葡萄糖、D-甘露糖、L-鼠李糖、L-阿拉伯糖、L-岩藻糖组成,且D-半乳糖醛酸含量最高,这表明果胶是SDF的主要成分。蒸汽爆破预处理后D-半乳糖醛酸和L-岩藻糖含量显著降低,表明蒸汽爆破预处理可使果胶发生降解。此外,L-鼠李糖和L-阿拉伯糖分别是鼠李糖半乳糖醛酸聚糖-Ⅰ果胶结构单元的主链及侧链组成部分,是ASP的主要单糖成分[27]。蒸汽爆破预处理后SDF中L-鼠李糖和L-阿拉伯糖含量的显著降低,表明蒸汽爆破预处理可使ASP的主链及侧链结构发生断裂,这与ASP含量变化的结果一致。蒸汽爆破预处理后,SDF中D-葡萄糖和D-甘露糖含量显著升高,可能是由于蒸汽爆破预处理使番茄皮渣纤维素分解为可溶性片段,或通过糖苷化反应合成了水溶性抗消化支化葡聚糖[28]。
表3 蒸汽爆破预处理对番茄皮渣IDF和SDF单糖组成的影响 单位:g/100 g
Table 3 Effect of steam explosion pretreatment on monosaccharide composition of IDF and SDF in tomato pomace
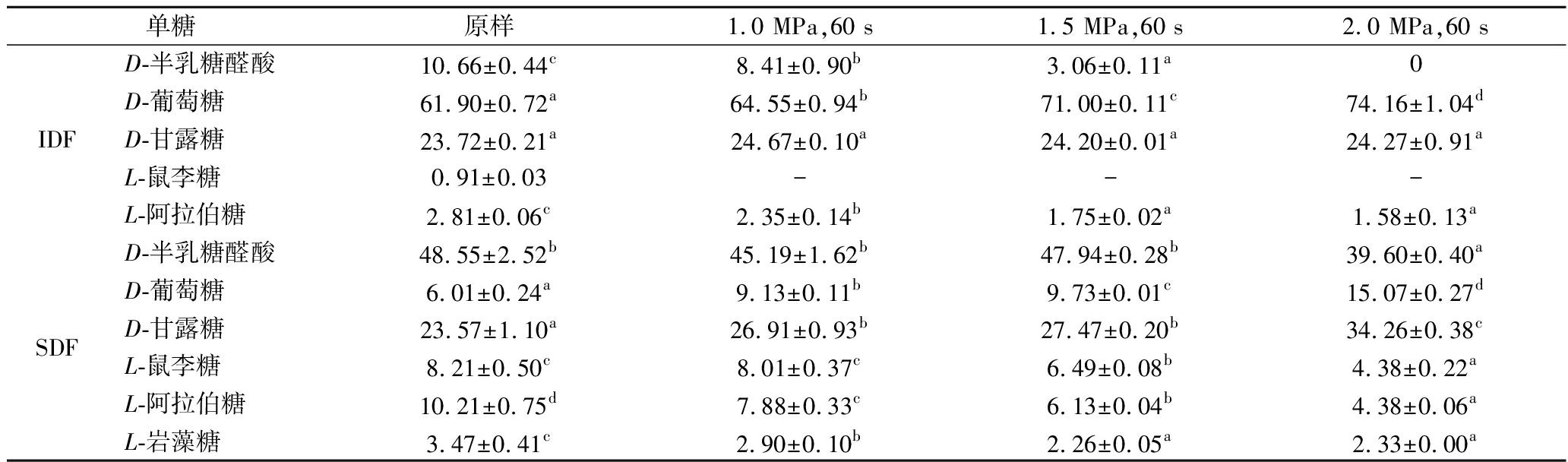
单糖原样1.0 MPa,60 s1.5 MPa,60 s2.0 MPa,60 sD-半乳糖醛酸10.66±0.44c8.41±0.90b3.06±0.11a0D-葡萄糖61.90±0.72a64.55±0.94b71.00±0.11c74.16±1.04dIDFD-甘露糖23.72±0.21a24.67±0.10a24.20±0.01a24.27±0.91aL-鼠李糖0.91±0.03---L-阿拉伯糖2.81±0.06c2.35±0.14b1.75±0.02a1.58±0.13aD-半乳糖醛酸48.55±2.52b45.19±1.62b47.94±0.28b39.60±0.40aD-葡萄糖6.01±0.24a9.13±0.11b9.73±0.01c15.07±0.27dSDFD-甘露糖23.57±1.10a26.91±0.93b27.47±0.20b34.26±0.38cL-鼠李糖8.21±0.50c8.01±0.37c6.49±0.08b4.38±0.22aL-阿拉伯糖10.21±0.75d7.88±0.33c6.13±0.04b4.38±0.06aL-岩藻糖3.47±0.41c2.90±0.10b2.26±0.05a2.33±0.00a
2.3 对番茄皮渣膳食纤维理化特性的影响
2.3.1 对番茄皮渣膳食纤维水合性质及持油性的影响
如表4所示,蒸汽爆破预处理后,番茄皮渣膳食纤维膨胀力较未处理显著降低,但各蒸汽爆破预处理压力间无显著性变化;持水力虽有下降趋势,但较未处理无显著性差异;溶解性在2.0 MPa蒸汽爆破预处理压力下较未处理显著提高了7%。SUI等[29]利用蒸汽爆破预处理麦麸也发现其膳食纤维的膨胀力显著降低,溶解度显著提高,与本研究结果一致。有研究认为,膳食纤维的水合性质与物料的结构、化学成分及粒度有关[30],溶解度与物料组成、多孔结构有关[17]。蒸汽爆破预处理后番茄皮渣膳食纤维膨胀力的降低可能是由于物料的毛细管结构被破坏,影响了水合性质,还有可能是蒸汽爆破预处理使大分子发生降解,可溶性果胶等易溶成分溶出增加,溶解度相应提高,而膨胀力和持水力相应下降。此外,蒸汽爆破预处理后番茄皮渣膳食纤维的持油力显著升高,在1.0、1.5和2.0 MPa条件下分别较未处理提高了16.61%、17.97%和13.32%,这表明蒸汽爆破预处理使番茄皮渣膳食纤维亲脂性增强。
表4 蒸汽爆破预处理对番茄皮渣膳食纤维理化特性的影响
Table 4 Effect of steam explosion pretreatment on physicochemical properties of tomato pomace dietary fiber

测定参数膨胀力/(mL·g-1)持水力/(g·g-1)溶解性/[g·(100 mL)-1]持油力/(g·g-1)原样1.79±0.12b4.38±0.41a33.02±1.27a2.95±0.17a1.0 MPa,60 s1.29±0.23a3.88±0.12a33.40±0.95ab3.44±0.16b1.5 MPa,60 s1.09±0.08a3.92±0.22a33.88±0.93ab3.48±0.04b2.0 MPa,60 s1.01±0.12a3.94±0.27a35.34±0.87b3.34±0.05b
持油力的大小与原料的多孔及结构、表面性质、总电荷密度和疏水性有关[31],蒸汽爆破预处理可能破坏了纤维基质的致密结构,提高了对油的吸附和保留能力,从而提高持油力[6]。
2.3.2 对番茄皮渣膳食纤维亚硝酸根离子吸附能力的影响
番茄皮渣膳食纤维含有的羧基、羟基等侧链基团及多孔结构,对亚硝酸盐具有一定吸附作用。蒸汽爆破预处理前后番茄皮渣膳食纤维亚硝酸根离子吸附能力如图1所示,在pH 2.0条件下,仅当蒸汽爆破预处理压力为1.5 MPa时,其对亚硝酸根离子吸附能力较原样显著提高了16.79%,其余蒸汽爆破预处理压力无显著性差异;在pH 7.0条件下,其对亚硝酸根离子吸附能力随着爆破压力的增加而逐渐增加,在1.0、1.5和2.0 MPa压力下分别较原样增加了52.79%、62.52%和212.57%。
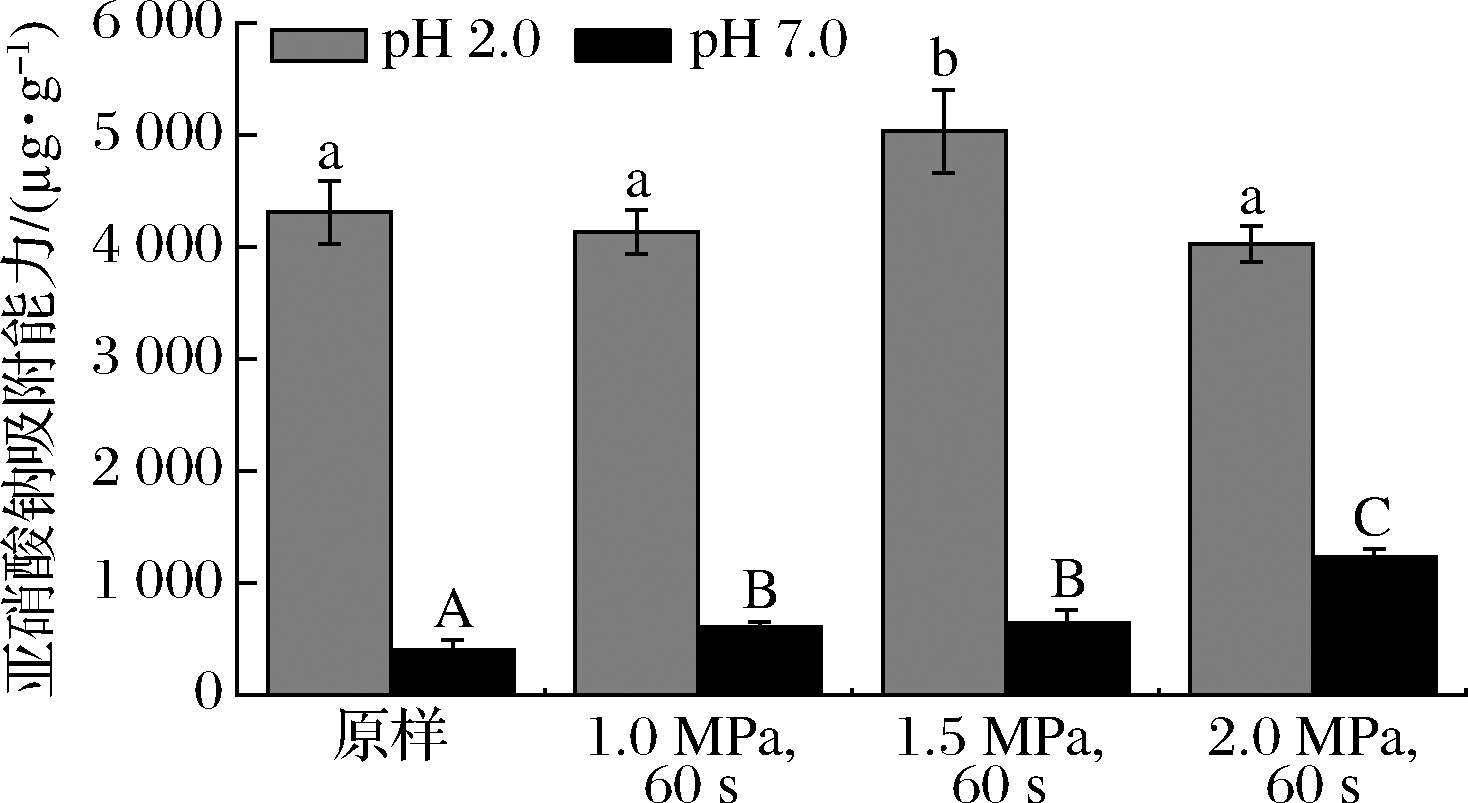
图1 蒸汽爆破预处理对番茄皮渣膳食纤维的亚硝酸根 离子吸附特性的影响
Fig.1 Effect of steam explosion pretreatment on nitrite ion adsorption of tomato pomace dietary fiber
注:大小写字母不同表示差异显著(P<0.05)
亚硝酸根离子吸附能力的改善主要是由于蒸汽爆破预处理使物料粒径减小,表面积增大,更多的多孔网络结构和官能团暴露[32],从而增强皮渣膳食纤维对亚硝酸根离子的吸附和保留能力。
2.3.3 对番茄皮渣膳食纤维抗氧化活性的影响
番茄皮渣含有多酚、番茄红素等抗氧化活性成分,赋予番茄皮渣膳食纤维一定的抗氧化能力。NAVARRO-GONZ LEZ等[33]报道番茄皮纤维中总酚含量为158.10 GAE mg/100 g;VALDEZ-MORALES等[34]报道4个不同品种番茄皮中总酚含量在157.8~351.6 mg GA当量/100 g。如表5所示,番茄皮渣膳食纤维具有DPPH自由基清除能力,经1.0 MPa蒸汽爆破预处理后,其DPPH自由基清除能力的变化显著。随着处理压力增加,DPPH自由基清除能力随之增加,2.0 MPa条件处理的样品,较原样提高了393%。蒸汽爆破预处理使番茄皮渣膳食纤维的Fe3+还原能力显著提高,且不同蒸汽爆破压力处理的样品组间存在显著性差异(P<0.05)。2.0 MPa条件下处理的样品,Fe3+还原能力提高了254%。蒸汽爆破预处理使番茄皮渣膳食纤维的ABTS阳离子自由基清除能力提高幅度最大。2.0 MPa条件下处理样品的ABTS阳离子自由基清除能力是原样的12.57倍,分别是1.0 MPa及1.5 MPa条件下的3.27倍和1.46倍。蒸汽爆破预处理对番茄皮渣膳食纤维抗氧化能力的提升作用,主要与番茄皮渣组织结构在蒸汽爆破时剥离导致抗氧化活性成分暴露有关[32]。
LEZ等[33]报道番茄皮纤维中总酚含量为158.10 GAE mg/100 g;VALDEZ-MORALES等[34]报道4个不同品种番茄皮中总酚含量在157.8~351.6 mg GA当量/100 g。如表5所示,番茄皮渣膳食纤维具有DPPH自由基清除能力,经1.0 MPa蒸汽爆破预处理后,其DPPH自由基清除能力的变化显著。随着处理压力增加,DPPH自由基清除能力随之增加,2.0 MPa条件处理的样品,较原样提高了393%。蒸汽爆破预处理使番茄皮渣膳食纤维的Fe3+还原能力显著提高,且不同蒸汽爆破压力处理的样品组间存在显著性差异(P<0.05)。2.0 MPa条件下处理的样品,Fe3+还原能力提高了254%。蒸汽爆破预处理使番茄皮渣膳食纤维的ABTS阳离子自由基清除能力提高幅度最大。2.0 MPa条件下处理样品的ABTS阳离子自由基清除能力是原样的12.57倍,分别是1.0 MPa及1.5 MPa条件下的3.27倍和1.46倍。蒸汽爆破预处理对番茄皮渣膳食纤维抗氧化能力的提升作用,主要与番茄皮渣组织结构在蒸汽爆破时剥离导致抗氧化活性成分暴露有关[32]。
表5 蒸汽爆破预处理对番茄皮渣膳食纤维抗氧化活性的影响
Table 5 Effect of steam explosion pretreatment on antioxidant activity of dietary fiber from tomato pomace

测定参数DPPH/[(mol TE·(100 g)-1 dw]FRAP/[(mol TE·(100 g)-1 dw]ABTS/[(mol TE·(100 g)-1 dw]原样1 018.44±127.06a4 296.42±535.74a1 188.58±200.24a1.0 MPa,60 s2 186.43±169.42b5 777.27±567.74b4 569.04±375.45b1.5 MPa,60 s2 620.68±63.53c7 180.19±409.53c10 238.55±274.95c2.0 MPa,60 s3 998.31±105.88d10 901.81±582.35d14 934.62±1 502.35d
2.4 对番茄皮渣膳食纤维粉体学特性的影响
如表6所示,蒸汽爆破预处理后,番茄皮渣膳食纤维的容重显著降低,在1.0、1.5和2.0 MPa蒸汽爆破预处理压力下分别较原样降低了5.78%,6.65%和8.09%。有研究表明容重与比表面积和总孔隙体积呈负相关[35],蒸汽爆破预处理后膳食纤维容重降低可能是由于纤维粒径减小,比表面积和孔隙体积增大所致。休止角和滑角是评价物料流动性的有效参数,其值越小,流动性越好,蒸汽爆破预处理后番茄皮渣膳食纤维的滑角和休止角均显著降低,在1.0、1.5和2.0 MPa蒸汽爆破预处理压力下滑角分别较原样降低了49.45%、52.87%和52.13%,休止角分别较原样降低了14.04%、15.87%和10.86%,表明蒸汽爆破预处理提高了番茄皮渣膳食纤维粉体的流动性。
表6 蒸汽爆破预处理对番茄皮渣膳食纤维粉体流动特性的影响
Table 6 Effect of steam explosion pretreatment on flow characteristics of tomato pomace dietary fiber

测定参数原样1.0 MPa,60 s1.5 MPa,60 s2.0 MPa,60 s容重/(g·mL-1)0.346±0.006b0.326±0.003a0.323±0.002a0.318±0.007a滑角/°81.27±3.75b41.08±1.78a38.30±1.68a38.90±1.90a休止角/° 57.35±0.53c49.30±0.87a48.25±0.34a51.12±0.31b
2.5 对番茄皮渣显微结构的影响
如图2所示,未处理的番茄皮渣呈致密块状结构(图2-a),经过蒸汽爆破预处理之后,番茄皮渣表面出现了褶皱与空洞;随着爆破压力的增大,细小孔状结构越明显(图2-b~图2-d)。已有研究表明,蒸汽爆破预处理的破壁作用是促进植物活性成分改性和提取的关键,不仅有助于生物大分子物质发生机械断裂和结构重排,还有助于加强溶质的内部扩散速率,提高提取率[6]。因此,本研究中番茄皮渣膳食纤维理化特性的改善,与蒸汽爆破预处理对番茄皮渣因结构破坏引起的组分分离和降解有关。
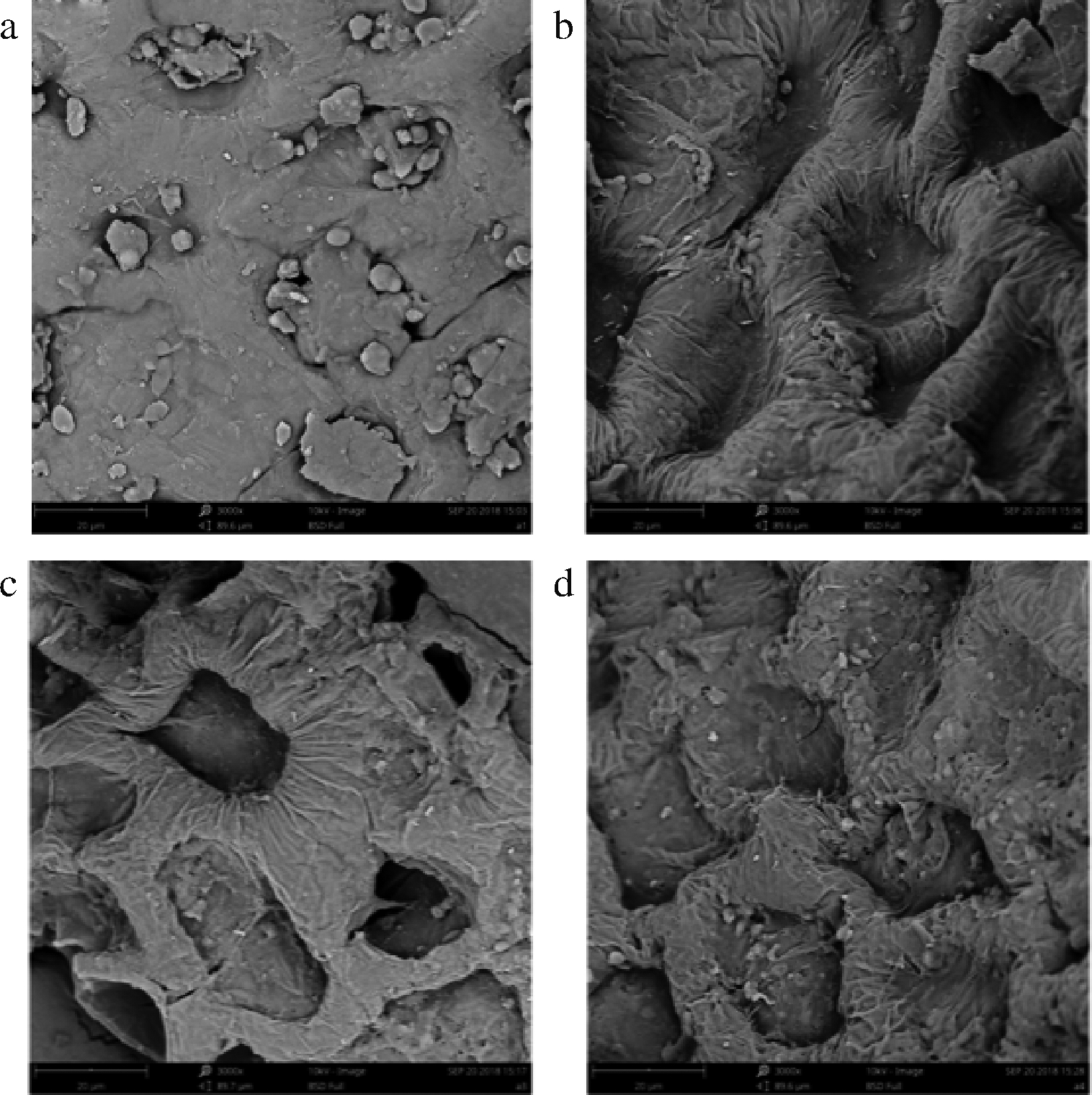
a-原样;b-1.0 MPa;c-1.5 MPa;d-2.0 MPa
图2 蒸汽爆破预处理前后番茄皮渣的扫描电镜 结果(×3 000倍)
Fig.2 SEM results of tomato pomace before and after steam explosion pretreatment (×3 000)
3 结论
蒸汽爆破预处理显著降低了番茄皮渣的DF及IDF含量,提高了SDF含量,且在1.0 MPa条件下SDF含量最高,较未处理样品提高了26.43%,SDF占DF比例为11.38%;此外,蒸汽爆破预处理导致了番茄皮渣NSP及总果胶提取率显著降低,WSP和CSP提取率显著升高,膳食纤维的单糖组成改变,持水力和膨胀力显著降低,溶解性、持油力、亚硝酸钠吸附能力、体外抗氧化能力及番茄皮渣膳食纤维表观特性整体提高,番茄皮渣组织网状结构和细小孔状结构暴露增加。研究表明蒸汽爆破预处理可以有效提升番茄皮渣SDF含量,在一定程度上改善其理化特性。
[1] LU Z Q,WANG J J,GAO R P,et al.Sustainable valorisation of tomato pomace:A comprehensive review[J].Trends in Food Science & Technology,2019,86:172-187.
[2] ![]() A,
A, ![]() V,et al.Application of high hydrostatic pressure and ultrasound-assisted extractions as a novel approach for pectin and polyphenols recovery from tomato peel waste[J].Innovative Food Science & Emerging Technologies,2020,64:102424.
V,et al.Application of high hydrostatic pressure and ultrasound-assisted extractions as a novel approach for pectin and polyphenols recovery from tomato peel waste[J].Innovative Food Science & Emerging Technologies,2020,64:102424.
[3] 叶发银, 汪美凤,刘嘉,等.挤压处理番茄皮膳食纤维的化学组成与结构[J].食品科学,2014,35(13):43-48.
YE F Y,WANG M F,LIU J,et al.Composition and structural properties of extruded tomato peel dietary fiber[J].Food Science,2014,35(13):43-48.
[4] DEBUSCA A,TAHERGORABI R,BEAMER S K,et al.Physicochemical properties of surimi gels fortified with dietary fiber[J].Food Chemistry,2014,148(2):70-76.
[5] GRIGELMO-MIGUEL N,MARTI N-BELLOSO O.Comparison of dietary fibre from by-products of processing fruits and greens and from cereals[J].LWT-Food Science and Technology,1999,32(8):503-508.
N-BELLOSO O.Comparison of dietary fibre from by-products of processing fruits and greens and from cereals[J].LWT-Food Science and Technology,1999,32(8):503-508.
[6] 何晓琴, 李苇舟,李富华,等.蒸汽爆破预处理在农产品加工副产物综合利用中的应用[J].食品与发酵工业,2019,45(8):252-257.
HE X Q,LI W Z,LI F H,et al.Application of steam-explosion pretreatment in utilizing agricultural by-products[J].Food and Fermentation Industries,2019,45(8):252-257.
[7] SHEN M,GE Y F,KANG Z Y,et al.Yield and physicochemical properties of soluble dietary fiber extracted from untreated and steam explosion-treated black soybean hull[J].Journal of Chemistry,2019:1-9.
[8] LI B,YANG W,NIE Y Y,et al.Effect of steam explosion on dietary fiber,polysaccharide,protein and physicochemical properties of okara[J].Food Hydrocolloids,2019,94:48-56.
[9] WANG T L,LIANG X H,RAN J J,et al.Response surface methodology for optimization of soluble dietary fiber extraction from sweet potato residue modified by steam explosion[J].International Journal of Food Science and Technology,2017,52(3):741-747.
[10] WANG L,XU H G,YUAN F,et al.Preparation and physico-chemical properties of soluble dietary fiber from orange peel assisted by steam explosion and dilute acid soaking[J].Food Chemistry,2015,185(14):90-98.
[11] ASP N G,JOHANSSON C G,HALLMER H,et al.Rapid enzymic assay of insoluble and soluble dietary fiber[J].Journal of Agricultural and Food Chemistry,1983,31(3):476-482.
[12] ZHOU L Y,WANG Y T,LIU F X,et al.Effect of high pressure carbon dioxide on the properties of water soluble pectin in peach juice[J].Food Hydrocolloids,2014,40:173-181.
[13] HAPPI EMAGA T,ROBERT C,RONKART S N,et al.Dietary fibre components and pectin chemical features of peels during ripening in banana and plantain varieties[J].Bioresource Technology,2008,99(10):4 346-4 354.
[14] QI J,LI Y,MASAMBA K G,et al.The effect of chemical treatment on the in vitro hypoglycemic properties of rice bran insoluble dietary fiber[J].Food Hydrocolloids,2016,52:699-706.
[15] CARVALHEIRO F,ESTEVES M P,PARAJ J C,et al.Production of oligosaccharides by autohydrolysis of brewery’s spent grain[J].Bioresource Technology,2004,91(1):93-100.
J C,et al.Production of oligosaccharides by autohydrolysis of brewery’s spent grain[J].Bioresource Technology,2004,91(1):93-100.
[16] LUO X L,WANG Q,ZHENG B D,et al.Hydration properties and binding capacities of dietary fibers from bamboo shoot shell and its hypolipidemic effects in mice[J].Food and Chemical Toxicology,2017,109:1 003-1 009.
[17] LI X H,LIU Y Z,YU Y Y,et al.Nanoformulations of quercetin and cellulose nanofibers as healthcare supplements with sustained antioxidant activity[J].Carbohydrate Polymers,2019,207:160-168.
[18] VON GADOW A,JOUBERT E,HANSMANN C F.Comparison of the antioxidant activity of aspalathin with that of other plant phenols of rooibos tea (Aspalathus linearis),α-tocopherol,BHT,and BHA[J].Journal of Agricultural and Food Chemistry,1997,45(3):632-638.
[19] BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”:The FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[20] NENADIS N,WANG L F,TSIMIDOU M,et al.Estimation of scavenging activity of phenolic compounds using the ABTS·+ assay[J].Journal of Agricultural and Food Chemistry,2004,52(15):4 669-4 674.
[21] GIORGIO PE P,GAI F,ROTOLO L,et al.Effects of diets with increasing levels of dried tomato pomace on the performances and apparent digestibility of growing rabbits[J].Asian Journal of Animal and Veterinary Advances,2012,7(6):521-527.
[22] 李伦, 张晖,王兴国,等.超微粉碎对脱脂米糠膳食纤维理化特性及组成成分的影响[J].中国油脂,2009,34(2):56-59.
LI L,ZHANG H,WANG X G,et al.Effect of super micro-milling on the physicochemical properties and composition of dietary fibre prepared from defatted rice bran[J].China Oils and Fats,2009,34(2):56-59.
[23] BOGOLITSYN K G,KRASIKOVA A A,GUSAKOVA M A,et al.Application of steam explosion as a method of wood matrix thermochemical activation[J].Journal of the Indian Academy of Wood Science,2016,13(1):82-89.
[24] RAMOS-AGUILAR O P,ORNELAS-PAZ J D J,RUIZ-CRUZ S,et al.Effect of ripening and heat processing on the physicochemical and rheological properties of pepper pectins[J].Carbohydrate Polymers,2015,115:112-121.
[25] KAZEMI M,KHODAIYAN F,LABBAFI M,et al.Pistachio green hull pectin:Optimization of microwave-assisted extraction and evaluation of its physicochemical,structural and functional properties[J].Food Chemistry,2019,271:663-672.
[26] WANG W J,MA X B,JIANG P,et al.Characterization of pectin from grapefruit peel:A comparison of ultrasound-assisted and conventional heating extractions[J].Food Hydrocolloids,2016,61:730-739.
[27] DOCO T,WILLIAMS P,VIDAL S,et al.Rhamnogalacturonan Ⅱ,a dominant polysaccharide in juices produced by enzymic liquefaction of fruits and vegetables[J].Carbohydrate Research,1997,297(2):181-186.
[28] LONG D Q,YE F Y,ZHAO G H.Optimization and characterization of wheat bran modified by in situ enhanced CO2 blasting extrusion[J].LWT-Food Science and Technology,2014,59(2):605-611.
[29] SUI W J,XIE X,LIU R,et al.Effect of wheat bran modification by steam explosion on structural characteristics and rheological properties of wheat flour dough[J].Food Hydrocolloids,2018,84:571-580.
[30] ZHAO G H,ZHANG R F,DONG L H,et al.Particle size of insoluble dietary fiber from rice bran affects its phenolic profile,bioaccessibility and functional properties[J].LWT-Food Science and Technology,2018,87:450-456.
[31] FIGUEROLA F,HURTADO M L,ESTÉVEZ A M,et al.Fibre concentrates from apple pomace and citrus peel as potential fibre sources for food enrichment[J].Food Chemistry,2005,91(3):395-401.
[32] SUI W J,XIAO Y,LIU R,et al.Steam explosion modification on tea waste to enhance bioactive compounds’ extractability and antioxidant capacity of extracts[J].Journal of Food Engineering,2019,261:51-59.
[33] NAVARRO-GONZ LEZ I,GARC
LEZ I,GARC A-VALVERDE V,GARCíA-ALONSO J,et al.Chemical profile,functional and antioxidant properties of tomato peel fiber[J].Food Research International,2011,44(5):1 528-1 535.
A-VALVERDE V,GARCíA-ALONSO J,et al.Chemical profile,functional and antioxidant properties of tomato peel fiber[J].Food Research International,2011,44(5):1 528-1 535.
[34] VALDEZ-MORALES M,ESPINOSA-ALONSO L G,ESPINOZA-TORRES L C,et al.Phenolic content and antioxidant and antimutagenic activities in tomato peel,seeds,and byproducts[J].Journal of Agricultural and Food Chemistry,2014,62(23):5 281-5 289.
[35] HUANG C C,CHEN Y F,WANG C C.Effects of micronization on the physico-chemical properties of peels of three root and tuber crops[J].Journal of the Science of Food and Agriculture,2010,90(5):759-763.