马铃薯淀粉生产废水是马铃薯淀粉以及相关淀粉产品生产过程中产生的废液,是一种高浓度的有机废水[1],平均每生产1 t淀粉,需排放20 t左右的废水,其中需要处理的含蛋白质废水约5 t左右,直接排放不但会造成资源浪费,还会带来环境污染问题[2-4]。马铃薯淀粉废水中含有淀粉、蛋白质、纤维素等有机物[5],基本没有毒性,具有高泡沫、高浓度、高浊度的“三高”特点,不能直接排放[6]。
未经处理的马铃薯淀粉生产废水会产生臭味气体。其中无机的恶臭污染物有硫化合物、氮化合物等;有机的恶臭污染物有链烃、芳香烃等[7-9]。马铃薯蛋白是造成废水恶臭和氨氮含量超标的主要原因,回收马铃薯蛋白,不仅可有效降低氨氮含量,减小臭味,同时有利于降低化学需氧量(chemical oxygen demand, COD)和浊度[10],也有利于废水的回田灌溉[11],对马铃薯行业具有现实意义。
常见的絮凝剂有机絮凝剂和无机絮凝剂。有机高分子絮凝剂用量少,但不易被生物分解。聚丙烯酰胺会生成N-亚硝胺类消毒副产物,一种新型的含氮消毒副产物,其潜在的致癌、致畸和致突变性风险引起了国内外学者的广泛关注[12-13]。常见的无机絮凝剂为铝盐化合物类以及铁盐类絮凝剂。铝盐类化合物进入人体内,会导致人体出现中毒症状,严重的还会导致老年痴呆[14]。铁盐化合物类絮凝剂会对铁质设备造成严重腐蚀,且具有明显的颜色变化, 在具体应用过程中,具有很大的局限性[14]。而聚谷氨酸(γ-polyglutamic acid,γ-PGA)作为一种新型的微生物絮凝剂,具有生物可降解性、水溶性、无毒等特点。采用聚谷氨酸回收马铃薯蛋白,过程较为温和,相较于传统的无机絮凝剂,不会造成重金属二次污染,具有环保和经济的双重效果[15-16],在水处理方面具有广阔的发展前景[17]。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
马铃薯,内蒙古蒙森农业科技股份有限公司;聚谷氨酸(纯度≥90%),天津慧智百川生物技术有限公司;CaCl2、K2SO4、CuSO4均为市售分析纯。
1.1.2 仪器与设备
752紫外可见分光光度计,天津市拓普仪器有限公司;TGL-16C台式高速离心机,湖南星科科学仪器有限公司;FE20数显pH计,北京汇中顺成科技有限责任公司;SKY-2102摇床,苏坤实业有限公司;WDP-9062电热恒温培养箱,上海安亭科学仪器有限公司;GZX-9030MBE数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;K9840自动凯氏定氮仪,山东海能科学仪器有限公司;JSM-IT300LV扫描电子显微镜,无锡东立智能技术有限公司;IS50傅里叶红外光谱分析仪,美国尼高力仪器公司。
1.2 实验方法
1.2.1 聚谷氨酸絮凝马铃薯淀粉废水中蛋白质
马铃薯淀粉废水制备:将马铃薯洗净、切块,用破碎机破碎,得到渣水混合物;用80目滤网进行过滤,使渣水分离,自然沉降 24 h,取上清液,即得到马铃薯淀粉废水。准确量取100 mL马铃薯淀粉废水于250 mL烧杯中,加入聚谷氨酸以及助凝剂CaCl2[18],并调节pH值,以200 r/min的速度用磁力搅拌器搅拌,放入水浴锅中静置一段时间,于5 000 r/min离心10 min,离心沉淀所得即为回收的马铃薯蛋白质。
1.2.2 蛋白质去除率的测定
马铃薯淀粉汁水中蛋白质含量的测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,采用凯氏定氮法。按公式(1)计算马铃薯蛋白去除率:
马铃薯蛋白去除率![]()
(1)
式中:m1,回收后的马铃薯蛋白,g;m2,马铃薯淀粉废水中蛋白质含量,g;m3,聚谷氨酸中蛋白质含量,g。
1.2.3 单因素试验
探究聚谷氨酸添加量、pH、助凝剂添加量、温度、絮凝时间对马铃薯蛋白含量的影响。
1.2.4 响应面优化试验
依据前期试验结果,确定了聚谷氨酸添加量、pH值、絮凝温度为实验因素。以马铃薯粗蛋白去除率为响应值,进行中心组合设计实验,各因素水平及编码值如表1所示。
表1 响应面试验因素及水平
Table 1 Factors and levels of Box-Behnken design

因素水平-101(A)γ-PGA/(g·L-1)0.7511.25(B)pH3.03.54.0(C)温度/℃354045
1.2.5 马铃薯蛋白的红外光谱分析
将干燥的马铃薯蛋白进行红外测试,扫描范围为4 000~400 cm-1,扫描次数为16,采用KBr压片法:取1 mg完全干燥的马铃薯蛋白粉末,并以质量比1∶150与干燥的光谱级KBr粉末一同均匀混合并在红外灯照射下于玛瑙研钵中研磨,完全研细直至粉末平均粒径达到2 μm。再将研好的粉末均匀倒入压模器中,经抽真空处理后,加压至20 MPa,即得到马铃薯蛋白的半透明薄膜。最后将薄片置于样品架,进行红外光谱测定。
1.2.6 聚谷氨酸絮体扫描电镜分析
加入聚谷氨酸以及助凝剂絮凝出马铃薯蛋白,烘干后制成薄膜,样品表面镀金,用扫描电镜观察形态变化。
1.2.7 废水检测指标及方法
pH采用数显pH计;化学需氧量的测定采用COD快速测定仪;氨氮参照 CJ/T 75—1999 纳氏试剂比色法测定。总磷参照GB 11893—1989钼酸铵分光光度计法进行测定。
1.3 数据处理
每组实验重复3次,使用Design-expert V8.0.6进行响应面设计及统计分析,采用Origin 9.0进行数据处理并作图。
2 结果与分析
2.1 聚谷氨酸添加量对马铃薯蛋白含量的影响
随着聚谷氨酸添加量的增加,由图1可知,蛋白含量基本呈上升趋势。当聚谷氨酸添加量为1 g/L时粗蛋白含量最高,此时蛋白回收率达到67.46%。随着聚谷氨酸添加量的增大,蛋白含量不再增加,呈下降趋势。絮凝剂添加过量时,会使已经形成的絮体重新变成稳定的胶体。因此,选择聚谷氨酸添加量为1 g/L。

图1 聚谷氨酸添加量对马铃薯蛋白含量的影响
Fig.1 Effect of polyglutamic acid on flocculation of potato protein content
2.2 pH对马铃薯蛋白含量的影响
由于马铃薯废水偏酸性,故絮凝pH值在酸性区间选择。随着pH值的降低,蛋白质含量呈上升趋势,在pH值为3.5时,蛋白质含量最高为68.19%;随着pH值的继续下降,蛋白含量也相继下降,这可能与马铃薯贮藏蛋白的等电点有关, 等电点在pH为3.5附近,蛋白质分子颗粒不存在同电的相互排斥作用,极易发生碰撞,蛋白质最容易发生聚沉[19]。同时低pH值有利于原水中带负电的胶粒发生电性中和及压缩双电层作用,从而减少了胶粒间斥力[20]。因此选择pH值在3.5为回收马铃薯蛋白的最佳pH值。
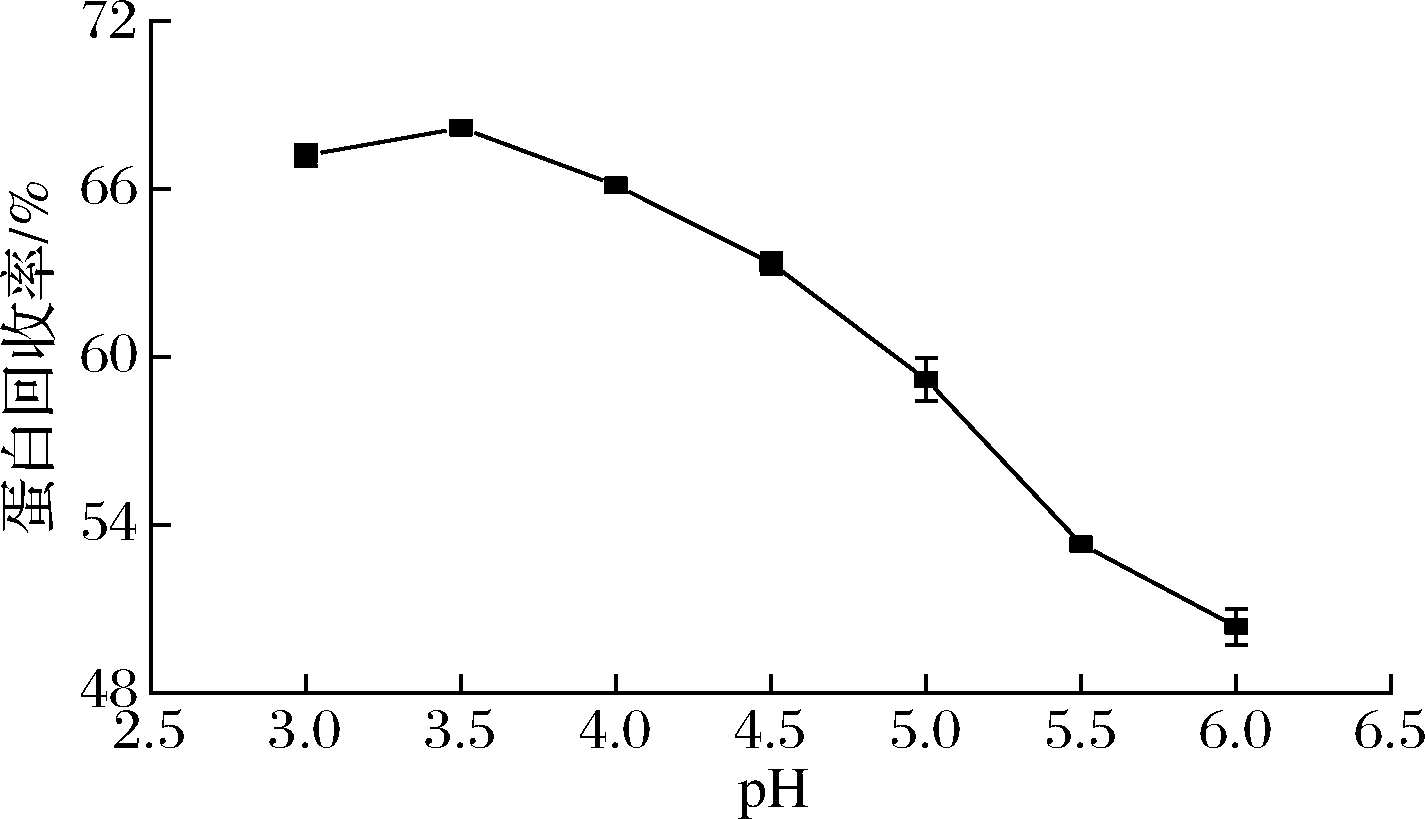
图2 pH对马铃薯蛋白含量的影响
Fig.2 Effect of pH on flocculation of potato protein content
2.3 助凝剂添加量对马铃薯蛋白含量的影响
添加助凝剂不仅有助于降低混凝剂用量还有助于降低混凝过程对流体力学条件的依赖性,提高混凝的稳定性。本实验选取CaCl2为助凝剂添加到絮凝过程中。由图2可知,随着助凝剂添加量的增加,蛋白质含量最高可达到66.57%。之后随着絮凝剂含量的增加,蛋白含量上升趋势不明显。不加入助凝剂时,蛋白回收率相差较大。因此选择助凝剂的添加量为质量分数1%。

图3 助凝剂添加量对马铃薯蛋白含量的影响
Fig.3 Effect of coagulant aid on flocculation of potato protein content
2.4 温度对马铃薯蛋白含量的影响
随着温度的增加,蛋白质含量先升高后降低。在温度为40 ℃时,蛋白含量最高为67.42%。同时,絮凝剂的扩散速度和颗粒的碰撞速度也随着温度的升高而增加;而当温度高于50 ℃时, 蛋白质的去除率随着温度的升高而降低。这是因为吸附过程是放热过程,温度过高不利于絮凝发生[21]。并且随着温度的升高,蛋白会逐渐变性,不仅颜色会发生改变,而且会降低马铃薯蛋白的品质,故选择较温和的40 ℃为马铃薯蛋白含量的最佳絮凝温度。
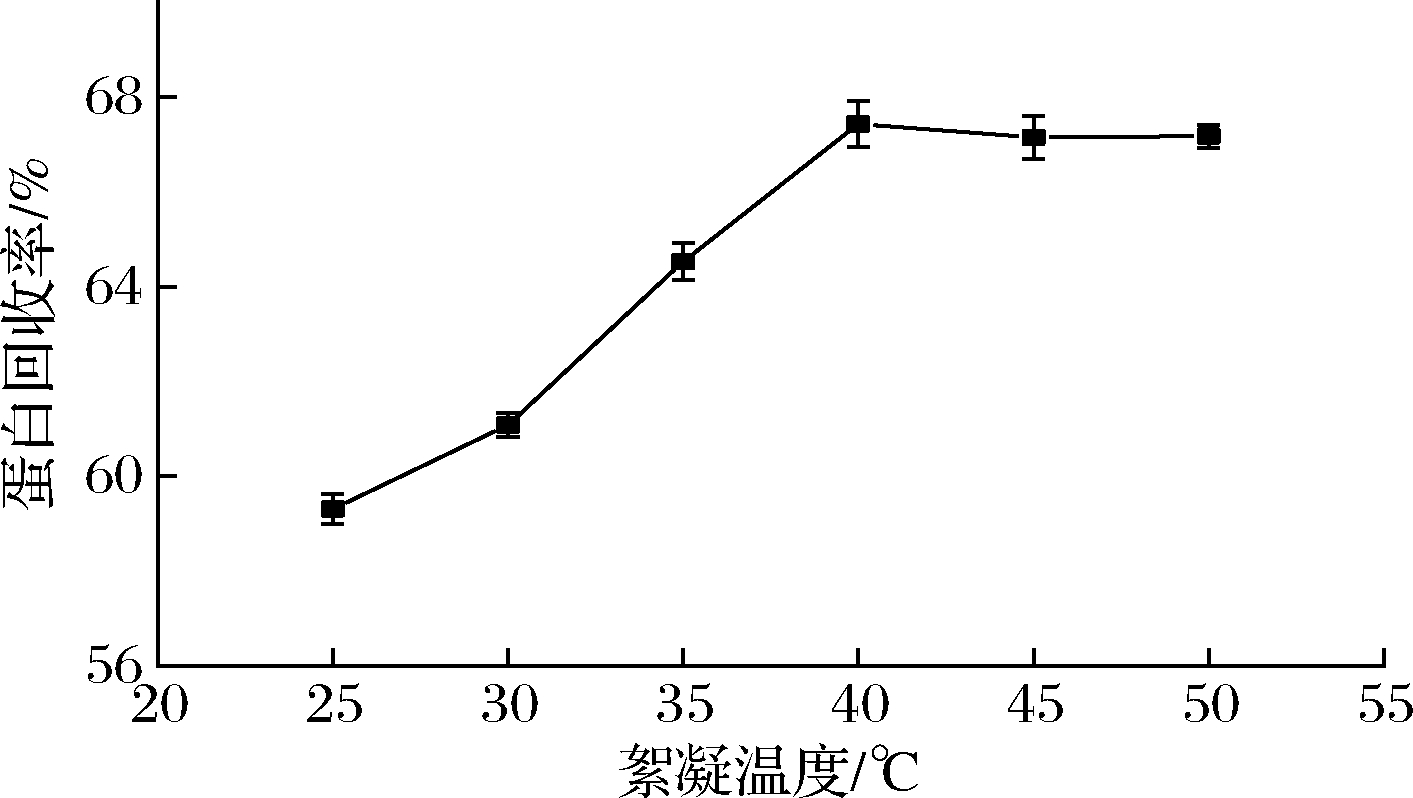
图4 温度对马铃薯蛋白含量的影响
Fig.4 Effect of temperature on flocculation of potato protein content
2.5 絮凝时间对马铃薯蛋白含量的影响
随着絮凝时间的增加,蛋白含量呈现先升高最终趋于平缓的趋势。絮凝体系的形成需要一定的时间,随着时间的增加,蛋白沉淀逐渐增加,在静置40 min时,蛋白质含量为68.16%。马铃薯蛋白质处于等电点时,呈絮状沉淀物,此现象称为蛋白质的结絮作用。结絮作用所形成的絮状物不稳定,随着时间的延长,可以再溶于溶液中[22]。因此絮凝效果在35 min时达到峰值,随着絮凝时间的进一步延长,蛋白含量基本保持不变,结絮后的蛋白质可能重新溶于水中导致回收率降低。由图5可知,随着时间的变化,絮凝时间和其他因素相比,回收率的波动较小,因此优化时,不考虑絮凝时间这一因素。
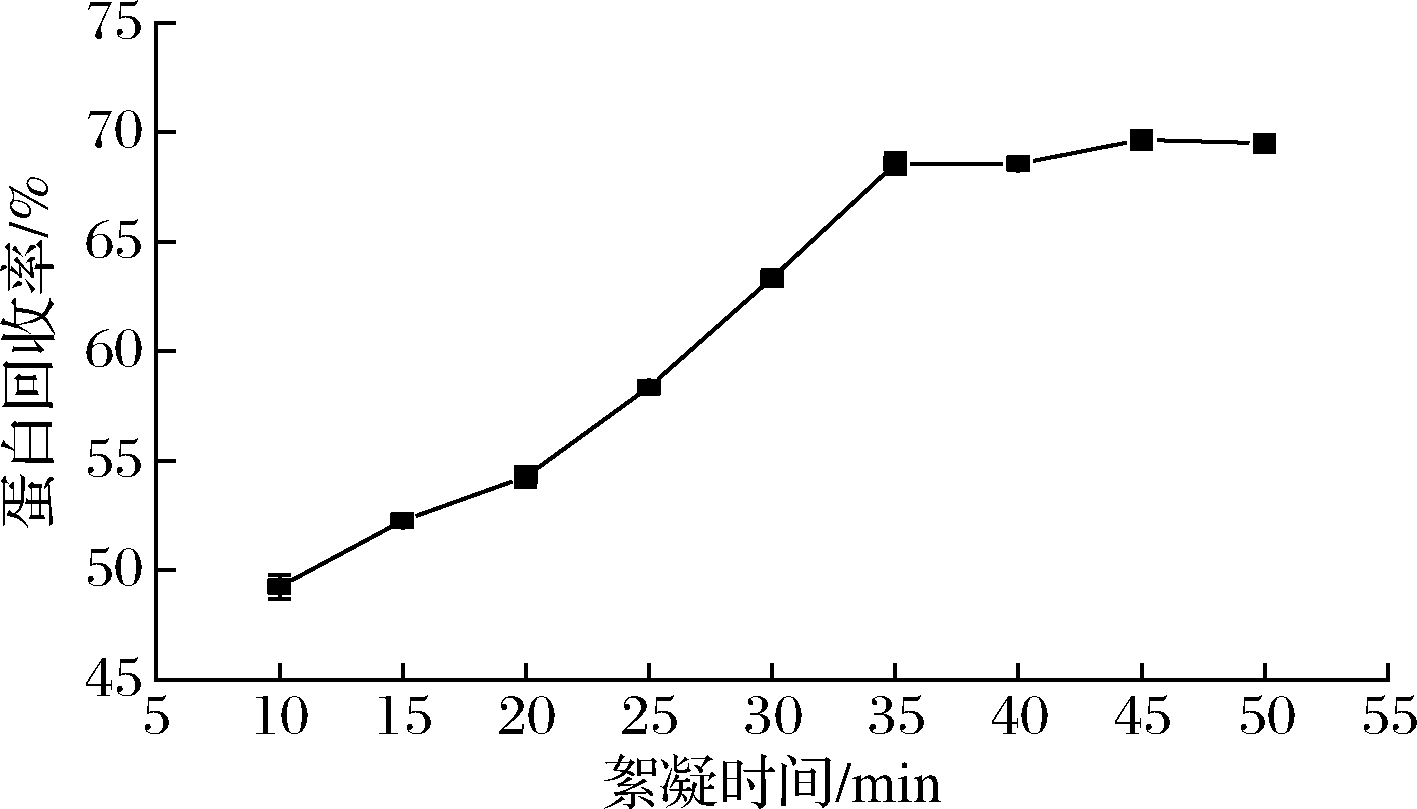
图5 絮凝时间对马铃薯蛋白含量的影响
Fig.5 Effect of flocculation time on flocculation of potato protein content
2.6 响应面优化实验结果
利用Design-Expert8.5软件对其进行试验设计,本实验一共需做17组试验,每组试验做3个平行实验,取平均值。
表2 多元回归方程的方差分析
Table 2 Analysis of variance for the fitted response surface mode
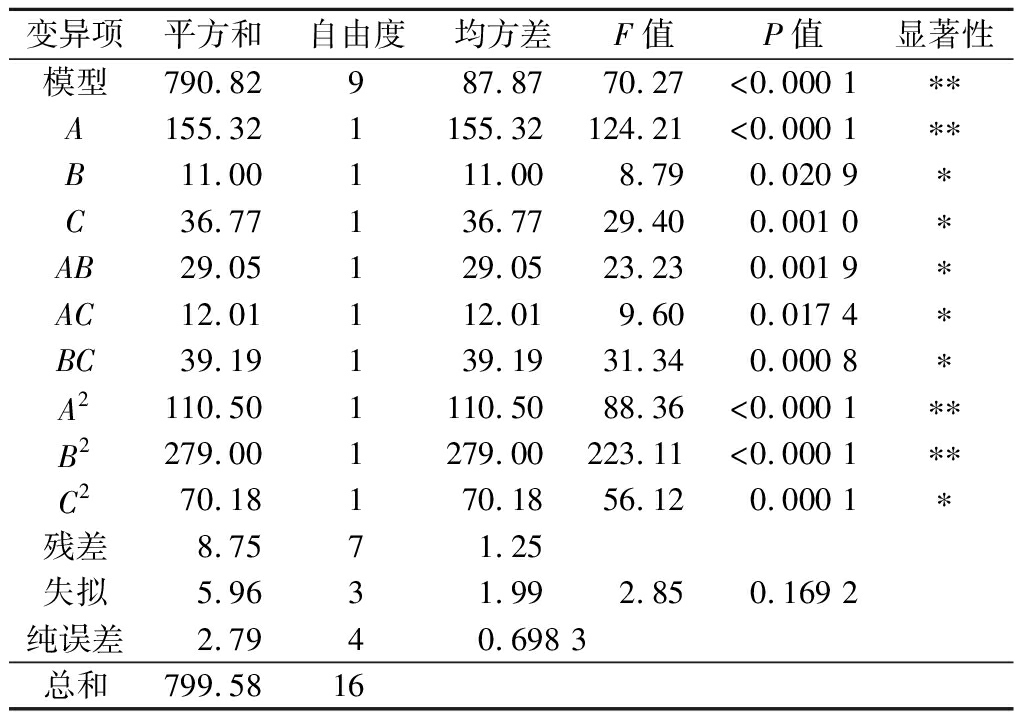
变异项平方和自由度均方差F值P值显著性模型790.82987.8770.27<0.000 1∗∗A155.321155.32124.21<0.000 1∗∗B11.00111.008.790.020 9∗C36.77136.7729.400.001 0∗AB29.05129.0523.230.001 9∗AC12.01112.019.600.017 4∗BC39.19139.1931.340.000 8∗A2110.501110.5088.36<0.000 1∗∗B2279.001279.00223.11<0.000 1∗∗C270.18170.1856.120.000 1∗残差8.7571.25失拟5.9631.992.850.169 2纯误差2.7940.698 3总和799.5816
注:*代表差异显著(P<0.05);**代表差异极显著(P<0.01)
利用Design-Expert 8.0软件对表2的数据进行回归拟合得到二阶回归方程式为:Y=70.74+4.41A-1.17B-2.14C-2.7AB+1.73AC+3.13BC-5.12A2-8.14B2-4.08C2,方程的相关系数![]() 可知,该模型可以作为98.91%的聚谷氨酸絮凝马铃薯蛋白的参考,拟合度良好,可以对粗蛋白含量进行预测。由表2可知,模型的F值为70.27,P值<0.000 1,说明模型极显著;多项式模型方程拟合的性质由确定系数R2表达,R2>0.8说明方程拟合度较好,可以用此模型对聚谷氨酸絮凝马铃薯蛋白进行预测。通过采用Design Expert 11.0 得出最佳条件聚谷氨酸添加量为0.91 g/L,絮凝pH值在3.24,絮凝温度在42.7 ℃,响应值Y(马铃薯蛋白去除率)达到最高值70.73%。
可知,该模型可以作为98.91%的聚谷氨酸絮凝马铃薯蛋白的参考,拟合度良好,可以对粗蛋白含量进行预测。由表2可知,模型的F值为70.27,P值<0.000 1,说明模型极显著;多项式模型方程拟合的性质由确定系数R2表达,R2>0.8说明方程拟合度较好,可以用此模型对聚谷氨酸絮凝马铃薯蛋白进行预测。通过采用Design Expert 11.0 得出最佳条件聚谷氨酸添加量为0.91 g/L,絮凝pH值在3.24,絮凝温度在42.7 ℃,响应值Y(马铃薯蛋白去除率)达到最高值70.73%。
2.7 验证实验
为了验证优化后的发酵培养基是否达到预期效果,按照实验模型的预测条件进行重复性试验,重复3次,测得结果取算数平均值,得到马铃薯蛋白去除率为68.43%,与预测值较为接近,证明此模型参数可靠,有参考价值。使用聚谷氨酸絮凝的马铃薯蛋白为灰白色,有利于蛋白的后续应用。在蛋白回收率方面,与酸热法[23]、碱提酸沉法[24]、无机絮凝剂法[25]等传统方法相比,本研究方法回收马铃薯蛋白质较为理想。
2.8 马铃薯蛋白的红外光谱扫描
2.8.1 聚谷氨酸的絮凝机理
图6中3 400~3 200 cm-1 处有宽大的吸收峰,这个峰归属于缔合的氢键(仲氨基>NH和羧基COOH之间)的O—H伸缩振动;3 080 cm-1 处有脂肪族仲胺中N—H的伸缩振动;1 593 cm-1 处有仲胺中N—H的变形振动,1 400 cm-1 处有酰胺键NH—C![]() O中C—N与N—H的耦合振动。然而,聚谷氨酸絮凝马铃薯蛋白样品中的3 400~3 200 cm-1处的峰变窄,3 080 cm-1、1 593 cm-1两处的吸收峰减弱,1 400 cm-1处的吸收峰也减弱。说明在絮凝过程中聚谷氨酸的仲胺上游离的N—H和羧基上游离的O—H含量均减少,而且它们之间缔合的氢键减弱,所以聚谷氨酸中的胺基和羧基分别与马铃薯蛋白结合形成了新的化学键,而不是缔合的氢键。
O中C—N与N—H的耦合振动。然而,聚谷氨酸絮凝马铃薯蛋白样品中的3 400~3 200 cm-1处的峰变窄,3 080 cm-1、1 593 cm-1两处的吸收峰减弱,1 400 cm-1处的吸收峰也减弱。说明在絮凝过程中聚谷氨酸的仲胺上游离的N—H和羧基上游离的O—H含量均减少,而且它们之间缔合的氢键减弱,所以聚谷氨酸中的胺基和羧基分别与马铃薯蛋白结合形成了新的化学键,而不是缔合的氢键。
聚谷氨酸在1 240 cm-1处并没有吸收峰,而聚谷氨酸絮凝马铃薯蛋白样品中都在1 240 cm-1有吸收峰,此峰是羧基中C—O的伸缩振动所引起的。进一步说明了聚谷氨酸在絮凝过程中游离的羧基减少。可能是由于聚谷氨酸中的氨基、羧基分别与马铃薯蛋白中的氨基、羧基形成了新的酰胺键,发生了交联反应。

a-加入助凝剂CaCl2聚谷氨酸絮凝马铃薯蛋白样品;b-未加入助凝剂CaCl2聚谷氨酸絮凝马铃薯蛋白样品;c-絮凝剂聚谷氨酸纯品
图6 聚谷氨酸絮凝马铃薯蛋白的红外光谱图
Fig.6 IR spectrum for flocculation of potato protein with polyglutamic acid
2.8.2 助凝剂CaCl2在聚谷氨酸絮凝马铃薯蛋白过程中的作用
(1)加入助凝剂CaCl2后,3 400 cm-1处的吸收峰明显增强,这个峰归属于缔合的氢键(仲氨基和羧基之间)的O—H伸缩振动。当加入Ca2+后,增强了氨基与羧基之间的电离作用力,使缔合的氢键增强,由于氢键的作用力增强,聚谷氨酸氢键和Ca2+之间的静电作用力也随之增强。
(2)加入助凝剂CaCl2后,1 750 cm-1、1 630 cm-1的吸收峰增强。1 750 cm-1的肩峰为酰胺键中C![]() O的伸缩振动峰,1 630 cm-1为羧酸盐O
O的伸缩振动峰,1 630 cm-1为羧酸盐O![]() C—O—M+中C
C—O—M+中C![]() O的伸缩振动峰。当加入Ca2+,聚谷氨酸中羧基上的氢被Ca2+取代形成羧酸盐,进一步增强了聚谷氨酸的静电力。
O的伸缩振动峰。当加入Ca2+,聚谷氨酸中羧基上的氢被Ca2+取代形成羧酸盐,进一步增强了聚谷氨酸的静电力。
(3)加入助凝剂CaCl2后,1 315 cm-1的吸收峰发生蓝移至1 330 cm-1。1 330 cm-1为脂肪族仲胺中C—N的伸缩振动峰。加入Ca2+后,仲胺中C—N上的电子云更集中,C—N键增强,增强了聚谷氨酸的负电性或带电能力,所以聚谷氨酸的静电力提升。
(4)加入助凝剂CaCl2后,1 640 cm-1处的吸收峰显著增强,1 640 cm-1为蛋白质酰胺键C![]() O的伸缩振动,表明样品中蛋白的含量显著提高。说明助凝剂的加入,显著增强了聚谷氨酸絮凝马铃薯蛋白的效果。
O的伸缩振动,表明样品中蛋白的含量显著提高。说明助凝剂的加入,显著增强了聚谷氨酸絮凝马铃薯蛋白的效果。
上述几个化学键的变化表明,CaCl2的加入,提升了聚谷氨酸的静电能力,使得聚谷氨酸的絮凝作用增强。扫描电镜的结果显示,聚谷氨酸絮凝马铃薯蛋白过程中加入助凝剂CaCl2,主要由于桥联作用提高了絮凝效率。
2.9 扫描电子显微镜分析
γ-PGA分子结构中有大量的游离羧基,具有-COO-反应活性基团,对阳离子具有一定的络合能力。带正电的离子会与γ-PGA的游离羧基结合从而改变γ-PGA的带电性,进一步改变γ-PGA分子间的作用力,因此加入Ca2+, γ-PGA便凝聚成絮团状集合体而发生聚沉[26]。
由图7-a和图7-b可以看出,由于在絮凝过程中,聚谷氨酸与马铃薯淀粉废水中悬浮物颗粒在吸附架桥和电中和压缩双电层的机理作用下[26],形成的絮体呈立体网状结构;同时由于生物大分子的振动收缩,在絮体沉降过程中,不断将分散在马铃薯淀粉废水中蛋白颗粒网捕和卷入絮体中[26],而与絮体一同沉淀下来。絮凝过程中的絮体电镜扫描图图7-c以及图7-d反映了这一机理,即网捕卷扫机理。红外图谱的结论与扫描电镜的结论吻合。

图7 聚谷氨酸絮体扫描电镜图
Fig.7 Scanning electron microscope of flocs of polyglutamic acid
2.10 马铃薯废水处理前后相关指标变化
使用聚谷氨酸去除马铃薯淀粉废水中的马铃薯蛋白后,马铃薯蛋白含量为65%,马铃薯淀粉废水的指标变化如表3所示。使用聚谷氨酸处理后的马铃薯淀粉废水,氨氮、总磷以及COD以及悬浮物(suspended substance, SS)值都降低。一方面,从工业废水处理的角度看,氨氮、总磷以及COD的降低有利于马铃薯废水的后续处理,可以考虑使用生物处理法进一步处理回收蛋白后的马铃薯淀粉废水,实现废水的资源化利用。另一方面,从肥料应用的方面看,利用其中的氮元素以及磷元素等,以马铃薯废水作为水溶性肥原料进行下一步研究。
表3 马铃薯淀粉废水的指标变化
Table 3 Index changes of potato starch wastewater

指标氨氮/(mg·L-1)总磷/(mg·L-1)CODpHSS值/(mg·L-1)原液78.387±0.15198.650±0.9533 820±305.3±0.23 650处理后废水46.548±0.17113.906±1.2522 050±384.2±0.279去除率/%40.6242.6634.80—97.84
3 结论
本研究利用新型微生物絮凝剂聚谷氨酸去除马铃薯蛋白,通过单因素试验以及响应面优化试验,得出:聚谷氨酸添加量0.93 g/L、初始pH值为3.23,絮凝温度40 ℃、静置时间为40 min,此条件下马铃薯蛋白去除率为68.43%。通过傅里叶红外光谱分析表明,聚谷氨酸絮凝马铃薯蛋白可能是聚谷氨酸中的氨基、羧基分别与马铃薯蛋白中的氨基、羧基形成了新的酰胺键,发生了交联反应。通过扫描电子显微镜分析表明,马铃薯蛋白通过网捕卷扫机理进入聚谷氨酸以及助凝剂形成的立体网状结构。测定回收蛋白前后马铃薯淀粉废水的相关指标值,氨氮去除率为40.62%、总磷去除率为42.66%、COD去除率为34.80%。此方法提取出的马铃薯蛋白,相比于无机絮凝剂,不会造成金属元素的超标,并且不会对环境造成二次污染,可以循环利用,如蛋白肥料的应用。本研究为马铃薯淀粉废水的处理提供了新的思路与方法,有利于实现马铃薯废水的资源化利用。在水处理方面应用前景广阔,具有可行性。
[1] 马健,刘万毅,董梅.马铃薯淀粉废水中蛋白质的回收[J].宁夏工程技术,2018,17(3):231-234.
MA J,LIU W Y,DONG M.Recovery of protein from potato starch wastewater[J].Ningxia Engineering Technology,2018,17(3):231-234.
[2] 付旭东. 高浓度马铃薯淀粉废水处理工艺研究及发展方向[J].环境研究与监测,2016,29(1):48-54.
FU X D.Research and development of high concentration potato starch wastewater treatment technology[J].Environmental Research and Monitoring,2016,29(1):48-54.
[3] PU S Y,MA H,ZINCHENKO A,et al.Novel highly porous magnetic hydrogel beads composed of chitosan and sodium citrate:An effective adsorbent for the removal of heavy metals from aqueous solutions[J].Environmental Science and Pollution Research,2017,24(19):16 520-16 530.
[4] YAN H H,NIAN Y G,ZHOU Y X,et al.A detailed dissolved organic matter characterization of starch processing wastewater treated by a sedimentation and biological hybrid system[J].Microchemical Journal,2017,130:295-300.
[5] 李芳蓉,贺莉萍,王英,等.马铃薯淀粉生产废水资源化处理及综合利用[J].粮食与饲料工业,2018(6):31-37.
LI F R,HE L P,WANG Y,et al.Waste water treatment in potato starch production and comprehensive utilization[J].Cereal & Feed Industry,2018(6):31-37.
[6] WU D.Recycle technology for waste residue in potato starch processing:A review[J].Procedia Environmental Sciences,2016,31:108-112.
[7] 杨洋. 工业废水处理站臭气处理实例分析与总结[J].广东化工,2018,45(11):209;208.
YANG Y.An analysis and summary on odor treatment example of industrial wastewater treatment stations[J].Guangdong Chemical Industry,2018,45(11):209;208.
[8] 李洪枚.我国城市污水处理厂恶臭污染物排放研究现状[C].成都:2014中国环境科学学会学术年会论文集,2014.
LI H M.Research status of odor pollutants emission from municipal wastewater treatment plants in China[C].Chengdu:2014 annual meeting of Chinese society of Environmental Sciences,2014.
[9] 李琳,刘俊新.细菌与真菌复合作用处理臭味气体的试验研究[J].环境科学,2004,25(2):22-26.
LI L,LIU J X.Study on odors treatment by the combination of bacteria and fungi[J].Environmental Science,2004,25(2):22-26.
[10] 阳成贵. 氨氮总磷超标污染环境影响评价及防治对策探讨[J].环境与发展,2018,30(3):117;119.
YANG C G.Study on environmental impact assessment and control countermeasures of ammonia nitrogen total phosphorus pollution[J].Environment and Development,2018,30(3):117;119.
[11] 李晓婷,刘刚,王天宁,等.马铃薯淀粉加工废水还田对土壤氮磷钾迁移转化的影响[J].安徽农业科学,2020,48(17):91-96;111.
LI X T,LIU G,WANG T N,et al.Effects of returning potato starch processing wastewater to soil on nitrogen,phosphorus,and potassium migration in soil[J].Journal of Anhui Agricultural Sciences,2020,48(17):91-96;111.
[12] 谈思颖. 胺类有机絮凝剂在氯胺消毒中生成亚硝胺类副产物研究[D].重庆:重庆大学,2019.
TAN S Y.Study on N-nitrosamine formation from amine-based organic flocculants during chloramintion[D].Chongqing:Chongqing University,2019.
[13] KUMAR M,SHEVATE R,HILKE R,et al.Novel adsorptive ultrafiltration membranes derived from polyvinyltetrazole-co-polyacrylonitrile for Cu(II)ions removal[J].Chemical Engineering Journal,2016,301:306-314.
[14] 许琼,毛晨鹏,周芯,等.水处理中絮凝剂的研究与应用进展[J].黑龙江科学,2017,8(24):172-173.
XU Q,MAO C P,ZHOU X,et al.Research and application progress of flocculants in water treatment[J].Heilongjiang Science,2017,8(24):172-173.
[15] 刘乐,费良军,陈琳,等.γ-聚谷氨酸对土壤结构、养分平衡及菠菜产量的影响[J].水土保持学报,2019,33(1):277-282;287.
LIU L,FEI L J,CHEN L,et al.Effects of γ - polyglutamic acid on soil structure,nutrient balance and spinach yield[J].Journal of Soil and Water Conservation,2019,33(1):277-282;287.
[16] PEREIRA A E S,SANDOVAL HERRERA I E,ZAVALA-BETANCOURT S A,et al.γ-Polyglutamic acid /chitosan nanoparticles for the plant growth regulator gibberellic acid:Characterization and evaluation of biological activity[J].Carbohydrate Polymers,2017,157:1 862-1 873.
[17] GOODING E A,SHARMA S,PETTY S A,et al.pH-dependent helix folding dynamics of poly-glutamic acid[J].Chemical Physics,2013,422:115-123.
[18] YOKOI H,ARIMA T,HIROSE J,et al.Flocculation properties of poly(γ-glutamic acid) produced by Bacillus subtilis[J].Journal of Fermentation and Bioengineering,1996,82(1):84-87.
[19] 刘婷婷,姚佳,张飞俊,等.回收马铃薯淀粉废水中蛋白质的工艺优化[J].食品科技,2013,38(10):202-208.
LIU T T,YAO J,ZHANG F J,et al.Optimization of protein extraction process from potato starch wastewater[J].Food Science and Technology,2013,38(10):202-208.
[20] 陈立丰,李明俊,万诗贵,等.有机高分子絮凝剂和聚铁絮凝剂处理高浊度原水的研究[J].水处理技术,1999,25(1):49-53.
CHEN L F,LI M J,WAN S G,et al.A study of treating high turbidity raw water with organic polymers and polymeric ferric sulfate flocculants[J].Technology of Water Treatment Technology,1999,25(1):49-53.
[21] 刘军. 聚丙烯酰胺在工业废水处理中的应用[J].广西轻工业,2009,25(7):98-99.
LIU J.Application of Polyacrylamide in industrial wastewater treatment[J].Guangxi Journal of Light Industry,2009,25(7):98-99.
[22] 任琼琼,陈丽清,韩佳冬,等.马铃薯淀粉废水中蛋白质的提取研究[J].食品工业科技,2012,33(14):284-287.
REN Q Q,CHEN L Q,HAN J D,et al.Research of protein extracting from potato starch waste-water[J].Science and Technology of Food Industry,2012,33(14):284-287.
[23] 江洪波,徐鑫,覃瑞,等.马铃薯蛋白提取方法综述[J].安徽农业科学,2019,47(3):9-11;15.
JIANG H B,XU X,QIN R,et al.Review on extraction methods of potato protein[J].Journal of Anhui Agricultural Sciences,2019,47(3):9-11;15.
[24] WAGLAY A,KARBOUNE S,ALLI I.Potato protein isolates:Recovery and characterization of their properties[J].Food Chemistry,2014,142:373-382.
[25] 张秀红,王文轩,张廉,等.利用剩余污泥制备微生物絮凝剂及其絮凝性能与机理分析[J].环境工程,2019,37(3):50-54.
ZHANG X H,WANG W X,ZHANG L,et al.Preparation of sludge flocculants from excess sludge and analysis of its flocculating performance and machanism[J].Environmental Engineering,2019,37(3):50-54.
[26] 孟少魁. 普鲁兰发酵条件优化及其重金属絮凝研究[D].武汉:华中科技大学,2006.
MENG S K.Optimization of fermentation conditions and flocculation of heavy metals in Pullulan[D].Wuhan:Huazhong University of Science and Technology,2006.