酱油是我国传统的发酵调味品,与人们的生活息息相关。酱油发酵是多种微生物共同作用的过程,经过微生物及其酶系的长期作用,赋予了酱油良好的风味[1]。4-乙基愈创木酚(4-ethyl guaiacol, 4-EG),分子式为C9H12O2,呈发酵香气,微带酚的气息,通常被描述为一种烟熏味和丁香味的物质,存在于日本酱油和中国传统高盐稀态酱油,其香气很受消费者欢迎[2]。4-EG风味阈值极低,其含量相差0.5 mg/L就很容易被感官识别,有文献认为,1~2 mg/L的4-EG便可明显改善酱油的风味品质[3]。因此,4-EG的含量与酱油的品质存在较为密切的关系。
4-EG可以通过化学合成,也可以从天然植物中提取,或者通过生物转化法制备,工业化生产主要是通过化学合成途径进行的[4]。由于人造食品的潜在危害,人们对天然食品的需求持续增长,但是从天然植物中提取4-EG的量非常有限,不能满足日益增长的消费需求[5-6]。而生物催化转化法具有反应条件温和、底物专一性好、工艺环境友好等优点,近年来发展迅速[7-8]。
近些年,有关生物催化转化方式的研究较多。董永胜等[9]发明了一种利用环状芽孢杆菌和酒香酵母菌株发酵产生4-EG的方法。王少磊等[10]从浓香型大曲中筛选到1株产4-EG的菌株。肖澎等[4, 11]探究了阿魏酸(ferulic acid,FA)转化为挥发性酚的途径,由FA转化生成4-EG的途径分为2步:首先FA在脱羧酶的作用下可转化为4-乙烯基愈创木酚(4-vinyl guaiacol,4-VG),随后4-VG通过还原酶的作用转化为4-EG。SUN等[12]研究了以米糠为原料制备FA粗提液,并利用地衣芽孢杆菌发酵进一步产生4-VG的方法。然而在酱油酿造过程中,利用生物转化产生4-EG的研究目前报道较少,本研究主要对高盐稀态酱油酿造过程中能够产生4-EG的菌株进行筛选、鉴定,并探讨菌株的生长特性,以期为提高传统酱油产品中4-EG的含量奠定相关研究基础。
1 材料与方法
1.1 材料与仪器设备
样品:菌种筛选原料由广东某食品有限公司提供;曲料和酱醪取自制曲车间和发酵缸。
试剂:FA、4-EG,麦克林生化科技有限公司;4-VG,上海阿拉丁试剂有限公司;细菌DNA试剂盒,广东环凯微生物科技有限公司;其他试剂均为国产分析纯,广州丛源试剂有限公司。
仪器设备:LDZX-50KBS立式高压蒸汽灭菌锅、DNP-9082生化恒温培养箱,上海博迅医疗生物仪器有限公司;SW-CJ-1FD超净工作台,深圳市永盛旺实业有限公司;THZ-82恒温振荡培养箱,常州恩培仪器有限公司;KH20A台式高速离心机,上海析域仪器设备有限公司;TU-1901双光束紫外可见分光光度计,上海仪电分析仪器有限公司;U3000高效液相色谱仪,赛默飞科技有限公司;Agilent 7000C三重串联四级杆气质联用仪,安捷伦科技有限公司;IX73荧光倒置显微镜,奥林巴斯有限公司。
1.2 实验方法
1.2.1 培养基的配制
LB液体培养基:NaCl 0.5 g,酵母膏0.5 g,葡萄糖0.1 g,蛋白胨 1 g,溶于100 mL去离子水,自然pH,121 ℃灭菌20 min。
LB固体培养基:同LB液体培养基配制方法,再加入2%(质量分数)琼脂粉。
发酵培养基:FA 0.1 g,酵母膏1 g,KH2PO4 0.09 g,Na2HPO4 1 g,MgSO4 0.02 g,CaCl2 0.01 g,溶于100 mL蒸馏水,自然pH,121 ℃灭菌20 min。
1.2.2 菌株的分离
分别称取10 g发酵酱醪、发酵成曲,在无菌条件下研磨成粉末加入到250 mL三角瓶中,同时加少数玻璃珠和90 mL生理盐水,在30 ℃,160 r/min条件下振荡20 min制成10-1菌种悬浮液,再用无菌生理盐水将悬液梯度稀释至10-4~10-7。取0.1 mL浓度为10-4~10-7的菌种悬液涂布于LB平板上30 ℃倒置培养24~48 h [13]。
根据菌落的形态特征等挑取单菌落在LB平板上划线,30 ℃培养24 h,得到产4-EG菌株的单克隆。将纯化的菌株接种于LB培养基中,30 ℃、160 r/min振荡培养24 h,置于甘油-20 ℃保藏[14]。
1.2.3 4-EG产生菌株的筛选
从菌株斜面上挑取菌落接至LB液体培养基中,于30 ℃,160 r/min摇床培养24 h制成瓶种。将种子液以5%的接种量(体积分数)接种至发酵培养基,30 ℃、160 r/min振荡培养6 d[15]。
移取发酵液10 mL,加同等体积二氯甲烷,混匀静置5 min,8 000 r/min离心15 min,转移至分液漏斗,待分层后取下层清液,以上操作重复3次,合并萃取液,加5 g无水硫酸钠冷冻过夜除去水分,用韦氏蒸馏柱浓缩至5 mL(60 ℃保持微沸),氮气吹扫浓缩至2 mL,过0.22 μm有机滤膜,用GC-MS/选择离子监测(selective ion monitoring, SIM)法进行检测分析。根据GC-MS检测结果选取目标菌株进行下一步分析鉴定[16]。
色谱条件:HP-5毛细管柱(30 m×0.32 mm×0.25 μm);恒流:1.0 mL/min;分流比15∶1;进样量1 μL;进样口温度250 ℃。升温程序:初温50 ℃,以8 ℃/min升温至100 ℃,保持5 min,以10 ℃/min升温至170 ℃保持3 min,以15 ℃/min升温到235 ℃,保持4 min,总分析时间29.58 min[17]。
质谱条件:电子电离源,能量70 eV,离子源温度250 ℃,传输线温度240 ℃。定性采用全扫描模式,质量扫描范围m/z 50~500;定量采用SIM,4-EG的特征离子为:m/z 137/152/122[18]。
1.2.4 目标菌株发酵过程各种物质含量的测定
将初筛所得目标菌株活化培养成种子液,接种至发酵培养基,于30 ℃、160 r/min振荡培养12 d,每2 d 取10 mL样品过滤离心后保存至4 ℃冰箱,发酵结束用HPLC检测样品中FA、4-VG及4-EG的相对含量,探究菌株发酵过程中3种物质的含量变化[19]。
HPLC条件:Waters Atlantis®T3反相C18色谱柱 (5 μm×4.6 mm×250 mm),流动相:A为甲醇,B为1%甲酸水;洗脱程序:0~15 min,100%~48% B;15~20 min,48% B;20~30 min,48%~30% B;30~35 min,30% B;流速为1 mL/min;进样量10 μL;柱温30 ℃;检测波长为0~18 min,320 nm;18~35 min,280 nm。
制定标准曲线:取标准品FA、4-VG、4-EG,溶于甲醇配制质量浓度为100 mg/L的混合标准溶液,依次稀释为:20、40、60、80、100 mg/L。用HPLC测定,甲醇为空白对照,以标准溶液质量浓度为横坐标,峰面积为纵坐标制定标准曲线,建立线性方程[20]。
1.2.5 菌株鉴定
1.2.5.1 形态特征观察
经过发酵实验筛选的目标菌株,将其菌悬液梯度稀释后涂布于LB平板培养基,置于35 ℃恒温箱培养24 h,观察菌体在固体平板上的形状、颜色、黏稠度、透明度等特征,提取单菌落进行革兰氏染色,在荧光倒置显微镜下观察菌体的显微形态[21]。
1.2.5.2 菌株生理生化鉴定
菌株的生理生化实验参考第九版《伯杰氏细菌鉴定手册》及东秀珠所著《常见细菌系统鉴定手册》,主要包括蔗糖、葡萄糖、麦芽糖、木糖等糖氧化发酵实验,鸟氨酸、精氨酸、赖氨酸等氨基酸脱羧酶实验,过氧化氢酶、脲酶、柠檬酸盐利用、甲基红实验、V-P实验、吲哚实验、淀粉水解、明胶水解、酪素水解等[12]。
1.2.5.3 菌株分子生物学鉴定
用试剂盒提取菌株基因组,采用16S rDNA通用引物,以目标菌株DNA为模板进行PCR扩增。取5 μL PCR扩增产物用于琼脂糖凝胶电泳检测,将检测结果正确的样品送往广州艾基生物技术有限公司测定16S rDNA序列。
测序结果拼接后导入NCBI数据库进行同源性BLAST比对,然后下载比对相似度在99.8%以上的前10个菌种的DNA序列,并利用MEGA-X构建系统发育树,并进行1 000次bootstraps检验计算支持率[10]。
1.2.6 目标菌株生物学特性研究
1.2.6.1 形态特征观察
将目标菌株等量接种到装有10 mL培养基的试管中,分别在不同温度,转速为160 r/min的摇床培养24 h,温度分别为25、28、30、32、35、37、40、42 ℃,空白对照为LB液体培养基,用紫外分光光度计测定600 nm处OD值[13]。
1.2.6.2 生长曲线
将目标菌株等量接种到装有10 mL培养基的试管中,置于30 ℃、160 r/min的摇床振荡培养,分别培养2、4、6、8、10、12、14、16、18、20 h,将标有相应时间的试管取出,立即放4 ℃冰箱保存,空白对照为LB液体培养基,用紫外分光光度计测定600 nm处OD值。
1.2.6.3 耐盐性
将目标菌株等量接种到不同NaCl浓度的LB液体培养基,在30 ℃、160 r/min振荡培养24 h,NaCl的质量分数分别为1%、3%、5%、7%、9%、11%、13%、15%、17%、19%,空白对照为LB液体培养基,用紫外分光光度计测定600 nm处OD值[13]。
1.2.7 统计分析
每个实验均设置3次平行,实验数据使用 Microsoft Office Excel 2010处理,实验结果用平均值±标准偏差的形式表示。
2 结果与讨论
2.1 4-EG产生菌株筛选
将菌种原料进行多次稀释涂布培养和划线分离,根据平板上菌落特征初步筛选分离获得10种菌株,根据分离时间顺序给菌株进行编号。将分离到的10株单菌接种到发酵培养基中,32 ℃、160 r/min振荡培养6 d,以4-EG含量为100 mg/L的标准溶液为对照,用GC-MS/SIM法检测发酵样品中的4-EG的含量,检测结果如表1所示。
表1 菌株筛选结果
Table 1 Results of strain screening
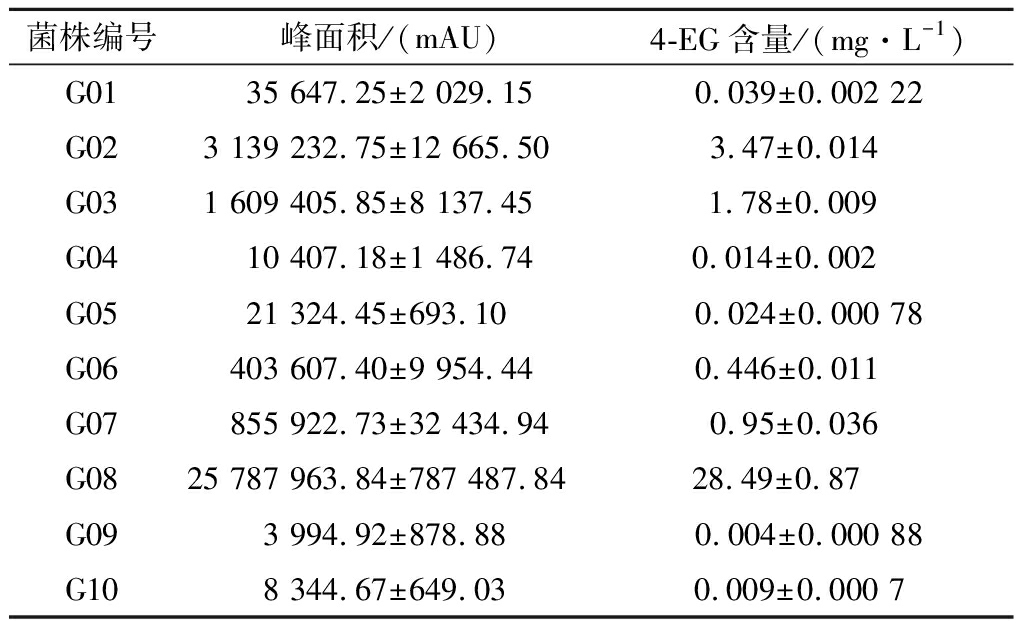
菌株编号峰面积/(mAU)4-EG含量/(mg·L-1)G0135 647.25±2 029.150.039±0.002 22G023 139 232.75±12 665.503.47±0.014 G031 609 405.85±8 137.451.78±0.009 G0410 407.18±1 486.740.014±0.002 G0521 324.45±693.100.024±0.000 78G06403 607.40±9 954.440.446±0.011 G07855 922.73±32 434.940.95±0.036 G0825 787 963.84±787 487.8428.49±0.87 G093 994.92±878.880.004±0.000 88G108 344.67±649.030.009±0.000 7
注:表中数值为平均值±标准偏差(n=3)。
由表1可知,菌株G02、G03、G08均可利用发酵培养基中的FA产生4-EG,其中菌株G08的产4-EG能力最强,该菌株发酵产物的4-EG含量可达28.49 mg/L,因此选取该菌株做下一步分析鉴定。
2.2 菌株G08发酵过程各种物质含量测定
2.2.1 标准曲线制作及线性关系考察
标准混合样品的液相色谱图如图1所示
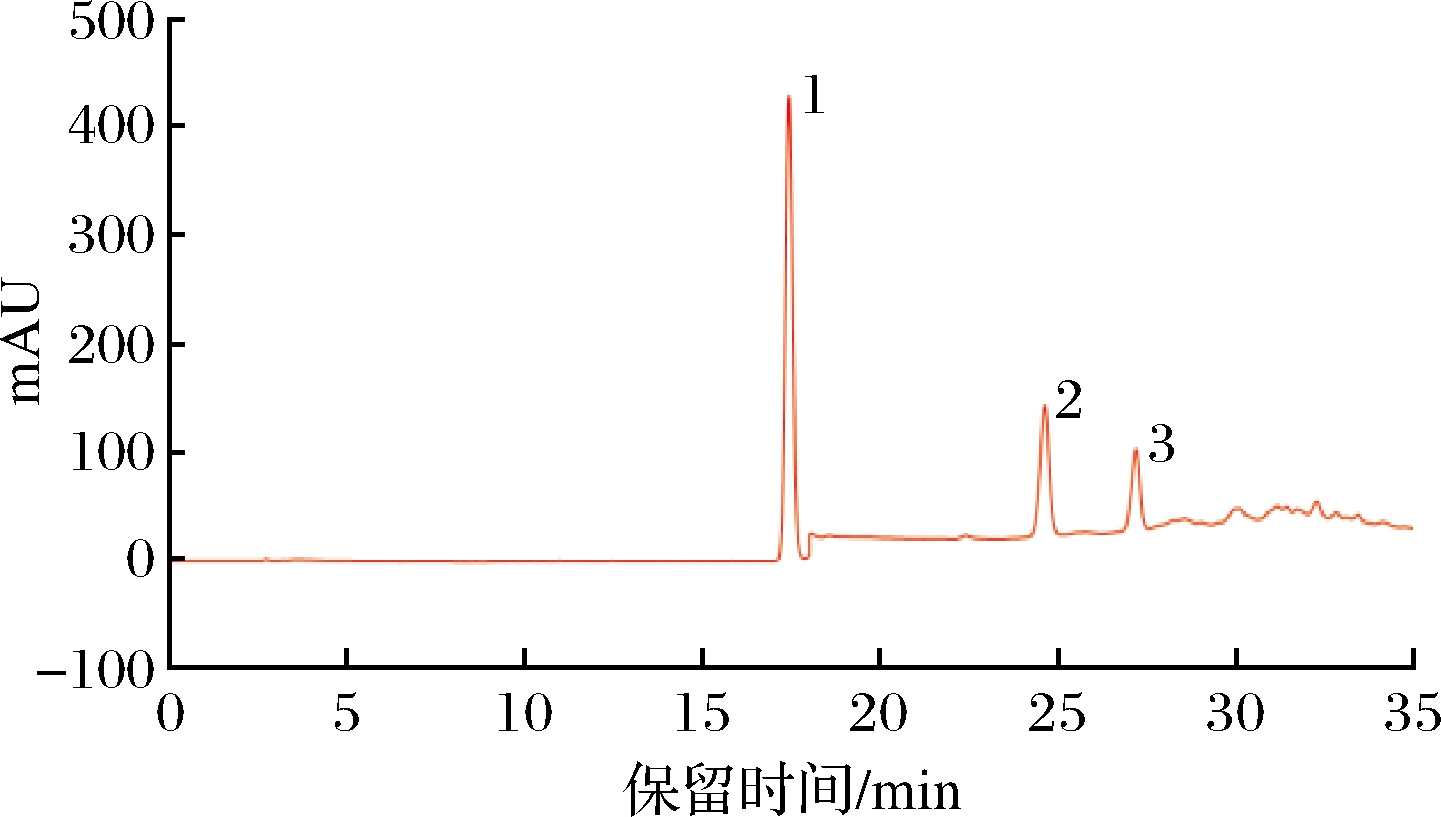
1-FA(17.4 min);2-4-VG(24.6 min);3-4-EG(27.2 min)
图1 标准混合样品液相色谱图
Fig.1 Liquid chromatogram of mixed standards
以标准溶液中的物质质量浓度(mg/L)和HPLC标准色谱图峰面积分别为横纵坐标制定标准曲线。FA的回归方程:y=0.952 8x-2.922 1,R2=0.996 6;4-VG的回归方程:y=0.471 8x-0.236 8,R2=0.998 7;4-EG的回归方程:y=0.250 2x-0.463 5,R2=0.998 6。
2.2.2 菌株G08发酵过程物质含量变化
将菌株G08活化培养成种子液,接入发酵培养基中,30 ℃、160 r/min恒温发酵12 d,每2 d取10 mL样品过滤离心后保存至4 ℃冰箱,发酵结束后用HPLC检测不同发酵时段的样品中FA、4-VG及4-EG的相对含量,结果如图2所示。
在菌株G08发酵前期,FA的含量在迅速降低,而4-VG的含量在不断升高,由此表明这一阶段的生物转化反应以FA脱羧生成4-VG为主。从第4天开始FA的含量基本稳定在190 mg/L,与此同时4-VG的含量在第4天达到最高为178 mg/L,随后开始逐渐降低,到第8天稳定在65 mg/L,而4-EG的含量则缓慢升高,且由第8天开始含量增速明显加快,到第12天达到最高为62 mg/L,由此可估算4-EG的摩尔转化率为7.92%。
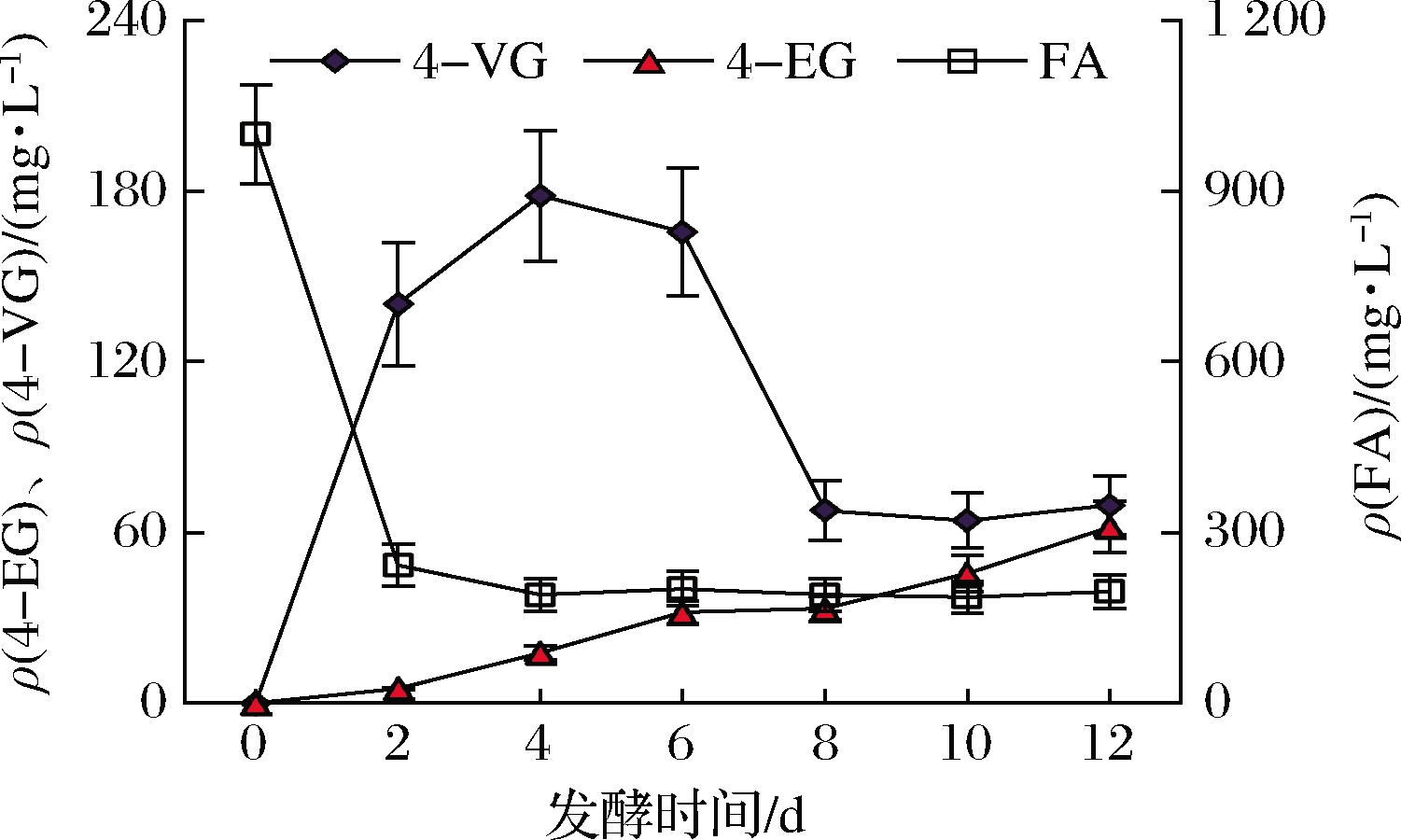
图2 G08发酵过程中物质含量变化
Fig.2 Changes of substance content during G08 fermentation
2.3 菌株G08的鉴定
2.3.1 形态特征鉴定
菌株G08经生理盐水稀释后涂布在LB平板上,35 ℃培养24 h,观察菌落形态,菌落幼期为乳白色,成熟期为淡黄色,不透明,形状规则,中央隆起,表面黏稠,边缘整齐(图3-a);在液体培养基中菌体成团,菌液浑浊,可产生菌膜;在显微镜下观察显微形态,菌体为不规则短杆状,革兰氏染色呈阳性,产芽孢(图3-b)。

a-菌落形态;b-显微形态
图3 菌株G08的菌落形态和显微形态
Fig.3 Colony morphology and micromorphology of strain G08
2.3.2 菌株生理生化鉴定
菌株G08的生理生化特性试验结果如表2所示。该菌株可氧化发酵蔗糖、麦芽糖、葡萄糖,发酵过程中产酸但不产气,不能够利用木糖。依据《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册(第九版)》的现有菌株特性进行比对,发现菌株G08的生理生化特性与芽孢杆菌属十分相似,可以初步判断为芽孢杆菌,还需通过分子生物学鉴定进一步验证。
表2菌株G08的生理生化特性
Table 2 Biochemical and physiological characters of strain G08

试验项目结果试验项目结果蔗糖 +明胶水解+葡萄糖 +过氧化氢酶+麦芽糖 +脲酶-木糖 -柠檬酸盐+鸟氨酸 -丙酸盐-精氨酸 +硝酸盐还原试验+赖氨酸 -吲哚试验-酪素水解+甲基红试验-淀粉水解+V-P试验+
注:“+”表示试验结果阳性,“-”表示试验结果阴性
2.3.3 菌株的分子生物学鉴定
以菌株G08基因组为模板进行PCR扩增,然后进行电泳试验,电泳检测结果如图4所示,扩增片段分子质量大约在1 200~1 500 bp,条带清晰明亮且不存在非特异性扩增,表示16S rDNA 扩增成功。将扩增产物回收纯化后进行测序,确定该片段的实际长度为1 368 bp。

图4 菌株G08的16S rDNA凝胶电泳图
Fig.4 Gel electrophoresis pattern of PCR amplified product of 16S rDNA from strain G08
将测序结果提交至NCBI 数据库用BLAST程序进行同源性比对,比对结果显示菌株G08与芽孢杆菌属的几个菌种的同源性均达到99.8%,可判定该菌株属于芽孢杆菌属。经多序列同源性分析,得到10个同源性大于99.8%的菌株,用MEGA-X软件构建系统发育树,获得菌株G08的系统发育地位,系统进化树如图5所示。结果表明菌株G08与Bacillus subtilis属于同一分支,综合该菌株的形态特征和生理生化特性,判断该菌株是芽孢杆菌属中的一个种,为枯草芽孢杆菌(Bacillus subtilis),命名为Bacillus subtilis G08。

图5 菌株G08基于16S rDNA序列构建的系统发育树
Fig.5 Phylogenetic tree based on partial 16S rDNA sequences of strain G08
2.4 菌株G08的生物学特性
2.4.1 最适生长温度
由图6可知,菌株G08的最适生长温度为35 ℃,低于35 ℃时,随温度的升高,OD600值缓慢递增;当高于35 ℃时,随温度的升高,OD600值逐渐递减。
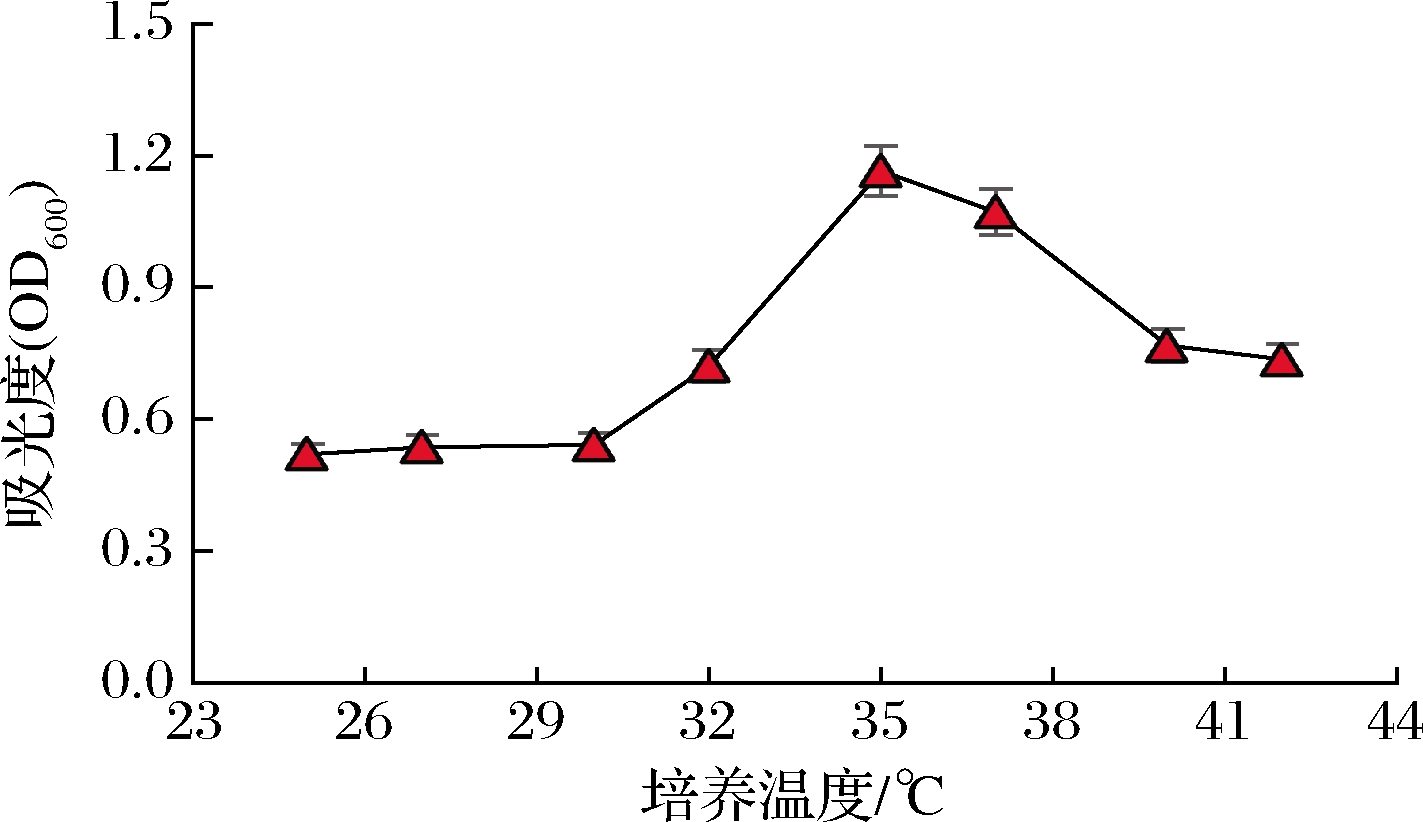
图6 菌株G08的最适生长温度
Fig.6 The optimum growing temperature for strain G08
2.4.2 生长曲线
由图7可知,在培养初期(0~10 h)菌株G08生长较为缓慢,为生长迟缓期;培养中期(10~16 h)生长速度明显加快,为对数增殖期;16 h后生长速度开始减缓,到18 h进入稳定期,OD600值基本不发生明显改变。
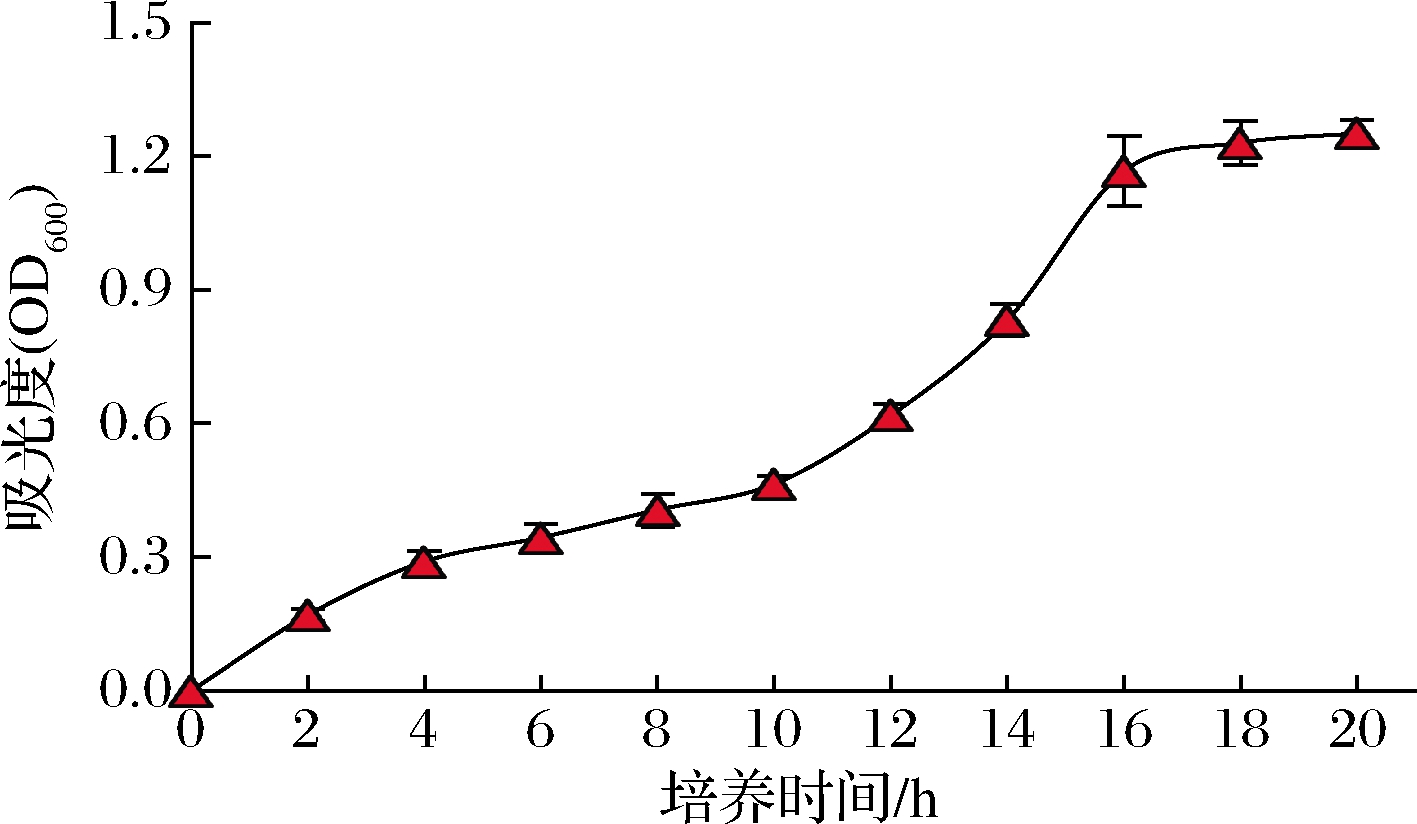
图7 菌株G08的生长曲线
Fig.7 The growth curve of strain G08
2.4.3 耐盐性
由图8 可知,当NaCl质量分数低于5%时,随着NaCl含量的升高,菌株G08的OD600值呈递增趋势,由此说明适量的NaCl有助于该菌株生长增殖;而NaCl质量分数高于5%时,菌株OD600值明显减小;NaCl质量分数在7%~9%时,菌株还能够正常生长;当NaCl质量分数高于9%时,菌株的生长明显受到抑制;NaCl质量分数高于11%时,菌株基本难以生长,由此可判断菌株G08对NaCl的耐受性为9%。
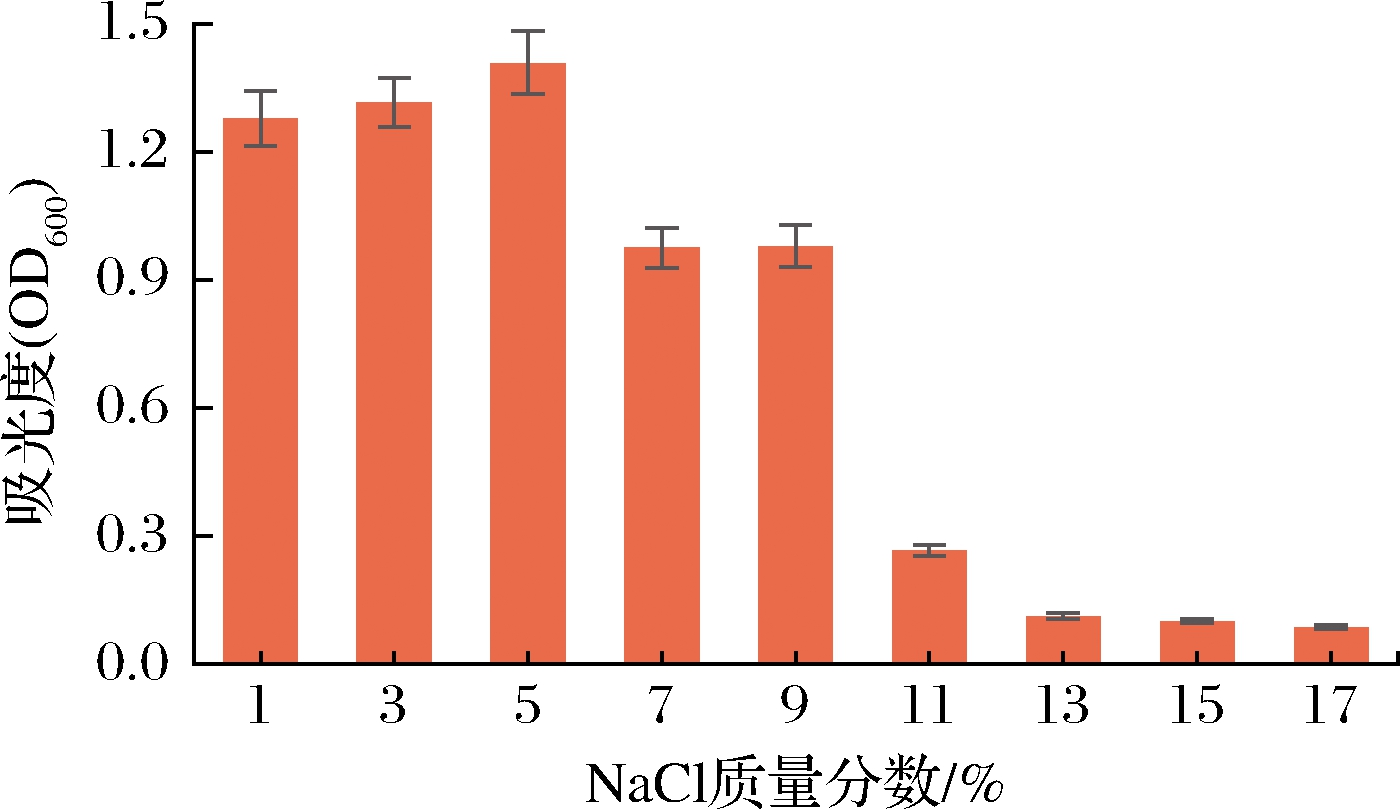
图8 菌株G08的耐盐性
Fig.8 The salt tolerance of strain G08
3 结论
本研究以FA为主要原料的培养基,以菌株发酵产物中4-EG的含量为参考标准,从传统中式酱油的酱醪、成曲中分离筛选到1株能够将FA转化4-EG的菌株G08,并探究了其转化过程中FA、4-VG及4-EG的含量变化。采用形态观察、生理生化鉴定、16S rDNA序列分析等方法判断该菌株属于枯草芽孢杆菌。该菌株在转化FA成为4-EG的能力上优于其他菌株,4-EG的摩尔转化率可达到7.92%。现已有文献报道一些耐盐酵母和芽孢杆菌有类似的转化能力,但如何将这类菌株与米曲霉、黑曲霉等酱油生产所用的常规菌种综合利用,有效开发麸皮、米糠、甜菜粕等农副产品中的阿魏酸,通过多菌种不同阶段连续发酵的方式提高酱油中4-EG的含量,需要结合生产实践进一步研究。
[1] 王远亮,王传花,马骞,等.酱油发酵前期微生物变化及其主要香味物质分析[J].食品与机械,2009,25(4):31-34.
WANG Y L,WANG C H,MA Q,et al.Analysis of microorganisms and main flavor substance in first stage of soy sauce fermentation[J].Food and Machinery,2009,25(4):31-34.
[2] 崔云前, 曹小红,王春玲.发酵行业4-乙烯基愈创木酚和4-乙基愈创木酚研究进展[J].中国酿造,2009(4):14-17.
CUI Y Q,CAO X H,WANG C L.Research progress of 4-vinylguaiacol and 4-ethylguaiacol in fermentation industry[J].China Brewing,2009(4):14-17.
[3] ITO T,KONNO M,SHIMURA Y,et al.Formation of guaiacol by spoilage bacteria from vanillic acid,a product of rice koji cultivation,in japanese sake brewing[J].Journal of Agricultural and Food Chemistry,2016,64(22):4 599-4 605.
[4] 肖澎, 袁华伟,何桂强.4-乙基愈创木酚转化菌的筛选、鉴定及转化性能的研究[J].食品与发酵工业,2014,40(6):44-49.
XIAO P,YUAN H W,HE G Q.Screening identification and the conversional properties of a Bacillus subtilis strain producing 4-ethylguaiacol[J].Food and Fermentation Industries,2014 40(6):44-49.
[5] SHIN J,JEONG S,JIA C H et al.Comparison of antioxidant capacity of 4-vinylguaiacol with catechin and ferulic acid in oil-in-water emulsion[J].Food Science and Biotechnology,2019,28(1):35-41.
[6] LI H,LIN L,FENG Y,et al.Enrichment of antioxidants from soy sauce using macroporous resin and identification of 4-ethylguaiacol,catechol,daidzein,and 4-ethylphenol as key small molecule antioxidants in soy sauce[J].Food Chemistry,2018,240:885-892.
[7] HU H,LI L,DING S.An organic solvent-tolerant phenolic acid decarboxylase from Bacillus licheniformis for the efficient bioconversion of hydroxycinnamic acids to vinyl phenol derivatives[J].Applied Microbiology and Biotechnology,2015,99(12):5 071-5 081.
[8] BAQUEIRO-PE A I,RODR
A I,RODR GUEZ-SERRANO G,GONZ
GUEZ-SERRANO G,GONZ LEZ-ZAMORA E,et al.Biotransformation of ferulic acid to 4-vinylguaiacol by a wild and a diploid strain of Aspergillus niger[J].Bioresource Technology,2010,101(12):4 721-4 724.
LEZ-ZAMORA E,et al.Biotransformation of ferulic acid to 4-vinylguaiacol by a wild and a diploid strain of Aspergillus niger[J].Bioresource Technology,2010,101(12):4 721-4 724.
[9] 董永胜,马蕾,崔云前,等.一种微生物发酵产生4-乙基愈创木酚的方法:中国,CN103805639 A[P].2014.05.21.
DONG Y S,MA L,CUI Y Q,et al.A microbial fermentation method for producing 4-ethyl guaiacol:China,CN103805639 A[P].2014.05.21.
[10] 王少磊, 曹荣升,沈芳,等.浓香型大曲中4-乙基愈创木酚产生菌的筛选及其鉴定[J].酿酒科技,2018(5):48-52.
WANG S L,CAO R S,SHEN F,et al.Screening and identification of a 4-ethylguaiacol-producing strain from Nongxiang Daqu[J].Liquor-Making Science & Technology,2018 (5):48-52.
[11] 肖澎, 李慧,吴重德,等.4-乙基愈创木酚生产菌株D-31培养条件的优化[J].食品工业科技,2014,35(13):244-247;252.
XIAO P,LI H,WU C D,et al.Optimization of culture condition for a strain D-31 producing 4-ethylguaiacol[J].Sci-ence and Technology of Food Industry,2014 35(13):244-247;252.
[12] SUN L H,LV S W,YU F,et al.Biosynthesis of 4-vinylguaiacol from crude ferulic acid by Bacillus licheniformis DLF-17056[J].Journal of Biotechnology,2018,281:144-149.
[13] 李丽, 章丹宇,刘军.浓香型白酒酿造过程中一株产阿魏酸酯酶菌株的筛选和鉴定[J].食品工业科技,2021,42(5):126-131;137.
LI L,ZHANG D Y,LIU J,et al.Screening,identification and biological characteristics of ferulic acid esterase strain in Luzhou-flavor liquor brewing process[J] Science and Technology of Food Industry,2021,42(5):126-131;137.
[14] 陈强, 朱新贵,曾小波.酱醪中产香酵母菌筛选及用于低盐固态发酵酱油增香研究[J].中国酿造,2011(6):137-141.
CHEN Q,ZHU X G,ZENG X B.Isolation of the aroma-producing yeast from soy sauce mash and it application for improving the flavor of low-aalt solid-fermentation soy-sauce[J].China Brewing,2011 (6):137-141.
[15] LI X,YANG J,LI X,et al.The metabolism of ferulic acid via 4-vinylguaiacol to vanillin by Enterobacter sp.Px6-4 isolated from Vanilla root[J].Process Biochemistry,2008,43(10):1 132-1 137.
[16] 冯云子. 高盐稀态酱油关键香气物质的变化规律及形成机理的研究[D].广州:华南理工大学,2015.
FENG Y Z.The Evolution and formation mechanism of key aroma compounds during the process of high-salt liquid fermentation soy sauce[D].Guangzhou:South China University of Technology,2015.
[17] FENG Y,SU G,SUN-WATERHOUSE D,et al.Optimization of headspace solid-phase micro-extraction (HS-SPME) for analyzing soy sauce aroma compounds via coupling with direct GC-olfactometry (D-GC-O) and gas chromatography-mass spectrometry (GC-MS)[J].Food Analytical Methods,2017,10(3):713-726.
[18] 孙啸涛, 王宗元,刘淼,等.涡旋辅助液液微萃取结合GC-MS法检测67种白酒中四甲基吡嗪、4-甲基愈创木酚和4-乙基愈创木酚[J].食品科学,2017,38(18):73-79.
SUN X T,WANG Z Y,LIU M,et al.Determination of tetramethylpyrazine-4-methyl guaiacol and 4-ethyl guaiacol in 67 Chinese Baijiu samples by vortex assisted liquid-liquid microextration combined with gas chromatography-mass spectrometry[J].Food Science,2017 38(18):73-79.
[19] QI W,ZHANG W,LU F.Effect of temperature,NaCl and ferulic acid concentration on bioconversion of ferulic acid to 4-vinylguaiacol and 4-ethylguaiacol by halotolerant yeasts Candida versatilis[C].International Conference on Applied Biotechnology 2016:289-297.DOI:10.1007/978-981-10-4801-2_29.
[20] XU L,ZHANG H,CUI Y,et al.Increasing the level of 4-vinylguaiacol in top-fermented wheat beer by secretory expression of ferulic acid decarboxylase from Bacillus pumilus in brewer’s yeast[J].Biotechnology Letters,2020,42(12):2 711-2 720.
[21] 胡博涵, 吴晖,赖富饶,等.产阿魏酸酯酶菌株的筛选及其酚酸释放研究[J].现代食品科技,2015,31(7):92-98.
HU B H,WU H,LAI F R,et al.Selection of feruloyl esterase-producing strains and estimation of phenolic acid production[J].Modern Food Science & Technology,2015,31(7):92-98.