蛹虫草Cordyceps militaris (L.) Link作为虫草属的模式种,也是子囊菌中重要的食药用真菌,含有多种药用功能成分物质。虫草素(cordycepin)即3′-脱氧腺苷(3′-deoxyadenosine)是其中重要的活性成分,具有抗菌、抗肿瘤、调节免疫、降血糖等多种药理作用及治疗代谢紊乱、氧化损伤等多种疾病的潜能[1]。
不同浓度的乙烯对真菌生长和发育的影响效果具有很大差异,高浓度乙烯会抑制灰霉菌(Botrytis cinerea)菌丝的生长及双孢蘑菇菌丝的生长和子实体的形成[2],而低浓度的乙烯则会促进灰霉菌菌丝的生长、芽管的伸长和附着胞的形成[3]。圆弧青霉(Penicillium cyclopium)在形成气生菌丝和分生孢子时伴随有乙烯迅速、大量的合成,若人为抑制乙烯的合成,则不能形成成熟的分生孢子,其萌发率降低90%[4]。
乙烯利不仅自身能够释放乙烯,并且在一定条件下能够诱导植物产生乙烯。目前已知的多种真菌均能够产生乙烯,但其合成途径与高等植物有所不同,不是由甲硫氨酸经1-氨基环丙烷1-羧酸途径产生,而是由甲硫氨酸经2-酮-4甲基硫代丁酸途径或由谷氨酸经酮戊二酸途径产生[5]。促进乙烯或者抑制乙烯的合成,可加速或者延缓植物果实后熟进程,在食用菌中,这一调控作用也同样存在[6]。研究发现在鸡腿菇的液体培养中添加乙烯利,能够有效地促进鸡腿菇菌丝的生长,显著提高菌丝体干重[7];在双孢菇的研究中,研究人员发现乙烯利能诱导增加乙烯释放量,加速双孢菇子实体离体后的衰老进程[8]。
1-甲基环丙烯(1-methylcyclopropene, 1-MCP)是一种小环烯烃气体,性质活泼,能阻止乙烯与其受体的结合从而导致乙烯信号转导受阻,是一种有效的乙烯拮抗化合物,可用于植物采摘后成熟期的延长[9-11]。1-MCP在香蕉的成熟反应中有防止软化的作用[12],SISLER等[13]通过研究环丙烯、1-MCP和3,3-二甲基环丙烯在许多植物中减弱乙烯的效应,提出这些新型抑制剂可用于植物寿命的延长,尤其是1-MCP在康乃馨、香蕉、豌豆苗等植物中的作用已得到验证。在食用真菌平菇中,1-MCP对采后子实体生理及贮藏品质方面都有着积极的影响[14]。而乙烯及其拮抗剂对蛹虫草中虫草素合成的影响尚未见报道。本研究通过蛹虫草栽培试验,探索不同浓度乙烯利和乙烯受体抑制剂1-MCP对蛹虫草子实体后期成熟产生虫草素含量的影响,为提高栽培蛹虫草中虫草素含量、改善虫草素品质提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株
蛹虫草CGMCC 3.16321菌株,中国科学院菌种保藏中心。
1.1.2 培养基
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):马铃薯(去皮)200 g,葡萄糖 20 g,琼脂 15~20 g,加水定容至1 L,测得pH值6左右,121 ℃高温灭菌30 min。
栽培培养基:30 g小麦添加40 mL 营养液,121 ℃高温灭菌1 h。
栽培营养液:蛋白胨10 g,葡萄糖20 g,KH2PO4 2 g,MgSO4·7H2O 0.5 g,柠檬酸铵 1 g,维生素B1 20 mg,加水定容至1 L,121 ℃高温灭菌30 min。
1.1.3 试剂与设备
乙烯利、1-MCP、蛋白胨、葡萄糖、KH2PO4、MgSO4·7H2O、柠檬酸铵、维生素B1等化学试剂,国药集团公司;ReverTra Ace qPCR RT Master Mix试剂盒,日本Toyobo公司。
7500Fast实时定量荧光PCR仪器,Applied Biosystems公司;LC-20AT高效液相色谱,日本岛津公司。
1.2 实验方法
1.2.1 培养条件
平板活化:将实验室保存的菌种斜面转到PDA平板上,22 ℃避光培养7~10 d。
摇瓶培养:用8 mm打孔器从活化好的平板菌落边缘打孔,将菌种块转移到液体培养基中。每瓶接种3块,22 ℃,150 r/min摇床培养3~4 d。
子实体栽培培养:每个栽培培养瓶接种5 mL液体种子,22 ℃黑暗培养7 d至菌丝布满培养基表面和底部,进行光照(12 h/d白光光照),22 ℃培养,原基形成阶段搔菌并给予5~10 ℃的温差刺激。培养40~50 d至子实体成熟。乙烯组在培养40 d时,每间隔12 h喷洒乙烯利溶液(质量浓度为100、250、500、750、1 000 mg/L,每个处理重复3次)15 mL于子实体[3],直至成熟;1-MCP组在培养40 d时,每间隔12 h喷洒1-MCP溶液(质量浓度为0.1、0.5、1.0、1.5、2.0 mg/L,每个处理重复3次)15 mL于子实体,直至成熟;对照组则是喷洒15 mL无菌蒸馏水于子实体。
1.2.2 实时定量PCR(real-time quantitative PCR,qRT-PCR)
收集各试验组子实体,用Trizol法提取RNA。将提取的总RNA利用ReverTra Ace qPCR RT Master Mix试剂盒合成cDNA。然后采用qRT-PCR法检测嘌呤核苷酸磷酸化酶、腺苷酸琥珀酸合成酶、腺苷酸激酶、腺苷酸琥珀酸裂解酶基因表达(引物序列见表1)。实时PCR反应体系:ddH2O 6.4 μL,QPCR SYBR Green Mix 10 μL,上游引物 0.8 μL,下游引物 0.8 μL,cDNA 模板 2 μL。扩增程序:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,34循环;熔解曲线分析。各试验样品都设置3个重复。以延伸因子(actin)作为内参基因,采用2-ΔΔCt法[15]进行相对表达量分析。
表1 实时荧光定量PCR引物序列
Table 1 Primer sequences for real-time quantitative PCR

基因引物序列(5′→3′)actinF:TATTCTTACCCTCCGCR:GGCGTGGGGAAGAGCAdslF:TCGTAGCCAACGCCR:AGTCGTCGCCTGCTAKF:GAAGCATCCGAGACR:CAGCATCAGCCTGCPNPF:CCTCCCTTCTAGAGCR:AGCGAGGAAGGCGAAdssF:GCCAAGTCGCAACTGAR:GACGATAACGCCAACC
1.2.3 虫草素含量测定
虫草素标准曲线制备:称取34.6 mg虫草素标准品溶于10 mL超纯水溶液中,终质量浓度为3.46 mg/mL,在10 mL的容量瓶中将虫草素的终质量浓度再稀释成不同浓度的5份,用高效液相色谱法测定260 nm处溶液的峰面积[16],以标准品质量浓度为横坐标,相应的峰面积为纵坐标,计算标准曲线,求线性回归方程。
虫草素含量测定:将各组子实体采集于45 ℃烘干,研磨成粉,水热回流,用超纯水定容至50 mL,然后过D-101大孔吸附树脂,旋转蒸发定容至10 mL,用高效液相色谱法测定260 nm处溶液的峰面积,代入标准曲线方程,得虫草素质量浓度。
2 结果与分析
2.1 虫草素合成相关基因表达量分析
2.1.1 外源乙烯处理结果
不同浓度的乙烯利处理子实体后,各组子实体中PNP、Adss、AK、Adsl基因相对表达量均上调(图1),其中乙烯利质量浓度为100 mg/L的处理组基因表达量上调最为明显,PNP、Adss、AK、Adsl四组基因相对表达量上调的倍数分别为3.219、3.775、3.584和2.646。由此可知,乙烯作为诱导物对蛹虫草次级代谢产物虫草素合成起到了正调控作用,并且通过浓度试验证明过量的乙烯对于这种促进作用效果不明显。

图1 不同剂量乙烯处理下虫草素合成相关基因的表达量
Fig.1 Relative expression levels of genes related to cordycepin biosynthesis under different doses of ethylene
注:**表示极显著差异(P<0.01)(下同)
2.1.2 乙烯阻断剂处理结果
不同浓度的1-MCP处理子实体后,以actin作为内参基因,PNP、Adss、AK、Adsl四组基因相对表达量均下调(图2),其中质量浓度为1.0 mg/L的1-MCP处理组相对表达量下调最为明显,PNP、Adss、AK、Adsl四组基因相对表达量分别下调至0.484、0.439、0.425、0.495。阻断乙烯与受体结合后明显表现出虫草素相关合成基因的表达下调,但是不能够完全抑制基因表达,可能是与所研究基因也参与蛹虫草核苷酸的代谢有关。

图2 不同剂量1-MCP处理下虫草素合成相关基因的表达量
Fig.2 Relative expression levels of genes related to cordycepin biosynthesis under different doses of 1-MCP
2.2 虫草素含量测定
2.2.1 虫草素标准曲线
以峰面积(mAU·s)为y轴,标准品质量浓度(μg/mL)为x轴,绘制标准曲线,结果如图3所示,其线性回归方程为:y=34 090.544 380x-1 839.950 667, R2=0.999 989。

图3 标准曲线
Fig.3 Standard curve
2.2.2 虫草素含量
利用高效液相对样品进行分析计算虫草素含量,如图4所示,对照组中蛹虫草虫草素质量浓度为(10.04±0.17) μg/mL,100 mg/L乙烯利处理组蛹虫草中虫草素的质量浓度为(25.37±0.22)μg/mL,1.0 mg/L 1-MCP处理组蛹虫草中虫草素的质量浓度为(0.52±0.12)μg/mL。由此可知,适当添加外源乙烯可以显著提高子实体中的虫草素产生量;而添加乙烯合成阻断剂后,子实体中虫草素产量明显降低,其结果与qPCR结果基本一致。
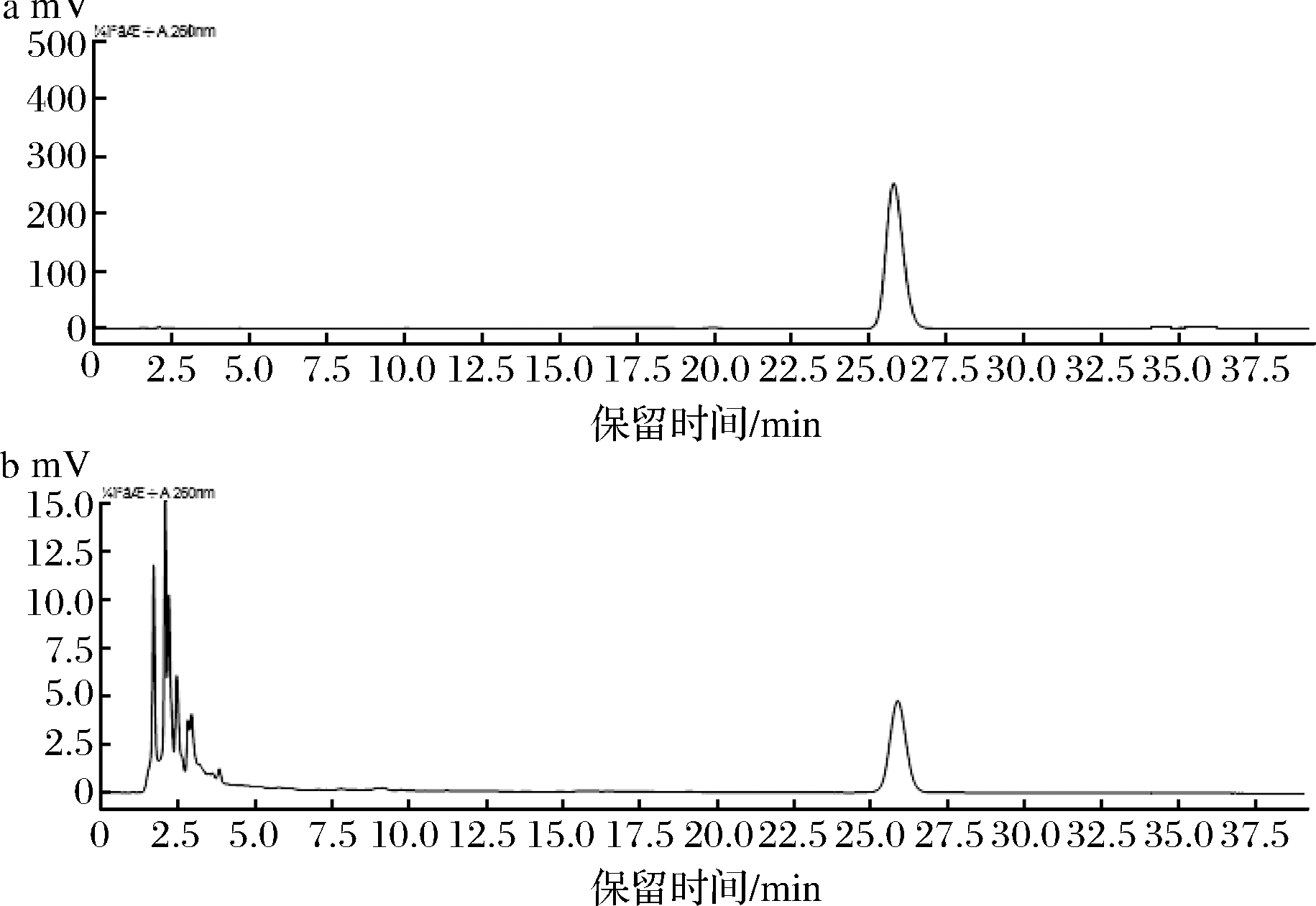
a-虫草素对照品;b-样品
图4 高效液相图谱
Fig.4 HPLC chromatography
3 讨论与结论
研究表明,不同浓度的乙烯对蛹虫草子实体中虫草素的产生影响不同,适当提高乙烯浓度能够促进核苷代谢相关基因(PNP、Adss、AK、Adsl)表达量上调,高效液相色谱结果也显示,子实体成熟后期虫草素的含量也随之显著提高;抑制蛹虫草自身乙烯的合成,则虫草素合成相关基因的表达量显著降低,高效液相色谱结果也表明,子实体后期虫草素的含量也随之显著降低。在一定范围内,子实体虫草素含量与外源乙烯添加量呈显著正相关。
乙烯作为植物激素,可以促进植物的生长,是早已被人们发现的与果实成熟有关的一种气态激素。近来又发现乙烯不仅能促进成熟,它对植物生长发育也有多方面的效应[17]。许多真菌合成乙烯,ILAG等[18]调查了228种真菌,其中58种(25.6%)可以合成乙烯。EL-SHAROUNY[19]从植物病根中分离的81种真菌中有31%的种产生乙烯。植物合成乙烯的途径是ACC途径,在真菌中则有KMBA途径和ACC途径,蛹虫草中存在着ACC途径[20]。
本研究发现,补充外源乙烯对蛹虫草子实体中虫草素合成相关基因的表达量有明显的上调作用,表明乙烯作用于虫草素合成途径可能是:AMP→ADP→dADP→dAMP→虫草素。通过基因表达量和子实体虫草素含量分析可以得出腺苷酸琥珀酸裂解酶是该合成途径的限速酶,此酶基因表达在100 mg/L乙烯利作用下上调(2.09±0.72),与子实体虫草素的质量浓度由(10.04±0.17)增加到(25.37±0.22)μg/mL,增加约1.5倍,其他基因表达上调均高于实际子实体虫草素表达水平,此相关合成途径的基因功能需进一步研究。
用乙烯受体抑制剂1-MCP处理,其结果与乙烯利则相反,与在双孢菇相关研究中结果一致[21]。本研究中乙烯阻断剂1-MCP通过与乙烯受体竞争性结合从而导致乙烯信号转导受阻,进而影响虫草素合成途径相关基因PNP、Adss、AK和Adsl的表达,但是这些基因也参与蛹虫草的核苷酸代谢,存在其他调控途径,所以1-MCP阻断乙烯作用后这些基因表达量下调作用不明显,但是对子实体虫草素合成影响较大。
乙烯对蛹虫草子实体后期成熟中虫草素的含量影响较大,通过调节虫草素合成过程中相关基因的表达从而影响蛹虫草栽培后期虫草素的含量。本研究表明,适当提高栽培环境中乙烯含量(外源添加乙烯利质量浓度100 mg/L),与对照相比大大提高了虫草素产生量,建议在蛹虫草栽培后期合理添加乙烯利,以达到增加子实体虫草素含量的目的,提高蛹虫草品质。
[1] SUGAR A M,MCCAFFREY R P.Antifungal activity of 3′-deoxyadenosine (cordycepin)[J].Antimicrobial Agents and Chemotherapy,1998,42(6):1 424-1 427.
[2] ZHANG C H,HUANG T,SHEN C H,et al.Downregulation of ethylene production increases mycelial growth and primordia formation in the button culinary-medicinal mushroom,Agaricus bisporus (Agaricomycetes)[J].International Journal of Medicinal Mushrooms,2016,18(12):1 131-1 140.
[3] DONG T Y,ZHENG T,FU W H,et al.The effect of ethylene on the color change and resistance to Botrytis cinerea infection in ‘Kyoho’ grape fruits[J].Foods,2020,9(7):892.
[4] PAŽOUT J,PAŽOUTOV S,VAN
S,VAN URA V.Effects of light,phosphate,and oxygen on ethylene formation and conidiation in surface cultures of Penicillium cyclopium westling[J].Current Microbiology,1982,7(3):133-136.
URA V.Effects of light,phosphate,and oxygen on ethylene formation and conidiation in surface cultures of Penicillium cyclopium westling[J].Current Microbiology,1982,7(3):133-136.
[5] YANG Y,MA R J,ZHANG B B,et al.Different expression analysis in fruit softening and ethylene biosynthetic pathways in peaches of different flesh textures[J].Horticultural Plant Journal,2016,2(2):75-81.
[6] ARSHAD M,FRANKENBERGER W T.Ethylene[M].New York:Kluwer Academic/Plenum Publishers,2002.
[7] 王秀艳, 白秀云.乙烯利、烟酸对鸡腿菇液体培养中菌丝体和多糖产量的影响[J].湖北农业科学,2014,53(6):1 349-1 351.
WANG X Y,BAI X Y.Effects of ethephon and nicotinic acid on mycelium and polysaccharide yield in Coprinus comatus of liquid culture[J].Hubei Agricultural Sciences,2014,53(6):1 349-1 351.
[8] 孟德梅. 双孢菇子实体生长发育与采后衰老过程中乙烯的调控及其生物合成途径的探究[D].北京:中国农业大学,2014.
MENG D M.Ethylene regulation on the growth,development,and postharvest senescence of Agaricus bisporus fruiting bodies and investigation on its biosynthesis pathway[D].Beijing:China Agricultural University,2014.
[9] BLANKENSHIP S M,DOLE J M.1-Methylcyclopropene:A review[J].Postharvest Biology and Technology,2003,28(1):1-25.
[10] 张建业, 姚向峰,杜庆志,等.1-MCP发气剂对苹果保鲜效果的研究[J].落叶果树,2021,53(2):26-30.
ZHANG J Y,YAO X F,DU Q Z,et al.Effects of 1-methylcyclopropylene gasifier on apple preservation[J].Deciduous Fruits,2021,53(2):26-30.
[11] WANG Q,WEI Y Y,CHEN X Y,et al.Postharvest strategy combining maturity and storage temperature for 1-MCP-treated peach fruit[J].Journal of Food Processing and Preservation,2020,44(4):e14 388.
[12] JIANG Y M,JOYCE D C,MACNISH A J.Responses of banana fruit to treatment with 1-methylcyclopropene[J].Plant Growth Regulation,1999,28(2):77-82.
[13] SISLER E C,SEREK M.Inhibitors of ethylene responses in plants at the receptor level:Recent developments[J].Physiologia Plantarum,1997,100(3):577-582.
[14] 吴海霞, 陈雷.1-MCP对平菇采后生理及贮藏品质的影响[J].江苏农业学报,2013,29(5):1 159-1 165.
WU H X,CHEN L.Effect of 1-MCP on post-harvest physiological and storage quality of Pleurotus ostreatus[J].Jiangsu Journal of Agricultural Sciences,2013,29(5):1 159-1 165.
[15] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.
[16] 国家药典委员会. 中华人民共和国药典:四部[M].北京:中国医药科技出版社,2015.
National Pharmacopoeia Commission.Pharmacopoeia of the People's Republic of China:Volume Ⅳ[M].Beijing:China Medical Science Press,2015.
[17] SANTNER A,ESTELLE M.Recent advances and emerging trends in plant hormone signalling[J].Nature,2009,459(7 250):1 071-1 078.
[18] ILAG L,CURTIS R W.Production of ethylene by fungi[J].Science,1968,159(3 821):1 357-1 358.
[19] EL-SHAROUNY H M.Screening of ethylene-producing root-infecting fungi in Egyptian soil[J].Mycopathologia,1984,85(1-2):13-15.
[20] ZHENG P,XIA Y L,XIAO G H,et al.Genome sequence of the insect pathogenic fungus Cordyceps militaris,a valued traditional Chinese medicine[J].Genome Biology,2011,12(11):1-22.
[21] CHEN S C,QIU C W,HUANG T,et al.Effect of 1-aminocyclopropane-1-carboxylic acid deaminase producing bacteria on the hyphal growth and primordium initiation of Agaricus bisporus[J].Fungal Ecology,2013,6(1):110-118.