红鳍东方鲀(Takifuguru bripes),属于大形鲀类,主要分布于中国近海(东、黄、渤海)以及长江中下游地区,为海淡水鱼类[1],是偏肉食性的杂食性鱼类。因其受应激反应臀鳍变红而得名。其肉质鲜嫩腴美,蛋白质、脂肪含量丰富,尤其是胶原蛋白含量丰富,其营养成分高,深受广大消费者的喜爱,适用于各种人群食用[2],随着《关于有条件放开养殖河鲀生产经营的通知》的正式发布,河豚鱼已经可以被安全食用[3]。目前有关河豚鱼肉的加工产品主要集中在冷冻食品包括河豚鱼丸、河豚鱼水饺等,而对于红鳍东方鲀的研究则主要集中在养殖以及鱼皮胶原蛋白的提取上,对于红鳍东方鲀鱼肉的加工方面少有报道[4]。胶原蛋白是存在于肌肉结缔组织中一种丰富的蛋白,是肉嫩度和质地变化的一个促成因素,一般来说,胶原蛋白含量与结缔组织强度密切相关[5-6],肌肉结缔组织中的胶原蛋白含量越高,肉的嫩度越低[7-8]。由于红鳍东方鲀的肌肉组织呈现很紧密的肌膜结缔组织分布,且鱼肉的胶原蛋白含量比普通鱼肉高得多,导致其有独特的质地和口感[9],因此有必要对其进行嫩化处理。
目前嫩化的方式较多,如酶处理、复合磷酸盐处理、超声波处理以及热处理等。热处理不仅可以降低肉类食品中微生物数量,抑制微生物生长,同时还可以赋予食品特定的风味、口感、色泽以及质构[10],改善肉的嫩度。这些变化主要是在加热过程中鱼肉蛋白质发生变性和聚焦所导致的[11]。鱼肉在热处理过程中会发生一系列生化反应,如热降解、脂质氧化、蛋白氧化等,从而引起蛋白质理化特性以及质构的变化[12]。齐海萍等[13]发现,鲤鱼经30 ℃热处理后,质构特性较好,蛋白质降解适中,能够较好地保持鱼肉原本的营养以及固有的风味。桂萍等[14]研究发现,加热对鲢鱼和鸡胸混合肉的肌原纤维蛋白的影响很显著。邓丽等[15]通过热处理发现,适宜的热处理可以赋予鲍鱼良好的质地和口感。JOUNG等[16]研究发现不同的真空低温条件对肉类产品理化性质的影响很显著,且65 ℃加热45 min时肉类产品的品质最佳。加热处理对鱼肉中的肌原纤维蛋白以及结缔组织蛋白有显著的影响,从而改变肉的嫩度,增加鱼肉的口感[17]。
本研究以冷冻河豚鱼为原料,为了提高河豚鱼肉在生产加工过程中的嫩度,用不同加热温度对其进行预处理,以河豚鱼肉的剪切力为主要指标,结合鱼肉的差示扫描量热(differential scanning calorimetry,DSC)、持水性、蒸煮损失率、质构特性、流变、扫描电镜(scanning electron microscope, SEM)等,研究不同加热温度对冷冻河豚鱼肉加工特性的影响,旨在选出具有最佳嫩化效果的处理温度,从而提高河豚鱼肉调理食品的口感和嫩度,为冷冻河豚鱼肉的加工和产品的开发利用提供理论参考。
1 材料方法
1.1 材料与仪器
材料:河豚鱼,主要分布于北太平洋西部,在中国各大海域都有捕获,每年3~5月份为河豚鱼产卵季节,也是河豚鱼最肥美的时候,本研究所用河豚鱼为红鳍东方鲀(捕捞于黄海),属于养殖红鳍东方鲀,长约35 cm,重约500 g,为脱毒宰杀,去除不可食用部位,购于大连富谷食品有限公司(-90 ℃超低温液氮速冻保藏),全程冷链由货车运回实验室,在-18 ℃下冻藏1周后用于实验。
试剂:戊二醛(电镜专用),北京宝希迪有限公司;无水乙醇,大连博诺有限公司。
仪器设备:差示扫描量热仪(μ-DSC),法国塞塔拉姆仪器公司;HITACHI CF 16RXⅡ离心机,Hitachi koki有限公司;HH-4型数显恒温水浴锅,常州智博瑞仪器制造有限公司;Stable Micro Systems TA.XT.plus型质构仪,英国SMS;Discovery HR-1旋转流变仪,美国TA仪器;S8020扫描电镜,日本Hitachi High-technologies公司;200型电子天平,美国双杰兄弟有限公司;DD-8 m2冷风机,大华制冷设备有限公司;BD-228 WL冰箱,青岛海尔特种冰柜有限公司。
1.2 实验方法
1.2.1 样品处理
将河豚鱼自然解冻后,沿侧线取鱼背肉,顺着肌纤维将鱼背肉切成长、宽、厚约为2 cm×2 cm×2 cm大小的鱼块,分别经50、60、75 ℃加热30 min后装入蒸煮袋,并同时将未加热的鱼肉一同装入蒸煮袋,真空封口,-40 ℃速冻40 min后置于-18 ℃冰箱中保存,用于测定持水率、蒸煮损失率、全质构、流变以及剪切力等指标。
1.2.2 DSC的测定
取10 mg鱼肉于样品盒中密封,然后将样品盒放入差示扫描量热仪样品池中,同时打开差示扫描量热仪,在20 ℃下平衡2 min,从20 ℃以5 ℃/min的速度升高到100 ℃,观察DSC扫描图谱[18]。
1.2.3 持水力的测定
参考朱瑞麒[19]方法,称取相同质量的河豚鱼肉并用脱脂棉干燥到恒重然后放入离心管中,在4 000 r/min,10 ℃条件下离心15 min,称其质量m1。每组样品测定4次,取平均值,计算如公式(1)所示:
(1)
式中:WHC,持水率,%;m0,河豚鱼肉的原始质量,g;m1,河豚鱼肉离心后的质量,g。
1.2.4 蒸煮损失率的测定
将河豚鱼样品放入蒸煮袋中,在85 ℃水浴锅中蒸煮15 min。然后用流水冷却到室温,再用滤纸将河豚鱼肉表面的水分吸干,称其质量为m2。每组样品测定4次,取平均值[20]。计算如公式(2)所示:
(2)
式中:CL,蒸煮损失率,%;m0,河豚鱼肉的原始质量,g;m2,河豚鱼肉蒸煮后的质量,g。
1.2.5 全质构分析
取河豚鱼鱼块,采用TA.XTPlus物性分析仪,利用平底柱头P50(直径50 mm)对河豚鱼肉进行2次TPA模式压缩测试,测试条件为:测试前速度为2 mm/s,测试速度为1 mm/s,测试后速度为5 mm/s,压缩程度是30%,停留间隔时间为5 s,负重探头类型为Auto-5 g,数据收集率是200 pps。每个样品测定6次,取平均值[21]。
1.2.6 嫩度的测定
采用TA-XT plus质构仪来测定河豚鱼肉剪切力。探头型号是BSK,测试模式是hot dog,测试前速率为2.0 mm/s,测试后速率为10.0 mm/s,下行距离为20 mm,样品厚度为10 mm。每个样品测定6次,取平均值[22]。
1.2.7 流变分析
利用旋转流变仪Discovery HR-1来进行分析,将河豚鱼样品均匀地分布在流变仪的下平板上,上平板降至2 mm,同时用刮板除去多余样品。采用频率扫描模式进行分析,频率从0 Hz升至65 Hz,以0.6 Pa为控制最大感应力,观察样品的弹性模量(G′)和黏性模量(G″)[23],分析样品的黏弹性。
1.2.8 SEM分析
通过冷场发射扫描电子显微镜来测定河豚鱼肉的微观结构,将河豚鱼肉纵切成3 mm左右的小块,密封放入小试管中,加入体积分数2.5 %戊二醛溶液(电镜专用),使之浸过样品,之后置于4 ℃冰箱中浸泡48 h,然后利用清水冲洗3次,再分别用不同体积分数的乙醇进行梯度脱水(10%、30%、50%、70%、80%、90%、95%),每个体积分数的乙醇脱水15 min,最后使用无水乙醇浸泡30 min。用CO2临界点干燥仪进行置换,使用扫描电镜观察[24]。
1.2.9 数据处理及统计分析
采用Microsoft Excel 2010进行实验数据统计分析。数据结果为均值±标准差(Mean±SD),采用SPSS 22.0软件(IBM公司)进行显著性分析(P<0.05表示具有显著性差异)。采用Origin Pro 8.5软件(Origin Lab公司)进行作图。
2 结果和分析
2.1 不同热处理温度的河豚鱼肉DSC
图1为河豚鱼DSC扫描图谱,随加热温度的升高,DSC扫描图谱中热吸收峰逐渐减少,表明河豚鱼肉中未变性蛋白逐渐减少。未经热处理的河豚鱼肉的DSC曲线出现2个吸收峰,分别在52.35和73.97 ℃左右。当鱼肉中心温度达到50和60 ℃时,DSC曲线上只剩下1个吸收峰,表明变性温度在50 ℃左右时蛋白已变性,继续加热到75 ℃时,DSC曲线完全没有吸收峰,表明此温度下的蛋白已经完全变性。综上分析可知,当加热温度达到75 ℃以上,基本可以使河豚鱼鱼肉中所有蛋白质受热变性[18]。48 ℃左右一般为肌球蛋白变性温度,60 ℃左右一般为肌浆蛋白变性温度,而65 ℃是胶原蛋白的中间变性温度,也就是说在65 ℃之前胶原蛋白开始变性,到65 ℃时并没有完全变性[25],PALKA 等[26]通过扫描电子显微镜观察牛肉半膜肌发现,结缔组织在50 ℃时并没有变化,在60 ℃时可观察到肌束膜和肌内膜颗粒化,70 ℃时颗粒化现象增加,说明温度从60 ℃升到70 ℃时,越来越多的胶原蛋白发生变性。付湘晋[27]经DSC分析得知,白鲢鱼肌肉中的蛋白变性温度分别为40.7、58.8和81.1 ℃,其分别对应了肌球蛋白、肌浆蛋白和肌动蛋白的变性,红鳍东方鲀含有蛋白质种类较多,但主要为肌球蛋白和肌动蛋白[28],因此未经热处理的鱼肉DSC曲线上出现的2个热吸收峰温度很可能是红鳍东方鲀中肌球蛋白和肌动蛋白的变性温度。
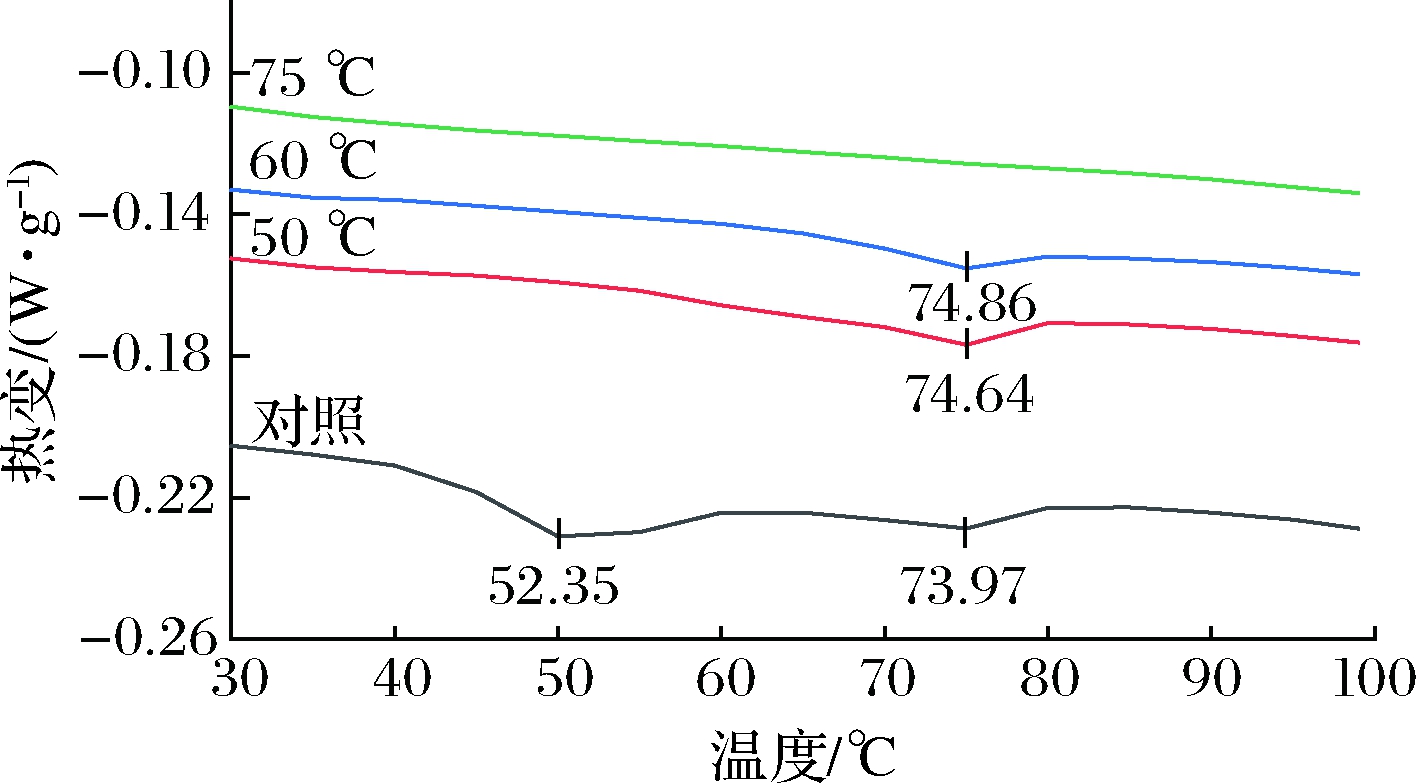
图1 不同热处理温度的河豚鱼DSC
Fig.1 DSC of puffer fish at different heat treatment temperatures
2.2 不同热处理温度的河豚鱼肉的蒸煮损失率和持水性
蒸煮损失是衡量肉品质的一个重要指标。图2为不同温度下河豚鱼蒸煮损失的结果。经不同温度处理后河豚鱼肉蒸煮损失率逐渐增大(P<0.05)。未经热处理的河豚鱼肉蒸煮损失率为32.5%,经50、60、75 ℃处理的鱼肉与未经热处理的鱼肉相比,蒸煮损失率分别增加了5.83%、9.33%、12.42%。这可能是由于随着温度的升高,鱼肉肌原纤维蛋白不断发生着变性以及脂肪氧化反应,胶原蛋白析出,从而导致鱼肉组织分散,空间结构不断被破坏,汁液流失逐渐增大,鱼肉的保水能力不断降低[29],表现为蒸煮损失率随温度升高而不断上升。鱼肉中心温度越高,空间结构被破坏的越厉害,肌纤维收缩程度越大,蒸煮损失越大[30]。此外,加热过程中蛋白疏水基团的暴露使其对水分的亲和力下降,也会使蒸煮损失增加[31]。加热温度较低时,鱼肉中的水分流失较少,蒸煮损失变化相对较小,而加热温度达到75 ℃时鱼肉中结合力较弱的水分基本完全排出[29],肌原纤维蛋白基本完全变性,蒸煮损失达到最高。
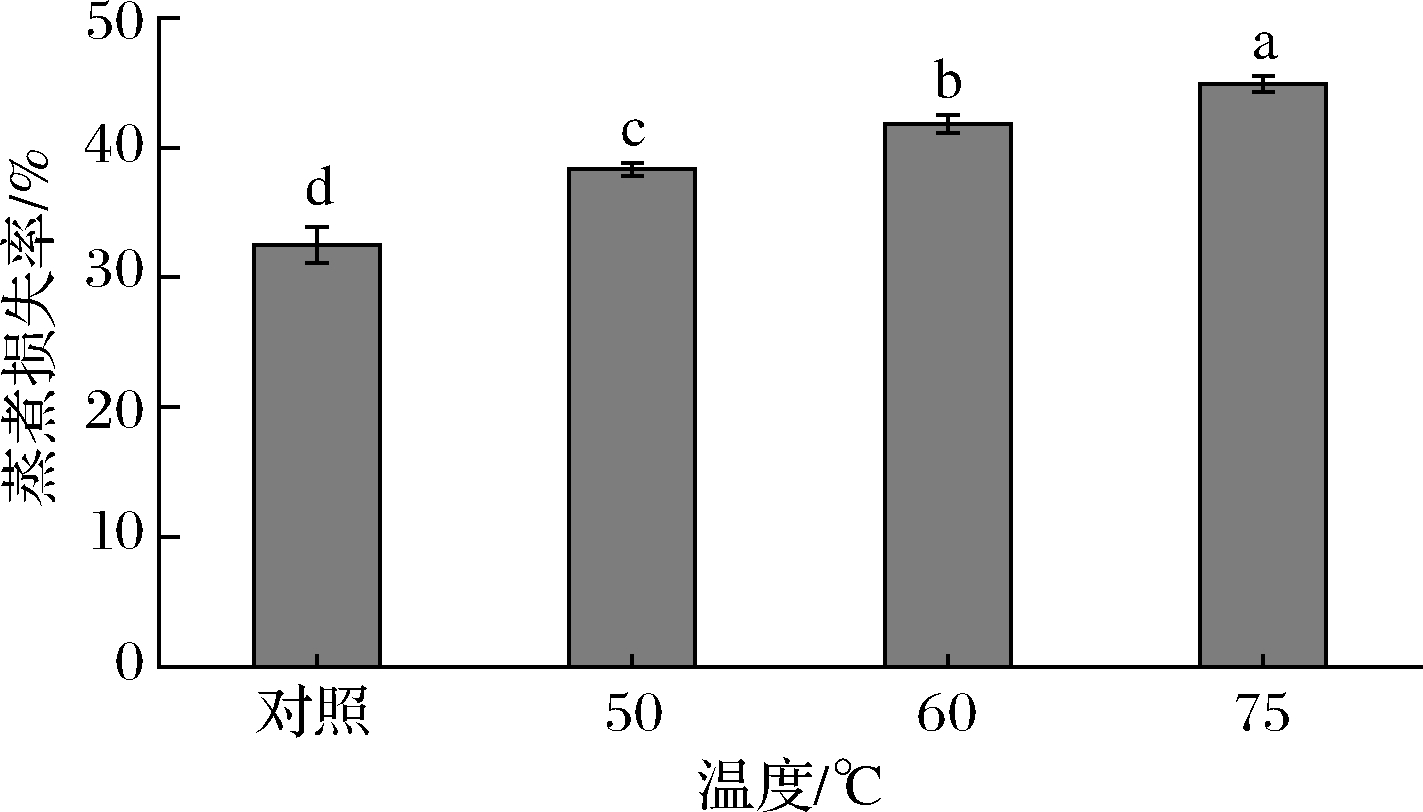
图2 不同热处理温度的河豚鱼肉的蒸煮损失率
Fig.2 Cooking loss rates of puffer fish meat at different heat treatment temperatures
由图3可知,对照组的河豚鱼肉持水率最高,达到了92.38%,经50 ℃处理后,持水率下降为86.03%,而经60 ℃处理后持水率又稍有上升,为89.49%,经75 ℃处理持水率基本与50 ℃持平,但总体来说,加热处理均比对照组的持水率低,这可能是由于50 ℃左右为蛋白质变性温度,因此蛋白质结构受热被破坏,导致肌球蛋白变性,肌原纤维收缩,维持蛋白质二级结构的化学键受到影响,组织毛细管力以及表面张力发生改变,使得毛细管中以及肌肉组织中的吸附水与一些结合水被释放出来,致使肌原纤维结构变得更加松散,导致持水率下降。因为75与50 ℃一样,同为变性温度,此时的蛋白质已经完全变性。而60 ℃处理组的持水率比50 和75 ℃要高,推测可能是加热到60 ℃时,由于热诱导凝胶形成过程中肌原纤维蛋白中的肌球蛋白发生聚集、变性,互相交联,从而形成致密而有序的三维网络结构,此结构依靠毛细管力将水保留在凝胶网孔中,使保水能力上升[32]。

图3 不同热处理温度的河豚鱼肉的持水率
Fig.3 Water holding capacity of puffer fish meat at different heat treatment temperatures
2.3 不同热处理温度的河豚鱼肉的流变特性
流变学以弹性力学和流体力学为基础,主要运用线性黏弹性理论,研究食品在很小的变形范围内的黏弹性以及变化规律,是肌原纤维蛋白凝胶特性的重要指标[33]。弹性模量G′代表了样品的弹性特征,而黏性模量G″则代表了样品的黏性特征。由于加热之后河豚鱼的胶原蛋白会流失,导致其黏弹性发生变化,影响鱼肉的品质,进而可能会影响鱼肉的嫩度,通过流变仪来分析不同温度下河豚鱼的黏弹性变化趋势,在保证鱼肉有较好的黏弹性下挑选出合适的加热温度,有利于后续改善河豚鱼的生产加工。由图4可知,未经热处理鱼肉和所有热处理鱼肉的G′大于G″,河豚鱼肉以弹性为主导,弹性特性强于黏性特性,流动性较弱。G′、G″越大,说明鱼肉凝胶性越好。随着扫描频率的不断增大,所有热处理鱼肉的G′和G″都高于未热处理的鱼肉,而随着加热温度的升高,鱼肉的G′和G″都呈现出逐渐下降的趋势。经50 ℃处理的鱼肉G′最大,其凝胶性最好,可能在此温度下蛋白质受热分解较少,肌原纤维较紧密,凝胶性很好,加热到60 和75 ℃后,其蛋白质受热分解更加剧烈,尤其是胶原蛋白,导致结构变得很松散,G′逐渐降低,凝胶性变差。60 ℃处理的鱼肉G′比未经热处理的鱼肉高,比50 ℃处理的鱼肉低,但也保持着比较好的凝胶性,这可能与上述所说的60 ℃下由于热诱导形成了致密的三维网状结构有关。G″随温度升高也呈现出逐渐下降的趋势,但是经热处理的鱼肉都比未经热处理的鱼肉要高,说明随温度的升高,样品的黏性也越来越大,这可能是由于温度升高,鱼肉蛋白析出导致黏性变大[34]。

图4 不同热处理温度的河豚鱼肉的黏弹性
Fig.4 Viscoelasticity of puffer fish meat at different heat treatment temperatures
2.4 不同热处理温度的河豚鱼肉的质构特性
硬度表现为样品受到外力而达到一定形变后人体对其的触觉柔软或者坚硬。由图5-a可知,随加热温度升高,河豚鱼肉的硬度发生显著变化(P<0.05)。随温度升高,鱼肉的硬度逐渐增大,经50、60、75 ℃处理后的鱼肉硬度与对照组相比分别增加了338.71、716.96、829.09 g,这可能是由于加热到50 ℃时肌原纤维开始逐渐变性,变得凝固收缩,进而使单位面积内的肌原纤维数量增加,对剪切力的抵抗变强,温度越高,肌纤维蛋白的增韧作用越强,因此硬度增加[35]。DAVEY等[36]发现,结缔组织的变性可导致肉在65~80 ℃变硬。KOPP等[37]发现,肌内的结缔组织在温度65 ℃以上快速加热时会发生剧烈收缩,从而使肉质变硬。因此推测60 ℃以上肉质变硬是由于胶原蛋白收缩使肌纤维空隙减小造成的。
咀嚼性是比较全面的综合质地分析参数,它是鱼肉硬度、弹性以及凝聚力综合作用的结果。由图5-b可见,咀嚼性总体上呈现出先上升后下降的趋势(P<0.05)。热处理组鱼肉的咀嚼度比对照组要高,热处理温度为60 ℃时,鱼肉具有最好的咀嚼度,这可能是因为本来折叠着的肌原纤维蛋白分子的侧链受热断裂而展开,随后在蛋白分子之间产生更坚固的侧链结合,并且进一步凝集,从而增大了鱼肉的咀嚼性[38]。而50 与75 ℃处于蛋白变性温度范围,蛋白结构被破坏,导致鱼肉组织结构较松散,其咀嚼性要低于60 ℃处理的鱼肉。
由图5-c和图5-d可知,随热处理温度的升高,鱼肉的黏聚性和回复性都比对照组高(P<0.05)。当热处理温度是50和60 ℃时,鱼肉的黏聚性和回复性都有不同程度地升高,这可能是由于肌动球蛋白变性所导致的,当热处理温度为75 ℃时,黏聚性和回复性均下降,可能是由于肌纤维收缩进一步加剧,鱼肉汁液流失增加,水分含量下降所致。
胶着度是指探头下压一次后从样品拔出来所需要的能量,它反映了鱼肉细胞分子间的结合力大小,结合力越大,胶着度越小。从图5-e可以看出,随热处理温度的升高,鱼肉的胶着度呈上升趋势,这可能是因为随着热处理温度的升高,蛋白质不断发生变性,鱼肉组织结构被破坏,结合力下降,导致胶着度不断上升。当温度达到75 ℃时,胶着度变化并不明显,可能是由于此热处理温度下的鱼肉蛋白质已经完全变性所致。胶着度如果过大,会影响鱼肉的口感,因此要保证加热温度使鱼肉胶着度稍有上升的情况下还不会使鱼肉品质下降。综合以上全质构数据分析,加热对河豚鱼的硬度、咀嚼性、黏聚性、回复性以及胶着度都有不同程度地改善,再结合持水以及蒸煮损失的结果,50 ℃为比较适宜的加热温度。
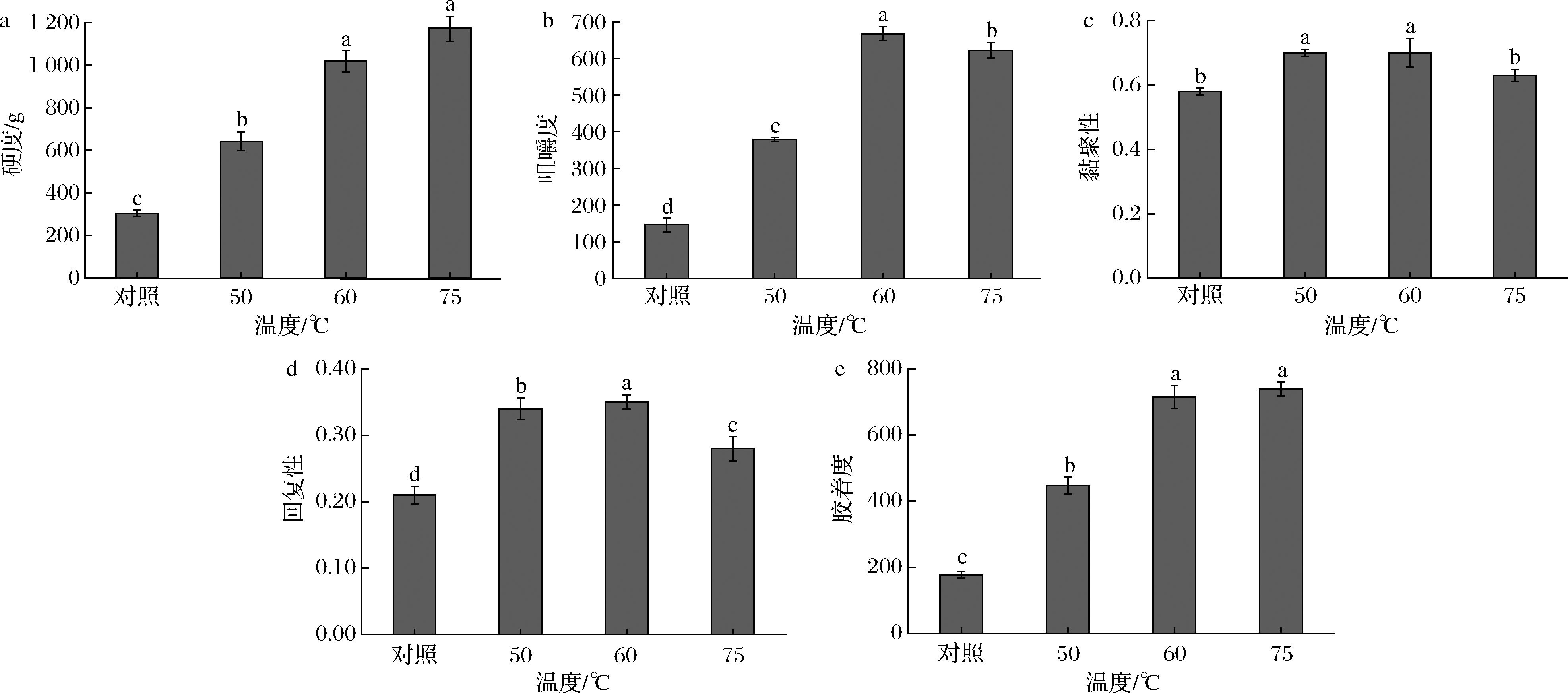
a-硬度;b-咀嚼度;c-黏聚性;d-回复性;e-胶着度
图5 不同热处理温度的河豚鱼肉的质构特性
Fig.5 TPA of puffer fish meat at different heat treatment temperatures
2.5 不同热处理温度的河豚鱼肉的嫩度
剪切力对衡量鱼肉嫩度有很重要的作用,剪切力越小,肉越嫩。图6为河豚鱼肉在不同热处理温度下的剪切力结果,经热处理后的鱼肉剪切力明显比未处理的鱼肉低(P<0.05),尤其是75 ℃处理的鱼肉其剪切力最低。肌内结缔组织是肌肉组织重要组成部分,在很大程度上影响了肉的嫩度,而其中肌束膜和肌内膜中胶原蛋白的变化起关键作用[39]。50 ℃时,由于胶原蛋白的收缩和变性导致剪切力下降,60 ℃时剪切力上升,加热到75 ℃时,由于胶原蛋白的分解导致肌内膜和肌束膜发生改变,从而使分子链上较弱的键断裂,蛋白质完全变性,导致结构松散,表现为剪切力下降。同为变性温度的50 ℃处理组比75 ℃处理组剪切力要高,可能是因为在此变性温度下蛋白质并没有处于完全变性的状态,从而导致鱼肉的肌原纤维未被完全破坏[40]。
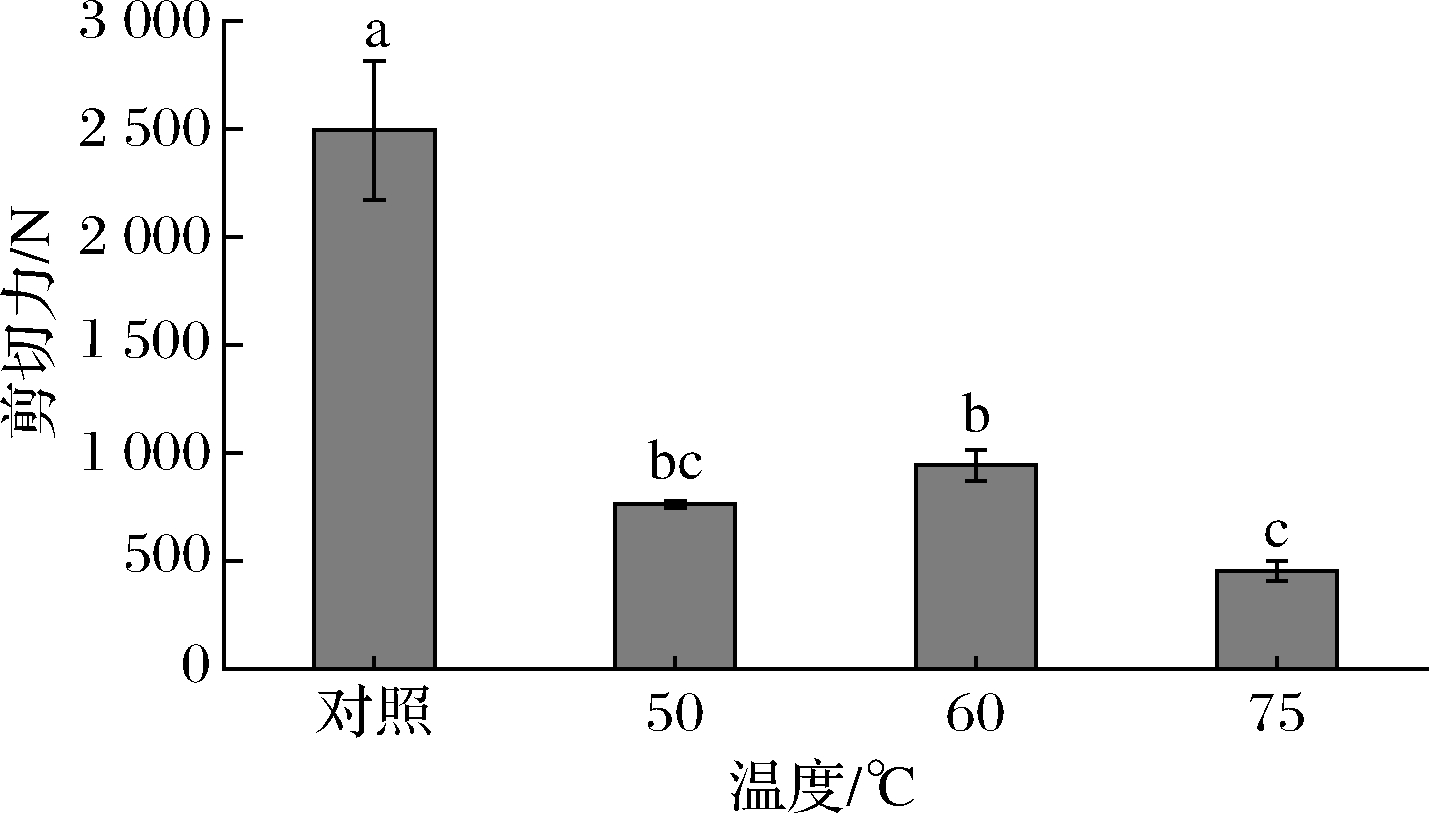
图6 不同热处理温度的河豚鱼肉的剪切力
Fig.6 Shearing forces of puffer fish at different heat treatment temperatures
臧大存等[41]研究发现鸭肉在加热过程中剪切力值不断升高,到60 ℃达到峰值,随着温度的继续升高剪切力值开始不断下降,这也与本文60 ℃时剪切力上升,到75 ℃时下降保持一致。总体来说,经热处理后的鱼肉嫩度与对照组相比都有不同程度地增加,达到了较理想的嫩化效果。
2.6 不同热处理温度的河豚鱼肉的组织结构
由图7可以看出,随加热温度上升,肌原纤维变得收缩,表现为组织结构由松散逐渐变得致密,单位体积内的次级肌束数量变多,肌纤维间的空隙越来越小。这主要是由于蛋白质受热变性导致肌束膜收缩,水分含量减少,肌束间的空间减小[42]。对照组的河豚鱼肉肌肉纤维排列很紧密,肌原纤维基本没有发生明显变化,当加热到50 ℃时,鱼肉的肌原纤维开始发生断裂,蛋白开始交联,肌内膜和肌束膜受到破坏,逐渐溶解,这可能是由于鱼肉受热后,鱼肉的肌球蛋白发生变性,导致其结构变的松散,温度升高到60 ℃时,由于胶原蛋白受热逐渐溶解,使鱼肉结构进一步被破坏,肌原纤维收缩更加剧烈,当温度达到75 ℃时,肌纤维直径变小,肌肉纤维受热收缩比60 ℃更加明显,这是因为温度达到75 ℃时,鱼肉中的肌球蛋白、肌动蛋白和胶原蛋白全部发生变性,导致肌原纤维蛋白受热已经完全变性[43]。

a-对照;b-50 ℃处理;c-60 ℃处理;d-75 ℃处理
图7 不同热处理温度的河豚鱼肉的微观组织结构
Fig.7 Microstructure of puffer fish meat at different heat treatment temperatures
3 结论
不同加热温度可以显著提高河豚鱼的嫩度,表现为所有加热处理的河豚鱼剪切力都有明显的降低。DSC扫描图谱显示未经热处理河豚鱼肉在52和73 ℃左右出现2个热吸收峰,即出现2个变性温度,表明此时蛋白受热变性,由全质构分析可知,热处理鱼肉的硬度整体都高于对照组,硬度随温度升高逐渐增大,整体来说鱼肉的咀嚼性、黏聚性、回复性和胶着度都比对照组要高,通过SEM观察发现,温度升高会使鱼肉组织变得松散,肌纤维结构断裂,温度过高会使肌纤维交联。综合以上分析可知,50 ℃处理下的河豚鱼嫩度有明显提高且能保持较好的口感。对于河豚鱼的嫩化处理还有待于进一步研究,以便提高河豚鱼的品质,改善口感,开发更多的河豚鱼产品。
[1] ZHOU R,ZHENG Y R,LIU Y,et al.Texture and quality assessment of ready-to-eat farmed obscure puffer fish (Takifugu obscurus) fillet by evaluating bacterial and myofibrillar degradation and biochemical changes during refrigerated storage[J].Journal of Aquatic Food Product Technology,2020,29(7):604-615.
[2] LIAO Y,WANG W L,CHEN G L,et al.Basic taste characteristics of flavor material from cultured Takifugu obscurus by-products[J].Flavour and Fragrance Journal,2020,35(3):320-328.
[3] 冯豪杰,蓝蔚青,刘大勇,等.不同减菌化处理方式对暗纹东方鲀冷藏期间品质变化的影响[J].食品科学,2020,41(7):210-217.
FENG H J,LAN W Q,LIU D Y,et al.Effects of different sterilization treatments on the quality of puffer fish(Takifugu obscurus) during refrigerated storage[J].Food Science,2020,41(7):210-217.
[4] 黄玉林,王文利,刘源,等.我国养殖河鲀(业)发展现状及研究进展[J].中国食品学报,2018,18(1):217-224.
HUANG Y L,WANG W L,LIU Y,et al.The development and progress of cultured puffer fish in China[J].Journal of Chinese Institute of Food Science and Technology,2018,18(1):217-224.
[5] PURSLOW P P.The structure and functional significance of variations in the connective tissue within muscle[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2002,133(4):947-966.
[6] ROY B C,SEDGEWICK G,AALHUS J L,et al.Modification of mature non-reducible collagen cross-link concentrations in bovine m.gluteus Medius and semitendinosus with steer age at slaughter,breed cross and growth promotants[J].Meat Science,2015,110:109-117.
[7] TAYLOR R G.Connective tissue structure function and influence on meat quality[J].Encyclopedia of Meat Science,2004(1):306-314.
[8] WESTON A R,ROGERS R W,ALTHEN T G,et al.Review:the role of collagen in meat tenderness[J].The Professional Animal Scientist,2002,18(2):107-111.
[9] 王选飞,刘俊荣,衣鸿莉,等.红鳍东方鲀肌肉组织及生化组成特性研究[J].食品科学技术学报,2020,38(6):93-102.
WANG X F,LIU J R,YI H L,et al.Study on muscle texture and biochemical properties of farmed Takifugu rubripes [J].Journal of Food Science and Technology,2020,38(6):93-102.
[10] GAO X,OGAWA H,TASHIRO Y,et al.Rheological properties and structural changes in raw and cooked abalone meat[J].Fisheries Science,2001,67(2):314-320.
[11] 范三红,刘晓华,胡雅喃,等.加热处理对鱼肉蛋白质理化特性的影响[J].食品工业科技,2014,35(12):104-107;112.
FAN S H,LIU X H,HU Y N,et al.Effect of heat treatment on protein in physical and chemical properties[J].Science and Technology of Food Industry,2014,35(12):104-107;112.
[12] XU Y X,WANG R,ZHAO H L,et al.Effect of heat treatment duration on the interaction between fish myosin and selected flavor compounds[J].Journal of the Science of Food and Agriculture,2020,100(12):4 457-4 463.
[13] 齐海萍,胡文忠,姜爱丽,等.热加工对鲤鱼质构的影响研究[J].食品科技,2011,36(5):144-146;150.
QI H P,HU W Z,JIANG A L,et al.Effects of thermal processing on texture and protein of carp[J].Food Science and Technology,2011,36(5):144-146;150.
[14] 桂萍,罗永康,冯力更.加热温度对混合肉肌原纤维蛋白质结构的影响[J].中国农业大学学报,2018,23(5):93-101.
GUI P,LUO Y K,FENG L G.Effects of temperature on the structure of myofibrillar protein in blended meat[J].Journal of China Agricultural University,2018,23(5):93-101.
[15] 邓丽,李岩,董秀萍,等.热加工过程中鲍鱼腹足蛋白间作用力及其质构特性[J].农业工程学报,2014,30(18):307-316.
DENG L,LI Y,DONG X P,et al.Chemical interactions and textural characteristics of abalone pleopod muscle protein during heating[J].Transactions of the Chinese Society of Agricultural Engineering,2014,30(18):307-316.
[16] BELIBAGLI K B,SPEERS R A,PAULSON A T.Thermophysical properties of silver Hake and mackerel surimi at cooking temperatures[J].Journal of Food Engineering,2003,60(4):439-448.
[17] THIANSILAKUL Y,BENJAKUL S,RICHARDS M P.Isolation,characterisation and stability of myoglobin from Eastern little tuna (Euthynnus affinis) dark muscle[J].Food Chemistry,2011,124(1):254-261.
[18] 姜启兴.鳙鱼肉热加工特性及其机理研究[D].无锡:江南大学,2015.
JIANG Q X.Study on thermal processing properties and mechanism of bighead carp (Aristichthys nobilis) muscle[D].Wuxi:Jiangnan University,2015.
[19] 朱瑞麒.淡水鱼鱼糜制品质量影响因素及其冷冻工艺优化[D].哈尔滨:东北农业大学,2015.
ZHU R Q.Influence factors of quality of fresh water fish surimi products and optimization of freezing process[D].Harbin:Northeast Agricultural University,2015.
[20] 尚珊,祁立波,姜鹏飞,等.海藻糖和复合磷酸盐对鲟鱼肉冻融稳定性的影响[J].食品工业科技,2020,41(9):205-209;326.
SHANG S,QI L B,JIANG P F,et al.Effect of trehalose and composite phosphate on the freezing-thawing stability of sturgeon[J].Science and Technology of Food Industry,2020,41(9):205-209;326.
[21] 鉏晓艳,邹开封,叶丽秀,等.嫩化时间对大口黑鲈半成品品质的影响[J].肉类研究,2016,30(7):1-5.
ZU X Y,ZOU K F,YE L X,et al.Effect of tenderization time on the quality of semi-finished products from Micropterus salmoides[J].Meat Research,2016,30(7):1-5.
[22] 鉏晓艳,邹开封,李新,等.鲌鱼肉制品嫩化工艺优化及表面微观结构观察[J].食品工业科技,2016,37(16):259-263;268.
ZU X Y,ZOU K F,LI X,et al.Tenderizing process optimization and surface morphology observation on meat of Culter alburnus[J].Science and Technology of Food Industry,2016,37(16):259-263;268.
[23] 夏俪宁.马鲛鱼肌原纤维蛋白氧化对凝胶特性影响[D].大连:大连工业大学,2018.
XIA L N.The effect of oxidation on the gel properties of myofibrillar protein from mackerel(Scomberomours niphonius)[D].Dalian:Dalian University of Technology,2018.
[24] 钱跃威, 徐瀚麟,吕奇晏,等.鳗鱼骨胶原肽钙螯合物的制备及其稳定性和Caco-2吸收特性[J].食品科学,2020,41(24):1-8.
QIAN Y W,XU H L,LYU Q Y,et al.Preparation and stability of calcium-chelating peptide and its absorption characteristics in caco-2 cells[J].Food Science,2020,41(24):1-8.
[25] 李超,徐为民,王道营,等.加热过程中肉嫩度变化的研究[J].食品科学,2009,30(11):262-265.
LI C,XU W M,WANG D Y,et al.Heat induced change of meat tenderness[J].Food Science,2009,30(11):262-265.
[26] PALKA K.Changes in intramuscular connective tissue and collagen solubility of bovine m.semitendinosus during retorting[J].Meat Science,1999,53(3):189-194.
[27] 付湘晋.白鲢鱼脱腥及其低盐鱼糜制备的研究[D].无锡:江南大学,2009.
FU X J.Removing the off-flavor of silver carp and the preparation of low salt surimi[D].Wuxi:Jiangnan University,2009.
[28] 杨静.暗纹东方鲀冷藏过程中质构劣化和蛋白降解变化研究[D].无锡:江南大学,2017.
YANG J.Study on texture softening and protein deterioration change of puffer fish(Takifugu obscurus) during refrigerated storage[D].Wuxi:Jiangnan University,2017.
[29] 孙红霞,黄峰,丁振江,等.不同加热条件下牛肉嫩度和保水性的变化及机理[J].食品科学,2018,39(1):84-90.
SUN H X,HUANG F,DING Z J,et al.Changes in tenderness and water-holding capacity and underlying mechanism during beef stewing[J].Food Science,2018,39(1):84-90.
[30] UTAMA D T,BAEK K H,JEONG H S,et al.Effects of cooking method and final core-temperature on cooking loss,lipid oxidation,nucleotide-related compounds and aroma volatiles of Hanwoo brisket[J].Asian-Australasian Journal of Animal Sciences,2018,31(2):293-300.
[31] 常海军.不同加工条件下牛肉肌内胶原蛋白特性变化及其对品质影响研究[D].南京:南京农业大学,2010.
C H J.Study on the properties of intramuscular collagen in beef under different processing conditions and its effect on quality[D].Nanjing:Nanjing Agricultural University,2010.
[32] 荣建华.冷冻和热加工对脆肉鲩肌肉特性的影响及其机制[D].武汉:华中农业大学,2015.
RONG J H.Effects of freezing and hot processing on muscle characteristics of crisped grass carps and its mechanism[D].Wuhan:Huazhong Agricultural University,2015.
[33] EGELANDSDAL B,MARTINSEN B,AUTIO K.Rheological parameters as predictors of protein functionality:A model study using myofibrils of different fibre-type composition[J].Meat Science,1995,39(1):97-111.
[34] 姚志琴.鱼滑类预凝胶鱼糜制品的制备研究[D].杭州:浙江工业大学,2015.
YAO Z Q.Study on preparation of fish surimi products with pre-gel of fish slime[D].Hangzhou:Zhejiang University of Technology,2015.
[35] BECKER A,BOULAABA A,PINGEN S,et al.Low temperature cooking of pork meat - Physicochemical and sensory aspects[J].Meat Science,2016,118:82-88.
[36] DAVEY C L,GILBERT K V.Temperature-dependant cooking toughness in beef[J].Journal of the Science of Food and Agriculture,1974,25(8):931-938.
[37] KOPP J,BONNET M.Stress-strain and isometric tension measurements in collagen[M].New York:Van Nostrand,1987.
[38] COMBES S,LEPETIT J,DARCHE B,et al.Effect of cooking temperature and cooking time on Warner-Bratzler tenderness measurement and collagen content in rabbit meat[J].Meat Science,2004,66(1):91-96.
[39] 汪洋,王稳航.肌内结缔组织与肉的嫩度的关联机制及相关肉嫩化技术的研究进展[J/OL].食品科学,2020.http://kns.cnki.net/kcms/detail/11.2206.TS.20200722.1347.072.html.
WANG Y,WANG W H.Research progress on the mechanism between intramuscular connective tissue and meat tenderness and related meat tenderization technology[J/OL].Food Science,2020.http:// http://kns.cnki.net/kcms/detail/11.2206.TS.20200722.1347.072.html.
[40] CHRISTENSEN M,PURSLOW P P,LARSEN L M.The effect of cooking temperature on mechanical properties of whole meat,single muscle fibres and perimysial connective tissue[J].Meat Science,2000,55(3):301-307.
[41] 臧大存,周光宏,徐幸莲,等.加热过程中鸭肉嫩度及超微结构的变化[J].江苏农业学报,2007,23(5):475-480.
ZANG D C,ZHOU G H,XU X L,et al.Changes of ultra-structure and tenderness of duck meat during heating[J].Jiangsu Journal of Agricultural Sciences,2007,23(5):475-480.
[42] 刘晶晶. 结缔组织热变化对牛肉嫩度影响的研究[D].北京:中国农业科学院,2018.
LIU J J.Study on the effect of thermal change of connective tissue on beef tenderness[D].Beijing:Chinese Academy of Agricultural Sciences,2018.
[43] 李艳红,王稳航.低温热处理对牦牛肉理化性质及感官特性的影响[J].食品与发酵工业,2021,47(2):145-152.
LI Y H,WANG W H.Effects of low-temperature cooking on physicochemical properties and sensory of yak meat[J].Food and Fermentation Industries,201,47(2):145-152.