人体内对血压调节起主要作用的是肾素-血管紧张素系统和激肽释放酶-激肽系统,这两套系统的调节效果正好相反,但发挥作用靠的都是一种重要的蛋白酶。在肾素-血管紧张素系统中血管紧张素I在血管紧张素转化酶(angiotensin-I converting enzyme,ACE)的催化作用下转化为血管紧张素II,其可使血管收缩最终导致血压升高,同时在激肽释放酶-激肽系统中ACE会催化舒缓激肽变为失活片段使其无法发挥舒张血管的作用,在双重作用下导致血压升高[1]。因此需要一种能够与ACE结合的物质,使之无法发挥催化作用,从而达到降压效果。市面上的降压药物,以人工合成的居多,高血压人群一般需要长期服用,会导致一系列负面影响[2]。目前食源性降压肽的研究成为热点,例如海洋水产源、乳蛋白源、植物蛋白源等,因具有易吸收、安全性高、副作用小等优势,有望成为大规模工业化生产的原料。
藜麦是一种起源于南美洲的古老作物,是优质的植物蛋白资源,氨基酸组成平衡且不含麸质[3]。藜麦蛋白是潜在的生物活性肽来源,可以对ACE产生抑制活性。ALUKO等[4]以碱性蛋白酶水解藜麦蛋白后发现,低分子质量(<5 kDa)的肽比高分子质量(>5 kDa)的肽具有更好的ACE抑制活性,RAVISANKAR等[5]的研究表明,藜麦源生物活性肽能够跨越Caco-2细胞屏障从而对ACE活性有一定的抑制作用。
制备ACE抑制肽主要有酶解法和微生物发酵法,比较而言,微生物发酵法产降压肽工艺简单、生产效率高、价格低廉,更容易实现工业化大规模生产[2]。目前常用菌种有枯草芽胞杆菌[6]、乳酸菌[7]、曲霉菌[8]等。而复合菌种发酵相比于单菌发酵,微生物可以产生广谱的蛋白酶,对蛋白的切割位点多,通过酶解可以将大分子蛋白质分解为高浓度的具有特定功能的小分子活性肽,酶解效率高。此外,菌体在发酵过程中的代谢产物会进一步修饰某些功能基团,提高所得肽的生物活性[9]。
本研究以藜麦为原料,通过红曲霉与乳酸菌混合菌种发酵,制备ACE抑制肽,并通过透析、葡聚糖凝胶过滤和反相高效液相色谱(reversed phase-HPLC,RP-HPLC)3步纯化发酵上清液,进行成分鉴定和性质研究。
1 材料与方法
1.1 实验材料
1.1.1 实验材料
藜麦(按GB 5009.5—2016测得蛋白质含量为12.096 g/100 g),北京农品堂食品有限公司;10份红曲样品,福建古田、浙江温州等地。
植物基因组提取试剂盒,天根生化科技(北京)有限公司;ACE(来自兔肺)、N-[3-(2-furylacryloyl)]-L-phenyalanyl-glycyl-glycine(FAPGG)、N-(2-hydroxyethyl)-N-(3-sulfopropyl)-piperazine(HEPES),美国Sigma公司;葡聚糖凝胶(Sephadex)G-25、胃蛋白酶、胰蛋白酶、α-胰凝乳蛋白酶,上海源叶生物科技公司;透析袋,美国Viskase公司。
1.1.2 实验菌种
紫色红曲霉(Monascus purpureus)40268、安卡红曲霉(Monascus anka)40704、丛毛红曲霉(Monascus pilosus)40710、紫色红曲霉(Monascus purpureus)41601、植物乳杆菌(Lactobacillus plantarum)21805、发酵乳杆菌(Lactobacillus fermentium)21828、植物乳杆菌植物亚种22160(Lactobacillus plantarum subsp.plantarum)、肠膜明串珠菌肠膜亚种(Leuconostoc mesenteroides subsp.mesenteroides)22184、类植物乳杆菌(Lactobacillus paraplantarum)22192、戊糖片球菌(Pediococcus pentosaceus)22227、干酪乳杆菌(Lactobacillus casei)23185、类干酪乳杆菌(Lactobacillus paracasei)6232,中国工业微生物菌种保藏管理中心;保加利亚乳杆菌(Lactobacillus bulgaricus)6063和6064,本实验室分离保存。
1.1.3 仪器与设备
TS-100B恒温摇床培养箱,上海善志仪器设备有限公司;LC-LX-HL210D高速冷冻离心机,上海力辰仪器科技有限公司;VICTOR Nivo多功能酶标仪,珀金埃尔默仪器有限公司;T100 PCR仪,美国Bio-Rad公司;RE-52AA旋转蒸发仪,山东博科科学仪器有限公司;LC-2030 PLUS高效液相色谱仪,日本岛津。
1.2 实验方法
1.2.1 菌株培养
称取从福建古田等地购买的10份红曲样品各5 g,分别加入95 mL无菌生理盐水充分振荡,涂布后在28 ℃培养箱中培养5 d,用无菌接种环刮下具有红曲霉基本特征的单个菌落表面的菌丝,转接至新的平板,反复几次直至菌株较为纯净。
利用植物基因组提取试剂盒提取红曲霉DNA,以提取菌落的总DNA为模板,利用真菌转录间隔区(internal transcribed spacer,ITS)通用引物(ITS1:5’-TCCGTAGGTGAACCTGCGG-3’;ITS4:5’-TCCTCCGCTTATTGATATGC-3’)进行PCR扩增。PCR扩增完成后进行琼脂糖凝胶电泳,送至生工生物工程(上海)股份有限公司测序,所得的序列信息利用基本局部比对搜索工具(basic local alignment search tool,BLAST)在GenBank核酸数据库中进行相似性比对。
1.2.2 菌株筛选
1.2.2.1 发酵过程
清洗藜麦种子,在蒸馏水中浸泡2 h,不断用蒸馏水冲洗直至洗涤液无泡沫,以除去皂苷并简化发芽过程。将漂洗后的谷物撒在发芽室中室温下发芽24 h,用高速粉碎机磨成粉末[10]。
将活化好的乳酸菌离心(4 ℃下7 500 r/min,10 min)后保留菌体,用无菌25%的林格氏液洗涤,离心(4 ℃下12 000 r/min,15 min)后用蒸馏水重悬,将细胞数量调整为6 lg CFU/mL(λ=600 nm,OD=1)。红曲霉活化好后用无菌接种环刮取孢子放入无菌蒸馏水中,充分分散后调整孢子浓度为106~107个/mL。
称取2 g藜麦粉放入250 mL锥形瓶中并加入80 mL蒸馏水后充分混匀,121 ℃灭菌20 min,冷却到室温后按照1%的接种量吸取乳酸菌悬浮液和红曲霉孢子悬液放入锥形瓶中并分别在37和28 ℃的摇床中振荡培养48和120 h,将发酵液在4 ℃、8 000 r/min离心8 min,收集上清液备用。根据以下指标筛选并综合分析得到最优菌种组合。
按照福林酚法[11]测定蛋白酶酶活力。利用发酵上清液中的蛋白酶在一定的温度与pH条件下可以水解酪蛋白底物,产生含有酚基的氨基酸,其在碱性条件下可将福林酚试剂还原,生成钼蓝与钨蓝,用分光光度法测定,计算其酶活力:1 mL酶液每分钟水解酪蛋白产生1 μg酪氨酸的酶量为1个酶活力单位(U/mL)。空白实验中用藜麦蛋白悬浮液替代样品,下同。
采用甲醛滴定法[12]测定蛋白水解度。取适量发酵上清液,加入60 mL去CO2蒸馏水,用精密pH计调节pH值为8.20,加入20 mL pH为8.20的甲醛,然后用0.100 0 mol/L的标准NaOH溶液滴定pH到9.20,记录消耗的NaOH体积,记录空白实验消耗的NaOH体积,—NH2含量和蛋白水解度分别按公式(1)(2)计算:
DH/%=h/htot×100
(1)
(2)
式中:h,水解后每克蛋白被裂解的肽键数;htot,每克蛋白质中肽键数,一般来说,htot是一个常数,经过计算,藜麦蛋白的htot为7.2 mmol/L;c(-NH2),-NH2含量,mol/L;c(N),N含量,mol/L。
采用比色法[13]测定粗多肽得率。取2.5 mL发酵上清液,加入等体积0.1 g/mL的三氯乙酸静置30 min,在4 ℃、5 000 r/min离心20 min,取2 mL上清液,加入8 mL双缩脲试剂,在25 ℃下静置30 min,测540 nm处的OD值。对照酪蛋白标准曲线求得样品溶液中的多肽含量。粗多肽得率按公式(3)计算:
粗多肽得率![]()
(3)
式中:ρ(多肽),样品溶液中的多肽质量浓度,mg/mL;V,样品总体积,mL;m,样品质量,mg。
1.2.2.2 混菌验证实验
将最优菌种组合按发酵步骤共同加入发酵底物中,在33 ℃的摇床中振荡培养84 h,将发酵液在4 ℃、8 000 r/min离心8 min,保留上清液按照上述方法测定蛋白酶酶活力、蛋白水解度和粗多肽得率,按照刘子毅[14]的方法测定ACE抑制率。
1.2.3 ACE抑制肽的工艺条件优化
选取菌种比例[m(戊糖片球菌22227)∶m(紫色红曲霉4422)分别为3∶1、2∶1、1∶1、1∶2、1∶3]、培养时间(48、72、96、120、144 h)、培养温度(28、31、34、37 ℃)3个因素进行单因素试验,料液比为1∶40(g∶mL),接种量为1%,离心后收集上清液,分别测定ACE抑制活性。
1.2.4 ACE抑制肽的分离纯化
1.2.4.1 透析
准备3种规格的透析袋,截留分子质量分别为1 k、6 k和10 kDa,获得了MWs <1 k、1 k~6 k、6 k~10 k和> 10 kDa的4个组分,调整至相同蛋白浓度,分别测定ACE抑制率,下同。
1.2.4.2 凝胶过滤色谱
葡聚糖凝胶(Sephadex)G-25使用前填料必须充分溶胀,平衡好基线,样品过滤后(0.45 μm)上样,用自动收集器每隔3 min收集1管,在220 nm处测定各管的吸光度值,以管数为横坐标,以吸光度值为纵坐标,绘制洗脱曲线,测定各峰处的ACE抑制率[15]。
1.2.4.3 RP-HPLC
色谱柱以十八烷基硅烷键合硅胶为填充剂(4.6 mm×250 mm,5 μm),洗脱条件为流动相A乙腈,B含0.1%三氟乙酸的超纯水,等度洗脱:0~15 min,55%A+45%B。检测波长280 nm,柱温35 ℃,进样量10 μL,流速0.6 mL/min,自动进样,手动收集各峰处的液体,测定ACE抑制率[16]。
1.2.5 ACE抑制肽的成分鉴定和性质研究
1.2.5.1 氨基酸组成分析[17]
配制一系列浓度的氨基酸标准溶液,利用高效液相色谱测定氨基酸组成。条件如下:色谱柱(4.6 mm×250 mm,5 μm)以十八烷基硅烷键合硅胶为填充剂;流速1.0 mL/min;柱温40 ℃;进样量5 μL;检测波长254 nm。
1.2.5.2 热稳定性、pH稳定性和酶学稳定性研究
取分离纯化后的样品,分别置于4、37、60、80 ℃的水浴中,在0、0.5、1.0、2.0、3.0 h取出后迅速冷却,检测其ACE抑制活性。
取分离纯化后的样品,分别调pH值为2、5、7、10,40 ℃水浴0、0.5、1.0、2.0、3.0 h取出,适应室温后,将pH调节至8.3,检测其ACE抑制活性[18]。
取分离纯化后的样品,将其pH值调节至2.0后加入胃蛋白酶,在37 ℃下孵育2 h,然后将酶解溶液的pH调节至7.0,再加入胰蛋白酶和α-胰凝乳蛋白酶,在37 ℃下孵育4 h后,沸水浴10 min灭酶活力,检测其ACE抑制活性。
2 结果与分析
2.1 产蛋白酶菌种及混菌发酵制备ACE抑制肽菌种的筛选
红曲样品种类及来源见表1。
表1 红曲样品来源
Table 1 The source of monascus sample

样品编号来源样品类型样品编号来源样品类型1福建省古田县程久红粬有限公司红曲米6浙江省温州市泰顺简氏酒厂红曲酒糟2福建省古田县红鑫酒粬有限公司红曲米7福建省古田县帝源酒曲厂红曲米3广东省梅州市古塘养生阁红曲米8湖北省武汉佳成生物制品有限公司功能性红曲粉4浙江省温州市平阳县红曲酒糟9湖北省武汉佳成生物制品有限公司红曲粉5浙江省温州市泰顺陈记土特产红曲米10福建省古田县程久红粬有限公司功能性红曲米
通过菌株分离纯培养,从红曲样品共得到29株疑似菌株,从形态学和分子生物学方面对疑似菌株进行鉴定[19]。在形态学上有6株分离菌株的各项特征与紫色红曲霉一致,PCR扩增产物凝胶电泳表明6株分离菌1316、4422、4424、7324、7413和7414在500 bp位置附近都出现宽亮条带,序列信息经过BLAST比对,表明该菌属于红曲霉属。根据同源性比对的结果,利用Mega 6.0软件构建系统发育树,结果如图1所示。通过系统发育树可以看出6株分离菌与紫色红曲霉Monascus purpureus JN121729.1的同源性最高,达到99%以上,可初步将6株分离菌株归类为红曲霉属,但是无法确定分离菌株具体为哪一种菌。

图1 以ITS序列同源性为基础的系统发育树
Fig.1 Phylogenetic tree based on ITS sequence homology
经7 d的培养后测得红曲霉4422、7413、40268、41601蛋白酶酶活力较高,最高值达到95.12 U/mL;41601、7413、40268、1316、4422对藜麦蛋白的水解度较高,最高值达到37.38%;粗多肽得率没有显著差异,其中40710、4422、7414、40704的粗多肽得率略高,最高值达到4.71%。乳酸菌经48 h的培养后,22192、6064、6063、22227蛋白酶酶活力较高,最高值达到了221.98 U/mL;6063、22184、22160、22192、22227对藜麦蛋白的水解度较高,最高值达到8.49%;22160、22192、21828、6064、22227的粗多肽得率较高,最高值达到28.67%;这表明菌种在代谢期间可以产生酶活力较高的蛋白酶,不同的蛋白酶作用于不同的切割位点,有利于大分子底物蛋白被切割成小分子肽段,从而产生生物活性肽。研究表明[20]许多蛋白质长链可能不显示生物活性,但被酶解后产物中的小分子肽会显示多种活性功能。生物活性肽的分子质量大小、肽链长度以及组成结构都会对其功能特性及生理活性产生影响。而粗多肽得率反映了菌种发酵底物蛋白过后所得的小分子肽的含量即发酵的反应程度。
综合分析蛋白酶酶活力、水解度和粗多肽得率3个因素,最终选择保加利亚乳杆菌6063、戊糖片球菌22227、类植物乳杆菌22192,紫色红曲霉7413、4422、41601、40268进行混菌发酵验证实验。
如图2所示,通过混菌验证试验发现,以ACE抑制率(图2-d)为主要指标,蛋白酶酶活力(图2-a)、蛋白水解度(图2-b)和粗多肽得率(图2-c)为次要指标进行分析,戊糖片球菌22227和紫色红曲霉4422混合发酵的效果最好,ACE抑制率最高,达到84.21%,虽然蛋白酶酶活力低于其他菌种组合,蛋白水解度和粗多肽得率较高。

a-蛋白酶酶活力;b-蛋白水解度;c-粗多肽得率;d-ACE抑制率 1-6063+7413;2-6063+4422;3-6063+41601;4-6063+40268;5-22227+7413;6-22227+41601;7-22227+4422;8-22227+40268; 9-22192+4422;10-22192+41601;11-22192+7413;12-22192+40268
图2 混菌验证发酵结果
Fig.2 The results by fermentation with mixed bacteria
由图3可知与混菌发酵相比,单菌发酵后的蛋白酶酶活力、粗多肽得率和ACE抑制率都显著降低(P<0.01),红曲霉4422发酵上清液的蛋白水解度与混菌发酵相比仅略有降低,总体来看,混菌发酵制备ACE抑制肽的优势程度大于单菌发酵。
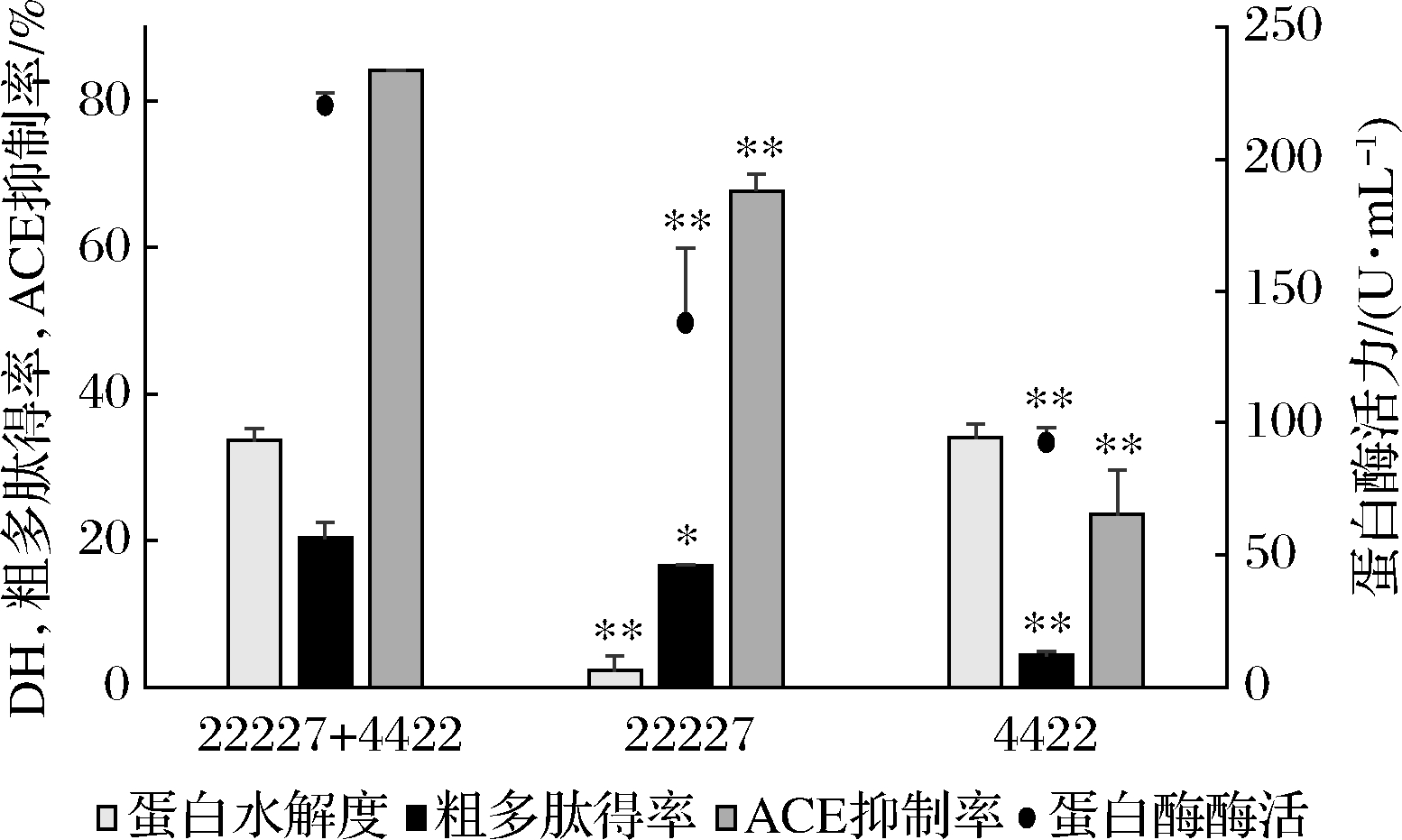
图3 单菌与混菌发酵的比较
Fig.3 Comparison of single and mixed fermentation
注:*,P<0.05;**,P<0.05
因此选择戊糖片球菌22227和紫色红曲霉4422作为混菌发酵产ACE抑制肽的优势菌种。可能是因为藜麦的蛋白结构具有优越性,经过发酵后所得肽段由于其氨基酸长度、组成和结构等原因导致更易与ACE结合,从而表现出较高的ACE抑制率。
2.2 混菌发酵制备ACE抑制肽的工艺优化
图4呈现了菌种比例、培养时间和培养温度对ACE抑制率影响的单因素试验结果。分析ACE抑制率随各个因素不同水平的变化规律,选择培养温度28 ℃、菌种比例2∶1、发酵时间7 d为最佳发酵条件。在此发酵条件下,ACE抑制率达到83.13%。这与利用枯草芽胞杆菌和黑曲霉复合发酵米糠制备ACE抑制肽所得的抑制率(64.48%)相比大大提高,当前制备ACE抑制肽应用最广泛的原料是大豆蛋白,与保加利亚乳杆菌(Lactobacillus bulgaricus)发酵大豆分离蛋白制备降压肽所得的抑制率(57.93%)[21]相比也有了大幅提升。

a-菌种比例;b-培养时间;c-培养温度
图4 单因素试验结果
Fig.4 Single factor experiment results
2.3 混菌发酵产ACE抑制肽的分离纯化及成分鉴定
2.3.1 透析分离
在最佳发酵条件下制备的发酵上清液经透析分离得到了4个组分(F1:>10 kDa,F2:6 k~10 kDa,F3:1 k~6 kDa和F4:<1 kDa),它们的ACE抑制率如图5所示,其中F3组分的ACE抑制率最高测定为82.85%。
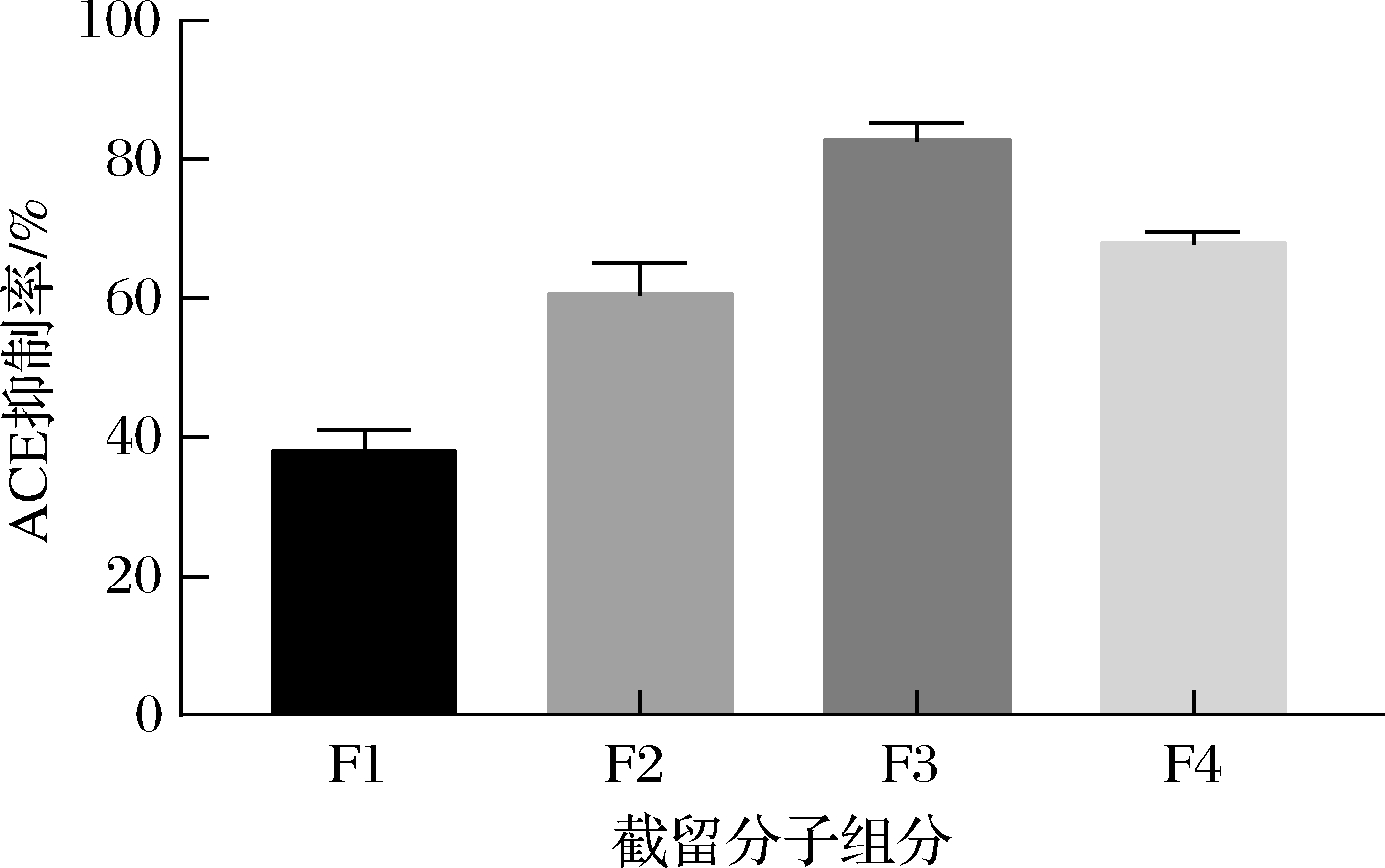
图5 不同截留分子质量组分的ACE抑制率
Fig.5 The ACE inhibition rate of different interception molecular weight components
2.3.2 葡聚糖凝胶过滤色谱分离纯化
合适的洗脱液、洗脱流速和上样量是葡聚糖凝胶过滤色谱分离纯化蛋白的关键,经透析后的组分F3在葡聚糖凝胶(Sephadex)G-25过滤层析色谱上分离得到了3个比较明显的峰,分别标记为S1、S2和S3,其中S2峰处的吸光度值最高,收集各峰处的液体测定它们的ACE抑制率,如图6所示,其中S2组分的ACE抑制率最高测定为86.06%。
2.3.3 RP-HPLC分离纯化
组分S2经RP-HPLC分离纯化后的色谱图如图7所示,此时的分离纯化肽仍不是单一组分,图中有3个比较明显的峰,其中峰Ⅲ的面积较大,重复收集3个峰处的液体,分别命名为H1、H2和H3,测定它们的ACE抑制率,其中H3组分的ACE抑制率最高测定为89.75%,可以看出与纯化前相比ACE抑制率得到了提升,效果良好。
2.3.4 成分鉴定
利用高效液相色谱对H3组分进行氨基酸种类和含量的测定,如表2所示,共测得12种氨基酸,包括丙氨酸、缬氨酸和甲硫氨酸等疏水性氨基酸,且它们的含量达到了氨基酸总量的50%以上,降压肽的ACE抑制活性与其结构中C末端的氨基酸种类有关,当为疏水性氨基酸时具有较高的抑制活性[22]。
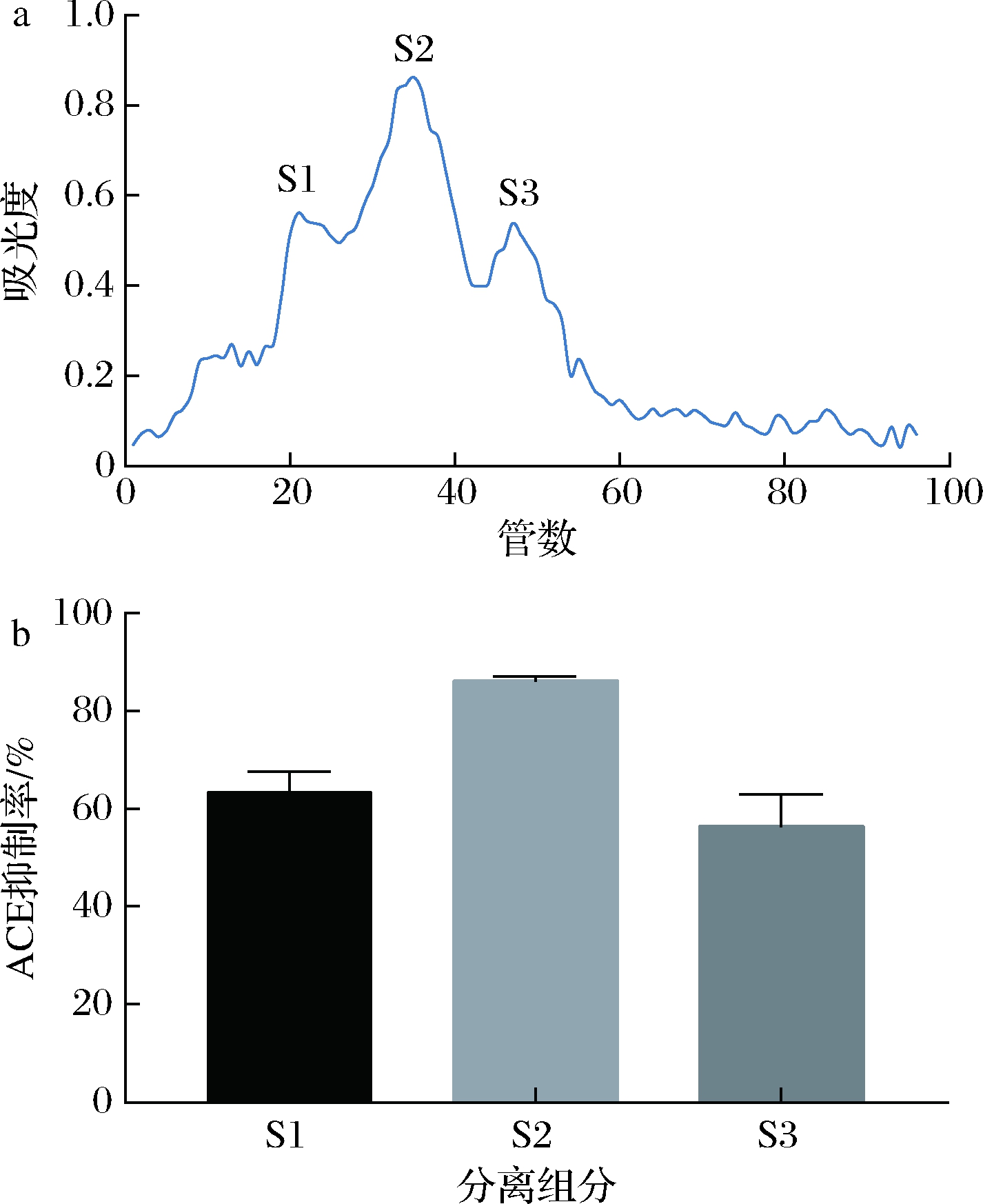
a-Sephadex G-25柱层析图谱;b-分离组分的ACE抑制率
图6 Sephadex G-25柱层析图谱及分离组分的ACE抑制率
Fig.6 Sephadex G-25 column chromatography and ACE inhibition rate of separated components
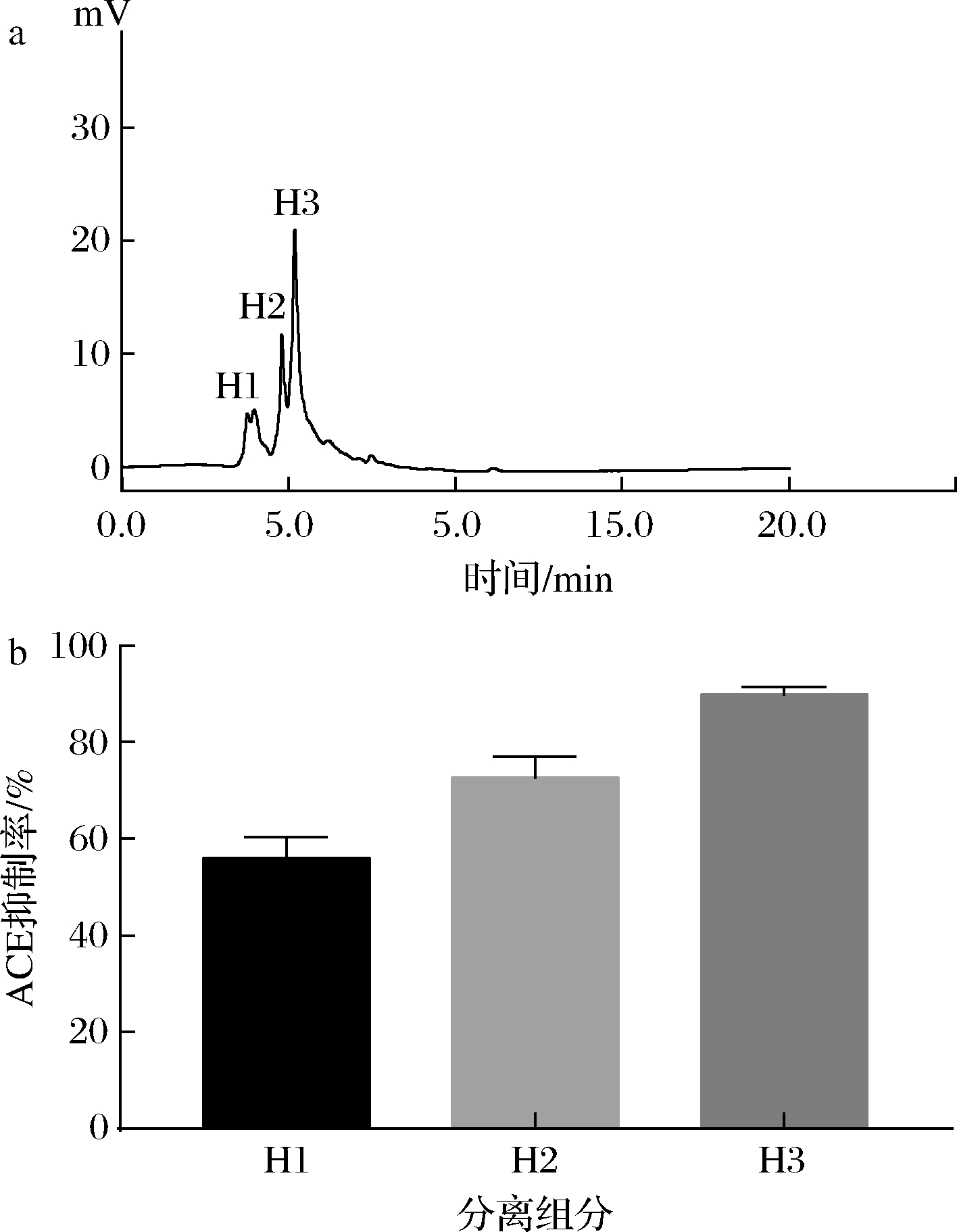
a-分离纯化肽的RP-HPLC图;b-分离组分的ACE抑制率
图7 分离纯化肽的RP-HPLC及分离组分的ACE抑制率
Fig.7 RP-HPLC of peptides and ACE inhibition rate of components
表2 组分H3的氨基酸组成
Table 2 The amino acid composition of H3
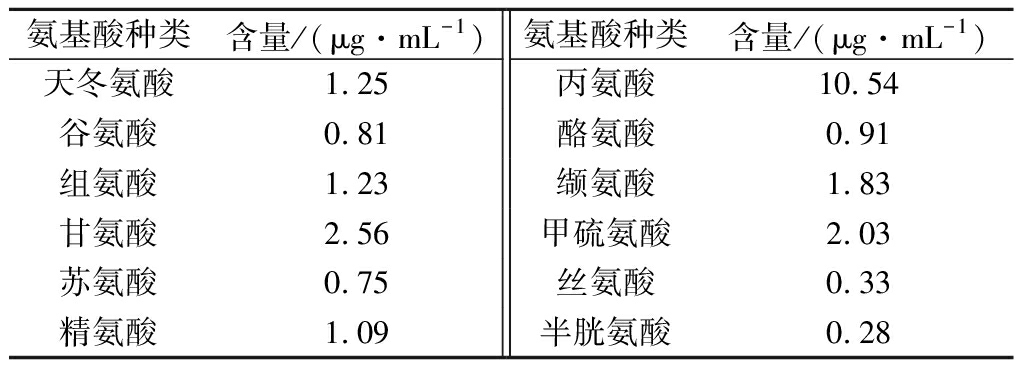
氨基酸种类含量/(μg·mL-1)氨基酸种类含量/(μg·mL-1)天冬氨酸1.25丙氨酸10.54谷氨酸0.81酪氨酸0.91组氨酸1.23缬氨酸1.83甘氨酸2.56甲硫氨酸2.03苏氨酸0.75丝氨酸0.33精氨酸1.09半胱氨酸0.28
2.4 混菌发酵产ACE抑制肽的性质研究
2.4.1 温度对ACE抑制肽活性的影响
生物活性肽的热稳定性非常重要,通常热处理会引起蛋白质变性如交联、缔合和聚集。在不同温度条件下所制备的降压肽对ACE的抑制效果是不同的。如图8所示,在4和37 ℃时,所制备降压肽的ACE抑制活性稳定,孵育3 h后ACE抑制率可保留91.84%。在60 ℃时,ACE抑制肽部分逐渐失活,抑制率最终可保留75.53%。在80 ℃时,有大量降压肽失去与ACE结合的能力,抑制率最终仅保留48.88%,这是因为ACE抑制肽在高温条件下的裂解速度会加快,超过60 ℃可能会影响肽的二级结构。所制备的ACE抑制肽在低温条件下,可以保持较好的活性,而当温度过高时其活性会大幅降低。蚕蛹源ACE抑制肽热稳定性的研究也得出了相似的结论[23]。

图8 温度对ACE抑制肽活性的影响
Fig.8 Effects of temperature on activities of ACE inhibitory peptides
2.4.2 pH对ACE抑制肽活性的影响
处于不同消化阶段会遇到不同pH,因此降压肽对不同pH值的稳定性十分关键。人胃的pH值为2~5,物质在摄入后至少需要2 h才能完全从胃进入十二指肠,而且大肠中胆汁的pH值几乎保持中性。pH条件会对降压肽与ACE结合的能力产生影响,如图9所示,在pH为5的条件下孵育3 h,所制备的降压肽的抑制率下降最缓慢,活性可保留到原来的87.31%,在pH为2的条件下孵育效果次之,抑制率可保留75.03%,在pH为7和10的条件下活性损失较为明显,分别仅为初始值的68.05%和44.73%。所制备的ACE抑制肽在偏酸性的条件下,可以保持较好的活性,而在强碱性条件下活性会大幅降低,稳定性差,可能由于在碱性环境下发生了水解,影响了肽的数量、大小、结构、氨基酸组成和疏水性,从而造成活性降低。

图9 pH对ACE抑制肽活性的影响
Fig.9 Effects of pH on activities of ACE inhibitory peptides
2.4.3 胃肠道蛋白酶对ACE抑制肽活性的影响
除pH值外,胰蛋白酶、胃蛋白酶和α-胰凝乳蛋白酶等胃肠道酶也是影响肽结构和活性的主要成分。如表3所示,与对照相比,经胃蛋白酶消化后,所制备的ACE抑制肽活性显著降低(P<0.05),这与关于蛋清源ACE抑制肽抵抗胃肠道蛋白酶试验结论类似[24],活性降低可能是由于部分ACE抑制肽被胃蛋白酶水解为分子质量更小的肽段,其组成和结构发生改变,不能再与ACE作用。而经胃蛋白酶、胰蛋白酶和α-胰凝乳蛋白酶连续消化后,ACE抑制率出现了轻微的上升现象,但与经胃蛋白酶消化相比影响并不显著,可以认为与经胃蛋白酶消化相比,连续消化并不影响ACE抑制肽的活性。在米糠蛋白源ACE抑制肽的体外消化试验中也发现了相似的现象[25]。
表3 肠道酶消化对ACE抑制肽活性的影响
Table 3 Effects of intestinal enzyme degradation on activities of ACE inhibitory peptides

消化酶处理方式ACE抑制活性/%对照87.09±1.64a胃蛋白酶72.61±0.54b胃蛋白酶+胰蛋白酶+α-胰凝乳蛋白酶74.43±0.83b
3 结论
本研究以藜麦为底物,利用红曲霉与乳酸菌混合菌种发酵的方式制备了一种ACE抑制肽,前期通过对蛋白酶酶活力、蛋白水解度和粗多肽得率3个指标进行筛选,得到混菌发酵的最优组合为紫色红曲霉4422(M.purpureus)和戊糖片球菌(P.pentosaceus)22227,所得降压肽的ACE抑制率可达到84.21%,通过对混菌发酵过程的最佳发酵条件进行优化,得到了在培养温度为28 ℃、P. pentosaceus 22227和M. purpureus 4422菌种比例为菌种比例为2∶1、发酵7 d,ACE抑制率最高,可达到83.13%,ACE抑制肽经透析、葡聚糖凝胶过滤色谱及RP-HPLC提纯之后得到的肽段,ACE抑制率可达到89.75%,其中含有丙氨酸、缬氨酸和甲硫氨酸等疏水性氨基酸,且占到氨基酸总量的50%以上,这些高含量的疏水性氨基酸这被认为与ACE抑制能力有关,在低温、弱酸性情况下以及体外连续消化试验过程中,该ACE抑制肽可保持较好的稳定性。
[1] ZHENG Y J,WANG X,ZHUANG Y L,et al.Isolation of novel ACE-inhibitory and antioxidant peptides from quinoa bran albumin assisted with an in silico approach:Characterization,in vivo antihypertension,and molecular docking[J].Molecules,2019,24(24):4 562.
[2] DASKAYA-DIKMEN C,YUCETEPE A,KARBANCIOGLU-GULER F,et al.Angiotensin-I-converting enzyme (ACE)-inhibitory peptides from plants[J].Nutrients,2017,9(4):316.
[3] GUO H M,HAO Y Q,RICHEL A,et al.Antihypertensive effect of quinoa protein under simulated gastrointestinal digestion and peptide characterization[J].Journal of the Science of Food and Agriculture,2020,100(15):5 569-5 576.
[4] ALUKO R E,MONU E.Functional and bioactive properties of quinoa seed protein hydrolysates[J].Journal of Food Science,2003,68(4):1 254-1 258.
[5] RAVISANKAR S,CAMPOS G,CHIRINOS R,et al.Quinoa (Chenopodium quinoa) peptides protect human umbilical vein endothelial cells (HUVEC) against risk markers for cardiovascular disease (CVD)[C].The FASEB Journal,2015,291.
[6] 李景, 陈定刚,马龙.响应面优化枯草芽孢杆菌发酵豆粕制备ACE抑制肽条件[J].中国油脂,2018,43(6):31-35.
LI J,CHEN D G,MA L.Optimization of fermentation conditions for preparation of ACE inhibitory peptides from soybean meal by Bacillus subtilis using response surface methodology[J].China Oils and Fats,2018,43(6):31-35.
[7] CHEN L,ZHANG Q H,JI Z,et al.Production and fermentation characteristics of angiotensin-I-converting enzyme inhibitory peptides of goat milk fermented by a novel wild Lactobacillus plantarum 69[J].LWT,2018,91:532-540.
[8] ZAREIAN M,OSKOUEIAN E,MAJDINASAB M,et al.Production of GABA-enriched idli with ACE inhibitory and antioxidant properties using Aspergillus oryzae:The antihypertensive effects in spontaneously hypertensive rats[J].Food & Function,2020,11(5):4 304-4 313.
[9] 范吉釴, 柯义强,刘红海,等.发酵法制备生物活性肽的研究进展[J].安徽农学通报,2020,26(23):19-23.
FAN J Y,KE Y Q,LIU H H,et al.Research progress in the preparation of bioactive peptides by fermentation[J].Anhui Agricultural Science Bulletin,2020,26(23):19-23.
[10] OBAROAKPO J U,LIU L,ZHANG S W,et al.α-Glucosidase and ACE dual inhibitory protein hydrolysates and peptide fractions of sprouted quinoa yoghurt beverages inoculated with Lactobacillus casei[J].Food Chemistry,2019,299:124 985.
[11] 李善仁. 混菌发酵豆粕制备大豆肽的研究[D].福州:福建农林大学,2009.
LI S R.Study on soybean peptides from soybean meal fermented by mixed strains[D].Fuzhou:Fujian Agriculture and Forestry University,2009.
[12] 何泽贺, 肖宇,刘建朝,等.大鳞副泥鳅蛋白制备ACE抑制肽的酶解方式研究[J].食品研究与开发,2021,42(7):134-140.
HE Z H,XIAO Y,LIU J C,et al.Study on enzymatic hydrolysis of ACE inhibitory peptide from loach (Paramisgurnus dablianus) protein[J].Food Research and Development,2021,42(7):134-140.
[13] 王銮, 包怡红,康宁.混菌固态发酵榛仁粕制备降血压肽工艺优化研究[J].中国粮油学报,2018,33(12):35-41.
WANG L,BAO H Y,KANG N.Optimization of preparation of antihypertensive peptide from hazelnut meal by solid-state fermentation with mixed bacteria[J].Journal of The Chinese Cereals and Oils Association,2018,33(12):35-41.
[14] 刘子毅. 玉米黄粉ACE抑制肽的制备及其活性研究[D].北京:中国农业科学院,2019.
LIU Z Y.Study on preparation and activity of ACE inhibitory peptide from corn gluten meal[D].Beijing:Chinese Academy of Agricultural Sciences,2019.
[15] 周亚丽. 魔芋ACE抑制肽分离纯化及体外降血压活性研究[D].西安:陕西科技大学,2017.
ZHOU Y L.Study on separation and purification of ACE inhibitory peptides from konjac and its antihypertensive activity in vitro[D].Xi’an:Shaanxi University of Science & Technology,2017.
[16] CHEN Y Y,GAO X,WEI Y X,et al.Isolation,purification and the anti-hypertensive effect of a novel angiotensin I-converting enzyme (ACE) inhibitory peptide from Ruditapes philippinarum fermented with Bacillus natto[J].Food & Function,2018,9(10):5 230-5 237.
[17] 罗鹏. 葵花籽ACE抑制肽的分离纯化、结构分析与稳态化研究[D].武汉:华中农业大学,2018.
LUO P.Separation and purification,structural analysis and stabilization of ACE inhibitory peptides derived from sunflower seeds[D].Wuhan:Huazhong Agricultural University,2018.
[18] 陈秋銮, 陈雪芹,马倩,等.酶解法制备牡丹籽ACE抑制肽及其稳定性[J].食品工业科技,2020,41(19):149-156.
CHEN Q L,CHEN X Q,MA Q,et al.Preparation and stability of ACE inhibitory peptides from peony seed meal by enzymatic hydrolysis[J].Science and Technology of Food Industry,2020,41(19):149-156.
[19] 杨高继, 刘欢欢,马艳,等.糙米中蜡样芽孢杆菌的分离鉴定及其毒力基因与药敏性检测[J].现代食品科技,2020,36(10):290-299.
YANG G J,LIU H H,MA Y,et al.Isolation,identification of Bacillus cereus from brown rice and its virulence genes detection and antibiotic susceptibility[J].Modern Food Science and Technology,2020,36(10):290-299.
[20] WANG L J.,SAITO M,TATSUMI E,et al.Antioxidative and angiotensin I-converting enzyme inhibitory activities of sufu (fermented tofu) extracts[J].Japan Agricultural Research Quarterly,2003,37(2):129-132.
[21] 李响, 刘畅,吴非.微生物发酵法制备大豆ACE抑制肽菌种的筛选[J].食品科学,2013,34(1):185-188.
LI X,LIU C,WU F.Screening of optimal strain for microbial preparation of ACE inhibitory peptides from soybean protein isolate[J].Food Science,2013,34(1):185-188.
[22] 谯飞. 大米蛋白ACE抑制肽制备及其膜高效分离技术的研究[D].哈尔滨:哈尔滨工业大学,2016.
QIAO F.The preparation of rice protein ACE inhibitory peptides and the research on its effective separation by membrane technology[D].Harbin:Harbin Institute of Technology,2016.
[23] 李勇. 蚕蛹ACE抑制肽的制备及其ACE抑制活性的研究[D].重庆:西南大学,2012.
LI Y.Study on pupa ACE inhibitory peptides preparation and its ACE inhibitory activity[D].Chongqing:Southwest University,2012.
[24] MIGUEL M,ALONSO M J,SALAICES M,et al.Antihypertensive,ACE-inhibitory and vasodilator properties of an egg white hydrolysate:Effect of a simulated intestinal digestion[J].Food Chemistry,2007,104(1):163-168.
[25] DOU B X,LIU Y,LIU Y M,et al.Isolation and characterization of angiotensin I converting enzyme (ACE) inhibitory peptides from rice bran proteins and evaluation of activity and stability[J].Pakistan Journal of Zoology,2020,52(4):1 397-1 405.