大鲵作为我国特种养殖大型水生两栖动物,具有较高的食用和药用价值[1]。近年来,大鲵已在我国多个省市实现了规模化人工养殖[2-4]。随着大鲵养殖产业逐渐低迷,特别是新冠肺炎疫情影响下,商品鲵滞销给养殖企业、养殖户造成了较大经济损失,大鲵综合加工利用愈发成为养殖业转型发展的瓶颈[4-5]。目前,大鲵深加工应用基础研究逐渐增多,诸如营养评价[6]、贮藏保鲜[7]、活性成分提取[8-9]等,对延伸大鲵产业链具有一定推动作用。
烧烤是肉类食材比较流行的烹制方法之一,因其制作便捷、口味鲜美,特别是食材中蛋白质、糖以及调味料在高温条件下诱发Maillard反应、酯化反应以及带有部分烟熏味,赋予烤肉独特的食味品质[10],被越来越多消费者青睐。随着食品挥发性风味物质检测技术和方法的日益成熟,烤肉的挥发性风味物质也能得到很好的定性定量评价,例如气相色谱-质谱联用法(GC-MS)、气相色谱-嗅闻法(gas chromatography olfactory, GC-O)、电子鼻等技术已广泛用于各种烤肉食品风味物质分析中[11-12]。与GC-MS常规挥发性成分分析相比,气相色谱-离子迁移谱(GC-ion mobility spectroscopy,GC-IMS)是一种快速检测挥发性风味成分的新兴技术,可实时得到风味物质的构成及可视化图谱,具有灵敏度高、检测速度快、操作方便等优点[11,13],在食品挥发性风味检测领域应用范围不断扩大。
在热加工肉类风味定性定量分析方面,有关GC-IMS技术的应用研究也显示出了一定优势。QIAN等[14]通过GC-IMS分析了腌制和油炸对红烧鸽子风味物质的影响;CHANG等[15]利用GC-IMS技术构建了自热油炸鲅鱼风味指纹图谱;CUI等[16]利用GC-IMS对不同烹饪加工的鱿鱼挥发性风味物质进行了分析;姚文生等[10]利用GC-IMS技术对市售烤羊肉串挥发性风味物质进行了分析,构建了烤羊肉串风味物质指纹图谱;徐永霞等[11]采用GC-IMS分析了海鲈鱼蒸制过程中挥发性风味物质的动态变化,表明GC-IMS结合正交偏最小二乘法可区分鱼肉熟化过程。
随着大鲵分割加工产业化,小包装速冻大鲵肉片、肉丸等初加工产品逐渐上市,消费人群不断扩大。前期利用GC-IMS技术对大鲵肉挥发性有机物进行了分析,发现大鲵不同部位气味物质存在较大差异[4]。养殖大鲵由于食用鱼饵料、腥味较重,限制了大众接受度。餐饮市场只有高明厨师和部分有经验的养殖户才能制作出美味可口的大鲵菜品,而普通大众无法做到。烧烤作为一种容易掌握的烹饪方式,在我国各地已形成了一种流行文化[10],大鲵肉经腌制、高温烤制、熟化后具有独特的口感和风味,也受到越来越多消费者追捧。然而有关大鲵肉烤制过程中挥发性风味物质研究,未见文献报道。为此,本研究利用GC-IMS技术结合偏最小二乘法分析确定大鲵肉烤制过程中特征挥发性风味物质的动态变化,为今后大鲵烤肉类调理食品开发提供数据支持。
1 材料与方法
1.1 材料与试剂
试验材料:养殖大鲵[3尾健康子二代个体,体重为(2.26±0.21)kg],汉中市魏大鲵生态繁养园。低温运回实验室后宰杀、去内脏、分割获得大鲵胴体4 ℃冷藏备用。
分析纯正酮(2-丁酮、2-戊酮、2-己酮、2-庚酮、2-辛酮和2-壬酮),国药化学试剂北京有限公司;料酒(含黄酒、香辛料、食盐、酵母抽提物、谷氨酸钠、5′-呈味核苷酸二钠,酒精度≥10%vol),山东鲁花集团有限公司;生姜和食盐,当地华润万家超市。
1.2 仪器与设备
K42电烤箱,广东格兰仕集团有限公司;Flavour Spec®风味分析仪,德国G.A.S公司。
1.3 实验方法
1.3.1 不同烤制时间大鲵肉样品制备
参考丁丹等[17]和前期烤制大鲵肉的方法[18],稍作调整。选取50个大小均匀去皮大鲵肉块[约3 cm×2 cm×1 cm,每块(25.67±1.46)g]→加入10 g生姜末、15 mL料酒和8 g食盐拌匀腌制30 min→沥干→放入电烤箱设置160 ℃→于0、20、40、60和80 min获得不同烤制时间大鲵肉样品,外观如图1所示,组织捣碎机绞碎混合均匀后,用于风味分析。
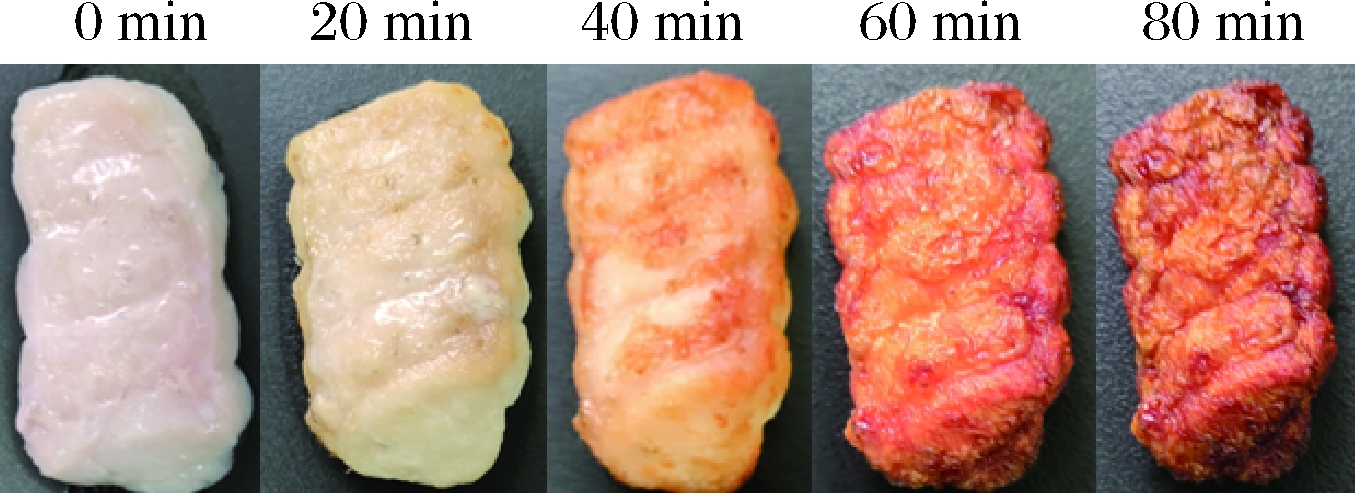
图1 不同烤制时间大鲵肉外观照片
Fig.1 Appearance photo of giant salamander meat at different roasting time
1.3.2 大鲵肉烤制过程中挥发性风味成分分析
采用GC-IMS对不同烤制时间大鲵肉样品挥发性有机物进行分析。分别取烤制过程中不同时间段大鲵肉样品,精密称取3.0 g,放入20.0 mL顶空进样瓶中,90 ℃孵育1 min进样后上机分析,每个肉样测定3次,由仪器软件获得挥发性有机物差异谱图;再通过仪器内置NIST 2014数据库和自建IMS数据库进行挥发性成分定性分析,仪器详细参数设置如下:
顶空孵化温度90 ℃;孵化时间1 min;加热方式:振荡加热;顶空进样针温度95 ℃;进样量500.0 μL,不分流模式;载气:高纯N2(纯度≥99.99 %);清洗时间0.5 min。
GC条件:色谱柱温度40 ℃;运行时间20 min;载气:高纯N2(纯度≥99.99%);流速:初始5.0 mL/min,保持10 min后在5 min内线性增至150 mL/min。漂移管长度5 cm;管内线性电压400 V/cm。
IMS条件:色谱柱(MXT-5,15 m,0.53 mm ID,1 μm FT);柱温60 ℃;漂移气(N2,纯度≥99.99%);流速150 mL/min;IMS探测器温度45 ℃;分析时间30 min。
1.4 数据统计分析
利用风味仪Laboratory Analytical Viewer(LAV)和Reporter、Gallery Plot 3个插件分析数据,由内置GC×IMS Library Search NIST 2014和IMS数据库对样品风味成分定性。利用Origin 8.5绘制不同组分相对含量变化柱状图;SIMCA-P 14.1软件进行正交偏最小二乘-判别法(orthogonal partial least squares-discriminant analysis,OPLS-DA)建模分析。ClustVis在线统计工具(https://biit.cs.ut.ee/clustvis/)进行主成分及聚类热图绘制。
2 结果与分析
2.1 不同烤制时间大鲵肉GC-IMS风味成分谱图分析
图2是烤制过程中大鲵肉挥发性风味成分3D谱图。谱图离子峰上每个化合物可能会有1、2个斑点(指示单体或二聚体),受到挥发性有机物含量和状态的影响[13]。从谱图外观可见,不同烤制时间大鲵肉样品的GC-IMS三维谱图肉眼不容易直接区分。

图2 不同烤制时间大鲵肉GC-IMS三维谱图
Fig.2 Three dimensional GC-IMS spectra of giant salamander meat at different roasting time
将图2中3D GC-IMS图转换生成二维俯视平面图(图3),能直观对比分析不同烤制时间大鲵肉挥发性风味物质的细微差别。由图3可见,不同烤制时间大鲵肉样品挥发性风味成分通过GC-IMS技术可以得到较好地识别与分离,不同烤制时间大鲵肉表现出相对特征性的GC-IMS图谱。同时,不同烤制时间大鲵肉样品中某些挥发性成分浓度有升高或降低,具有一定的差异(图3-b红色方形、椭圆虚线框区域)。本文利用GC-IMS技术对不同烤制时间大鲵肉挥发性风味成分进行检测,发现不同烤制时间大鲵GC-IMS特征谱具有一定差异,究其原因可能与烤制过程中脂肪氧化、水分蒸发以及美拉德反应等综合因素有关[17-19]。
2.2 大鲵肉烤制前期GC-IMS挥发性风味成分定性分析
经过对比特征性风味成分的保留时间和迁移时间,通过GC-IMS内置数据库搜索从而实现挥发性物质的定性分析。图4为对烤制初期大鲵肉样品Library Search定性分析结果(以0 min为例,其他烤制时间未显示),图中信号峰旁的数字,表示1个具体风味化合物。调用风味仪NIST 2014气相保留指数与IMS迁移时间数据库,从不同烤制时间大鲵肉60个信号峰中,鉴定出43种挥发性有机化合物(表1),可大体分为9种醇类、8种醛类、8种酮类、7种烯类、6种酯类、2种醚类、2种吡嗪类和1种酚类。

a-俯视图;b-对比图
图3 不同烤制时间大鲵肉GC-IMS二维谱图
Fig.3 Two dimensional GC-IMS spectra of giant salamander meat at different roasting time
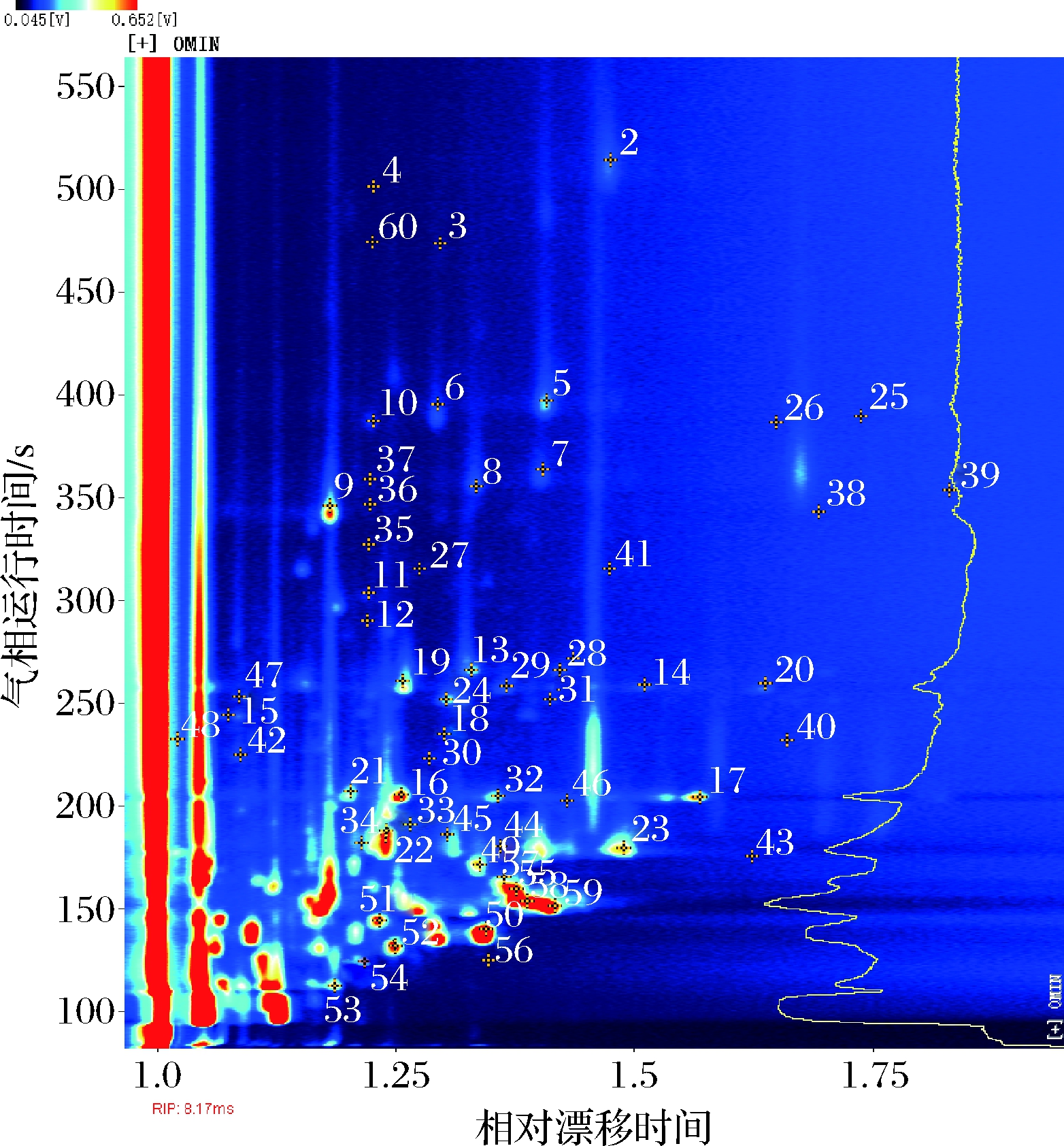
图4 烤制前期大鲵肉挥发性风味物质离子 迁移谱定性分析
Fig.4 IMS qualitative analysis of volatile flavor compounds of giant salamander meat before roasting
表1 不同烤制时间大鲵肉中鉴定的挥发性风味物质
Table 1 Volatile flavor compounds identified from giant salamander meat at different roasting time

编号风味物质名称CAS号分子式分子质量保留指数保留时间/s漂移时间/ms12-methoxy-4-vinylphenol(4-乙烯基-2-甲氧基苯酚)C7786610C9H10O2150.21 4571 008.1591.218 222nonanal(壬醛)C124196C9H18O142.21 113.7514.411.476 743butyl sulfide(二丁基硫醚)C544401C8H18S146.31 085.1473.3931.298 164linalool(芳樟醇)C78706C10H18O154.31 104.6501.3591.228 2952-ethyl-1-hexanol(2-乙基己醇)C104767C8H18O130.21032396.9531.409 9761,8-cineol-M(桉叶油醇单体)C470826C10H18O154.31 030.7395.0891.295 067octanal(辛醛)C124130C8H16O128.21 008.6363.3941.405 318butyl butanoate-M(丁酸丁酯单体)C109217C8H16O2144.21 003.1355.4711.335 439methyl-5-hepten-2-one(甲基庚烯酮)C110930C8H14O126.2996.2345.6831.183 2510limonene(双戊烯)C138863C10H16136.21 025.2387.1651.228 2911alpha-fenchene(α-葑烯)C471841C10H16136.2947303.7341.223 6312alpha-pinene(α-蒎烯)C80568C10H16136.2931.1290.1171.221 4513heptanal(庚醛)C111717C7H14O114.2903.1266.2541.328 0914styrene(苯乙烯)C100425C8H8104.2894.5258.8611.512 2915hexanal-M(己醛单体)C66251C6H12O100.2795.4205.0721.257 9816hexanal-D(己醛二聚体)C66251C6H12O100.2794204.3071.569 86172-heptanone-M(2-庚酮单体)C110430C7H14O114.2896.9260.91.259 22182-heptanone-D(2-庚酮二聚体)C110430C7H14O114.2895.1259.3711.638 219ethyl butyrate(丁酸乙酯)C105544C6H12O2116.2798.8206.8561.204 55203-methylbutan-1-ol-M(戊醇单体)C123513C5H12O88.1749.8185.1231.240 31213-methylbutan-1-ol-D(戊醇二聚体)C123513C5H12O88.1735.9179.4631.490 2322isoamyl acetate(乙酸异戊酯)C123922C7H14O2130.2882.4251.6811.303 95231,8-cineol-D(桉叶油醇二聚体)C470826C10H18O154.31 026.7389.3461.738 58241-octen-3-one(1-辛烯-3-酮)C4312996C8H14O126.2960.5315.191.276 62252-methyl-1-pentanol(2-甲基-1-丁醇)C105306C6H14O102.2829.1223.1171.286 35262,3-butanediol(2,3-丁二醇)C513859C4H10O290.1795.3205.0161.358 4927beta-pinene(β-蒎烯)C127913C10H16136.2974.7327.3591.223 7928beta-pyronene(β-人参烯)C514965C10H16136.2997346.5831.224 9729delta-carene(3-蒈烯)C29050337C10H16136.21 005.7359.1611.224 9730butyl butanoate-D(丁酸丁酯二聚体)C109217C8H16O2144.21 001.7353.4661.831 5231ethyl 2-methylbutyrate(2-甲基丁酸乙酯)C7452791C7H14O2130.2845.4231.8411.661 2232benzaldehyde(苯甲醛)C100527C7H6O106.1960.4315.0881.475 0733methylpyrazine(2-甲基吡嗪)C109080C5H6 N294.1831.8224.5641.08934(E)-2-pentenal(反-2-戊烯醛)C1576870C5H8O84.1740.8181.4561.359 63353-hydroxybutan-2-one(3-羟基-2-丁酮)C513860C4H8O288.1716171.4151.340 136ethyl acetate(乙酸乙酯)C141786C4H8O288.1613139.8891.345 53372-butanone(2-丁酮)C78933C4H8O72.1582.7131.7151.251 14382-pentanone(2-戊酮)C107879C5H10O86.1685.7159.5051.378 0739tert-butylmethylether(甲基叔丁基醚)C1634044C5H12O88.1557.5124.9431.348 78403-pentanone(3-戊酮)C96220C5H10O86.1701.6165.5761.365 05411-butanol(丁醇)C71363C4H10O74.1664.1153.6671.388 92423-methylbutanal(异戊醛)C590863C5H10O86.1654.5151.0981.418 51432-ethyl-3,5-dimethylpyrazine(3,5-二甲基-2-乙基-吡嗪)C13925070C8H12N2136.21 085.8474.4021.227 04
2.3 不同烤制时间大鲵肉挥发性成分指纹图谱
为解析不同烤制时间大鲵肉挥发性风味物质的差异性,利用不同烤制时间大鲵肉3次测试的GC-IMS二维图谱中全部信号峰,构建了不同烤制时间大鲵肉挥发性风味指纹图谱。如图5所示,横向指示不同烤制时间大鲵肉样品(从上至下分别为烤制0、20、40、60和80 min),纵向指示烤制过程中大鲵肉中同一挥发性有机物(颜色越深,反映该物质含量较大)[10,11,13]。由图5横纵向谱图差异对比可见,不同烤制时间大鲵样品挥发性有机物质显示较大差异(图5红框区域),其中未烤制大鲵肉(0 min)的挥发性有机物中,以壬醛、2-乙基己醇、丁酸乙酯、戊醇(单体、二聚体)、乙酸异戊酯、乙酸乙酯、2-庚酮、异戊醛、己醛单体含量相对较高(图5中红色框区域A1和A2区域),与前期报道的大鲵不同可食部位挥发性有机物成分差异较大[4],可能是原料新鲜状态、调味料腌制等因素造成。与未烤制相比,大鲵肉烤制后挥发性风味物质种类和含量明显增加(图5),这与鱼类热加工后挥发性风味成分变化趋势相同[11,19]。

图5 不同烤制时间大鲵肉挥发性成分Gallery指纹谱图
Fig.5 Gallery fingerprint of volatile organic compounds of giant salamander meat at different roasting time
注:每个斑点代表1种挥发性风味物质,图下方为已定性的化合物名称,数字表示未定性化合物(下同)
随着烤制时间的延长(20~80 min),大鲵肉挥发性有机物中壬醛、2-乙基己醇、丁酸乙酯、戊醇(单体、二聚体)、乙酸异戊酯、乙酸乙酯含量急剧下降。与0 min相比,烤制20~40 min时大鲵肉中4-乙烯基-2-甲氧基苯酚、二丁基硫醚、芳樟醇、桉叶油醇(单体、二聚体)、双戊烯、α-葑烯、α-蒎烯、β-蒎烯、3-蒈烯、2-甲基-1-丁醇、3, 5-二甲基-2-乙基吡嗪、反-2-戊烯醛、1-辛烯-3-酮、2, 3-丁二醇、甲基庚烯酮、2-甲基丁酸乙酯和苯甲醛含量明显增多(图5红框中B、C区域);但是随着烤制时间从40增加到60 min,这些挥发性有机物含量逐渐下降,而苯甲醛、2-庚酮(单体、二聚体)、2-丁酮、异戊醛、2-戊酮、2-甲基吡嗪、丁醇、3-戊酮、辛醛、苯乙烯、丁酸丁酯(单体、二聚体)、乙酸异戊酯含量逐渐增加(图5红框中C、D区域);烤制时间从60继续增至80 min过程中,大鲵肉中苯甲醛、2-庚酮(单体、二聚体)、2-丁酮、异戊醛、2-戊酮、2-甲基吡嗪、丁醇含量逐渐降低,而辛醛、苯乙烯、丁酸丁酯(单体、二聚体)、乙酸异戊酯、己醛(单体、二聚体)、庚醛和甲基叔丁基醚含量逐渐增加(图5中D、E区域)。
肉类热加工过程中挥发性成分较为复杂,具有多样性,总体包含醇类、酮类、醛类、萜烯衍生物、烃类以及少量呋喃、硫醚、萘类等有机化合物[10,12,17]。为了更好表征各类挥发性化合物的变化,根据化合物在指纹图谱上的信号强度,换算得到不同烤制时间下大鲵肉中挥发性组分的相对含量变化(图6)。从图6中可看出,大鲵烤肉中挥发性成分以酮类、醇类为主,其次是醛类、酯类和烯类。大鲵烤肉中检测到酮类物质相对含量为27.47%~39.67%,由甲基庚烯酮、2-庚酮、1-辛烯-3-酮、3-羟基-2-丁酮、2-丁酮、2-戊酮和3-戊酮构成;醇类物质相对含量为19.54%~48.95%,由芳樟醇、2-乙基己醇、桉叶油醇、戊醇、2-甲基-1-丁醇、2,3-丁二醇和丁醇构成;醛类物质相对含量为8.18%~21.34%,由壬醛、辛醛、庚醛、己醛、苯甲醛、反-2-戊烯醛和异戊醛构成;烯类物质相对含量为8.09%~25.09%,由双戊烯、α-葑烯、苯乙烯、α-蒎烯、苯乙烯、β-蒎烯、3-蒈烯构成;酯类物质相对含量为6.37%~11.34%,由丁酸丁酯单体、丁酸乙酯、乙酸异戊酯、丁酸丁酯二聚体、2-甲基丁酸乙酯、乙酸乙酯构成。
醛类物质主要为脂肪氧化的产物,阈值较低,对肉类总体挥发性风味影响较大;酮类和醇类物质也来源于脂肪酸的氧化降解,其阈值高于醛类,带有花香、水果香等令人愉悦的风味;酯类物质主要是酸类和醇类物质酯化反应的产物[19-20]。从图6中可知,大鲵肉烤制前以醇类(33.66%)、醛类(21.34%)、酮类(19.54%)和酯类(22.07%)为主,含有微量吡嗪类、酚类化合物。与烤制前0 min相比,大鲵肉烤制20 min后,醛类、醇类和酯类含量有所下降,而酮类、烯类、醚类化合物相对含量有所上升;随着烤制时间从20增加到80 min,烤制大鲵肉中醇类、烯类、醚类化合物含量逐渐降低,而酯类、酮类、醛类化合物相对比例逐渐增加。肉制品热加工过程中,由于脂肪氧化降解的程度加深,醛类、酮类物质比例上升,对肉类风味产生重要影响,特别是酮类物质对于水产品降低腥味有较大贡献[19]。本研究中烤制中后期(40~80 min),大鲵肉中挥发性有机物以酮类、醇类和醛类为主,主要是不饱和脂肪酸的氧化降解或氨基酸的Strecker降解反应产生[10,17],可能是大鲵烤肉风味形成的基础。
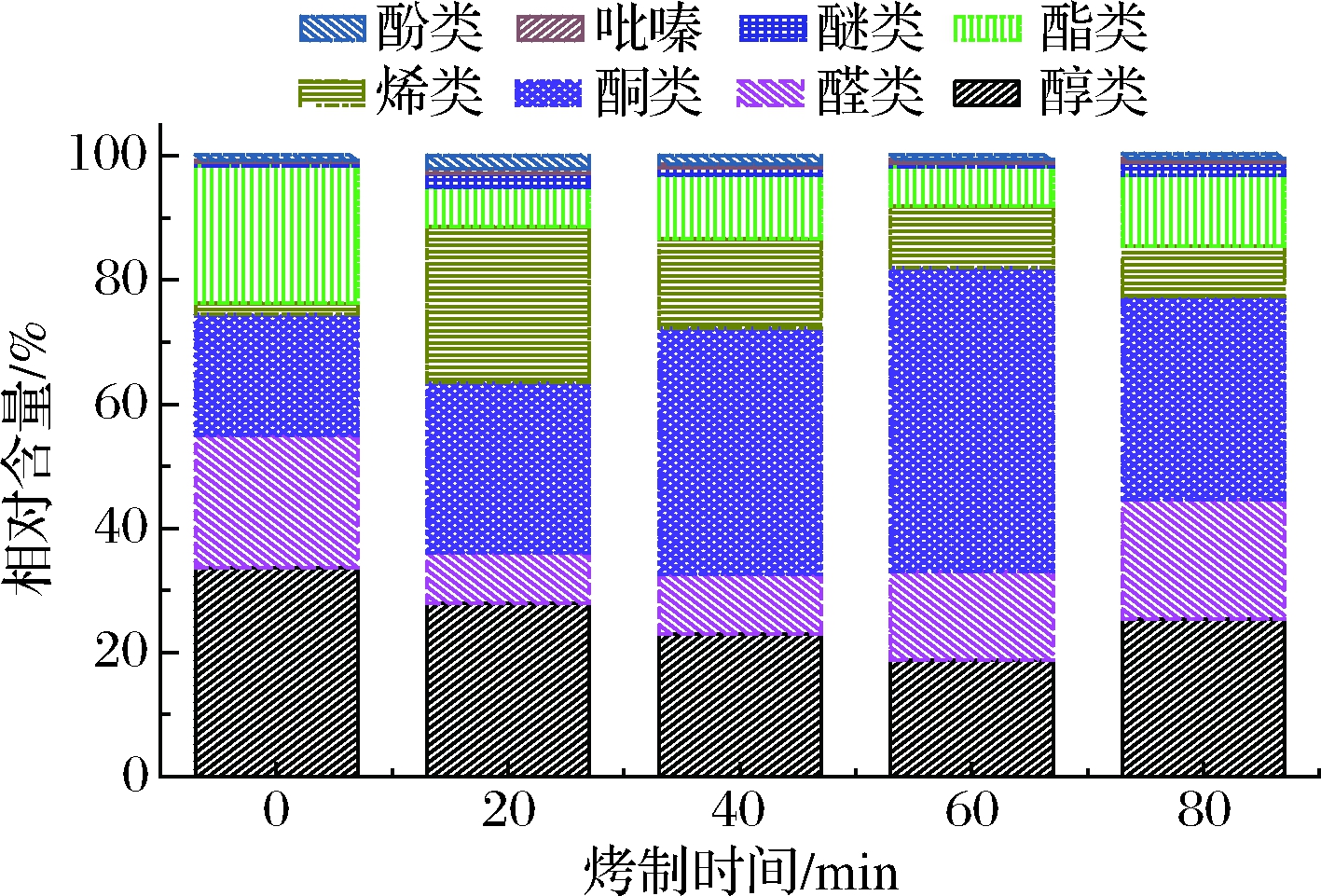
图6 大鲵肉烤制过程中挥发性组分相对含量变化
Fig.6 Fingerprint of volatile organic compounds of giant salamander meat at different roasting time
2.4 OPLS-DA及模型验证
OPLS-DA是一种基于目标成分与样品类别关系模型的统计算法。利用OPLS-DA中的score plot对不同烤制时间下大鲵肉样品中的挥发性有机物质进行分类,结果如图7所示。随机改变分类变量的排列顺序建立相应的模型,图中RX2(cum) =0.966,RY2 (cum) =0.879,当R2和Q2的值处于0.5~1时,表明模型有较好的概括解释率:Q2 (cum) =0.714,表示模型有较好预测能力[21]。

图7 不同烤制时间大鲵肉挥发性成分OPLS-DA得分图
Fig.7 OPLS-DA analysis of giant salamander meat at different roasting time
本研究中模型稳定性和预测性能较好,提示构建的模型稳定性及预测能力均符合要求,可用于区分烤制过程中大鲵肉挥发性风味物质的差异,与徐永霞等[11]在构建海鲈鱼蒸制过程中的OPLS-DA模型参数结果相近。
利用置换检验对OPLS-DA所做的模型进行验证,根据样本数据的随机排列情况进行统计学推断[11,21]。它将样本进行顺序上的置换(permutation test,n=200),重新得出统计检验量,构造经验分布,以此为基础进行建模。图8中Q2代表累计交叉有效性,其值与模型预测能力成正比关系;R2代表累计方差值,表示有多少原始数据被用来建立OPLS-DA判别模型,其值大反映出模型解释变异好[21-22]。对OPLS-DA模型进行拟合,得到RX2=0.966,RY2=0.879,Q2=0.714,提示所建模型拟合效果较好。为了继续验证模型是否存在过拟合,将部分样本类别进行200次的置换拟合,结果见图8-a,图中R2与左边纵轴相交(0,0.718),Q2与左边纵轴相交(0,-0.459),R2和Q2两条回归线斜率相对较大,左边随机排列产生的实验值R2和Q2值均低于最右边的R2和Q2值,且Q2回归线的截距是负数,说明OPLS-DA判别模型无过拟合现象,模型可用于不同烤制时间大鲵肉挥发性成分的分类判别。
通过GC-IMS指纹图谱,将不同烤制时间下的大鲵肉样品43种挥发性化合物的关系进行可视化。依据OPLS-DA模型中的变量重要性(VIP值)将每个变量对分类的贡献进行量化,筛选VIP值>1的挥发性有机物作为潜在的特征风味成分,结果如图8-b所示。图8-b中大鲵肉烤制过程中共有14种特征挥发性风味物质VIP>1,包括醇类4种(丁醇、桉叶油醇单体、戊醇二聚体和2, 3-丁二醇)、醛类3种(己醛二聚体、异戊醛和反-2-戊烯醛)、酮类4种(甲基庚烯酮、2-丁酮、3-戊酮和2-戊酮)、烯类2种(α-葑烯和双戊烯)以及酯类1种(乙酸乙酯)。该结果与徐永霞等[11]利用GC-IMS建立了海鲈鱼蒸制过程中OPLS-DA模型,并通过VIP值确定了11种特征挥发性标志化合物较为相似。
2.5 不同烤制时间大鲵肉特征挥发性风味物质主成分及聚类分析
为直观区分不同烤制时间大鲵肉特征挥发性化合物的变化,对筛选的14种特征性化合物成分进行主成分和聚类分析,结果见图9。主成分分析表明,烤制过程中筛选的14种特征性有机物PC1和PC2,分别为48.7%和33.4%,总和为82.1%,能够解释样本总体的变异[23-25];而且同一烤制时间大鲵肉样品中14种特征风味物质相对聚集,能够较好区分不同烤制时间大鲵肉样品(图9-a)。

a-OPLS-DA拟合曲线;b-VIP值分布
图8 不同烤制时间大鲵肉挥发性成分OPLS-DA 拟合曲线及VIP值分布
Fig.8 OPLS-DA simulation and VIP distribution of giant salamander meat volatile components at different roasting time
通过这些风味化合物的信号强度绘制聚类热图,如图9-b所示。不同烤制时间下大鲵肉样品14种特征挥发性有机物差异,大鲵烤肉风味特征大致分为3类,分别为烤制前(0 min)、烤制初期(20、40 min)、烤制中后期(60、80 min)。未烤制大鲵肉中挥发性特征有机物的种类较少,其中丁醇、异戊醛、乙酸乙酯和戊醇二聚体含量相对较多;烤制初期(20~40 min)特征性有机物种类和含量逐渐增加,其中反-2-戊烯醛、甲基庚烯酮、2,3-丁二醇、桉叶油醇单体、α-葑烯和双戊烯含量明显增加,反-2-戊烯醛、甲基庚烯酮、2,3-丁二醇可能来源于高温下蛋白质、糖类、脂质等成分的聚合、降解反应,而桉叶油醇单体、α-葑烯和双戊烯可能由于香辛料中高温加热挥发造成含量上升[17,19,26]。烤制中后期,其中烤制60 min后14种特征性有机物种类和含量最多,可能由于高温脂肪氧化、美拉德反应等原因产生了较多的挥发性有机化合物[19,27-28],结合烤制过程中实际感官色泽,烤制60 min后色香味相对较好,可作为大鲵烤肉的整体挥发性风味轮廓;烤制80 min后这些物质含量有所下降,伴随一定的感官品质劣变。本研究通过GC-IMS和OPLS-DA模型中变量重要性(VIP值>1)初步筛选了大鲵烤肉14种潜在特征风味物质,但是由于未对其进行定量分析,今后还需要结合GC-MS、GC-O和相对气味活性值深入揭示大鲵肉烤制过程中挥发性风味物质精细变化[15,30]。

a-主成分得分图;b-聚类热图
图9 不同烤制时间大鲵肉特征挥发性物质主成分及 聚类热图分析
Fig.9 PCA score and clustering heatmap of characteristic volatile organic compounds of giant salamander meat at different roasting time
3 结论
采用GC-IMS初步确定了不同烤制时间大鲵肉挥发性风味物质。从大鲵烤肉中共鉴定出43种挥发性有机化合物,包括醇类9种、醛类8种、酮类8种、烯类8种、酯类6种、醚类2种、吡嗪类2种和酚类1种。大鲵肉烤制前以醇类(33.66%)、醛类(21.34%)、酮类(19.54%)和酯类(22.07%)为主,含微量吡嗪类、酚类化合物。与烤制前相比,大鲵肉烤制20 min后,醛类、醇类和酯类含量有所下降,而酮类、烯类、醚类化合物相对含量有所上升;随着烤制时间从20增加到80 min,大鲵肉中醇类、烯类、醚类化合物含量逐渐降低,而酯类、酮类、醛类化合物相对比例逐渐增加。采用OPLS-DA建立了稳定性和预测能力较好的模型,从43种挥发性有机物中筛选出14种潜在特征标志物(VIP>1),包括4种醇类(丁醇、桉叶油醇单体、戊醇二聚体和2, 3-丁二醇)、3种醛类(己醛二聚体、异戊醛和反-2-戊烯醛)、4种酮类(甲基庚烯酮、2-丁酮、3-戊酮和2-戊酮)、2种烯类(α-葑烯和双戊烯)和1种酯类(乙酸乙酯)。主成分分析表明,2个主成分累计贡献率为82.1%,通过这些挥发性成分可进行大鲵肉烤制阶段的区分。
[1] HE D,ZHU W M,ZENG W,et al.Nutritional and medicinal characteristics of Chinese giant salamander (Andrias davidianus) for applications in healthcare industry by artificial cultivation:A review[J].Food Science and Human Wellness,2018,7(1):1-10.
[2] LU C Q,CHAI J,MURPHY R W,et al.Giant salamanders:Farmed yet endangered[J].Science,2020,367(6 481):989.
[3] JIN W G,PEI J J,DU Y N,et al.Characterization and functional properties of gelatin extracted from Chinese giant salamander (Andrias davidianus) skin[J].Journal of Aquatic Food Product Technology,2019,28(8):861-876.
[4] 金文刚,赵萍,金晶,等.基于气相-离子迁移色谱分析大鲵不同可食部位挥发性气味指纹差异[J/OL]. 食品科学: 1-11[2021-01-15].https://kns.cnki.net/kcms/detail/11.2206.TS.20210115.1601.034.html.
JIN W G,ZHAO P,JIN J,et al.Volatile component fingerprint analysis of giant salamander (Andrias davidiauns) from different edible parts based on gas chromatography-ion mobility spectroscopy[J/OL]. Food Science:1-11[2021-01-15].https://kns.cnki.net/kcms/detail/11.2206.TS.20210115.1601.034.html.
[5] 倪冬冬, 李洪军,贺稚非,等.大鲵汤加工过程中营养品质变化规律[J].食品科学,2017,38(20):119-124.
NI D D,LI H J,HE Z F,et al.Changes in nutritional quality during processing of giant salamander soup[J].Food Science,2017,38(20):119-124.
[6] 王苗苗, 罗庆华,王海磊,等.张家界大鲵肌肉营养成分分析[J].营养学报,2015,37(4):411-413.
WANG M M,LUO Q H,WANG H L,et al.Analysis of nutrients components in the muscle of Zhangjiajie giant salamander[J].Acta Nutrimenta Sinica,2015,37(4):411-413.
[7] HU Y F,LI N N,CHEN J R,et al.Effect of chlorine dioxide on quality of giant salamander cutting meats in small modified atmosphere packaging[J].Advance Journal of Food Science and Technology,2016,10(4):302-308.
[8] ZHU W M,JI Y,WANG Y,et al.Structural characterization and in vitro antioxidant activities of chondroitin sulfate purified from Andrias davidianus cartilage[J].Carbohydrate Polymers,2018,196:398-404.
[9] RAMADHAN A H,NAWAS T,ZHANG X W,et al.Purification and identification of a novel antidiabetic peptide from Chinese giant salamander (Andrias davidianus) protein hydrolysate against α-amylase and α-glucosidase[J].International Journal of Food Properties,2017,20:S3 360-S3 372.
[10] 姚文生,马双玉,蔡莹暄,等.基于气相-离子迁移谱技术分析烤羊肉串的挥发性风味成分[J].食品工业科技,2021,42(8):256-263.
YAO W S,MA S Y,CAI Y X,et al.Analysis of volatile flavor substances in mutton shashlik based on GC-IMS technology[J].Science and Technology of Food Industry,2021,42(8):256-263.
[11] 徐永霞,白旭婷,冯媛,等.基于GC-IMS和化学计量学分析海鲈鱼肉蒸制过程中风味物质的变化[J/OL].食品科学:1-11[2021-03-24].https://kns.cnki.net/kcms/detail/11.2206.TS.20210323.1117.030.html.
XU Y X,BAI X T,FENG Y,et al.Changes of flavor compounds in sea bass during steaming process based on GC-IMS and chemometrics[J/OL].食品科学:1-11[2021-03-24].https://kns.cnki.net/kcms/detail/11.2206.TS.20210323.1117.030.html.
[12] 罗佳峰,孙震,何俊,等.腌制及烤制时间对蜜汁烤鸭腿风味物质的影响[J].食品科学,2021,42(18):191-198.
LUO J F,SUN Z,HE J,et al.Effects of curing and roasting time on flavor of honey-roasted duck leg[J].Food Science,2021,42(18):191-198.
[13] 杜超,戚军,姚文生,等.基于气相-离子迁移谱分析反复炖煮过程中鸡肉风味物质的变化规律[J].食品与发酵工业,2020,46(9):265-271.
DU C,QI J,YAO W S,et al.Detection of volatile compounds in re-stewed chicken by GC-IMS[J].Food and Fermentation Industries,2020,46(9):265-271.
[14] QIAN M,ZHENG M Y,ZHAO W H,et al.Effect of marinating and frying on the flavor of braised pigeon[J].Journal of Food Processing and Preservation,2021,45(3):e15219.
[15] CHANG L L,LIN S Y,ZOU B W,et al.Effect of frying conditions on self-heating fried Spanish mackerel quality attributes and flavor characteristics[J].Foods,2021,10(1):98.
[16] CUI Z K,YAN H,MANOLI T,et al.Changes in the volatile components of squid (Illex argentinus) for different cooking methods via headspace-gas chromatography-ion mobility spectrometry[J].Food Science and Nutrition,2020,8(10):5 748-5 762.
[17] 丁丹,王松磊,罗瑞明,等.基于SPME-GC-MS分析不同烤制时间新疆烤羊腿表层及内层挥发性化合物[J].食品科学,2021,42(2):227-234.
DING D,WANG S L,LUO R M,et al.Analysis of volatile compounds in the surface and inner layers of Xinjiang roast lamb leg at different roasting times using SPME-GC-MS[J].Food Science,2021,42(2):227-234.
[18] JIN W G,CHEN X H,GENG J Z,et al.Quality characteristics and moisture mobility of giant salamander (Andrias davidianus) jerky during roasting process[J].Journal of Food Quality,2021,2 021:1-11.
[19] 蔡路昀,马帅,程煊茹,等.不同烤制时间对沙丁鱼片风味及品质的影响[J].水产学报,2016,40(5):785-798.
CAI L Y,MA S,CHENG X R,et al.Effects of different roasting time periods on character and flavor in sardine slices[J].Journal of Fisheries of China,2016,40(5):785-798.
[20] LI M Q,YANG R W,ZHANG H,et al.Development of a flavor fingerprint by HS-GC-IMS with PCA for volatile compounds of Tricholoma matsutake Singer[J].Food Chemistry,2019,290:32-39.
[21] 王珂雯,徐雷,徐贞贞,等.基于液相色谱-四极杆飞行时间质谱方法分析冰鲜鸡肉代谢标志物[J].食品科学,2021,42(16):293-303.
WANG K W,XU L,XU Z Z,et al.Analysis of metabolic markers in chilled chicken based on liquid chromatography-quadruple time-of-flight mass spectrometry[J].Food Science,2021,42(16):293-303.
[22] PUTRI A R,ALIA O-GONZ
O-GONZ LEZ M J,FERREIRO M,et al.Development of a methodology based on headspace-gas chromatography-ion mobility spectrometry for the rapid detection and determination of patin fish oil adulterated with palm oil[J].Arabian Journal of Chemistry,2020,13(10):7 524-7 532.
LEZ M J,FERREIRO M,et al.Development of a methodology based on headspace-gas chromatography-ion mobility spectrometry for the rapid detection and determination of patin fish oil adulterated with palm oil[J].Arabian Journal of Chemistry,2020,13(10):7 524-7 532.
[23] GERHARDT N,BIRKENMEIER M,SANDERS D,et al.Resolution-optimized headspace gas chromatography-ion mobility spectrometry (HS-GC-IMS) for non-targeted olive oil profiling[J]. Analytical and Bioanalytical Chemistry,2017,409(16):3 933-3 942.
[24] WANG F,GAO Y Q,WANG H B,et al.Analysis of volatile compounds and flavor fingerprint in Jingyuan lamb of different ages using gas chromatography-ion mobility spectrometry (GC-IMS)[J].Meat Science,2021,175:108449.
[25] JIA S L,LI Y,ZHUANG S,et al.Biochemical changes induced by dominant bacteria in chill-stored silver carp (Hypophthalmichthys molitrix) and GC-IMS identification of volatile organic compounds[J].Food Microbiology,2019,84:103248.
[26] 赵萍,陈小华,刘俊霞,等.生姜/料酒脱腥过程中大鲵肝挥发性有机物动态变化[J/OL].食品与发酵工业:1-12[2021-06-17].https://doi.org/10.13995/j.cnki.11-1802/ts.027769.
ZHAO P,CHEN X H,LIU J X,et al.Dynamic changes of volatile organic compounds in giant salamander (Andrias davidiauns) liver during ginger/cooking wine deodorization[J/OL].Food and Fermentation Industries:1-12[2021-06-17].https://doi.org/10.13995/j.cnki.11-1802/ts.027769.
[27] YAO W S,CAI Y X,LIU D Y,et al.Comparative analysis of characteristic volatile compounds in Chinese traditional smoked chicken (specialty poultry products) from different regions by headspace-gas chromatography-ion mobility spectrometry[J].Poultry Science,2020,99(12):7 192-7 201.
[28] ZHANG Q,DING Y C,GU S Q,et al.Identification of changes in volatile compounds in dry-cured fish during storage using HS-GC-IMS[J].Food Research International,2020,137:109339.