矿物油是原油经过物理分离(蒸馏、萃取)和化学转化(加氢反应、裂解、烷基化和异构化)过程形成的碳数为10~50的烃类混合物,主要包括直链、支链及环状的饱和烃矿物油(mineral oil saturated hydrocarbons,MOSH)和聚芳烃化合物组成的芳香烃矿物油(mineral oil aromatic hydrocarbons,MOAH)2类[1]。矿物油在生产、生活中的用途十分广泛,可用作油墨、涂料的溶剂、农药的乳化剂、食品和化妆品的生产助剂、机械润滑剂等[2]。矿物油用途广泛从而导致食品污染的来源丰富。食品接触材料,尤其是残留在回收纸、再生纸包装中的印刷油墨,这部分的矿物油向干性食品中的迁移量最高可达到100 mg/kg[3];食品生产助剂使用的食品级白油,如面包脱模剂、口香糖的胶姆糖基础剂、水果的表面处理剂等。有研究发现,甜面包中矿物油的残留量为910 mg/kg[4]。食品原材料收割、晾晒、加工过程中接触到的发动机润滑油、未完全燃烧的汽油、沥青碎屑等也是食品中矿物油的来源。矿物油毒理学研究发现,人体皮下脂肪、淋巴结、脾脏、肝脏、肺、肾脏等器官中均含有相当数量的MOSH,其中以淋巴结和脾脏中MOSH含量最高[5]。欧洲食品安全局的研究显示,MOSH(C16~C35)经膳食摄入后在体内积聚,会导致淋巴结、脾脏和肝脏等器官产生肉芽肿和慢性炎症。有研究发现,MOSH是人体内累积量最大的污染物[6],其主要来源于食物摄入。因此,食品中MOSH的污染物值引起人们关注[7]。
近年来,多起巧克力中矿物油检出事件被社会所关注。因此,加强巧克力中MOSH的监测非常必要。MOSH化学组成复杂,分为直链或支链烷烃矿物油。氢火焰离子化检测器(gas chromatography-flame ionization detection,GC-FID)因其对碳响应特点成为目前MOSH定量测定的首选方法。然而,单纯使用GC-FID,其选择性差、灵敏度偏低,且需要净化与富集目标物[8]。目前,液相色谱与气相色谱联用(LC-GC)是最高效的矿物油分析技术,它通过接口技术实现LC与GC的在线净化、富集,有效提高了信噪比和灵敏度[9-11]。但LC-GC仪器组装繁琐且使用维护成本高,难以批量普及。固相萃取(solid-phase extraction,SPE)净化技术成为常用的解决途径[12-15]。
本实验采用SPE-GC-FID建立巧克力中MOSH的检测方法,其创新之处在于:(1)采用了操作简便的SPE柱净化方法并优化了净化条件;(2)根据巧克力前处理的干扰情况,选择了合适的内标[环己基环己烷(bicyclohexyl,Cycy)]进行准确定量。该方法操作简便、实验条件要求不高,适用于巧克力中MOSH含量的日常检测。
1 材料与方法
1.1 材料与试剂
8个巧克力样品,市购;正己烷、丙酮(均为色谱纯),美国Fisher Scientific公司;硅胶(160~200目)、10%硝酸银硅胶(160~200目),日本wako公司;MOSH标准溶液,德国Dr.E公司;Cycy、胆甾烷(5-α-cholestane,Cho)、C8~C40正构烷烃混合标准溶液,美国Sigma公司。
1.2 仪器与设备
GC—2030气相色谱仪(配备FID),日本Shimadzu公司;EVA50A氮气吹干仪,北京普立泰科仪器有限公司;Milli-Q超纯水设备,美国Millipore公司;KS501振荡器,德国IKA公司;N1000旋转蒸发仪,日本EYELA公司。
1.3 实验方法
1.3.1 标准品配制
标准储备溶液:分别准确称取MOSH、Cho、Cycy标准品10 mg,由正己烷定容至10 mL,得到1 000 mg/L标准储备液。
标准中间溶液:分别准确移取上述1 mL标准储备液于10 mL容量瓶中,用正己烷定容,得到100 mg/L标准中间溶液。
标准工作溶液:分别移取100 mg/L MOSH标准中间溶液 10、100、200、500、800 μL,用990、900、800、500、200 μL正己烷定容至1 mL。即得到1、10、20、50、80 mg/L工作标准溶液。
1.3.2 样品提取
准确称取巧克力样品2.0 g于50 mL具塞锥形瓶中,加入50 μL 100 mg/L Cycy内标溶液,20 mL正己烷溶剂,振荡1 h后静置过夜。取10 mL上清液用旋转蒸发仪浓缩至0.5 mL,用正己烷定容至1 mL待用。
1.3.3 样品净化
1.3.3.1 0.3%硝酸银硅胶制备
称取97 g硅胶于500 mL铝箔纸包裹外壁的圆底烧瓶中,再加入3 g质量分数10%硝酸银硅胶,然后用旋蒸仪继续混匀3 h,后放入115~120 ℃烘箱干燥12 h。即得到0.3%硝酸银硅胶,于干燥器内避光保存,2周内使用。
1.3.3.2 SPE柱制备及净化
取10 mL玻璃注射器,外部用铝箔纸包裹避光,底部放入尺寸合适的经正己烷浸泡的玻璃纤维滤纸,装填3 g 0.3%硝酸银硅胶,敲实排出气泡,上面再放入1层滤纸。用10 mL正己烷预淋洗SPE柱,弃去流出液,待液面接近硝酸银硅胶填料时,加入浓缩液(1.3.2),待浓缩液接近硝酸银硅胶填料约1 mm时,用5 mL正己烷洗脱并开始接收,待液面接近硝酸银硅胶填料,加入5 ml正己烷。收集上述洗脱液后,在40 ℃下浓缩至约0.5 mL,待测。
1.3.4 色谱条件
色谱柱:Agilent DB-5石英毛细管柱(30 m×0.32 mm×0.25 μm);载气为高纯氮气,柱流量1.5 mL/min;进样量2 μL。进样口温度275 ℃;GC分析条件:起始温度50 ℃,然后以2.5 ℃/min升温至60 ℃,再 以22 ℃/min升温至280 ℃,然后以30 ℃/min升温至320 ℃保持12 min;FID条件:检测器温度350 ℃,氢气流量30 mL/min,空气流量 300 mL/min,补偿气为氮气,流量为25 mL/min
2 结果与分析
2.1 提取溶剂的选择
MOSH属于非极性有机物,常用石油醚、乙醚、正己烷等溶剂利用相似相溶原理进行提取。但石油醚是一类混合物,有可能引入对MOSH检测有影响的物质;乙醚具有较强的毒性,本实验中有大量浓缩操作,乙醚蒸气可能对实验人员健康和实验环境带来不良影响,因此最终选取正己烷作为样品中MOSH的提取溶剂。在通常的油脂提取中会采用酸水解法,打破乳脂油膜,将巧克力中的油脂提取出来。但巧克力中的MOSH主要源于加工、包装等操作带来的外部引入。因此,本实验采用正己烷浸泡过夜法对巧克力中MOSH进行提取[16]。
2.2 净化填料的选择
针对巧克力提取溶液中主要干扰物为非极性油脂,含有大量的脂肪及萜烯类等物质,选取极性较强的硅胶填料可以达到较好的净化效果。硅胶经过高温活化后不仅可以增强吸附能力,还能够消除其他可能的干扰。硝酸银硅胶是在硅胶的基础上络合 AgNO3所形成,它基于 AgNO3与含有双键(或不饱和键)的物质结合形成配合物,且不同物质形成的配合物的稳定系数不同,通过不同极性的洗脱溶剂洗脱,从而达到分离的目的,其较硅胶而言保留含不饱和键的极性干扰物的能力更强[17],含有硝酸银的硅胶对角鲨烯等烯烃干扰物有良好的净化效果[13]。因此,采用硝酸银硅胶作为SPE柱填料用于吸附巧克力提取液中的油脂和烯烃,从而达到净化的目的。
2.3 硅胶填料中硝酸银含量的优化
硅胶填料中硝酸银的含量对SPE柱的净化效果有直接的影响,但目前对食品中矿物油组分进行净化的SPE柱还未商品化。本实验对0.3%、0.5%、1.0% 3种不同硝酸银含量的硅胶的净化效果进行对比。比较了3种不同填料对油脂的净化能力。将0.2 mL混合标准溶液加入巧克力提取液中经浓缩后定容至1 mL,分别上样至3种硝酸银含量的硅胶SPE柱中,采用正己烷洗脱,分别接收1 mL洗脱液,随后注入GC分析。结果表明,在3种不同SPE柱上的饱和矿物油的回收率差异不显著(图1),都能满足巧克力的净化要求。而硝酸银含量高的硅胶柱更容易受光照的影响,对避光条件和实验操作的要求更高,因此选择使用0.3%硝酸银硅胶为净化填料。
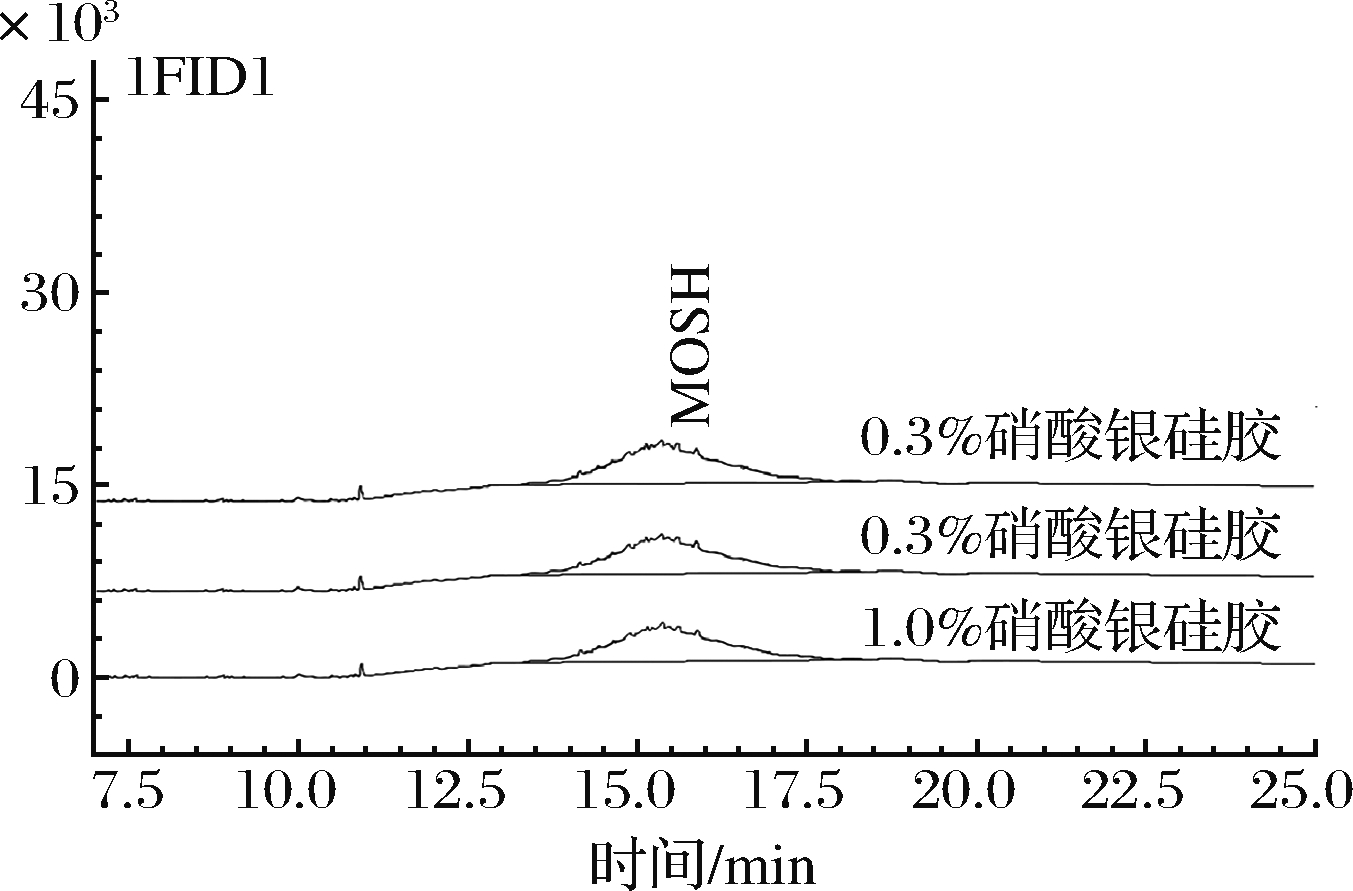
图1 不同硝酸银含量对回收率的影响
Fig.1 Effect of silver nitrate content on recovery
2.4 洗脱体积的优化
在确定了硝酸银质量分数以后,本实验通过使用MOSH和Cho混合标准工作溶液,来考查不同洗脱液体积对MOSH回收率和MOSH标记物(Cho)的流出情况(图2)。
由图2可知,当用2 mL正己烷洗脱时,MOSH和Cho均没有回收;当用4 mL正己烷洗脱时,矿物油的回收率增加到27%,Cho回收率为3%;当用6 mL正己烷洗脱时,矿物油的回收率为48%,Cho回收率为15%;当用8 mL正己烷洗脱时,矿物油的回收率为85%,Cho回收率为36%;当用10 mL正己烷洗脱时,矿物油的回收率为93%,Cho回收率为68%,标志着MOSH部分已经基本全部洗脱下来;之后随着正己烷洗脱体积的增加(12 mL与14 mL),矿物油的回收率与使用10 mL正己烷洗脱液时差异不大,但Cho的流出量显著增加。考虑到增加洗脱体积会使其他弱极性干扰物增加。因此最终采用10 mL正己烷洗脱。
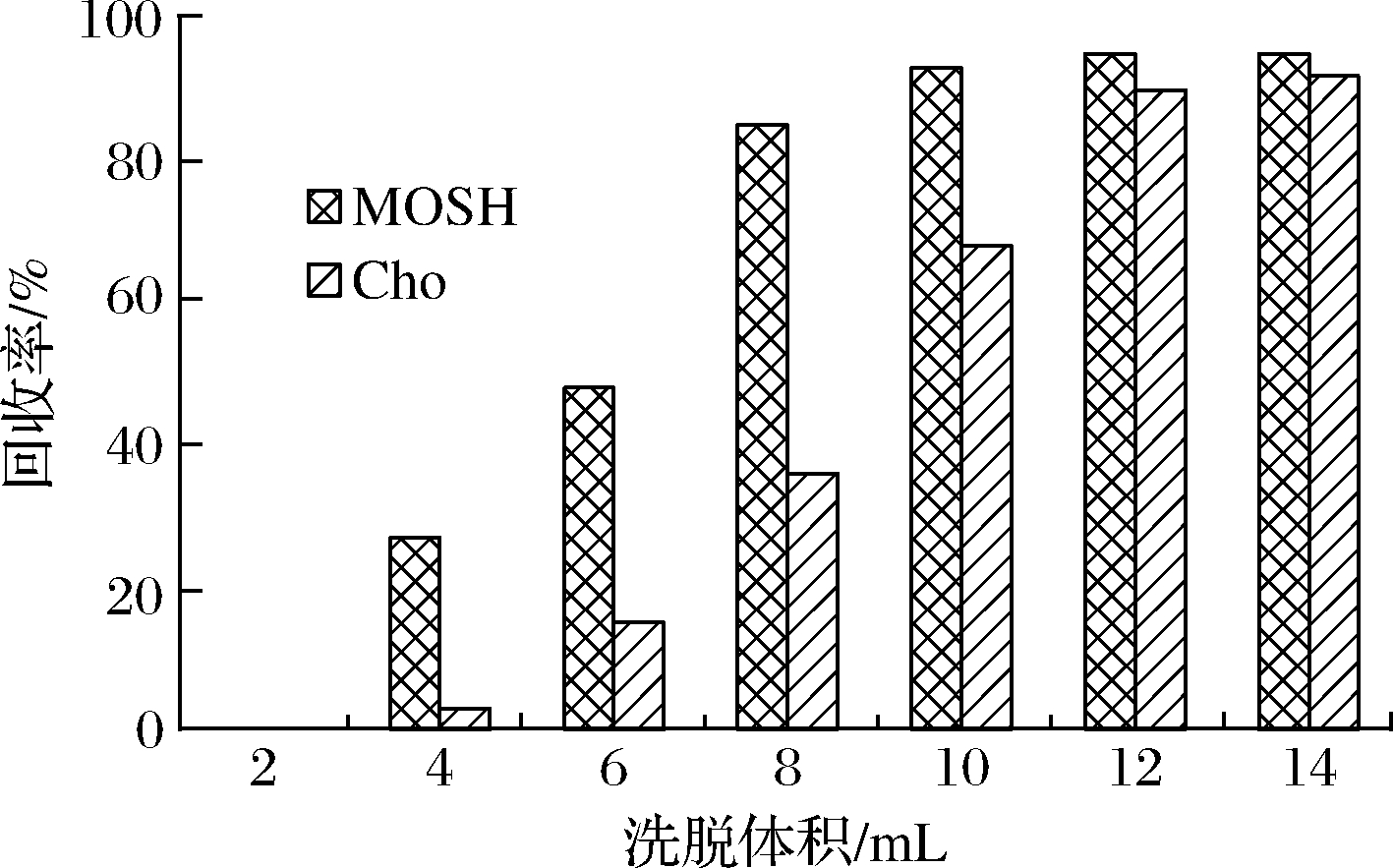
图2 洗脱体积对MOSH与Cho回收率的影响
Fig.2 Effect of different elution volumes on MOSH and Cho recoveries
2.5 仪器条件的优化
2.5.1 GC升温速率的优化
MOSH的谱图是1个“驼峰”式的宽峰,具有较长的保留时间。为了提高宽峰的高度,以便更好的定量。通常采用较快的程序升温速率,使色谱峰更为“尖锐”,以提高灵敏度。文献中大多采用的升温速率为20~25 ℃/min,有的高达50 ℃/min[16]。为了保持谱图的基线稳定,同时使正构烷烃C8~C40较为合理的分布在整个色谱图中,本实验优化GC的升温程序为:起始温度50 ℃,然后以2.5 ℃/min升温至60 ℃,再以22 ℃/min升温至280 ℃,然后以30 ℃/min升温至320 ℃保持12 min。
2.5.2 定量方法的优化
由于矿物油作为一种混合物,峰形比较宽大,容易受到样品制备和进样过程的影响。因此使用内标法可以有效减少上述因素的影响。选取1个合适的内标对定量有较大的影响。内标法要求内标物应不受被测样品干扰,保留时间相近又可以完全分离。经过研究,当选取Cycy作为巧克力提取液中MOSH的定量内标时,样品的共流出干扰物较少。
同时由于矿物油的“驼峰”形态,导致对色谱峰积分的起始时间要求很高。需要建立确定的积分条件才能保证定量结果的准确性和再现性。MOSH的中低黏度部分对人体的危害最大,也是主要关注的部分。因此,本实验采用正构烷烃(n-C8~C40)中C16和C35的保留时间作为MOSH峰积分的起点和终点。从而使定量结果获得较好的准确性和可操作性(图3~图5)。
2.6 方法学考察
2.6.1 线性范围
将1.3.1节配制的MOSH系列工作溶液,在1.3.4节条件下分析。以GC谱图中的峰面积(y)与相应质量浓度(x)绘制曲线,所得标准曲线为y=65 878.4x-57 113.2,相关系数0.999,说明MOSH在1~80 mg/L质量浓度内线性关系良好。
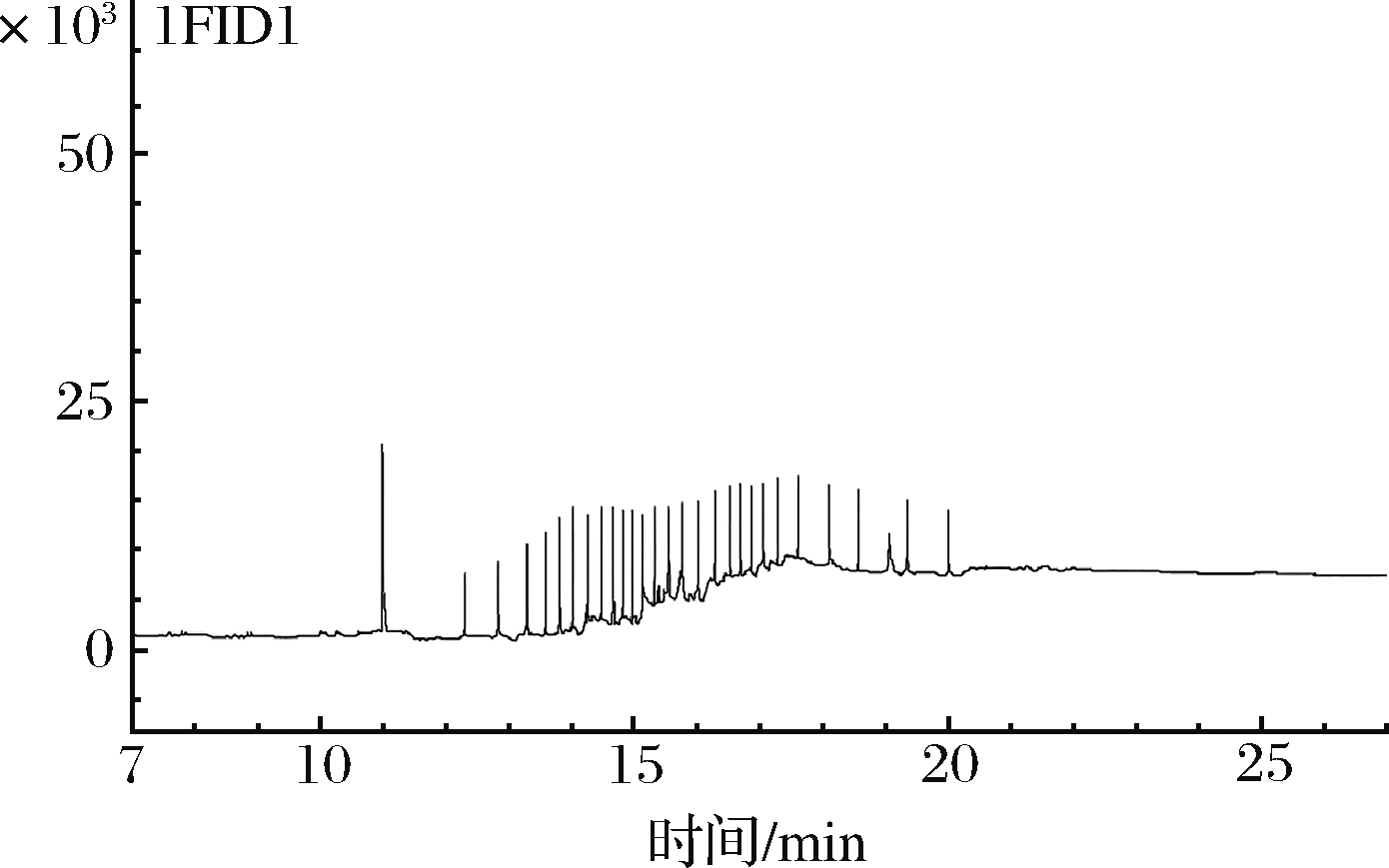
图3 空白样品气相谱图
Fig.3 GC chromatogram of blank sample
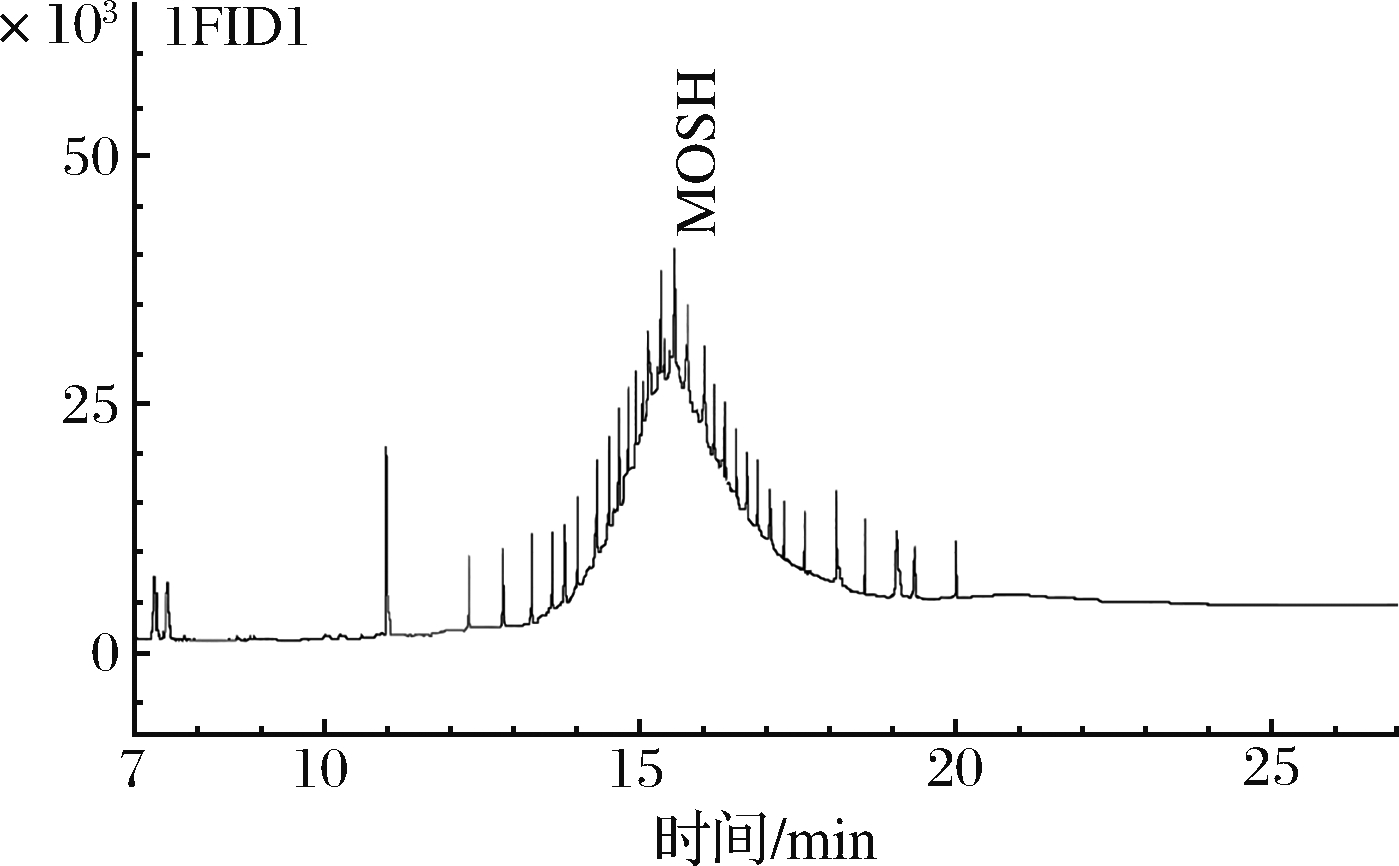
图4 标准样品中饱和矿物油气相谱图
Fig.4 GC chromatogram of MOSH in standard sample
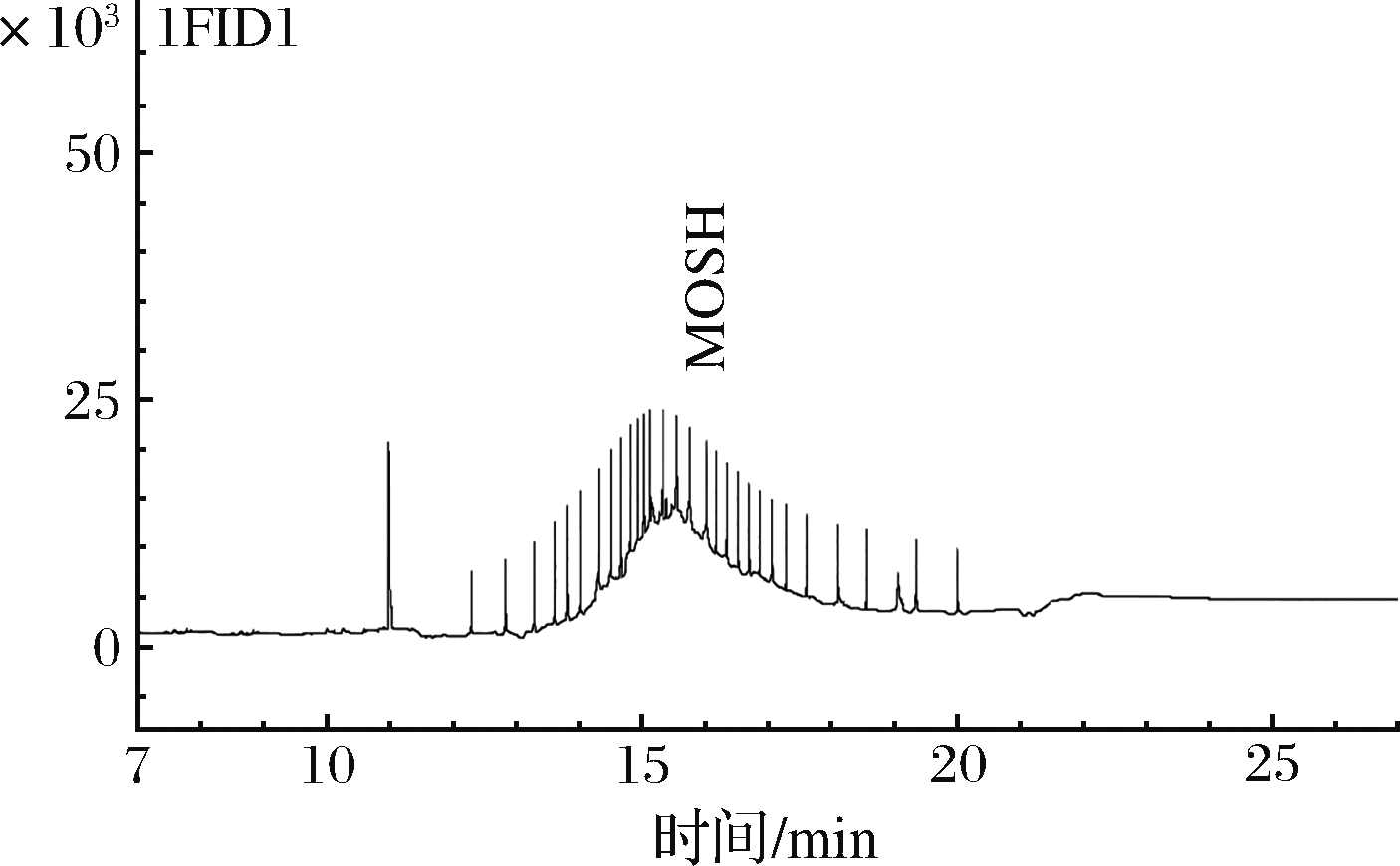
图5 实测样品中饱和矿物油气相谱图
Fig.5 GC chromatogram of MOSH in test sample
2.6.2 定量限(limit of quantification, LOQ)
本实验将2.0 g巧克力用20 mL正己烷提取,分别取10 mL提取液浓缩至1 mL,上样至SPE柱净化,用10 mL洗脱液洗脱并浓缩至0.5 mL,注入GC-FID分析的体积为2 μL,因此对应的巧克力中MOSH的LOQ为0.5 mg/kg。
2.6.3 回收率
选取巧克力作为样品基质,分别添加MOSH标准溶液进行回收率实验,添加量为0.5、2.0、20.0 mg/kg。提取液经0.3%硝酸银浸渍硅胶SPE柱净化,每个试样及空白分别平行测定5次,计算平均加标回收率和相对标准偏差(relative standard deviation,RSD)(表1)。结果表明,加标回收率为90%~99%,相对标准偏差为6.1%~9.9%,该方法的回收率和相对标准偏差均符合检测要求。
表1 MOSH的回收率和相对标准偏差(n=5)
Table 1 Recovery and relative standard deviation of MOSH(n=5)

样品添加浓度/(mg·kg-1)添加回收率测定值范围/(mg·kg-1)平均回收率/%RSD/%0.50.40~0.51909.9巧克力21.79~2.08956.12018.1~21.5996.4
2.7 实际样品检测
采用上述方法检测了市售不同厂家与品牌巧克力中MOSH含量。结果如表2所示,8 个巧克力中只有样品1、2和6未检出MOSH,其余5个样品的MOSH含量在1.2~5.1 mg/kg。按照联合国粮农组织和世界卫生组织食品添加剂联合专家委员会规定的中低黏度矿物油(Ⅱ类和Ⅲ类)的每日容许摄入量(acceptable daily intake,ADI)0.01 mg/kg BW估算[18-19],1个体重60 kg的成年人每日允许摄入MOSH的上限是0.6 mg。2014年,德国联邦食品及农业部建议,碳链长度介于C20~C35的MOSH在食品中迁移量不应超过2 mg/kg;其他研究者认为C20~C35的MOAH迁移量不应超过0.5 mg /kg[13];然而目前国内暂无MOSH在巧克力中的最大残留限量,仅GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中规定在除胶基糖果以外的其他糖果和鲜蛋中用于被膜剂的食品级白矿物油的最大使用量为5 g/kg。按照上述检出MOSH的巧克力的含量计算,每日允许摄入的上述巧克力的质量在0.12~0.5 kg。由于目前我国居民的膳食摄入统计中尚无巧克力类食品的数据,但估计上述巧克力摄入量高于日常摄入量,巧克力中MOSH对成人的危害较小。但食品中MOSH来源广泛[20],本次检测的巧克力数量较少,尚不能代表巧克力中MOSH的实际残留水平,同时MOSH对婴幼儿等特殊人群的危害研究尚少。所以进一步加大巧克力的检测范围与数量,对掌握我国市售巧克力中MOSH情况十分必要,对巧克力中存在的MOSH应引起进一步关注。
表2 不同巧克力中的 MOSH 含量 单位:mg/kg
Table 2 MOSH content in different chocolate
MOSH样品1样品2样品3样品4样品5样品6样品7样品8MOSH (n-C16~C35)<0.5<0.52.01.25.1<0.51.62.3
3 结论与讨论
本实验建立了一种硝酸银硅胶SPE柱净化,采用优化后的程序升温 GC-FID法测定巧克力中MOSH的检测方法。其结果满足方法学与相关控制标准的要求。本方法操作简单、成本低,适用于实验室对巧克力中MOSH的检测。用本方法测定了8个市售巧克力中MOSH的含量,结果表明,仅有3个样品未检出,其中25%的巧克力中MOSH(C16~C35)的含量超过了德国联邦食品及农业部建议迁移量,因此建议相关部门加强巧克力中矿物油污染物的监管。
[1] World Health Organization.Evaluation of certain food additives[J].World Health Organization Technical Report Series,2012(974):1-183.
[2] 李克亚, 王志伟,胡长鹰.食品及食品包装纸中矿物油的研究进展∥“食品工业新技术与新进展” 学术研讨会暨 2014 年广东省食品学会年会论文集[C].广州:广东省食品学会,2014:81-85.
LI K Y,WANG Z W,HU C Y.Research progress of mineral oil in food and food packaging paper∥“New Technology and New Progress in Food Industry” Symposium and Proceedings of the 2014 Guangdong Food Association Annual Conference[C].Guangzhou:Guangdong Food Association,2014:81-85.
[3] BIEDERMANN M,UEMATSU Y,GROB K.Mineral oil contents in paper and board recycled to paperboard for food packaging[J].Packaging Technology and Science,2011,24(2):61-73.
[4] BIEDERMANN M,GROB K.How “white” was the mineral oil in the contaminated Ukrainian sunflower oils[J].European Journal of Lipid Science and Technology,2009,111(4):313-319.
[5] BARP L,KORNAUTH C,WÜGER T,et al.Mineral oil in human tissues,Part I:Concentrations and molecular mass distributions[J].Food and Chemical Toxicology,2014,72:312-321.
[6] GROB K.Update on recycled paperboard and its compliance for food contact[J].Journal Für Verbraucherschutz und Lebensmittelsicherheit,2014,9(3):213-219.
[7] VOLLMER A,BIEDERMANN M,GRUNDBÖCK F,et al.Migration of mineral oil from printed paperboard into dry foods:survey of the German market[J].European Food Research and Technology,2011,232(1):175-182.
[8] 武彦文, 王颖,李冰宁,等.定量分析食品中的矿物油污染物[J].食品安全质量检测学报,2015,6(6):2 145-2 150.
WU Y W,WANG Y,LI B N,et al.Quantitative analysis of mineral oil hydrocarbons in food[J].Journal of Food Safety & Quality,2015,6(6):2 145-2 150.
[9] MORET S,GROB K,CONTE L S.On-line high-performance liquid chromatography-solvent evaporation - high-performance liquid chromatography - capillary gas chromatography - flame ionisation detection for the analysis of mineral oil polyaromatic hydrocarbons in fatty foods[J].Journal of Chromatography A,1996,750(1-2):361-368.
[10] BARP L,PURCARO G,MORET S,et al.A high-sample-throughput LC-GC method for mineral oil determination[J].Journal of Separation Science,2013,36(18):3 135-3 139.
[11] PURCARO G,ZOCCALI M,TRANCHIDA P Q,et al.Comparison of two different multidimensional liquid-gas chromatography interfaces for determination of mineral oil saturated hydrocarbons in foodstuffs[J].Analytical and Bioanalytical Chemistry,2013,405(2-3):1 077-1 084.
[12] MORET S,BARP L,GROB K,et al.Optimised off-line SPE-GC-FID method for the determination of mineral oil saturated hydrocarbons (MOSH) in vegetable oils[J].Food Chemistry,2011,129(4):1 898-1 903.
[13] MORET S,BARP L,PURCARO G,et al.Rapid and sensitive solid phase extraction-large volume injection-gas chromatography for the analysis of mineral oil saturated and aromatic hydrocarbons in cardboard and dried foods[J].Journal of Chromatography A,2012,1 243:1-5.
[14] FISELIER K,GRUNDBÖCK F,SCHÖN K,et al.Development of a manual method for the determination of mineral oil in foods and paperboard[J].Journal of Chromatography A,2013,1 271(1):192-200.
[15] 安红梅, 柯润辉,刘秀,等.固相萃取结合气相色谱-火焰离子化检测器分析面包中饱和烃类矿物油[J].食品与发酵工业,2016,42(1):152-156.
AN H M,KE R H,LIU X,et al.Research on the determination of mineral oil saturated hydrocarbons (MOSH) in bread by SPE-GC-FID[J].Food and Fermentation Industries,2016,42(1):152-156.
[16] BIEDERMANN M,GROB K.On-line coupled high performance liquid chromatography-gas chromatography for the analysis of contamination by mineral oil.Part 1:Method of analysis[J].Journal of Chromatography A,2012,1 255:56-75.
[17] FIORINI D,FISELIER K,BIEDERMANN M,et al.Contamination of grape seed oil with mineral oil paraffins[J].Journal of Agricultural and Food Chemistry,2008,56(23):11 245-11 250.
[18] WHO.Evaluation of certain food additives[R].Geneva:WHO,2002.
[19] FAO/WHO.Summary of evaluations performed by the joint FAO/WHO expert committee on food additives[J]. Nutrition Reviews,2000,58(3):90.
[20] 杨春艳, 柯润辉,安红梅,等.食品中烃类矿物油的污染情况及迁移研究进展[J].食品与发酵工业,2017,43(2):258-264.
YANG C Y,KE R H,AN H M,et al.Research progress on contamination and migration of mineral oil hydrocarbons in food[J].Food and Fermentation Industries,2017,43(2):258-264.