低聚异麦芽糖(isomaltooligosaccharides,IMOs)是一类功能性低聚糖,由2~10个α-1、6-糖苷键连接的葡萄糖基组成[1],包括异麦芽糖、潘糖、异麦芽三糖等主要功能成分[2]。IMOs可促进双歧杆菌和乳杆菌等益生菌在人体肠道中的增殖[3],调节肠道菌群;有低热量值[4],促进胃肠蠕动,改善便秘和脂质代谢[5-6],防龋齿等功能,因此,IMOs被广泛用作益生素、食品添加剂和饲料成分[7-8]。
目前,一般通过酶促转化的方法生产IMOs,利用α-淀粉酶、β-淀粉酶、普鲁兰酶和葡萄糖苷酶[9]从淀粉中催化生产,其典型的生产过程通常包括3个步骤:一是液化,其中淀粉被耐热α-淀粉酶液化产生低聚糖和糊精;二是糖化,低聚糖和糊精被β-淀粉酶和普鲁兰酶等糖化酶糖化;三是转糖基化,α-葡萄糖苷酶(EC 3.2.1.20)可催化葡萄糖从底物的非还原末端释放,并将葡萄糖基残基转移到非还原葡萄糖单位的6—OH基团,产生IMOs[10-11]。目前,商业α-淀粉酶、β-淀粉酶和普鲁兰酶等的研究及工业应用较为成熟,而工业上应用的α-葡萄糖苷酶大多来源于黑曲霉(Aspergillus niger),由于热稳定性差、反应速率不高和酶纯化及回收利用成本高等问题,限制了α-葡萄糖苷酶在规模化生产IMOs上的应用。
随着工业应用前景的日益增长,α-葡萄糖苷酶作为工业化生产IMOs的关键酶制剂,在高效合成IMOs的过程中,发挥着提高催化效率和降低生产成本的重要作用,因而受到学者的广泛关注,因此本文对α-葡萄糖苷酶的来源、性质、分类和催化机制进行了阐述,重点阐述了α-葡萄糖苷酶高效合成IMOs策略方面的研究进展,以期为高效清洁工业化生产IMOs提供思路。
1 α-葡萄糖苷酶的来源和性质
α-葡萄糖苷酶在自然界中分布广泛,生物体内存在多种α-葡萄糖苷酶,可存在于细胞内、细胞外或作为细胞结合酶,在很大程度上影响植物淀粉代谢和动物糖原代谢, 对维持生物体的正常生理功能起着重要作用。除具有水解活性外,一些α-葡萄糖苷酶还具有转糖基化活性[8, 12-13],产生功能性IMOs。
学者从各种动物、植物、微生物(细菌和真菌)中分离和表征了α-葡萄糖苷酶,其中绝大多数来源于微生物,少数来源于动物和植物(见表1)。不同来源的α-葡萄糖苷酶的特性存在较大的差异,其相对分子质量一般在50 k~145 kDa,大多数是单体、二聚体,但也有少数以三聚体或四聚体存在,如腾冲嗜热厌氧菌(T.tengcongensis)来源的α-葡萄糖苷酶[14](三聚体,285 kDa),交枝顶孢霉(A.implicatum)来源的α-葡萄糖苷酶[15](四聚体,440 kDa)等;α-葡萄糖苷酶的等电点(pI)一般在3.0~5.0,最适pH值在4.5~6.0,但也有少数极端微生物来源的α-葡萄糖苷酶的最适pH值高于6.0,如深海交替假单胞菌(Pseudoalteromonas sp.)来源的α-葡萄糖苷酶的最适pH值为8.5[16],深海地芽孢杆菌(Geobacillus)来源的α-葡萄糖苷酶的最适pH值为9.0[17];α-葡萄糖苷酶水解的最适温度一般在50 ℃以下,而嗜热菌来源的α-葡萄糖苷酶的耐热性一般可超过60 ℃[18-20]。
2 α-葡萄糖苷酶的分类和催化机制
α-葡萄糖苷酶根据底物特异性分为3类,Ⅰ型α-葡萄糖苷酶偏好水解多种异质底物(如蔗糖和芳基-α-葡萄糖苷);Ⅱ型α-葡萄糖苷酶在水解同质底物上更活跃(主要底物为麦芽糖、异麦芽糖),对异质底物的活性较低;Ⅲ型α-葡萄糖苷酶类似于Ⅱ型,但可水解长链底物(如多糖和淀粉)[13]。大多数细菌的α-葡萄糖苷酶属于Ⅰ型葡萄糖苷酶[21],来自各种真菌的主要属于Ⅱ型[22],而来自植物的大都属于Ⅲ型,但也有少数例外,如YAN等[23]研究发现来自樟绒枝霉(M.cinnamonmea)的α-葡萄糖苷酶可水解对硝基苯-α-D-葡萄糖苷(pNPGlu)、异麦芽糖、潘糖和蔗糖,属于Ⅰ型酶;来自爪哇毛霉(M.javanicus)[24]的α-葡萄糖苷酶对淀粉和麦芽糖的水解活性都很强,属Ⅲ型酶。
表1 已发现的产α-葡萄糖苷酶的生物
Table 1 Organisms with α-glucosidase producing ability

类别分类名称动物致倦库蚊(Culex quinquefasciatus)、草地贪夜蛾(Spodoptera frugiperda)、花斑海兔(Aplysia fasciata)、虾夷扇贝(Patinopecten yessoensis)、桑蚕(Bombyx mori)、梨形四膜虫(Tetrahymena pyriformis)、小蜜蜂(Apis florea)微生物霉菌黑曲霉(Aspergillus niger)、淡紫拟青霉(Paecilomyces lilacinus)、爪哇毛霉(Mucor javanicus)、构巢曲霉(Aspergillus nidu-lans)、米曲霉(Aspergillus oryzae)、红色红曲菌(Monascus ruber)、樟绒枝霉(Malbranchea cinnamomea)、柄孢霉(Podospora anserina)、交枝顶孢霉(Acremonium implicatum)酵母酿酒酵母(Saccharomyces cerevisiae)、白假丝酵母(Candida albicans)、扣囊复膜酵母菌(Saccharomycopsis fibuligera)、法夫酵母(Xanthophyllomyces dendrorhous)、卡尔酵母(Saccharomyces carlsbergensis)、梅奇酵母(Metschnikowia spp.)细菌阪崎肠杆菌(Enterobacter sakazakii)、海栖热袍菌(Thermotoga maritim)、腾冲嗜热杆菌(Thermoanaerobacter tengcongensis)、多形拟杆菌(Bacteroides thetaiotaomicron)、假交替单胞菌属(Pseudoalteromonas sp.)、嗜热脂肪地芽孢杆菌(Geobacillus stearothermophilus)、青春双歧杆菌(Bifidobacterium adolescentis)、热产硫化氢高温厌氧杆菌(Thermoanaerobacter thermo-hydrosulfuricus)、地衣芽孢杆菌(Bacillus licheniformis)、嗜热厌氧乙醇杆菌(Thermoanaerobacter ethanolicus)、疏棉状嗜热丝孢菌(Thermomyces lanuginosus)、肠膜明串珠菌(Leuconostoc mesentcroides)、枯草芽孢杆菌(Bacillus subtilis)古细菌超嗜热硫化叶菌(Sulfolobus tokodaii)、极端嗜热菌(Thermus thermophilus)、超嗜盐古细菌(Haloquadratum walsbyi)、硫矿硫化叶菌(Sulfolobus solfataricus)植物花状湿地藓(Hyophilla nymaniana)、水稻种子、大麦、葡萄
根据结构分类,α-葡萄糖苷酶可分为5种糖苷水解酶(glycoside hydrolase, GH)家族:GH4、GH13、GH31、GH63和GH97[25]。家族GH13中超过850 000个蛋白作用于含α-葡萄糖苷键的底物,包括α-淀粉酶、环糊精葡萄糖转移酶、普鲁兰酶、α-葡萄糖苷酶和寡糖-1,6-葡萄糖苷酶。根据结构分类,Ⅰ型α-葡萄糖苷酶属于糖苷水解酶GH13家族,而Ⅱ型和Ⅲ型是GH31家族成员[26]。
糖苷酶根据催化作用机制的不同可分为构型翻转酶和构型保持酶。糖苷酶水解糖苷键时发生底物端基构型的保持或翻转, 产物的构型则由酶分子的构型决定,与底物无关。构型翻转酶在水解糖苷键,攻击异头碳时产生构型的翻转(如α→β),而α-葡萄糖苷酶在水解反应中“保持”其构型而生成α-端基异构体,属于构型保持酶,而且其催化机制允许它们充当转移酶,催化转糖基化反应合成IMOs。α-葡萄糖苷酶介导的反应包括2个连续的步骤:第一步,酶活性中心可根据不同类型的底物而相应发生结构变化,从而使其可以和多种糖类底物结合,利用亲核残基(Asp或Glu)攻击糖苷键,与分裂的糖苷形成共价键;第二步,另一个(酸/碱)催化残基(再次是Asp或Glu)介导糖基部分向受体分子(糖苷底物自身)的转移,完成糖基化,最终形成IMOs。α-葡萄糖苷酶的结构,特别是它的催化中心,决定了其转糖基化活性和对特定底物的偏好,因此决定了可能产生的转糖基化产物的模式[27],家族GH13成员中的α-葡萄糖苷酶,显示出一个特征性的(β/α)8桶催化结构域,其中有4~7个短保守区,包括涉及到酶水解机制的关键氨基酸和由3个酸性残基组成的催化三元组[26, 28]。
3 α-葡萄糖苷酶高效合成IMOs的策略
IMOs的工业化生产,要从α-葡萄糖苷酶的高效表达和IMOs催化合成系统2方面考虑。传统的诱变技术和发酵条件的优化虽可提高α-葡萄糖苷酶的本体表达水平,但提高幅度有限,因此学者通过构建基因工程菌,提高异源α-葡萄糖苷酶的重组表达水平,其中表达系统主要有大肠杆菌[29-32](Escherichia coli)和毕赤酵母[33-36](Pichia pastoris)等。此外,学者们还采取了其他多种策略,比如通过提高α-葡萄糖苷酶的耐热性和稳定性,固定化α-葡萄糖苷酶和α-葡萄糖苷酶酵母表面展示技术等,高效低成本的催化合成IMOs。
3.1 提高异源α-葡萄糖苷酶的重组表达水平
为改善α-葡萄糖苷酶在P.pastoris中的异源表达水平,开发了许多策略,包括发酵优化、高异源基因拷贝数、密码子优化、共表达伴侣等方法。王晓燕等[37]通过将来源于枝顶孢霉属(Acremonium sp. S4G13)的α-葡萄糖苷酶在P.pastoris GS115中重组表达,发酵优化后酶活力提高了5.4倍,该酶对α-1,3糖苷键具有高度选择性,可催化麦芽低聚糖制备热量低、抗龋齿、促双歧杆菌增殖、免疫激活等多种作用的黑曲霉低聚糖。毕赤酵母通过其严格调控的醇氧化酶(alcohol oxidase,AOX)强启动子消耗甲醇作为能量和唯一碳源,但在甲醇诱导过程中AOX催化产生的H2O2等活性氧(reactive oxygen species,ROS)随时间推移而增加,对酵母细胞造成氧化损伤,降低目的蛋白的表达。研究发现,采用目的蛋白与分子伴侣共表达[38],可促进目的蛋白的折叠和分泌,还可降低对目的蛋白的降解,这类的促折叠因子有N-乙酰转移酶、蛋白质二硫键异构酶(protein disulfide isomerase,PDI)、热激蛋白等。LIU等[39]通过P.pastoris优化黑曲霉来源的α-葡萄糖苷酶的发酵参数,表达水平从2.07 U/mL增加到5.50 U/mL,进而通过对α-葡萄糖苷酶基因密码子优化,最后表达量增加到10.1 U/mL,但共表达PDI后发现对P.pastoris的生长和α-葡萄糖苷酶的表达产生了不利影响,这一结果始料未及,推测P.pastoris PDI共表达系统中未折叠蛋白反应与细胞凋亡可能存在联系。由于P.pastoris在甲醇诱导时可产生ROS物质,包括![]() 等,对细胞可造成氧化损伤,并干扰目的蛋白的正确折叠。WU等[40]首次在P.pastoris KM71中共表达N-乙酰转移酶,以提高抗氧化应激能力,保护细胞在甲醇诱导阶段免受ROS损伤,结果表明在高溶解氧(dissolved oxygen,DO)条件下,N-乙酰转移酶过表达菌株的细胞活力显著提高,生物量增加22.7%,同时,25% DO条件下重组α-葡萄糖苷酶的表达水平提高了21.5%,蛋白的降解也大大缓解。
等,对细胞可造成氧化损伤,并干扰目的蛋白的正确折叠。WU等[40]首次在P.pastoris KM71中共表达N-乙酰转移酶,以提高抗氧化应激能力,保护细胞在甲醇诱导阶段免受ROS损伤,结果表明在高溶解氧(dissolved oxygen,DO)条件下,N-乙酰转移酶过表达菌株的细胞活力显著提高,生物量增加22.7%,同时,25% DO条件下重组α-葡萄糖苷酶的表达水平提高了21.5%,蛋白的降解也大大缓解。
总之,应从培养水平(培养基组成和发酵条件优化)、细胞水平(构建蛋白酶缺陷型菌株)和蛋白质水平(融合表达)等方面出发,采取以上一种或者多种优化策略,减少内源性蛋白酶对α-葡萄糖苷酶的降解,全面提高α-葡萄糖苷酶在P.pastoris中的重组表达水平。
3.2 筛选和构建耐热和稳定性高的α-葡萄糖苷酶
目前工业上应用的α-葡萄糖苷酶来源于黑曲霉,一般在50 ℃以下较稳定,不耐热限制了目前α-葡萄糖苷酶转糖基化反应的商业化应用。如果适当提高转糖基化反应的温度,则有利于降低反应液的黏度、提高催化反应速率和IMOs的转化率,从而降低生产成本。因此,开发具有良好稳定性的耐热α-葡萄糖苷酶,对工业化生产IMOs有重要的意义[41],耐热α-葡萄糖苷酶的高效表达策略如图1所示。
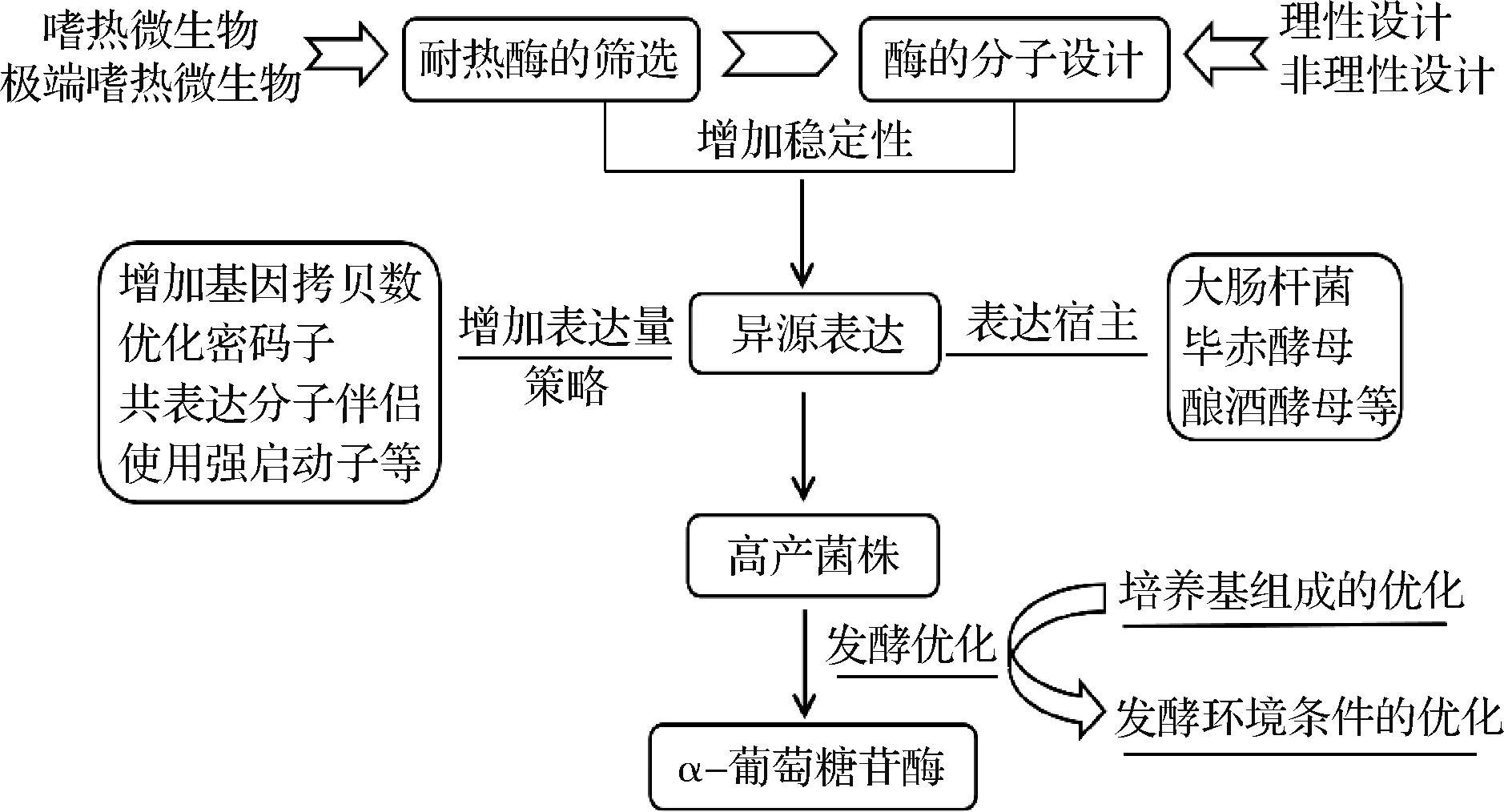
图1 耐热α-葡萄糖苷酶的高效表达策略
Fig.1 High-efficient expression strategy of thermostable α-glucosidase
从嗜热环境中分离产α-葡萄糖苷酶的微生物,很早就引起了人们的关注。ZHANG等[19]将来自地芽孢杆菌属(Geobacillus sp.)的α-葡萄糖苷酶在E.coli BL21(DE3)中重组表达,酶水解的最适温度为65 ℃,在60 ℃时半衰期为84 h,pH 7.0时水解活性最大,摇瓶中的α-葡萄糖苷酶的水解活性达107.9 U/mL;优化转糖基化反应条件后,在60 ℃、pH 7.0下,用30%麦芽糖浆合成IMOs的转化率达37%。ZHOU等[20]将T.tengcongensis MB4来源的α-葡萄糖苷酶在E.coli BL21 (DE3)中重组表达,该酶最适温度为60 ℃,水解活性的最适pH值为5.5,且其糖基化产物为含α-1, 6糖苷键的IMOs,该酶耐热性好且专一性强,在工业上合成IMOs有较好的应用前景。学者们还从其他极端嗜热微生物中发现并表征了耐热α-葡萄糖苷酶,并通过诱变的方法以提高酶的热稳定性。ZHOU等[18]用E.coli BL21(DE3) 表达来源于Thermus thermophilus TC11的α-葡萄糖苷酶,重组酶对pNPGlu、蔗糖、海藻糖和潘糖等都具有水解活性,以蔗糖和海藻糖为底物,检测到糖基化活性;该酶在70 ℃下能稳定7 h以上,耐热性好,从随机诱变库中获得突变体Q10Y,其![]() (保持50%初始酶活时的温度)比野生型提高了4 ℃。PARK[42]将Sulfolobus tokodaii来源的α-葡萄糖苷酶在E.coli BL21 (DE3)中表达,在95 ℃和pH 4.0时观察到最大活性,100和105 ℃的高温下半衰期分别为40.1和7.75 min,表现出稳定性,该酶在pH 4.0~11.0可保留85%以上的活性,对麦芽三糖的催化效率最高,而且还可将麦芽糖转化为IMOs。
(保持50%初始酶活时的温度)比野生型提高了4 ℃。PARK[42]将Sulfolobus tokodaii来源的α-葡萄糖苷酶在E.coli BL21 (DE3)中表达,在95 ℃和pH 4.0时观察到最大活性,100和105 ℃的高温下半衰期分别为40.1和7.75 min,表现出稳定性,该酶在pH 4.0~11.0可保留85%以上的活性,对麦芽三糖的催化效率最高,而且还可将麦芽糖转化为IMOs。
通过定点突变技术可提高蛋白质的稳定性,比如在目的蛋白的适当位置引入脯氨酸。ZHOU等[14]将5种耐热和中等耐热微生物来源的α-葡萄糖苷酶与腾冲嗜热厌氧菌(T.tengcongensis MB4)的蛋白序列进行比对,选择T.tengcongensis MB4来源的α-葡萄糖苷酶(TtGluA)中的4个位点(Leu152、Asn208、Lys285和Thr430)进行Pro替代,结果突变体L152P、K285P和T430P的TtGluA热稳定性均明显提高,研究揭示出所选位点不仅对该酶的热稳定性很重要,而且与该酶的底物结合和催化活性有关。MA等[43]研究了黑曲霉Asn694突变对α-葡萄糖苷酶水解和转糖基化的影响,用Ala、Leu、Phe和Trp替代Asn694(该残基被预测参与了α-葡萄糖苷酶的加亚位的形成),结果表明除N694A外,其他突变体均增强了产生麦芽三糖的α- (1→4) 转移反应的初始速度,随反应时间增加,N694F和N694 W突变型导致异麦芽糖和异麦芽三糖的大量积累,超过了野生型酶;反应结束时的主要产物分别是潘糖(N694A和N694L)或异麦芽糖(N694F和N694 W)。对于耐热α-葡萄糖苷酶除了采取定点突变等理性设计外,学者还应进行酶定向进化等非理性设计,借助计算机模拟分析,通过3D建模、分子对接和分子模拟等技术,将优势位点组合,产生超级突变株,以进一步提高α-葡萄糖苷酶的热稳定性。
3.3 采用固定化酶或酵母表面展示技术
固定化酶已被用于食品、制药和其他工业生物过程,不仅可消除产品中潜在的蛋白质污染,而且还可重复利用该酶,从而降低操作成本[44-45]。WANG等[46]将α-葡萄糖苷酶固定在环氧树脂上,研究发现,在pH 6.0、离子强度2.0 mol/L和30 mg蛋白质/g树脂条件下,酶固定化效率为79.61%;在V(乙酸丁酯)∶V(水)=25∶75的缓冲体系中,pH 4.5和55 ℃条件下,IMOs的产率最高(50.83%,质量分数),最后固定化酶颗粒在完成转糖基化后被分配到有机相,有利于固定化酶的分离和回收利用。CHEN等[47]以壳聚糖为载体,戊二醛为交联剂的共价交联和吸附交联,研究了自Geobacillus stearothermophilus U2发酵且纯化得到的α-葡萄糖苷酶在壳聚糖上的固定化条件,又以壳聚糖膜固定化α-葡萄糖苷酶、β-淀粉酶、普鲁兰酶、真菌α-淀粉酶,用淀粉为底物,优化了制备IMOs的条件,该方法是一种潜在的用淀粉生物转化IMOs的工业化应用技术。
酵母表面展示技术是将目的蛋白基因与特定载体蛋白基因融合后导入酵母细胞,在载体蛋白引导下,目的蛋白表达并定位于微生物细胞表面,保持其正确构象和原有生物活性的一种技术。CASA- VILLEGAS等[48]将来源于黑曲霉的α-葡萄糖苷酶与来自酵母的糖基磷脂酰肌醇锚定序列融合表达于S.cerevisiae BY4741的细胞表面,可用于连续批量生产IMOs,且通过控制底物中麦芽糖和葡萄糖的比例可调节潘糖和异麦芽糖的产量。ZHAO等[49]开发了一种P.pastoris表面展示α-葡萄糖苷酶的全细胞催化系统来生产IMOs,结果表明,在2 mL反应体系中,最佳条件下可利用30%麦芽糖,在2 h内以约49%的转化率合成IMOs;在2 L搅拌反应器中进行0.5 L的反应体系,2 h内转化率约为44%,且催化系统重复使用3次后,转化率依然稳定。王框[50]通过P.pastoris表面展示α-葡萄糖苷酶,并以Fe3O4微球包裹壳聚糖,经戊二醛交联后作为固定P.pastoris细胞的载体,在固定床反应器中连续催化麦芽糖底物合成IMOs,工艺优化后IMOs产率最高为12.12 g/h,底物转化率为36.69%,生产效率达到42.9 g/(L·h),且1~5次重复利用后α-葡萄糖苷酶活力维持在80%以上。综上,以淀粉为原料,IMOs的工业合成途径及策略如图2所示。相对于固定化α-葡萄糖苷酶而言,酵母表面展示α-葡萄糖苷酶,可提高α-葡萄糖苷酶的稳定性和耐受性,作为全细胞催化剂,既可减少酶固定化操作中的活性损失,也可降低载体成本费和固定化操作费用,用于合成IMOs显示出反应效率高,操作稳定性好的广阔应用前景。
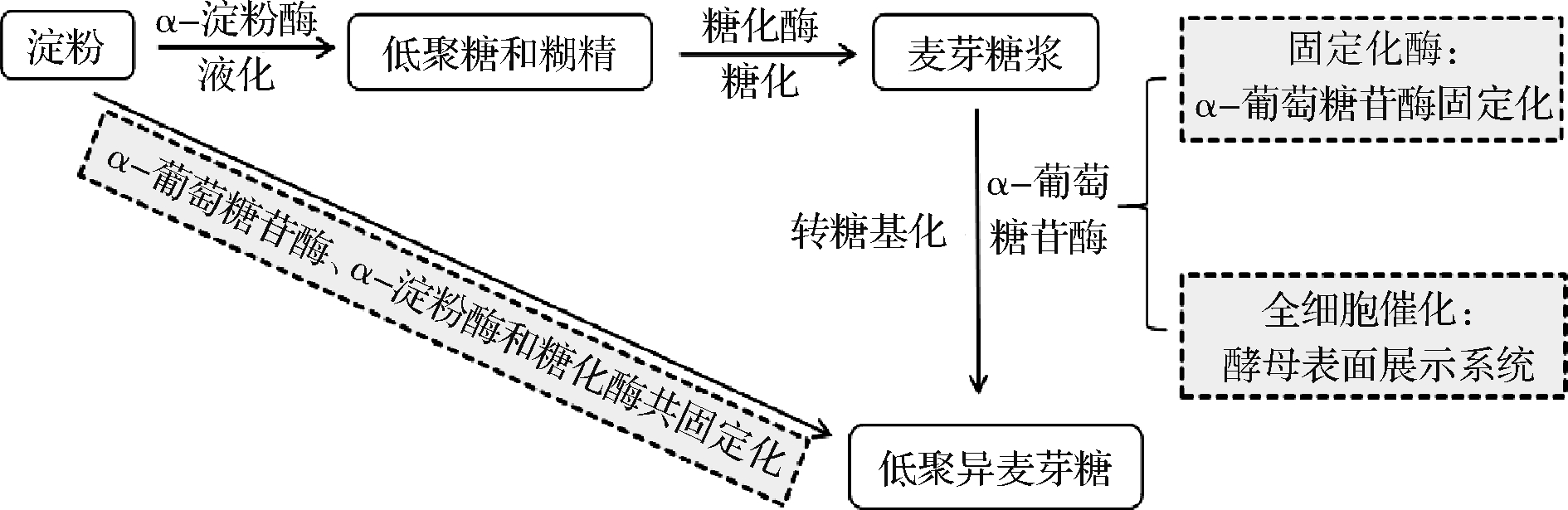
图2 低聚异麦芽糖的工业合成途径及策略
Fig.2 Industrial synthesis pathway and strategy of isomaltooligosaccharides
4 展望
IMOs的工业化生产,依赖于高效低成本的催化合成体系,除α-葡萄糖苷酶保持对底物耐受能力强,对热、pH和变性剂的构象稳定外,还需转糖基化的高效性和专一性(转葡萄糖残基到非还原葡萄糖单位的6—OH基团)。目前工业级的IMOs的生产成本在很大程度上取决于酶的生产、回收和纯化,而细胞表面展示技术,不仅可提高酶的稳定性,而且不需对酶进行繁琐的纯化工序,可多次重复利用,降低生产成本,因此成为工业化生产IMOs最具前景的高效生物催化系统之一。此外,寻找具有不同酶性质的α-葡萄糖苷酶的新来源非常重要,新酶应具备水解广泛或不同特定底物的特异性、转糖基化反应专一性以及合成其他功能性低聚糖等特性,如形成α-1,2、α-1,3或α-1,4糖苷键的功能性低聚糖,以更好地满足各自应用所需的特定要求。当然,不论是IMOs还是其他功能性低聚糖的高效酶促转化,还有待进一步揭示α-葡萄糖苷酶催化水解不同底物的分子结构基础,阐明调控功能性低聚糖形成的结构元素,明确转糖基化反应蛋白分子的构效关系,并通过理性设计或定向进化等蛋白质改造的技术手段,开发适合特定应用需要的新型酶制剂。
[1] HUANG Z H,LI Z H,SU Y J,et al.Continuous production of isomalto-oligosaccharides by thermo- inactivated cells of Aspergillus niger J2 with coarse perlite as an immobilizing material[J].Applied Biochemistry and Biotechnology,2018,185(4):1 088-1 099.
[2] SHI Q,HOU Y X,JUVONEN M,et al.Optimization of isomaltooligosaccharide size distribution by acceptor reaction of Weissella confusa dextransucrase and characterization of novel α-(1→2)-branched isomaltooligosaccharides[J].Journal of Agricultural and Food Chemistry,2016,64(16):3 276-3 286.
[3] OJHA S,MISHRA S,CHAND S.Production of isomalto-oligosaccharides by cell bound α-glucosidase of Microbacterium sp.[J].LWT-Food Science and Technology,2015,60(1):486-494.
[4] SOTO-MALDONADO C,CONCHA-OLMOS J,CáCERES-ESCOBAR G,et al.Sensory evaluation and glycaemic index of a food developed with flour from whole (pulp and peel) overripe banana (Musa cavendishii) discards[J].LWT-Food Science and Technology,2018,92:569-575.
[5] MEYER T S M,MIGUEL A S M,FERNáNDEZ D E R,et al.Biotechnological production of oligosaccharides-applications in the food industry[M].Food Production and Industry.England:InTech,2015.
[6] YEN C H,TSENG Y H,KUO Y W,et al.Long-term supplementation of isomalto-oligosaccharides improved colonic microflora profile,bowel function,and blood cholesterol levels in constipated elderly people-A placebo-controlled,diet-controlled trial[J].Nutrition,2011,27(4):445-450.
[7] MADSEN L R,STANLEY S,SWANN P,et al.A survey of commercially available isomaltooligosaccharide -based food ingredients[J].Journal of Food Science,2017,82(2):401-408.
[8] RUDEEKULTHAMRONG P,SAWASDEE K,KAULPIBOON J.Production of long-chain isomaltooligosaccharides from maltotriose using the thermostable amylomaltase and transglucosidase enzymes[J].Biotechnology and Bioprocess Engineering,2013,18(4):778-786.
[9] KAULPIBOON J,RUDEEKULTHAMRONG P,WATANASATITARPA S,et al.Synthesis of long-chain isomaltooligosaccharides from tapioca starch and an in vitro investigation of their prebiotic properties[J].Journal of Molecular Catalysis B:Enzymatic,2015,120:127-135.
[10] SORNDECH W,NAKORN K N,TONGTA S,et al.Isomalto-oligosaccharides:Recent insights in production technology and their use for food and medical applications[J].LWT,2018,95:135-142.
[11] GOFFIN D,DELZENNE N,BLECKER C,et al.Will isomalto-oligosaccharides,a well-established functional food in Asia,break through the European and American market? The status of knowledge on these prebiotics[J].Critical Reviews in Food Science and Nutrition,2011,51(5):394-409.
[12] NGIWSARA L,IWAI G,TAGAMI T,et al.Amino acids in conserved region II are crucial to substrate specificity,reaction velocity,and regioselectivity in the transglucosylation of honeybee GH-13 α-glucosidases[J].Bioscience,Biotechnology,and Biochemistry,2012,76(10):1 967-1 974.
[13] AUIEWIRIYANUKUL W,SABURI W,KATO K,et al.Function and structure of GH13_31 α-glucosidase with high α-(1→4)-glucosidic linkage specificity and transglucosylation activity[J].FEBS Letters,2018,592(13):2 268-2 281.
[14] ZHOU C,XUE Y F,MA Y H.Enhancing the thermostability of α-glucosidase from Thermoanaerobacter tengcongensis MB4 by single proline substitution[J].Journal of Bioscience and Bioengineering,2010,110(1):12-17.
[15] YAMAMOTO T,UNNO T,WATANABE Y,et al.Purification and characterization of Acremonium implicatum α-glucosidase having regioselectivity for α-1,3-glucosidic linkage[J].Biochimica et Biophysica Acta(BBA)-Proteins and Proteomics,2004,1 700(2):189-198.
[16] LI W,XUE Y,LI J J,et al.A cold-adapted and glucose-stimulated type II α-glucosidase from a deep-sea bacterium Pseudoalteromonas sp.K8[J].Biotechnology Letters,2016,38(2):345-349.
[17] HUNG V S,HATADA Y,GODA S,et al.α-Glucosidase from a strain of deep-sea Geobacillus:A potential enzyme for the biosynthesis of complex carbohydrates[J].Applied Microbiology and Biotechnology,2005,68(6):757-765.
[18] ZHOU C,XUE Y F,MA Y H.Evaluation and directed evolution for thermostability improvement of a GH 13 thermostable α-glucosidase from Thermus thermophilus TC11[J].BMC Biotechnology,2015,15:97.
[19] ZHANG F,WANG W Y,BAH F B M,et al.Heterologous expression of a thermostable α-glucosidase from Geobacillus sp.Strain HTA-462 by Escherichia coli and its potential application for isomaltose-oligosaccharide synthesis[J].Molecules,2019,24(7):1 413.
[20] ZHOU C, XUE Y F,ZHANG Y L,et al.Recombinant expression and characterization of Thermoanaerobacter tengcongensis thermostable α-glucosidase with regioselectivity for high yield isomaltooligosaccharides synthesis[J].Journal of Microbiology and Biotechnology,2009,19(12):1 547-1 556.
[21] NIMPIBOON P,NAKAPONG S,PICHYANGKURA R,et al.Synthesis of a novel prebiotic trisaccharide by a type I α-glucosidase from B.licheniformis strain TH4-2[J].Process Biochemistry,2011,46(2):448-457.
[22] ZHANG Y K,LI W,WU K Y,et al.Purification and characterization of an intracellular α-glucosidase with high transglycosylation activity from A.niger M-1[J].Preparative Biochemistry & Biotechnology,2011,41(2):201-217.
[23] YAN Q J,HAN P,YANG S Q,et al.Purification and characterization of a novel α-glucosidase from Malbranchea cinnamomea[J].Biotechnology Letters,2015,37(6):1 279-1 286.
[24] SUGIMOTO M,SUZUKI Y.Molecular cloning,sequencing,and expression of a cDNA encoding α-glucosidase from Mucor javanicus[J].The Journal of Biochemistry,1996,119(3):500-505.
[25] LOMBARD V,GOLACONDA RAMULU H,DRULA E,et al.The carbohydrate-active enzymes database (CAZy) in 2013[J].Nucleic Acids Research,2014,42(D1):D490-D495.
[26] OKUYAMA M,SABURI W,MORI H,et al.α-glucosidases and α-1,4-glucan lyases:Structures,functions,and physiological actions[J].Cellular and Molecular Life Sciences,2016,73(14):2 727-2 751.
[27] SONG K M,OKUYAMA M,NISHIMURA M,et al.Aromatic residue on β→α loop 1 in the catalytic domain is important to the transglycosylation specificity of glycoside hydrolase family 31 α-glucosidase[J].Bioscience Biotechnology and Biochemistry,2013,77(8):1 759-1 765.
[28] PLAZA-VINUESA L,HERNANDEZ-HERNANDEZ O,MORENO F J,et al.Unravelling the diversity of glycoside hydrolase family 13 α-amylases from Lactobacillus plantarum WCFS1[J].Microbial Cell Factories,2019,18(1):183.
[29] CHAUDET M M,ALLEN J L,ROSE D R.Expression and purification of two Family GH31 α-glucosidases from Bacteroides thetaiotaomicron[J].Protein Expression and Purification,2012,86(2):135-141.
[30] CUEBAS-IRIZARRY M F,IRIZARRY-CARO R A,L PEZ-MORALES C,et al.Cloning and molecular characterization of an alpha-glucosidase (MalH) from the halophilic archaeon Haloquadratum walsbyi[J].Life,2017,7(4):46.
PEZ-MORALES C,et al.Cloning and molecular characterization of an alpha-glucosidase (MalH) from the halophilic archaeon Haloquadratum walsbyi[J].Life,2017,7(4):46.
[31] CHEN H C,YANG S S,XU A J,et al.Insight into the glycosylation and hydrolysis kinetics of alpha-glucosidase in the synthesis of glycosides[J].Applied Microbiology and Biotechnology,2019,103(23-24):9 423-9 432.
[32] GARCIA-GONZALEZ M,MINGUET-LOBATO M,PLOU F J,et al.Molecular characterization and heterologous expression of two α-glucosidases from Metschnikowia spp.,both producers of honey sugars[J].Microbial Cell Factories,2020,19(1):140.
[33] SUTHANGKORNKUL R,SIRICHAIYAKUL P,SUNGVORNYOTHIN S,et al.Functional expression and molecular characterization of Culex quinquefasciatus salivary α-glucosidase (MalI)[J].Protein Expression and Purification,2015,110:145-150.
[34] KUMAR S,BASU A,ANU-APPAIAH K A,et al.Identification and characterization of novel transglycosylating α-glucosidase from Aspergillus neoniger[J].Journal of Applied Microbiology,2020,129(6):1 644-1 656.
[35] KUMAR S,MUTTURI S.Expression of a novel α-glucosidase from Aspergillus neoniger in Pichia pastoris and its efficient recovery for synthesis of isomaltooligosaccharides[J].Enzyme and Microbial Technology,2020,141:109653.
[36] KAEWMUANGMOON J,KILASO M,LEARTSAKULPANICH U,et al.Expression of a secretory α-glucosidase II from Apis cerana indica in Pichia pastoris and its characterization[J].BMC Biotechnology,2013,13(1):1-13.
[37] 王晓燕, 江波,张涛.重组α-1,3-葡萄糖苷酶的毕赤酵母表达及发酵优化[J].食品工程,2019(4):28-34;62.
WANG X Y,JIANG B,ZHANG T.Expression in Pichia pastoris and optimization of fermentation of recombinant α-1,3-glucosidase[J].Food Engineering,2019(4):28-34;62.
[38] HUANG J J,ZHAO Q Y,CHEN L X,et al.Improved production of recombinant Rhizomucor miehei lipase by coexpressing protein folding chaperones in Pichia pastoris,which triggered ER stress[J].Bioengineered,2020,11(1):375-385.
[39] LIU X,WU D,WU J,et al.Optimization of the production of Aspergillus niger α-glucosidase expressed in Pichia pastoris[J].World Journal of Microbiology and Biotechnology,2013,29(3):533-540.
[40] WU D,ZHU H F,CHU J,et al.N-acetyltransferase co-expression increases α-glucosidase expression level in Pichia pastoris[J].Journal of Biotechnology,2019,289:26-30.
[41] KHANG P V,PHUONG D M,MA L.New steroids from Anemarrhena asphodeloides rhizome and their α-glucosidase inhibitory activity[J].Journal of Asian Natural Products Research,2017,19(5):468-473.
[42] PARK J E.Enzymatic properties of a thermostable α-glucosidase from acidothermophilic crenarchaeon Sulfolobus tokodaii strain 7[J].Journal of Microbiology and Biotechnology,2013,23(1):56-63.
[43] MA M,OKUYAMA M,SATO M,et al.Effects of mutation of Asn694 in Aspergillus niger α-glucosidase on hydrolysis and transglucosylation[J].Applied Microbiology and Biotechnology,2017,101(16):6 399-6 408.
[44] MENDIS M,MENDOZA B R,SIMSEK S.Covalent immobilization of transglucosidase onto polymer beads for production of isomaltooligosaccharides[J].Catalysis Letters,2012,142(9):1 107-1 113.
[45] MARíN-NAVARRO J,TALENS-PERALES D,OUDE-VRIELINK A,et al.Immobilization of thermostable β-galactosidase on epoxy support and its use for lactose hydrolysis and galactooligosaccharides biosynthesis[J].World Journal of Microbiology and Biotechnology,2014,30(3):989-998.
[46] WANG J,LI W,NIU D D,et al.Improved synthesis of isomaltooligosaccharides using immobilized α-glucosidase in organic-aqueous media[J].Food Science and Biotechnology,2017,26(3):731-738.
[47] CHEN P,XU R X,WANG J H,et al.Starch biotransformation into isomaltooligosaccharides using thermostable alpha-glucosidase from Geobacillus stearothermophilus[J].PeerJ,2018,6:e5086.
[48] CASA-VILLEGAS M,MAR N-NAVARRO J,POLAINA J.Synthesis of isomaltooligosaccharides by Saccharomyces cerevisiae cells expressing Aspergillus niger α-glucosidase[J].ACS Omega,2017,2(11):8 062-8 068.
N-NAVARRO J,POLAINA J.Synthesis of isomaltooligosaccharides by Saccharomyces cerevisiae cells expressing Aspergillus niger α-glucosidase[J].ACS Omega,2017,2(11):8 062-8 068.
[49] ZHAO N N,XU Y S,WANG K,et al.Synthesis of isomalto-oligosaccharides by Pichia pastoris displaying the Aspergillus niger α-glucosidase[J].Journal of Agricultural and Food Chemistry,2017,65(43):9 468-9 474.
[50] 王框. 表面展示α-葡萄糖苷酶毕赤酵母的固定及其在低聚异麦芽寡糖合成中的应用[D].广州:华南理工大学,2018.
WANG K.Immobilization of Pichia Pastoris surface displayed with α-glucosidase and its application in the synthesis of isomaltooligosaccharides[D].Guangzhou:South China University of Technology,2018.