多环芳烃(polycyclic aromatic hydrocarbons,PAHs)为煤、石油、木材和烟草以及高分子化合物等中的有机物不完全燃烧或在还原性条件下经热分解产生的挥发性碳氢化合物,对环境和人类健康带来严重的危害[1],得到了世界各国的共同关注。PAHs的结构特点是分子中含有2个或2个以上苯环,可分为芳香稠环型和芳香非稠环型两类[2],广泛存在环境、食品和生物体中。肉制品是人类日常饮食的重要组成部分,然而,肉制品在加工过程中常伴随有毒、有害物质的产生,其中最典型的有害物如PAHs,肉制品在热加工过程中,尤其是烧烤、烟熏、油炸等热加工肉制品中检测出PAHs类致癌物含量较多[3],由PAHs引起的食品安全问题屡见不鲜,严重危害人类健康。研究结果表明,肉制品中的组分如蛋白质、脂类物质的裂解以及糖类物质的不完全燃烧均会导致PAHs等有害物质的生成[4]。另外,不同的加工方式、热加工温度、肉制品中的脂肪类型及含量等也会影响PAHs的生成[5]。因此,研究肉制品中PAHs的生成过程以及其控制措施,对提升食品安全、保障国民健康具有重要的意义。
目前国内外对食品中PAHs的检测做了大量研究,把PAHs列为食品安全监测的重点对象[6]。然而,食品本身基质复杂,组分多且含量高,对目标物PAHs的检测存在较大干扰;选择合适的前处理方法和检测方法,排除干扰,对食品中PAHs检测分析尤为关键[7]。因此,快速、便捷、高效的样品前处理方法是建立准确、可靠的PAHs分析方法的基础。本文首先对PAHs的性质、危害进行简要介绍,主要对热加工食品中PAHs的前处理和检测方法的研究现状进行总结、评述,为开发出更加快捷、灵敏、高效的PAHs新型检测技术提供参考。
1 PAHs的危害与种类
1.1 PAHs毒性
世界卫生组织分支部门——国际癌症研究机构(International Agency for Research on Cancer, IARC)发布调查报告,将加工肉制品列为“Ⅰ类”人类致癌物,其中最典型的有害物包括PAHs等[8]。PAHs具有“三致效应”:强致畸、致癌和致突变性,能够引起生物体多个器官部位的肿瘤和癌变[9-10]。研究发现,非基因毒性疾病与2型糖尿病有可能由PAHs引发[11-13]。小鼠生殖能力会被B(a)P等PAHs损害,推测PAHs很可能对人体有生殖毒性[14-15]。
1.2 PAHs种类
迄今为止,已发现有200多种PAHs,食品中常见的有20种左右。在PAHs 类化合物中,3, 4-苯并芘,简称苯并(a)芘[B(a)P],其致癌性强、分布范围广,占全部致癌性PAHs的1%~20%,且性质稳定,与其他PAHs有一定的相关性,常被作为食品中PAHs检测的特征化合物[16-17]。由于食品内部成分复杂多样,PAHs相关毒理学尚处于研究阶段,美国环境保护局(Environmental Protection Agency, EPA)总结出16种PAHs,依据其强致癌、致突变的能力,作为监测的重点指标,简称EPA16[18],16种PAHs的具体名称及致癌、致突变性如表1所示。随后,欧盟食品安全局(European Food Safety Authority, EFSA)提出PAH4、PAH8的概念,即分别测定16种PAHs中的4种[B(a)P、Chr、B(a)A和B(b)F]的含量,PAH8[PAH4、B(k)F、BghiP、DahA、InP]的标准,认为PAH4和PAH8是判定肉制品中PAHs含量最合适的指标[19]。并且欧盟(European Union, EU)对不同食品中的B(a)P和PAH4作出最大限值规定,对烟熏肉和烟熏肉制品中B(a)P含量限量规定为2 μg/kg,PAH4的最大残留量为12 μg/kg[20]。我国食品污染物限量标准GB 2762—2017《食品安全国家标准 食品中污染物限量》中对熏烧烤肉及肉制品中的苯并(a)芘限量规定为5.0 μg/kg[21]。
表1 EPA16毒性
Table 1 Toxicity of EPA16
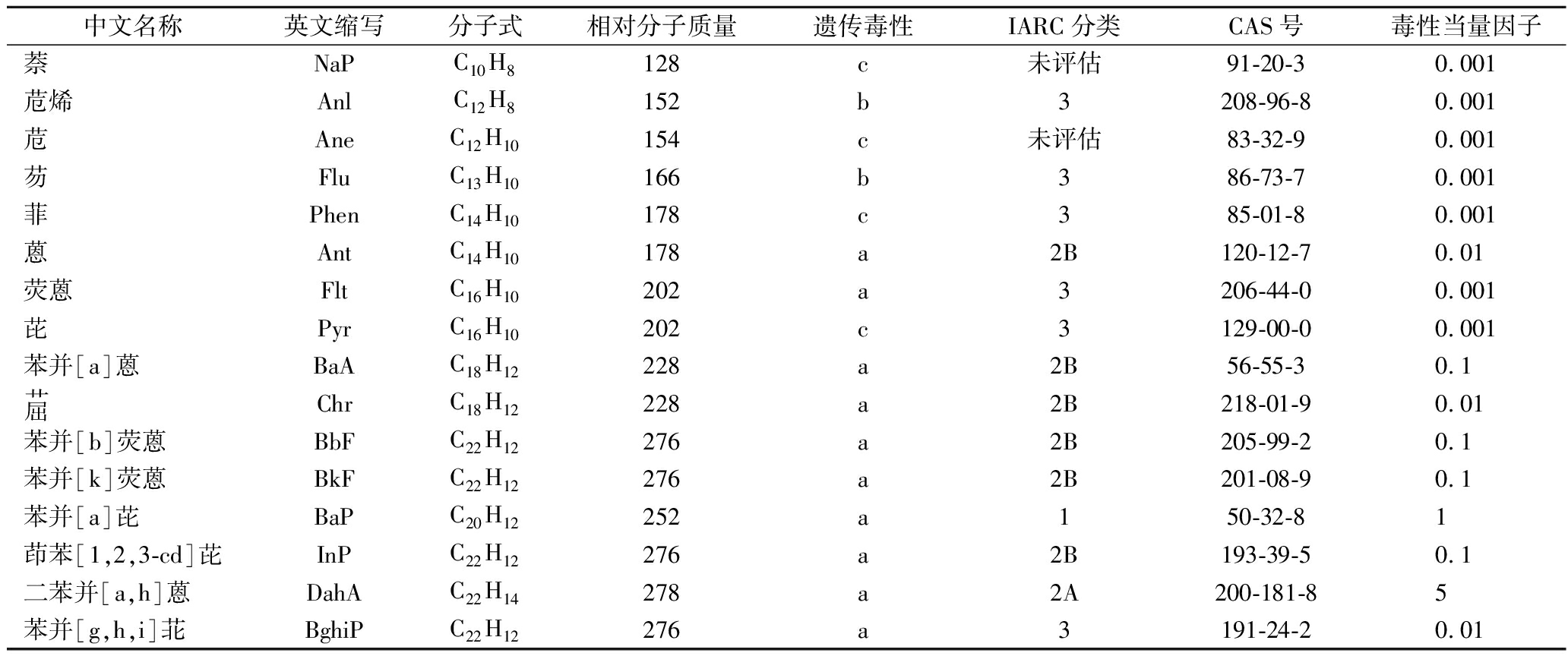
中文名称英文缩写分子式相对分子质量遗传毒性IARC分类CAS号毒性当量因子萘NaPC10H8128c未评估91-20-30.001苊烯AnlC12H8152b3208-96-80.001苊AneC12H10154c未评估83-32-90.001芴FluC13H10166b386-73-70.001菲PhenC14H10178c385-01-80.001蒽AntC14H10178a2B120-12-70.01荧蒽FltC16H10202a3206-44-00.001芘PyrC16H10202c3129-00-00.001苯并[a]蒽BaAC18H12228a2B56-55-30.1艹屈ChrC18H12228a2B218-01-90.01苯并[b]荧蒽BbFC22H12276a2B205-99-20.1苯并[k]荧蒽BkFC22H12276a2B201-08-90.1苯并[a]芘BaPC20H12252a150-32-81茚苯[1,2,3-cd]芘InPC22H12276a2B193-39-50.1二苯并[a,h]蒽DahAC22H14278a2A200-181-85苯并[g,h,i]苝BghiPC22H12276a3191-24-20.01
注:a-阳性;b-阴性;c-可疑;1-致癌;2A-很可能致癌;2B-可能致癌;3-未分类
2 国内外研究现状
2.1 前处理方法
食品中PAHs的含量一般较低,且食品本身基质复杂,干扰较多,难以直接测定,必须经过提取、净化等前处理过程,提高PAHs的提取效率。研究表明提取方法、试剂的选择、净化的程度等提取技术的差异对于检测结果的差异非常显著,因此,提取效率高、分离效果好的前处理方法对下一步PAHs含量分析至关重要。传统的样品前处理方法如液液萃取、索氏提取法等,操作繁琐,费时费力,且提取效率相对较低[22-23]。近年来,新兴样品前处理技术如超声波提取、加速溶剂萃取、微波辅助萃取、固相萃取技术、固相微萃取技术、凝胶渗透色谱法、QuEChERS等因简便、快捷、高效,可以与多种分离技术连用等优点,发展迅速。
2.1.1 超声波提取
超声波提取是利用超声波辐射样品,产生的强烈机械振动使分子做无规则运动的速率加快,目标成分溶解到溶剂中,实现快速提取。潘峰等[24]采用超声波提取PAHs,发现PAHs总量与提取时间在一定阶段内成反比,由于超声空化效应,使萘、苊等小分子质量PAHs被攻击逸出,而未检出。阳文武等[25]通过超声提取,采用高效液相色谱-荧光检测法同时测定烤肉中15种PAHs,结果显示PAHs的线性关系良好,平均回收率为71.1%~98.8%,检出限(limit of detection, LOD)为0.33~3.30 μg/kg,定量限(limit of quantitation, LOQ)为1.0~10.0 μg/kg。超声波提取效率较好,但在实际提取过程中可能产生空化效应,影响检测结果的准确性。
2.1.2 加速溶剂萃取
加速溶剂萃取(accelerated solvent extraction, ASE)是通过增加压力来提高溶剂的温度,从而提高目标提取物的溶解性;利用加速溶剂萃取仪实现自动萃取,适合提取高脂肪食品中的PAHs。周蕾等[26]通过加速溶剂萃取,气相色谱-质谱分析,快速检测烟熏腊肉中16种PAHs,结果显示,加标回收率为60.3%~93.2%,检出限在0.172~0.233 μg/kg,该方法适合烟熏腊肉中16种PAHs的检测。李聪等[27]利用加速溶剂萃取-高效液相色谱-荧光检测技术,检测哈尔滨红肠中4种PAHs[苯并(a)芘(BaP)、苯并(a)蒽(BaA)、![]() (Chr)和苯并(b)荧蒽(BbF)]。结果显示,加标回收率均在50%~90%,相对标准偏差均<8%;5种哈尔滨红肠中PAHs的总含量均远低于欧盟标准(30 μg/kg),该方法适用于哈尔滨红肠中PAHs的日常快速测定与分析。
(Chr)和苯并(b)荧蒽(BbF)]。结果显示,加标回收率均在50%~90%,相对标准偏差均<8%;5种哈尔滨红肠中PAHs的总含量均远低于欧盟标准(30 μg/kg),该方法适用于哈尔滨红肠中PAHs的日常快速测定与分析。
2.1.3 微波辅助萃取
微波辅助萃取(microwave-assisted extraction, MAE)主要是利用微波能辐射加热的特性,根据萃取物料内部对不同微波的热敏感性不同,使被萃取物质通过加热分离出来的过程;该法仅适用于微波条件下不易降解的组分。PURCARO等[28]采用MAE,结合反相高效液相色谱和荧光光谱优化了烟熏肉中PAHs的测定,与超声辅助萃取相比,提取率更高。将优化后的技术用于意大利市场不同烟熏肉制品中PAHs的含量测定,回收率可达77%~103%。GHASEMZADEH等[29]采用MAE和分散液-液微萃取结合气相色谱-质谱的方法,对熏鱼中16种PAHs进行了提取和定量。结果显示,检出限在0.11~0.43 ng/g,回收率为82.1%~105.5%,相对标准偏差在2.8%~9%,重复性较好。
2.1.4 固相萃取技术
固相萃取技术(solid phase extraction, SPE)主要原理是通过固体吸附剂吸附目标化合物,使非目标成分分离出去,然后将目标成分洗脱,从而达到萃取分离的目的;主要适用于对样品中目标物的分离、纯化、浓缩,是一种用于富集样品中目标物的前处理技术。KAFOURIS等[30]利用皂化和液相萃取,SPE净化提取物,高效液相色谱和荧光检测器对262份熏香肠、培根、猪肉和火腿、烤猪肉和家禽样品的PAH4[苯并(a)蒽(BaA)、![]() (Chr)、苯并(b)荧蒽(BbF)和苯并(a)芘(BaP)]含量进行了测定,结果显示96%的样品至少受一种PAHs的污染,在这些受污染的样品中,12%的烟熏产品和15%的烤肉样品超过了欧盟立法的最高水平。PAN等[31]提出了一种基于磁固相萃取系统和GC-MS的创新方法来预测烧烤烟雾中16种PAHs。该法采用合成的一种磁性纳米材料作磁性固相萃取的吸附剂,回收率在73.4%~90.7%,检出限为1.2~5.4 ng/L。定量限为3.7~16.4 ng/L。SPE是一门成熟且具发展潜力的样品预处理技术,也是目前最常用的样品前处理方法,固相吸附洗脱剂的选择是提高固相萃取技术吸收率的关键,因此开发高效、高选择性的固相吸附洗脱剂是关键。
(Chr)、苯并(b)荧蒽(BbF)和苯并(a)芘(BaP)]含量进行了测定,结果显示96%的样品至少受一种PAHs的污染,在这些受污染的样品中,12%的烟熏产品和15%的烤肉样品超过了欧盟立法的最高水平。PAN等[31]提出了一种基于磁固相萃取系统和GC-MS的创新方法来预测烧烤烟雾中16种PAHs。该法采用合成的一种磁性纳米材料作磁性固相萃取的吸附剂,回收率在73.4%~90.7%,检出限为1.2~5.4 ng/L。定量限为3.7~16.4 ng/L。SPE是一门成熟且具发展潜力的样品预处理技术,也是目前最常用的样品前处理方法,固相吸附洗脱剂的选择是提高固相萃取技术吸收率的关键,因此开发高效、高选择性的固相吸附洗脱剂是关键。
2.1.5 固相微萃取技术
固相微萃取技术(solid phase microextraction extraction, SPME)属于非挥发性溶剂型选择性萃取的方法,其根据相似相容原理,利用具有不同涂层的萃取头,对样品中的目标分析物进行萃取,能够实现集提取、富集、净化、进样为一体的全过程。MA等[32]将共价有机骨架材料TpBD固定在不锈钢线上为固相微萃取纤维用于SPME,并用GC-MS法检测烤肉中16种PAHs,结果显示,检出限为0.02~1.66 ng/L,定量限为0.07~5.52 ng/L,回收率为85.1%~102.8%。康迪等[33]采用新型活性炭纤维作为SPME的萃取纤维与气相色谱-质谱联用检测烤肉中的PAHs。结果表明,16种PAHs的线性范围为1~1 000 μg/L,检出限在0.1~50 μg/kg。SPME技术效率高且无需使用有机溶剂,同时可与仪器直接联用,因此得到广泛的应用。但是目前大多数萃取涂层材料价格昂贵,且选择性较差,开发高选择性、高稳定性的涂层材料对SPME技术发展尤为关键。
2.1.6 凝胶渗透色谱法
凝胶渗透色谱法(gel permeation chromatography, GPC)主要是通过化学性质相似但分子体积不同而进行分离,即大分子物质先流出,小分子后流出,可去除大分子物质。且对于分子体积相差较大的物质分离效果较好。LUCIA等[34]通过ASE提取,GPC纯化,GC-MS检测技术对蓝贻贝、鲑鱼鱼片、鱼油和鱼饲料中24种PAHs进行定性与定量分析,结果显示,小分子苊(Ace)、芴(Fl)、芘(Py)和苯并(a)蒽(BaA)的定量受到了限制,苯并(a)芘(BaP)的检出限和定量限分别为1.7 pg/g和0.44 pg/g。该方法可用于海洋基质中石油类化合物的定性鉴别。于徊萍等[35]利用GPC净化,GC-MS分析食用油脂中16种PAHs,回收率在80.6%~106.7%,检出限为0.11~1.1 μg/kg。
2.1.7 QuEChERS
QuEChERS是快速(quick)、简便(easy)、廉价(cheap)、有效(effective)、可靠(rugged)及安全(safe)的样品前处理技术的缩写,样品经过溶剂提取后,通过加入吸附剂与样品中干扰物结合,从而达到净化目的[36]。ODUNTAN等[37]采用优化后的QuEChERS前处理方法,使用HPLC-荧光定量分析了鲤鱼肌肉中的5种低分子量PAHs,萘(Nap)、苊(Ace)、菲(Phe)、芴(Flu)和芘(Pyr)。与索氏提取法相比较,提取PAHs的浓度相当,鲫鱼中PAHs的含量,芴的最小浓度为0.8 μg/kg, 苊的最大浓度为739 μg/kg。DUEDAHL等[38]建立并验证了QuEChERS法作为一种新的快速简便的PAHs筛选方法,并用于苯并(a)蒽(BaA)、![]() (Chr)、苯并(b)荧蒽(BbF)和苯并(a)芘(BaP)4种PAHs的定量分析,4种PAHs化合物的定量限在0.14~0.24 μg/kg(鱼类)和0.12~0.24 μg/kg(生大麦)。总回收率为88%~117%,重复性和内部重现性为2.6%~16%。该方法可作为评价熏鱼的快速筛选方法。QuEChERS因其高效便捷、绿色安全,在批量样品处理和检测中具有很大优势而得到广泛的使用,且随着科学技术的发展,自动化水平的提高,QuEChERS在肉制品等食品中PAHs的前处理上具有广阔的应用前景。
(Chr)、苯并(b)荧蒽(BbF)和苯并(a)芘(BaP)4种PAHs的定量分析,4种PAHs化合物的定量限在0.14~0.24 μg/kg(鱼类)和0.12~0.24 μg/kg(生大麦)。总回收率为88%~117%,重复性和内部重现性为2.6%~16%。该方法可作为评价熏鱼的快速筛选方法。QuEChERS因其高效便捷、绿色安全,在批量样品处理和检测中具有很大优势而得到广泛的使用,且随着科学技术的发展,自动化水平的提高,QuEChERS在肉制品等食品中PAHs的前处理上具有广阔的应用前景。
不同的前处理方法,优缺点不一,同时对PAHs提取效率和分析检测结果都可能造成不同程度的影响,不同前处理方法的优缺点比较见表2。针对不同样品特性,选择最适合的样品前处理方法,可以提高提取效率,从而保证分析结果的准确性和可靠性。
表2 多环芳烃前处理方法比较
Table 2 Comparison of pretreatment methods for PAHs

方法 优点缺点回收率范围/%超声波提取操作简单、快速高效、溶剂使用量低易产生空化效应71.1~98.8加速溶剂萃取萃取效率高、快速安全、重现性好技术成本高50~95微波辅助萃取节能环保、萃取效率高设备投资大、适宜条件有限77~105固相萃取技术操作简单、成本低、提取率高、减少干扰物质吸附剂选择性不高、误差较大73.4~90.7固相微萃取操作简单、用样少、效率高、易于自动化成本较高85.1~102.8凝胶渗透色谱全自动化、耗时短、成本低、安全系数高设备装置复杂80.6~106.7QuEChERS简便快捷、灵敏度高、绿色自动化净化效果不佳88~117
2.2 检测方法
PAHs的检测分析方法较多,主要涉及高效液相色谱法、气相色谱-质谱联用技术、毛细管电泳法、酶联免疫法、表面增强拉曼光谱技术等。
2.2.1 高效液相色谱法
GB 5009.265—2016中明确指出,高效液相色谱法是测定食品中PAHs的第一种方法。王春蕾等[40]通过在线固相萃取/高效液相色谱-紫外/荧光(Online-SPE/HPLC-UV/FLD)检测方法,对熏烤鱼和熏烤肉制品中15种PAHs进行检测,结果表明,标曲线性良好,熏烤鱼的回收率为67.4%~107.2%,熏烤肉制品的回收率为71.8%~110.5%。KHOSROWSHAHI等[41]利用一种由向日葵茎和石墨化氮化碳纳米片组成的绿色生物复合材料为固相萃取吸附剂,采用高效液相色谱结合紫外检测,最佳条件下5种PAHs的检出限和定量限分别可达0.4~32 ng/g和1.2~95 ng/g。另外,该方法也可应用于烤肉等PAHs的测定。HPLC检测存在分析时间长、基线易漂移等缺陷,今后发展关键在于提高其检测效率和结果准确性。
2.2.2 气相色谱-质谱法
气相色谱-质谱法是国家标准第二法,具有高分辨性和高灵敏度的特点,广泛应用于PAHs检测分析中。刘笑笑等[42]比较中性氧化铝柱、HLB小柱、分子印迹技术、GPC凝胶色谱净化技术、QuEChERS法5种不同萃取净化法结合气相色谱-串联质谱法检测烤肉中14种PAHs含量的效果,结果表明,分子印迹柱稳定性更好,成本更低,更适用于烤肉中14种PAHs残留的检测,分子印迹柱和GPC方法在烤肉制品中平均回收率为80%~100%。周华等[43]建立了一种快速、高效、准确的SPE联合GC-MS,测定烟熏、烘烤食品中16种PAHs,检出限0.03~0.10 μg/kg,定量限0.10~0.30 μg/kg。WICKRAMA等[44]采用高分辨率GC-MS测定了3种金枪鱼组织中卤代多环芳烃的含量,这是第一次在生物样品中发现大量的卤代多环芳烃,HPAHs可能对食用金枪鱼的消费者健康产生不利影响。GC-MS是目前分析复杂组分最有效的检测方法之一。是目前最常用的检测易挥发和半挥发性有机物的方法,可同时进行定性和定量分析。
2.2.3 毛细管电泳法
毛细管电泳法(capillary electrophoresis, CE)是一类以毛细管为分离通道、以高压直流电场为驱动力的新型液相分离分析技术,主要依据样品中各组分之间淌度和分配行为的差异来实现分离。CE是色谱和电泳相结合的分离分析技术。潘红等[45]建立了3种CE分析烤肉中PAHs,实验表明,胶束电动色谱-场放大样品堆积法检出限较低,能够应用于烤肉中多种痕量PAHs的快速富集和检测。FEREY等[46]优化了环糊精修饰的毛细管区带电泳分离方法,首次在CE中实现所有19种PAHs的完全分离,分析时间<18 min;优化后的CE可用于植物油等复杂基质的样品中PAHs的检测分析。
2.2.4 酶联免疫分析法
酶联免疫分析法主要是利用样品中抗原与抗体的可逆性结合这一特性,通过调控反应过程实现检测目的。KNOPP等[47]研究了ELISA直接测定样品PAHs的结果可行性,并在精确度和结果可靠性方面与HPLC进行了对比。结果表明,ELISA的选择性和灵敏度要显著优于HPLC,极大程度缩短了测定时间。BARCELO等[48]采用ELISA测定水中的PAHs,回收率为70%~95%。ELISA基于的原理是抗体的特异性,一般只适用于单一PAHs的检测,开发具有相对普适性,提高检测通量是ELISA技术发展的关键。
2.2.5 拉曼光谱技术
随着纳米技术和表征技术的发展,以拉曼光谱为基础发展起来的表面增强拉曼光谱(surface enhanced Raman spectroscopy, SERS)以超高的灵敏度在分析检测领域引起人们广泛的关注。肖旺等[49]利用硫醇修饰的银纳米点阵列作为SERS活性基底,SERS结合分子印迹技术快速检测食用油中的苯并(a)芘,检出限达5.0 ng/mL,回收率在93%~100%。王炬勇等[50]以银纳米粒子为SERS基底,结合液液萃取(liquid-liquid extraction, LLE)与流动注射分析(flow injection analysis, FIA)技术,发展了LLE-SERS与FIA-SERS两种检测方法,最终研发了一套船载式PAHs检测仪,为PAHs的现场检测提供了新的技术。
食品种类多样,组成成分以及加工工艺的不同都可能会增加PAHs的检测难度。因此,在实际检测过程中应当根据检测需要,结合检测方法的技术特点及待检样本的特性进行选择。不同检测方法的优缺点比较见表3。
表3 多环芳烃检测技术方法比较
Table 3 Comparison of polycyclic aromatic hydrocarbon detection techniques

检测方法优点缺点检出限、定量限及回收率高效液相色谱提取效率高、方便快捷、稳定度高基线易漂移LOD:0.4~32 ng/g;LOQ:1.2~95 ng/g;回收率:71.8%~110.5%气相色谱-质谱联用分析速度快、灵敏度高对检测对象高选择性LOD:0.03~0.10 μg/kg;LOQ:0.10~0.30 μg/kg;回收率:80%~100%毛细管电泳法无色谱柱污染、应用广泛、高效快速重现性较差回收率:90.6%~95.9%酶联免疫分析法灵敏度高、选择性高、样品容量大、分析成本低可能会存在假阳性结果回收率:70%~95%表面增强拉曼光谱法快速高效、检出限低、自动化易受外界环境影响LOD:5.0 ng/mL;回收率:93% ~100%
3 总结
随着科技的发展,多学科、多领域的新技术逐渐应用于PAHs检测分析,如何在国际上建立并统一高效、快速、可靠的PAHs在线分析检测技术是目前亟需研究和完成的热点。PAHs检测技术发展方向主要涉及简化样品前处理以及改进仪器,提高检测效率和准确度。近年来,样品前处理技术发展迅速,其核心在于萃取材料的制备与选择,新型的吸附材料如磁纳米粒子、分子印迹聚合物、金属有机框架化合物、碳纳米管等受到极大关注。选择性高、稳定性好的吸附材料对前处理具有决定性作用。
中国是肉类生产和消费大国,人们对安全健康食品的追求逐年上升,食品安全越来越受到广泛关注。联合多种先进新技术,构建在线富集、净化、检测等一体化分析技术,实现PAHs检测分析的高灵敏度、高通量、便携化、智能化是未来技术发展的关键。
[1] 赵冰,任琳,李家鹏,等.传统肉制品中多环芳烃来源和检测方法研究进展[J].肉类研究,2012,26(6):50-53.
ZHAO B,REN L,LI J P,et al.Research progress in sources and determination methods for polycyclic aromatic hydrocarbons in traditional meat products[J].Meat Research,2012,26(6):50 - 53.
[2] 陈曼, 何明,郭妍婷,等.烟熏油炸食品及食用油中PAHs的检测及控制方法研究进展[J].仲恺农业工程学院学报,2017,30(3):65-71.
CHEN M,HE M,GUO Y T,et al.Research progress on detection and control of polycyclic aromatic hydrocarbons in smoked fried foods and edible oils[J].Journal of Zhongkai University of Agriculture and Engineering,2017,30(3):65-71.
[3] 张浪, 杜洪振,田兴垒,等.煎炸食品中多环芳烃的生成及其控制技术研究进展[J].食品科学,2020,41(3):272-280.
ZHANG L,DU H Z,TIAN X L,et al.Formation and control of polycyclic aromatic hydrocarbons in fried foods:a review[J].Food Science,2020,41(3):272-280.
[4] 肖昭竞, 童兰艳,代政华,等.肉制品中多环芳烃检测技术研究进展[J].食品工业,2019,40(12):244-247.
XIAO Z J,TONG L Y,DAI Z H,et al.Review on determination technologies for polycyclic aromatic hydrocarbons in meat products[J].The Food Industry,2019,40(12):244-247.
[5] 崔国梅, 彭增起,孟晓霞.烟熏肉制品中多环芳烃的来源及控制方法[J].食品研究与开发,2010,31(3):180-183.
CUI G M,PENG Z Q,MENG X X.The sources and control methods of polycyclic aromatic hydrocarbons in smoked meat products[J].Food Research and Development,2010,31(3):180-183.
[6] 李锡东, 丁华,殷丽娜,等.多环芳烃检测方法研究进展[J].橡胶工业,2017,64(2):123-127.
LI X D,DING H,YIN L N,et al.Research progress on detection methods of polycyclic aromatic hydrocarbons[J]. China Rubber Industry,2017,64(2):123-127.
[7] 邵琪. 烤肉中4种多环芳烃检测方法的筛选及其应用的研究[D].哈尔滨:黑龙江东方学院,2019.
SHAO Q.Screening and application of 4 polycyclic aromatic hydrocarbons detection methods in grilled meat[D].Harbin:East University of Heilongjiang,2019.
[8] BOUVARD V,LOOUIS D,GUYTON K Z Z,et al.Carcinogenicity of consumption of red and processed meat[J].The Lancet Oncology,2015,16(16):1 599-1 600.
[9] GRANT W B.Air pollution in relation to U.S.cancer mortality rates:an ecological study;likely role of carbonaceous aerosols and polycyclic aromatic hydrocarbons[J].Anticancer Research,2009,29(9):3 537-3 545.
[10] HU H,KAN H D,KEARNEY G D,et al.Associations between exposure to polycyclic aromatic hydrocarbons and glucose homeostasis as well as metabolic syndrome in nondiabetic adults[J].Science of the Total Environment,2015,505:56-64.
[11] ANDERSEN Z J,RAASCHOU-NIELSEN O,KETZEL M,et al.Diabetes incidence and long-term exposure to air pollution:A cohort study[J].Diabetes Care,2012,35(1):92-98.
[12] RAASCHOU-NIELSEN O,SØRENSEN M,KETZEL M,et al.Long-term exposure to traffic-related air pollution and diabetes-associated mortality:A cohort study[J].Diabetologia,2013,56(1):36-46.
[13] ALSHAARAWY O,ZHU M T,DUCATMAN A M,et al.Urinary polycyclic aromatic hydrocarbon biomarkers and diabetes mellitus[J].Occupational and Environmental Medicine,2014,71(6):437-441.
[14] PERERA F,TANG D L,WHYATT R,et al.DNA damage from polycyclic aromatic hydrocarbons measured by benzo[a]Pyrene-DNA adducts in mothers and Newborns from northern Manhattan,the World Trade Center Area,Poland,and China[J].Cancer Epidemiology,Biomarkers & Prevention,2005,14(3):709-714.
[15] TARANTINI A,MA TRE A,LEF
TRE A,LEF BVRE E,et al.Polycyclic aromatic hydrocarbons in binary mixtures modulate the efficiency of benzo[a]Pyrene to form DNA adducts in human cells[J].Toxicology,2011,279(1-3):36-44.
BVRE E,et al.Polycyclic aromatic hydrocarbons in binary mixtures modulate the efficiency of benzo[a]Pyrene to form DNA adducts in human cells[J].Toxicology,2011,279(1-3):36-44.
[16] 刘宜奇, 胡长鹰.食品中多环芳烃的安全性研究进展[J].食品科学,2019,40(19):353-362.
LIU Y Q,HU C Y.Recent advances in understanding the safety of polycyclic aromatic hydrocarbons in foods[J].Food Science,2019,40(19):353-362.
[17] 沈习习, 汤晓艳,战俊良,等.烧烤肉中多环芳烃的检测方法及控制措施[J].中国食物与营养,2019,25(11):21-25.
SHEN X X,TANG X Y,ZHAN J L,et al.Research progress in testing standards and control technologies of polycyclic aromatic hydrocarbons (PAHs) in grilled meat products[J].Food and Nutrition in China,2019,25(11):21-25.
[18] ROZENTALE I,ANCANS J,BARTKIENE E,et al.Efficacy of ozonation treatments of smoked fish for reducing its benzo[a]Pyrene concentration and toxicity[J].Journal of Food Protection,2016,79(12):2 167-2 173.
[19] European Food Safety Authority (EFSA).Polycyclic aromatic hydrocarbons in food-scientific opinion of the panel on contaminants in the food chain[J].EFSA Journal,2008,6(8):724.
[20] EU.Commission Regulation (EU) No 835/2011 of 19 August 2011 amending Regulation (EC) No 1881/2006 as regards maximum levels for polycyclic aromatic hydrocarbons in foodstuffs[J].Official Journal of the European Union,2011,215(8):4-8.
[21] 国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 2762—2017 食品安全国家标准 食品中污染物限量[S].北京:中国标准出版社,2017.
National Health and Family Planning Commission,State Food and Drug Administration.GB 2762—2017 National food safety standards limit of pollutants in food[S].Beijing:China Standards Press,2017.
[22] MOTTIER P,PARISOD V,TURESKY R J.Quantitative determination of polycyclic aromatic hydrocarbons in barbecued meat sausages by gas chromatography coupled to mass spectrometry[J].Journal of Agricultural and Food Chemistry,2000,48(4):1 160-1 166.
[23] 姜新杰, 高振江,张世湘,等.北京烤鸭中多环芳烃分析测定方法探索[J].中国家禽,2007,29(10):56-58.
JIANG X J,GAO Z J,ZHANG S X,et al.Analysis and determination of polycyclic aromatic hydrocarbons in Beijing roast duck[J].China Poultry,2007,29(10):56-58.
[24] 潘峰, 王艺霏,郑松涛.超声-索氏提取法提取焦化厂土壤中多环芳烃[J].河南师范大学学报(自然科学版),2010,38(5):122-124.
PAN F,WANG Y F,ZHENG S T,Solvent extraction separation polycyclic aromatic hydrocarbons in coking soil with co-assisted ultrasonic and soxhlet technology[J].Journal of Henan Normal University (Natural Science),2010,38(5):122-124.
[25] 阳文武, 谭顺中,郭娅,等.多环芳烃分子印迹柱-高效液相色谱荧光检测法快速测定烤肉中15种多环芳烃[J].肉类研究,2018,32(11):47-52.
YANG W W,TAN S Z,GUO Y,et al.Determination of 15 polycyclic aromatic hydrocarbons in barbecued meat by molecularly imprinted solid-phase extraction combined with high performance liquid chromatography-fluorescence detection[J].Meat Research,2018,32(11):47-52.
[26] 周蕾, 陈溪,袁明珠,等.加速溶剂萃取和凝胶渗透色谱净化GC-MS法测定烟熏腊肉中16种多环芳烃[J].化学分析计量,2016,25(1):15-18.
ZHOU L,CHEN X,YUAN M Z,et al.Determination of 16 kinds of polycyclic aromatic hydrocarbons in smoked bacon by ASE coupled with GPC and GC-MS[J].Chemical Analysis and Meterage,2016,25(1):15-18.
[27] 李聪, 赵颖,徐宝才,等.加速溶剂萃取-高效液相色谱-荧光检测法测定哈尔滨红肠中的4种多环芳烃[J].肉类研究,2017,31(12):36-40.
[28] LI C,ZHAO Y,XU B C,et al.Detection of four polycyclic aromatic hydrocarbons in Harbin red sausage by accelerated solvent extraction coupled with high performance liquid chromatography with fluorescence detection[J].Research on Rabbit Meat Products,2017,31(12):36-40.
[28] PURCARO G,MORET S,CONTE L S.Optimisation of microwave assisted extraction (MAE) for polycyclic aromatic hydrocarbon (PAH) determination in smoked meat[J].Meat Science,2009,81(1):275-280.
[29] GHASEMZADEH-MOHAMMADI V,MOHAMMADI A,HASHEMI M,et al.Microwave-assisted extraction and dispersive liquid-liquid microextraction followed by gas chromatography-mass spectrometry for isolation and determination of polycyclic aromatic hydrocarbons in smoked fish[J].Journal of Chromatography A,2012,1 237:30-36.
[30] KAFOURIS D,KOUKKIDOU A,CHRISTOU E,et al.Determination of polycyclic aromatic hydrocarbons in traditionally smoked meat products and charcoal grilled meat in Cyprus[J].Meat Science,2020,164:108 088.
[31] PAN Y,ZHANG Y H,PENG Z F,et al.Enrichment and determination of sixteen trace polycyclic aromatic hydrocarbons in barbecue smoke by using a continuous magnetic solid‐phase extraction and gas chromatography-mass spectrometry[J].Separation Science Plus,2020,3(1-2):28-36.
[32] MA T T,SHEN X F,YANG C,et al.Covalent immobilization of covalent organic framework on stainless steel wire for solid-phase microextraction GC-MS/MS determination of sixteen polycyclic aromatic hydrocarbons in grilled meat samples[J].Talanta,2019,201:413-418.
[33] 康迪, 王亚林,贾金平,等.活性炭纤维-固相微萃取技术快速检测烤肉中多环芳烃[J].环境科学与技术,2011,34(9):88-91;118.
KANG D,WANG Y L,JIA J P,et al.Solid-phase micro-extraction with activated carbon fiber for quick determination of PAHs in roasted meat[J].Environmental Science & Technology,2011,34(9):88-91;118.
[34] LIGUORI L,HEGGSTAD K,HOVE H T,et al.An automated extraction approach for isolation of 24 polyaromatic hydrocarbons (PAHs) from various marine matrixes[J].Analytica Chimica Acta,2006,573-574:181-188.
[35] 于徊萍, 刘亚娜,刘鹏,等.凝胶渗透色谱净化-气相色谱/质谱法同时测定食用油脂中16种多环芳烃[J].环境化学,2019,38(2):438-441.
YU H P,LIU Y N,LIU P,et al.Determination of 16 polycyclic aromatic hydrocarbons residual in edible oils by gel permeation chromatography-gas chromatography-mass spectrum[J].Environmental Chemistry,2019,38(2):438-441.
[36] 杜磊, 徐华超,周卓为,等.QuEChERS/气相色谱质谱法同时测定膨化食品中多环芳烃类物质[J].广州化学,2020,45(2):22-27.
DU L,XU H C,ZHOU Z W,et al.Determination of PAHs in fried expanded food by QuEChERS/GC-MS/MS[J].Guangzhou Chemistry,2020,45(2):22-27.
[37] ODUNTAN,A O,TAVENGWA N T,CUKROWSKA E,et al.QuEChERS method development for bio-monitoring of low molecular weight polycyclic aromatic hydrocarbons in South African carp fish using HPLC-fluorescence:an initial assessment:research article[J].South African Journal of Chemistry,2016,69:98-104.
[38] DUEDAHL-OLESEN L,IVERSEN N M,KELMO C,et al.Validation of QuEChERS for screening of 4 marker polycyclic aromatic hydrocarbons in fish and malt[J].Food Control,2020,108:106434.
[39] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB.5009.265—2016 食品安全国家标准食品中多环芳烃的测定[S].北京:中国标准出版社,2017.
National Health and Family Planning Commission,State Food and Drug Administration.GB 5009.265—2016.Determination of polycyclic aromatic hydrocarbons in food according to national food safety standard[S].Beijing:China Standards Press,2017.
[40] 王春蕾, 蒋树新,刘华良,等.在线固相萃取/高效液相色谱法检测熏烤鱼及熏烤肉制品中的多环芳烃[J].分析测试学报,2016,35(7):805-810.
WANG C L,JIANG S X,LIU H L,et al.Determination of polycyclic aromatic hydrocarbons in smoked fish and smoked meat by online solid-phase extraction and high performance liquid chromatography[J].Journal of Instrumental Analysis,2016,35(7):805-810.
[41] MARZI KHOSROWSHAHI E,RAZMI H.Application of sunflower stalk-carbon nitride nanosheets as a green sorbent in the solid-phase extraction of polycyclic aromatic hydrocarbons followed by high-performance liquid chromatography[J].Journal of Separation Science,2018,41(9):2 020-2 028.
[42] 刘笑笑, 张菁菁,丁辉,等.分子印迹-气相色谱-串联质谱法检测烤肉中的14种多环芳烃[J].食品安全质量检测学报,2019,10(14):4 557-4 564.
LIU X X,ZHANG J J,DING H,et al.Determination of 14 kinds of polycyclic aromatic hydrocarbons in barbecue by molecular imprinting-gas chromatography-tandem mass spectrometry[J].Journal of Food Safety & Quality,2019,10(14):4 557-4 564.
[43] 周华, 黄琴,宋晨黎,等.气质联用法同时测定烟熏烘烤食品中16种多环芳烃[J].中国预防医学杂志,2020,21(4):417-421.
ZHOU H,HUANG Q,SONG C L,et al.Simultaneous detection of 16 polycyclic aromatic hydrocarbons in smoked-baked food using gas chromatography-mass spectrometry[J].Journal of Chinese Preventive Medicine,2020,21(4):417-421.
[44] WICKRAMA-ARACHCHIGE A U K,HIRABAYASHI T,IMAI Y,et al.Accumulation of halogenated polycyclic aromatic hydrocarbons by different tuna species,determined by high-resolution gas chromatography Orbitrap mass spectrometry[J].Environmental Pollution,2020,256:113487.1-113487.8.
[45] 潘红. 烤肉中多环芳烃的检测[D].无锡:江南大学,2009.
PAN H.Detection of polycyclic aromatic hydrocarbons in roast meat[D].Wuxi:Jiangnan University,2009.
[46] FEREY L,DELAUNAY N,RUTLEDGE D N,et al.An experimental design based strategy to optimize a capillary electrophoresis method for the separation of 19 polycyclic aromatic hydrocarbons[J].Analytica Chimica Acta,2014,820:195-204.
[47] KNOPP D,SEIFERT M,V
 N
N N E N,et al.Determination of polycyclic aromatic hydrocarbons in contaminated water and soil samples by immunological and chromatographic methods[J].Environmental Science & Technology,2000,34(10):2 035-2 041.
N E N,et al.Determination of polycyclic aromatic hydrocarbons in contaminated water and soil samples by immunological and chromatographic methods[J].Environmental Science & Technology,2000,34(10):2 035-2 041.
[48] BARCEL D,OUBI
D,OUBI A A,SALAU J S,et al,Determination of PAHs in river water samples by ELISA[J].Analytica Chimica Acta,1998,376(1):49-53.
A A,SALAU J S,et al,Determination of PAHs in river water samples by ELISA[J].Analytica Chimica Acta,1998,376(1):49-53.
[49] 肖旺. 基于表面增强拉曼光谱技术快速检测苯并(a)芘的研究[D].广州:华南理工大学,2017.
XIAO W.Rapid detection of benzo(a)pyrene based on surface-enhanced Raman spectroscopy technique[D].Guangzhou:South China University of Technology,2017.
[50] 王炬勇. 基于表面增强拉曼光谱技术对环境水体中痕量多环芳烃的检测研究[D].厦门:厦门大学,2019.
WANG J Y.Detection of trace polycyclic aromatic hydrocarbons in environment water based on surface-enhanced Raman spectroscopy[D].Xaimen:Xiamen University,2019.