蜡样芽胞杆菌(Bacillus cereus)是蜡样芽胞杆菌族(Bacillus cereus sensu lato)的重要成员之一,是一种常见的食源性致病菌,广泛存在于水、空气、土壤和食品中,在长时间室温放置的米饭等淀粉类食品中经常被发现[1]。部分高毒力菌株产呕吐毒素,能导致爆发性,甚至致死性的食物中毒事件[2]。呕吐毒素是一种小分子缩合肽,它对酸、碱、热稳定,在一般的食品加工中不易被破坏,且其活性不受胃蛋白酶的干扰,所以在活菌被消除的情况下仍能引起食物中毒[3]。
蜡样芽胞杆菌大多具有青霉素耐药性。β-内酰胺类抗生素的靶标是细菌的细胞壁,通过抑制青霉素结合蛋白(penicillin-binding proteins,PBPs)的转肽酶活性减少肽聚糖的生物合成,使细胞膜受到损伤,随后细菌裂解死亡[4]。当外界环境发生变化时,为了维持正常的生命活动,许多细菌利用σ因子,如胞外功能(extracytoplasmic function,ECF)σ因子来响应细胞壁损伤,这些因子都是在特定条件下经诱导被激活后发挥作用[5]。σP(SigP)就是一个在蜡样芽胞杆菌族成员中发现的ECF σ因子[6]。β-内酰胺酶的表达受到了SigP的调控,而SigP的激活则依赖于抗SigP因子RsiP的降解[7],因此RsiP是调控蜡样芽胞杆菌青霉素耐药性的重要因子。
本研究从解放军总医院第五医学中心食物中毒病人的食物残渣中分离出1株含有高呕吐毒素毒力的蜡样芽胞杆菌,命名为BC307。BC307具有青霉素抗性,对RsiP进行分析,将RsiP蛋白进行原核表达并纯化,制备多克隆抗体,验证蜡样芽胞杆菌中RsiP蛋白的表达,为蜡样芽胞杆菌耐药性的研究提供基础。
1 材料与方法
1.1 菌株
蜡样芽胞杆菌BC307(中国医学细菌保藏管理中心,编号CMCC(B)63317);蜡样芽胞杆菌HN001(腹泻型食物中毒分离株);炭疽芽胞杆菌疫苗株A16R;苏云金芽胞杆菌BT9727;感受态细胞BL21(DE3),北京全式金生物技术有限公司。
1.2 实验动物
无特定病原(specified pathogen free, SPF)级,BALB/c小鼠,5周龄,雌性,北京维通利华实验动物有限公司。
1.3 实验试剂
二硫苏糖醇(dithiothreitol,DTT)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、NaCl、甘油、咪唑、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside, IPTG)、硫酸卡那霉素、Trition X-100,生工生物工程(上海)股份有限公司;Bradford蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;Ni-IDA琼脂糖凝胶、SDS-PAGE上样缓冲液、SDS-PAGE电泳缓冲液、SDS-PAGE预制胶、SDS-PAGE Marker,南京铭研生物科技有限公司;HRP-羊抗鼠IgG(H+L)、免疫佐剂QuickAntibody-Mouse3 W,北京康为世纪生物科技有限公司。
1.4 BC307菌株的分离和初步鉴定
称取50 g病人的食物残渣,加生理盐水至110 g。充分匀浆混匀后,吸取1 mL悬浊液稀释至10-5后吸取1 mL接种在LB琼脂培养基上,用L型涂布棒涂布于整个表面,置于37 ℃恒温箱培养10~13 h后进行计数,选取菌落做验证实验。
首先利用16S rDNA序列鉴定分离株的种属[8],再用gyrB序列[9]和炭疽芽胞杆菌毒力大质粒上特异性引物lef(位于pXO1)[10]和capC(位于pXO2)[11]进一步鉴定,以与炭疽芽胞杆菌区分。引物由北京天一辉远生物科技有限公司合成,序列如表1。
表1 目的基因引物信息
Table 1 Primers for target genes

目的基因引物序列(5’-3’)产物长度/bp退火温度/℃16SF:AGAGTTTGATCCTGGCTCAGR:GGCTACCTTGTTACGACTT1 51350gyrBF:ATTGGTGACACCGATCAAACAR:TCATACGTATGGATGTTATTC36545lefF:AATCGCTCCAGTGTTGATAGTGR:TGAGTGGTCCCGTCTTTATCC88552capCF:GGTAACCCTTGTCTTTGAATTGR:GTATTAGGAGTTACACTGAGCC37450cesAF:TTCGGTGTTACTGTGTCTGR:ATCGCATTCTCTTCCATCC74550cesBF:AGACAGCATTCCGATTGGR:TTCACTACCTTCACGCATT86748cesCF:CATGTCGGCTATCTTCCAGR:GCAACCAGATTCTCCACTT52745cesDF:GTGACAAGACCATTAGACCR:ACCTGAGACGATTAGTAGTA46547cesHF:TCTGTTGTGGCAATAGGTR:GGAATGATAACTCCTTGACA43447cesPF:AGGTGTGGATGTGGAGAAR:GATTGTCGGTCAGCCTAC41050cesTF:CAGGCGGAAGTGCTAATGR:GTCCTCCTTCATAATGTATCAG60949
挑取平板上的单克隆菌落进行革兰氏染色并镜检。
利用蜡样芽胞杆菌产生磷脂酶[12]和溶血素[13]的特性鉴定分离株,将LB固体平板上挑选的单克隆分别涂布在卵黄平板和绵羊血平板上,37 ℃培养10~13 h后,与炭疽芽胞杆菌疫苗株A16R(缺失pXO2)[14]进行比较,拍照记录。
挑取BC307单克隆菌落接种于5 mL LB液体培养基,37 ℃、220 r/min振荡培养13 h,取400 μL菌液涂布LB固体平板,待菌液吹干后按照说明书轻轻贴上氨苄西林Etest药敏试纸条,在37 ℃培养箱中孵育,10 h后判读试纸条。
1.5 管家基因和毒力基因的鉴定
通过PCR扩增蜡样芽胞杆菌族菌株BC307的管家基因(glp、gmk、ilv、pta、pur、pyc、tpi)[14]并测序,对BC307与其他11株蜡样芽胞杆菌族菌株(BC-AH187、BC-NC7401、BC-10987、BC-14579、BC-AH820、BC-E33L、BA-A2012、BA-Ames、BA-Ames Ancestor、BT-HD73、BT-9727)一起进行多位点序列分型分析(Multilocus Sequence Typing,MLST),使用MEGA-X生成聚类树图[15],在线编辑聚类树图使用(https://itol.embl.de/)。通过PCR扩增毒力基因ces基因簇[16],引物信息如表1。
1.6 抗sigma因子RsiP的生物信息分析
蜡样芽胞杆菌族成员中,炭疽芽胞杆菌、蜡样芽胞杆菌和苏云金芽胞杆菌研究最为广泛,它们的DNA序列具有极高的同源性[17],但是蜡样芽胞杆菌和苏云金芽胞杆菌具有青霉素耐药性而炭疽杆菌一般对青霉素敏感[18]。为探究RsiP对细菌青霉素耐药性的影响,我们对蜡样芽胞杆菌族成员炭疽芽胞杆菌Ames菌株、蜡样芽胞杆菌BC307、苏云金芽胞杆菌BT9727的RsiP氨基酸序列同源性进行BLAST分析。
SigP-bla1开放阅读框和BLAST分析采用NCBI(https://www.ncbi.nlm.nih.gov/)在线工具和DNAMAN软件;蛋白质序列分析和分子量预测采用ExPASy在线Scan Prosite程序(http://www.expasy.org/tools/pi_tool.html)。
1.7 蜡样芽胞杆菌BC307 RsiP蛋白诱导表达及纯化
重组表达载体pET28a-sumo-rsiP[19]由北京天一辉远生物科技有限公司构建,将其转化至BL21(DE3)感受态细胞中,构建表达菌株pET28a-rsiP-BL21。挑取pET28a-rsiP-BL21单克隆菌株于25 mL LB培养基(含有30 μg/mL Kan)中37 ℃振荡培养、过夜活化,次日,按2%体积比转接于1 L新鲜LB培养基(含有30 μg/mL Kan)中,37 ℃,200 r/min振荡培养,至OD600为0.6时取1 mL菌液作为诱导前留样;加入终浓度为0.5 mmol/L的IPTG,20 ℃、200 r/min 诱导15 h。取1 mL菌液作为诱导后留样,2管留样12 000 r/min离心2 min收集菌体,弃上清液,加入100 μL 1×PBS振荡重悬菌体,取20 μL加入5 μL 5×SDS凝胶电泳上样缓冲液,混匀后100 ℃煮沸5 min,12 000 r/min 离心1 min,取其上清液进行SDS-PAGE电泳检测。
将诱导后的菌液4 ℃,6 000 r/min离心20 min收集菌体沉淀,超声裂解,以缓冲液[20 mmol/L Tris(pH 8.0)、300 mmol/L NaCl和20 mmol/L 咪唑溶于纯水中]平衡Ni-IDA柱,最后用不同浓度咪唑的平衡缓冲液洗脱目标蛋白,并收集每个组分进行SDS-PAGE分析检测。将收集的目的蛋白,用50倍体积的1×PBS透析过夜,加入sumo酶在4 ℃酶切12 h,然后过镍柱收集流穿液,获得RsiP重组蛋白。
1.8 RsiP抗体制备及血清效价测定
选择5只雌性BALB/c小鼠,5周龄,按照每剂100 μL用量将抗原与佐剂1∶1混合,皮下多点注射,100 μL/只,14 d后加强免疫。第22天尾尖采血并分离血清,-20 ℃备用。采用ELISA法测定血清抗体滴度:用包被液将抗原稀释至1 μg/mL,100 μL/孔加至酶标板,37 ℃孵育1 h;1× PBST洗板3次,加入封闭液,200 μL/孔,4 ℃过夜后弃封闭液;加入用PBS稀释的待检血清(起始稀释度1∶10),100 μL/孔,同时设阴性对照,37 ℃孵育1 h;1×PBST洗板3次,加入二抗(与TBST稀释比例为1∶5 000),100 μL/孔,37 ℃孵育1 h;1×PBST洗板3次,加入底物液,100 μL/孔,室温放置5~8 min;加入终止液终止反应,50 μL/孔,酶标仪测定A450/A620,实验孔与阴性对照孔的比值大于2.1且不小于0.2判定为阳性。最后进行血清采集、分离。
1.9 Western Blotting检测蜡样芽胞杆菌族成员RsiP蛋白的表达
制备炭疽芽胞杆菌、蜡样芽胞杆菌、苏云金芽胞杆菌全菌蛋白样品,将细菌培养至T3时期(生长曲线进入稳定期后的第3 h),4 ℃、8 000 r/min离心8 min,收集50 mL菌体,用低盐PBS重悬洗3次。用预先配好的5 mL裂解液(7 mol/L尿素与1% DTT溶于纯水中)重悬菌体,分装至硬壁管中,加入0.1 mm直径的玻璃珠,在Precellys24均质器上6 500 r/min振荡破碎菌体,每次20 s,冰上冷却5 min,重复15次。20 ℃、1 200 r/min离心10 min,重复2次,收取上清液蛋白,尽量去除杂质和玻璃珠。
取上清液蛋白与2×SDS-PAGE上样缓冲液等比例混匀,100 ℃水浴8 min,冷却后上样,进行12% SDS-PAGE电泳。然后将蛋白转移至聚偏二氟乙烯膜上,在封闭液中(5%脱脂奶粉,溶于TBST)37 ℃封闭1 h。用RsiP抗血清作为一抗(与TBST稀释比例为1∶500~1∶2 000)包被,室温轻摇1 h,用TBST洗3次,每次7 min;用羊抗鼠作为二抗(与TBST稀释比例为1∶5 000)包被,室温轻摇1 h,用TBST洗3次,每次7 min,DAB显色。
2 结果与分析
2.1 菌株的分离和初步鉴定
取1 mL样品,稀释105倍后取1 mL涂板,培养10~13 h后,平板上的菌落数共计12 CFU。计算出食物中毒病人食物残渣中活菌浓度为2.64×105CFU/g。BC307的16S rDNA PCR扩增结果如图1-a,在1 500 bp处有明显条带,测序后经BLSAT比对后,与蜡样芽胞杆菌NC7401、AH187等同源性达100%。利用PCR方法检测蜡样芽胞杆菌基因组上特异性引物gyrB,炭疽芽胞杆菌毒力大质粒上特异性引物lef(位于pXO1)和capC(位于pXO2),发现该菌株可以扩增出gyrB基因特异性条带,而lef和capC基因无条带(图1-b);并且经过测序,BC307的gyrB序列与HN001相似度为100%,可初步认为此菌株为蜡样芽胞杆菌。染色后显微镜下观察,该菌为革兰氏阳性菌,菌体为杆状、末端方,呈短或长链,能产芽胞,芽胞圆形或柱形(图1-c),且没有伴胞晶体,该菌株与蜡样芽胞杆菌的形态表现一致。将LB肉汤固体平板上的BC307单克隆菌落分别涂布在卵黄平板和绵羊血平板上,培养10 h后,与炭疽芽胞杆菌A16R相比,BC307菌落出现了明显的卵磷脂环(图1-d)和溶血环(图1-e),符合蜡样芽胞杆菌的特征。经10 h的培养,BC307在LB平板上长满菌落,没有在Etest试纸条周围出现抑菌环(图1-f),对青霉素有非常强的抗性,与蜡样芽胞杆菌耐药特点相符。
综上,通过菌落计数、16S rDNA鉴定、特异性基因PCR鉴定、菌株生理生化鉴定、药敏试验及显微镜下菌体形态鉴定发现,该食物中毒病例中分离的菌株可以扩增出蜡样芽胞杆菌基因组特异性基因gyrB,存在卵磷脂环和溶血现象,具有青霉素耐药性,菌体形态与蜡样芽胞杆菌HN001相似,能够正常形成芽胞,因此,初步确定该菌株为蜡样芽胞杆菌并命名为BC307,该菌株目前已在中国医学细菌保藏管理中心中心保藏,编号为CMCC(B)63317。

a、b-PCR产物1.5%琼脂糖凝胶电泳图,M-Marker,1-BC307, 2-HN001,3-A16R;c-分离菌的革兰氏染色镜检图;d-卵黄 平板和e-血平板,1~5代表分离株BC307的5个单克隆,平板中心 A16R为炭疽芽胞杆菌,作为阴性对照;f-Etest药敏试验
图1 分离株的鉴定
Fig.1 Identification of isolates
2.2 菌株MLST分析和毒力基因的分析
我们进一步对BC307进行了MLST基因分型分析,根据管家基因的测序结果,使用在线工具https://pubmlst.org/organisms/bacillus-cereus进行比对,结果显示BC307属于ST26序列型。使用MEGA X软件,与其他11株蜡样芽胞杆菌群菌株一起构建UPGMA树。进化距离使用最大合成似然法计算[20],单位是每个位点的碱基取代数。该分析涉及12个核苷酸序列,对于每个序列对,删除所有歧义位置(成对删除选项),进行了进化分析。BC307与其他ST26序列型成员,如NC7401等产呕吐毒素的蜡样芽胞杆菌,能在进化树上聚类到一支,说明它们有高度的相似性(图2-a)。
呕吐毒素由非核糖体肽合成酶合成,编码基因ces基因簇共24 kb,位于208 kb的大质粒上,包含cesA、cesB、cesC、cesD、cesH、cesP、cesT共7个编码区[21],如图2-b所示。利用ces基因簇的引物PCR扩增BC307菌落,结果为阳性(图2-c),证明BC307基因组中存在ces基因簇,BC307为产呕吐毒素的高毒力蜡样芽胞杆菌菌株。
2.3 菌株青霉素抗性基因的分析
细菌对青霉素耐药与β-内酰胺酶密切相关,β-内酰胺酶一般由bla基因编码。在青霉素的诱导下[5],蜡样芽胞杆菌中的RsiP蛋白被多种蛋白酶降解,不再阻遏SigP的表达,SigP获得自由后,调控自身与bla的转录,提高β-内酰胺酶的表达[7],从而使细菌对氨苄青霉素耐药,调控关系如图3-a。

a-分离株的多位点序列分型;b-ces基因簇序列,共含有cesA、cesB、 cesC、cesD、cesH、cesP、cesT 7个编码区;c-分离株毒素基因PCR产物 1.5%琼脂糖凝胶电泳分析,M- Marker,1~7分别代表ces 基因簇7个编码区
图2 BC307毒力基因分析
Fig.2 Virulence gene analysis of BC307
在NCBI网站在线对炭疽芽胞杆菌BA-Ames、蜡样芽胞杆菌BC307、苏云金芽胞杆菌BT9727的RsiP氨基酸序列进行了BLAST分析(图3-b)。根据分析结果得知,炭疽芽胞杆菌的RsiP氨基酸序列与蜡样芽胞杆菌和苏云金芽胞杆菌相似性达98.07%。

a-炭疽芽胞杆菌Ames、蜡样芽胞杆菌BC307和苏云金芽胞杆菌 BT9727的sigP-bla1开放阅读框;b-炭疽芽胞杆菌Ames、蜡样芽胞杆 菌BC307和苏云金芽胞杆菌BT9727 RsiP氨基酸序列的BLAST分析
图3 BC307青霉素抗性基因的分析
Fig.3 Penicillin resistance gene analysis of BC307
2.4 外源蛋白的诱导表达
采用ExPASy在线Scan Prosite程序和Tmpred软件分析蜡样芽胞杆菌BC307 RsiP蛋白分子质量和跨膜情况,结果显示RsiP蛋白分子质量约为32 kDa,在54~71位氨基酸处有一个跨膜结构域。为了优化蛋白外源表达和纯化,构建表达载体时保留预测的RsiP蛋白膜内区域,预计重组蛋白分子质量约为25 kDa。将表达质粒转化BL21(DE3),诱导表达后得到蛋白大约40 kDa的目的条带,与含标签的目的蛋白预期大小一致;sumo酶切后得到25 kDa的条带,与目的蛋白预期大小一致。经镍柱亲和纯化成功获得了高纯度的RsiP重组蛋白,12% SDS-PAGE 检测蛋白表达纯化效果(图4-a)。
2.5 ELISA检测抗体效价
将RsiP蛋白免疫BALB/c小鼠制备多克隆抗体,采用ELISA法检测血清IgG效价。将抗血清稀释不同浓度(1∶10~1∶1 280),实验结果显示佐剂对照组几乎不产生RsiP抗体,实验组RsiP蛋白的血清效价高达1∶1 280,RsiP蛋白能刺激小鼠产生较强的免疫应答,我们得到了高效价的RsiP多克隆鼠抗抗体(图4-b)。
2.6 Western Blotting鉴定
将炭疽芽胞杆菌B17D2、蜡样芽胞杆菌BC307和苏云金芽胞杆菌BT9727的菌体蛋白作为抗原,RsiP抗血清作为一抗,通过Western Blotting进行鉴定。结果显示小鼠血清中的抗体能与RsiP蛋白特异性结合。炭疽芽胞杆菌、蜡样芽胞杆菌和苏云金芽胞杆菌胞内RsiP蛋白表达量无明显差异(图4-c,4-d)。
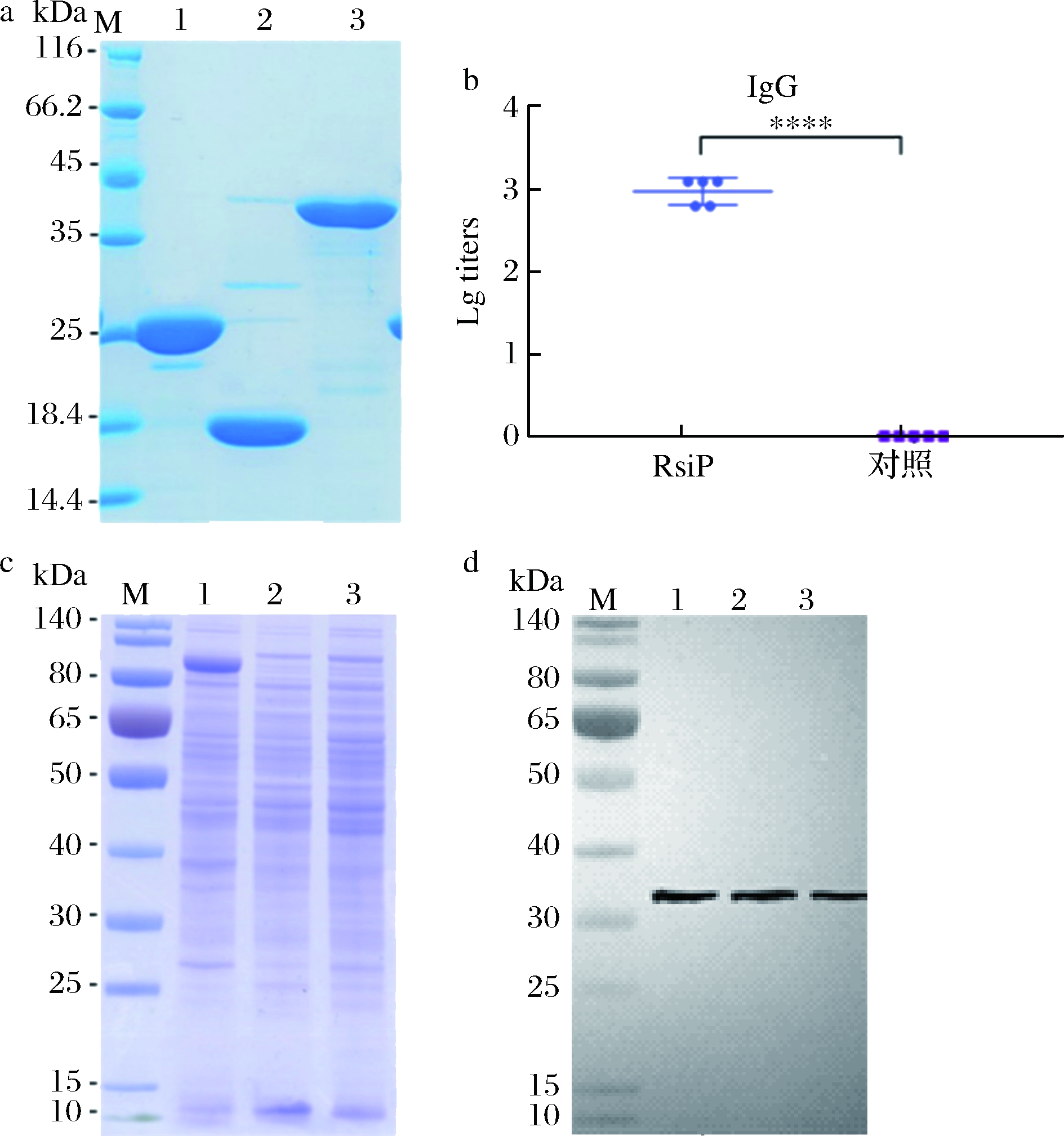
a-重组RsiP蛋白SDS-PAGE 分析,M-Marker, 1-RsiP蛋白,2-Sumo 标签,3-含sumo标签的RsiP蛋白;b-RsiP抗体效价;c-细菌中RsiP 蛋白的SDS-PAGE,d-抗体对细菌中RsiP蛋白的Western Blotting分析, M-Marker;1-炭疽芽胞杆菌A16R;2-蜡样芽胞杆菌BC307; 3-苏云金芽胞杆菌BT9727
图4 RsiP的表达纯化及抗体制备
Fig.4 Expression, purification and antibody preparation of RsiP
3 结论与讨论
蜡样芽胞杆菌引起的食物中毒对食品安全和人们的身体健康造成威胁。本研究在食物中毒病人食物残渣中分离鉴定出一株产呕吐毒素的蜡样芽胞杆菌,命名为BC307,其具有很强的青霉素耐药性。蜡样芽胞杆菌群的成员非常相似,对蜡样芽胞杆菌的鉴定首先要排除其是炭疽芽胞杆菌的可能性。16S rDNA鉴定不能有效地区分炭疽芽胞杆菌和蜡样芽胞杆菌。因此本研究在16S rDNA鉴定的基础上,又通过特异性基因gyrB、lef、capC进行了验证。通过溶血、卵磷脂酶等表型及青霉素耐药性的鉴定,初步确定BC307为蜡样芽胞杆菌。进一步分析证明,BC307属于蜡样芽胞杆菌ST26序列型,该序列型的成员如NC7401、AH187等均属于产呕吐毒素的高毒菌株[22]。因此进一步对BC307的ces基因簇进行扩增,发现BC307含有完整的ces基因簇,说明BC307也应是产呕吐毒素的高毒力菌株,这也与病人食物中毒的呕吐症状相符[23]。
青霉素敏感实验也可以用于区分蜡样芽胞杆菌与炭疽芽胞杆菌。炭疽芽胞杆菌一般对青霉素敏感,而多数蜡样芽胞杆菌对青霉素类抗生素耐药。在蜡样芽胞杆菌β-内酰胺酶的调控系统中,RsiP是一个关键调控因子。本实验成功构建了pET28a-sumo-rsiP重组表达载体,在大肠杆菌中sumo标签大大提高了蛋白的可溶性表达,获得了高纯度RsiP蛋白。制备的RsiP蛋白鼠抗血清具有较高的效价,可用于蜡样芽胞杆菌族成员的RsiP蛋白检测,为进一步探究RsiP在青霉素抗性调控机制中的作用以及蜡样芽胞杆菌耐药性研究提供了实验基础。
此外,炭疽芽胞杆菌青霉素敏感的原因尚不清晰,有研究表明炭疽杆菌β-内酰胺酶基因沉默的原因可能是RsiP不被降解,但是没有提供直接的实验证据。是否因为炭疽芽胞杆菌RsiP存在突变位点?本研究发现,炭疽杆菌Ames株与苏云金芽胞杆菌BT9727株相比,RsiP蛋白只在第84位存在一个I→S的突变,但此突变是否为炭疽芽胞杆菌RsiP无法被有效降的关键突变仍不得而知下一步研究将比对GenBank数据库中所有已公布的蜡样芽胞杆菌族的RisP序列,找到炭疽芽胞杆菌特有的突变位点,并利用CRSIPR-Cas9等方法对其进行编辑,验证该猜测。同时,既然RsiP无法被降解,其是否有其他不可或缺的调控功能,下一步将构建青霉素调控因子的一系列缺失株及相应的回复株,并对其重要表型进行研究,综合分析炭疽杆菌青霉素敏感的原因。
[1] DIETRICH R,JESSBERGER N,EHLING-SCHULZ M,et al.The food poisoning toxins of Bacillus cereus[J].Toxins,2021,13(2):98.
[2] NARANJO M,DENAYER S,BOTTELDOORN N,et al.Sudden death of a young adult associated with Bacillus cereus food poisoning[J].Journal of Clinical Microbiology,2011,49(12):4 379-4 381.
[3] RAJKOVIC A,UYTTENDAELE M,VERMEULEN A,et al.Heat resistance of Bacillus cereus emetic toxin,cereulide[J].Letters in Applied Microbiology,2008,46(5):536-541.
[4] MASSOVA I,MOBASHERY S.Structural and mechanistic aspects of evolution of β-lactamases and penicillin-binding proteins[J].Current Pharmaceutical Design,1999,5(11):929-937.
[5] HO T D,ELLERMEIER C D.Extra cytoplasmic function σ factor activation[J].Current Opinion in Microbiology,2012,15(2):182-188.
[6] ROSS C L,THOMASON K S,KOEHLER T M.An Extracytoplasmic function σ factor controls β-lactamase gene expression in Bacillus anthracis and other Bacillus cereus group species[J].Journal of Bacteriology,2009,191(21):6 683-6 693.
[7] HO T D,NAUTA K M,MÜH U,et al.Activation of the extracytoplasmic function σ factor σ(P) by β-lactams in Bacillus thuringiensis requires the site-2 protease RasP[J].mSphere,2019,4(4).DOI:10.1101/707133.
[8] HA J,PARK Y J,KIM Y J,et al.Late prosthetic joint infection and bacteremia by Bacillus cereus confirmed by 16S rRNA sequencing and hip joint tissue pathology[J].Annals of Clinical Microbiology,2016,19(2):54-57.
[9] WANG L T,LEE F L,TAI C J,et al.Comparison of gyrB gene sequences,16S rRNA gene sequences and DNA-DNA hybridization in the Bacillus subtilis group[J].International Journal of Systematic and Evolutionary Microbiology,2007,57:1 846-1 850.
[10] OKINAKA R T,CLOUD K,HAMPTON O,et al.Sequence and organization of pXO1,the large Bacillus anthracis plasmid harboring the Anthrax toxin genes[J].Journal of Bacteriology,1999,181(20):6 509-6 515.
[11] KOEHLER T M.Bacillus anthracis genetics and virulence gene regulation[J].Current Topics in Microbiology and Immunology,2002,271:143-164.
[12] 赵雨, 郭建华,张春枝.蜡状芽孢杆菌ZY12产磷脂酶D的影响因素[J].食品与发酵工业,2021,47(9):57-62.
ZHAO Y,GUO J H,ZHANG C Z.Factors influencing phospholipase D production by Bacillus cereus ZY12[J].Food and Fermentation Industries,2021,47(9):57-62.
[13] SENESI S,GHELARDI E.Production,secretion and biological activity of Bacillus cereus enterotoxins[J].Toxins (Basel),2010,2(7):1 690-1 703.
[14] LIU X K,QI X P,ZHU L,et al.Genome sequence of Bacillus anthracis attenuated vaccine strain A16R used for human in China[J].Journal of Biotechnology,2015,210:15-16.
[15] KUMAR S,STECHER G,LI M,et al.MEGA X:Molecular evolutionary genetics analysis across computing platforms[J].Molecular Biology and Evolution,2018,35(6):1 547-1 549.
[16] EHLING-SCHULZ M,FRICKER M,GRALLERT H,et al.Cereulide synthetase gene cluster from emetic Bacillus cereus:Structure and location on a mega virulence plasmid related to Bacillus anthracis toxin plasmid pXO1[J].BMC Microbiology,2006,6:20.
[17] BAZINET A L.Pan-genome and phylogeny of Bacillus cereus sensu lato[J].BMC Evolutionary Biology,2017,17(1):176.
[18] GARGIS A S,MCLAUGHLIN H P,CONLEY A B,et al.Analysis of whole-genome sequences for the prediction of penicillin resistance and β-lactamase activity in Bacillus anthracis[J].mSystems,2018,3(6).DOI:10.1128/msystems.00 154-18.
[19] PANAVAS T,SANDERS C,BUTT T R.SUMO fusion technology for enhanced protein production in prokaryotic and eukaryotic expression systems[J].Methods in Molecular Biology,2009,497:303-317.
[20] TAMURA K,NEI M,KUMAR S.Prospects for inferring very large phylogenies by using the neighbor-joining method[J].PNAS,2004,101(30):11 030-11 035.
[21] LÜCKING G,FRENZEL E,RüTSCHLE A,et al.Ces locus embedded proteins control the non-ribosomal synthesis of the cereulide toxin in emetic Bacillus cereus on multiple levels[J].Frontiers in Microbiology,2015,6:1101.
[22] TAKENO A,OKAMOTO A,TORI K,et al.Complete genome sequence of Bacillus cereus NC7401,which produces high levels of the emetic toxin cereulide[J].Journal of Bacteriology,2012,194(17):4 767-4 768.
[23] 韩蓓, 吕佳,杜仁佳.蜡状芽孢杆菌相关食物中毒研究进展[J].国外医学(医学地理分册),2017,38(3):211-214.
HAN B,LYU J,DU R J.Review on the food poisoning caused by Bacillus cereus[J].Foreign Medical Sciences(Section of Medgeography),2017,38(3):211-214.