法尼烯是倍半萜化合物,存在于多种植物的叶片和果实中,是重要的信息素[1],在植物防御中发挥重要作用[2-3],也是柴油和喷气燃料的高效替代物[4]。法尼烯合成酶(farnesene synthase,FS)是法尼烯合成途径中的关键酶,催化前体法尼基焦磷酸(farnesyl diphosphate,FPP)生成法尼烯。
法尼烯在植物中含量极低,提取困难,利用合成生物学方法有望高效获得这一高值化学品[5]。FS是法尼烯合成途径中的关键酶,对法尼烯的生成具有重要调控作用[6-7]。目前已有多种植物来源的FS通过微生物异源表达被鉴定了功能,但仅对苹果、青蒿等来源的FS进行了详尽的酶学性质研究[8-11],对FS酶学性质认识的不足限制了其在合成生物学中的应用。法尼烯作为挥发性物质在柑橘中存在广泛[12],本研究拟通过基因挖掘及异源表达对一种甜橙来源的萜类合成酶(farnesene synthase from Citrus sinensis,FSCS)进行功能表征,并对酶学性质进行研究,以期将其应用于重组酿酒酵母合成法尼烯。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
本研究所用菌株和质粒见表1。
表1 本研究所用菌株和质粒
Table 1 Strains and plasmids used in this study

菌株和质粒相关特性来源菌株WH4YPH499 gal80△::loxp,his3::PGAL10-HMG1, trp1::PGAL1-HMG1, lys2::PGAL10-HMG1研究室BL21(DE3)E.coli,野生型,用于基因克隆研究室WH4-FscsWH4 gal80△::PTDH3-Fscs-TTPI1,G418r本研究JM109E.coli,野生型,用于基因克隆研究室质粒Ts-XTPKANMX,PTDH3和TTPI1研究室Ts-GAL80GAL80位点整合同源臂来源研究室Ts-xtpfscs筛选标记KANMX和Fscs独立表达盒本研究Ts gal80xtpfscsPTDH3-Fscs-TTPI1,loxp-KANMX-loxp,整合位点GAL80本研究pET28a-FscsE.coli表达载体,携带编码Fscs基因,Kanr本研究
1.1.2 仪器和试剂
限制性核酸内切酶(Sal Ⅰ,BamH Ⅰ,Nco Ⅰ,Dpn Ⅰ,Xba Ⅰ)、T4 DNA连接酶,美国Thermo Fisher;2×Taq PCR Master Mix、2×Phanta Max Master Mix,南京诺唯赞生物科技有限公司;质粒DNA 提取试剂盒、DNA 纯化试剂盒、DNA 凝胶回收试剂盒,康宁生命科学有限公司(上海);卡那霉素、氨苄青霉素、遗传霉素(geneticin,G418)、法尼烯标准品,美国Sigma;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、二硫苏糖醇(dithiothreitol,DTT)、异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG),北京索莱宝科技有限公司;蛋白胨和酵母粉,OXOID;其余试剂均为国产或进口分析纯。
GCMS-QP 2020气质色谱-质谱联用仪,日本岛津公司;UltiMate 3000高效液相色谱仪,Thermo Scientific。
1.1.3 培养基及培养条件
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose, YPD)培养基(g/L):酵母提取物10.0,胰蛋白胨20.0,无水葡萄糖20.0。
两相萃取发酵培养基(g/L):葡萄糖30.0,酵母粉10.0,蛋白胨20.0,十二烷(体积分数10%)。
TB(terrific broth)培养基(g/L):甘油5.0,蛋白胨12.0,酵母粉24.0,K2HPO412.5,KH2PO4 2.3。
大肠杆菌发酵培养条件:将种子液按体积分数3%接种量转接至50 mL发酵培养基,添加终质量浓度为30 μg/mL卡那霉素,于37 ℃、200 r/min摇床培养至OD600为0.6~0.8,加入终浓度为0.5 mmol/L IPTG诱导,于18 ℃、200 r/min摇床培养22 h。
酿酒酵母发酵培养条件:将种子液按体积分数2%接种量转接至30 mL发酵培养基,添加终质量浓度为30 g/L葡萄糖溶液,体积分数10%的十二烷,于30 ℃、200 r/min摇床培养72 h。
1.2 实验方法
1.2.1 氨基酸序列分析
将NCBI数据库中大豆来源FS(登录号:NM_001353335.1)氨基酸序列用BLAST比对,选择序列相似度为53%的Fscs,借助DNAMAN进行关键位点分析。
1.2.2 重组表达质粒构建
1.2.2.1 原核表达质粒pET28a-Fscs构建
根据E.coli密码子偏好优化并基因合成pUC57-Fscs,在两端分别加入酶切位点BamH Ⅰ、Sal Ⅰ。提取质粒,用Sal Ⅰ、BamH Ⅰ双酶切并胶回收,将载体pET28a用Sal Ⅰ、BamH Ⅰ双酶切并线性化。将基因片段与载体于16 ℃条件下连接,连接产物转入DE3感受态,涂布卡那抗性平板,于37 ℃恒温烘箱中培养10~12 h,挑取转化子,提取质粒双酶切验证并测序。构建表达质粒pET28a-Fscs所需引物见表2。
表2 构建pET28a-Fscs表达质粒所用引物
Table 2 Primers for the construction of plasmid carrying Fscs

引物名称引物序列(5’→3’)长度/bpFscs-BamH Ⅰ-FCGGGATCCATGGAGCAAGGTAAACAATTGGGTCAC35Fscs-Sal Ⅰ-R ACGCGTCGACTTAGCTAAATGGGCTAGGAGGCATAGG37
注:下划线为酶切位点
1.2.2.2 真核表达质粒Ts gal80-xtpfscs的构建
质粒Ts-xtpfscs的构建:将针对Saccharomyces cerevisiae密码子优化合成的pUC57-Fscs提取质粒,用Sal Ⅰ、BamH Ⅰ双酶切并胶回收;提取质粒Ts-XTP,反向PCR准备载体,PCR产物用Dpn Ⅰ消化并用Sal Ⅰ、BamH Ⅰ双酶切;将目的片段与载体于16 ℃条件下连接,转化JM109感受态,筛选正确转化子,酶切验证后保藏菌株。
质粒Ts gal80-xtpfscs的构建:提取质粒Ts-xtpfscs,用Xba Ⅰ酶切后胶回收;提取质粒Ts-GAL80,反向PCR准备载体并用Xba Ⅰ酶切;后续实验步骤同质粒Ts-xtpfscs的构建。构建质粒所需引物见表3。
Ts gal80-xtpfscs醋酸锂转化酿酒酵母WH4:活化酿酒酵母WH4菌株,培养至OD600=0.6;将Ts gal80-xtpfscs用Nco Ⅰ酶切并纯化,进行酿酒酵母醋酸锂转化实验。涂布G418抗性培养基,筛选转化子进行菌落PCR及基因组验证。
表3 构建Ts-xtpfscs及Ts gal80-xtpfscs表达质粒所用引物
Table 3 Primers for the construction of plasmids Ts-xtpfscs and Ts gal80-xtpfscs

引物名称 引物序列(5’→3’)长度/bpXTP-Sal I-7ACGCGTCGACTTTGTTTGTTTATGTGTGTTTATTC35XTP-BamH I-8CGCGGATCCGCGGATTAATATAATTATATAAAAATAT37GAL80-Xba Ⅰ-3CATGTCTAGAAAGCATCTTGCCCTGTGCT30GAL80-Xba Ⅰ-4CATGTCTAGAGACGGGAGTGGAAAGAACG29
注:下划线为酶切位点
1.2.3 重组pET28a-Fscs的诱导表达及蛋白纯化
以0.5 mmol/L IPTG为诱导剂,18 ℃、200 r/min发酵22 h使蛋白表达。收集发酵液于4 ℃、8 000 r/min离心10 min,收集菌体,用20 mmol/L磷酸钠缓冲液(pH 7.4)振荡重悬洗涤细胞2次,超声破碎菌体8~10 min,于4 ℃、12 000 r/min离心10 min,上清液即为粗酶液。用镍柱对FSCS粗酶液进行纯化,并将纯酶液进行超滤浓缩,4 ℃、12 000 r/min离心20 min,重复3次。
1.2.4 酶学性质研究方法
用纯酶液进行酶学性质检测,以FPP为底物,20 mmol/L,pH 7.4的磷酸钠溶液作为缓冲液,加入终浓度为5 mmol/L DTT,体积分数10%甘油。反应体系上方覆盖十二烷萃取产物,反应结束后取上层有机相,10 000 r/min离心10~15 min, 进行产物检测。
FSCS产物特异性:向500 μL反应体系中加入15 mmol/L MgCl2,100 μg纯酶,30 μmol/L FPP, 覆盖300 μL十二烷,密封,于30 ℃、150 r/min反应1 h,相同反应条件下以空载为对照,进行产物检测。
FSCS最适金属离子条件:分别向反应体系中添加终浓度为10.0~80.0 mmol/L Mg2+,10.0~50.0 mmol/L K+,2.0~10.0 mmol/L Mn2+,并以添加50 mmol/L EDTA作为对照组,其余反应条件同FSCS产物特异性。
FSCS最适温度条件:500 μL反应体系中加入100 μg纯酶,30 μmol/L FPP,覆盖300 μL十二烷,密封,分别在15~45 ℃条件下反应1 h,进行产物检测。
1.2.5 产物检测方法
以GC-MS及HPLC对产物进行检测。
GC-MS条件:色谱柱SH-Rtx-5MS(30 m×0.32 mm,0.25 μm),流速1 mL/min, 电离方式EI。进样口温度260 ℃,起始温度80 ℃,以5 ℃/min升至180 ℃,再以25 ℃/min升至280 ℃。扫描质量范围35~800 amu。配制不同浓度法尼烯标准品,确定出峰时间并制作丰度-浓度标准曲线。y=894 139 x+436 156,R2=0.999。其中y:丰度,x:质量浓度,mg/L。
HPLC条件:色谱柱(Diamonsil Plus C18,250 mm×4.6 mm, 5 μm),体积分数70%的甲醇,体积分数30%的乙腈为流动相,流速1 mL/min,检测波长210 nm,柱温40 ℃。配制不同浓度法尼烯标准品,确定出峰时间并制作峰面积-浓度标准曲线。y=1.801 2 x+1.553 1, R2=0.999。其中y:峰面积,mAU·min;x:质量浓度,mg/L。
2 结果与讨论
2.1 FSCS氨基酸序列分析
将大豆来源法尼烯合成酶基因Fsso的氨基酸序列在BLAST进行同源性比对。序列相似度80%以上的多为豆科来源植物,Fscs序列相似度53%,编码区全长1 831 bp,编码573个氨基酸。NCBI参考序列号为:LOC102618658。倍半萜合成酶一般编码550~580个氨基酸,分子质量在50 k~100 kDa[13]。通过DNAMAN对FSCS进行氨基酸序列分析发现,其含有萜类合成酶家族特有的保守结构域DDxxD及NSE/DTE,其中DDxxD为富含天冬氨酸的保守结构域,是底物的结合位点,对酶的活性有重要作用[14]。序列比对结果如图1所示。

“★”、“▲”分别表示DDxxD及NSE/DTE结构域
图1 FSSO及FSCS氨基酸序列比对
Fig.1 Comparison of the amino acid sequences of FSSO and FSCS
2.2 pET28a-Fscs表达菌株的构建及蛋白纯化
按照1.2.2.1的方法构建质粒pET28a-Fscs,质粒片段大小为7 078 bp,将质粒用BamH Ⅰ、Sal Ⅰ双酶切验证,理论条带大小为1 722和5 356 bp,结果如图2所示。电泳条带大小与理论值一致,重组质粒pET28a-Fscs构建成功。
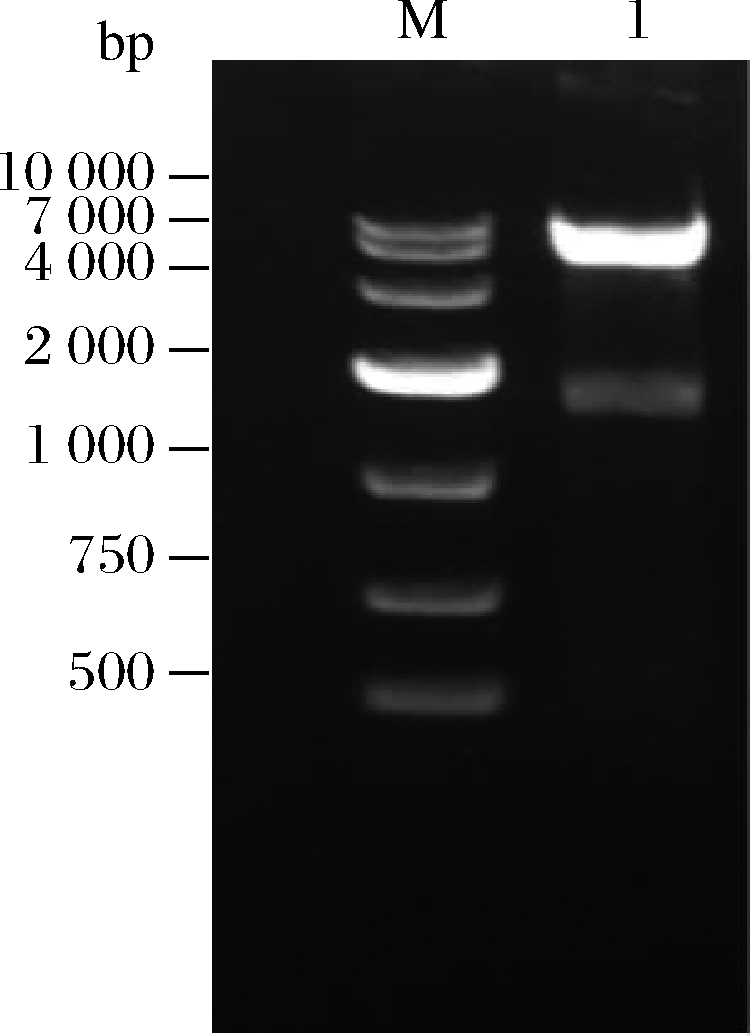
M-DNA marker;1-重组质粒双酶切
图2 重组质粒pET28a-Fscs双酶切验证
Fig.2 Verification of recombinant plasmid pET28a-Fscs through enzyme digestion reactions
将菌株pET28a-Fscs于18 ℃条件下发酵22 h,加入0.5 mmol/L IPTG诱导目的蛋白表达,以空载为对照,将粗酶及纯酶液进行SDS-PAGE检测,结果如图3所示。在70 kDa位置有目的蛋白条带,与pET28a-Fscs预测分子质量69.5 kDa相符,获得了纯度较高的目的蛋白,用于后续酶学性质研究。
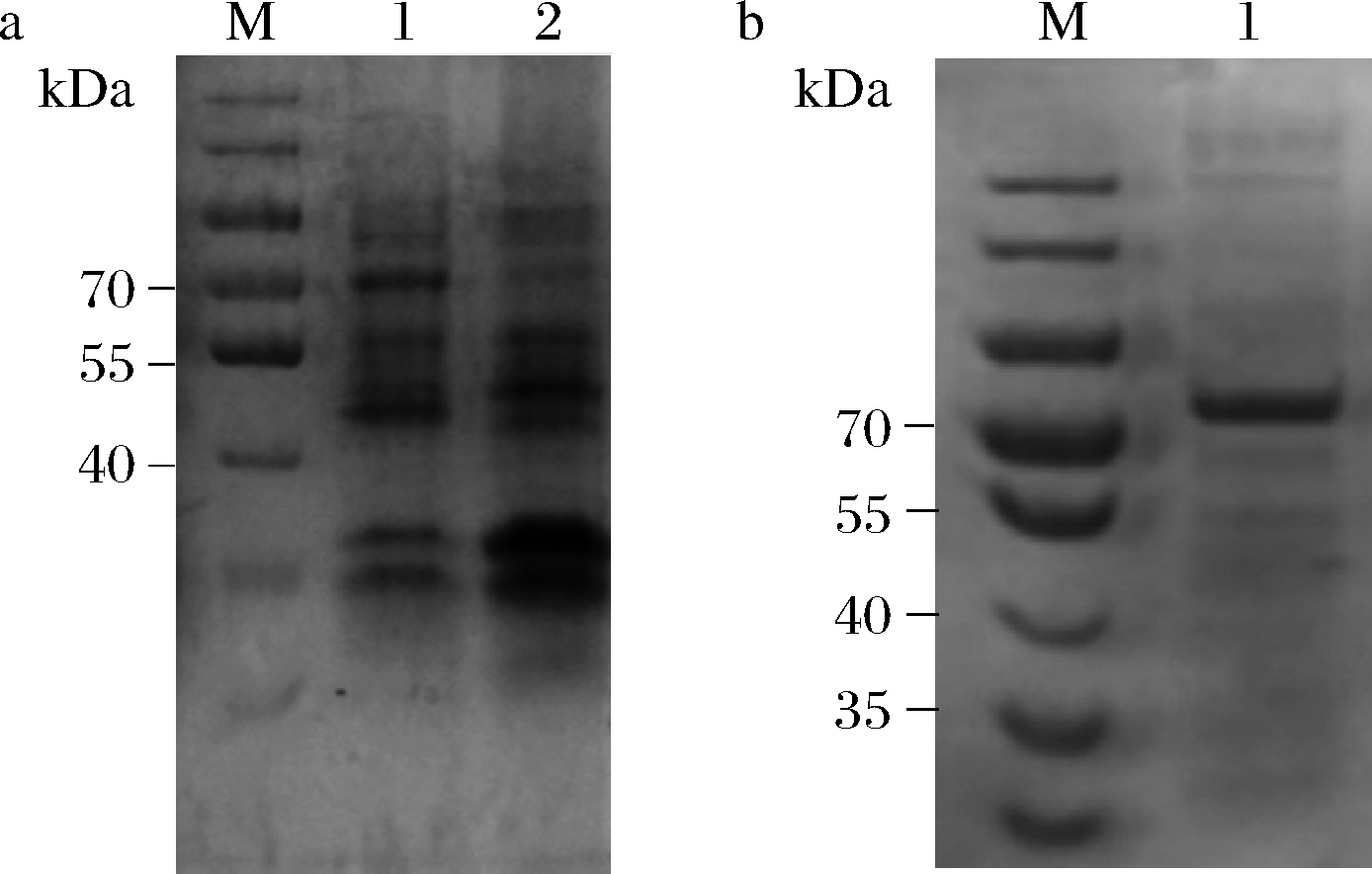
a-FSCS粗霉SDS-PAGE;b-FSCS粗霉SDS-PAGE M-蛋白质marker;a1-FSCS粗酶;a2-pET28a空载;b1-FSCS纯酶
图3 重组蛋白FSCS SDS-PAGE检测结果
Fig.3 SDS-PAGE results of recombinant protein FSCS
2.3 FSCS酶学性质研究
2.3.1 产物特异性探究
按1.2.4配制酶反应体系,以FPP为底物与纯酶进行反应,以空载作为对照,探究产物特异性。反应后检测到α-法尼烯生成,GC-MS检测结果如图4所示。FPP与空载反应未检测到产物生成,证明FSCS具有法尼烯合成酶功能。

图4 α-法尼烯GC-MS检测结果
Fig.4 GC-MS detection results of α-farnesene
2.3.2 金属离子对产物的影响
多数萜类合成酶需要在Mg2+或Mn2+的参与下发挥作用[15]。为探究FSCS所需的金属离子及最适离子条件,按1.2.4方法检测产物生成情况。单独添加Mg2+时,检测到法尼烯生成,在30 mmol/L Mg2+条件下产物浓度最高。以50 mmol/L EDTA为对照,未检测到产物生成,如图5-a所示。部分萜类合成酶存在H-α1结构域,K+的存在能够增强底物与酶的结合,从而增强酶的活性[16]。因此在30 mmol/L Mg2+浓度的基础上,添加不同浓度K+检测产物生成情况。如图5-b所示,K+对产物生成有显著促进作用,40 mmol/L K+条件下产物质量浓度达到最高为3.86 mg/L,相较于单独添加Mg2+提升近6.3倍。随后在30 mmol/L Mg2+、40 mmol/L K+基础上加入不同浓度Mn2+,对产物生成无显著促进作用,且较高浓度的Mn2+对产物生成有轻微抑制作用,如图5-c所示。单独添加Mn2+基本未检测到产物生成,说明FSCS对Mg2+亲和度高于Mn2+。上述实验结果表明,Mg2+为酶必需的辅因子,且K+对产物生成有显著促进作用。大豆、梨等来源的法尼烯合成酶需要Mg2+与K+共同作为辅因子参与反应,而多数萜类合成酶仅需要Mg2+作为辅因子[17],萜类合成酶对金属离子的亲和性应与蛋白特定结构有关。
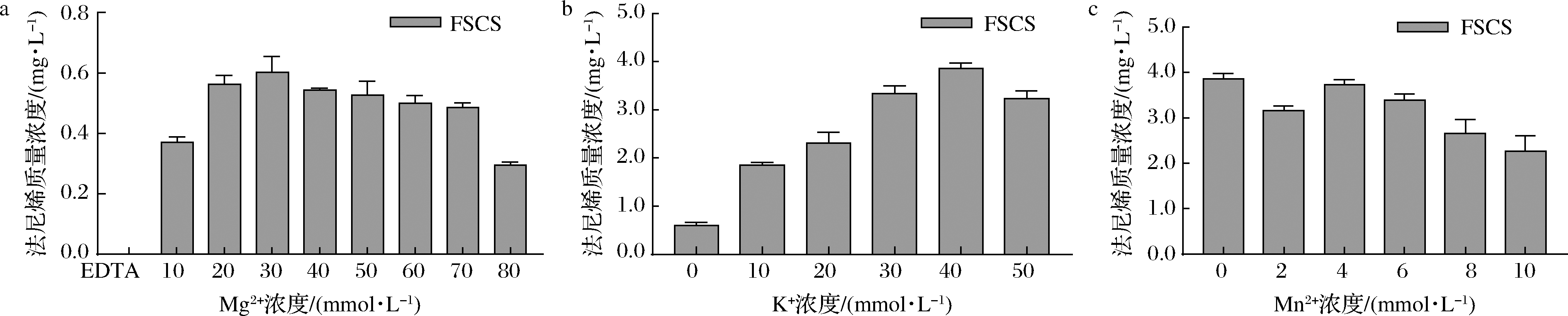
图5 不同金属离子对法尼烯生成的影响
Fig.5 Effects of different metal ions on the formation of farnesene
2.3.3 最适反应温度探究
如图6所示,在20 ℃条件下,法尼烯浓度最高,45 ℃以上基本检测不到产物生成。说明FSCS对高温耐受性差,在较低温度下能保持一定活力。研究表明,多数萜类合成酶对高温耐受性较差,苹果来源的一种FS最适反应温度为10~20 ℃,且在0 ℃仍保持一半活性[18]。

图6 温度对法尼烯生成的影响
Fig.6 Effects of temperature on the formation of farnesene
2.4 酿酒酵母重组表达菌株WH4-Fscs的构建及产物检测
按照1.2.2.2的方法构建Ts gal80-xtpfscs表达盒,以GAL80为位点进行酿酒酵母染色体整合。分别以BamH Ⅰ、Sal Ⅰ、Xba Ⅰ及Nco Ⅰ进行酶切验证。BamH Ⅰ、Sal Ⅰ酶切理论条带大小分别为1 722和6 570 bp;Xba Ⅰ酶切理论条带大小分别为4 692和2 700 bp;Nco Ⅰ酶切理论条带大小分别为2 692和5 600 bp,均与图中条带位置相符。提基因组进行PCR验证,理论片段大小为2 500 bp,与条带位置相符,重组表达菌株构建成功,结果如图7所示。
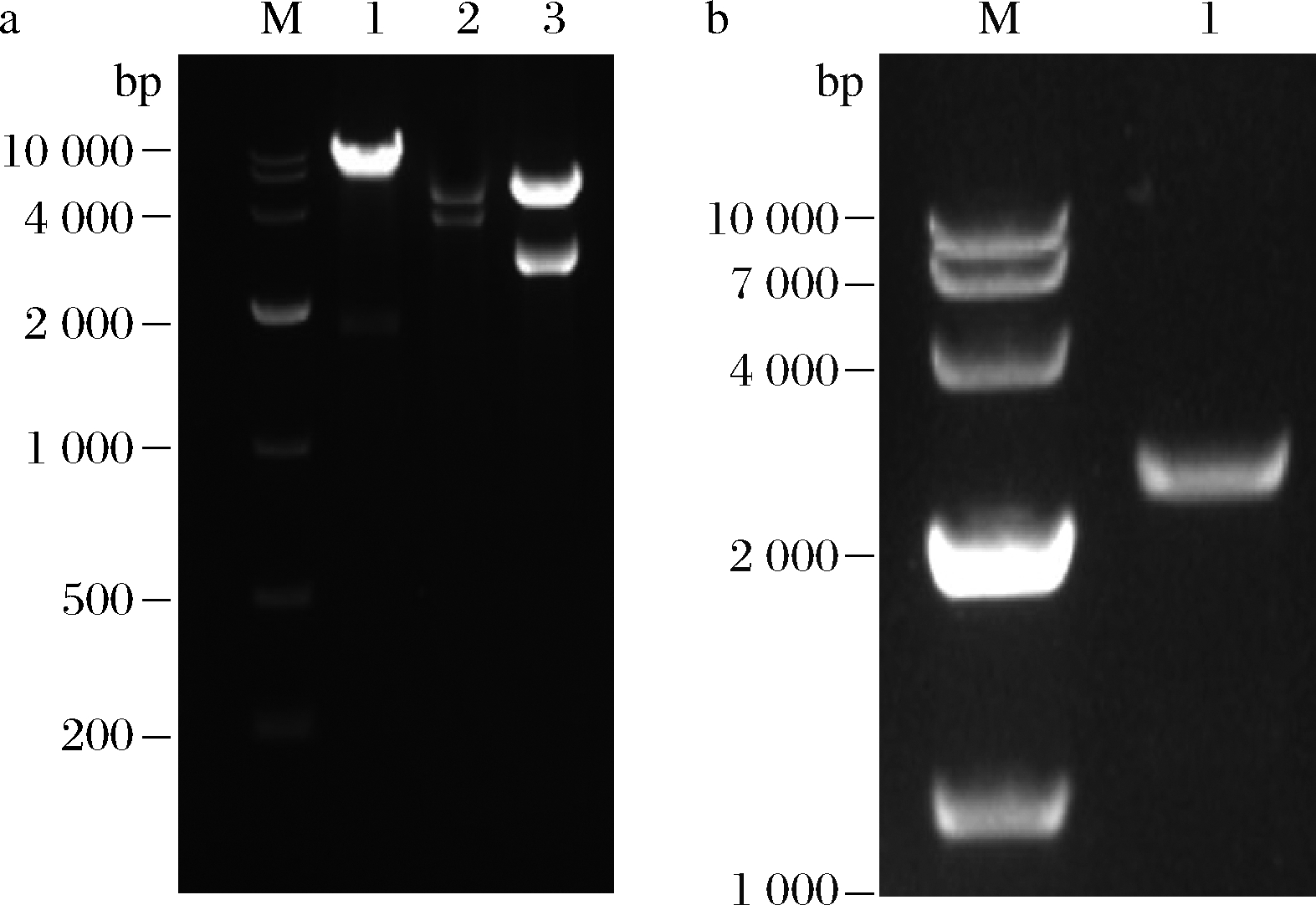
a-单双酶切验证;b-基因组PCR验证 M-DNA marker;a1-Sal Ⅰ、BamH Ⅰ酶切;a2-Xba Ⅰ酶切; a3-Nco Ⅰ酶切
图7 Ts gal80-xtpfscs单双酶切及基因组PCR验证
Fig.7 Verification of recombinant plasmid Ts gal80-xtpfscs through enzyme digestion reactions and genome PCR
以WH4原始菌株为对照,HPLC检测法尼烯生成,结果如图8所示。标准品出峰时间约在4.418 min,WH4-Fscs α-法尼烯出峰时间在4.382 min,WH4原始菌株未检测到法尼烯生成,酿酒酵母重组菌株WH4-Fscs构建成功。

a- WH4-Fscs;b-法尼烯标准品;c-WH4原始菌株
图8 法尼烯标准品、WH4-Fscs及WH4原始菌株HPLC检测结果
Fig.8 HPLC results of farnesene reference standard, recombinant strain WH4-Fscs and original strain WH4
2.5 FSCS酶学性质在酿酒酵母表达菌株WH4-Fscs中的应用
2.5.1 最适金属离子条件在酿酒酵母WH4-Fscs产法尼烯中的应用
通过酶学性质实验,FSCS最适金属离子条件为30 mmol/L Mg2+, 40 mmol/L K+。将此条件应用于酿酒酵母重组菌株中,以不添加外源金属离子作为对照,在30 ℃条件下发酵72 h,检测法尼烯生成情况。如图9所示,与不添加金属离子相比,最适离子条件下法尼烯产量有30%的提升,达到43.76 mg/L。相关研究表明,Mg2+能够缓解葡萄糖分解代谢物的抑制作用,在培养基中添加Mg2+能够增强酿酒酵母发酵过程中对乙酸的耐受性,增加乙醇产量,提高细胞活力[19-20]。
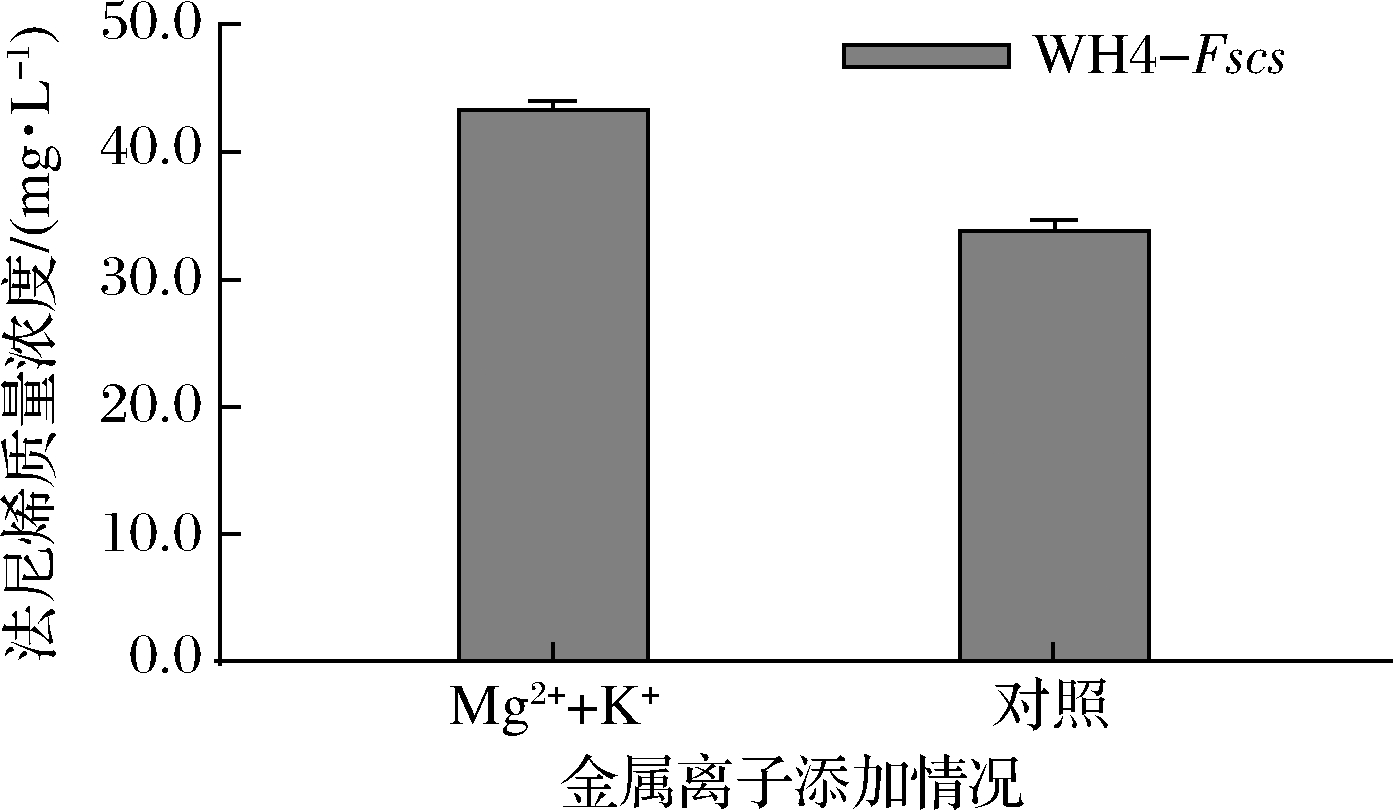
图9 金属离子对WH4-Fscs发酵产法尼烯的影响
Fig.9 Effects of metal ions on production of farnesene by WH4-Fscs fermentation
2.5.2 温度在酿酒酵母WH4-Fscs产法尼烯中的应用
FSCS最适温度条件为20 ℃,以30 ℃为对照组,实验组和对照组均在30 ℃发酵24 h,待葡萄糖基本消耗完毕后调整温度。后续发酵72 h,发酵过程中分别于24、48、60、72、96 h取样,检测产物生成以及菌体生长情况。由图10可知,30 ℃条件下,发酵前60 h 的OD600高于20 ℃条件,最高为7.153。发酵60 h后,20 ℃条件下菌体OD600更高,最高为7.084。
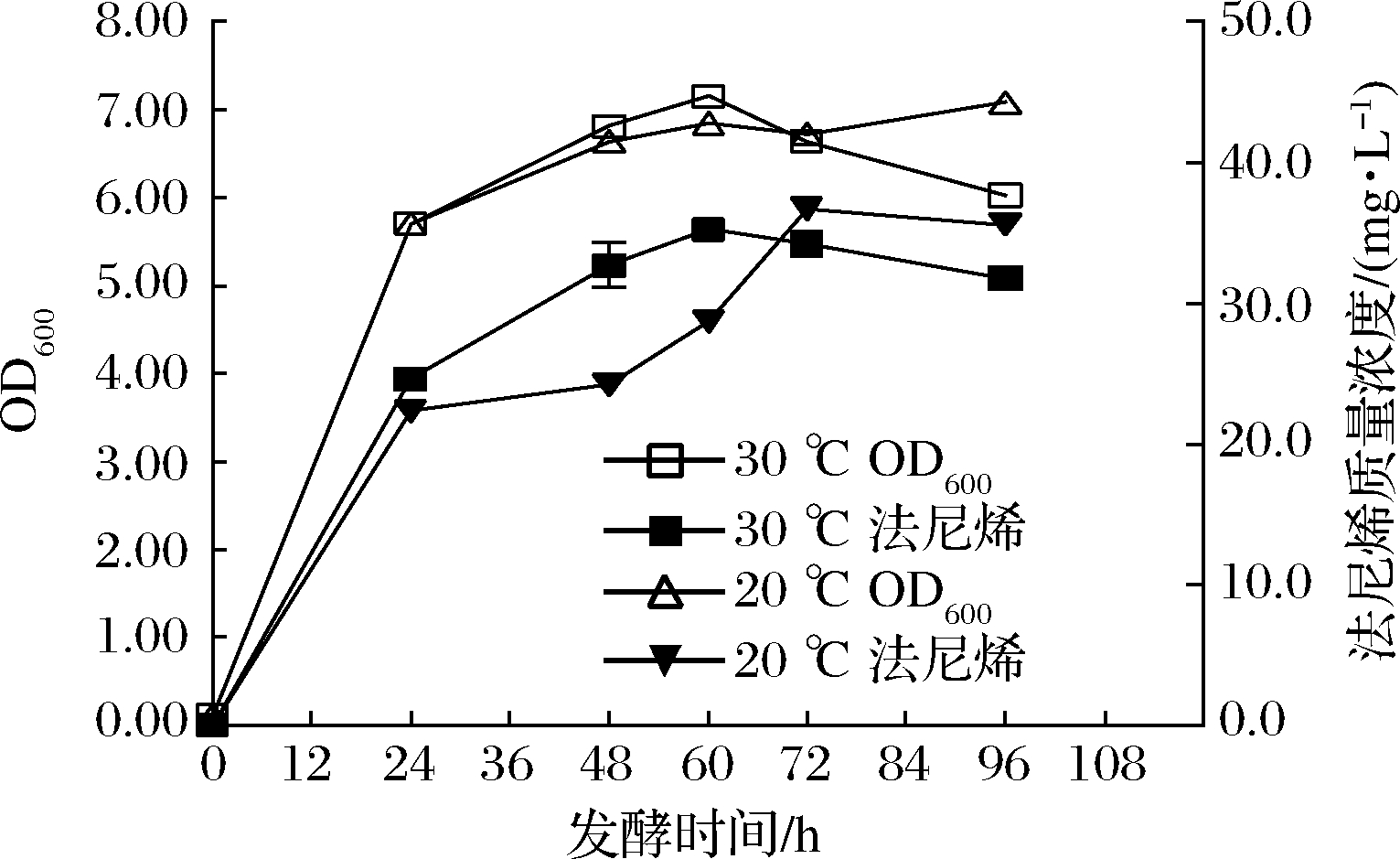
图10 不同温度对WH4-Fscs菌体生长及 法尼烯合成的影响
Fig.10 Effects of different temperatures on bacteria growth and farnesene synthesis of WH4-Fscs
从法尼烯产量上看,发酵前期30 ℃条件下法尼烯产量维持更高水平,发酵后期20 ℃条件下法尼烯产量更稳定。低温发酵可促进酿酒酵母中酯类、萜烯类等物质的形成并延长保留时间[21-22]。法尼烯挥发性较强,在发酵后期可通过降低温度来维持法尼烯产量。
3 结论
本研究对一种甜橙来源的FS进行了功能表征,并将其酶学性质应用于酿酒酵母表达系统中。以FPP为底物时,FSCS能催化生成法尼烯,而部分萜类合成酶不存在明确的产物或底物特异性,可与不同底物反应生成多种萜类化合物。FSCS的催化功能依赖于Mg2+的参与,在K+存在的条件下,对产物生成有显著促进作用,该特性与苹果、大豆等来源的FS相似。FSCS对高温耐受性差,较低温度下能够保持活性。将酶学性质应用于酿酒酵母表达菌株,最适金属离子条件下法尼烯产量有30%提升,且最适温度条件对发酵后期产物积累及菌体生长有一定促进作用。上述研究结果有助于进一步了解FS的酶学性质,也为FS在酿酒酵母中的高效表达提供了理论指导。在现有研究基础上,未来对FS的催化机理仍有待进一步解析,其在细胞内与代谢途径中其他关键酶的调控关系也有待探究。
[1] ZHANG R B,WANG B,GROSSI G,et al.Molecular basis of alarm pheromone detection in aphids[J].Current Biology,2017,27(1):55-61.
[2] SOULEYRE E J F,BOWEN J K,MATICH A J,et al.Genetic control of α-farnesene production in apple fruit and its role in fungal pathogenesis[J].The Plant Journal,2019,100(6):1 148-1 162.
[3] WANG X W,ZENG L T,LIAO Y Y,et al.Formation of α-farnesene in tea (Camellia sinensis) leaves induced by herbivore-derived wounding and its effect on neighboring tea plants[J].International Journal of Molecular Sciences,2019,20(17):4 151-4 165.
[4] TIPPMANN S,SCALCINATI G,SIEWERS V,et al.Production of farnesene and santalene by Saccharomyces cerevisiae using fed-batch cultivations with RQ-controlled feed[J].Biotechnology and Bioengineering,2016,113(1):72-81.
[5] 孙丽超, 李淑英,王凤忠,等.萜类化合物的合成生物学研究进展[J].生物技术通报,2017,33(1):64-75.
SUN L C,LI S Y,WANG F Z,et al.Research progresses in the synthetic biology of terpenoids[J].Biotechnology Bulletin,2017,33(1):64-75.
[6] LANGE B M,AHKAMI A.Metabolic engineering of plant monoterpenes,sesquiterpenes and diterpenes-current status and future opportunities[J].Plant Biotechnology Journal,2013,11(2):169-196.
[7] MILLER D J,ALLEMANN R K.Sesquiterpene synthases:Passive catalysts or active players?[J] Natural Product Reports,2012,29(1):60-71.
[8] GREEN S,FRIEL E N,MATICH A,et al.Unusual features of a recombinant apple α-farnesene synthase[J].Phytochemistry,2007,68(2):176-188.
[9] LIN J Y,WANG D,CHEN X L,et al.An (E,E)-α-farnesene synthase gene of soybean has a role in defence against nematodes and is involved in synthesizing insect-induced volatiles[J].Plant Biotechnology Journal,2017,15(4):510-519.
[10] PICAUD S,BRODELIUS M,BRODELIUS P E.Expression,purification and characterization of recombinant (E)-β-farnesene synthase from Artemisia annua[J].Phytochemistry,2005,66(9):961-967.
[11] ZHANG X H,NIU M Y,TEIXEIRA DA SILVA J A,et al.Identification and functional characterization of three new terpene synthase genes involved in chemical defense and abiotic stresses in Santalum album[J].BMC Plant Biology,2019,19(1):115.
[12] ASAI T,MATSUKAWA T,KAJIYAMA S.Metabolic changes in Citrus leaf volatiles in response to environmental stress[J].Journal of Bioscience and Bioengineering,2016,121(2):235-241.
[13] 刘宇. 过表达苹果α-法尼烯合酶基因烟草早衰机制研究[D].泰安:山东农业大学,2016.
LIU Y.Study on mechanisms of early senescence of tobacco overexpressing apple α-farnesene synthase gene[D].Taian:Shandong Agricultural University,2016.
[14] CHEN X L,KOLLNER T G,JIA Q D,et al.Terpene synthase genes in eukaryotes beyond plants and fungi:Occurrence in social amoebae[J].Proceedings of the National Academy of Sciences of the United States of America,2016,113(43):12 132-12 137.
[15] KIRYU M,HAMANAKA M,YOSHITOMI K,et al.Rice terpene synthase 18 (OsTPS18) encodes a sesquiterpene synthase that produces an antibacterial (E)-nerolidol against a bacterial pathogen of rice[J].Journal of General Plant Pathology,2018,84(3):221-229.
[16] GREEN S,SQUIRE C J,NIEUWENHUIZEN N J,et al.Defining the potassium binding region in an apple terpene synthase[J].Journal of Biological Chemistry,2009,284(13):8 661-8 669.
[17] HUANG M S,ABEL C,SOHRABI R,et al.Variation of herbivore-induced volatile terpenes among Arabidopsis ecotypes depends on allelic differences and subcellular targeting of two terpene synthases,TPS02 and TPS03[J].Plant Physiology,2010,153(3):1 293-1 310.
[18] RUPASINGHE H P V,PALIYATH G,MURR D P.Sesquiterpene α-farnesene synthase:Partial purification,characterization,and activity in relation to superficial scald development in apples[J].Journal of the American Society for Horticultural Science,2000,125(1):111-119.
[19] ISMAIL K S,SAKAMOTO T,HASUNUMA T,et al.Zinc,magnesium,and calcium ion supplementation confers tolerance to acetic acid stress in industrial Saccharomyces cerevisiae utilizing xylose[J].Biotechnology Journal,2014,9(12):1 519-1 525.
[20] BARROS DE SOUZA R,SILVA R K,FERREIRA D S,et al.Magnesium ions in yeast:Setting free the metabolism from glucose catabolite repression[J].Metallomics,2016,8(11):1 193-1 203.
[21] ROLLERO S,BLOEM A,CAMARASA C,et al.Combined effects of nutrients and temperature on the production of fermentative aromas by Saccharomyces cerevisiae during wine fermentation[J].Applied Microbiology and Biotechnology,2015,99(5):2 291-2 304.
[22] 祝霞, 刘琦,赵丹丹,等.酿造条件对酿酒酵母发酵香气的影响[J].食品科学,2019,40(16):115-123.
ZHU X,LIU Q,ZHAO D D,et al.Effect of different winemaking conditions on fermentation aroma production by Saccharomyces cerevisiae[J].Food Science,2019,40(16):115-123.