全球粮食作物和食品原料中真菌毒素污染问题严峻,正严重威胁着人类的生命健康[1]。其中,黄曲霉毒素B1(aflatoxin B1,AFB1)和玉米赤霉烯酮(zearalenone,ZEN)作为两种主要的真菌毒素,容易污染花生、玉米及常见谷物,会造成肝癌、神经毒性、破坏生殖系统等严重后果[2-4]。对于真菌毒素的降解,除了常用的物理、化学方法外[5-6],生物法被认为是一种可以温和、高效降解这两种真菌毒素的有效方法[7-8]。一些已经发现的降解酶能在一定程度上单独实现对AFB1和ZEN的降解,且大多数酶都在大肠杆菌、酵母等表达系统中成功实现了重组酶的表达[9-10]。
乳酸克鲁维酵母(Kluyveromyces lactis)作为一种食品级酵母,其蛋白质分泌能力强、表达系统和发酵过程安全,被广泛应用于食品、医药工业,也逐渐应用于真菌毒素降解领域的研究[11]。孙莹[12]研究了3种来源的锰过氧化物酶并在乳酸克鲁维酵母中实现了表达,优化后的酶PhcMnp对AFB1的降解率达到75.71%。徐荣荣[13]将ZEN水解酶ZHD101进行了突变,且在乳酸克鲁维酵母中实现了突变体的分泌表达,其对饲料样品中ZEN的降解率为74.60%。
目前,针对真菌毒素的生物法降解研究,主要集中在降解微生物和酶的筛选、酶的突变改造、重组菌的构建与表达、毒素降解机理研究和降解条件优化等[14-15],而能降解真菌毒素的重组菌高密度发酵培养研究偏少,特别是针对食品级乳酸克鲁维酵母重组菌的高密度发酵培养条件优化和工艺研究鲜见报道。而发酵工程的一个重要任务是提高菌体培养前期的细胞密度,为后期的发酵产物生产提供更多的生物量[16-17]。因此,为提高食品级重组乳酸克鲁维酵母在食品和饲料行业的商业化应用价值,需要对该菌进行高密度培养条件优化研究。
本研究以本实验室已构建的可同时降解AFB1和ZEN的食品级重组乳酸克鲁维酵母GG799(pKLAC1-ZPF1)为主要研究对象,通过单因素试验、响应面试验、正交试验等方法优化了该菌的培养基成分和培养工艺参数,然后以5 L发酵罐扩大培养来验证优化结果,旨在为该食品级重组酵母的工业化应用提供理论依据和参考数据。
1 材料与方法
1.1 实验材料
1.1.1 菌株及质粒
宿主菌乳酸克鲁维酵母(Kluyveromyces lactis)GG799株、表达载体pKLAC1由本实验室保藏。可同时降解AFB1和ZEN两种毒素的食品级重组乳酸克鲁维酵母GG799(pKLAC1-ZPF1)由本实验室构建[18],其中ZPF1为能同时降解AFB1和ZEN两种毒素的融合酶。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)液体培养基:1.0%酵母提取物、2.0%蛋白胨、2.0%葡萄糖,加蒸馏水至1.0 L,调pH 6.0,115 ℃灭菌20 min备用。
YEPD固体培养基:1.0%酵母提取物、2.0%蛋白胨、2.0%葡萄糖、2.0%琼脂粉,加蒸馏水至1.0 L,调pH 6.0,115 ℃灭菌20 min,冷却至50 ℃左右混匀后注入9 cm直径灭菌的平皿,冷却后备用。
黄豆芽培养基:称取适量黄豆芽于蒸馏水中,煮沸并维持30 min,过滤弃滤渣,加入20.0 g葡萄糖,再加水至1.0 L,115 ℃灭菌20 min备用。
脱脂乳培养基:7%白砂糖和12%脱脂乳粉,加蒸馏水至1.0 L,于110 ℃灭菌15 min备用。
麦芽汁培养基:根据市售麦芽汁培养基浓缩液说明书,用蒸馏水进行稀释,115 ℃灭菌20 min备用。
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:称取200.0 g去皮、切块的马铃薯于蒸馏水中,煮沸并维持30 min,趁热过滤弃滤渣,加入20.0 g葡萄糖,再加水至1.0 L,115 ℃灭菌20 min备用。
1.2 仪器与设备
SBA-40ES双通道生物传感分析仪,济南延和生物科技有限公司;5 L微生物发酵罐,上海百仑生物科技有限公司;Mobile Minor喷雾干燥机,中国基伊埃工程技术有限公司;SCIENTZ-10 N真空冷冻干燥机,宁波新芝生物科技股份有限公司;ZQZY-70B振荡培养箱,上海知楚仪器有限公司;1300系列Ⅱ级A2型生物安全柜,美国赛默飞世尔科技公司;LDZX-50kBS立式压力蒸汽灭菌器,上海申安医疗器械厂;超高效液相色谱串联四级杆质谱联用仪,美国沃特世公司;Synergy H1多功能酶标仪,美国伯腾仪器有限公司;LRH-70生化培养箱,上海一恒仪器公司。
1.3 实验方法
1.3.1 菌株培养方法
菌株活化:从-80 ℃冰箱中取出保存的重组乳酸克鲁维酵母GG799(pKLAC1-ZPF1)甘油管,划线接种于YEPD固体培养基平板中,30 ℃培养3~5 d进行活化。
一级种子液培养:挑取平板上的单菌落接种于100.0 mL YEPD液体培养基中,于30 ℃、220 r/min培养18~22 h。
二级种子液培养:按照体积分数1%的接种量将一级种子液转接于含有500.0 mL YEPD培养基中,于30 ℃、220 r/min培养18~22 h。
发酵罐高密度培养:按照体积分数5%的接种量将OD600=1.0的二级种子液转接于含有2.0 L培养基的5 L发酵罐中,于28 ℃、220 r/min、通气量1.5 vvm条件下培养18~35 h。
1.3.2 基础培养基的筛选方法
将一级种子液分别接入YEPD液体培养基、麦芽汁培养基、PDB培养基、黄豆芽培养基、脱脂乳粉培养基中,各培养基体积均为500.0 mL。于30 ℃、200 r/min培养28 h,每隔2~4 h取样,测定OD600值。根据数据绘制生长曲线,选择最佳基础培养基。
1.3.3 培养基成分的优化方法
1.3.3.1 单因素试验
在最佳基础培养基和培养时间的基础上,设计单因素试验表,如增强出版附件表1所示。于30 ℃、200 r/min培养20 h。测定生物量(以收获的细胞干重表征,下同)和活菌数,以确定单因素下的最佳培养基成分。
1.3.3.2 响应面试验
根据单因素试验结果,选择葡萄糖、蛋白胨、酵母提取物、KH2PO4、MgSO4为主要参考因素,设计5因素3水平响应面试验表,如增强出版附件表2所示。根据响应面试验数据和分析结果,确定复合因素下的最佳培养基成分。
1.3.4 培养参数的优化方法
1.3.4.1 单因素试验
按照1.3.3的最佳培养基成分,进行培养参数的单因素优化试验,方案如增强出版附件表3所示。测定生物量和活菌数以确定单因素下的最佳培养基成分。
1.3.4.2 正交试验
根据1.3.4.1单因素试验结果,设计3因素3水平的正交试验以确定复合因素下的最佳培养参数,方案如增强出版附件表4所示。
1.3.5 发酵罐扩大培养试验方法
1.3.5.1 发酵罐扩大培养方法
按照1.3.3和1.3.4试验得到的最佳培养基成分和最佳培养条件,对重组酵母进行5 L发酵罐高密度培养试验。具体参数如下:装液量2.0 L,接种量5%,接入OD600=1.0的二级种子液。发酵初始条件:28 ℃、通气量1.5 vvm。控制发酵过程中温度28 ℃、溶氧100%。培养基pH优化:使用优化后的培养基和培养条件,探究3种不同pH(4.5、5.0、5.5)对重组酵母高密度培养时生物量的影响。每隔一定时间取样,测定生物量和剩余葡萄糖浓度。
1.3.5.2 样品预处理及相关测定方法
在整个扩大培养过程中,周期性取菌液检测细胞干重和葡萄糖浓度。细胞干重测定方法[19]:取50.0 mL发酵液于离心管中,8 000 r/min离心10 min,弃上清液收集菌体。将菌体用去离子水洗涤后,放入干燥箱中于80 ℃干燥至恒重,称重并计算细胞干重。葡萄糖浓度测定采用SBA-40ES双通道生物传感分析仪进行。
2 结果与分析
2.1 重组乳酸克鲁维酵母基础培养基的筛选
选择YEPD培养基、麦芽汁培养基、黄豆芽培养基、PDB培养基和脱脂乳培养基,在30 ℃、200 r/min条件下培养0~30 h进行对比和筛选试验。基础培养基筛选试验结果见图1。从图1可知,重组酵母细胞生长密度达到最高时的OD600值分别为:YEPD(4.43)>麦芽汁培养基(3.73)>黄豆芽培养基(3.58)>PDB(3.52)>脱脂乳粉(2.99)。因此,选择YEPD培养基为最佳基础培养基。在5种不同培养基的培养下,重组乳酸克鲁维酵母的生长趋势接近。0~8 h处于调整期,菌体生长较缓慢;在8 h后进入对数期,菌液逐渐浑浊;在18 h时进入稳定期,活菌数进入动态平衡。
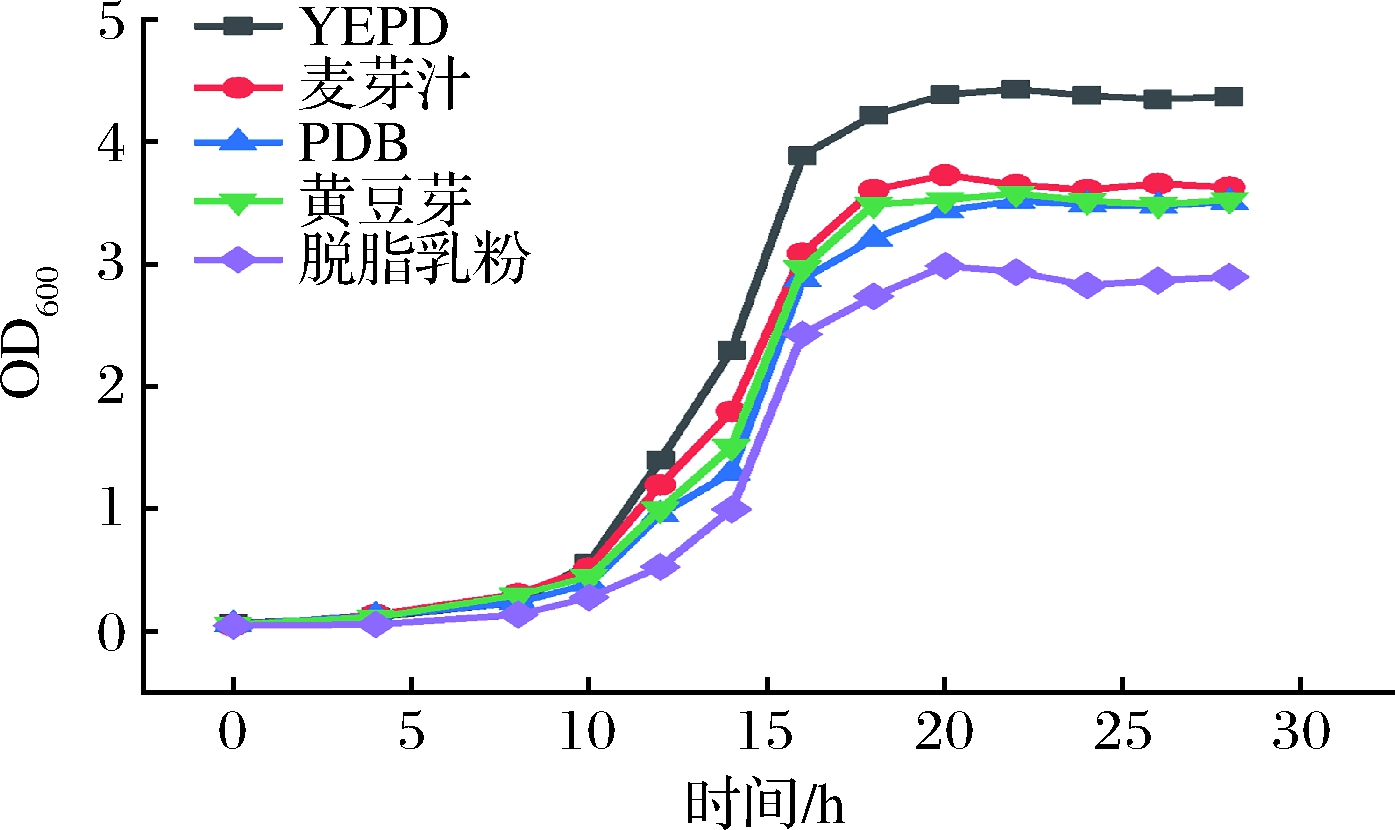
图1 不同基础培养基对重组酵母生长的影响
Fig.1 Effects of different culture media on the growth of recombinant yeast strains
对数生长后期或稳定期前期的菌体基本已经是成熟细胞,具有较强的抗干燥和抗冷冻能力,有利于后续菌体干燥工艺下的细胞存活率,所以该时期为最佳的菌体收获时间[20]。本实验中将培养20 h定为重组乳酸克鲁维酵母菌体细胞收集的最佳时间点。
2.2 培养基成分优化试验结果
2.2.1 单因素优化试验结果
2.2.1.1 最佳碳源筛选结果
不同菌种需要不同的生长条件,在培养过程中所需要的碳源种类也不同[21]。在以YEPD为基础培养基,于30 ℃、200 r/min条件下培养20 h时,其生物量约为(1.15±0.15) g/L,活菌数约为(2.05±0.36)×108 CFU/mL,本研究以YEPD在此条件下获得的生物量和活菌数为后续条件优化的对照数据。
通过向基础培养基增添碳源物质来筛选最佳的碳源及其浓度,可以有效增加菌种的生物量和活菌数。图2显示了不同碳源及其浓度对重组酵母生长的影响。
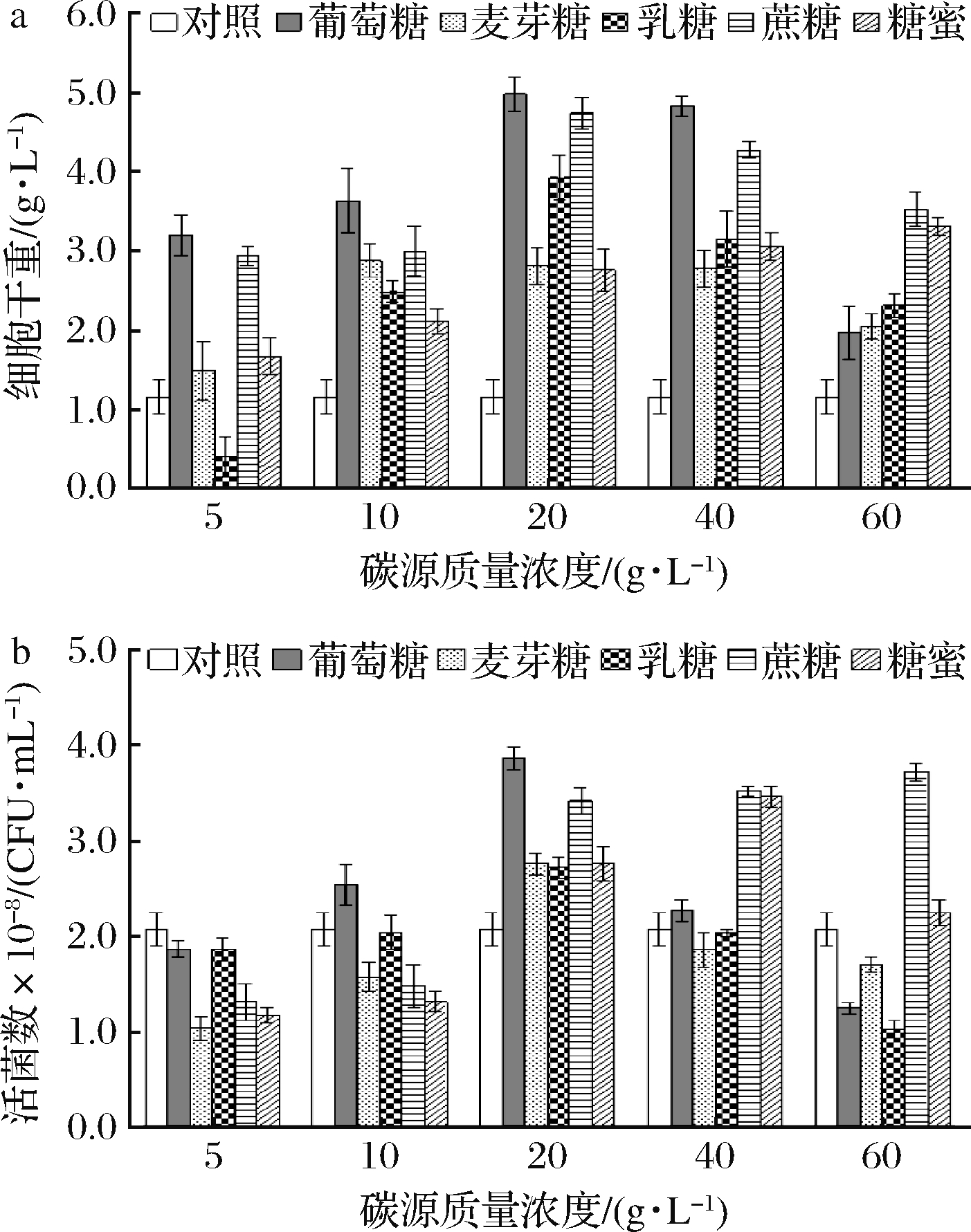
a-细胞干重;b-活菌数
图2 不同碳源及其含量对重组酵母生长影响
Fig.2 Effects of different carbon sources and concentrations on the growth of recombinant yeast strain
从图2可知,随着葡萄糖、麦芽糖、乳糖3种碳源浓度的增加,生物量和活菌数呈现先增大后减小的趋势,其中葡萄糖的质量浓度在20.0 g/L时,生物量和活菌数最高,分别为4.98 g/L和3.86×108 CFU/mL。随着蔗糖浓度的不断增加,活菌数呈现不断上升趋势,可能因为蔗糖比葡萄糖有更强的维持培养基低渗环境的效应,高浓度下更有利于菌体生长,但整体均小于20.0 g/L葡萄糖所达到的活菌数[16]。糖蜜是制糖工业副产品,其中含有蔗糖、葡萄糖、乳糖等多种糖类,是较为理想的低成本材料。但在本研究中效果不如葡萄糖和蔗糖。考虑到作用对比的实际效果,本研究选择在低浓度时对菌株生长有明显促进作用的20.0 g/L的葡萄糖作为碳源。
2.2.1.2 最佳氮源筛选结果
米糠和麸皮是农作物加工中的副产品,含有丰富的脂肪、粗蛋白、粗纤维和维生素,可以为微生物发酵提供氮源[16]。本研究针对上述有机和无机氮源对重组酵母生长影响进行了研究,结果图3所示。

a- 不同有机氮源及其含量下的细胞干重;b- 不同有机氮源及其含量下的活菌数; c- 不同无机氮源及其含量下的细胞干重;d- 不同无机氮源及其含量下的活菌数
图3 不同氮源及其含量对重组酵母生长影响
Fig.3 Effects of different nitrogen sources and concentrations on the growth of recombinant yeast strain
从图3-c和图3-d可知,无机氮源基本无法使菌体正常生长。高恩燕[16]研究了无机氮源NH4Cl、(NH4)2SO4和NH4NO3对乳源马克思克鲁维酵母的生长影响也发现,相对于空白组,无机氮源的添加不利于菌株的增殖,本实验中乳酸克鲁维酵母对无机氮源利用情况与该文献结果相似。由图3-a和图3-b可知,当蛋白胨、米糠、麸皮作为唯一氮源时,其生物量和活菌数都达到较高水平,其中米糠作为氮源时的生物量最高,达到13.32 g/L。麸皮作为氮源时的活菌数最高,达到6.03×108 CFU/mL,而蛋白胨和酵母提取物作为氮源时的活菌数基本与麸皮差不多。但是,考虑到本试验使用的麸皮和米糠颗粒粗大,本身含有的纤维可能占有一定的质量,且粗糙颗粒的不均匀性不利于重组酵母制剂化制备,为避免米糠和麸皮粗颗粒对后期研究的影响,本实验研究选取40.0 g/L蛋白胨和20.0 g/L的酵母提取物作为氮源进行后续研究。
2.2.1.3 最佳无机盐筛选结果
微生物生长中的各类代谢活动需要各种无机盐离子来参与调节,如可以调控细胞通透性和渗透压的K+、Na+、Ca2+等,可以调节细胞内部相关酶活性的Mg2+、Fe3+等[22]。研究了不同无机盐对重组酵母的影响。从图4可知,在基础培养基中添加KCl和CaCl2时,随着浓度的增加,重组酵母生物量相比对照组稍有增加,但增加量不显著;而KCl在较低的浓度下活菌数反而明显降低,CaCl2浓度对活菌数影响呈一定的波动。总体而言,KCl、CaCl2对重组酵母生长没有明显促进作用。KH2PO4添加量对活菌数呈现先增加后降低的趋势,在KH2PO4质量浓度4.0 g/L时,生物量达到最大为6.56 g/L,活菌数则在质量浓度6.0 g/L时达到最大值3.88×108 CFU/mL。同时发现,随着MnSO4浓度的增加,重组酵母生物量和活菌数减少趋势相当明显,说明额外添加MnSO4会抑制该菌株的生长。而添加的MgSO4在较低浓度下表现出对该菌株生物量和活菌数的明显促进效应。综合分析上述结果,考虑到培养基成本因素,选取4.0 g/L的KH2PO4和0.5 g/L的MgSO4为培养基最佳添加无机盐,以便后续研究。

a-细胞干重;b-活菌数
图4 不同无机盐及其含量对重组酵母生长影响
Fig.4 Effects of different inorganic salts and concentrations on the growth of recombinant yeast strain
2.2.2 响应面试验优化结果
根据上述单因素筛选结果,选择葡萄糖、蛋白胨、酵母提取物、KH2PO4、MgSO4为考察目标进行响应面试验,对培养基进行综合优化。试验结果如增强出版附件表5所示,回归模型如回归方程所示,方差分析如增强出版附件表6所示。对附表5中实验数据进行回归分析,可得回归方程为:Y=6.14+0.344 3A-0.0521B-0.024 1C-0.025 6D-0.180 6E+0.043 5AB-0.269 8AC+0.089 3AD+0.177 0AE+0.112 0BC+0.359 0BD+0.182 0BE-0.789 0CD+0.177 0CE+0.248 5DE-0.277 1A2-0.346 3B2-0.203 8C2+0.058 3D2-0.157 0E2。式中Y为响应值,即酵母生物量;A、B、C、D、E分别表示葡萄糖、蛋白胨、酵母提取物、KH2PO4、MgSO4的添加量。
从增强出版附表6方差分析可以看出,该模型非常显著(F=69.28,P<0.000 1),失拟项(F=0.288 8,P=0.973 6>0.05),相关系数R2=0.983 0,校正系数R2=0.968 8,说明该试验结果误差小,模型与实际预测值拟合效果较好,可以使用该模型来分析响应值的变化。模型中的参数A、E、AC、AE、BD、CD、CE、DE、A2、B2、C2、E2对重组酵母的生物量的提高有显著影响,AB项作用效果不显著。
多维因素相互作用的响应面优化试验结果如图5所示,按参考文献[16]方法分析响应面等高线变化速度和3D曲面图的斜度,观察并比较分析5个因素对响应值影响大小:以A(葡萄糖)、B(蛋白胨)、C(酵母提取物)、D(KH2PO4)、E(MgSO4)的含量为影响因子,以生物量即细胞干重为响应值进行响应面试验。
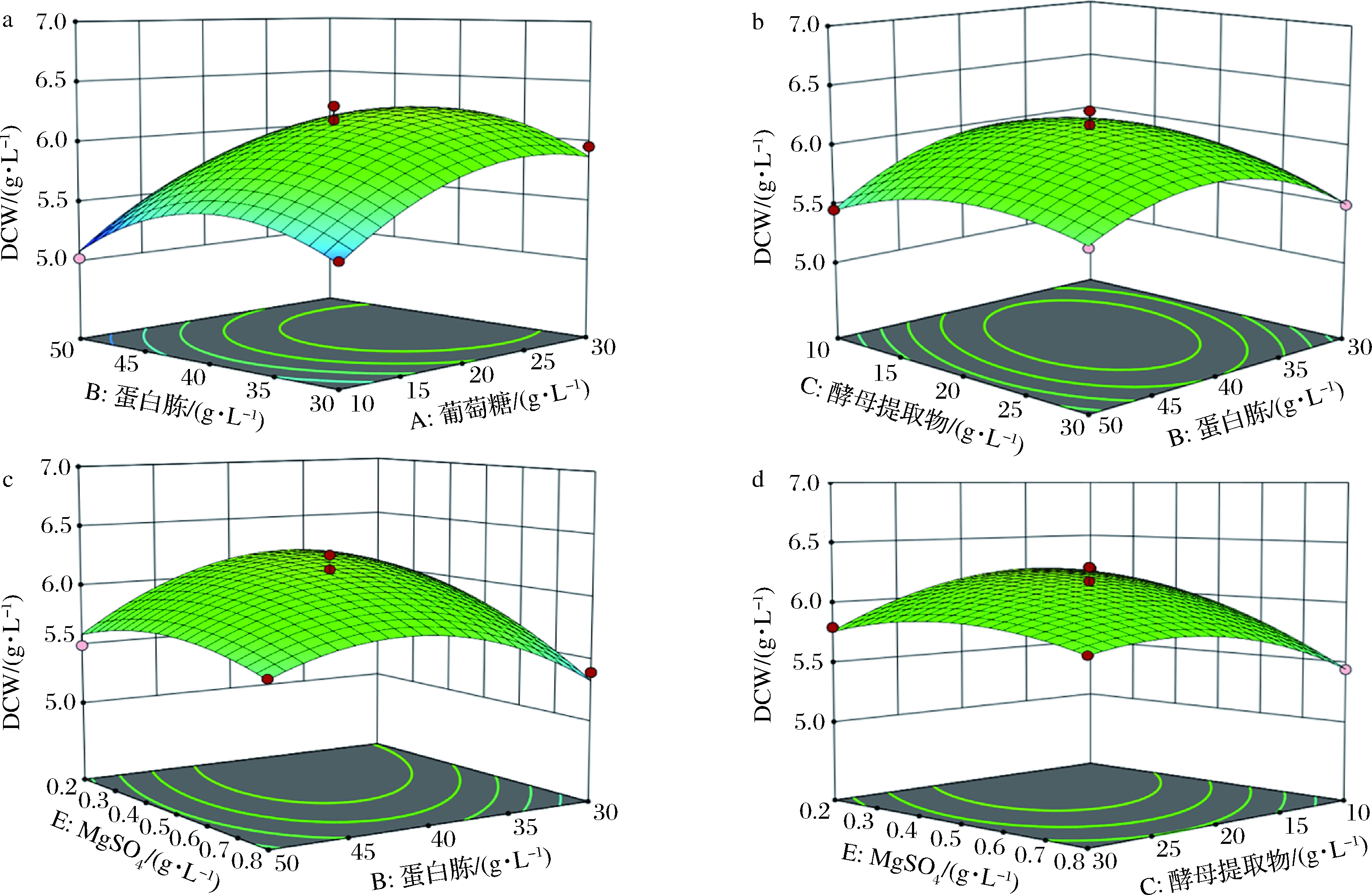
a-葡萄糖质量浓度-蛋白胨质量浓度;b-蛋白胨质量浓度-酵母提取物质量浓度 c-蛋白胨质量浓度-MgSO4质量浓度;d-酵母提取物质量浓度-MgSO4质量浓度
图5 多维因素相互作用的响应面优化结果
Fig.5 Response surface optimization results with multi-dimensional factors interactions
试验对应的3D曲面图及等高线图部分提示:与A(葡萄糖)相比,B(蛋白胨)方向等高线变化速度快,3D曲面的斜度也更大。由此可知蛋白胨对细胞干重的影响大于葡萄糖。同理,蛋白胨对细胞干重的影响也大于酵母提取物、MgSO4。对方程进行求解,可得到重组酵母生物量最大时的培养基最佳组成为:葡萄糖20.41 g/L,蛋白胨30.46 g/L,酵母提取物24.73 g/L,KH2PO4 4.48 g/L,MgSO4 0.65 g/L。在该条件下进行培养试验,得到的酵母菌体生物量最大值为(6.35±0.17) g/L,是以YEPD为基础培养基条件下重组酵母生物量的5.5倍。因此通过响应面优化后得到的培养基成分组成优势明显,可进行后续试验研究。
2.3 培养参数优化试验结果
2.3.1 培养参数的单因素优化试验结果
采用上述优化的培养基组分,探讨了不同温度、转速和pH等参数对重组酵母生长的影响,以活菌数为考量指标,单因素优化结果如图6所示。从图6-a可知,重组酵母的生物量和活菌数均随着温度的升高呈现先升后降趋势。在28 ℃时生物量和活菌数达到最大,分别为6.52 g/L、3.35×108 CFU/mL。从图6-b可知,当转速为200 r/min时,重组酵母的生物量和活菌数达到最高,分别为6.63 g/L、2.90×108 CFU/mL。从图6-c可知,重组酵母的最佳生长pH为5.0。当pH高于或者低于5.0时,对活菌数会造成较大的影响。

a-培养温度;b-培养转速;c-培养基pH
图6 不同温度、转速和pH对重组酵母生长的影响
Fig.6 Effects of different temperatures, agitation speeds and pH conditions on the growth of recombinant yeast strain
2.3.2 培养参数的正交优化试验结果
对重组酵母的培养参数进行了正交试验优化,结果如表1所示。从表1的极差分析结果可以看出,温度(A)、转速(B)、pH(C)三种培养参数对重组酵母生长的生物量影响程度大小:RC>RB>RA,优化后方案为C1B3A1。
表1 培养条件优化的正交试验结果
Table 1 Orthogonal tests results of culture parameters

编码A(温度)/℃B(转速)/r·min-1C(pH) 生物量/(g·L-1)1261804.57.508±0.132262005.07.668±0.223262205.57.548±0.214281804.57.124±0.195282005.06.142±0.166282205.58.090±0.247301804.57.048±0.088302005.06.862±0.149302205.57.020±0.17K17.5747.2277.562K27.1196.8917.271K36.9777.5536.837R0.5980.6620.723因素主次CBA优化方案C1B3A1
综合以上结果,培养参数的最佳组合为:温度26 ℃、转速220 r/min、初始pH 4.5。在此条件下重复3次试验,获得重组酵母生物量为(8.62±0.22) g/L,该结果是以YEPD为基础培养基,于30 ℃、200 r/min条件下培养20 h时重组酵母生物量的7.5倍。
2.4 发酵罐扩大培养试验结果
为使得优化后的工艺条件能够更好地应用于工业化生产,对该重组酵母进行了5 L发酵罐放大培养试验,验证上述优化条件下的高密度培养结果。按照上述优化的培养基最佳组成和最佳培养参数进行发酵罐培养试验,收获的生物量与培养基葡萄糖含量变化结果见图7。发酵进行到18~20 h时,培养基葡萄糖含量基本耗尽,需要对其进行恒速补料。考虑到摇瓶培养方式下优化培养参数时,发现pH对重组酵母的生长有较大影响,故在发酵罐试验中再次对pH进行了梯度优化试验,结果表明使其恒定在pH 5.0条件下,此时重组酵母生长最好,培养35 h其生物量达到(34.05±3.34) g/L,是以YEPD为基础培养基、于30 ℃、200 r/min条件下培养20 h时重组酵母生物量的29.6倍。

a-细胞干重;b-培养基葡萄糖含量
图7 不同pH下重组酵母5 L发酵罐扩大培养结果
Fig.7 Expended cultivation of recombinant yeast strain in 5 L fermentor at different pH conditions
3 结论与讨论
乳酸克鲁维酵母GG799(pKLAC1-ZPF1)是一种可同时降解AFB1和ZEN的食品级重组酵母,对食品和饲料行业原料中真菌毒素的降解具有重要潜在应用价值。本研究在单因素试验优化的基础上,利用响应面试验和正交试验优化了该重组酵母的培养基成分和培养参数。确定了摇瓶培养优化的培养基最佳成分为:葡萄糖20.41 g/L、蛋白胨30.46 g/L、酵母提取物24.73 g/L、KH2PO4 4.48 g/L、MgSO4 0.65 g/L;最佳培养参数为:26 ℃、220 r/min、初始pH 4.5。在上述优化条件下进行发酵罐扩大培养并继续优化了培养pH,获得的生物量是摇瓶培养对照条件下的29.6倍。本研究优化并提高了食品级重组乳酸克鲁维酵母的生物量,为GG799(pKLAC1-ZPF1)株将来工业化应用提供了重要理论依据和参考数据。
[1] ADEYEYE S A O.Aflatoxigenic fungi and mycotoxins in food:A review[J].Critical Reviews in Food Science and Nutrition,2020,60(5):709 - 721.
[2] NAZHAND A,DURAZZO A,LUCARINI M,et al.Characteristics,occurrence,detection and detoxification of aflatoxins in foods and feeds[J].Foods (Basel),2020,9(5):644.
[3] LEE H J,RYU D.Worldwide occurrence of mycotoxins in cereals and cereal-derived food products:Public health perspectives of their co-occurrence[J].Journal of Agricultural and Food Chemistry,2017,65(33):7 034-7 051.
[4] ESKOLA M,KOS G,ELLIOTT C T,et al.Worldwide contamination of food-crops with mycotoxins:Validity of the widely cited 'FAO estimate' of 25[J].Critical Reviews in Food Science and Nutrition,2020,60(16):2 773-2 789.
[5] LIU Y,GALANI YAMDEU J H,GONG Y Y,et al.A review of postharvest approaches to reduce fungal and mycotoxin contamination of foods[J].Comprehensive Reviews in Food Science and Food Safety,2020,19(4):1 521-1 560.
[6] WAN J,CHEN B C,RAO J J.Occurrence and preventive strategies to control mycotoxins in cereal-based food[J].Comprehensive Reviews in Food Science and Food Safety,2020,19(3):928-953.
[7] ADEBO O A,NJOBEH P B,GBASHI S,et al.Review on microbial degradation of aflatoxins[J].Critical Reviews in Food Science and Nutrition,2017,57(15):3 208-3 217.
[8] WANG N,WU W W,PAN J W,et al.Detoxification strategies for zearalenone using microorganisms:A review[J].Microorganisms,2019,7(7):208.
[9] WANG X L,QIN X,HAO Z Z,et al.Degradation of four major mycotoxins by eight manganese peroxidases in presence of a dicarboxylic acid[J].Toxins (Basel),2019,11(10):566.
[10] ZHANG Z X,XU W,WU H,et al.Identification of a potent enzyme for the detoxification of zearalenone[J].Journal of Agricultural and Food Chemistry,2020,68(1):376-383.
[11] SPOHNER S C,SCHAUM V,QUITMANN H,et al.Kluyveromyces lactis:An emerging tool in biotechnology[J].Journal of biotechnology,2016,222:104-116.
[12] 孙莹. 锰过氧化物酶的酵母异源表达及其降解黄曲霉毒素研究[D].无锡:江南大学,2020.
SUN Y.Study on expression of manganese peroxidase and its degradation of aflatoxin by recombinant yeast[D].Wuxi:Jiangnan University,2020.
[13] 徐荣荣. 玉米赤霉烯酮降解酶Zhd101的突变改造、分泌表达及应用研究[D].无锡:江南大学,2019.
XU R R.Mutational modification,secretion expression and application of zearalenone degrading enzyme Zhd101[D].Wuxi:Jiangnan University,2019.
[14] JIANG F,KONGSAEREE P,SCHILKE K,et al.Effects of pH and temperature on recombinant manganese peroxidase production and stability[J].Applied Biochemistry and Biotechnology,2008,146:15-27.
[15] XIANG L,WANG Q H,ZHOU Y L,et al.High-level expression of a ZEN-detoxifying gene by codon optimization and biobrick in Pichia pastoris[J].Microbiological Research,2016,193:48-56.
[16] 高恩燕.乳源马克思克鲁维酵母菌的筛选、增殖培养及其冻干菌粉制备的优化研究[D].镇江:江苏大学,2019.
GAO E Y.Optimization research of screening and proliferation culture of dairy yeast (Kluyveromyces marxianus) and preparation of freeze-dried powder[D].Zhenjiang:Jiangsu University,2019.
[17] 王亮, 胡曼,王江月,等.马克斯克鲁维酵母高密度发酵条件的优化研究[J].食品工业科技,2017,38(17):111-118;124.
WANG L,HU M,WANG J Y,et al.Optimization of high density fermentation conditions of Kluyveromyces marxianus[J].Science and Technology of Food Industry,2017,38(17):111-118;124.
[18] XIA Y,WU Z F,HE R,et al.Simultaneous degradation of two mycotoxins enabled by a fusion enzyme in food-grade recombinant Kluyveromyces lactis[J].Bioresources and Bioprocessing,2021,8(1):1-11.
[19] 叶勤. 发酵过程原理[M].北京:化学工业出版社,2005.
YE Q.Principle of fermentation process[M].Beijing:Chemical Industry Press,2005.
[20] 周亚男, 王英琪,刘红,等.喷雾干燥法制备鲁氏酵母发酵剂的研究[J].食品研究与开发,2017,38(12):114-118.
ZHOU Y N,WANG Y Q,LIU H,et al.Study on preparation of Zygosaccharomyces rouxii fermentation agent by spray drying[J].Food Research and Development,2017,38(12):114-118.
[21]  LVAREZ-CAO M E,CERD
LVAREZ-CAO M E,CERD N M E,GONZ
N M E,GONZ LEZ-SISO M I,et al.Bioconversion of beet molasses to alpha-galactosidase and ethanol[J].Frontiers in Microbiology,2019,10:405.
LEZ-SISO M I,et al.Bioconversion of beet molasses to alpha-galactosidase and ethanol[J].Frontiers in Microbiology,2019,10:405.
[22] JØRGENSEN H.Effect of nutrients on fermentation of pretreated wheat straw at very high dry matter content by Saccharomyces cerevisiae[J].Applied Biochemistry and Biotechnology,2009,153(1):44-57.