由于全球气候变暖,葡萄成熟时的含糖量越来越高,导致葡萄酒酒度不断升高[1]。在过去30年的时间里,全球葡萄酒的酒精度平均上升了约2%(乙醇体积分数,下同)[2-3]。在我国西北部分葡萄酒产区,特别是近10年来,葡萄完全成熟时的含糖量甚至超过270 g/L,从而导致葡萄酒最终酒精度超过15%。较高的酒精度不利于酒体平衡,也影响葡萄酒的香气和风味[4]。利用葡萄栽培技术、葡萄酒物理脱醇技术和微生物技术等,可以在一定程度上降低葡萄酒的酒精度[5-6],这其中,选育具有低产乙醇的酵母菌株将是最简单和经济的方法。有研究显示,假丝酵母属(Candida)、有孢汉逊酵母属(Hanseniaspora)、有孢圆酵母属(Torulaspora)、美奇酵母属(Metschnikowia)、毕赤酵母属(Pichia)、Starmerella和Lachancea等酵母属的部分菌株具有低产乙醇的特性,可以使葡萄酒的酒精度降低0.3%~3.8%[7-11]。
Hanseniaspora主要包括葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),仙人掌有孢汉逊酵母(Hanseniaspora opuntiae)、季也蒙有孢汉逊酵母(Hanseniaspora guilliermondii)、葡萄园有孢汉逊酵母(Hanseniaspora vineae)等。有研究表明H.uvarum的纯种或混合发酵可以降低酒精含量,同时产生较低的挥发酸和更高的甘油、有机酸、醛类、醇类等次级代谢产物[12]。ROSSOUW等[10]利用H.opuntiae和H.uvarum发酵Pinotage,酒精度分别降低了0.6%和0.8%。GOBBI等[13]使用H.uvarum单独发酵Verdicchio和Trebbiano,可使乙醇产量降低32.9%。ZHU等[14]筛选到2株乙醇产量及产率均低于酿酒酵母的H.uvarum 06/4菌株,其乙醇产量减少了10%。但同时,大部分有孢汉逊酵母在葡萄酒生境下的生长能力较弱,因为较高的葡萄含糖量、酒精度的增加、发酵温度的变化、SO2的添加等都可能会抑制有孢汉逊酵母的生长。
我国葡萄酒产区分布广、生态多样,蕴藏着丰富的有待开发的非酿酒酵母资源,而有孢汉逊酵母属酵母是葡萄表皮和葡萄酒发酵早期主要的“土著”酵母属,因此本研究以有孢汉逊酵母属酵母为研究对象。为了获得低产乙醇且酿造特性较好的本土有孢汉逊酵母菌株,本研究以从宁夏、甘肃、陕西和新疆分离获得的53株有孢汉逊酵母为材料,首先利用模拟葡萄汁发酵,筛选出乙醇产率较低和生长速率较快的有孢汉逊酵母,并对其糖、乙醇、SO2、低pH、温度耐受性、嗜杀性和产H2S特性等葡萄酒酿造学特性进行分析。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
53株本土有孢汉逊酵母(分离自宁夏、甘肃、陕西和新疆)和1株酿酒酵母(分离自宁夏),均保藏于西北农林科技大学葡萄酒学院,如表1所示。
表1 本研究使用的本土酵母菌株
Table 1 Indigenous yeast strains used in this study

酵母菌种菌株名称来源酿酒酵母(Saccharomyces cerevisiae)NX11424宁夏季也蒙有孢汉逊酵母(Hanseniaspora guilliermondii)HgB-1-4、HgC-2-4、HgC-3-1、HgC-4-4陕西仙人掌有孢汉逊酵母(Hanseniaspora opuntiae)Ho01 W23、Ho01 W25、Ho23 W64、Ho23 W68、HoA-1-2、HoA-1-3、HoA17-2-10、HoB-1-1、HoB-1-3、HoB-1-5、HoB-2-1、HoB-2-3、HoB7-15、HoBG-1-3、HoC-1-3、HoC-1-4、HoC-1-5、HoC-3-3、HoC-4-1、HoC-4-2、HoD-1-1、HoD-1-2、HoD-1-3、HoD-1-5陕西、新疆葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)Hu01 W21、Hu13 W76、HuA6-1-6、HuA9-2-1、HuA27-3-4、HuB-1-2、HuB1S-6、HuB-2-2、HuBG-1-5、HuBG-1-6、HuC-2-3、HuC-2-5、HuC-3-2、HuC-3-5、HuC-4-5、HuC413、HuC466、HuD-1-4、HuD-2-1、HuD-2-2、HuD-2-3、HuD-2-4、HuF-2-1、HuM68、HuM69陕西、新疆、甘肃、宁夏
1.1.2 培养基
YEPD培养基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,121 ℃高压灭菌20 min。
YEPD-MB培养基(g/L):葡萄糖 20,蛋白胨20,酵母浸粉10,琼脂20,亚甲基蓝0.03,0.2 mol/L 磷酸柠檬酸缓冲溶液调pH值至4.6,121 ℃高压灭菌20 min。
Triple M模拟汁[15]:葡萄糖100 g/L,果糖100 g/L,4 mL/L ergo stock(Tween-80 12.5 mL,95%乙醇 37.5 mL,麦角固醇 0.125 g);L-(+)酒石酸 6 g/L,L-(-)苹果酸 3 g/L,柠檬酸0.5 g/L;YNB 1.7 g/L,酸水解酪蛋白2 g/L,肌醇0.006 g/L,CaCl2 0.2 g/L,L-脯氨酸1 g/L,DL-色氨酸0.1 g/L,精氨酸0.8 g/L,(NH4)3PO4 1 g/L。KOH溶液调pH值至3.25,0.22 μm滤膜过滤除菌。
WL营养琼脂,青岛高科技工业园海博生物技术有限公司;BIGGY琼脂,北京陆桥技术有限责任公司。
1.2 仪器与设备
ZHWY—2102C恒温培养振荡器,上海智城分析仪器制造有限公司;AUX320分析天平,日本SHIMADZU公司;SX-500立式压力蒸汽灭菌器,中国Techcomp公司;ELX800全自动酶标仪,美国Bio Tek公司;BK1301生物显微镜,重庆光电仪器有限公司;Spectra Max M2多功能微孔板检测仪,美国Molecular Devices公司。
1.3 实验方法
1.3.1 酵母培养
将保藏的酵母菌液划线于WL营养琼脂培养基,28 ℃下培养3~5 d。在WL营养琼脂培养基上挑取单菌落接种于YEPD液体培养基中,于28 ℃、150 r/min的条件下培养24 h制备酵母种子液。
1.3.2 低产乙醇有孢汉逊酵母的筛选
将53株有孢汉逊酵母及对照菌株酿酒酵母NX11424的活化菌液以2%的接种量接种于50 mL 模拟汁中,28 ℃、150 r/min扩大培养24 h,然后再将扩大培养的菌液以1×106 CFU/mL的接种量接种到装有150 mL模拟葡萄汁的250 mL发酵瓶中发酵,发酵瓶用封口膜密封,25 ℃静置发酵,每个菌株设置3组平行。发酵过程中,每隔8 h对酿酒酵母取样测定残糖和CO2失重,每24 h测定有孢汉逊酵母的CO2失重。当糖含量<4 g/L或连续72 h CO2失重不再变化时视为发酵结束。发酵结束后,通过比较各菌株的CO2失重速率、乙醇产量、乙醇产率、乙醇产率的变化率等指标,筛选获得低产乙醇的有孢汉逊酵母。
1.3.3 低产乙醇有孢汉逊酵母的发酵验证
为进一步确定所筛选有孢汉逊酵母的低产乙醇特性,将其和对照菌株NX11424再次进行模拟发酵。
将待测有孢汉逊酵母及对照菌株酿酒酵母NX11424的活化菌液,以2%的接种量接种于50 mL模拟汁中,28 ℃、150 r/min扩大培养24 h,然后再将扩大培养的菌液以1×106 CFU/mL的接种量接种到装有150 mL模拟葡萄汁的250 mL发酵瓶中发酵,发酵瓶用封口膜密封,25 ℃静置发酵,每个菌株设置3组平行。利用移液枪在超净工作台进行无菌取样,每次取样体积均等且控制在1 mL。通过测定发酵液的还原糖含量监控发酵过程(酿酒酵母:每24 h测定1次;有孢汉逊酵母:发酵前期,每48 h测定1次,发酵后期,每72 h测定1次)。发酵结束后,测定各菌株的理化指标。
1.3.4 优选有孢汉逊酵母的系统发育树构建
采用通用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)进行26S rDNA D1/D2区的扩增。PCR扩增液送至上海生工生物工程股份有限公司进行测序。将测序结果在NCBI数据库中用BLAST软件与已知序列进行同源比对分析。根据同源序列搜索结果,用Clustal X软件对优选菌株和相关模式菌株的多个序列进行匹配分析(Alignment),利用MEGA 7.0构建系统发育树,并进行1 000次Bootstrap检验。
1.3.5 四株有孢汉逊酵母菌株的工艺学性状
1.3.5.1 糖耐受性
在YEPD液体培养基中加入葡萄糖,使其葡萄糖质量浓度分别为100、150、200、250、300、350 和400 g/L,经过滤除菌后,将酵母种子液以1×106 CFU/mL的接种量接种于培养基中,28 ℃条件下培养48 h,使用酶标仪测定各菌株的OD600。
1.3.5.2 酒精耐受性
在灭菌之后的YEPD液体培养基中加入无水乙醇调整乙醇体积分数为2%、4%、6%、8%、10%,将酵母种子液以1×106 CFU/mL的接种量接种于培养基中,28 ℃条件下培养48 h,使用酶标仪测定各菌株的OD600。
1.3.5.3 SO2耐受性
在灭菌之后的YEPD液体培养基中加入H2SO3调整SO2质量浓度为60、120、180、240、300、360和420 mg/L,将酵母种子液以1×106CFU/mL的接种量接种于培养基中,28 ℃条件下培养48 h,使用酶标仪测定各菌株的OD600。
1.3.5.4 温度耐受性
将酵母种子液以1×106 CFU/mL的接种量接种于已灭菌的YEPD液体培养基中,分别置于温度为10、15、20、25、30、35和40 ℃的培养箱中,28 ℃条件下培养48 h,使用酶标仪测定各菌株的OD600。
1.3.5.5 低pH耐受性
用磷酸-柠檬酸缓冲液调节YEPD液体培养基的pH值分别为2.8、3.2、3.6、4.0,灭菌后接种酵母种子液,接种量为1×106 CFU/mL,28 ℃条件下培养48 h,使用酶标仪测定各菌株的OD600。
1.3.5.6 酵母嗜杀性测定
将酿酒酵母NX11424细胞计数后用无菌水稀释至107 CFU/mL后涂布于YEPD-MB培养基,然后取5 μL非酿酒酵母菌液点样在涂有酿酒酵母的YEPD-MB培养基上,28 ℃恒温培养2 d。若非酿酒酵母菌株为嗜杀菌株,其菌落周围会形成蓝色死菌带和透明抑菌圈[16]。
1.3.5.7 酵母产H2S特性检验
将5 μL非酿酒酵母菌液点样于BIGGY培养基上,28 ℃恒温培养3~5 d,观察菌落颜色。一般H2S产量由低到高对应菌落颜色分别为白色(不产)、黄棕色(低产)、褐色(中产)和黑色(高产)[17]。
1.3.6 理化指标测定
利用酶标仪测定样品在600 nm波长下的OD值;采用DNS法[18]测定残糖的含量。按照Megazyme乙醇试剂盒(K-ETOH)和BioSystems甘油试剂盒分别检测乙醇和甘油。参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》[19]测定总酸和挥发酸。
1.4 数据处理与指标计算
1.4.1 数据处理
利用Excel 2016进行发酵数据统计。采用SPSS 20.0进行单因素方差分析(ANOVA)和Duncan多范围检验以确定数据之间的显著差异(P<0.05)。利用Origin Pro 2018作图。
1.4.2 指标计算
乙醇产量/(g·L-1)=φ(乙醇)×10×0.789
(1)
式中:0.789为乙醇密度,g/mL[13]。
乙醇产率![]()
(2)
乙醇产率变化率![]()
(3)
式中:A,供试有孢汉逊酵母发酵结束时的乙醇产率;B,当酿酒酵母与供试有孢汉逊酵母消耗相同糖时,酿酒酵母的乙醇产率。
2 结果与分析
2.1 低产乙醇有孢汉逊酵母菌株的筛选
对53株本土有孢汉逊酵母进行模拟葡萄汁发酵,以乙醇产率作为主要评价指标,以S.cerevisiae NX11424为对照菌株,评估了有孢汉逊酵母菌株的产乙醇能力(表2)。有孢汉逊酵母的CO2最大失重速率明显低于S.cerevisiae NX11424,其中,葡萄汁有孢汉逊酵母(H.uvarum)HuD-2-2的发酵速率较快,CO2最大失重速率达到0.48 g/(L·h)。有孢汉逊酵母的乙醇产率介于0.185~0.494 g/g,而S.cerevisiae NX11424的乙醇产率为0.404 g/g。53株有孢汉逊酵母中,有28株酵母的乙醇产率低于S.cerevisiae NX11424,降低幅度为3.78%~39.52%。
综合分析CO2最大失重速率、糖利用率、乙醇产率及乙醇产率的变化率等指标,初步筛选出4株低产乙醇且发酵速率较快的菌株,分别为H.opuntiae HoA-1-3、HoC-4-2和H.uvarum HuB-2-2、HuC-3-2,其进化关系如图1所示。H.opuntiae HoA-1-3、HoC-4-2和H.uvarum HuB-2-2、HuC-3-2的糖利用率分别为86.94%、90.13%和98.77%、87.69%,乙醇产率分别降低了26.03%、22.33%和23.77%、32.05%。
表2 菌株的发酵相关参数
Table 2 Fermentation parameters of the strains

菌株CO2最大失重速率/[g·(L·h)-1]残糖/(g·L-1)糖利用率/%酒精度/%乙醇产量/(g·L-1)乙醇产率/(g·g-1糖)乙醇产率变化率/%NX114240.63±0.051.82±0.4099.09±0.2010.16±0.0180.13±0.050.404±0.0010HgB-1-40.18±0.01139.01±1.1030.50±4.553.58±0.3728.24±2.920.465±0.02415.16 HgC-2-40.20±0.01126.49±1.3936.75±2.694.55±0.3035.93±2.350.489±0.0235.32 HgC-3-10.19±0.01123.06±2.4638.47±7.234.13±0.6732.58±5.310.425±0.02521.12 HgC-4-40.20±0.01126.07±3.3336.96±1.664.25±0.2733.52±2.120.455±0.04812.59 Ho01 W230.22±0.00110.04±5.9144.98±3.503.25±0.2025.63±1.100.409±0.0141.17 Ho01 W250.24±0.02103.41±6.9948.29±3.493.05±0.4024.10±3.150.252±0.052-37.62 Ho23 W640.21±0.01118.63±2.5840.69±5.793.53±0.1427.88±1.120.358±0.015-11.45 Ho23 W680.27±0.01127.70±3.5836.15±4.794.11±0.2132.43±1.650.494±0.21122.35 HoA-1-20.21±0.01104.17±4.4747.92±1.583.70±0.7829.17±4.340.303±0.020-24.96 HoA-1-30.35±0.0126.11±2.1386.94±4.296.58±0.3951.95±2.180.299±0.003-26.03 HoA17-2-100.27±0.0260.07±2.9469.97±4.974.64±0.5136.58±4.010.261±0.018-35.36 HoB-1-10.20±0.0165.65±2.0667.18±3.036.38±0.4150.36±11.150.378±0.028-6.47 HoB-1-30.20±0.01103.32±15.2648.34±5.394.19±0.3933.05±2.170.344±0.023-14.94 HoB-1-50.25±0.01126.12±3.7536.94±1.873.63±0.2028.64±1.580.389±0.036-3.78 HoB-2-10.20±0.01107.81±3.7246.09±4.365.15±0.2640.61±6.760.445±0.02810.10 HoB-2-30.23±0.0199.91±2.4050.04±1.23.18±0.3225.08±2.510.250±0.022-38.01 HoB7-150.18±0.01124.65±3.7437.67±1.874.26±0.4333.60±3.410.464±0.00614.85 HoBG-1-30.40±0.0114.64±2.3492.68±3.179.08±1.3071.61±10.290.388±0.068-4.01 HoC-1-30.21±0.02116.74±2.6541.63±4.322.96±0.4023.36±3.140.283±0.008-29.99 HoC-1-40.23±0.02103.72±3.5448.14±1.775.61±0.4244.23±6.490.459±0.01813.56 HoC-1-50.22±0.02128.54±1.0135.73±3.514.08±0.6132.19±4.810.469±0.00116.14 HoC-3-30.22±0.02131.31±1.6534.35±5.334.30±0.4733.91±6.090.492±0.01621.86 HoC-4-10.20±0.01128.71±2.7735.64±1.393.92±0.3930.93±3.040.434±0.0437.45 HoC-4-20.34±0.0119.74±1.6590.13±2.837.13±0.7056.24±3.440.314±0.009-22.33 HoD-1-10.23±0.01131.10±1.6834.45±3.844.03±0.1431.83±4.390.459±0.01513.63 HoD-1-20.21±0.02127.08±2.4736.46±1.244.01±0.2331.66±1.830.435±0.0397.70 HoD-1-30.22±0.0184.00±1.8958.00±7.034.23±0.4733.36±5.390.301±0.017-25.44 HoD-1-50.38±0.0115.08±1.5192.46±0.759.49±0.5474.91±4.280.405±0.0270.31 Hu01 W210.39±0.0117.34±4.2991.33±2.159.81±0.2377.36±1.810.424±0.0074.84 Hu13 W760.24±0.0169.44±3.6765.28±5.344.12±0.6932.47±1.430.244±0.002-39.52 HuA6-1-60.24±0.0299.8±5.4750.10±2.734.30±0.1833.95±1.430.339±0.014-16.05 HuA9-2-10.22±0.00112.43±5.9843.78±2.994.82±0.0538.02±0.420.435±0.0277.79 HuA27-3-40.22±0.01112.6±6.7943.70±3.394.15±0.4832.76±3.800.376±0.046-6.95 HuB-1-20.21±0.01137.88±6.7931.06±3.393.77±0.0429.77±0.280.483±0.05319.57 HuB1S-60.22±0.01106.31±4.7946.84±1.693.03±0.2023.92±3.370.257±0.004-36.41 HuB-2-20.41±0.012.46±0.2698.77±0.517.72±0.5960.91±4.470.308±0.001-23.77
续表1

菌株CO2最大失重速率/[g·(L·h)-1]残糖/(g·L-1)糖利用率/%酒精度/%(体积分数)乙醇产量/(g·L-1)乙醇产率/(g·g-1糖)乙醇产率变化率/%HuBG-1-50.46±0.0113.58±1.2893.21±1.168.52±0.0467.24±9.980.360±0.022-10.99 HuBG-1-60.44±0.0120.64±1.5589.68±2.677.56±0.3559.67±7.550.332±0.016-17.89 HuC-2-30.45±0.0217.11±1.6491.45±0.829.52±0.2675.10±2.040.411±0.0101.63 HuC-2-50.27±0.01110.91±1.7244.55±2.863.01±0.3823.76±2.990.271±0.008-32.97 HuC-3-20.28±0.0124.63±0.6887.69±4.846.13±0.2948.34±8.060.274±0.014-32.05 HuC-3-50.44±0.0118.88±1.0790.56±1.038.02±0.0763.26±4.190.349±0.031-13.68 HuC-4-50.23±0.01120.88±4.3139.56±7.162.98±0.3823.49±2.980.307±0.027-23.91 HuC4130.36±0.0121.87±2.0589.06±2.537.63±0.5960.21±2.550.337±0.065-16.52 HuC4660.20±0.01156.07±2.9321.96±3.112.39±0.2618.85±7.010.429±0.0026.09 HuD-1-40.18±0.02145.83±1.8327.09±0.913.19±0.2525.17±1.980.464±0.02614.93 HuD-2-10.43±0.017.34±2.3096.33±1.1510.47±0.6382.60±4.930.429±0.0216.08 HuD-2-20.48±0.025.35±2.8497.32±1.429.49±0.0974.85±0.700.385±0.005-4.81 HuD-2-30.20±0.02129.46±1.6535.27±6.323.91±0.3730.84±6.900.441±0.0379.21 HuD-2-40.39±0.013.32±0.6298.34±0.3110.42±0.4182.18±3.270.418±0.0153.42 HuF-2-10.22±0.0153.1±1.5873.45±7.795.11±0.4540.32±3.580.276±0.030-31.58 HuM680.18±0.0178.86±5.4660.57±0.006.52±0.5251.44±0.000.425±0.0255.11 HuM690.20±0.0194.56±4.3152.72±1.534.06±0.2432.06±4.130.305±0.018-24.39
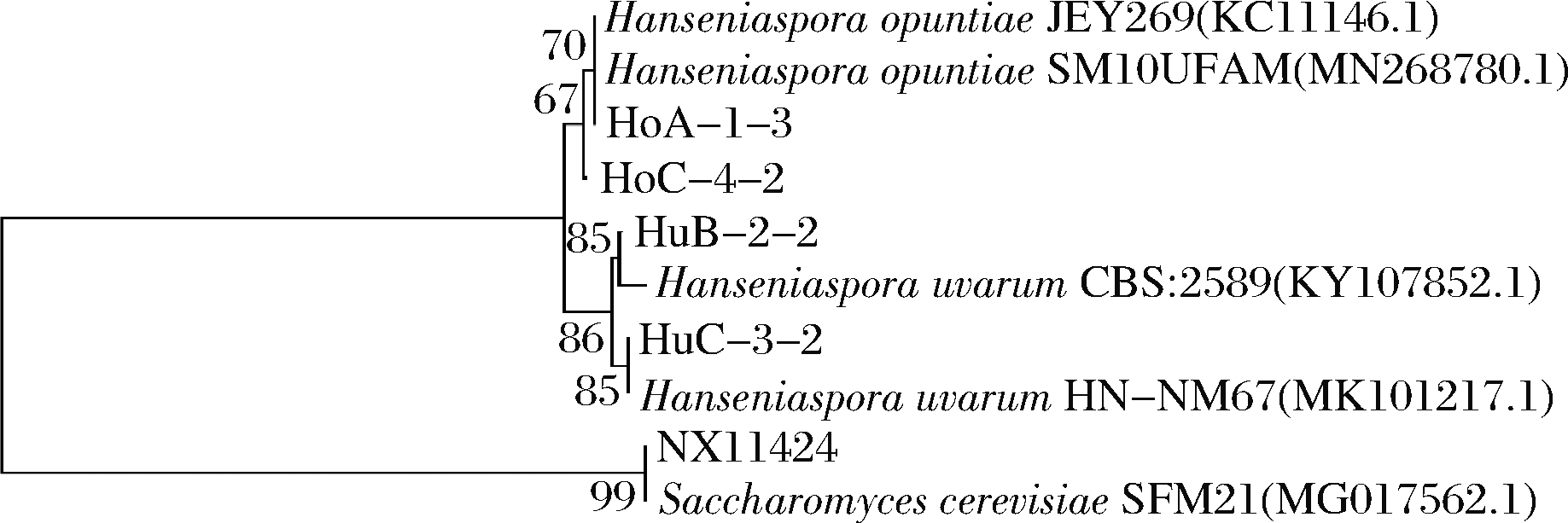
图1 四株有孢汉逊酵母的系统进化树
Fig.1 Phylogenetic tree of four Hanseniaspora strains
2.2 低产乙醇有孢汉逊酵母的进一步发酵验证
为了进一步验证筛选获得的4株有孢汉逊酵母菌株的乙醇合成能力,再次进行模拟葡萄汁发酵。
2.2.1 四株有孢汉逊酵母菌株的发酵动力学特征
当发酵进行到12 d时,4株有孢汉逊酵母逐渐适应了模拟葡萄汁环境,发酵速度均明显加快,其中H.uvarum HuC-3-2的糖消耗速率最快,并于第21天完成发酵;H.opuntiae HoC-4-2和H.uvarum HuB-2-2的发酵趋势基本一致,发酵能力稍弱于H.uvarum HuC-3-2;H.opuntiae HoA-1-3的发酵能力最弱,在30 d内不能完成发酵(图2-a和图2-b)。尽管H.opuntiae HoC-4-2、H.uvarum HuB-2-2和H.uvarum HuC-3-2均可以单独完成葡萄模拟汁发酵,但在真实葡萄酒发酵过程中,通常需要将有孢汉逊酵母和酿酒酵母进行混合接种发酵。
4株有孢汉逊酵母的乙醇产量明显低于NX11424,其中H.opuntiae HoA-1-3的乙醇产生速率最慢,其他3株有孢汉逊酵母产乙醇速率的趋势相似(图2-c)。发酵结束后,H.opuntiae HoA-1-3、H.opuntiae HoC-4-2、 H.uvarum HuB-2-2和H.uvarum HuC-3-2的酒精度分别为6.41%、8.47%、9.38%和8.48%。
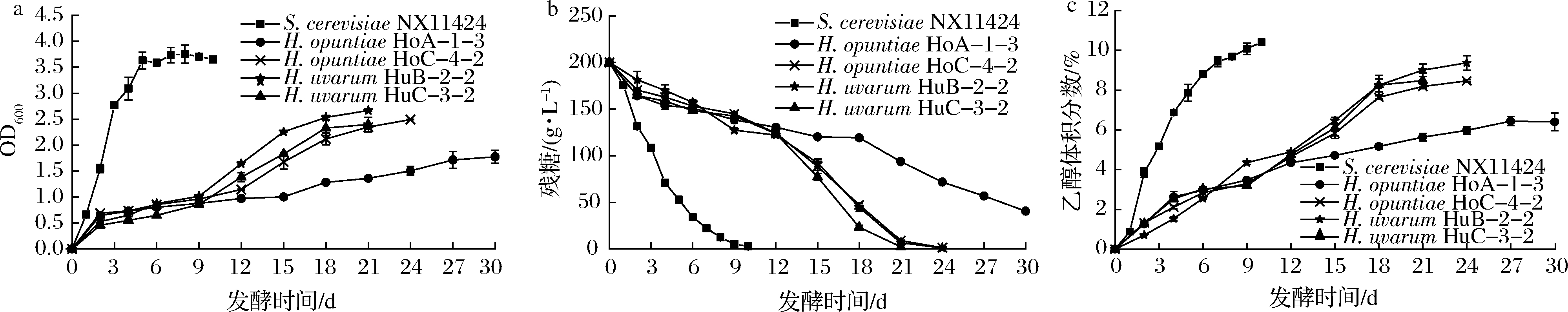
a-菌体生长特征;b-糖消耗特征;c-乙醇产量特征
图2 四株有孢汉逊酵母菌株的菌体生长特征、糖消耗特征和乙醇产量特征
Fig.2 Characteristics of cell growth, sugar consumption and ethanol production of four Hanseniaspora strains
2.2.2 四株有孢汉逊酵母菌株的代谢物
除H.opuntiae HoA-1-3外,其他菌株的残糖含量均在4 g/L以下。5株酵母菌株的酒精度和乙醇产率分别为6.41%~10.41%(体积分数)和0.317~0.417 g/g。与S.cerevisiae NX11424相比,H.opuntiae HoA-1-3、HoC-4-2和H.uvarum HuB-2-2、HuC-3-2的乙醇产率分别降低了23.87%、19.25%和10.74%、18.74%(表3)。
表3 发酵结束后菌株的理化指标
Table 3 Physical and chemical properties of the strains at the end of the fermentation

菌株残糖/(g·L-1)酒精度/%乙醇产率/(g·g-1)乙醇产率变化率/%甘油/(g·L-1)甘油产率/(mg·g-1)总酸/(g·L-1)总酸产率/(mg·g-1)挥发酸/(g·L-1)挥发酸产率/(mg·g-1)NX114242.81±0.28a10.41±0.08c0.417±0.030c05.30±0.00b26.88±0.04a7.13±0.09c36.15±0.41b0.57±0.02a2.89±0.13aHoA-1-340.63±0.35b6.41±0.44a0.317±0.023a23.874.30±0.07a26.67±0.50a6.50±0.18a40.76±1.23c0.66±0.05b4.14±0.33cHoC-4-21.40±0.11a8.47±0.06b0.336±0.002ab19.255.61±0.01c28.25±0.09c6.91±0.09bc34.78±0.48b0.72±0.00bc3.61±0.02bcHuB-2-21.06±0.17a9.38±0.87bc0.372±0.034bc10.745.42±0.02b27.22±0.08ab6.52±0.04a32.79±0.22a0.64±0.02ab3.23±0.09abHuC-3-22.29±0.26a8.48±0.38b0.339±0.012ab18.745.55±0.07c28.07±0.61bc6.67±0.19ab33.74±1.28a0.79±0.04c3.97±0.26c
注:同列不同字母表示处理间存在显著性差异(P<0.05)
H.opuntiae HoC-4-2、H.uvarum HuB-2-2和H.uvarum HuC-3-2的甘油产量均高于菌株S.cerevisiae NX11424,分别增加了2.3%、4.7%和5.9%。此外,4株有孢汉逊酵母的挥发酸均高于S.cerevisiae NX11424,挥发酸含量增加了12.3%~38.6%。甘油和挥发酸产量的增加,说明发酵底物碳源有更多的碳流向了甘油和乙酸的合成,这可能是4株有孢汉逊酵母乙醇产率降低的重要原因。
此外,模拟葡萄汁的总酸含量为9.0 g/L(以酒石酸计),发酵结束后,4株有孢汉逊酵母的降酸幅度(23.22%~27.78%)均高于S.cerevisiae NX11424(20.67%)。因此,本研究筛选的4株有孢汉逊酵母在葡萄酒降酸方面也具有一定的应用潜力。
2.3 四株有孢汉逊酵母菌株的酿造特性
2.3.1 糖耐受性
较高糖质量浓度的葡萄汁会抑制酵母菌的生长,从而延长发酵时间[20],而且高渗透压也会影响酒精发酵的代谢产物,如乙酸合成量的增加等[21]。H.opuntiae HoA-1-3、HoC-4-2和H.uvarum HuB-2-2、HuC-3-2均能够耐受400 g/L的初始葡萄糖质量浓度,但当初始糖质量浓度>300 g/L时,4株酵母的生长量呈现下降趋势(图3)。其中,H.opuntiae HoA-1-3和H.uvarum HuB-2-2在初始糖质量浓度为250 g/L时表现出生长抑制,H.uvarum HuC-3-2和H.opuntiae HoC-4-2分别在初始糖质量浓度为300和350 g/L时表现出生长抑制。综合看来,H.opuntiae HoA-1-3和HoC-4-2对高糖具有较好的耐受性,这对于高糖葡萄汁发酵的顺利进行具有重要意义。
2.3.2 酒精耐受性
酒精耐受性是酵母菌株重要的葡萄酒工艺学性状。H.opuntiae HoA-1-3、HoC-4-2和H.uvarum HuB-2-2、HuC-3-2的生长受到高酒精含量的显著抑制(图4)。H.opuntiae HoA-1-3和H.opuntiae HoC-4-2可以耐受6%(体积分数)的酒精度,而H.uvarum HuB-2-2和H.uvarum HuC-3-2仅能耐受4%的酒精度。当酒精度>6%时,4株有孢汉逊酵母尽管仍可以生长,但是生长趋势极其微弱。在这部分的试验中出现了一个有意思的现象,即4株有孢汉逊酵母在YEPD培养基中酒精耐受性较弱,但是在模拟葡萄汁中却能产生8%以上的酒精,这可能是由于4株有孢汉逊酵母在10余天的模拟葡萄汁发酵过程中经历了一个酒精度逐渐升高的适应性驯化,这也间接反应出这4株有孢汉逊酵母可能比较容易使用适应性驯化或者理化诱变等方法进行育种。
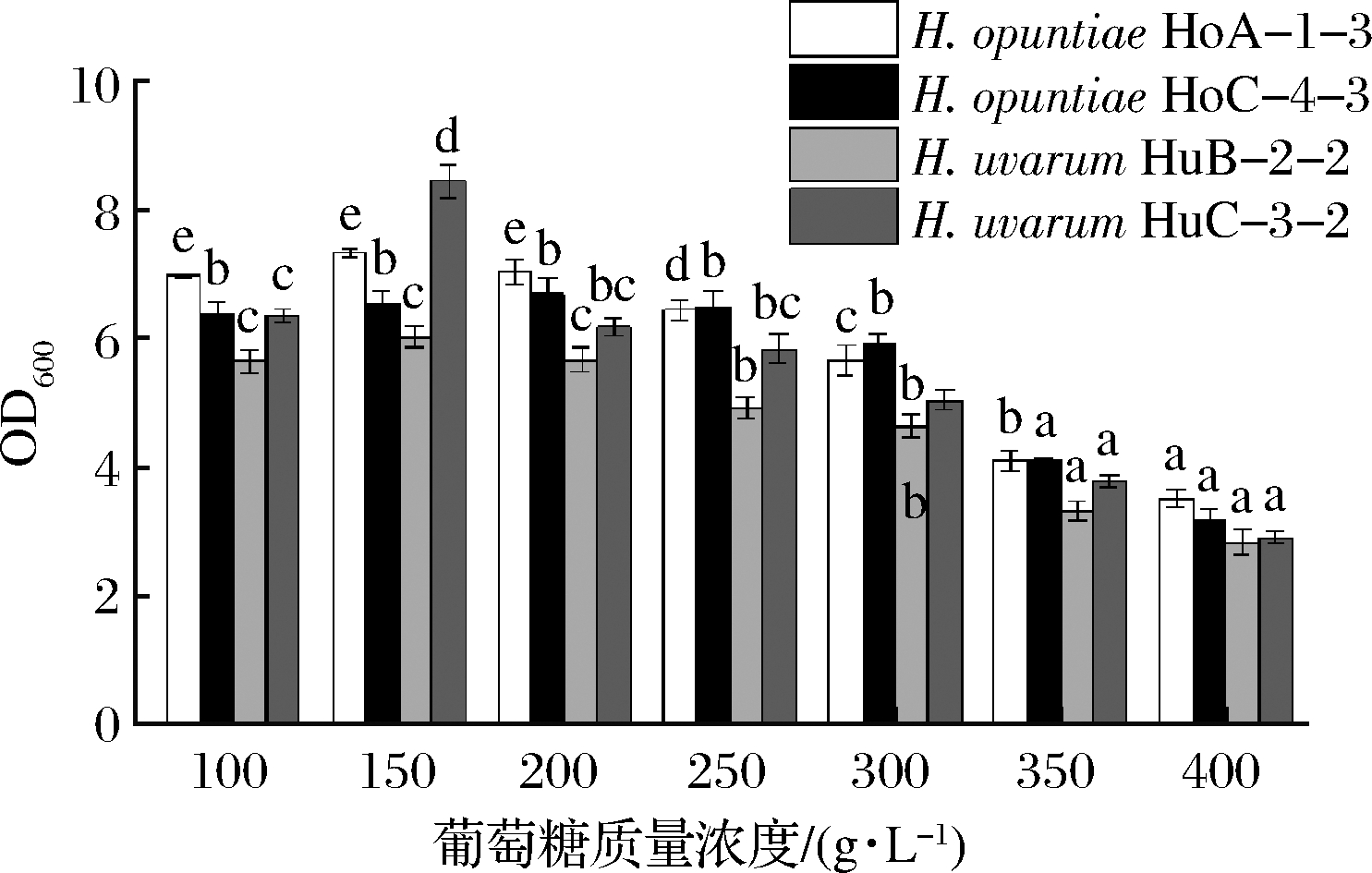
图3 有孢汉逊酵母菌株的葡萄糖耐受性
Fig.3 Glucose tolerance characteristics of the Hanseniaspora strains
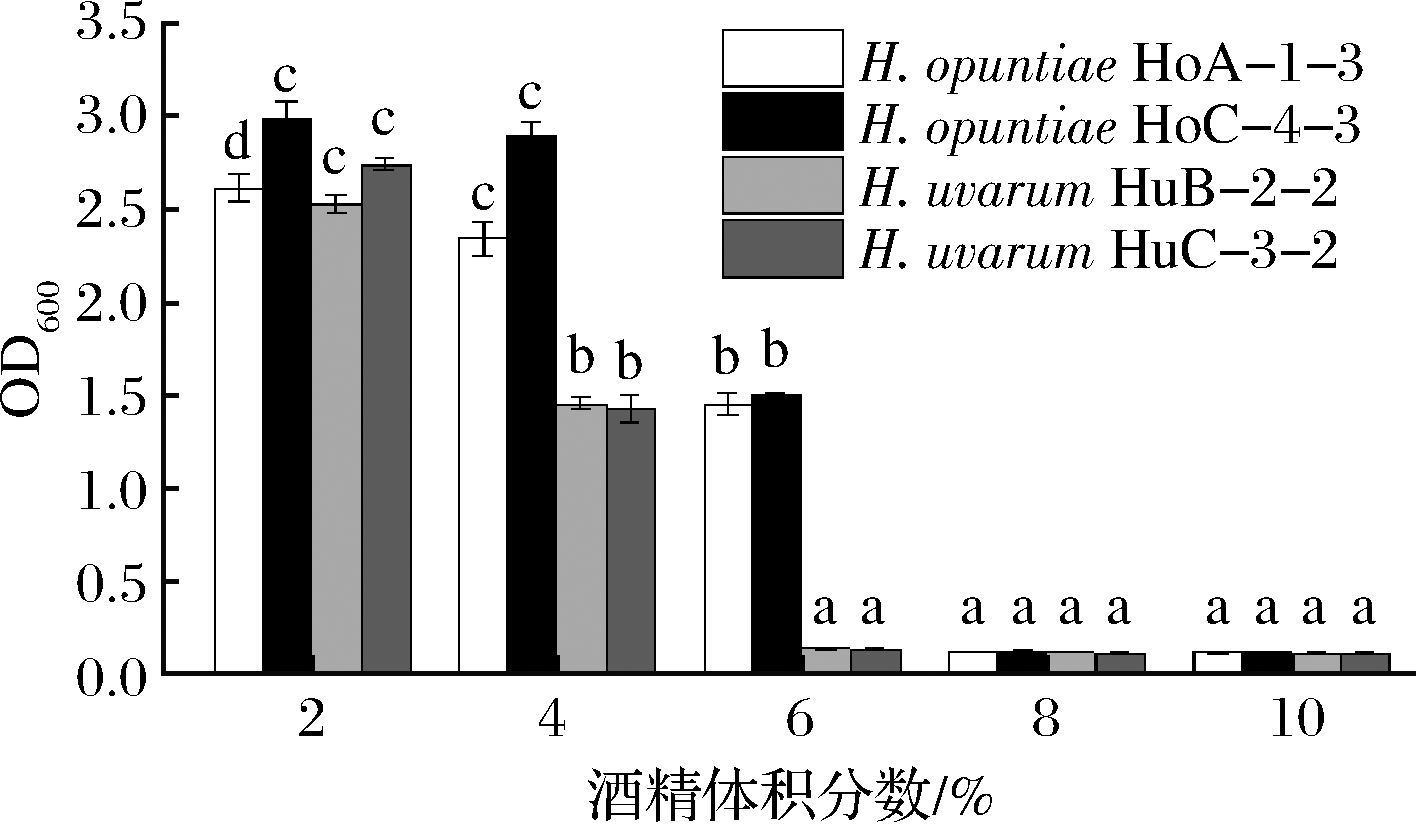
图4 有孢汉逊酵母菌株的酒精耐受性
Fig.4 Ethanol tolerance of the Hanseniaspora strains
对这4株有孢汉逊酵母开展以提高发酵速度为目标的常压室温等离子体诱变育种,初步证实了上述猜想,1次诱变即可获得大量的发酵速度加快的正向突变菌株。
2.3.3 SO2耐受性
如图5所示,4株有孢汉逊酵母菌株在SO2质量浓度<300 mg/L时均能很好地生长,且在不同质量浓度下的生长没有明显差异。当SO2质量浓度达到360 mg/L时,H.opuntiae HoA-1-3、H.opuntiae HoC-4-2和H.uvarum HuB-2-2的生长几乎被完全抑制,但H.uvarum HuC-3-2在SO2质量浓度达到420 mg/L时,生长才受到完全抑制。在葡萄原料卫生状况良好的情况下,酿造干型葡萄酒添加的SO2通常不超过60 mg/L。因此,从生产应用的角度来看,SO2不是限制这些菌株应用的因素。

图5 有孢汉逊酵母菌株的SO2耐受性
Fig.5 SO2 tolerance of the Hanseniaspora strains
2.3.4 温度耐受性
发酵温度是决定葡萄酒质量的重要因素,酵母生长的最适温度不同,低温和高温都会影响酵母菌的生长繁殖和发酵速率[22]。在葡萄酒酿造过程中,高温菌株将提高发酵临界温度,降低发酵停滞的风险,而汉逊酵母属是耐高温酵母属之一[23]。由图6可知,H.opuntiae HoA-1-3、H.opuntiae HoC-4-2和H.uvarum HuB-2-2都能在40 ℃高温条件下正常生长,H.uvarum HuC-3-2的生长较弱。有研究表明部分非酿酒酵母比酿酒酵母能更好地在10~15 ℃的低温条件下发酵,发酵前的冷浸渍也有利于有孢汉逊酵母的生长[24-25],而本研究的4株有孢汉逊酵母菌株均能在10 ℃的低温下生长,且当培养温度为20 ℃时,菌株的生长量均达到最大值。
2.3.5 低pH耐受性
葡萄汁的pH值通常在3.0~4.0[20],因此葡萄酒酿造用酵母菌需要具有较强的耐酸性能。H.opuntiae HoA-1-3、HoC-4-2和H.uvarum HuB-2-2、HuC-3-2在pH 2.8~4.0均能很好的生长,尤其是H.uvarum HuC-3-2在不同pH值条件下的生长量均高于其他菌株(图7),因此,从pH值耐受性角度看,本研究的4株有孢汉逊酵母菌均可满足葡萄酒生产要求。
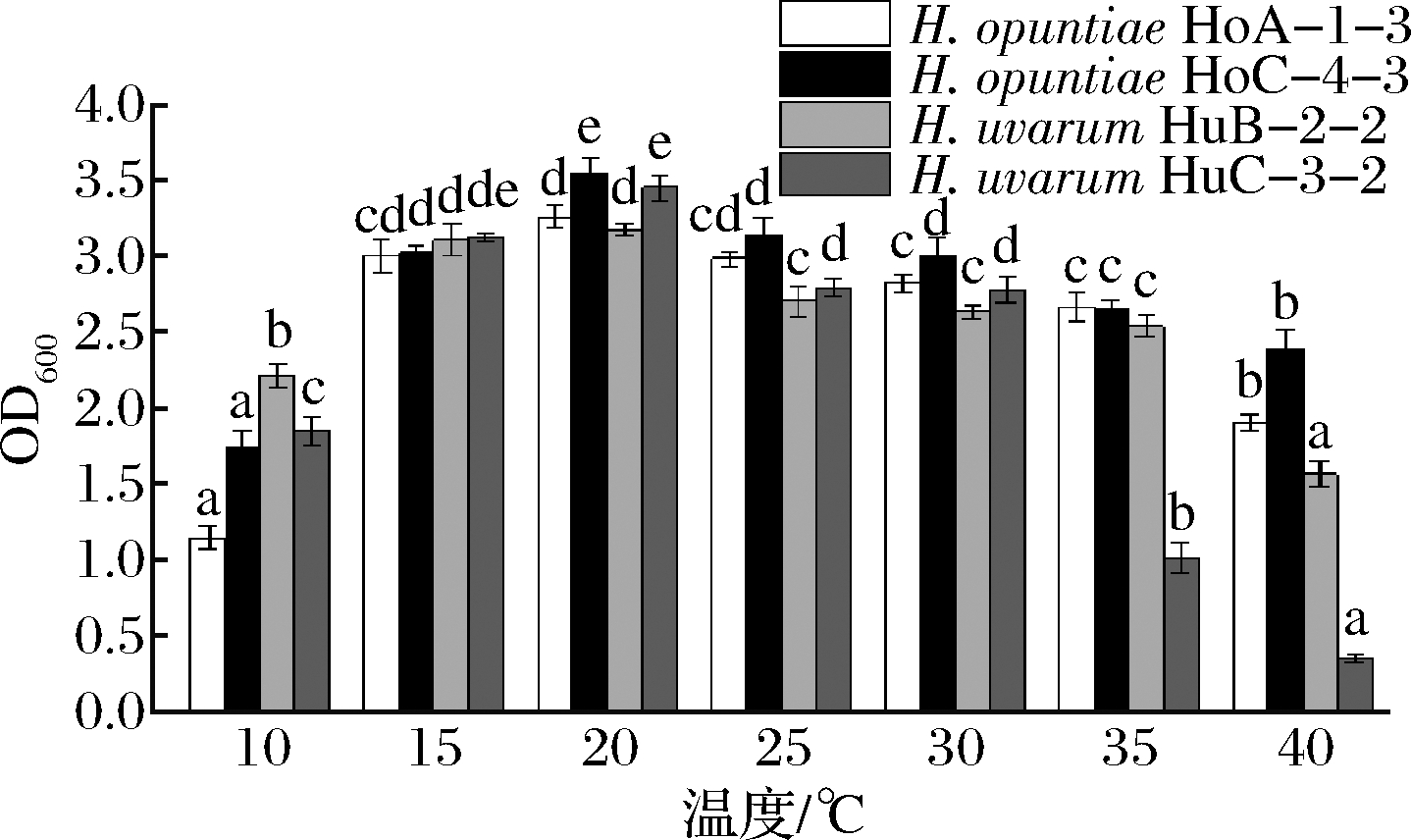
图6 有孢汉逊酵母菌株的温度耐受性
Fig.6 Temperature tolerance of the Hanseniaspora strains
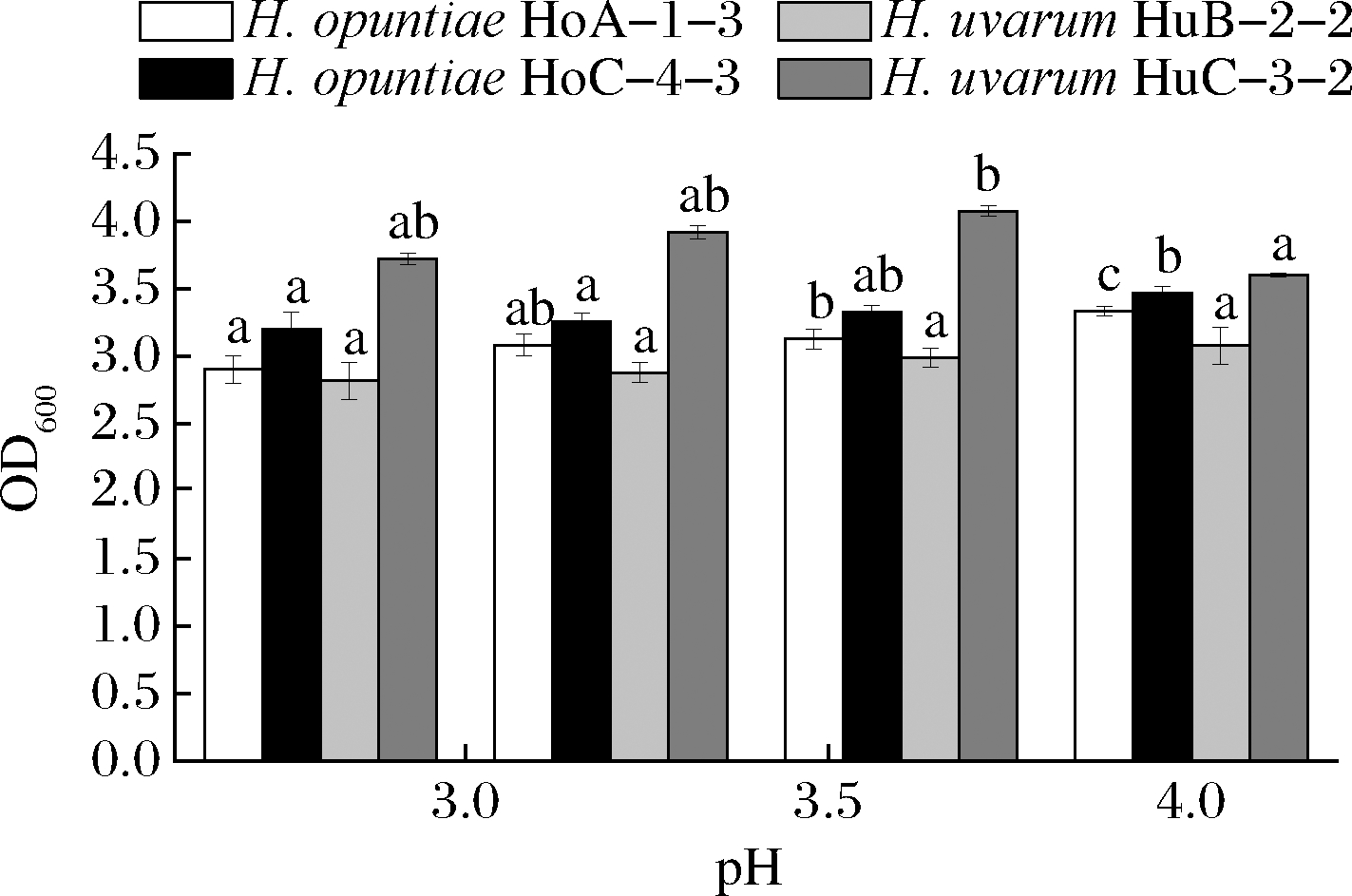
图7 有孢汉逊酵母菌株的pH耐受性
Fig.7 pH tolerance of the Hanseniaspora strains
2.3.6 嗜杀特性
嗜杀酵母在其生长繁殖过程中会分泌嗜杀毒素,但对自身产生的毒素具有免疫功能[26]。4株有孢汉逊酵母周围均未出现蓝色抑菌圈,说明这4株有孢汉逊酵母对S.cerevisiae NX11424均无嗜杀作用(图8)。对S.cerevisiae没有嗜杀活性,将有利于这4株有孢汉逊酵母和S.cerevisiae进行混合发酵。

图8 有孢汉逊酵母菌株的嗜杀性
Fig.8 Killing activity of the Hanseniaspora strains
2.3.7 产H2S特性
H2S具有较强的挥发性,较低的嗅觉阈值(50~80 μg/L),过高会使葡萄酒具有臭鸡蛋气味,影响葡萄酒的香气质量,破坏葡萄酒的风味[18]。5株酵母菌株在BIGGY培养基上的显色如图9所示,S.cerevisiae NX11424和H.uvarum HuB-2-2属于中产H2S菌株,H.opuntiae HoA-1-3、H.opuntiae HoC-4-2和H.uvarum HuC-3-2均为不产H2S菌株。

图9 酵母菌株的产H2S特性
Fig.9 H2S production capacity of the yeast strains
3 结论
本研究以宁夏、甘肃、陕西和新疆葡萄酒产区分离的53株有孢汉逊酵母为研究对象,利用模拟葡萄汁发酵筛选获得H.opuntiae HoA-1-3、H.opuntiae HoC-4-2、H.uvarum HuB-2-2和H.uvarum HuC-3-2等4株具有低产乙醇性状的有孢汉逊酵母属酵母,其乙醇产率分别降低23.87%、19.25%、10.74%和18.74%。4株有孢汉逊酵母均能耐受400 g/L的糖、300 mg/L的SO2、pH 2.8、10 ℃低温和40 ℃高温,均无嗜杀活性;除H.uvarum HuB-2-2外,其他3株有孢汉逊酵母均不产H2S。整体而言,本研究筛选获得的H.opuntiae HoC-4-2和H.uvarum HuC-3-2在低产乙醇的同时,还具有较好的生长特性、耐受能力、发酵性能等酿造学特性,具有一定的应用价值。
为了将其应用于真实的葡萄酒酿造,在后续的研究工作中,一方面需要进一步研究4株有孢汉逊酵母与酿酒酵母的混合发酵技术,以及其对葡萄酒感官质量的影响;另外,可以这4株有孢汉逊酵母为出发菌株,通过物理化学诱变或者适应性进化等育种手段,选育具有更优秀酿造学特征的低产乙醇酵母菌株,从而实现在生产中的推广应用。
[1] MESTRE FURLANI M V M,MATURANO Y P,COMBINA M,et al.Selection of non-Saccharomyces yeasts to be used in grape musts with high alcoholic potential:A strategy to obtain wines with reduced ethanol content[J].FEMS Yeast Research,2017,17(2).DOI:10.1093/femsyr/fox010.
[2] GOOLD H D,KROUKAMP H,WILLIAMS T C,et al.Yeast’s balancing act between ethanol and glycerol production in low-alcohol wines[J].Microbial Biotechnology,2017,10(2):264-278.
[3] CANONICO L,SOLOMON M,COMITINI F,et al.Volatile profile of reduced alcohol wines fermented with selected non-Saccharomyces yeasts under different aeration conditions[J].Food Microbiology,2019,84:103 247.
[4] ENGLEZOS V,CRAVERO F,TORCHIO F,et al.Oxygen availability and strain combination modulate yeast growth dynamics in mixed culture fermentations of grape must with Starmerella bacillaris and Saccharomyces cerevisiae[J].Food Microbiology,2018,69:179-188.
[5] MATURANO Y P,MESTRE M V,KUCHEN B,et al.Optimization of fermentation-relevant factors:A strategy to reduce ethanol in red wine by sequential culture of native yeasts[J].International Journal of Food Microbiology,2019,289:40-48.
[6] VARELA J,VARELA C.Microbiological strategies to produce beer and wine with reduced ethanol concentration[J].Current Opinion in Biotechnology,2019,56:88-96.
[7] FRESNO J M,MORATA A,LOIRA I,et al.Use of non-Saccharomyces in single-culture,mixed and sequential fermentation to improve red wine quality[J].European Food Research and Technology,2017,243(12):2 175-2 185.
[8] RÖCKER J,STRUB S,EBERT K,et al.Usage of different aerobic non-Saccharomyces yeasts and experimental conditions as a tool for reducing the potential ethanol content in wines[J].European Food Research and Technology,2016,242(12):2 051-2 070.
[9] TRONCHONI J,CURIEL J A,SAENZ-NAVAJAS M P,et al.Aroma profiling of an aerated fermentation of natural grape must with selected yeast strains at pilot scale[J].Food Microbiology,2018,70:214-223.
[10] ROSSOUW D,BAUER F F.Exploring the phenotypic space of non-Saccharomyces wine yeast biodiversity[J].Food Microbiology,2016,55:32-46.
[11] ROLLE L,ENGLEZOS V,TORCHIO F,et al.Alcohol reduction in red wines by technological and microbiological approaches:A comparative study[J].Australian Journal of Grape and Wine Research,2018,24(1):62-74.
[12] HONG Y A,PARK H D.Role of non-Saccharomyces yeasts in Korean wines produced from Campbell early grapes:Potential use of Hanseniaspora uvarum as a starter culture[J].Food Microbiology,2013,34(1):207-214.
[13] GOBBI M,VERO L,SOLIERI L,et al.Fermentative aptitude of non-Saccharomyces wine yeast for reduction in the ethanol content in wine[J].European Food Research and Technology,2014,239(1):41-48.
[14] ZHU X L,NAVARRO Y,MAS A,et al.A rapid method for selecting non-Saccharomyces strains with a low ethanol yield[J].Microorganisms,2020,8(5):658.
[15] SPIROPOULOS A,BISSON L F.MET17 and hydrogen sulfide formation in Saccharomyces cerevisiae[J].Applied and Environmental Microbiology,2000,66(10):4 421-4 426.
[16] 杨诗妮, 叶冬青,贾红帅,等.本土戴尔有孢圆酵母在葡萄酒酿造中的应用潜力[J].食品科学,2019,40(18):108-115.
YANG S N,YE D Q,JIA H S,et al.Oenological potential of indigenous Torulaspora delbrueckii for winemaking[J].Food Science,2019,40(18):108-115.
[17] LI Y,ZHANG Y J,LIU M L,et al.Saccharomyces cerevisiae isolates with extreme hydrogen sulfide production showed different oxidative stress resistances responses during wine fermentation by RNA sequencing analysis[J].Food Microbiology,2019,79:147-155.
[18] WANG C X,LIU M L,LI Y,et al.Hydrogen sulfide synthesis in native Saccharomyces cerevisiae strains during alcoholic fermentations[J].Food Microbiology,2018,70:206-213.
[19] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2008.
General Administration of Quality Supervision,Inspection and Quarantine of the People's Republic of China,Standardization Administration of China.GB/T 15038—2006 Analytical methods of wine and fruit wine[S].Beijing:Standards Press of China,2008.
[20] 冯莉, 陈雪,李丽,等.5株克鲁维毕赤酵母的酿造学特性[J].中国食品学报,2018,18(12):66-73.
FENG L,CHEN X,LI L,et al.The enology characteristics of five strains of Pichia kluyveri[J].Journal of Chinese Institute of Food Science and Technology,2018,18(12):66-73.
[21] HEIT C,MARTIN S J,YANG F,et al.Osmoadaptation of wine yeast (Saccharomyces cerevisiae) during Icewine fermentation leads to high levels of acetic acid[J].Journal of Applied Microbiology,2018,124(6):1 506-1 520.
[22] 李华, 王华,袁春龙.葡萄酒工艺学[M].北京:科学出版社,2007.
LI H,WANG H,YUAN C L.Wine Technology[M].Beijing:Science Press,2007.
[23] 刘超帝, 缪礼鸿,陈瑾,等.耐高温酵母菌的筛选及其乙醇发酵特性[J].食品科学,2016,37(19):128-134.
LIU C D,MIAO L H,CHEN J,et al.Isolation and alcohol fermentation characteristics of thermotolerant yeasts[J].Food Science,2016,37(19):128-134.
[24] 原苗苗. 非酿酒酵母及其发酵温度对葡萄酒香气的影响[D].济南:齐鲁工业大学,2018.
YUAN M M.Effects of non-Saccharomyces and fermentation temperature on wine aroma[D].Jinan:Qilu University of Technology,2018.
[25] ALBERTIN W,MIOT-SERTIER C,BELY M,et al.Oenological prefermentation practices strongly impact yeast population dynamics and alcoholic fermentation kinetics in Chardonnay grape must[J].International Journal of Food Microbiology,2014,178:87-97.
[26] 李丽, 冯莉,秦义,等.野生嗜杀白假丝酵母LFA418的产毒条件优化及其毒素粗提物特性[J].食品科学,2017,38(12):50-56.
LI L,FENG L,QIN Y,et al.Optimization of culture conditions for toxin production by wild killer yeast Candida albicans LFA418[J].Food Science,2017,38(12):50-56.