近年来,随着人们生活水平的提高及膳食习惯的变化,高脂饮食逐渐增加,其过量摄入会导致脂肪蓄积从而形成肥胖[1]。脂肪过多不仅影响行动,还会增加慢性疾病的患病率和死亡率[2]。研究表明,高脂饮食可以诱导结肠癌[3]、非酒精性脂肪肝[4]、认知障碍[5]等。因此,形成良好的饮食习惯、利用食物来源的功能成分预防肥胖及其相关疾病具有十分重要的意义。
肠道微生物可以产生短链脂肪酸、胆汁酸和色氨酸等代谢产物,从而参与宿主免疫代谢过程[6]。短链脂肪酸可以调节固有免疫细胞参与炎症性肠病的发生与发展[7];胆汁酸可以乳化脂肪,促进脂溶性食物的消化吸收;色氨酸通过调节芳香烃受体的活性来调节宿主对急性肝功能衰竭的敏感性[6]。因此,通过对肠道菌群的研究可以进一步明确肠道微生物与机体代谢之间的关系。
黑木耳(Auricularia auricula)又称木耳、云耳、木菌等,木耳子实体中含有多种活性物质,是一种营养丰富的药食同源食用菌,具有较高的营养价值及医用价值。目前,关于木耳活性物质的研究主要集中在黑木耳多糖、黑色素、胶原蛋白、多酚和黄酮类化合物以及钙、铁、锌、锰等微量元素[8]。黑木耳活性物质具有抗氧化、降血脂、降血糖、抑菌、抗凝血、抗肿瘤、抗辐射等功效[9]。本文采用柞水黑木耳为原料,进一步建立Balb/C小鼠高脂肥胖模型,探讨膳食补充黑木耳对小鼠肥胖、肝脏脂肪堆积的改善作用以及对肠道菌群的影响。
1 材料与方法
1.1 材料与试剂
材料:柞水黑木耳,柞水当地经销商;普通饲料(control diets,CD)参照Research Diets D12450B、高脂饲料(high fat diets,HFD)参照Research Diets D12451,北京维通利华实验动物技术有限公司。
试剂:4%多聚甲醛溶液,武汉塞维尔生物科技有限公司;无水乙醇(分析纯),天津市天力化学试剂有限公司;异氟烷,深圳瑞沃德生命科技有限公司;生化试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
ULTS1368超低温冰箱,西门子股份公司;BSA2235电子天平,赛多利斯科学仪器有限公司;BJ-150粉碎机,德清拜杰电器有限公司;FD5-3T真空冷冻干燥机,西盟国际公司;Z326K冷冻离心机,贺默仪器科技有限公司;M200 PRO酶标仪,帝肯贸易有限公司。
1.3 肥胖模型小鼠建立与实验分组
雄性Balb/C小鼠60只(北京维通利华实验动物技术有限公司),饲养于西安交通大学医学院动物实验中心,环境温度(25±2)℃,相对湿度(55±5)%,12 h光暗交替循环条件下自由摄食、饮水。小鼠适应性喂养1周后随机分为正常组和模型组,其中12只喂食普通饲料作正常组,48只喂食高脂饲料作模型组。共15周,每周固定时间称重。
依据记录的体重数据,从高脂膳食组选出体重高于普通饲料组20%的小鼠,即为建模成功的小鼠。然后,根据体重均匀原则,将小鼠分为3组(n=10只/组),其中CD组喂食普通饲料,HFD组喂食高脂饲料,黑木耳组(Auricularia auricula,AA组)喂食添加了木耳粉的高脂饲料。实验进行4周,每2 d称重1次。本动物研究及操作经过西北大学实验动物管理及伦理委员会批准(NWU-AWC-20210315M)。实验设计如图1所示。
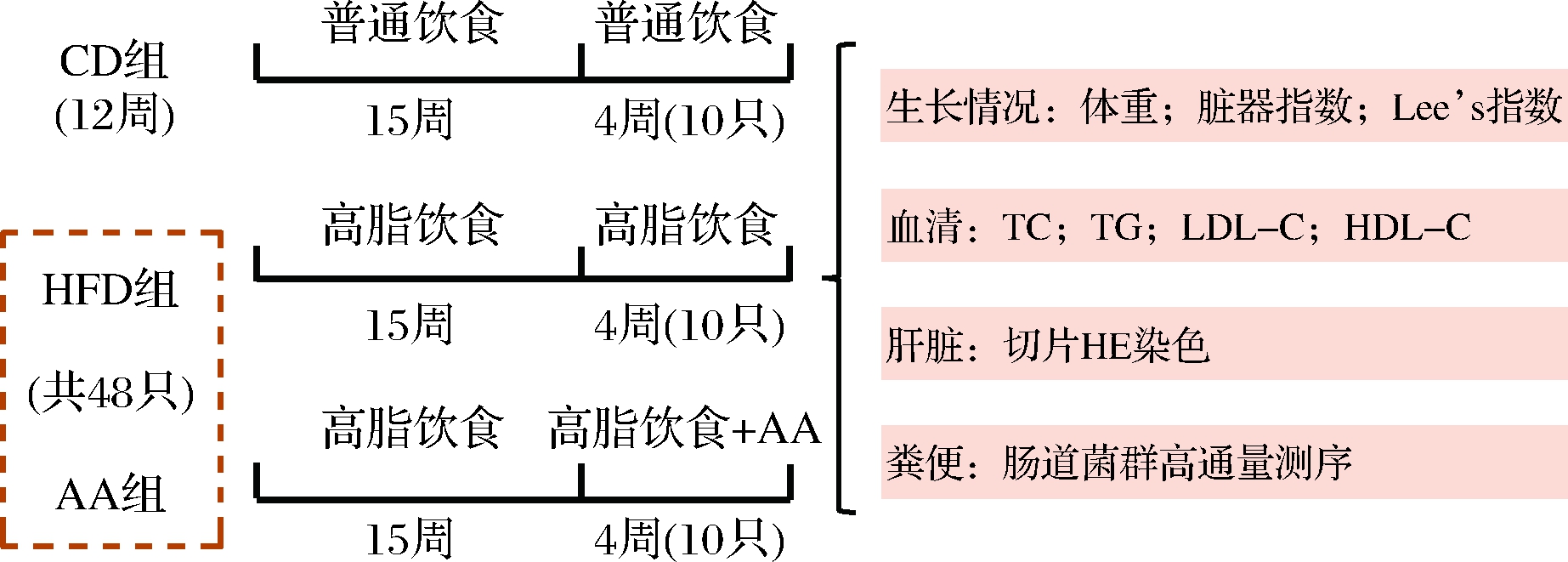
图1 实验设计及测定指标
Fig.1 Experimental design and tested indexes
1.4 木耳粉的添加方式及添加量的确定
清洗干净的黑木耳预冻后用真空冷冻干燥机冷冻干燥48 h,将冻干的黑木耳经粉碎后过80目筛。得到的黑木耳粉末加入高脂饲料中混匀,制成条状后再次冻干,即得含有黑木耳粉的高脂饲料。
傅思瑞等[10]的研究中,黑木耳粉的灌胃剂量为120 mg/mL;李强等[11]在黑木耳粉抗氧化水平的研究中采用了3种添加剂量,其中高剂量组为8.4 g/(kg·d),显著提高了机体抗氧化水平。根据参考文献中的添加量最后确定本研究饲料中的添加量约为130 g/(kg·d)。
1.5 动物组织样本采集
小鼠处死后,收集血清,摘取肝脏、脾脏组织称重,然后用锡纸包裹经液氮速冻后储存于-80 ℃低温冰箱中或将需要固定的组织迅速放于固定液中(4%多聚甲醛溶液)固定。脏器指数计算如公式(1)所示:
脏器指数![]()
(1)
1.6 血清生化指标的测定
小鼠禁食不禁水,异氟烷吸入麻醉后,脱颈处死。眼球采血,得到的血样在4 ℃、3 500 r/min下离心2次,每次10 min,得上清液即为小鼠血清,保存于-80 ℃冰箱,待用。
小鼠血清中总胆固醇(total cholesterol,T-CHO)、总甘油三酯(total triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)含量测定方法按照相应试剂盒的说明书进行操作。
1.7 肝脏组织病理学观察
取多聚甲醛固定的小鼠肝脏组织,经脱水、包埋、切片、苏木-伊红(hematoxylin eosin,HE)染色后,光学显微镜下观察其组织形态及病理变化。
1.8 小鼠肠道菌群高通量测序
收集4周末的小鼠粪便,用无菌离心管收集并标记,放入液氮,30 min后放-80 ℃冰箱保存待测。PCR扩增及高通量测序技术委托杭州联川生物技术股份有限公司检测。
1.9 统计方法
实验数据均以平均值±标准差表示。采用SPSS 22.0软件进行统计学分析,采用ANOVA及Duncan’ test分析各组间显著性差异(P<0.05)。
2 结果与分析
2.1 木耳对小鼠体重及脏器的影响
体重是判断个体肥胖的直观指标。如图2-a所示,CD组小鼠的体重在实验过程中明显低于HFD组;HFD组小鼠体重相对稳定且保持组间最高;而AA组小鼠的体重整体低于HFD组。实验开始小鼠对添加了木耳的饲料需要适应,因此小鼠体重轻微下降;但从第2周开始小鼠的体重回升;第3周后小鼠的体重开始下降,说明木耳此时开始发挥体重调节的作用。实验进行至4周末,AA组小鼠体重显著低于HFD组。另外,图2-b结果也显示,HFD组小鼠的平均体重大于CD组,二者之间存在显著差异。AA组有所下降,且显著低于HFD组小鼠的平均体重。综上表明,膳食补充木耳可以显著降低小鼠体重。
Lee’s指数是评价肥胖程度的有效指数,数值越大,表明动物肥胖程度越严重。图2-c表明HFD组小鼠的Lee’s指数最大,且显著高于CD组;AA组Lee’s指数相比HFD组显著降低,和CD组相近。与上述小鼠体重结果一致,说明膳食补充黑木耳能够显著降低肥胖小鼠Lee’s指数,减轻小鼠的肥胖程度。
动物脏器的重量与其体重的比值为脏器指数,如表1所示,其可以反应动物的生理状态。肥胖可引起肝脏肿大,体现在肝脏指数增加、肝脂肪增多[12],木耳能够显著降低肝脏指数,减轻肝脏内脂质沉积,改善肝脂肪变性程度,保护肝脏。脾脏是机体最大的免疫器官,是机体细胞免疫和体液免疫的中心。长期高脂饮食容易导致机体产生炎症,降低免疫能力。实验结果表明,木耳显著降低了脾脏指数,有效改善高脂饮食对脾脏造成的影响。

a-小鼠体重变化;b-小鼠平均体重;c-Lee’s指数
图2 木耳对小鼠体重的影响(n=6)
Fig.2 Effect of Auricularia auricula on body weight of mice (n=6)
注:字母不同表示组间存在显著差异,P<0.05(下同)
表1 各组小鼠脏器指数 单位:%
Table 1 The organ index of mice in each group

指数CDHFDAA肝脏指数3.74±0.32c4.71±0.18a4.19±0.30b脾脏指数0.27±0.05b0.56±0.12a0.34±0.02b
2.2 血清脂质水平
血清中胆固醇含量主要受到饮食习惯的影响。机体长期摄入高热量的食物会导致血清中T-CHO含量增加,从而引发其他相关的慢性疾病,例如动脉粥样硬化、高血脂症、糖尿病等[13]。而高脂食物中的甘油三酯水解成小分子物质后被肠黏膜吸收,在肠黏膜上又再次合成甘油三酯进入血液循环,从而增加血清中TG的含量。另外,LDL-C被认为是“坏的胆固醇”,由LDL运载而进入外周组织。当LDL过量时,所携带的胆固醇就存积在动脉壁上引起动脉硬化。高浓度LDL-C是造成动脉粥样硬化的危险因素。与之相反的是,HDL-C是“好的胆固醇”,是逆向转运的内源性胆固醇酯,可以运入肝脏后再清除出血液,因此可以抗动脉粥样硬化,减少患冠状动脉性心脏病的危险[14]。
图3-a~图3-c表明,HFD组小鼠血清中T-CHO、TG以及LDL-C的含量显著高于CD组,AA组显著降低,且与普通组无显著差异。说明日常饮食中补充黑木耳有利于降低血液中胆固醇、甘油三酯和LDL-C的含量,降脂效果良好。相反,图3-d中HFD组小鼠血清中HDL-C含量显著低于CD组,AA组显著增加。由此看来,木耳有助于机体HDL-C含量增加,加强抗动脉粥样硬化的能力,减少患病机率。
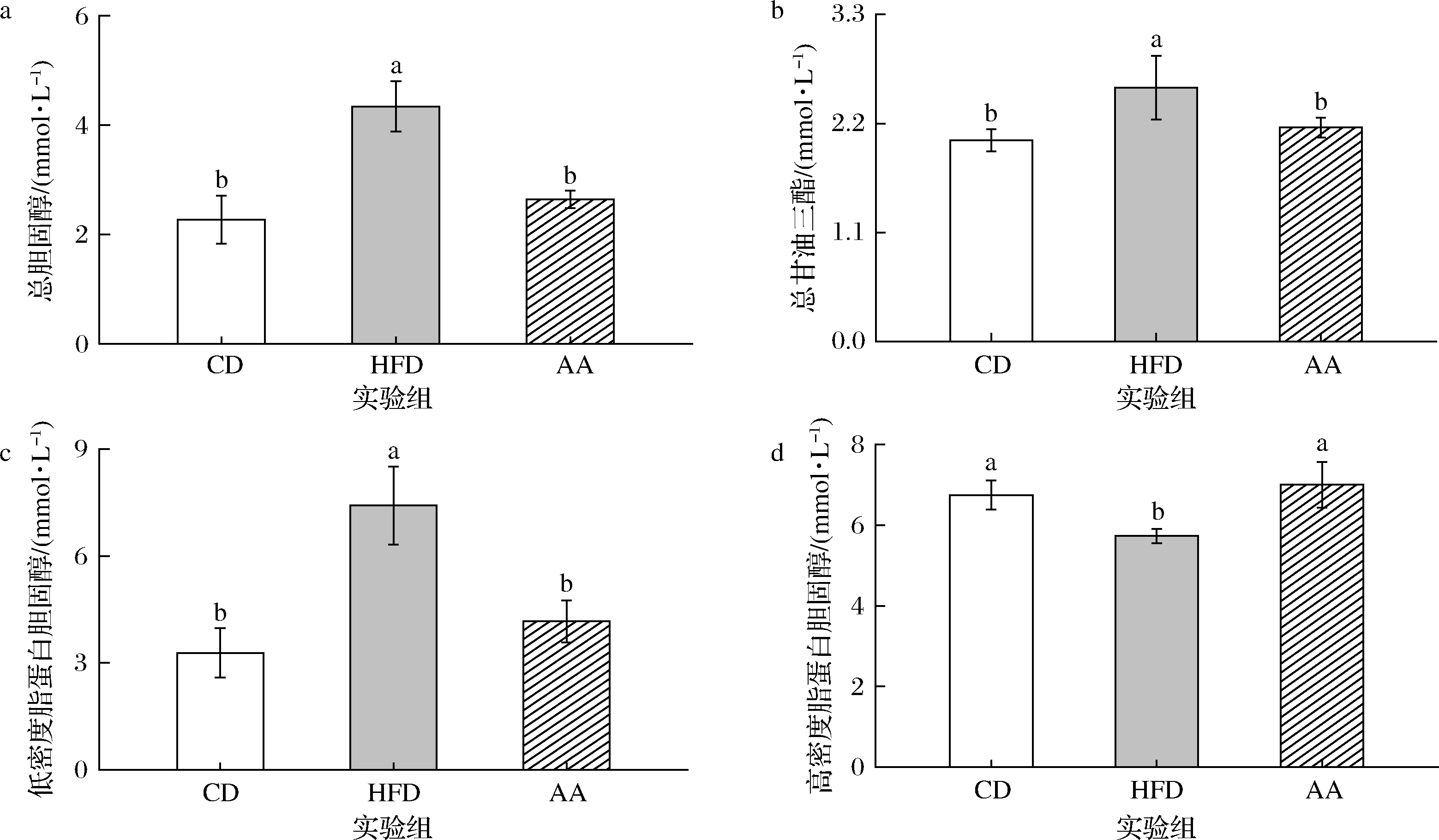
a-T-CHO;b-TG;c-LDL-C;d-HDL-C
图3 小鼠血清脂质含量(n=5)
Fig.3 Serum lipid levels of mice (n=5)
2.3 木耳对小鼠肝脏的影响
肝脏是脂质代谢的重要场所,一旦脂质代谢紊乱就会导致脂肪肝、高血脂症和动脉粥样硬化等慢性疾病。正常的肝组织,由于肝细胞脂质的合成和排泄维持动态平衡,一般并无脂质堆积。当大量脂质在胞浆内,就会形成大小不等的脂滴,破坏肝脏正常结构,影响肝脏功能。
图4为各组小鼠肝脏切片的HE染色图,CD组小鼠的肝脏切片中基本没有观察到脂滴的存在;HFD组小鼠的肝脏组织中,脂滴数量多且体积大;而AA组脂滴数量减少且体积缩小。结果表明黑木耳能有效改善小鼠肝脏中的脂质代谢紊乱,减少肝脏中的脂滴,抑制肝脏中脂肪堆积。这可能是因为黑木耳中多糖含量高,且何嘉烽[15]的研究发现黑木耳多糖可以降低血脂,预防高脂血症。

a-CD组;b-HFD组;c-AA组
图4 各组小鼠肝脏病理切片
Fig.4 Liver pathology of mice in each group
2.4 木耳对小鼠肠道菌群结构的影响
饮食习惯会引起肠道菌群改变。周青青等[16]的研究表明,高脂高胆固醇饮食使小鼠肠道菌群α多样性降低,厚壁菌门和拟杆菌门的比例显著增高。王家妮等[17]也通过探究高脂饲料对肠道的影响,发现高脂饲料对肠道发育及肠道菌群都有不同程度的影响。
α多样性是指1个特定区域生态系统内的多样性,是反映丰富度和均匀度的总和指标。表2展示了各组小鼠α多样性的指数,其中HFD组小鼠Shannon指数显著低于CD组,而AA组显著上调,但与CD组仍存在明显差异;CD组Simpson指数和Chao1指数都显著高于HFD组,但是AA组Simpson指数显著增加,与CD组无差异,而AA组Chao1指数虽增加,但与HFD组没有显著差异。由此看出,高脂膳食使得肠道菌群多样性降低,而日常补充木耳则丰富了肠道内微生物的种类,使肠道菌群多样性增加,改善高脂饮食引起的肠道菌群变化,从而可以减轻高脂饮食对肠道的损伤。
表2 肠道菌群α多样性统计表(n=4)
Table 2 Statistic of gut microbiota α-diversity (n=4)

实验组ShannonSimpsonChao1CD7.92±0.18a0.97±0.04a939.78±78.50aHFD5.39±0.54c0.96±0.01a394.16±59.55bAA6.18±0.07b0.96±0.01a449.01±43.75b
β多样性通过微生物群落结构来度量不同样本间菌群组成的相似度。如图5所示,横坐标主成分1方向贡献了8.59%的差异度,纵坐标主成分2贡献了7.24%的差异度。在主成分1水平上,AA组更接近于HFD组;从主成分2维度来看,AA组与CD组的差异比HFD组更小,说明CD组和AA组物种组成更为接近,而这两者与HFD组存在明显差异。

图5 β多样性分析:主成分分析(n=6)
Fig.5 β-diversity index:PCA (n=6)
2.5 木耳对小鼠肠道菌群门水平的影响
研究表明肠道菌群中厚壁菌门、拟杆菌门及二者的比例与肥胖密切相关[18]。如图6-a所示,小鼠肠道菌群中厚壁菌门和拟杆菌门占菌群的绝大部分。且结合图6-b来看,HFD组小鼠拟杆菌门显著高于CD组,而AA组又显著高于HFD组,与CD组没有明显差异;图6-c中,HFD组厚壁菌门显著高于CD组和AA组;图6-d显示,HFD组厚壁菌门与拟杆菌门的比例显著低于CD组,AA组二者的比例又显著增加,与CD组没有差异。与现有研究结果一致,肠道菌群与肥胖密切相关,厚壁菌门降低、拟杆菌门增加或者是二者的比例降低都有助于促进肥胖[18]。总体看来,日常补充黑木耳能够减轻高脂饮食引起的肠道菌群门水平紊乱,抑制肥胖对机体带来的危害。

a-门水平的相对丰度;b-拟杆菌门的相对丰度;c-厚壁菌门的相对丰度;d-厚壁菌门与拟杆菌门的比例
图6 木耳对小鼠肠道菌群门水平的影响(n=4)
Fig.6 Effects of A.auricula on intestinal flora in mice at phylum level (n=4)
2.6 木耳对小鼠肠道菌群属水平的影响
饮食习惯对肠道内微生物产生影响,从而引起机体的生理变化。研究发现,嗜胆菌属(Bilophila)在胆汁酸含量丰富的肠道中大量繁殖,高脂饮食能使其在肠道菌群中所占比例激增,增加炎性肠病和肝胆疾病的风险[19];瘤胃梭菌属(Ruminiclostridium_9)丰度与肥胖指标呈正相关[20];别样杆菌属(Alistipes)代谢产生了丁酸、乙酸和丙酸,在抗炎作用中起重要作用[21]。高通量测序结果表明,不同饮食导致各组小鼠的菌属相对丰度不同(图7-a)。如图7-b~图7-d所示,HFD组小鼠嗜胆菌属和瘤胃梭菌属含量显著高于CD组,而AA组含量显著低于HFD组;相反的是,别样杆菌属在HFD组中,相对丰度显著低于CD组和AA组。表明高脂饮食会增加与肥胖相关的肠道微生物丰度、降低有益菌的相对丰度,而膳食补充黑木耳则可以改善高脂饮食引起的肠道菌群紊乱,减轻对机体的损害。

a-属水平相对丰度;b-Bilophila相对丰度;c-Ruminiclostridium_9相对丰度;d-Alistipes相对丰度
图7 木耳对小鼠肠道菌群属水平的影响(n=3)
Fig.7 Effects of A. auricula on intestinal flora in mice at genus leve (n=3)
2.7 肠道菌群功能预测的差异分析
为了进一步探讨黑木耳对肠道菌群代谢的影响,对各组样品进行功能预测分析。如图8所示,HFD组小鼠的D-葡萄糖醛酸的降解、D-半乳糖醛酸酯的降解、L-精氨酸的合成等途径均显著低于CD组;AA组中这3种物质的代谢均显著上调。由此可知,高脂饮食会使得机体糖代谢紊乱,从而破坏其参与的循环。研究发现,日常补充L-精氨酸改变了肠道微生物,促进了分泌型免疫球蛋白(SIgA)的分泌、激活了肠道免疫,从而增进肠道健康[22]。由此可得,本研究中膳食补充黑木耳显著提高了小鼠机体的精氨酸合成,但能否有效改善小鼠机体的抗氧化能力和免疫功能还需要进一步实验验证。

a-CD与HFD差异代谢途径;b-HFD与AA差异代谢途径
图8 肠道菌群功能预测
Fig.8 Differential analysis of intestinal flora function prediction
3 结论
本研究通过膳食添加黑木耳粉改善了高脂饮食引起的小鼠体重的增加及血清甘油三酯、胆固醇的积累,同时减少了肝组织脂肪含量。说明黑木耳能有效降低高脂膳食给机体带来的危害,改善机体组织、器官因肥胖引起的损伤。
高脂饮食导致肠道厚壁菌门、嗜胆菌属、瘤胃梭菌属丰度增加,拟杆菌门、别样杆菌属丰度降低,而膳食补充黑木耳后肠道菌群丰度有所改善。说明日常饮食中添加黑木耳能有效调节高脂饮食引起的肠道菌群紊乱,减轻其带来的危害。黑木耳含有丰富的木耳多糖、黑色素、蛋白质及微量元素等,具有抗肿瘤、降血脂、降血糖以及抗动脉粥样硬化等功效。有研究表明,黑木耳胞外多糖具有促进肠道内有益菌群增殖,增加短链脂肪酸含量及上调血清抗炎因子水平的作用[23];黑木耳中的多糖、黄酮复配物对肠道菌群具有正向调节作用[24];黑木耳多糖可能通过调控肠道菌群改善高脂血症[25]。这些研究说明黑木耳中的多糖可以调控肠道中的微生物从而改善机体代谢。但本实验中改善肝脏脂质代谢并调节肠道菌群的活性成分是否为黑木耳多糖还需要进一步实验论证。
越来越多的研究表明肠道微生物与机体代谢息息相关。肥胖是一种低度炎症疾病,往往表现为脂肪组织和肠道微生物引起的全身低级炎症。但膳食补充黑木耳能否有效降低高脂饮食引起的肠道炎症,改善肠道代谢及其病理变化,仍有待进一步研究。
[1] 吐克孜·吾守尔,王茹,张姣姣,等.樱桃李果实提取物对小鼠高脂膳食诱导肥胖的预防作用[J].中国食品学报,2021,21(6):144-149.
TUKEZI·W S E,WANG R,ZHANG J J,et al.The preventive effect of Prunus cerasifera Ehrh.fruit extract on obesity induced by high-fat diet in mice[J].Journal of Chinese Institute of Food Science and Technology,2021,21(6):144-149.
[2] KATTA N,LOETHEN T,LAVIE C J,et al.Obesity and coronary heart disease:Epidemiology,pathology,and coronary artery imaging[J].Current Problems in Cardiology,2020,46(3):100655.
[3] 张小利. 高脂饮食促进结肠炎相关结肠癌发生发展的机制初探[D].北京:北京协和医学院,2020.
ZHANG X L.Mechanism study on the promotion of colitis-associated carcinogenesis by high fat diet[D].Beijing:Peking Union Medical College,2020.
[4] 倪家敏, 周飞,黄暨生,等.高糖高脂诱导大鼠代谢相关脂肪性肝病模型的建立[J].药物评价研究,2021,44(3):487-491.
NI J M,ZHOU F,HUANG J S,et al.Establishment of metabolic associated fatty liver disease model in Sprague-Dawley rats by high-sucrose-fat diet[J].Drug Evaluation Research,2021,44(3):487-491.
[5] 马领然, 周迪,吕子阳,等.褪黑素改善高脂饮食小鼠认知障碍的可能机制探讨[J].中南药学,2020,18(8):1 323-1 328.
MA L R,ZHOU D,LUV Z Y,et al.Possible mechanism of melatonin in improving cognitive impairment in high-fat diet mice[J].Central South Pharmacy,2020,18(8):1 323-1 328.
[6] ZHENG Z P,WU L,HAN Y Q,et al.Gut microbiota-controlled tryptophan metabolism improves D-Gal/LPS-induced acute liver failure in C57BL/6 mice[J/OL].Engineering,2021.https://doi.org/10.1016/j.eng.2020.12.013
[7] 陈玉琼, 顾天宇,张思,等.短链脂肪酸在炎症性肠病中的免疫调节作用[J].现代免疫学,2021,41(3):255-259.
CHEN Y Q,GU T Y,ZHANG S,et al.Immunoregulatory role of short chain fatty acids in inflammatory bowel disease[J].Current Immunology,2021,41(3):255-259.
[8] 刘文贺, 苏玲,王琦.不同产区黑木耳中营养成分比较分析[J].北方园艺,2020(5):121-128.
LIU W H,SU L,WANG Q.Comparative analysis of nutritional ingredients of Auricularia heimuer in different main planting areas[J].Northern Horticulture,2020(5):121-128.
[9] PAK S J,CHEN F,MA L J,et al.Functional perspective of black fungi (Auricularia auricula):Major bioactive components,health benefits and potential mechanisms[J].Trends in Food Science & Technology,2021,114:245-261..
[10] 傅思瑞. 木耳红曲降血脂产品研发[D].成都:成都大学,2020.
FU S R.The research and development of hypolipidemic products by Auricularia auricula Monascus[D].Chengdu:Chengdu University,2021.
[11] 李强, 高艳荣,徐凌中.黑木耳粉对矽肺大鼠体内抗氧化水平的影响[J].包头医学院学报,2012,28(1):21-22;47.
LI Q,GAO Y R,XU L Z.Effects of Auricularia Auricular powders on antioxidation in rat lungs exposed to silica[J].Journal of Baotou Medical College,2012,28(1):21-22;47.
[12] 宋河涛. 滴鼻感染大肠杆菌对肥胖小鼠肝脏损伤病理学评价[D].雅安:四川农业大学,2019.
SONG H T.Pathological evaluation of liver injury in obese mice infected with Escherichia coli by nasal drip[D].Ya’an:Sichuan Agricultural University,2019.
[13] 滕跃. 降胆固醇益生菌的筛选及其改善高脂饮食小鼠脂代谢机制研究[D].长春:吉林农业大学,2020.
TENG Y.Screening of cholesterol-lowering probiotics and its mechanism of lipid metabolism in mice fed a high-fat diet[D].Changchun:Jilin Agricultural University,2020.
[14] 赵斌, 刘震,陈平安,等.高密度脂蛋白胆固醇和冠心病患者非狭窄冠状动脉微循环阻力的关系[J].解剖学研究,2021,43(2):138-142.
ZHAO B,LIU Z,CHEN P A,et al.Relationship between high density lipoprotein cholesterin and coronary microcirculation resistance of non-constricted coronary arteries in patients with coronary heart disease[J].Anatomy Research,2021,43(2):138-142.
[15] 何嘉烽. 黑木耳多糖的降血脂作用及相关机制的初步探讨[D].广州:广东药科大学,2019.
HE J F.Study on hypolipidemic effects of Auricular auricula polysaccharides on hyperlipidemia and its related mechanism[D].Guangzhou:Guangdong Pharmaceutical University,2019.
[16] 周青青, 蒋丰岭,王家妮,等.不同饮食摄入对小鼠糖脂代谢、肠道菌群的影响[J].食品研究与开发,2021,42(10):16-23.
ZHOU Q Q,JIANG F L,WANG J N,et al.Effects of different dietary ingestions on glucose and lipid metabolism,intestinal microbiota in mice[J].Food Research and Development,2021,42(10):16-23.
[17] 王家妮, 程如越,罗雅亭,等.高脂饲料诱导小鼠代谢综合征及对肠道发育、肝脏功能和肠道菌群的影响[J].卫生研究,2021,50(1):93-99.
WANG J N,CHENG R Y,LUO Y T,et al.High-fat diet induces metabolic syndrome in mice and its influence on intestinal development,liver function and intestinal microbiota[J].Journal of Hygiene Research,2021,50(1):93-99.
[18] ZHAO C Y,QU Q S,YANG F,et al.Monascus ruber fermented Panax ginseng ameliorates lipid metabolism disorders and modulate gut microbiota in rats fed a high-fat diet[J].Journal of Ethnopharmacology,2021,278:114300.
[19] JIAN C,LUUKKONEN P,S DEVIRTA S J,et al.Impact of short-term overfeeding of saturated or unsaturated fat or sugars on the gut microbiota in relation to liver fat in obese and overweight adults[J].Clinical Nutrition,2021,40(1):207-216.
DEVIRTA S J,et al.Impact of short-term overfeeding of saturated or unsaturated fat or sugars on the gut microbiota in relation to liver fat in obese and overweight adults[J].Clinical Nutrition,2021,40(1):207-216.
[20] HOU D Z,ZHAO Q Y,YOUSAF L,et al.Consumption of mung bean (Vigna radiata L.) attenuates obesity,ameliorates lipid metabolic disorders and modifies the gut microbiota composition in mice fed a high-fat diet[J].Journal of Functional Foods,2020,64,103 687.
[21] GUO C L,WANG Y Q,ZHANG S H,et al.Crataegus pinnatifida polysaccharide alleviates colitis via modulation of gut microbiota and SCFAs metabolism[J].International Journal of Biological Macromolecules,2021,181:357-368.
[22] WU M M,XIAO H,SHAO F Y,et al.Arginine accelerates intestinal health through cytokines and intestinal microbiota[J].International Immunopharmacology,2020,81:106029.
[23] 郝敏, 李殿龙,徐俊亭,等.黑木耳胞外多糖对小鼠肠道微生态及免疫调节的影响[J].中国食品学报,2021,21(3):63-70.
HAO M,LI D L,XU J T,et al.Effects of exopolysaccharides from Auricularia auricula-judae on the intestine microecology and immunomodulatory in mice[J].Journal of Chinese Institute of Food Science and Technology,2021,21(3):63-70.
[24] 白利琴. 多糖黄酮对大鼠血脂代谢与肠道菌群调节作用研究[D].石家庄:河北科技大学,2020.
BAI L Q.Effect of polysaccharide and flavornoid on the regulation of lipid metabolism and intestinal flora proliferation[D].Shijiazhuang:Hebei University of Science and Technology,2020.
[25] ZHANG T T,ZHAO W Y,XIE B Z,et al.Effects of Auricularia auricula and its polysaccharide on diet-induced hyperlipidemia rats by modulating gut microbiota[J].Journal of Functional Foods,2020,72:104038.