免疫力是指人对外界病毒的抵抗能力,主要来自人体自身的免疫系统。免疫系统为人体在复杂多变的内外环境中处于平衡状态提供可靠的保证,是人体健康的基石[1-2]。2019年底爆发的全球性公共卫生事件“COVID-19”,截至2021年1月4日,全球确诊病例数已超过8 000万,死亡病例数超过180万,相关病例病死率达到了2.22%[3],其中患者大多为免疫力低下的中老年人[4],这更让人们深刻意识到增强免疫力的重要性。为满足临床需要,有必要开发新的功能食品或治疗药物来提高免疫功能,而天然产物尤其是药食同源中药被认为是发掘潜在的免疫调节作用成分的重要来源。
人参为五加科植物人参(Panax ginseng C.A.Meyer)的干燥根和根茎[5],以人参为代表的中药由于其安全性和多靶点的优势[6],在提高免疫力方面有着重要的作用[7],通过人参的免疫刺激作用可有助于治疗病理依赖于降低吞噬能力的疾病[8-9]。近年来,随着人参被列为新资源食品[10],其食用价值深受人们的信赖及喜爱,人参系列产品应运而生,如人参保健酒、人参多糖发酵乳饮料与人参红景天片等[11-13]。具有提高免疫力功能的人参功能因子及相应产品有待进一步的开发与研究。人参发挥多重药理作用的物质基础主要有皂苷、糖肽、多糖、多肽、蛋白质、挥发油等成分[14-16]。人参糖肽复合物(ginseng glycopeptides,Ggp)是由多糖、肽和糖肽组成的一类非皂苷类大分子化合物的混合物,同时具备糖类和肽类的双重特性,现代药理学研究表明其具有多种生物活性,如降血糖、降血脂、保护神经细胞、抗炎镇痛、改善认知障碍、增强记忆力、镇静、降胆固醇等[17],目前,对于其提高机体免疫力功能的研究较少。此外,糖肽类物质的生物活性一方面受本身糖蛋白性质的影响,另一方面与其自身的复杂结构有关,其结构的复杂性主要是由糖肽的单糖组成及连接方式、氨基酸组成及连接方式、糖-肽结合位点的多样性决定的,而这些因素都与其分子质量息息相关,分子质量不同,结构组成不同,其相应的生物学活性也不同。随着各种天然生物活性糖蛋白的不断发现和研究,对糖肽的开发也成为了一大研究热点[18]。因此,本研究拟通过水提醇沉法、酶解法与透析法相结合制备不同分子质量的人参糖肽复合物,采用建立环磷酰胺致免疫低下动物模型研究其免疫调节活性,旨在挖掘人参提高免疫力的物质基础,探讨不同分子质量的人参糖肽对免疫活性的影响,扩展人参糖肽的潜在临床价值。
1 材料与方法
1.1 材料与试剂
5年生人参,由吉林省怡生对外贸易有限公司提供,经长春中医药大学陈长宝教授鉴定为五加科植物人参的干燥根和根茎;BALB/c小鼠,SPF级,体重18~21 g,雌性,许可证号为SCXK(辽)2020—0001,辽宁长生生物技术有限公司;风味蛋白酶(食品级),河南万邦实业有限公司;木瓜蛋白酶(食品级),浙江一诺生物科技有限公司;BCA蛋白浓度测定试剂盒(增强型),碧云天生物技术有限公司;环磷酰胺注射液,规格200 mg/支,Baxter Oncilogy Gat;香菇菌多糖片,规格15 mg/片(批号:20010104),开封制药(基团)有限公司生产;2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB),Macklin;RPM1I640完全培养液,Gibco;YAC-1,中国科学院上海细胞库;乙二胺四乙酸二钾、印度墨汁、Na2CO3,上海源叶生物科技有限公司;Hank′s液、硝基氯化四氮唑、吩嗪二甲酯硫酸盐、氧化型辅酶Ⅰ、0.2 mol/L的Tris-HCl缓冲液、2.5%Triton, Solarbio;其他试剂均为分析纯。
1.2 仪器与设备
IH-H208C型富士宝电磁炉,佛山市富士宝电器科技股份有限公司;JJ-1型增力电动搅拌器,江苏金坛市江南仪器厂制造证;EYELA N-1100型旋转蒸发仪、EYELA-FDU2100型冻干机,东京理化器械株式会社;M200 pro型酶标仪,瑞士TECAN集团公司;ZQZY-85CNS型振荡培养箱,上海知楚仪器有限公司;XT200i型动物全血细胞分析仪,Sysmex;LSCO150 型CO2培养箱,Themo Fisher Scientific;LC20A 型高效液相色谱仪,SHIMADZU。
1.3 试验方法
1.3.1 不同分子质量人参糖肽的制备
人参糖肽制备工艺流程如下:
取适量人参粗粉→浸泡30 min→14倍蒸馏水煎煮提取1 h、 提取3次、过滤→合并滤液、浓缩→使用70%乙醇醇沉→抽滤得沉淀→人参糖蛋白粗提物(纯度>90.1%)→加入蒸馏水使底物质量分数为13%→加入风味蛋白酶∶木瓜蛋白酶(质量比1∶1) 使加酶量为1%(质量分数)→用1 mol/L NaOH或HCl调节pH至6→置50 ℃水浴锅水浴4 h→100 ℃灭酶10 min→酶解液离心→上清液冷冻干燥→人参糖肽粗提物(纯度>88.4%)→加水溶解→使用截留分子质量为14~8 kDa、 7 kDa和1 kDa透析袋进行透析→透析内外液冷冻干燥→对样品进行分子质量分布的测定,得到14 kDa(纯度>85.1%)、11kDa(纯度>89.8%)和<1 kDa(purity>86.4%)的3组人参糖肽。
分子质量分布的测定:通过高效液相色谱分析系统,以分子质量为12 000、 5 000、1 000、180 Da的葡聚糖与葡萄糖标准品制作标准曲线,利用GPC软件计算分子质量的分布,选用Sepax Technologies SRT SEC-100色谱柱(7.8 mm×300 mm,5 μm),流动相为0.7% Na2SO4,流速0.5 mL/min,柱温35 ℃。
1.3.2 人参糖肽增强免疫力功能实验
1.3.2.1 动物造模、分组及给药
将适应性饲养1周的270只BALB/c小鼠,分为3批,每批90只,每批小鼠随机分9组(n=10):空白对照组(Blank)、阳性对照组[香菇菌多糖片,20 mg/(kg·d),PC]、模型对照组[环磷酰胺,50 mg/(kg·d), Model]、人参糖肽总提取物低剂量组[70 mg/(kg·d),Ggp-L]、人参糖肽总提取物中剂量组[140 mg/(kg·d),Ggp-M]、人参糖肽总提取物高剂量组[210 mg/(kg·d),Ggp-H]、14 kDa人参糖肽[93.4 mg/(kg·d),Ggp-1]、11 kDa人参糖肽[33.6 mg/(kg·d), Ggp-2]、<1 kDa人参糖肽[29.4 mg/(kg·d), Ggp-3],其中,3个不同分子质量组的给药剂量根据各自的提取率等同于人参糖肽总提取物高剂量组,各组连续灌胃给予受试物30 d,空白对照组与模型组给予等体积生理盐水。在第3周后开始以50 mg/(kg·d)的剂量隔天腹腔注射环磷酰胺,共注射5次,建立小鼠免疫力低下模型。实验结束后,颈椎脱臼法处死小鼠,分别进行免疫器官指数、小鼠碳廓清实验、迟发型变态反应(delayed type hypersensitivity,DTH)、外周血白细胞总数及NK细胞活性测定实验。
1.3.2.2 外周白细胞总数测定
以摘除小鼠眼球的方法采集全血,24 h内以全血细胞分析仪检测白细胞总数。
1.3.2.3 小鼠碳廓清实验
称量小鼠体重,以0.1 mL/10g的注射量将生理盐水稀释4倍的印度墨汁注入小鼠尾静脉。注入墨汁后,立刻计时,在2和10 min分别从内眦静脉丛取血20 μL,立即加至2 mL Na2CO3溶液中,在酶标仪600 nm处测吸光度,以Na2CO3溶液为空白对照。用颈椎脱臼法处死小鼠,取肝脏、脾脏和胸腺,用滤纸吸干脏器表面血污,称重。一般以校正的吞噬指数a表示小鼠碳廓清能力。计算如公式(1)、公式(2)所示:
(1)
(2)
式中:a,吞噬指数;K,廓清指数;A1,2 min的吸光度;A2,10 min的吸光度;t1=2 min;t2=10 min。
1.3.2.4 小鼠DTH
用脱毛膏将每只小鼠腹部皮肤脱毛约1 cm×1 cm, 用DNFB溶液50 μL均匀涂抹致敏,5 d后用DNFB溶液10 μL均匀涂抹于小鼠右耳(2面)进行攻击,放回笼子,24 h后用颈椎脱臼法处死小鼠,以左右耳重的差值作为迟发型超敏反应值。
1.3.2.5 NK细胞活性测定
实验前24 h将新鲜的且存活率大于95%的靶细胞(YAC-1细胞)进行传代培养。应用前以Hank′s液洗清3次,用RPMI1640完全培养液调整细胞浓度为4 ×105个/mL。将每只小鼠颈椎脱臼处死,无菌取脾,置于盛有适量无菌Hank′s液的小平皿中,用镊子轻轻将脾磨碎,制成单细胞悬液。用Hank′s液清洗 2次, 1 000 r/min离心10 min弃上清液。细胞沉淀加入红细胞裂解液,再加入Hank′s液,1 000 r/min离心10 min,用1 mL含10%小牛血清的RPMI1640完全培养液重悬,最后用RPMI1640完全培养液调整细胞浓度为2×107个/mL。取靶细胞和效应细胞各100 μL(效靶比50 ∶1),加入U型96孔培养板中;靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和2.5%Triton各100 μL;上述各项均设3个复孔,于37 ℃、5% CO2培养箱中培养 4 h, 然后将96孔培养板1 500 r/min离心5 min,每孔吸取上清液100 μL置平底96孔培养板中,同时加入LDH基质液100 μL,反应3 min,每孔加入30 μL 1 mol/L 的HCl溶液,在酶标仪490 nm处测定吸光度。计算如公式(3)所示:
NK细胞活性![]()
(3)
式中:A0,自然释放孔吸度光;A1,反应孔吸光度;A2,最大释放孔吸光度。
1.3.3 数据统计
本实验中数据采用t检验法进行统计学分析,使用GraphPad Prism 7.0软件进行组间比较,数据以![]() 的形式表示,P<0.05为差异显著,P<0.01为差异极显著,P>0.05为差异不显著。
的形式表示,P<0.05为差异显著,P<0.01为差异极显著,P>0.05为差异不显著。
2 结果与分析
2.1 分子质量分布测定
HPLC及GPC软件分析得到人参糖肽的平均分子质量及分子质量分布,按照试验条件通过截留分子质量为14~8 kDa、7 kDa和1 kDa透析袋透析后,得到的人参糖肽平均分子质量为13 867、11 086、446 Da,能够较好地满足14、11 kDa和<1 kDa人参糖肽的要求。人参糖肽的分子质量分布见表1。
表1 人参糖肽的分子质量分布 单位:%
Table 1 Molecular weight distribution of ginseng glycopeptides
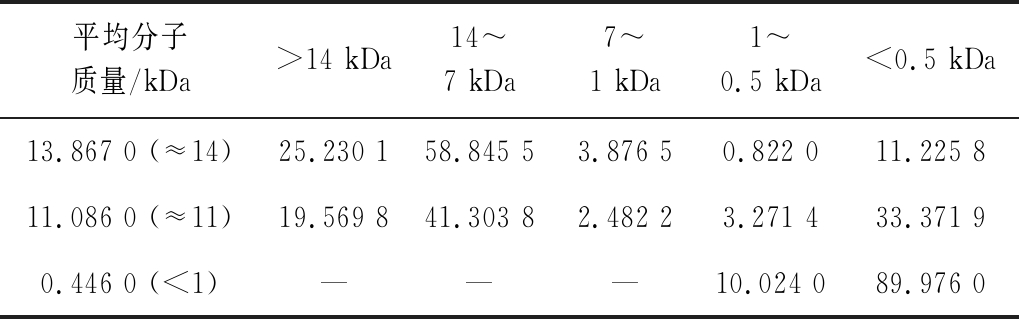
平均分子质量/kDa>14 kDa14~7 kDa7~1 kDa1~0.5 kDa<0.5 kDa13.867 0 (≈14)25.230 158.845 53.876 50.822 011.225 811.086 0 (≈11)19.569 841.303 82.482 23.271 433.371 90.446 0 (<1)———10.024 089.976 0
2.2 人参糖肽增强免疫力功能测定
2.2.1 外周血白细胞总数测定
白细胞是参与免疫应答的血细胞,白细胞总数及各种白细胞百分比会因产生炎症或疾病而变化,因此白细胞数是评价免疫作用的重要标准之一[19]。Model组白细胞计数明显低于Blank组(图1-a,P<0.01)。与Model组相比,PC组的小鼠外周血白细胞数极显著增加(P<0.01);人参糖肽复合物3个剂量组的Ggp-L组的小鼠外周血白细胞显著提高(P<0.05),Ggp-M与Ggp-H组的小鼠外周血白细胞数均极显著提高(P<0.01); Ggp-1与Ggp-3组的小鼠外周血白细胞数均极显著提高(P<0.01),Ggp-2组的小鼠外周血白细胞数显著提高(P<0.05)。与Ggp-H组相比,Ggp-1组无明显变化(P>0.05),Ggp-2组的小鼠外周血白细胞数极显著降低(P<0.01),而Ggp-3组的小鼠外周血白细胞数显著提高(P<0.05)。结果表明,环磷酰胺可使小鼠的白细胞计数显著降低,使小鼠免疫功能下降。人参糖肽复合物能促进环磷酰胺引起的免疫抑制小鼠白细胞的形成,提高机体免疫力作用,且具有剂量依赖性,低分子质量的人参糖肽效果更明显。
2.2.2 小鼠体重及免疫器官指数
如表2所示,灌胃给予不同剂量和不同分子质量的人参糖肽复合物30 d,不会导致小鼠死亡,与Blank组相比体重无显著降低,表明人参糖肽复合物不会对小鼠产生毒性作用;脾脏和胸腺作为外周免疫器官和中枢免疫器官,是参与免疫反应的主要场所,免疫器官指数的变化可以初步反映药物对免疫器官以及免疫调节是否具有影响[20]。与Blank组相比,Model组脾脏和胸腺指数均有显著下降(P<0.05); 给药组与Model组相比,免疫器官指数均有明显的提高(P<0.05)。结果表明,人参糖肽复合物与不同分子质量的人参糖肽复合物均能够在一定程度上逆转环磷酰胺所致的小鼠的免疫器官指数的下降,可逆转环磷酰胺诱导的免疫器官萎缩,说明人参糖肽复合物对两大免疫器官具有保护作用。
表2 小鼠体重及免疫器官指数实验结果![]()
Table 2 Experimental results of mouse body weight and ![]()

注:脏器指数=脏器重/体重;数据以![]() 表示;经单因素方差分析(ANOVA)检验,与Blank组比较#P<0.05、## P<0.01;与Model组比较*P<0.05、** P<0.01
表示;经单因素方差分析(ANOVA)检验,与Blank组比较#P<0.05、## P<0.01;与Model组比较*P<0.05、** P<0.01
组别初始体重/g最终体重/g脾脏指数/(mg·g)-1胸腺指数/(mg·g)-1Blank20.51±0.8622.23±0.904.52±0.231.74±0.14Model19.51±0.6021.15±0.37#1.72±0.14##0.30±0.02##PC19.50±1.0722.24±0.71*2.14±0.18**0.35±0.01**Ggp-L18.93±0.6220.89±0.652.09±0.19**0.45±0.02**Ggp-M19.44±1.0121.53±0.902.45±0.10**0.48±0.03**Ggp-H19.41±0.9422.26±0.94*2.57±0.05**0.49±0.01**Ggp-119.21±0.8321.14±0.902.18±0.41*0.48±0.02**Ggp-219.25±0.7721.15±0.722.29±0.21**0.47±0.02**Ggp-319.03±0.6922.98±0.68*1.88±0.04*0.46±0.03**
2.2.3 碳廓清实验
巨噬细胞对先天性免疫具有重要作用,可以通过分泌各种细胞因子来调节机体免疫能力,血液中的单核-巨噬细胞系统具有对进入体内的异物吞噬清除的功能,因此可通过吞噬率来反映单核-巨噬细胞系统的功能[21-22]。从图1-b可以看出,与Blank组相比,Model组免疫抑制小鼠碳廓清吞噬指数显著降低(P<0.05)。与Model组相比,PC组的小鼠碳廓清的吞噬指数极显著提高(P<0.01);人参糖肽复合物3个剂量组的Ggp-L组的小鼠碳廓清的吞噬指数显著提高(P<0.05),Ggp-M与Ggp-H组的小鼠碳廓清的吞噬指数均极显著提高(P<0.01),且随着给药剂量的增大吞噬指数呈现一定的剂量依赖性;Ggp-1组小鼠碳廓清的吞噬指数极显著提高(P<0.01),Ggp-2与Ggp-3组小鼠碳廓清的吞噬指数均显著提高(P<0.05)。与Ggp-H组相比,Ggp-1组无显著性差异(P>0.05), Ggp-2、Ggp-3组小鼠碳廓清的吞噬指数均极显著降低(P<0.01)。结果表明,人参糖肽复合物与不同分子质量的人参糖肽复合物能够一定程度上增强小鼠单核-巨噬细胞功能,提高小鼠的非特异性免疫应答水平。且人参糖肽复合物的吞噬能力与人参糖肽复合物的剂量和分子质量有关,高剂量和高分子质量的人参糖肽复合物对改善巨噬细胞吞噬功能有较好的作用。
2.2.4 DTH实验
DTH是一种由T细胞介导的炎症免疫反应,DTH需要被激活的T淋巴细胞特异性识别特定抗原,从而增殖并释放细胞因子[23-24]。在本研究中,我们使用DNFB作为抗原诱导的耳部DTH来评估人参糖肽复合物在机体细胞免疫功能的状况。根据DTH耳肿胀试验的结果(图1-c),Model组与Blank组相比,Model组DTH程度极显著降低(P<0.01)。与Model组相比,PC组小鼠DTH程度极显著提高(P<0.01);人参糖肽复合物3个剂量组的Ggp-L组的小鼠DTH程度显著增加(P<0.05),Ggp-M与Ggp-H组的小鼠DTH程度均极显著增加(P<0.01),且呈一定的剂量依赖性;Ggp-1、Ggp-2、Ggp-3组小鼠DTH程度均极显著提高(P<0.01)。与Ggp-H组相比,Ggp-1组DTH程度极显著降低(P<0.01),Ggp-2、Ggp-3组小鼠DTH程度均极显著提高(P<0.01)。结果表明,人参糖肽复合物与不同分子质量的人参糖肽复合物能够在一定程度上改善环磷酰胺对DTH的抑制作用,增强环磷酰胺处理的小鼠细胞介导的免疫功能,说明低分子质量的人参糖肽复合物可能对增强细胞免疫效果更好。
2.2.5 NK细胞活性测定
NK细胞是天然免疫系统中的重要组成部分,是机体抗肿瘤、抗感染的一种重要免疫细胞[25]。本文采用LDH法测定环磷酰胺诱导的免疫抑制小鼠NK细胞活性。如图1-d所示,与Blank组相比,Model组NK细胞活性极显著降低(P<0.01)。与Model组相比,Ggp-L组无显著性差异(P>0.05),Ggp-M、Ggp-H组的小鼠NK细胞活性均极显著增加(P<0.01), 且呈一定的剂量依赖性;PC组、Ggp-1、Ggp-2、Ggp-3组小鼠NK细胞活均极显著提高(P<0.01)。与Ggp-H组相比,Ggp-1组NK细胞活性极显著降低(P<0.01), Ggp-2、Ggp-3组无明显变化(P>0.05)。结果表明,人参糖肽复合物与不同分子质量的人参糖肽复合物能够在一定程度上增加NK细胞的活力,且效果与临床常用免疫促进剂药香菇菌多糖相似。因此,人参糖肽复合物可能通过促进环磷酰胺诱导免疫低下小鼠体内NK细胞活性来调节免疫反应,且其作用效果随分子质量的降低而增强。
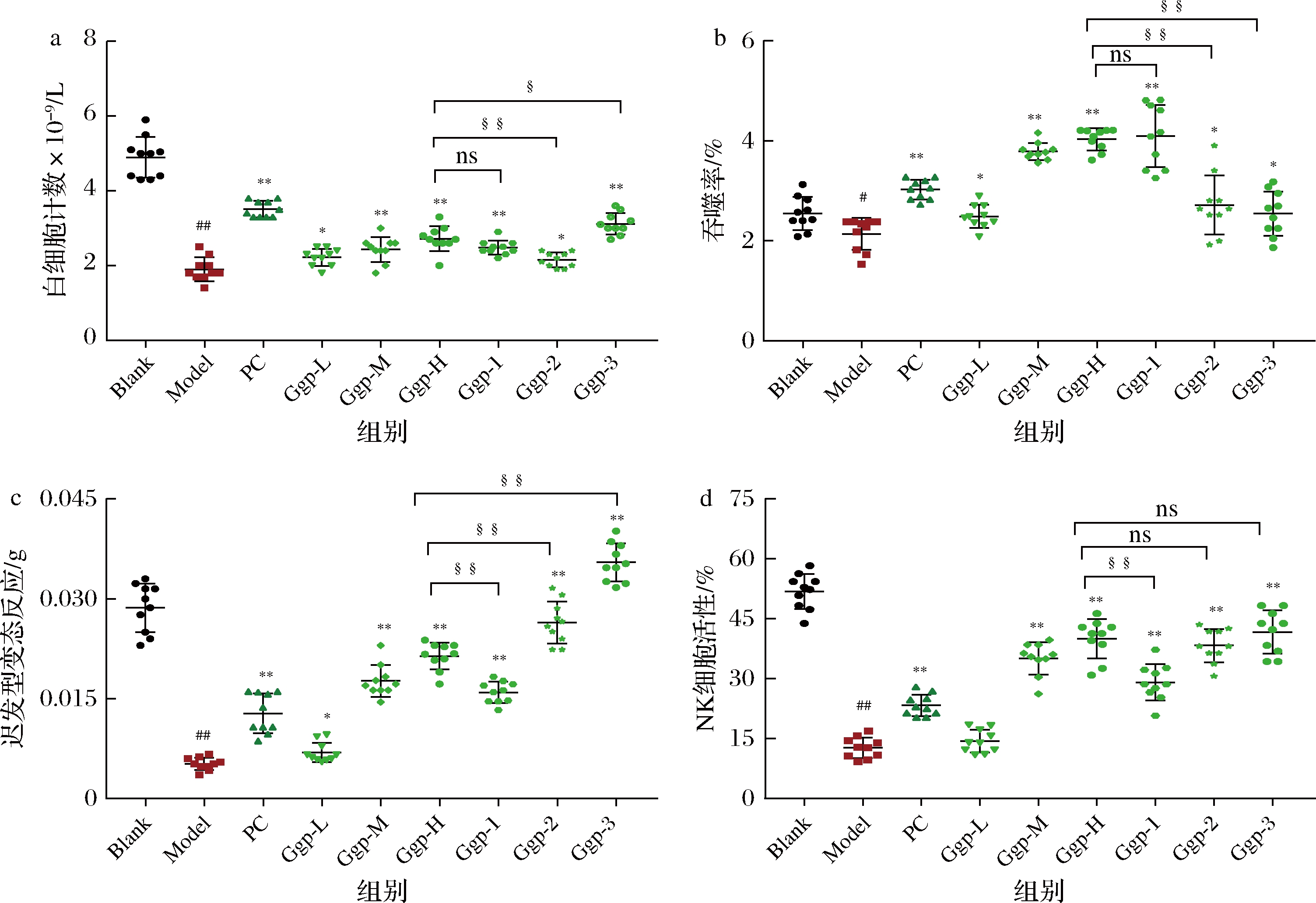
a-白细胞计数;b-碳廓清实验;c-DTH;d-NK细胞活性
图1 人参糖肽复合物与不同分子质量的人参糖肽对白细胞计数、碳廓清实验、DTH、NK细胞活性的影响
Fig.1 Effects of ginseng glycopeptide complex and different molecular weight of ginseng glycopeptide on white blood cell count, carbon clearance test, delayed type hypersensitivity and NK cell activity
注:测定值为![]() 与Blank组比较,## P<0.01、#P<0.05;与Model组比较** P<0.01、*P<0.05;与Ggp-H组比较,§§ P<0.01、§P<0.05、ns P>0.05
与Blank组比较,## P<0.01、#P<0.05;与Model组比较** P<0.01、*P<0.05;与Ggp-H组比较,§§ P<0.01、§P<0.05、ns P>0.05
3 结论
人参糖肽总提取物及重均分子质量在14、11 kDa和<1 kDa的3种人参糖肽对免疫功能低下小鼠均具有升高外周血白细胞总数,促进免疫器官生长发育,增强小鼠DTH和吞噬细胞的吞噬能力,提高NK细胞活性的作用,且较低分子质量的人参糖肽复合物的免疫效果相对更明显,均具有增强免疫力的功能。后续将对人参糖肽的结构以及其调节免疫活性的机理进行研究,为开发具有提高免疫力功效的保健食品及药品提供了潜在活性成分和应用依据。
[1] 牛向飞. 重大工程团队免疫系统运行机制研究[D].哈尔滨:哈尔滨工业大学, 2018.
NIU X F.The operation mechanism of the immune system in megaproject team[D].Harbin:Harbin Institute of technology, 2018.
[2] RANASINGHE C, OZEMEK C, ARENA R.Exercise and well-being during COVID 19-time to boost your immunity[J].Expert Review of Anti-infective Therapy, 2020, 18(12):1 195-1 200.
[3] 李锦成, 刘民, 刘珏.全球自然感染SARS-CoV-2人群的抗体水平研究[J].中国全科医学, 2021, 24(10):1 173-1 178.
LI J C, LIU M, LIU J.Antibody responses to SARS-CoV-2 in naturally infected population worldwide[J].Chinese General Practice, 2021, 24(10):1 173-1 178
[4] YANEZ N D, WEISS N S, ROMAND J A, et al.COVID-19 mortality risk for older men and women[J].BMC Public Health, 2020, 20(1):1 742.
[5] 国家药典委员会. 中华人民共和国药典, 一部[M].北京:中国医药科技出版社, 2015.
National pharmacopoeia commission.Pharmacopoeia of the People′s Republic of China, Part One[M].Beijing:China Medical Science and Technology Press, 2015.
[6] 王蕾, 董金香, 罗浩明, 等.人参糖蛋白对阿霉素所致心肌毒性的保护作用及机制研究[J].中草药, 2021,52(7):1 965-1 973.
WANG L, DONG J X, LUO H M, et al.Protective effect and mechanism of ginseng glycoproteins on cardiotoxicity caused by adriamycin[J].Chinese Traditional and Herbal Drugs, 2021,52(7):1 965-1 973.
[7] CHOI M K, SONG I S.Interactions of ginseng with therapeutic drugs[J].Archives Pharmacal Research, 2019, 42(10):862-878.
[8] UM Y, EO H J, KIM H J, et al.Wild simulated ginseng activates mouse macrophage, RAW264.7 cells through TRL2/4-dependent activation of MAPK, NF-κB and PI3K/AKT pathways[J].Journal of Ethnopharmacology, 2020, 263:113218.
[9] HAO J J, HU H W Y, LIU J, et al.Integrated metabolomics and network pharmacology study on immunoregulation mechanisms of panax ginseng through macrophages[J].Evidence-based Complementary Alternative Medicine, 2019(2):1-14.
[10] 祁玉丽. 人参多糖对肠道微生态及肠黏膜免疫作用的研究[D].长春:吉林农业大学, 2019.
QI Y L.Effects of ginseng polysaccharides on intestinal microecology and mucosal immunity[D].Changchun:Jilin Agricultural University, 2019.
[11] 李进. 人参、枸杞、熟地保健酒制备工艺研究[J].食品研究与开发, 2016, 37(18):95-99.
LI J.Process research of ginseng, Chinese wolfberry, prepared rhizome of Rehmannia health wine[J].Food Research and Development, 2016, 37(18):95-99.
[12] 吴琼, 陈丽娜, 王晶, 等.人参多糖发酵乳饮料的生产工艺及质构分析[J].食品科技, 2015, 40(10):83-87.
WU Q, CHEN L N, WANG J, et al.Production process of ginseng polysaccharide fermented milk beverage and texture analysis[J].Food Science and Technology, 2015, 40(10):83-87.
[13] 樊艳霞. 增强免疫力保健食品人参红景天片的研究[D].长春:吉林大学, 2018.
FAN Y X.Study of Ginseng-Rhodiola with a health food to enhance immunity[D].Changchun:Jilin University, 2018.
[14] GUO M K, SHAO S, WANG D D, et al.Recent progress in polysaccharides from Panax ginseng C.A.Meyer[J].Food & Function, 2021, 12(2):494-518.
[15] 南敏伦, 赵昱玮, 司学玲, 等.人参糖肽分离及性质[J].中国实验方剂学杂志, 2015, 21(3):51-54.
NAN M L, ZHAO Y W, SI X L, et al.Isolation and characterization of glycopeptide from Panax ginseng[J].Chinese Journal of Experimental Traditional Medical Formulae, 2015, 21(3):51-54.
[16] 吕京南. 人参非皂苷成分治疗老年痴呆作用的药效物质基础研究[D].长春:长春中医药大学, 2016.
LYU J N.Study on the pharmacodynamic material basis of non-saponins of ginseng in the treatment of Alzheimer′s disease[D].Changchun:Changchun University of Traditional Chinese Medicine, 2016.
[17] 俞萍, 张庆贺, 陈长宝, 等.人参糖肽研究进展[J].食品与机械, 2020, 36(10):215-218;227.
YU P, ZHANG Q H, CHEN C B, et al.The research progress of ginseng glycopeptide[J].Food & Machinery, 2020, 36(10):215-218;227.
[18] 刘志龙. 海蜇糖蛋白及其糖肽免疫活性研究[D].洛阳:河南科技大学, 2013.
LIU Z L.Study on the immunological activity of jellyfish glycoprotein and its glycopeptide[D].Luoyang:Henan University of Science and Technology, 2013.
[19] 张兆肖, 郑铮, 杨丽, 等.骆驼初乳对环磷酰胺诱导小鼠免疫功能低下的调节作用[J].现代食品科技, 2019, 35(4):1-8.
ZHANG Z X, ZHENG Z, YANG L, et al.Effects of camel colostrum on cyclophosphamide-induced immunodeficiency in mice[J].Modern Food Science and Technology, 2019, 35(4):1-8.
[20] 王辉, 秦翠丽, 宫强, 等.非消化寡糖对小鼠免疫调节的影响[J].食品与机械, 2019, 35(9):1-5.
WANG H, QIN C L, GONG Q, et al.Effects of non-digestible oligosaccharides their combinations on the immunomodulation of mice[J].Food & Machinery, 2019, 35(9):1-5.
[21] 陈金龙, 张月巧, 袁娅, 等.植物多糖通过NF-κB信号通路对巨噬细胞的免疫调节作用研究进展[J].食品科学, 2015, 36(23):288-294.
CHEN J L, ZHANG Y Q, YUAN Y, et al.Progress in research on immune-regulatory effects of plant polysaccharides on macrophages through NF-κB signaling pathway[J].Food Science, 2015, 36(23):288-294.
[22] 徐荣, 杨朴丽, 徐通, 等.诺丽果粉增强免疫力功能实验研究[J].食品工业科技, 2017, 38(24):297-302.
XU R, YANG P L, XU T, et al.Effect of Morinda citrigolia fruit powder on strengthening immune function in mice[J].Science and Technology of Food Industry, 2017, 38(24):297-302.
[23] TILWARI A.Effect of five medicinal plants used in Indian system of medicines on immune function in Wistar rats[J].African Journal of Biotechnology, 2011, 10(73):16 637-16 645.
[24] 方笋, 王萌, 赵晓娟, 等.芍芪多苷对迟发型变态反应小鼠细胞免疫功能的影响[J].中国药理学通报, 2008, 24(4):444-448.
FANG S, WANG M, ZHAO X J, et al.Effect of Shaoqiduogan on cellular immunity in mice with delayed-type hypersensitivity[J].Chinese Pharmacology Bulletin, 2008, 24(4):444-448.
[25] 刘英姿, 罗有梁, 周铁忠.碎米花杜鹃原花青素A-1对小鼠免疫细胞的影响[J].中药药理与临床, 2012, 28(2):46-49.
LIU Y Z, LUO Y L, ZHOU T Z.Effects of proanthocyanidin A-1 from Rhododendron spiciferum on mice immunocyte[J].Pharmacology and Clinic of Traditional Chinese Medicine, 2012, 28(2):46-49.