青稞中富含淀粉、适量的蛋白质和脂肪,是较好的酿酒和制曲原粮[1]。青稞酒主要以青稞为原粮,青稞、豌豆制成的中低温大曲为糖化发酵剂,以青石板或瓷砖窖为发酵容器,经一次投粮,“清蒸清烧四次清”的发酵工艺酿造而成[2]。受大曲质量、原粮品质及酿造工艺的影响,青稞酒生产过程中存在淀粉利用率低、发酵周期长、出酒率低等问题。曲乃酒之骨,大曲对白酒发酵的启动尤为重要,其不仅是白酒发酵的原料之一,而且是重要的微生物、酶制剂和风味物质来源。青稞大曲为青稞酒酿造的主要大曲,因青稞中富含β-葡聚糖、玻璃质等成分[3],使得青稞大曲曲坯的黏度较高,且过于致密,不利于营造微氧发酵环境。其次,青稞大曲酿造地处高原,气候干燥,日均气温低,环境微生物丰度低。大曲酿造过程中水分蒸发量大,顶点温度持续较短,成熟期较早,导致微生物的捕捉及富集能力较弱,成品青稞大曲的糖化力、液化力、发酵力等指标较低,可能造成青稞酒酿造过程中淀粉利用率低、发酵周期长和出酒率较低[2-3]。
目前,对青稞大曲的研究主要集中在传统藏曲、微生物群落结构[4-5]和风味组分的剖析[6-7],而对青稞制曲工艺研究以提升青稞大曲质量的文献报道较少。本文针对青稞大曲存在的上述问题,拟以青稞为主要原料,辅以小麦、麸皮或竹纤维制作中低温大曲,对大曲的理化特性、微生物群落及风味组分分析,初步评价青稞大曲的品质,为提升青稞大曲质量、推进青稞制曲工艺发展提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
青稞,青海三江集团;软质小麦、麸皮,本地市售;竹纤维,本地市售鲜竹。
氢氧化钠、葡萄糖、盐酸、五水硫酸铜、可溶性淀粉、酒石酸钾钠、酪蛋白、L-酪氨酸、磷酸氢二钠、磷酸二氢钠等(均为分析纯),聚合化工;2-辛醇、己酸乙酯、己酸(均为色谱纯),Sigma-Aldrich。
1.2 仪器与设备
SP-756P紫外可见分光光度计,上海屹谱仪器有限公司;MLS-375L全自动灭菌锅,日本日立公司;DHG-9245A烘箱,上海一恒科学仪器有限公司;DL-1电炉,北京中兴伟业仪器有限公司;5804R高速冷冻离心机,德国艾本德公司;GC/MS-QP2020气相色谱-质谱联用仪,日本岛津公司。
1.3 实验方法
1.3.1 制曲
结合文献[8]报道的方法,以工业化机械制曲制备中低温青稞大曲。纯小麦曲为主流的中低温大曲,因此,以其为标准和对照曲。不同青稞大曲配料如表1所示,其中,A~I和M为生料制曲,J~L为熟料制曲:原料120~150 ℃炒10~15 min,原料粉碎度为过20目筛的不超过35%~45%,竹子粉碎度为过20目筛。
表1 不同青稞大曲配方
Table 1 Material compositions of different highland barley Daqu

分类样品编号及配方青稞+麸皮A:70%青稞+30%麸皮B:60%青稞+40%麸皮C:50%青稞+50%麸皮青稞+小麦D:60%青稞+40%小麦E:50%青稞+50%小麦F:40%青稞+60%小麦青稞+竹纤维G:95%青稞+5%竹纤维H:90%青稞+10%竹纤维I:85%青稞+15%竹纤维熟青稞+熟小麦J:60%熟青稞+40%熟小麦K:50%青稞+50%熟小麦L:40%熟青稞+60%熟小麦小麦M:100%小麦
1.3.2 取样
中低温大曲发酵结束后,贮存3个月,采用5点取样法从曲房不同位置采集成品样,将样品捣碎,混合均匀,取500 g大曲粉于无菌取样袋中立即密封,共取2份,1份保存在-20 ℃用于理化特性及风味物质检测,1份保存在-80 ℃用于基因组DNA的提取。
1.3.3 理化指标的检测
酸度、淀粉、水分、糖化力、发酵力、液化力、酯化力均参考QB/T 4257—2011《通用大曲分析方法》中的步骤[9];蛋白质测定:凯氏定氮法[10];脂肪的测定:索氏抽提法[11];还原糖测定:斐林试剂法[8];酸性蛋白酶活力测定:福林-酚试剂法[12]。
1.3.4 大曲微生物基因组DNA提取
称取5 g大曲粉,用SDS法提取大曲样品中微生物的基因组DNA。基因组DNA送往上海美吉生物医药科技有限公司进行高通量测序,测序数据在美吉生物云平台(https://cloud.majorbio.com/)进行处理。
1.3.5 大曲风味组分分析
采用顶空固相微萃取结合GC-MS测定大曲中风味组分的种类和含量。
1.3.6 数据分析方法
大曲的理化指标用SPSS 23.0进行显著性分析。用OriginPro 9.0作柱形图。结果用平均值±标准偏差的形式表示。样本组间微生物群落差异heatmap图用R语言pheatmap程序包绘制。
2 结果与分析
2.1 大曲原料的理化指标分析
原料中丰富的营养物质为微生物的生长提供了必要的碳源、氮源、生长因子、无机盐和水分。测定原料的理化指标对大曲的总体预评估具有重要的意义[13]。如表2所示,3种原料的水分含量均在14%(质量分数)以下,淀粉含量充足,且含有一定量的蛋白质和少量脂肪,能够满足微生物的生长需求,为微生物产酶和风味物质提供充足的条件,可用于制曲[8]。为解决传统青稞大曲黏度较高和曲坯致密这一问题,拟将青稞辅以不同比例的麸皮、小麦和竹纤维进行生料制曲,有利于增加青稞大曲的疏松度,营造更有利于微生物生长的微氧发酵环境。同时,本文也进行了熟料制曲,增加原料的糊化和液化,以促进微生物的生长繁殖。
表2 原粮的营养成分含量 单位:%(质量分数)
Table 2 Nutrients contents of grains
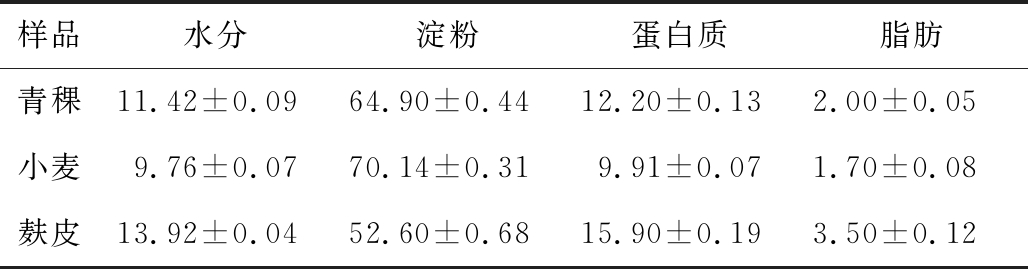
样品水分淀粉蛋白质脂肪青稞11.42±0.0964.90±0.4412.20±0.132.00±0.05小麦9.76±0.0770.14±0.319.91±0.071.70±0.08麸皮13.92±0.0452.60±0.6815.90±0.193.50±0.12
2.2 不同青稞大曲的理化特性分析
2.2.1 不同青稞大曲的理化指标分析
不同青稞大曲的水分、酸度、还原糖和淀粉含量如图1所示,大曲的含水量为12%~16%(质量分数),随着青稞含量的增加,毛细现象明显,大曲水分含量越低,均满足成品曲长期贮存的要求[8]。青稞大曲的酸度较低,青稞+麸皮生料配方间的酸度差异明显,其余青稞大曲的酸度相近。大曲中还原糖含量差异较大,可能与产淀粉酶的微生物的丰度及微生物的生长繁殖代谢差异有关。大曲淀粉含量为58%~64%(质量分数),生料小麦曲的最高,熟料曲的次之,添加麸皮的生料曲最低,可能与不同原料淀粉的含量有关。特别地,熟料制曲还原糖整体处在较高的水平,可能与其提前进行糊化和液化,利于微生物分解利用有关,也可能与其黏度较高,曲坯溶氧不足,微生物生长代谢消耗较少有关。
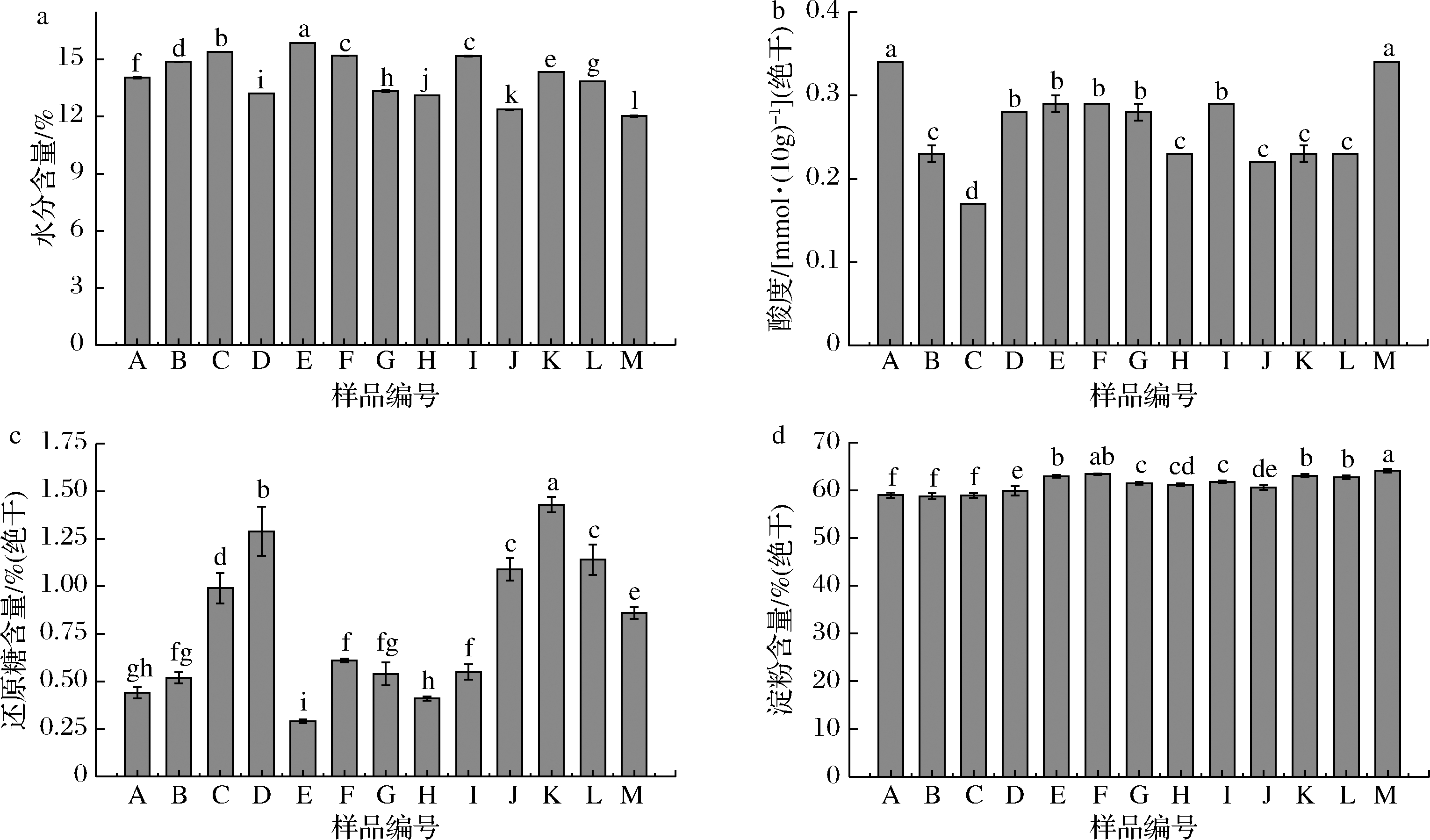
a-水分含量;b-酸度;c-还原糖含量;d-淀粉含量
图1 不同青稞大曲理化指标
Fig.1 Physicochemical indices of different highland barley Daqu
注:图中不同小写字母表示差异显著(P<0.05)(下同)
2.2.2 不同青稞大曲的酶活力分析
糖化力、液化力、发酵力、酯化力和酸性蛋白酶活力是大曲的重要功能指标,对其检测有助于初步评估大曲的质量[8]。大曲的酶活力指标如图2所示,不同大曲的各种酶活力差异显著(P<0.05)。对照曲M的液化力最高(1.60±0.01) U,A、B和C曲的糖化力最高,为(1 132.80±35.64)~(1 166.40±31.9) U,熟料大曲的液化力和糖化力最低。F曲的发酵力最高,为(5.00±0.07) U,D、J和L曲的最低。H曲的酯化力最高,为(397.20±3.96) U,M曲的最低。H、J和G曲的酸性蛋白酶活力较高,F曲的最低。整体上,青稞大曲的液化力低于小麦曲,酯化力高于小麦曲,青稞生料曲的发酵力与小麦曲相近。添加麸皮有利于增加糖化力,添加竹纤维和熟料制曲有利于增加酯化力和酸性蛋白酶活力。与文献报道[14-15]相比,本文所得大曲的液化力和酯化力正常,糖化力、发酵力和酸性蛋白酶活力较高。
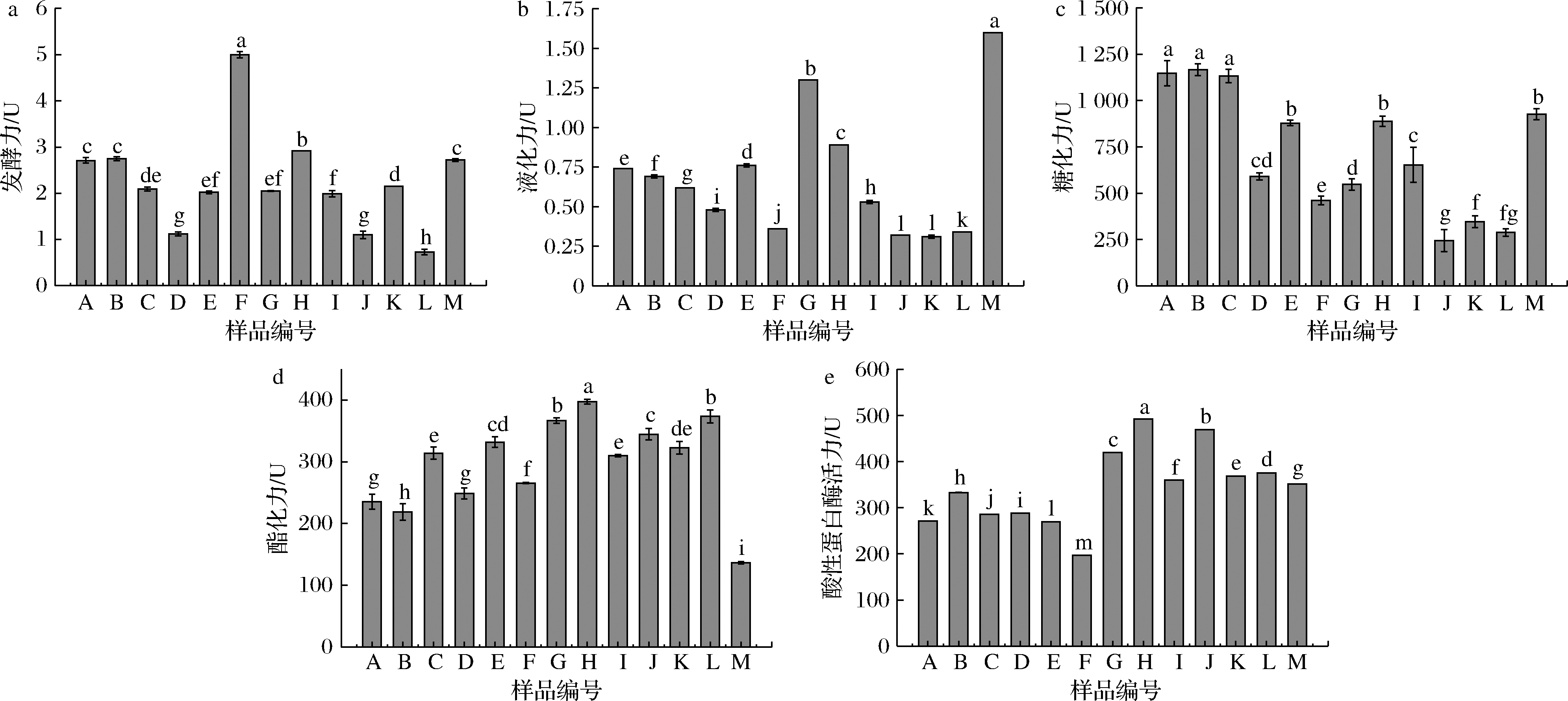
a-发酵力;b-液化力;c-糖化力;d-酯化力;e-酸性蛋白酶活力
图2 不同青稞大曲的酶活力
Fig.2 Enzyme activities of different highland barley Daqu
2.3 不同青稞大曲的微生物群落分析
2.3.1 不同青稞大曲细菌群落结构
大曲细菌群落组成(<1%合并为others)如图3所示,不同大曲中检出18种优势细菌,且细菌组成相似,但丰度存在差异。乳酸菌(Weissella、Lactobacillus、Leuconostoc、Enterococcus、Pediococcus)为异养厌氧菌,发酵过程中,随着微生物的生长,曲坯溶氧量下降,演变为优势菌,丰度在48.09%~92.07%。与M曲相比,添加麸皮、小麦、竹纤维的生料和熟料制作的青稞大曲中魏斯氏菌属(Weissella)的丰度显著增高,而乳杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)和Carnobacterium的丰度显著降低。其次,添加麸皮、小麦和竹纤维的生料青稞大曲中糖多胞菌属(Saccharopolyspora)和片球菌属(Pediococcus)的丰度增加,而肠球菌(Enterococcus)等的丰度降低。熟料制作的大曲中明串珠菌属(Leuconostoc)、肠杆菌科(Enterobacteriaceae)、鞘氨醇杆菌属(Sphingobacterium)、棒杆菌属(Corynebacterium)、链霉菌属(Streptomyces)和苍杆菌属(Ochrobactrum)的丰度显著增加。

图3 不同青稞大曲的细菌群落结构
Fig.3 Bacterial community of different highland barley Daqu
不同配料导致曲坯疏松度和微氧环境存在差异,发酵温度变化差别明显,虽然细菌对温度的耐受性较高[16],但是对溶氧量的需求不同,可能导致青稞大曲细菌丰度存在差异。乳酸菌为白酒发酵的重要功能微生物之一,可促进美拉德反应和白酒的发酵,维持与保护酿酒微生态,其合成的乳酸和醋酸是乳酸乙酯、乙酸乙酯等风味物质的前体,有利于增加白酒的浓厚度和丰富白酒的风味[17]。Saccharopolyspora在A曲中的丰度最高,为放线菌的一种,可合成酶类、维生素、纤维素促降解因子等,其在白酒发酵中的作用需进一步研究[18-21]。Staphylococcus在G、I和M曲中的丰度也较高,能够利用还原糖产酸,对大曲的风味有一定的贡献[16];芽孢杆菌(Bacillus)能够合成淀粉酶和蛋白酶,可分解某些大分子物质合成双乙酰,且与大曲中己酸乙酯的形成有关[22],但在各样本中的丰度较低,与吴树坤等[18]的研究相似。
2.3.2 不同青稞大曲真菌群落结构
大曲真菌群落组成(<1%合并为others)如图4所示,不同大曲中共检出14种优势真菌,且真菌组成差异明显,酵母菌(丰度31.45%~50.92%)和霉菌(丰度48.64%~66.81%)为B、C和D曲的优势真菌,霉菌(丰度73.22%~94.35%)为E、F、G、H和M曲的优势真菌,而酵母菌(丰度83.53%~95.36%)为A、I、J、K和L曲的优势真菌。添加麸皮、小麦和竹纤维有利于曲霉属(Aspergillus)的生长,后二者也有利于嗜热子囊菌属(Thermoascus)的生长,而熟料制曲不利于霉菌的生长。其次,添加麸皮和熟料制曲有利于酵母菌如假丝酵母属(Candida)、威克汉姆酵母属(Wickerhamomyces)、丝孢酵母属(Trichosporon)、葡萄牙棒孢酵母属(Clavispora)和Diutina等的生长,且随着麸皮量的减少,酵母菌的丰度增加。霉菌为好氧微生物,酵母菌为兼性厌氧微生物,对温度的耐受较弱[16]。随着麸皮、生小麦和竹纤维用量的增加,大曲疏松度增加,且添加竹纤维的疏松度最高,导致曲坯溶氧较高。因此,添加小麦和竹纤维营造的曲坯疏松度、溶氧环境可能有利于霉菌的生长。添加麸皮所营造的曲坯疏松度和溶氧环境可能有利于霉菌和酵母菌的生长。熟料大曲曲坯的黏度较大,疏松度和溶氧较低,有利于酵母菌的生长。因此,曲坯的疏松度、微氧环境及发酵温度对真菌的生长有较大的影响。不同配料导致曲坯疏松度、微氧环境和发酵温度变化存在差异,使得青稞大曲真菌组成差异显著。Thermonascus和Thermomyces为耐热真菌,产纤维素酶、淀粉酶、蛋白酶、β-葡聚糖酶和脂肪酶等酶类,对白酒发酵有重要作用[18]。Aspergillus能够合成纤维素酶、淀粉酶、蛋白酶、酯化酶、果胶酶和有机酸,也是白酒发酵的重要功能微生物[23]。酵母菌(Candida、Issatchenkia、Kodamaea、Wickerhamomyces、Clavispora、Trichosporon)主要合成乙醇、多元醇和酯类等,对白酒的产酒和生香有重要作用。有些酵母菌如Candida、Saccharomycopsis、Issatchenkia等也可分泌淀粉酶、蛋白酶或β-葡萄糖苷酶,分解原料中的大分子物质,为白酒风味物质的形成提供前体,有利于提高基础酒的品质[23]。

图4 不同青稞大曲的真菌群落结构
Fig.4 Fungal community of different highland barley Daqu
2.3.3 不同青稞大曲微生物群落差异性分析
微生物群落相似性热图如图5所示。细菌群落方面,M和G聚为一簇,其细菌群落相近,其余样品聚为一簇,它们的细菌群落相近,由于微生物如Acetobacter、Saccharopolyspora、Paracoccus、Carnobacterium、Chloroplast、Streptomyces、Sphingobacterium、Enterococcus和Corynebacterium等的丰度影响又聚为几小簇,C和D、E和H、B和F的细菌群落分别更相近,而I、J、K和L的更相近。同细菌群落分析一致,不同配料对青稞大曲细菌组成有影响但不显著。真菌群落方面,B、C、D、F、M、G、E和H聚为一簇,由于B的酵母菌丰度(50.92%)略高于霉菌丰度(48.64%),单独聚为一簇,而C和D的霉菌丰度(51.85%、66.81%)略高于酵母菌丰度(47.10%、31.45%),二者聚为另一小簇,F、M、G、E和H因霉菌丰度在73.22%~94.35%,聚为另一簇,E和H单独聚为一小簇,结果表明,B、C、D、F、M、G、E和H的真菌群落相近,C和D的更为相近,E和H的更为相近。A、I、J、K和L以酵母菌为最主要的优势真菌,聚为另一簇。同真菌群落分析一致,添加生小麦和竹纤维有利于霉菌的生长,添加麸皮和熟料制曲有利于酵母菌的生长,不同配料对青稞大曲真菌组成影响显著。

a-细菌;b-真菌
图5 不同青稞大曲细菌和真菌属水平上的热图
Fig.5 Bacterial and fungal heatmaps of different highland barley Daqu on genus level
2.4 不同青稞大曲微生物群落与酶活力相关性分析
计算酶活力与属水平丰度前18的细菌及前14的真菌的Pearson相关系数,绘制相关性热图,如图6所示。液化力与Thermoascus极显著相关,与Saccharopolyspora显著相关,与Lactobacillus、Chloroplast和Aspergillus呈一定的相关。糖化力与Saccharopolyspora极显著相关,与Lactobacillus、Chloroplast、Pediococcus、Thermoascus、Kodamaea、Aspergillus、Clavispora呈一定的相关。Thermoascus和Aspergillus均合成淀粉酶,Thermonascus在添加麸皮、小麦和竹纤维的大曲中的丰度较高,可产生更多的淀粉酶,大曲的糖化力和液化力较高。与Thermoascus相比,Aspergillus的丰度较低,可能导致其与糖化力和液化力相关性不显著。而熟料制曲不利于霉菌生长,Thermoascus的丰度很低,可能导致液化力和糖化力较低。Saccharopolyspora与糖化力和液化力显著相关,其在大曲中的功能报道较少,仍需进一步的研究。
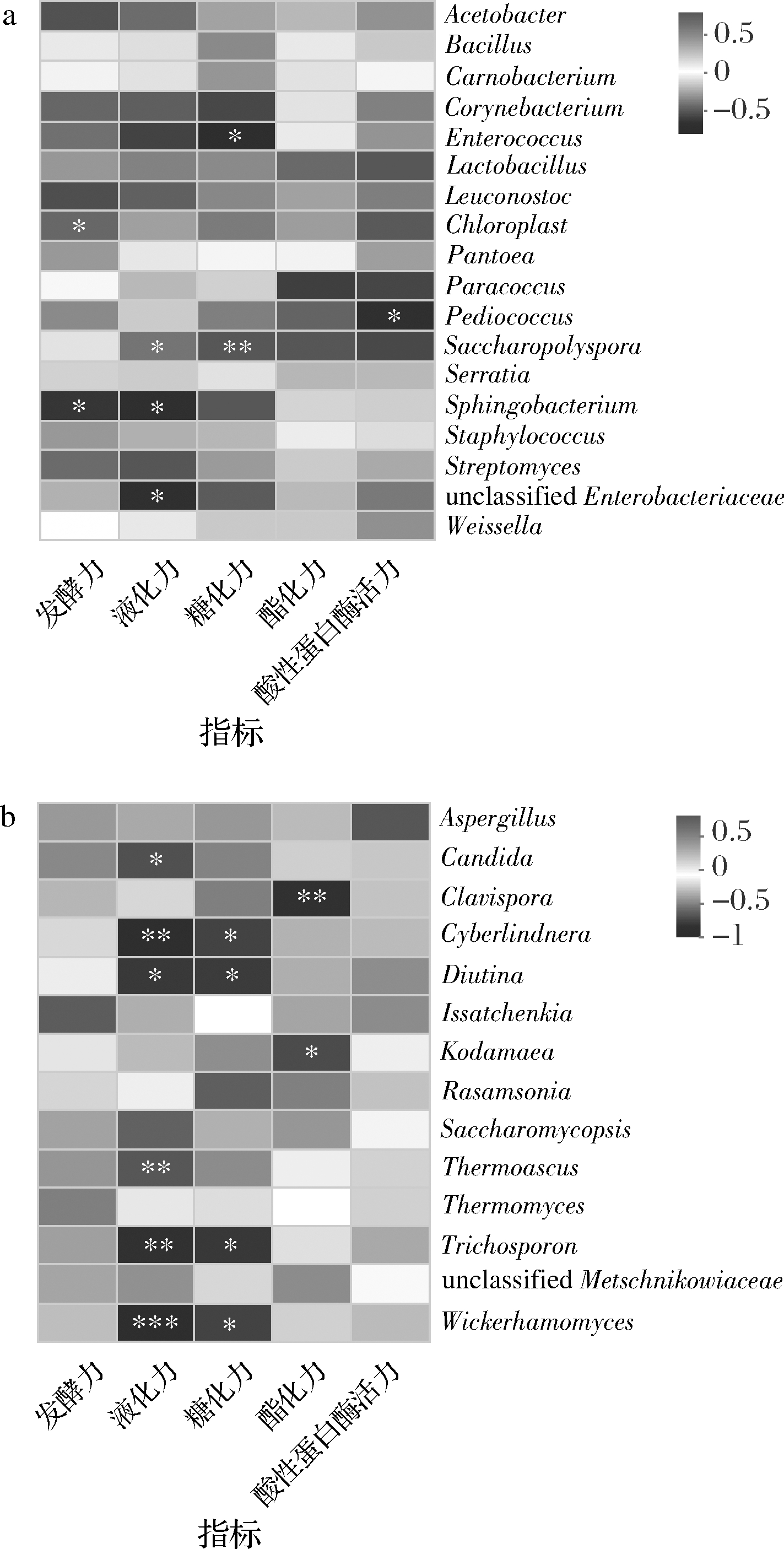
a-细菌;b-真菌
图6 不同青稞大曲细菌和真菌群落与酶活力的相关性分析
Fig.6 Correlation analysis between bacterial and fungal communities and enzyme activities of different highland barley Daqu
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
发酵力与Chloroplast显著相关,与Lactobacillus、Pantoea、Pediococcus、Thermoascus、Aspergillus、Thermomyces呈一定的相关,还与Kodamaea和Rasamsonia有一定的正相关,但相关系数略低于前述微生物。采用麦芽浸粉代替高粱粉糖化液测定的发酵力为糖化发酵力。添加麸皮、小麦和竹纤维的生料青稞大曲的糖化力和液化力较高,发酵时还原糖的含量高,有利于酵母菌增殖和代谢,呈现出较高的发酵力。熟料大曲的糖化力和液化力较低,虽然其酵母菌丰度高,但还原糖较低的情况下,酵母菌增殖和代谢缓慢,呈现出较低的发酵力。可能导致发酵力与酵母菌的相关性较差。Leuconostoc、Rasamsonia和Diutina与酯化力呈一定的相关性,酵母菌Rasamsonia的相关系数>0.50,较其余2种的相关系数高。微生物与酯化力的相关性并不显著,与李媛媛等[14]的研究结果一致,但具体原因需进一步研究。大曲中的酸性蛋白酶可能主要由细菌合成,酸性蛋白酶活力与细菌的相关系数远高于真菌相关系数。不同青稞大曲中各功能微生物丰度的差异以及微生物间的相互协同作用,可能导致其酶活力差异显著。
2.5 不同青稞大曲风味成分分析
大曲在白酒发酵中不仅起到提供菌源、糖化发酵和投粮的作用,还起到生香的作用。大曲的生香作用主要是醇酸酯化、前体物质转化及菌源生香得到大曲酒的主体香[8]。因此,分析大曲风味物质有利于初步判断酒曲的质量。大曲中风味物质的种类和含量如图7所示。风味物质种类方面,在A~M编号的13种大曲中分别检出56、49、47、51、47、49、56、45、55、47、53、47和56种风味物质。A、G和M曲的最多,其次为I曲和K曲,C、E、H、J和L曲的最少,可能与不同大曲中功能微生物的多样性差异有关。在含量方面,不同大曲风味物质的含量差异显著,K曲风味物质的含量最高,其次为M和A曲,F曲的含量最低。B、E、G和H曲的风味物质含量相近,与其功能微生物群落结构相似结果一致。大曲中的风味物质主要来源于微生物代谢合成,相似的微生物群落结构导致相应曲药中风味物质的含量相近。醇类、酯类和酮类为大曲中主要的风味物质,其他风味化合物的含量相对较低。如附表1https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CAPJ&dbname=CAPJLAST&filename=SPFX20210509009所示,正己醇、1-庚醇、2-乙 基-1-己醇、1-辛醇、苯乙醇、雪松醇、1-壬醇为大曲中的优势醇类,主要由酵母菌在厌氧条件下转化氨基酸和在有氧条件下转化糖类,或酵母主导的相应醛类的还原生成,较其他大曲,熟料大曲中酵母菌的丰度较高,可能导致这些醇类在熟料大曲中的含量相对较高,而酵母菌丰度的差异可能导致其他大曲中醇类的含量不同。大曲中的主要酯类为甲酯类,如棕榈酸甲酯、棕榈酸乙酯、油酸甲酯、亚油酸甲酯、肉豆蔻酸甲酯、十六碳烯酸甲酯、2,2,4-三甲基-1,3-戊二醇二丁酸酯,同YAN等[24]的研究一致,多数酯类在K曲和M曲中的含量高于其他大曲。酯类主要由微生物代谢产生和酸醇的酯化生成,熟料更有利于微生物的使用,酵母菌丰度和微生物的代谢差异可能导致大曲中酯类含量不同。2-己烯醛,壬醛、2,5-二羟基苯甲醛、苯甲醛、苯乙醛为主要的醛类组分,在不同大曲中的含量差异明显,但并未呈现一定的规律,可能与原料带来的发酵环境、营养物质的差异及微生物代谢活性和差异有关。2-辛酮为主要的酮类组分,赋予大曲蘑菇、土壤气息,随着麸皮、小麦、竹纤维含量的增加,其含量呈现下降的趋势,添加麸皮和熟料的大曲中含量较高。三甲基吡嗪和四甲基吡嗪为主要的含氮类化合物,且在熟料大曲中的含量较高。吡嗪类主要由氨基和羰基化合物间的美拉德反应以及微生物合成或转化乙偶姻、丙酮醇和氨基丙酮生成。原料经炒制后,更有利于淀粉、蛋白质的分解,为吡嗪的生成提供更多的氨基和羰基化合物,可能导致其吡嗪类化合物的含量较高。

a-种类;b-含量
图7 不同青稞大曲风味物质种类及含量
Fig.7 Types and contents of volatile compounds in different highland barley Daqu
3 结论
本文对不同配料青稞大曲的理化特性、微生物群落结构及风味组分进行了研究,结果表明,不同大曲的理化指标差异显著,添加麸皮有利于增加大曲的糖化力和发酵力,添加竹纤维和熟料制曲有利于增加大曲的酯化力和蛋白酶活力。其次,不同大曲的微生物群落结构差异显著,乳酸菌为主要的优势细菌,酵母菌和霉菌为优势真菌。不同配料对大曲中细菌群落有影响但不显著,对真菌群落结构的影响显著,可能与原料配比赋予大曲曲坯的疏松度、微氧环境和发酵温度差异及微生物的生长属性有关。不同大曲中各功能微生物丰度的差异以及微生物间的相互协同作用,可能导致各种酶活力差异显著。醇类、酯类和酮类为大曲中主要的风味物质,风味物质的差异可能与功能微生物的多样性及丰度有关,熟料制曲有利于风味物质的合成。因此,可根据发酵目的选择合适的大曲,要达到一个较好的糖化和液化效果,保证较好的出酒率,可选择添加麸皮的青稞大曲,而要获得酯香突出、香气丰富的清香型白酒,则可选择添加竹纤维的青稞大曲,也可对不同大曲进行搭配使用。
[1] FAN S S, TANG K, XU Y, et al.Characterization of the potent odorants in Tibetan Qingke Jiu by sensory analysis, aroma extract dilution analysis, quantitative analysis and odor activity values[J].Food Research International, 2020, 137:109349.
[2] 张志薇, 靳玉龙, 刘小娇, 等.传统青稞酒现状探究[J].西藏农业科技, 2020, 42(1):91-93.
ZHANG Z W, JIN Y L, LIU X J, et al.Study on status of traditional barley liquor[J].Tibet Journal of Agricultural Sciences, 2020, 42(1):91-93.
[3] GUO L X, LUO Y M, ZHOU Y, et al.Exploring microbial dynamics associated with flavours production during highland barley wine fermentation[J].Food Research International, 2020, 130:108971.
[4] 黄昊, 哈祖德, 顾京赛, 等.西藏传统青稞酒酿造用藏曲中主要酵母菌的分离及酿造特性研究[J].食品与发酵工业, 2021, 47(2):8-14.
HUANG H, HA Z D, GU J S, et al.Isolation of yeast strains from Zangqu of traditional Tibetan Qingke (highland barley) wine brewing and the oenological properties[J].Food and Fermentation Industries, 2021, 47(2):8-14.
[5] 袁亦舟, 张伟国, 徐建中.青稞酒曲微生物多样性分析及米根霉制曲条件优化[J].食品与发酵工业, 2018, 44(5):39-45.
YUAN Y Z, ZHANG W G, XU J Z.Investigation of the microbial diversity in highland barley Qu and optimization of the koji-making condition with Rhizopus oryzae[J].Food and Fermentation Industries, 2018, 44(5):39-45.
[6] 樊杉杉, 董雅君, 杨兴华, 等.不同地区来源藏曲对西藏传统酿造青稞酒风味特征的影响[J].食品与发酵工业, 2019, 45(2):7-14.
FAN S S, DONG Y J, YANG X H, et al.Effects of different Zangqu from different regions on the flavor of Tibetan traditional Qingke wine[J].Food and Fermentation Industries, 2019, 45(2):7-14.
[7] 刘冲冲, 冯声宝, 吴群, 等.青稞酒发酵过程中的风味功能微生物及其风味代谢特征解析[J].微生物学通报, 2020, 47(1):151-161.
LIU C C, FENG S B, WU Q, et al.Flavor-related microbiota and their flavor metabolism during highland barley Baijiu fermentation[J].Microbiology China, 2020, 47(1):151-161.
[8] 沈怡方. 白酒生产技术全书[M].北京:中国轻工业出版社, 1998:50-80.
SHEN Y F.Liquor Production Technology Book[M].Beijing:China Light Industry Press, 1998:50-80.
[9] 中华人民共和国工业和信息化部. QB/T 4257—2011酿酒大曲通用分析方法[S].北京:轻工业出版社,2012.
Ministry of Industry and Information Technology.QB/T 4257—2011 General analysis method of brewing Daqu[S].Beijing:China Light Industry Press, 2012.
[10] 国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 5009.5—2016食品中蛋白质的测定[S].北京:中国标准出版社, 2017.
National Health and Family Planning Commission of the People′s Republic of China, National Medical Products Administration.GB 5009.5—2016 Determination of protein in food[S].Beijing:China Standard Press, 2017.
[11] 国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 5009.6—2016食品中脂肪的测定[S].北京:中国标准出版社, 2017.
National Health and Family Planning Commission of the People′s Republic of China, National Medical Products Administration.GB 5009.6—2016 Determination of fat in food [S].Beijing:China Standard Press, 2017.
[12] 中华人民共和国国家质量监督检验检疫局, 中国国家标准化管理委员会.GB/T 28715—2012饲料添加剂酸性、中性蛋白酶活力的测定 分光光度法[S].北京:中国标准出版社, 2013.
The State Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, National Standardization Administration of China.GB/T 28715—2012 Determination of acidic and neutral protease activity in feed additives-Spetrophotometric method[S], Beijing:China Standard Press, 2013.
[13] FAN G S, FU Z L, TENG C, et al.Comprehensive analysis of different grades of roasted-sesame-like flavored Daqu[J].International Journal of Food Properties, 2019, 22(1):1 205-1 222.
[14] 李媛媛, 罗碧霞, 张兰兰, 等.不同粮食曲的理化特性及其微生物群落结构[J].食品与发酵工业, 2020, 46(10):74-79.
LI Y Y, LUO B X, ZHANG L L, et al.Research on physicochemical properties and microbial community structure of Daqu made from different grains[J].Food and Fermentation Industries, 2020, 46(10):74-79.
[15] 马茹菲, 马玉帛, 佟世生, 等.不同清香型大曲理化生化指标和挥发性成分分析[J].酿酒科技, 2019(3):70-75.
MA R F, MA Y B, TONG S S, et al.Physiochemical and biochemical indexes and volatile compounds of different Qingxiang Daqu[J].Liquor-Making Science & Technology, 2019(3):70-75.
[16] ZHANG L Q, WU C D, DING X F, et al.Characterisation of microbial communities in Chinese liquor fermentation starters Daqu using nested PCR-DGGE[J].World Journal of Microbiology & Biotechnology, 2014, 30(12):3 055-3 063.
[17] 梁晨, 杜海, 徐岩.大曲贮存过程中原核微生物群落结构及风味成分演替规律[J].微生物学通报, 2017, 44(2):384-393.
LIANG C, DU H, XU Y.The succession of procaryotic microbial community and the flavor components in the storage process of Daqu[J].Microbiology China, 2017, 44(2):384-393.
[18] 吴树坤, 谢军, 卫春会, 等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学, 2019, 40(14):144-152.
WU S K, XIE J, WEI C H, et al.Comparison of microbial community structure of starter cultures (Daqu) for Luzhou-flavor liquor in different regions of Sichuan[J].Food Science, 2019, 40(14):144-152.
[19] WU X Y, JING R X, CHEN W H, et al.High-throughput sequencing of the microbial diversity of roasted-sesame-like flavored Daqu with different characteristics[J].3 Biotech, 2020, 10(11):1-11.
[20] DENG L, MAO X, LIU D, et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Frontiers in Microbiology, 2020,11:588117.
[21] WANG Y R, CAI W C, WANG W P, et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Science & Nutrition, 2021, 9(2):1 003-1 016.
[22] HE G Q, DONG Y, HUANG J, et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT, 2019, 111:1-8.
[23] 李静心, 王艳丽, 何宏魁, 等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业, 2018, 44(12):52-59.
LI J X, WANG Y L, HE H K, et al.High-throughput sequencing revealed fungal community structures at high temperature Daqu and medium temperature Daqu[J].Food and Fermentation Industries, 2018, 44(12):52-59.
[24] YAN S B, TONG Q Q, GUANG J Q.Yeast dynamics and changes in volatile compounds during the fermentation of the traditional Chinese strong-flavor Daqu[J].LWT, 2019, 106:57-63.

