葡萄酒酒精发酵过程中,酿酒酵母(Saccharomyces cerevisiae)将糖转化为酒精和CO2的同时,还可产生醇、酯、酮、醛、酸等多种挥发性次级代谢产物,构成了葡萄酒的主要香气成分[1-2]。酵母多糖作为良好的发酵助剂,可以明显提升酒体香气品质,改善口感,并具有使用便捷、可控、通用性较强等特点[3]。甘露聚糖作为酵母细胞壁的主要成分,其蛋白端通过与酒体中香气物质作用,可以增加香气的稳定性,提高葡萄酒香气持久性[4]。JUEGA等[5]将甘露聚糖添加到经3株酿酒酵母(W1、W2、W3)发酵的阿尔巴利诺葡萄酒中,发现不同酒样中的挥发性香气成分存在一定差异,其中W1葡萄酒中挥发性物质含量最高,尤其是萜烯类物质香叶醇和芳樟醇等含量明显增加。尹宁宁等[6]研究指出,外源性添加300 mg/L的甘露聚糖,可使蛇龙珠干红葡萄酒样中酯类和萜稀类物质含量分别提高25.2%、50%,酸类物质含量降低7.5%。甘露聚糖(150 mg/L)也可以通过与葡萄酒中的部分香气物质结合降低其挥发性[7]。RIBERIRO等[8]、门颖[9]在干白葡萄酒中添加200 mg/L的甘露聚糖,可以提高其感官评分。酵母多糖除甘露聚糖(35%)外,还包括不溶性的β-葡聚糖(50%~60%),可被广泛应用于食品、药物、化妆品和化学工业等各个领域[10-12]。然而,β-葡聚糖的低水溶性限制了其应用效果和范围[13]。为了进一步促进其实际生产应用,研究者采用生物酶解[14-15]、氧化降解等[16]方法,将β-葡聚糖裂解为聚合度较低的低聚糖,从而增加其水溶性,同时保持较高的生物活性及抗氧化功能。但关于β-葡聚糖在葡萄酒酿造中的相关研究未见报道。
本研究以霞多丽(Chardonnay)酿酒葡萄为原料,在酒精发酵前外源性添加不同质量浓度的水溶性β-葡聚糖,利用顶空固相微萃取结合气相色谱质谱联用技术(headspace solid phase micro-extraction combined with gas chromatography-mass,HS-SPME/GC-MS)检测发酵酒样中的挥发性香气化合物,探讨其对霞多丽干白葡萄酒香气品质的影响,以期为水溶性β-葡聚糖在葡萄酒酿造生产应用提供理论依据。
1 材料与方法
1.1 材料与试剂
霞多丽酿酒葡萄,2020年9月采自甘肃武威莫高酿酒葡萄种植基地,还原糖含量240 g/L,总酸含量6.47 g/L(以酒石酸计)。
Arome White酿酒酵母(S.cerevisiae),意大利Enartis公司;水溶性β-葡聚糖SG 90,安琪酵母股份有限公司;2-辛醇(色谱纯),美国Sigma公司;L-苹果酸、纤维二糖、肌醇、维生素B1、维生素B6、生物素等均为国产分析纯,上海源叶生物科技有限公司;柠檬酸、MgSO4、MnSO4、酒石酸氢钾、偏重亚硫酸钠、(NH4)2HPO4、无水葡萄糖、KH2PO4、K2SO4等常规试剂均为国产分析纯,天津光复化工研究所。
1.2 仪器与设备
TRACE 1310-ISQ气相色谱-质谱联用仪,美国Thermo Scientific公司;SPME手动进样手柄、50/30 μm DVB/CAR/PDMS萃取头,上海安谱科学仪器有限公司;PHS-3C精密pH计,上海仪电科学仪器股份有限公司;DK-S12电热恒温水浴锅,上海森信实验仪器有限公司;HX502T型电子天平,慈溪市天东衡器厂。
1.3 实验方法
1.3.1 模拟葡萄汁的配制
模拟葡萄汁的配制参考马腾臻[17]的方法。模拟 汁成分(mg/L):葡萄糖220 000、纤维二糖200、(NH4)2HPO4 1 500、KH2PO4 750、K2SO4 500、7H2O·MgSO4 250、 CaCl2 0.117、NaCl 200、L-苹果酸300、柠檬酸200、酒石酸氢钾2 500、偏重亚硫酸钠80、肌醇20、维生素B5 15、维生素B1 0.25、维生素B6 0.25、生物素0.003、维生素B3 2。
1.3.2 酿酒酵母菌株活化
按产品说明书推荐方法对Arome White酿酒酵母菌株进行活化。将活性干酵母溶于10倍体积无菌水中,37 ℃静置20 min,再加入等体积的霞多丽葡萄澄清汁,28 ℃活化25 min,备用接种。
1.3.3 水溶性β-葡聚糖对酿酒酵母菌株生物量的影响
参考王安娜[18]的方法。在2 L的模拟葡萄汁(2.5 L棕色罐)中分别添加不同质量浓度(100、200、300、400、500 mg/L)的水溶性β-葡聚糖,以未添加水溶性β-葡聚糖为对照组(CK),按0.2 g/L接种酿酒酵母,25 ℃培养箱控温培养。每隔24 h测定模拟汁中酵母细胞的生物量(OD600),绘制酿酒酵母菌株生长曲线,比较不同质量浓度的水溶性β-葡聚糖对酿酒酵母菌株生长的影响差异。每个样品设置平行3组,结果取平均值。
1.3.4 葡萄酒微酿实验
葡萄酒酒精发酵工艺如下:
霞多丽酿酒葡萄→筛选、除梗、破碎、除去皮渣→加40 mg/L SO2、20 mg/L果胶酶→低温澄清48 h(4 ℃) →倒灌→澄清汁置于2.5 L棕色发酵罐(添加水溶性β-葡聚糖)→接种酿酒酵母→25 ℃ 恒温发酵→残糖<4 g/L时结束酒精发酵
待酒精发酵结束后,分别取待测酒样于50 mL离心管中,于-20 ℃密封保存待测基本理化指标及挥发性香气化合物,每组处理重复3次。
1.3.5 基本理化指标的测定
参照GB 5009.237—2016《葡萄酒、果酒通用分析方法》的方法进行测定[19]。
1.3.6 挥发性香气成分分析
参照祝霞等[20]的香气物质萃取方法及GC-MS条件,并略作修改。各发酵酒样重复测定3次。
1.3.6.1 香气成分富集
取8 mL待测酒样加入15 mL顶空瓶中,同时添加2.5 g NaCl、10 μL 2-辛醇(质量浓度为81.06 mg/L),加磁力搅拌转子后封口膜封口并摇匀,放入恒温加热磁力搅拌器中,40 ℃水浴平衡30 min,然后插入萃取针(旋出萃取头)顶空萃取30 min。
1.3.6.2 GC-MS条件
GC条件:色谱柱DB-WAX 60 m×2.5 mm×0.25 μm,进样口温度240 ℃,传输线温度230 ℃,离子源温度250 ℃,不分流进样;载气(He)流速1 mL/min;进样时间5 min;柱温升温程序:40 ℃保持5 min,以3.5 ℃/min升至180 ℃,保持15 min。
MS条件:电子轰击离子源;电子能量70 eV;传输线温度180 ℃;离子源温度200 ℃;质谱扫描范围50~350 m/z。
定性定量分析:通过NIST-11、Wiley及香精香料谱库对香气化合物质谱图进行初步检索比对,并结合人工图谱解析进行定性分析,确认各个香气物质的化学成分。对已有标准品的高级醇、酯类和萜烯类等化合物,利用标准曲线(R2>0.995)定量,无标准品的化合物采用化学结构、官能团相似、碳原子数相近的标准物质进行半定量。
1.4 感官评价
感官评价参照GB/T 15037—2006[21]及祝霞等[20]的方法,对酒样进行感官评价。所有酒样进行随机编号,并由10名具有一定葡萄酒品尝经验或经过专业培训的人员(男、女各5人)对酒样进行感官评定。分别从外观(澄清度、颜色强度),香气(花香、果香、甜味、脂肪味)和风味(酸度、浓郁度、余味长短、平衡感)共10个方面对酒样进行评价,使用10分结构化数值进行量化。0~10分表示感官逐渐增强。
1.5 数据处理及分析
香气物质数据作图用Excel 2010和Origin 2018软件。结果用平均值和标准误表示,并用SPSS 19.0进行主成分分析以及Duncan′s多重差异显著性分析(P< 0.05)。
2 结果与分析
2.1 水溶性β-葡聚糖对酿酒酵母生物量的影响
由图1可知,随着水溶性β-葡聚糖添加量的增加,Arome White酿酒酵母的生长速率呈现先增加后降低的趋势。酒精发酵3 d后,酵母的生长趋于稳定;在发酵至第7 天时,酿酒酵母的OD600值由大到小依次为300 mg/L(2.509)>400 mg/L(2.461)>500 mg/L(2.398)>200 mg/L(2.271)>100 mg/L(2.221)>CK(2.046),与对照组相比,分别提高了22.68%、20.28%、17.20%、11.00%、8.55%。其中300 mg/L的OD600值最大,分别是100、200 mg/L的1.13和1.10倍。 综合分析,在模拟汁酒精发酵时添加水溶性β-葡聚糖有利于Aroma White酿酒酵母菌株的生长,且添加量为300、400、500 mg/L时效果更好,因此选择这3个质量浓度进行香气化合物分析检测。

图1 水溶性β-葡聚糖对酿酒酵母生物量的影响
Fig.1 Effects of water-soluble β-glucan on the biomass of S.cerevisiae strains
2.2 发酵酒样基本理化指标
由表1可知,对照组(CK)的酒精度最高;300 mg/L 处理组葡萄酒的总酸和挥发酸含量显著低于CK(P<0.05)。4个处理组葡萄酒的色度间存在显著差异,其中300 mg/L处理组酒样色度值最低(0.38),较对照降低了79.3%(P<0.05)。酵母多糖可以“包裹”酒中的多酚,降低其与单宁的作用,在某种程度上增加葡萄酒抗氧化的能力,从而间接的保护了葡萄酒的色泽稳定[22-23]。综合分析,各处理组发酵酒样理化指标均符合GB/T 15037—2006的要求[21]。
表1 酒样基本理化指标
Table 1 Basic physicochemical composition of wine samples
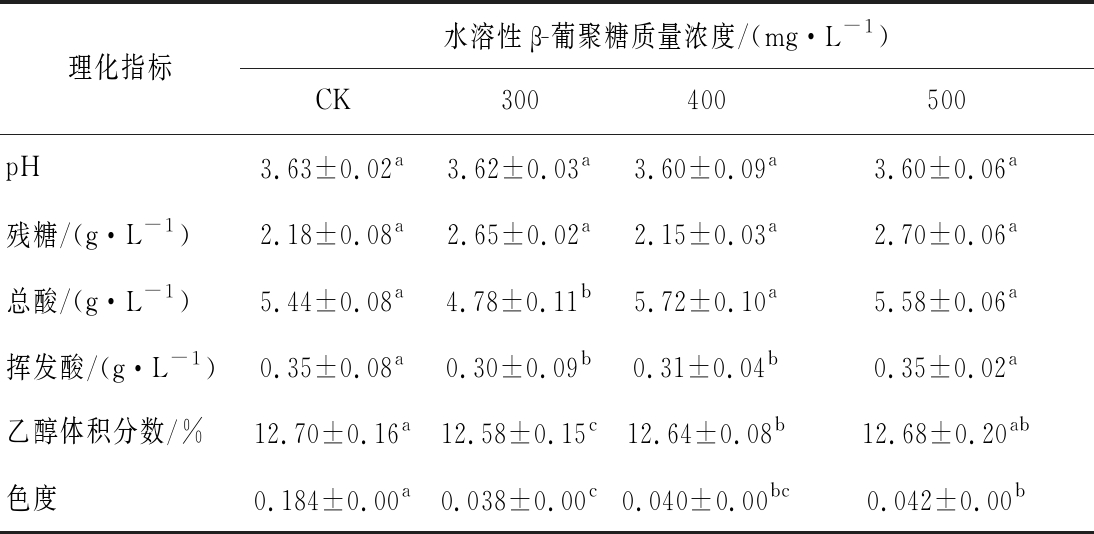
注:表中同一指标不同字母表示差异显著,样本量n=3(P<0.05)
理化指标水溶性β-葡聚糖质量浓度/(mg·L-1)CK300400500pH3.63±0.02a3.62±0.03a3.60±0.09a3.60±0.06a残糖/(g·L-1)2.18±0.08a2.65±0.02a2.15±0.03a2.70±0.06a总酸/(g·L-1)5.44±0.08a4.78±0.11b5.72±0.10a5.58±0.06a挥发酸/(g·L-1)0.35±0.08a0.30±0.09b0.31±0.04b0.35±0.02a乙醇体积分数/%12.70±0.16a12.58±0.15c12.64±0.08b12.68±0.20ab色度0.184±0.00a0.038±0.00c0.040±0.00bc0.042±0.00b
2.3 霞多丽干白葡萄酒香气成分检测
不同处理组酒样的主要香气物质GC-MS检测结果如图2所示。酒样共检测出69种香气化合物,其中酯类35种,醇类20种,酸类5种,萜烯类3种,醛酮类6种。由表2可知,对照组(CK)检出63种香气化合物,总含量为26.22 mg/L,水溶性β-葡聚糖添加组(300、400、500 mg/L)分别检测出64、63、64种香气物质,总量依次为53.71、49.66、45.15 mg/L。
2.3.1 酯类化合物
酯类物质是酒精发酵过程中产生的主要次级代谢产物,分为乙酸酯、脂肪酸乙酯和其他酯类,对葡萄酒的花果香气具有重要贡献[24-25]。由图2可知,酯类物质含量随水溶性β-葡聚糖浓度的增加呈先增加后降低的趋势。其中300 mg/L添加组共检出32种酯类物质,含量是对照组的2.10倍(34.55 mg/L),其次为400、500 mg/L水溶性β-葡聚糖添加组,含量和种类都为(33.14 mg/L,32种)。
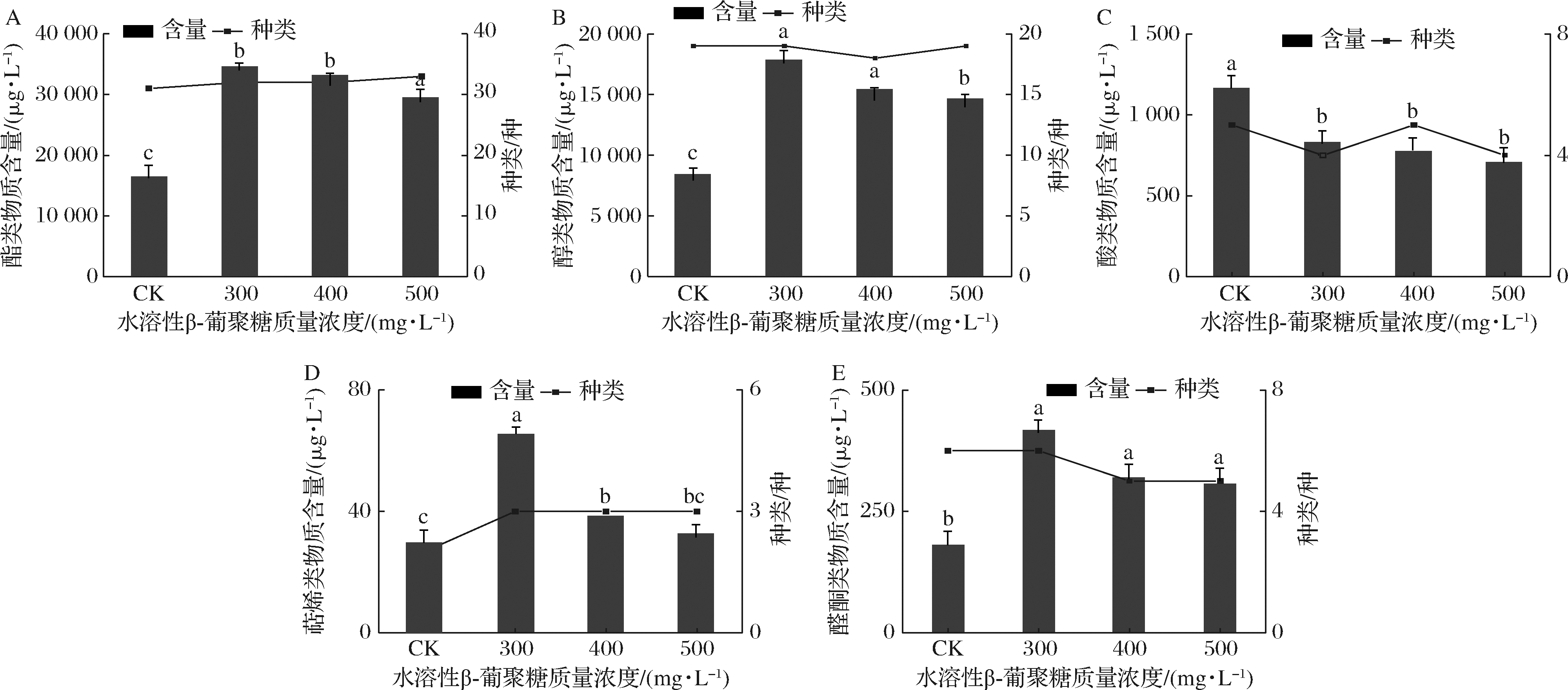
A-酯类物质;B-醇类物质;C-酸类物质;D-萜烯类物质;E-醛酮类物质
图2 不同处理葡萄酒香气化合物的含量和种类
Fig.2 Content and variety of aroma compounds in wines with different treatments
实验共检出9种乙酸酯。添加水溶性β-葡聚糖可显著增加葡萄酒中乙酸酯类物质总量,当添加量为300 mg/L时,含量最高(11.46 mg/L),是对照组的1.93倍。其中乙酸乙酯、乙酸异戊酯、乙酸苯乙酯、乙酸己酯的气味活性值(odor activity value,OAV)>0.1。乙酸乙酯是葡萄酒中重要的香气物质,其含量低于150 mg/L能够增加葡萄酒香气的复杂性,各处理组中乙酸乙酯的含量为0.55~1.14 mg/L,其中300 mg/L添加组中乙酸乙酯的含量最高,是CK的1.66 倍。乙酸异戊酯和乙酸己酯能够为葡萄酒带来香蕉和梨等香气,300 mg/L添加组中这2种酯类物质的含量最高,分别为6.67、1.31 mg/L。 乙酸苯乙酯在各处理组之间均存在显著差异(P<0.05),且300 mg/L水溶性β-葡聚糖添加组的含量最高,与CK相比,增加了38.46%。
实验共检测出13种脂肪酸乙酯,是酯类物质中种类最多,含量最高的物质。由图2可知,300和400 mg/L 水溶性β-葡聚糖添加组的脂肪酸乙酯含量较高,分别是CK组的2.20和2.35倍。其中,癸酸乙酯(果香,脂肪味)、辛酸乙酯(果香,茴香味)、己酸乙酯(香蕉,青苹果味)、丁酸乙酯(香蕉,菠萝味)等脂肪酸乙酯的OAV>0.1,赋予葡萄酒更浓郁的果香品质。
2.3.2 高级醇类化合物
葡萄酒中的高级醇含量低于300 mg/L时,对葡萄酒香气具有积极的作用[26]。实验共检出20种高级醇类化合物,其中300 mg/L水溶性β-葡聚糖添加组的醇类物质含量最高(17.85 mg/L),是对照组的2.12倍,400、500 mg/L添加组的高级醇类化合物含量分别为15.38、14.64 mg/L,分别是对照组的1.83和1.74倍。正戊醇、正辛醇和苯乙醇的OAV>0.1。正戊醇为葡萄酒带来杂醇味等独特气味,其中300 mg/L 处理组中含量最高(6.13 mg/L),是CK的1.66倍。
2.3.3 酸类化合物
酸类物质大部分来源于酵母菌和乳酸菌代谢的副产物[27]。实验共检出5种酸类化合物,由图2-C可知,添加水溶性β-葡聚糖显著降低了葡萄酒中酸类物质含量(P<0.05),500 mg/L添加组的酸类物质含量最低(0.70 mg/L),与对照组相比,降低了40.17%。 300、400 mg/L添加组的酸类物质含量分别为0.83、0.78 mg/L,分别比对照组降低了29.06%和33.33%。所检测到的5种酸类物质中,辛酸的含量比对照组降低了7.4%~19.5%,有利于减轻葡萄酒的酸败味和脂肪味。
2.3.4 萜烯类化合物
酒样中共检测出香茅醇、芳樟醇和大马士酮3种萜烯类物质。其中300 mg/L处理组的萜烯类物质总量最高(0.065 mg/L),是CK组的2.27倍。其次为300、400 mg/L处理组,分别比对照组提升了33.21%和12.31%。芳樟醇和大马士酮含量为0.014、0.022 mg/L,相比于CK组分别提升了9.7%、36.8%,能够为葡萄酒提供一定的玫瑰花香和甜香[28-29]。
2.4 香气成分的主成分分析
由于酒样中检测到的挥发性香气物质种类繁多,含量差异较大。为综合分析添加不同质量浓度水溶性β-葡聚糖的产香特征,故对香气化合物中OAV>0.1的物质进行主成分分析(principal component analysis,PCA),并以特征值大于1进行主成分抽提,得到PC1和PC2贡献率分别为52.916%和28.586%。 2个主成分累计解释总方差81.503%,即这2个主成分能基本反映原数据全部的变异(图3、图4)。
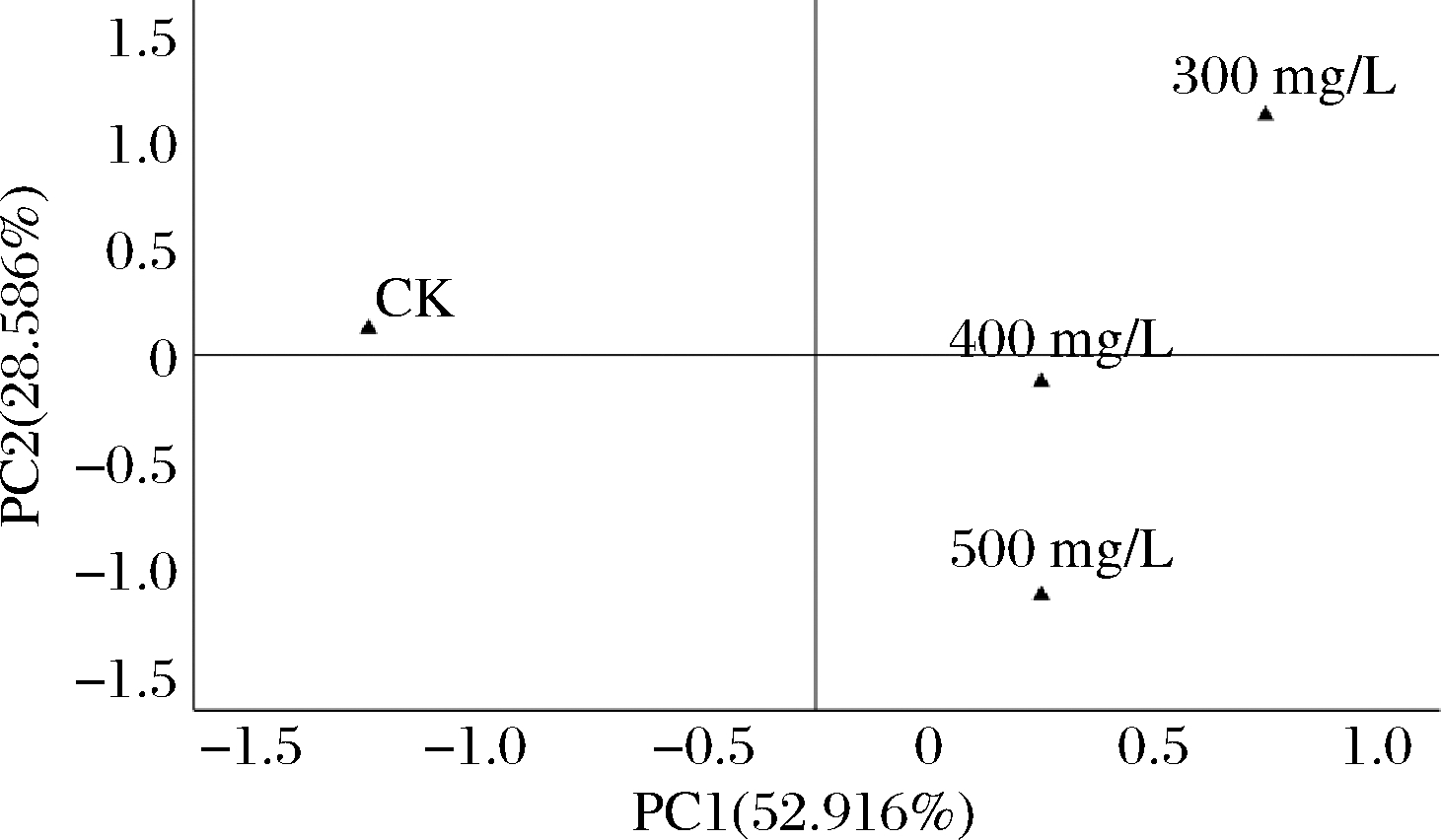
图4 香气化合物PCA的样品分布图
Fig.4 Score plot of PCA for volatile aroma compounds
由图3可知,乙酸苯乙酯(花果香)、乙酸己酯(果香)、辛酸乙酯(果香)、苯乙醇(玫瑰香,花香)、乙酸乙酯(香蕉味,果香)等物质在PC1正半轴上的得分较高,即反映了葡萄酒中的花香和果香特征;异丁酸(脂肪味)、辛酸(奶油味)、丁酸(奶酪味)等物质在PC1负半轴的得分较高,即反映了脂肪味等不良的香气特征;芳樟醇(柑橘味,果香)、大马士酮(花香)等物质在PC2正半轴得分较高,即反映了花果香等香气特征;癸醛(柑橘味,果香)、丁酸乙酯(香蕉,果香)、己酸乙酯(青苹果,果香)等物质在PC2负半轴得分较高,即反映了果香等香气特征。

图3 香气化合物主成分分析的因子载荷图
Fig.3 Factor loading plot for PCA of volatile aroma compounds
由图4可知,处理组酒样的香气特征可在这2个主成分所形成的二维平面上被很好地分开,其中300 mg/L 处理组在PC1、PC2正半轴有较高得分,主要体现了脂肪酸乙酯和乙酸酯类物质的香气信息,因而其酒样的花香、果香特征突出;400、500 mg/L处理组酒样香气特征相似,均在PC1正半轴有较高得分,但PC2得分较低,该区域突出的香气特征是花香以及微弱的果香味。CK分布在PC1的负半轴区域,该区域最突出的香气特征是脂肪味,且CK处理酒样与其他处理组差异较大。综合分析可知,酒精发酵前添加水溶性β-葡聚糖有利于改善葡萄酒香气品质单一、特点不突出等问题。
2.5 感官评价结果
由图5可知,添加不同质量浓度的水溶性β-葡聚糖对葡萄酒感官评价的影响不同。CK组酒样中,除澄清度评分较高外,其余指标评分均较低。从香气(花香、果香、甜味、脂肪味)方面分析,添加水溶性β-葡聚糖能明显增强酒样的花香、果香和甜味特征,降低酒样的脂肪味。整体来看,与CK组相比,添加水溶性β-葡聚糖更有利于提升葡萄酒的果香和花香特征,特别是300 mg/L处理组,可显著改善葡萄酒的香气特征。
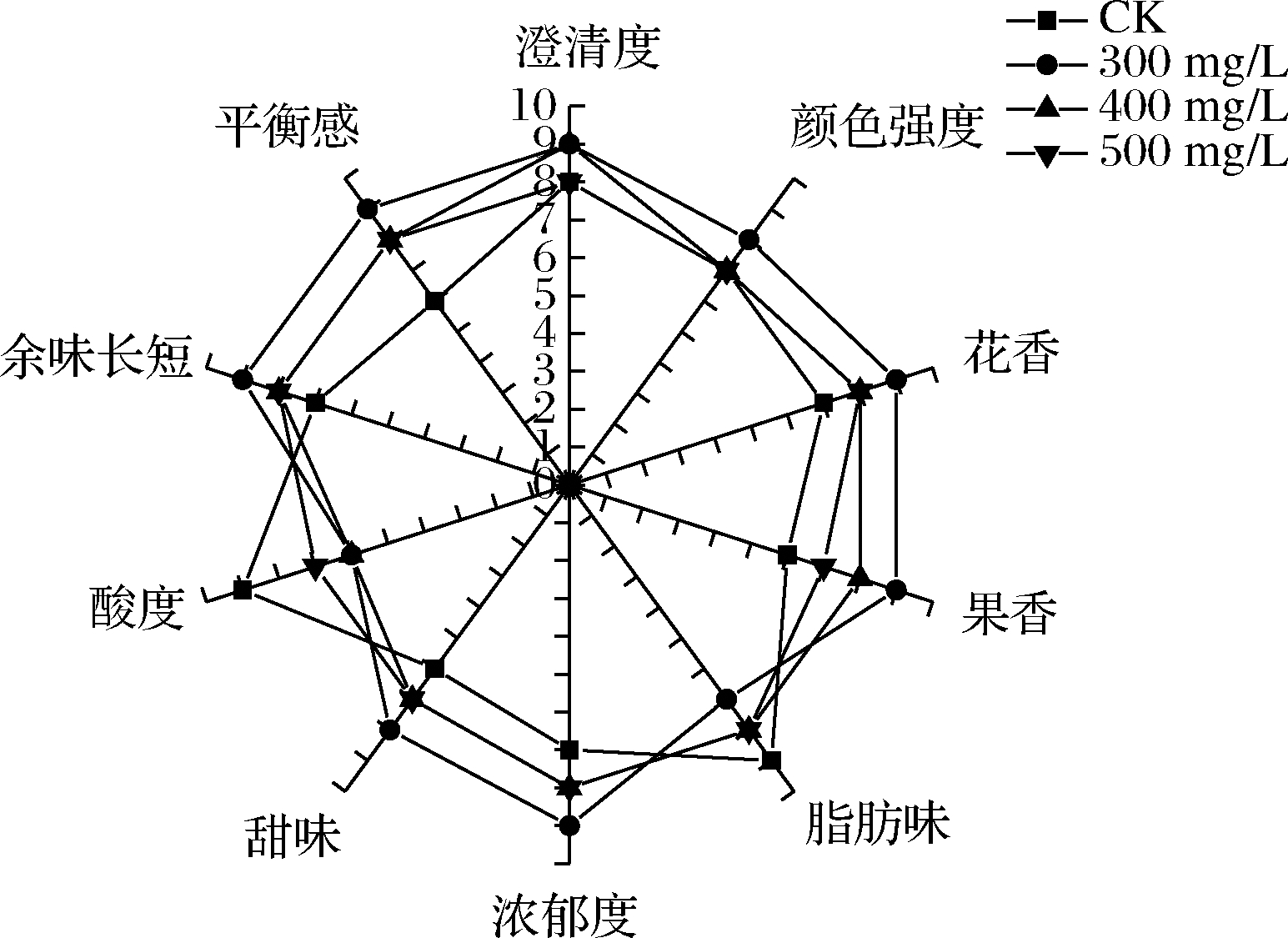
图5 霞多丽干白葡萄酒感官分析雷达图
Fig.5 Radar map for sensory analysis of Chardonnay dry white wine
3 结论
实验以霞多丽酿酒葡萄为原料,利用HS-SPME/GC-MS检测外源性添加不同质量浓度的水溶性β-葡聚糖,对发酵酒样中挥发性香气化合物的影响。结果显示,水溶性β-葡聚糖能显著增加葡萄酒中香气物质的含量(P<0.05);其中添加300 mg/L的水溶性β-葡聚糖能够显著促进葡萄酒中醇、酯类物质的合成;主成分分析结合感观分析结果表明,与对照组和其他处理组相比,300 mg/L组葡萄酒的花香和果香特征明显增强提高了葡萄酒的感官品质。研究结果可为提升霞多丽干白葡萄酒香气品质提供理论支持,但其对葡萄酒发酵香气的影响机制还有待进一步研究。
[1] 原苗苗, 赵新节, 孙玉霞.低温对葡萄酒香气成分和酵母代谢的影响[J].食品与发酵工业, 2017, 43(12):268-276.
YUAN M M, ZHAO X J, SUN Y X.The effects of low temperature on wine aroma compounds and yeast metabolism[J].Food and Fermentation Industries, 2017, 43(12):268-276.
[2] IORIZZO M, TESTA B, LOMBARDI S J, et al.Selection and technological potential of Lactobacillus plantarum bacteria suitable for wine malolactic fermentation and grape aroma release[J].LWT, 2016, 73:557-566.
[3] DEL BARRZO-GAL N R,
N R, ![]() GIL M, et al.Evaluation of yeast derivative products developed as an alternative to lees:The effect on the polysaccharide, phenolic and volatile content, and colour and astringency of red wines[J].Molecules, 2019, 24(8):1 478-1 485.
GIL M, et al.Evaluation of yeast derivative products developed as an alternative to lees:The effect on the polysaccharide, phenolic and volatile content, and colour and astringency of red wines[J].Molecules, 2019, 24(8):1 478-1 485.
[4] DIAKO C, MCMAHON K, MATTINSON S, et al.Alcohol, tannins, mannoprotein and their interactions influence the sensory properties of selected commercial merlot wines:A preliminary study[J].Journal of Food Science, 2016, 81(8):2 039-2 048.
[5] JUEGA M, NUNEZ Y P, CARRASCOSA A V, et al.Influence of yeast mannoproteins in the aroma improvement of white wines[J].Journal of Food Science, 2012, 77(8):499-504.
[6] 尹宁宁, 许引虎, 李敏, 等.不同酵母多糖对蛇龙珠干红葡萄酒品质的影响[J].食品与生物技术学报, 2018, 37(6):646-654.
YIN N N, XU Y H, LI M, et al.Effect of yeast polysaccharide on the quality of wine Cabernet Gernischt dry red[J].Journal of Food Science and Biotechnology, 2018, 37(6):646-654.
[7] CHALIER P, ANGOT B, DELTEIL D, et al.Interactions between aroma compounds and whole mannoprotein isolated from Saccharomyces cerevisiae strains[J].Food Chemistry, 2007, 100(1):22-30.
[8] RIBEIRO T, FERNANDES C, NUNES F M, et al.Influence of the structural features of commercial mannoproteins in white wine protein stabilization and chemical and sensory properties[J].Food Chemistry, 2014, 159:47-54.
[9] 门颖. 酵母甘露糖蛋白对葡萄酒品质影响的研究[D].济南:齐鲁工业大学, 2015.
MEN Y.Study on the effect of yeast mannose glycoprotein on the quality of wine[D].Jinan:Qilu University of Technology, 2015.
[10] RIEDER A, BALLANCE S, BÖCKER U, et al.Quantification of 1, 3-β-D-glucan from yeast added as a functional ingredient to bread[J].Carbohydrate Polymers, 2018, 181:34-42.
[11] SALGADO M, SANTOS F, RODR GUEZ-ROJO S, et al.Development of barley and yeast β-glucan aerogels for drug delivery by supercritical fluids[J].Journal of CO2 Utilization, 2017, 22:262-269.
GUEZ-ROJO S, et al.Development of barley and yeast β-glucan aerogels for drug delivery by supercritical fluids[J].Journal of CO2 Utilization, 2017, 22:262-269.
[12] GUO W Y, GU X L, TONG Y Q, et al.Protective effects of mannan/β-glucans from yeast cell wall on the deoxyniyalenol-induced oxidative stress and autophagy in IPEC-J2 cells[J].International Journal of Biological Macromolecules, 2019, 135:619-629.
[13] KHAN A A, GANI A, MASOODI F A, et al.Structural, thermal, functional, antioxidant & antimicrobial properties of β-D-glucan extracted from baker′s yeast (Saccharomyces cereviseae)-effect of γ-irradiation[J].Carbohydrate Polymers, 2016,140:442-450.
[14] 杨学山, 祝霞, 李颍, 等.葡萄酒泥酵母制备水溶性β-D-葡聚糖工艺优化及其纯化后抗氧化性分析[J].食品科学, 2016, 37(14):24-31.
YANG X S, ZHU X, LI Y, et al.Purification and antioxidant activities of water-soluble β-D-glucan from waste wine yeast[J].Food Science, 2016, 37(14):24-31.
[15] ZHENG Z M, HUANG Q L, LUO X G, et al.Effects and mechanisms of ultrasound and alkali assisted enzymolysis on production of water-soluble yeast β-glucan[J].Bioresource Technology, 2019, 273:394-403.
[16] 王珊珊, 蔡超, 郝杰杰, 等.水溶性酵母β-葡聚糖的制备及免疫活性评价[J].高等学校化学学报, 2019, 40(9):1 873-1 880.
WANG S S, CAI C, HAO J J, et al.Preparation and immunological activity evaluation of water-soluble β-glucan from Saccharomyces cerevisiae[J].Chemical Journal of Chinese Universities, 2019, 40(9):1 873-1 880.
[17] 马腾臻. ‘蛇龙珠’葡萄酒酒精发酵过程中品种香气释放调控研究[D].兰州:甘肃农业大学, 2015.
MA T Z.Release of varietal aroma compounds during alcoholic fermentation of Cabernet Gernischt wine[D].Lanzhou:Gansu Agricultural University, 2015.
[18] 王安娜. 酵母多糖在葡萄酒生产中的应用研究[D].杨凌:西北农林科技大学, 2013.
WANG A N.Effect of commercial yeaste polysaccharides in wine production as an additive agengt[D].Yangling:Northwest A&F University, 2013.
[19] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社, 2006.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, China National Standardization Management Committee.GB/T 15038—2009 General analysis methods for wine and fruit wine [S].Beijing:China Standards Press, 2006.
[20] 祝霞, 王媛, 刘琦, 等.混菌发酵对贵人香低醇甜白葡萄酒的香气影响[J].食品与发酵工业, 2019, 45(4):95-102.
ZHU X, WANG Y, LIU Q, et al.Effects of co-fermentation on the aroma of Italian Riesling low-alcohol sweet white wine[J].Food and Fermentation Industries, 2019, 45(4):95-102.
[21] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 15037—2006 葡萄酒[S].北京:中国标准出版社, 2008.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, China National Standardization Management Committee.GB/T 15037—2006 Wine[S].Beijing:China Standards Press, 2008.
[22] 葛正凯, 黄倩, 李洁, 等.不同抗氧化剂对白葡萄酒品质的影响[J].中国酿造, 2020,39(10):136-144.
GE Z K, HUANG Q, LI J.et al.Effect of different antioxidant on white wine quality[J].China Brewing, 2020,39(10):136-144.
[23] 朱力, 王显苏, GUERRAND D, 等.酵母多糖有效改善葡萄酒的整体口感和品质-葡萄酒中的多糖和酵母多糖的作用[J].中外葡萄与葡萄酒, 2005(3):60-63.
ZHU L, WANG X S, GUERRAND D, et al.The role of yeast polysaccharides in improving wine tasting and quality [J].Chinese and Foreign Grape and Wine, 2005(3):60-63.
[24] ZHANG B Q, LUAN Y, DUAN C Q, et al.Use of Torulaspora delbrueckii co-fermentation with two Saccharomyces cerevisiae strains with different aromatic characteristic to improve the diversity of red wine aroma profile[J].Frontiers in Microbiology, 2018, 9:606-615.
[25] 王媛, 祝霞, 杨学山, 等.混菌发酵对美乐低醇桃红葡萄酒香气的影响[J].核农学报, 2018, 32(11):2 195-2 207.
WANG Y, ZHU.X, YANG X S, et al.Effects of co-fermentation on volatile compounds of Merlot low alcohol rose wine[J].Journal of Nuclear Agricultural Sciences, 2018, 32(11):2 195-2 207.
[26] FIA G, MILLARINI V, GRANCHI L, et al.Beta-glucosidase and esterase activity from Oenococcus oeni:screening and evaluation during malolactic fermentation in harsh conditions[J].LWT, 2018, 89:262-268.
[27] 杨学山, 刘琦, 段卫朋, 等.不同浸渍工艺对贵人香干白葡萄酒香气品质的影响[J].核农学报, 2020, 34(10):2 271-2 279.
YANG X S, LIU Q, DUAN W P, et al.Effect of different maceration process on aroma quality of Italian Riesling dry white wine[J].Journal of Nuclear Agricultural Sciences, 2020, 34(10):2 271-2 279.
[28] S NCHEZ-PALOMO E, G
NCHEZ-PALOMO E, G MEZ GARC
MEZ GARC A-CARPINTERO E, ALONSO-VILLEGAS R, et al.Characterization of aroma compounds of Verdejo white wines from the La Mancha region by odour activity values[J].Flavour & Fragrance Journal, 2010, 25(6):456-462.
A-CARPINTERO E, ALONSO-VILLEGAS R, et al.Characterization of aroma compounds of Verdejo white wines from the La Mancha region by odour activity values[J].Flavour & Fragrance Journal, 2010, 25(6):456-462.
[29] PINEAU B, BARBE J C, VAN LEEUWEN C, et al.Which impact for β-D-amascenone on red wines aroma[J].Journal of Agricultural and Food Chemistry, 2007,55(10):4 103-4 108.