黑豆是豆科植物大豆属的黑色种子,又名黑大豆,在我国种植范围广、产量大[1]。研究表明黑色谷物的营养价值普遍高于其他同类浅色食品,相比其他杂粮全谷物豆类,黑豆中多酚类化合物含量高且种类丰富,富含的多酚与黄酮成分赋予了黑豆许多生理功能[2]。多酚类化合物对抗氧化、抗炎、抗癌、降血脂等慢性疾病起到了预防和调节的作用,具有良好的医用价值[3-6]。黑豆被称为“豆中之王”,常吃黑豆益于健康,日常人们多数将黑豆煮制加工成黑豆粥、黑豆饭、黑豆浆等进行食用,而黑豆中多酚类化合物内的酚羟基基团在高温条件下不稳定,热加工会对其功能性质和生物利用度产生影响[7]。研究发现,煮制处理后大豆总酚和总黄酮含量均低于未加工处理状态的大豆,且豆类种子经过常压煮制加工后,大概有26%~52%的多酚类化合物流失到豆汤中[8-9]。刘婷婷[10]研究发现黑大豆、黑小豆、红小豆、绿豆、红芸豆、紫花芸豆的总酚含量均在煮制后下降,乔丽华[11]的研究也同样证实了黑豆中多酚类化合物的含量受温度环境的影响产生了显著差异。尽管如此,目前针对黑豆多酚类化合物的研究仍集中在含量和抗氧化活性的变化上,关于黑豆在加工前后多酚类化合物的组成仍不清晰,这影响着黑豆的营养分析和功能评价。代谢组学技术依靠高通量、高灵敏度、检测范围广的特点可以对生物样品中的小分子代谢产物进行定性和定量分析,在营养科学和植物代谢研究方面被广泛应用[12-13]。
本研究对黑豆进行煮制加工,比较煮制前后总酚含量和总黄酮含量的变化,基于超高效液相色谱-四极杆-静电场轨道阱质谱(ultra performance liquid chromatography-quadrupole-electrostatic field orbitrap mass spectrometry,UHPLC-QE-MS)技术,应用非靶向代谢组学方法,检测煮制前后黑豆多酚类化合物的组成及含量,分析其差异性变化,为黑豆加工过程中化学物质表征和功能成分研究提供参考。
1 材料与方法
1.1 材料与试剂
黑豆产自黑龙江省,市售;没食子酸标准品、芦丁标准品,美国Sigma公司;DPPH、福林酚,上海源叶生物科技有限公司;甲醇(LC-MS级)、乙腈(LC-MS级),CNW Technologies公司;乙酸铵(LC-MS级),SIGMA-ALDRICH公司;乙酸(LC-MS级),Fisher Chemical公司。
1.2 仪器与设备
MJ-10A高速万能粉碎机、MB-WFS4029美的电饭煲,美的生活电器制造有限公司;Vanquish超高效液相、Q Exactive HFX高分辨质谱、Heraeus Fresco17离心机,Thermo Fisher Scientific;BSA124S-CW天平,Sartorius;PS-60AL超声仪,深圳市雷德邦电子有限公司。
1.3 试验方法
1.3.1 原料预处理
黑豆洗净后于烘箱烘干,美的电饭煲中加入500 mL 去离子水,水沸腾后立即加入50 g黑豆,煮制40 min,将豆子取出沥干水分,放入烘箱烘干至恒重。加工后的黑豆与新鲜黑豆分别使用粉碎机研磨成豆粉;过80目筛;使用石油醚进行脱脂处理。完成后密封放入冰箱保存。
1.3.2 酚类提取物的制备
称取3 g黑豆粉,加入45 mL 70%(体积分数)乙醇,超声800 W提取30 min后离心(4 000 r/min)10 min,取上清液,沉淀按上述步骤再重复提取2次,合并3次 上清液,40 ℃旋转蒸发,定容至10 mL备用。
1.3.3 黑豆活性成分的测定
(1)总酚的测定
根据Folin-Ciocalteu法稍作修改[14]绘制没食子酸标准曲线,所得线性回归方程:y=5.380 7x-0.007 5, 回归系数R2=0.999 2。其中:y为吸光度;x为没食子酸标准液浓度,mg/mL。准确吸取1 mL样品溶液于25 mL的具塞试管中;分别加入福林酚试剂1 mL及质量分数为12%的碳酸钠溶液2 mL并定容至刻度线,室温25 ℃下避光反应2 h;在765 nm波长处测定样品的吸光度,并根据标准曲线和计算公式得出黑豆总酚的含量。总酚含量的计算如公式(1)所示:
总酚含量![]()
(1)
式中:ρ为根据标准曲线算得提取液总酚质量浓度,mg/mL;V为提取液体积,mL;N为稀释倍数;M为称取的黑豆粉质量,g。
(2)总黄酮的测定
根据高丽威等[15]的方法稍作修改绘制芦丁标准曲线,所得线性回归方程:y=0.630 5x+0.000 9,回归系数R2=0.999 1。其中:y为吸光度;x为芦丁标准液质量浓度,mg/mL。准确吸取样品溶液2.0 mL放置于10 mL的容量瓶中;加3 mL体积分数为70%的乙醇溶液,再加入5%(质量分数)的亚硝酸钠溶液0.3 mL, 摇匀静置6 min;加入100 g/L的硝酸铝溶液0.3 mL,摇匀静置6 min;加入40 g/L的氢氧化钠溶液4 mL,再用70%的乙醇定容至刻度,摇匀静置12 min; 在510 nm 下测定吸光度,并根据标准曲线和计算公式得出黑豆总黄酮的含量。总黄酮含量的计算如公式(2)所示:
总黄酮含量![]()
(2)
式中:ρ为根据标准曲线算得提取液总黄酮质量浓度,mg/mL; V为提取液体积,mL;N为稀释倍数;M为称取的黑豆粉质量,g。
1.4 UHPLC-QE-MS分析
移取100 μL样品至EP管中,加入400 μL提取液(甲醇,含同位素标记内标混合物),涡旋混匀30 s, 超声10 min(冰水浴),-40 ℃静置1 h。然后将样品4 ℃,12 000 r/min离心15 min,取上清液于进样瓶中上机检测。
本研究使用Vanquish (Thermo Fisher Scientific)超高效液相色谱仪,通过Waters ACQUITY UPLC HSS T3 (2.1 mm×100 mm×1.8 μm)液相色谱柱对目标化合物进行色谱分离。液相色谱A相为水相,含5 mmol/L 乙酸铵和5 mmol/L乙酸,B相为乙腈。样品盘温度:4 ℃,进样体积:3 μL。Thermo Q Exactive HFX质谱仪条件为:质谱电压4.0 kV(正离子)、3.8 kV(负离子);鞘气流速30 arb;辅助气流速10 arb;Full MS分辨率60 000;MS/MS分辨率7 500;离子传输管温度350 ℃。
1.5 数据处理
原始数据经ProteoWizard软件转成mzXML格式后,使用自主编写的R程序包(内核为XCMS)进行峰识别、峰提取、峰对齐和积分等处理,然后与BiotreeDB(V2.1)自建二级质谱数据库匹配进行物质注释,算法打分的Cutoff值设为0.3。
2 结果与分析
2.1 黑豆总酚和总黄酮含量变化
表1为煮制对黑豆总酚、总黄酮含量的影响。由表1可以看出,煮制加工使黑豆总酚和总黄酮含量发生明显下降,总酚含量下降59.06%,总黄酮含量下降64.74%。 煮制加工导致了黑豆中多酚类化合物的流失与降解,这与乔丽华[11]的研究结果相符。由于水分的存在,通常也会加剧热处理的程度,加速多酚类物质的氧化损失。
表1 新鲜黑豆与煮制黑豆总酚和总黄酮含量 单位:mg/g
Table 1 Contents of total phenols and total flavonoids in fresh black beans and cooked black beans

样品总酚含量总黄酮含量新鲜黑豆18.03±0.8914.92±0.68煮制黑豆7.38±1.575.26±1.23
2.2 代谢物定性结果
代谢物通过BiotreeDB数据库进行定性,代谢物定性结果如表2所示。新鲜黑豆(r)中共检测出89个 多酚类化合物,煮制加工后的黑豆(p)中共检测出86个多酚类化合物。2组样品比较,同时存在的多酚类化合物有83个,新鲜黑豆独有多酚类化合物6个,煮制加工黑豆独有多酚类化合物3个。
表2 多酚类代谢物定性结果
Table 2 Qualitative results of polyphenol metabolites

序号保留时间质核比MS2 score物质名称rp1299.52287.050.998 4山奈酚++2218.94271.050.998 3染料木素++3189.70449.100.995 8黄芪苷++4201.83433.110.995 6芹菜素-7-葡萄糖苷++5193.06285.070.995 0鹰嘴豆芽素A++6521.27287.050.993 8木犀草素++7153.42463.120.989 6芍药素葡萄糖苷++8155.04433.110.989 16-羟基大豆苷元4'-葡萄糖苷++9102.95361.090.989 0毒马草黄酮++10126.80433.110.988 3Genistein 5-glucoside++11164.21447.120.984 8豆异黄酮++12175.12273.070.983 8柚皮素++13192.78317.060.981 4异鼠李素++14326.11123.040.995 6苯甲酸++15523.33449.100.970 5藤黄菌素-4' -O-葡糖苷++16161.26475.120.969 46″-O-乙酰染料木苷++17240.32519.110.964 66″-丙二酰染料木苷++1861.65459.120.963 86″-O-乙酰大豆苷++19595.65449.100.963 4木犀草苷++20117.33491.110.959 5矢车菊素3-(4-乙酰葡萄糖苷)++2162.52489.130.946 26″-O-乙酰甘氨酸++22107.41475.120.943 0芹菜素7-O-(6'-O-乙酰葡萄糖苷)++23176.57291.080.938 0表儿茶素+-24219.12433.110.936 8染料木苷++25102.58152.070.936 5对乙酰氨基酚++26210.09565.150.928 8芹菜甙++27187.90457.110.908 6表儿茶素3-O-(4-甲基没食子酸酯)++28473.43241.080.887 4(±)-2-(1-甲基丙基)-4,6-二硝基苯酚++29325.5595.040.865 7苯酚+-30189.62471.080.864 5白藜芦醇++31405.41379.120.998 211-甲基黄连素++32260.00533.120.843 56'-丙二酰三叶酸++3358.91307.180.837 9辣椒素酯+-34266.35535.100.833 52'-Hydroxygenistein 7-(6″-malonylglu-coside)++3591.71547.140.828 66″-O-Malonylwistin-+36181.81491.150.800 44',5,6-三甲基黄芩苷7-葡萄糖苷++37118.23431.130.683 5芒柄花苷++38214.58503.110.722 76″-O-丙二酰大豆苷++39482.78491.240.718 3Rubraflavone C-+40230.54335.250.664 2[10]-Paradol++4160.78170.080.604 36-羟基多巴胺++42236.02549.120.589 9金圣草素 7-O-(6″-丙二酰葡萄糖苷)++
续表2
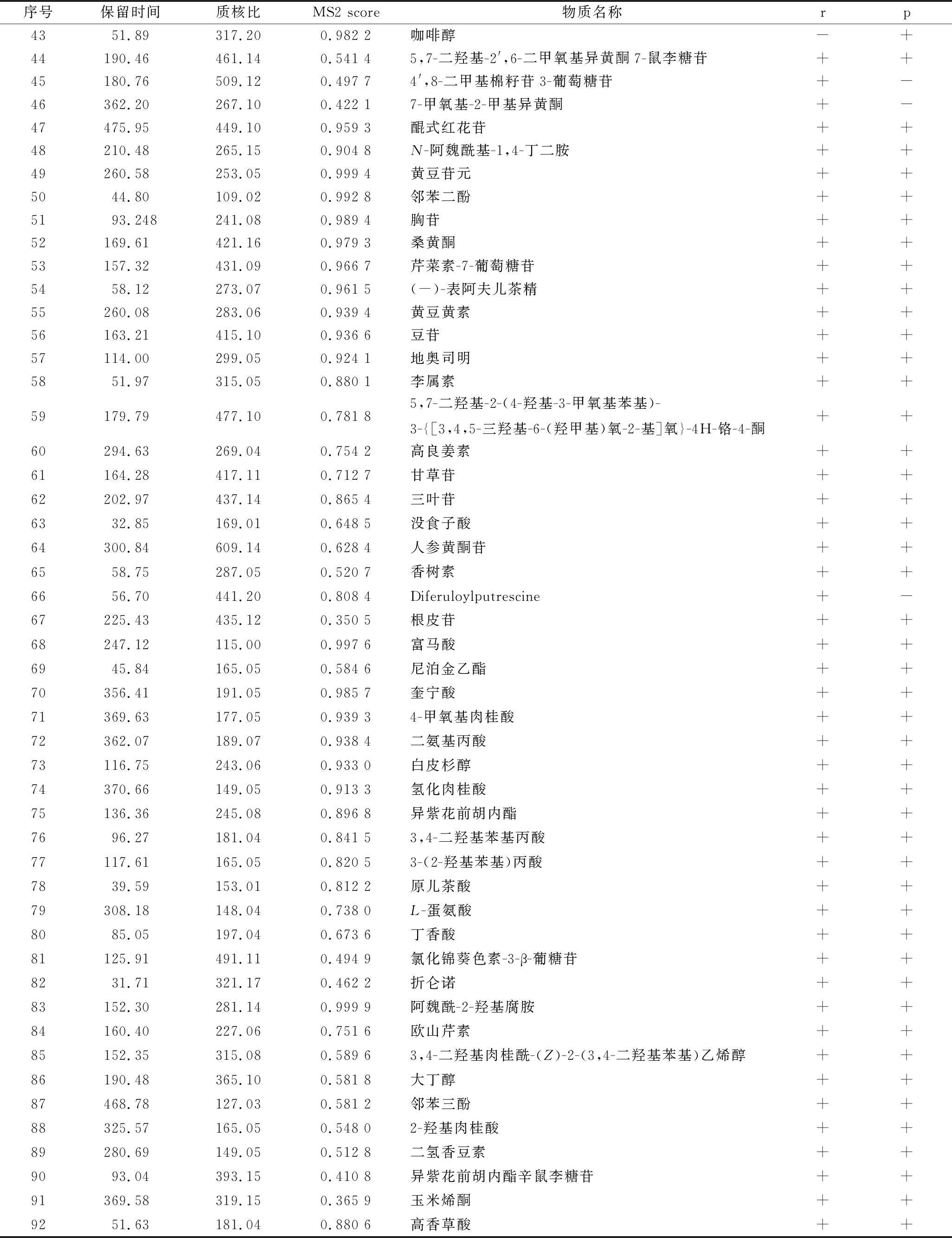
注:“+”表示含有该代谢物,“-”表示不含有该代谢物
序号保留时间质核比MS2 score物质名称rp4351.89317.200.982 2咖啡醇-+44190.46461.140.541 45,7-二羟基-2',6-二甲氧基异黄酮7-鼠李糖苷++45180.76509.120.497 74',8-二甲基棉籽苷3-葡萄糖苷+-46362.20267.100.422 17-甲氧基-2-甲基异黄酮+-47475.95449.100.959 3醌式红花苷++48210.48265.150.904 8N-阿魏酰基-1,4-丁二胺++49260.58253.050.999 4黄豆苷元++5044.80109.020.992 8邻苯二酚++5193.248241.080.989 4胸苷++52169.61421.160.979 3桑黄酮++53157.32431.090.966 7芹菜素-7-葡萄糖苷++5458.12273.070.961 5(-)-表阿夫儿茶精++55260.08283.060.939 4黄豆黄素++56163.21415.100.936 6豆苷++57114.00299.050.924 1地奥司明++5851.97315.050.880 1李属素++59179.79477.100.781 85,7-二羟基-2-(4-羟基-3-甲氧基苯基)-3-{[3,4,5-三羟基-6-(羟甲基)氧-2-基]氧}-4H-铬-4-酮++60294.63269.040.754 2高良姜素++61164.28417.110.712 7甘草苷++62202.97437.140.865 4三叶苷++6332.85169.010.648 5没食子酸++64300.84609.140.628 4人参黄酮苷++6558.75287.050.520 7香树素++6656.70441.200.808 4Diferuloylputrescine+-67225.43435.120.350 5根皮苷++68247.12115.000.997 6富马酸++6945.84165.050.584 6尼泊金乙酯++70356.41191.050.985 7奎宁酸++71369.63177.050.939 34-甲氧基肉桂酸++72362.07189.070.938 4二氨基丙酸++73116.75243.060.933 0白皮杉醇++74370.66149.050.913 3氢化肉桂酸++75136.36245.080.896 8异紫花前胡内酯++7696.27181.040.841 53,4-二羟基苯基丙酸++77117.61165.050.820 53-(2-羟基苯基)丙酸++7839.59153.010.812 2原儿茶酸++79308.18148.040.738 0L-蛋氨酸++8085.05197.040.673 6丁香酸++81125.91491.110.494 9氯化锦葵色素-3-β-葡糖苷++8231.71321.170.462 2折仑诺++83152.30281.140.999 9阿魏酰-2-羟基腐胺++84160.40227.060.751 6欧山芹素++85152.35315.080.589 63,4-二羟基肉桂酰-(Z)-2-(3,4-二羟基苯基)乙烯醇++86190.48365.100.581 8大丁醇++87468.78127.030.581 2邻苯三酚++88325.57165.050.548 02-羟基肉桂酸++89280.69149.050.512 8二氢香豆素++9093.04393.150.410 8异紫花前胡内酯辛鼠李糖苷++91369.58319.150.365 9玉米烯酮++9251.63181.040.880 6高香草酸++
由表2可知,2组样品共定性出92个多酚类化合物,包括53个黄酮类化合物,其中22个为异黄酮类化合物、8个酚酸类化合物、7个酚类化合物、8个木脂素类化合物、6个香豆素类化合物、5个苯丙素类化合物、3个花青素类化合物以及2个芪类化合物。豆异黄酮、木犀草素、黄豆苷元、染料木苷、芹菜素-7-葡萄糖苷等多酚类化合物的检出与XU等[16]和FENG等[17]的研究结果相吻合,并且朱怡霖等[18]的研究从横山老黑豆多酚类化合物中分离出原儿茶酸、没食子酸、染料木苷、大豆苷元等酚酸类化合物和异黄酮类化合物。这与本实验发现的黑豆中多酚类化合物的组成结果相似,但本实验更系统地定性出黑豆及煮制加工后黑豆的组成成分。从代谢物数量的方面来看,83个多酚类化合物共同存在于新鲜黑豆与煮制黑豆中,主要为黄酮类和酚类化合物,这些物质在热处理前后仍然存在,说明其对温度变化具有一定的稳定性。新鲜黑豆中独有的多酚类代谢物数量略高于加工后的黑豆,2组黑豆样品独有的多酚类代谢物主要集中在黄酮类、酚类以及木脂素类化合物上。值得一提的是新鲜黑豆中多酚类代谢物含有的表儿茶素和苯酚在经过常压煮制后完全消失,这种情况的发生可能与表儿茶素在热处理后易发生差向异构化作用或变旋作用有关[19],此种黄酮物质具有诸多生理活性,如抗氧化、抗炎、保护神经、抑菌等作用。而苯酚作为结构最简单的酚类化合物最容易受到外界温度升高的刺激,增加其酚羟基的电离,使其更容易分解流失于水中。除此之外,在加工后的黑豆中检测到的咖啡醇也是新鲜黑豆中不含有的。由此说明,黑豆经常压煮制后,其多酚类代谢物的种类发生变化,而这种高变化也将影响着黑豆的生物活性和功能评价。
2.3 新鲜黑豆与煮制加工黑豆中酚类物质差异性分析
2.3.1 主成分分析(principal component analysis,PCA)
对样品进行主成分分析,判别新鲜黑豆与煮制加工黑豆各组样本之间和组内样本之间的变异度大小。图1为两样品的PCA得分图,R2X=0.942>0.5,说明拟合性较好,主成分1(PC1)的贡献率为 77.5%,主成分2(PC2)的贡献率为11.2%。此外,所有样本点都处在95%的置信区间内,且2组样本在二维图上表现出明显的分离趋势,同时煮制加工黑豆样本点的距离要大于新鲜黑豆。PCA结果表明,煮制对黑豆多酚类化合物具有显著影响。
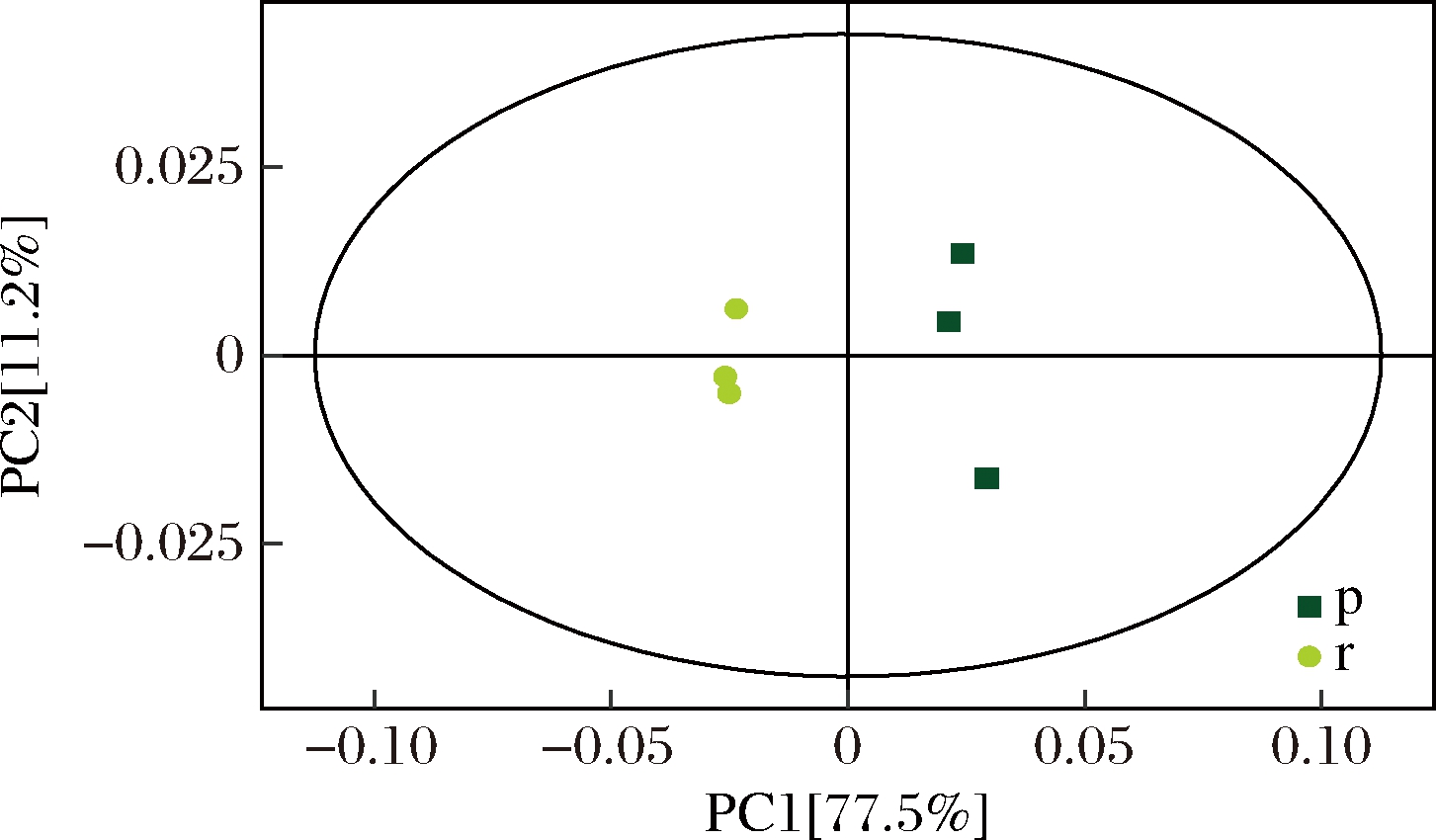
图1 r组与p组的PCA模型得分散点图
Fig.1 Score scatter plot of PCA model for group r vs p
2.3.2 正交偏最小二乘法-判别分析(orthogonal projections to latent structures- discriminant analysis,OPLS-DA)
PCA法虽然能够有效地提取主要信息,但是对于相关性较小的变量不敏感,而OPLS-DA可以使组间区分最大化,有利于寻找差异代谢物。图2为煮制前后黑豆的OPLS-DA得分图。
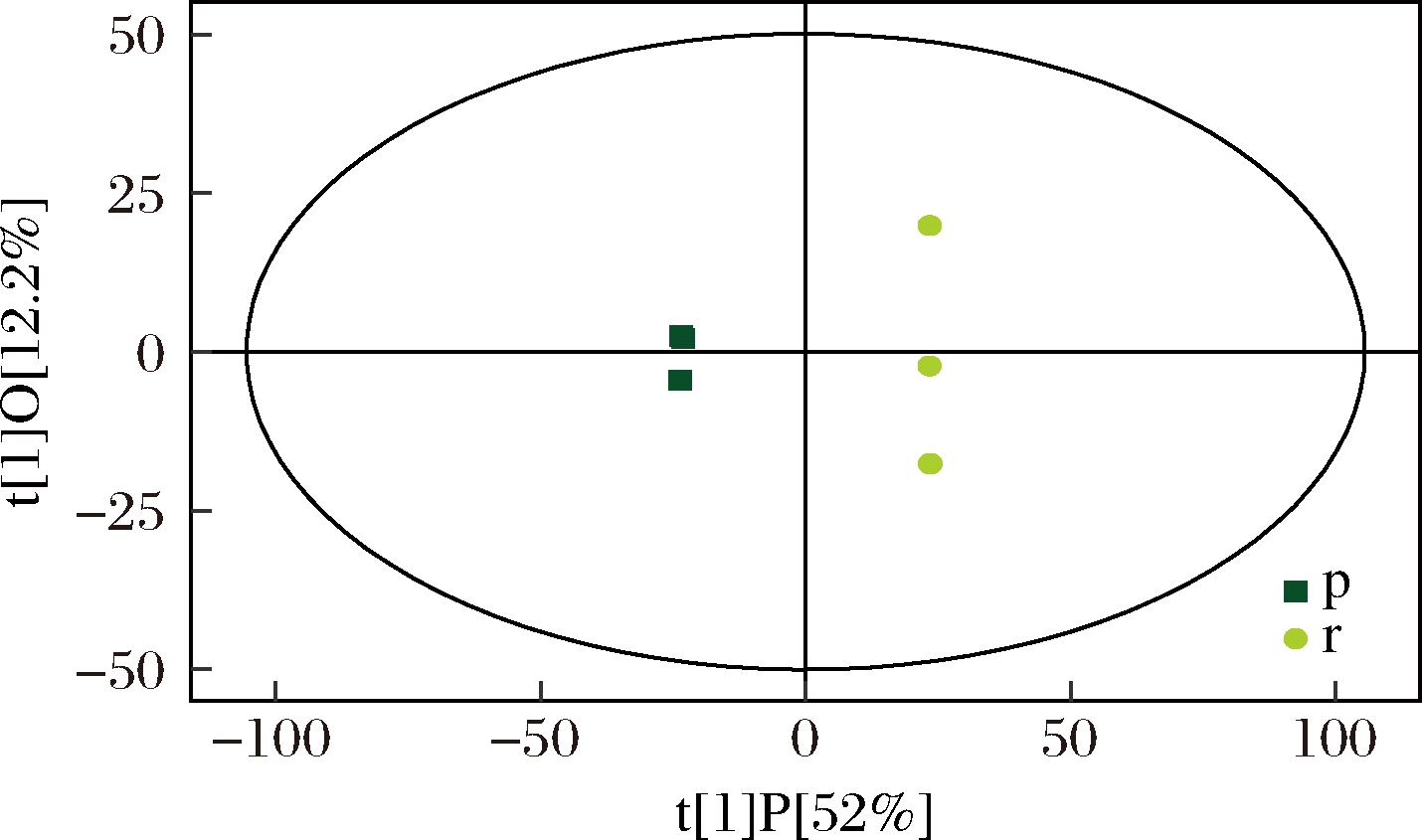
图2 r对p的OPLS-DA模型得分散点图
Fig.2 Score scatter plot of OPLS-DA model for group r vs p
根据OPLS-DA模型对92种多酚类化合物数据进行分析,煮制加工黑豆样品分布在置信区间的左侧,新鲜黑豆样品分布在置信区间的右侧,2组样品的区分效果非常明显。分布形态上看,存在一定差异,r样本点离散程度要大于p样本点,这可能与煮制加工会促进黑豆多酚类化合物与自身蛋白质、多糖等物质的相互作用,导致其空间结构与组分含量的变化有关。OPLS-DA得到2个主成分,主成分1的贡献率为52%、主成分2的贡献率为12.2%,R2X=0.642, R2Y=1、Q2=0.978,其中 Q2>0.9 为出色的模型,相比于PCA模型效果更好。再次说明煮制加工对黑豆多酚类化合物具有显著的影响。
2.4 差异代谢物的筛选
以OPLS-DA模型主成分的 VIP>1 且t检验的P值<0.05为标准,筛选出黑豆在煮制前后的多酚类差异代谢物,结合数据库通过保留时间等条件与库中物质进行匹配,从而进行两黑豆样本差异代谢物的定性,定性结果如表3所示。
表3 多酚类差异代谢物定性结果
Table 3 Qualitative results of differential metabolites of polyphenols

注:VIP表示来自OPLS-DA模型的VIP值;P值表示来自t-test的P值;LOG-倍数变化:2组实验物质定量的比值,取以2为底的对数;“+”表示相对含量上升,“-”表示相对含量下降
序号多酚物质匹配分值保留时间质荷比VIPP值倍数变化LOG-倍数变化1黄豆苷元0.999260.58253.051.247 20.000 121 0382.312 21.209 22表阿夫儿茶精0.96158.12273.071.604 60.000 941 4683.988 21.995 73柚皮素0.954118.12271.071.006 60.014 978 6590.548 6-1.052 24黄豆黄素0.953260.08283.061.765 30.029 925 1935.525 82.466 15豆苷0.936163.21415.101.230 60.000 174 4210.441 8-1.178 36地奥司明0.924114299.051.571 10.039 303 460.246 7-2.018 97李属素0.88051.97315.051.636 70.003 481 094.366 52.126 58原儿茶酸0.81239.59153.012.076 70.040 502 39110.8633.441 49高良姜素0.754294.63269.041.127 20.001 520 7862.019 31.013 810甘草苷0.712164.28417.111.203 40.006 099 4450.440 9-1.181 311丁香酸0.67685.05197.041.576 40.000 518 6983.814 91.931 612没食子酸0.64532.85169.011.380 85.698 18E-052.786 81.478 613香树素0.52058.75287.051.991 36.669 49E-058.362 63.063 914根皮苷0.350225.43435.121.241 50.000 181 9682.297 31.199 915阿魏酰-2-羟基腐胺0.999152.30281.142.246 80.000 330.090 9-3.458 616毒马草黄酮0.989102.95361.091.928 28.261 91E-056.632 42.729 517矢车菊素3-(4-乙酰葡萄糖苷)0.959117.33491.112.258 90.004 362 4520.075 4-3.727 418醌式红花苷0.959475.95449.102.403 70.000 289 0317.877 84.160 119木犀草苷0.944241.71449.102.921 10.007 531 96374.629 96.221 620对乙酰氨基酚0.936102.58152.071.431 70.002 666 9052.912 41.542 2213,4-二羟基苯基丙酸0.84196.27181.041.253 90.011 904 0822.485 71.313 722三叶苷0.865202.97437.142.674 00.008 321 75232.225 35.010 123氯化锦葵色素-3-β-葡糖苷0.838100.31493.131.590 33.806 58E-053.615 51.854 224辣椒素酯0.83758.91307.182.758 40.002 715 27346.921 55.552 1256″-O-Malonylwistin0.82891.71547.143.185 80.008 117 2280.005 8-7.412 426Diferuloylputrescine0.80856.70441.203.385 20.003 070 945232.896 67.863 527欧山芹素0.751160.40227.061.401 60.013 900 5650.340 8-1.552 6286″-O-丙二酰大豆苷0.722214.58503.111.213 40.006 166 8860.472 1-1.082 729大丁醇0.581190.48365.101.733 20.001 574 3954.723 72.239 930异紫花前胡内酯0.896136.36245.081.513 20.002 361 4593.522 71.816 731白皮杉醇0.933116.75243.061.553 90.001 892 2630.265 6-1.912 432芹菜素-7-葡萄糖苷0.995201.83433.112.770 60.012 124 14649.087 85.617 233木犀草素0.993521.27287.052.363 90.010 111 36515.882 23.989 334Genistein 5-glucoside0.988126.80433.111.229 40.040 056 3880.445 6-1.165 935异鼠李素0.981192.78317.062.030 25.983 64E-068.046 93.008 436藤黄菌素-4' -O-葡糖苷0.970523.336449.102.410 20.049 680 15219.161 04.260 1376″-O-乙酰染料木苷0.969161.26475.121.969 93.354 76E-060.140 7-2.828 6386″-O-乙酰大豆苷0.96361.65459.122.066 53.346 18E-050.115 1-3.118 1396″-O-乙酰甘氨酸0.94662.52489.131.688 66.619 68E-060.236 1-2.082 440芹菜素7-O-(6'-O-乙酰葡萄糖苷)0.943107.41475.122.385 70.017 621 3620.055 5-4.169 0412-(3,4-二羟基苯基)-5,7-二羟基-6-[3,4,5-三羟基-6-(羟甲基)氧-2-基]-4H-铬-4-酮0.675278.91449.102.921 20.022 265 87872.490 46.179 742金圣草素 7-O-(6″-丙二酰葡萄糖苷)0.589236.02549.121.494 90.002 192 3433.294 01.719 8435,7-二羟基-2',6-二甲氧基异黄酮7-鼠李糖苷0.541190.46461.141.427 30.013 828 5412.846 11.509 044二氢香豆素0.512280.69149.051.290 50.002 982 9542.409 91.268 9454',8-二甲基棉籽苷3-葡萄糖苷0.497180.76509.123.176 60.009 900 28166.152 17.376 346富马酸0.997247.121151.184 50.009 224 3410.442 3-1.176 747高香草酸0.88051.63181.041.371 10.004 339 4352.852 21.512 0
差异代谢物是指加工前后同时存在的,但是含量上存在显著差异的物质。高温热处理会导热不稳定的植物多酚类化合物发生降解或化学氧化形成醌类化合物[20]。煮制过程中由于水分的存在,通常会加剧热处理程度,加速多酚类物质的氧化损失。r与p代谢物对比,共筛选出47个多酚类差异代谢物,多数为黄酮类、异黄酮类及其衍生物、酚酸类化合物,还有少量的木脂素类、苯丙素类、花青素类化合物。由表2可知,在47个差异物质中,r黑豆样本中有31个多酚类代谢物的含量高于p,其中李属素、异鼠李素、木犀草素、香树素等黄酮类化合物含量显著下降,说明温度对黄酮类化合物的稳定性和生物活性具有一定影响,影响程度与化合物的结构有关,如羟基化程度和位置、取代基的存在[21]。没食子酸、原儿茶酸、丁香酸、高香草酸作为黑豆中常见的酚酸类物质在煮制后的损失同样较为严重,相比之下没食子酸受加工带来的影响最小,梁亚静[22]的研究得到了同样的结果。p样本中有16个多酚类代谢物的含量高于r,这些物质包含异黄酮类及其异黄酮的衍生物和花青素类化合物,在煮制加工过程中它们的含量得到了提升,倍性变化在1.05~7.41倍。
6″-O-Malonylwistin、6″-O-乙酰染料木苷、6″-O-乙酰大豆苷、6″-O-乙酰甘氨酸等异黄酮类化合物的相对含量呈上升趋势,表明热处理能够破坏黑豆黄酮类化合物与单糖或多糖部分之间的OH基团(O-糖苷),降解一部分乙酰基葡萄糖苷型类黄酮使之成为游离态,导致某些异黄酮类化合物含量的升高[23],其次,适当的热处理可使提取率较低的结合态酚类化合物半溶出,以提高其含量[24]。矢车菊素3-(4-乙酰葡萄糖苷)、氯化锦葵色素-3-β-葡糖苷等花青素类化合物的含量变化趋势并不一致,其原因可能是热处理过程使能够降解花青素类化合物的多酚氧化酶失去了活性,因此部分黑豆的花青素类化合物含量在受热过程中有所增加[25]。柚皮素、高良姜素、甘草苷、富马酸、Genistein 5-glucoside、二氢香豆素等多酚类化合物差异不显著,表明其热稳定性强于其他酚类化合物,其原因可能是此类化合物中含有苯环及碳碳双键等稳定的化学结构。其次,苯酚上的羟基与多糖上的氧原子间会形成氢键,这种相互作用可以形成葡聚糖凝胶,提高多酚类化合物的稳定性[26]。黑豆在加工后65.9%的多酚类差异代谢物含量发生了下降,这与其总酚含量和总黄酮含量的下降存在密切联系。综上所述,煮制加工作为豆类食品最常用的一种传统加工熟化方式,加工过程中部分多酚类化合物的含量呈现出显著性的差异,适当的热加工也可以提高黑豆食品的适口性和营养价值[27]。结果表明,煮制加工对黑豆中多酚类物质的含量具有显著影响。
2.5 差异代谢物的聚类分析
以上分析得到的差异代谢物在生物学上往往具有结果和功能的相似性和互补性,或者受同一代谢通路的正、负调控。因此选择聚类分析将具有相近性质的对象化为一类,而将较大性质差异的对象归到不同类[28],结果如图3所示。
图3为黑豆经煮制加工前后的差异组分层次聚类分析热力图,横坐标r和p分别代表新鲜黑豆样本和煮制加工黑豆样本,纵坐标代表2种黑豆样本对比的差异代谢物名称,热力图的颜色代表了代谢物的丰度,红色为高表达组分,蓝色为低表达组分,颜色由蓝到白再到红代表着代谢物丰度逐渐升高。图3可以分成上下2个区域,上半区域的原儿茶酸、(-)-表阿夫儿茶精、黄豆苷元、根皮苷、没食子酸、丁香酸等此类酚酸类化合物与黄酮类化合物表达量明显高于p样 本;下半区域的富马酸、地奥司明、白皮杉醇、豆苷、柚皮素等此类酚类化合物与异黄酮类化合物表达量明显高于r样本。根据观察颜色变化差异得出木犀草苷、三叶苷、芹菜素-7-葡萄糖苷、辣椒素酯等物质存在极显著差异;没食子酸、丁香酸、黄豆黄素、二氢香豆素、高香草酸等物质存在差异显著,这与表3结果相似。通过层次聚类分析可以看出,煮制加工对黑豆多酚类代谢物产生的影响显著,黑豆中大部分多酚类物质在经过煮制加工后含量有所减少。这些差异代谢物是众多代谢物中因煮制加工而导致的含量变化显著的物质,则差异代谢物对于黑豆功能性食品的开发与研究具有一定的参考意义。

图3 r对p的层次聚类分析热力图
Fig.3 Heatmap of hierarchical clustering analysis for group r vs p
3 结论
本研究通过对黑豆煮制加工前后总酚、总黄酮的含量进行比较,并基于UHPLC-QE-MS代谢组学平台,较系统地明确了新鲜黑豆和煮制加工黑豆的多酚类化合物组成。通过显著变化的多酚类化合物,为探索煮制对多酚类化合物的影响及代谢机制提供参考。研究表明,煮制加工对黑豆中多酚类化合物的数量、种类及含量均具有影响,其中含量上的差异最为显著,且加工对黄酮类化合物影响最显著。多酚类化合物作为具有多种生物功能活性的化学物质,下一步可对其加工后的功能活性变化进行研究,而且还可深入探讨加工对黑豆中酚类物质构效关系的影响。
[1] 常汝镇.中国黑豆资源及其营养和药用价值[J].中国食物与营养,1998,4(5):38-39.
CHANG R Z.Chinese black soybean resources and their nutritional and medicinal value[J].Chinese Food and Nutrition,1998,4(5):38-39.
[2] AMAROWICZ R, PEGG R B.Legumes as a source of natural antioxidants[J].European Journal of Lipid Science and Technology, 2008, 110(10):865-878.
[3] DIAO J X, OU J Y, DAI H, et al.Antioxidant and antiapoptotic polyphenols from green tea extract ameliorate ccl4-induced acute liver injury in mice[J].Chinese Journal of Integrative Medicine, 2019, 26(10):736-744.
[4] LEONG D J, CHOUDHURY M, HANSTEIN R, et al.Correction to:Green tea polyphenol treatment is chondroprotective, anti-inflammatory and palliative in a mouse posttraumatic osteoarthritis model[J].Arthritis Research & Therapy, 2019, 21(1):.DOI:10.1186/S13075-018-1791-9.
[5] MIYATA Y, SHIDA Y, HAKARIYA T, et al.Anti-cancer effects of green tea polyphenols against prostate cancer[J].Molecules (Basel,Switzerland), 2019, 24(1):193-212.
[6] QI R, LIAN G, YU M M, et al.Study on hypolipidemic and anti-atherosclerosis effects of grapeseed polyphenols[J].Atherosclerosis, 2017, 263:e168.
[7] OLIVER S, VITTORIO O, CIRILLO G, et al.Enhancing the therapeutic effects of polyphenols with macromolecules[J].Polymer Chemistry, 2016, 7(8):1 529-1 544.
[8] BOATENG J, VERGHESE M, WALKER L T, et al.Effect of processing on antioxidant contents in selected dry beans (Phaseolus spp.L.)[J].LWT-Food Science and Technology, 2008, 41(9):1 541-1 547.
[9] XU B J, CHANG S K C.Reduction of antiproliferative capacities,cell-based antioxidant capacities and phytochemical contents of common beans and soybeans upon thermal processing[J].Food Chemistry, 2011, 129(3):974-981.
[10] 刘婷婷.不同加工方式对杂豆酚类物质及其抗氧化性的影响[D].大庆:黑龙江八一农垦大学,2019.
LIU T T.Effects of different processing methods on phenolic compounds and their antioxidant properties[D].Daqing:Heilongjiang Bayi Agricultural University,2019.
[11] 乔丽华.不同加工方式对小粒大豆抗氧化性能及生理活性影响研究[D].杨凌:西北农林科技大学,2016.
QIAO L H.Study on the effect of different processing methods on the antioxidant performance and physiological activity of small soybean[D].Yangling: Northwest A&F University,2016.
[12] RAZA A.Metabolomics:A systems biology approach for enhancing heat stress tolerance in plants[J].Plant Cell Reports, 2020:1-23.DOI:10.1007/s00 299-020-02 635-8.
[13] FENG Z, DING C Q, LI W H, et al.Applications of metabolomics in the research of soybean plant under abiotic stress[J].Food Chemistry, 2020, 310:125914.
[14] SINGLETON V L, ORTHOFER R, LAMUELA-RAVENT S R M.Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent[J].Methods in Enzymology, 1999, 299(1):152-178.
S R M.Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent[J].Methods in Enzymology, 1999, 299(1):152-178.
[15] 高丽威,李向荣.微波萃取法提取紫心甘薯总黄酮及其抗氧化活性研究[J].浙江大学学报(理学版),2009,36(5):571-574.
GAO L W, LI X R.Study on microwave-assisted extraction and anti-oxidation activity of flavonoids from purple sweet potato[J].Journal of Zhejiang University (Science Edition)2009,36(5):571-574.
[16] XU B, CHANG S K C.Total phenolics, phenolic acids, isoflavones,and anthocyanins and antioxidant properties of yellow and black soybeans as affected by thermal processing[J].Journal of Agricultural and Food Chemistry, 2008, 56(16):7 165-7 175.
[17] FENG S, SONG L, LEE Y K, et al.The Effects of fungal stress on the antioxidant contents of black soybeans under germination[J].Journal of Agricultural and Food Chemistry, 2010, 58(23):12 491-12 496.
[18] 朱怡霖,张海生,赵鑫帅, 等.大孔树脂分离纯化横山老黑豆酚类物质[J].食品与生物技术学报, 2019, 38(9):103-110.
ZHU Y L, ZHANG H S, ZHAO X S, et al.Separation and purification of phenolics from Hengshan old black bean by macroporous resin[J].Journal of Food and Biotechnology, 2019, 38(9):103-110.
[19] 于莎莎,丁阳平,罗赛, 等.儿茶素衍生物合成及药理作用研究进展[J].食品科学, 2012, 33(17):318-326.
YU S S, DING Y P, LUO S, et al.Research advance in synthesis and pharmacological effects of catechin derivatives[J].Food Science, 2012, 33(17):318-326.
[20] SWETA K, VEDA K, ARCHANA S.Impact of soaking and germination durations on antioxidants and anti-nutrients of black and yellow soybean (Glycine max.L) varieties[J].Journal of Plant Biochemistry & Biotechnology, 2015, 24(3):355-358.
[21] CHAABAN H, IOANNOU I, CHEBIL L, et al.Effect of heat processing on thermal stability and antioxidant activity of six flavonoids[J].Journal of Food Processing and Preservation, 2017, 41(5):e13203.
[22] 梁亚静.不同加工方式对芸豆营养特性及抗氧化活性的影响[D].长沙:中南林业科技大学,2015.
LIANG Y J.Effects of different processing methods on the nutritional characteristics and antioxidant activity of kidney beans[D].Changsha: Central South University of Forestry and Technology,2015.
[23] ACOSTA-ESTRADA B A, GUTIERREZ-URIBE J A, SERNA-SALDIVAR S O.Bound phenolics in foods, a review[J].Food Chemistry, 2014, 152(6):46-55.
[24] NAYAK B, LIU R H, TANG J.Effect of processing on phenolic antioxidants of fruits vegetables, and grains—A review[J].Critical Reviews in Food Science and Nutrition, 2015, 55(7):887-919.
[25] ANKIT P, NIGEL P B, COLM O, et al.Effect of thermal processing on anthocyanin stability in foods;mechanisms and kinetics of degradation[J].Trends in Food Science & Technology, 2010, 21(1):3-11.
[26] 康子悦,沈蒙,葛云飞, 等.基于植物广泛靶向代谢组学技术探究小米粥中酚类化合物组成及其抗氧化性[J].食品科学,2021,42(4):206-214.
KANG Z Y, SHEN M, GE Y F, et al.Exploring the composition of phenolic compounds in millet gruel based on omics technology and analyzing its antioxidant level[J].Food Science,2021,42(4):206-214.
[27] LOPEZ M, LETICIA X, LEYVA L, et al.Effect of cooking and germination on bioactive compounds in pulses and their health benefits[J].Journal of Functional Foods, 2017,38:624-634.
[28] 张舒,王长远,冯玉超, 等.气质联用代谢组学技术分析不同产地稻米代谢物[J/OL].食品科学,2021.DOI:10.7056/spkx1002-6630-20200409-128.
ZHANG S, WANG C Y, FENG Y C, et al.Analysis of metabolites of rice from different producing areas by GC/MS metabolomics technology[J/OL].Food Science,2021.DOI:10.7056/SPKX1002-663020200409-128.