刺身鱼是可作生食的一类鱼,包括了不同的渔业种类,刺身又称生鱼片,具有丰富的营养价值,是一道广受世界各地消费者青睐的菜肴[1]。鱼类生物体含水量高,整个体系中的水分占总质量的65%~80%,且肌纤维细,极易腐败变质。因此,活鱼捕捞后通常通过低温来保持原有的色泽和新鲜度。经过冻结后,虽然抑制了鱼体内的微生物生长,减弱了酶活性[2],但在冷冻过程中鱼体内的水转化为冰晶,会对鱼体组织细胞产生一定的破坏性[3],导致其水分受到影响,颜色、风味和质地等也随之发生变化[4-5],致使刺身鱼品质明显下降,但不同贮运过程对刺身鱼品质影响的程度有所不同。目前行业中仍存在将捕捞上岸的刺身鱼置于不同温度条件进行贮运的现实情况,因此研究刺身鱼在不同贮运期间的水分迁移以及分布等变化对其品质保鲜和经济价值具有积极意义。
传统的水分含量检测方法无法做到对水分状态、分布及迁移等的测量,不能确切直观地反映体系中的水分结合特征[6]。S NCHEZ-ALONSO等[7]和MCDONNELL等[8]利用低场核磁共振技术(low-field nuclear magnetic resonance, LF-NMR)分别对冷冻鳕鱼和盐腌猪肉进行了研究,发现横向弛豫时间(T2)对不同的冷冻条件和盐腌浓度敏感,在这2种过程中均存在水分迁移的现象。近年来,由于其具有快速无损、操作简便、直观明了、稳定性高[9]等优点,越来越多的研究者运用LF-NMR和核磁共振成像(magnetic resonance imaging, MRI)进行食品中的水分分析。T2主要提供水在食物基质中的结合性质,以此反映食物中不同状态的水分群如结合水、不易流动水和自由水。而MRI则显示水的空间分布及变化,二者是研究水在各种食品中的状态、流动性和分布的有力工具,可以为水的迁移提供直接信息[10-11]。
NCHEZ-ALONSO等[7]和MCDONNELL等[8]利用低场核磁共振技术(low-field nuclear magnetic resonance, LF-NMR)分别对冷冻鳕鱼和盐腌猪肉进行了研究,发现横向弛豫时间(T2)对不同的冷冻条件和盐腌浓度敏感,在这2种过程中均存在水分迁移的现象。近年来,由于其具有快速无损、操作简便、直观明了、稳定性高[9]等优点,越来越多的研究者运用LF-NMR和核磁共振成像(magnetic resonance imaging, MRI)进行食品中的水分分析。T2主要提供水在食物基质中的结合性质,以此反映食物中不同状态的水分群如结合水、不易流动水和自由水。而MRI则显示水的空间分布及变化,二者是研究水在各种食品中的状态、流动性和分布的有力工具,可以为水的迁移提供直接信息[10-11]。
目前,已有许多学者对贮藏过程中的果蔬等食品的水分进行了探究。如冯爱博等[12]和罗洁莹等[13]分别对贮藏过程中的雷竹笋和鹰嘴蜜桃进行了系统的水分研究。但对鱼类的水分研究大都集中在加工过程当中[14-16]。为丰富鱼类在贮运过程中的水分研究,本研究结合实际情况将刺身鱼置于3种不同温度条件下进行贮藏,以模拟不同的贮运过程中刺身鱼内水分随贮藏时间变化的影响,为其贮运过程的品质研究提供支撑和参考。
1 材料与方法
1.1 材料与试剂
刺身鱼选用虹鳟(Oncorhynchus mykiss),由四川省雅安市天全县润兆渔业提供,每条鱼的质量为3.5~4.5 kg; 苏木素染液、伊红染液,珠海贝索生物技术有限公司;40%(体积分数)甲醛、无水磷酸氢二钠、二水磷酸二氢钠、无水乙醇、二甲苯、盐酸,均为分析纯,成都市科隆化学有限公司。
1.2 仪器与设备
温度标签,成都奕阳现代食品安全技术研究中心;ULTS 1368型超低温冰箱,赛默飞世尔(苏州)仪器有限公司;BCD-568 WDPF型冰箱,海尔集团;MesoMR23-040V-1型低场核磁共振仪,苏州纽迈析仪器股份有限公司;RM 2016型转轮式切片机,德国徕卡;JT-12S型自动组织脱水机,武汉俊杰电子有限公司;BMJ-A型包埋机,常州郊区中威电子仪器厂;RS 36 型全自动染色机,常州派斯杰医疗设备有限公司;PHY-Ⅲ型病理组织漂烘仪,常州市中威电子仪器有限公司;Pannoramic 250型数字切片扫描仪,济南丹吉尔电子有限公司。
1.3 实验方法
1.3.1 刺身鱼前处理
将新鲜购回的刺身鱼处死,去头去尾、去骨去皮、去内脏,用蒸馏水将其血污清洗干净,分割成8 cm×4 cm×4 cm的鱼块,用保鲜膜包裹后随机分成3组进行贮藏。(1)低温处理组:将鱼块置于-18 ℃条件下长期贮藏;(2)超低温处理组:将鱼块置于-78 ℃条件下长期贮藏;(3)转组:在-78 ℃条件下使鱼块中心温度快速从室温下降至-18 ℃,再迅速转移到-18 ℃长期贮藏。
1.3.2 冻结曲线测定
取9个温度标签,设置其采集时间间隔为300 s,采集次数为80次,将其启动后分别放至9个新鲜鱼块的中心部位,用保鲜膜包裹后随机分为3组进行相应的处理,以对不同温度贮藏条件下的刺身鱼块进行冻结温度的监测,每组3个平行。待采集时间终止后取出鱼块中的标签读取数据并做记录,绘制不同处理条件下的冻结曲线。
1.3.3 低场核磁水分测定及1H成像分析
将刺身鱼块取出,于4 ℃解冻24 h后修整成大小为2 cm×2 cm×2 cm的方块,用滤纸吸去鱼块表面的水分,装入核磁管中,分别对3种不同温度贮藏条件下贮藏了0、4、8、12、16、20、24周的刺身鱼水分进行测定,每组3个平行。在正式对样品进行测试之前,需要用标准油样在Q-FID序列下对仪器和系统进行校正。校正完成后,反复试验直到找到样品的最佳脉冲重复序列时间,最后在Q-CPMG序列下对样品进行水分测定。参数设置为:工作温度32 ℃,质子共振频率20 MHz,采样点数240 154,脉冲重复序列时间3 500 ms,采样频率200 kHz,累加次数2,回波时间0.2 ms。将测得的数据进行反演,得到各水分群对应的弛豫时间及峰积分面积。
水分测定完成之后利用核磁共振成像系统对样品进行成像处理。在成像之前,需用标准油样对仪器和成像系统进行校正,成像后用仪器自带的图像处理软件对图片进行统一映射和伪彩处理。参数设置为:以俯视图为成像方位,重复时间500 ms,回波时间20 ms。
1.3.4 HE染色分析
配制10%(体积分数)中性甲醛固定液,将在3种 不同温度贮藏条件下贮藏了24周的刺身鱼样品分别取出后快速修整为2 cm×2 cm×2 cm的方块,并迅速放入配好的固定液中持续固定48~72 h。将固定好的样品取出依次进行脱水、包埋、切片等操作,最终制得切片样品。而后将其脱蜡,使用苏木精染色后冲洗,再用盐酸酒精分化,再次冲洗后放入50 ℃的温水中或弱碱性水溶液返蓝,直到出现蓝色为止。取出用自来水冲洗后放入85%的酒精,再用伊红对其染色,水洗后用梯度酒精进行脱水,经二甲苯透明后利用中性树胶封固。最后用数字切片扫描仪对切片进行图像采集,选择要观察的区域放大(×100),观察刺身鱼的肌纤维状态及冰晶形成情况。
1.4 数据分析
所有实验数据均用SPSS 26.0做方差分析及差异显著性分析,作图利用Origin Pro 9.0进行绘制。
2 结果与分析
2.1 不同温度贮藏条件下刺身鱼的冻结曲线
利用温度标签获得了3种不同温度贮藏条件下的刺身鱼样品中心温度随冻结时间的变化曲线,其冻结点在-1.8 ℃左右,这与鱼肉的冻结点在-2.0~-0.6 ℃相符合[17]。如图1所示,刺身鱼降温过程可大致分为3个阶段。在第一阶段,3种不同温度贮藏条件下的刺身鱼中心温度从初温快速降低至-1.8 ℃, 这是因为此时刺身鱼放出的热量是显热,这部分热量与全部放出的热量相比,其值较小,所以降温速度快,曲线较陡[18];在第二阶段,3组刺身鱼样品中心温度从冻结点降低至-5 ℃过程中降温速率缓慢,并且都在-1.8 ℃持续了一段时间,在图中表现为重叠。其中-18 ℃低温处理组的持续时间最长,达到了64 min,而该组通过第二阶段的时间长达152 min。 这是因为此时为冰结晶最大生成带,刺身鱼中的大部分水结成冰晶,放出大量的潜热,而在整个冻结过程中,刺身鱼的绝大部分热量都在此阶段放出,因此刺身鱼在该阶段的降温速率慢,冻结曲线平坦;在第三阶段,经过潜热释放带之后,3组刺身鱼中心温度从-5 ℃继续下降至终温,其降温速率开始上升,冻结曲线斜率增大。此时放出的热量一部分是由于已结晶的部分继续降温至冻结终温,另一部分是由于剩余少量的水继续结晶[19],所以此时的曲线不如第一阶段陡峭。
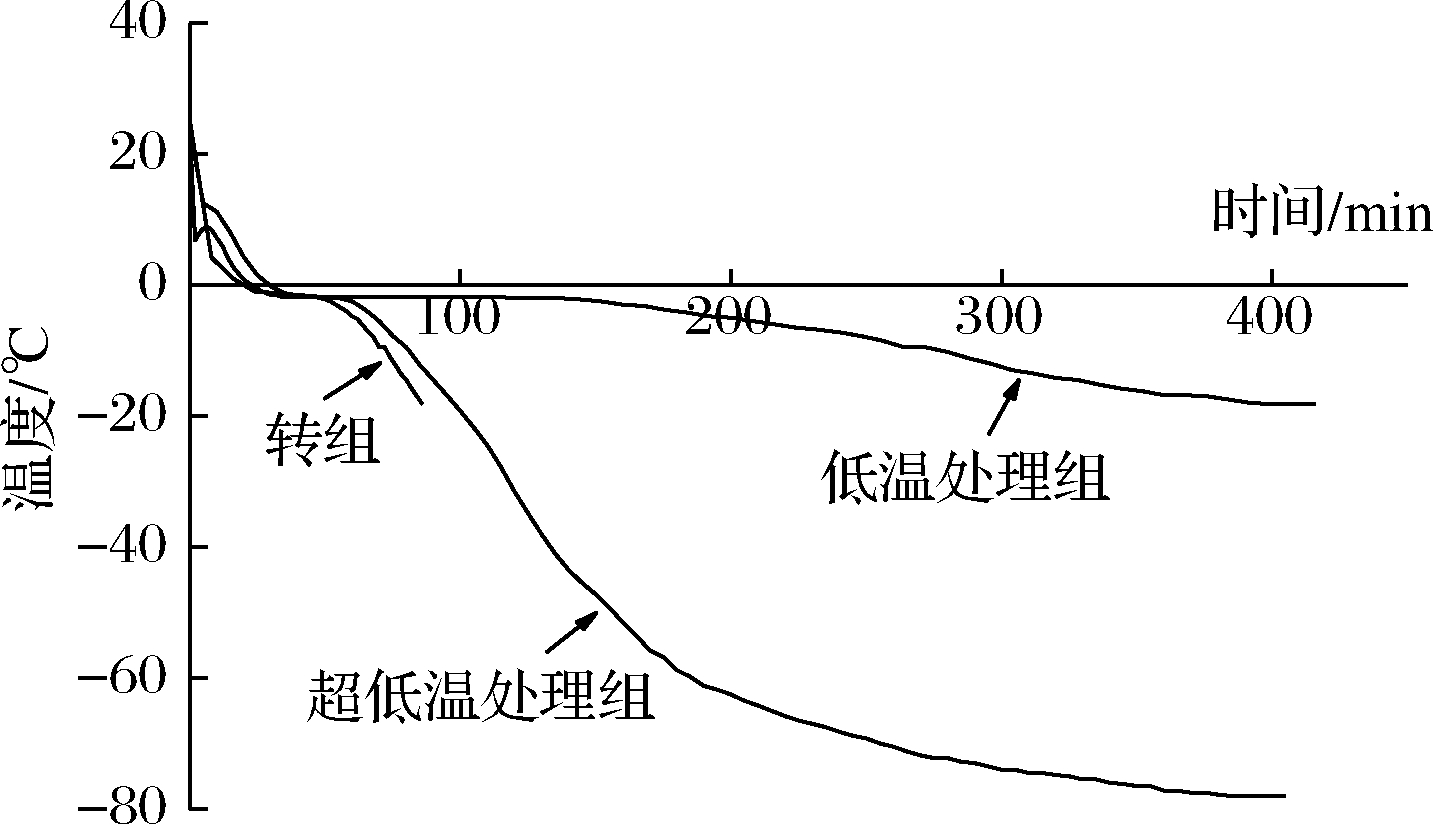
图1 不同贮藏条件下刺身鱼的冻结曲线
Fig.1 Freezing curves of sashimi under different storage conditions
食品中心温度通过冰结晶最大生成带的热交换对食品冻结速度的影响很大,而冻结速度不仅关系到食品中冰晶的大小,更是关系到食品中的水分迁移[20]。比较3种不同贮藏条件下刺身鱼中心温度通过冰结晶最大生成带的时间发现,超低温处理组和转组用时29 min,与低温处理组(152 min)相比明显耗时较短;对于3组刺身鱼中心温度从初温降至终温的整个冻结过程中,超低温处理组(终温为-78 ℃)耗时385 min,低温处理组(终温为-18 ℃)耗时400 min, 而转组(终温为-18 ℃)仅耗时86 min。由此可见,贮藏温度越低,刺身鱼中心温度降温速率越快,且其经过冰结晶最大生成带的时间越短,越有利于刺身鱼快速冻结。
2.2 不同温度贮藏条件下刺身鱼的水分分析
2.2.1 不同温度贮藏条件下刺身鱼的低场核磁共振图谱
LF-NMR可用于评价水分在食品中的呈现状态,图2对刺身鱼弛豫时间数据进行多指数拟合,得到不同温度贮藏条件下刺身鱼弛豫时间随贮藏时间变化的低场核磁共振图谱。如图2所示,在3种不同温度贮藏条件下,刺身鱼样品在0~10 000 ms之间均呈现出3~4个峰,弛豫时间T2越短,说明水分的自由度越低[21]。其中,弛豫时间最短的水分群T2b(0~10 ms)被认为是与大分子紧密结合且不受外界条件影响的结合水;弛豫时间最长的水分群T22和T23(100~10 000 ms) 是主要依靠毛细管凝结作用存在于肌纤维蛋白网络外的自由水[22];而弛豫时间介于两者之间的水分群T21(10~100 ms)是被困在蛋白密集的肌纤维网络中的不易流动水[23]。因此可以看出,不同温度贮藏条件下的刺身鱼在贮藏期间均存在着3种不同状态的水分群,且其中的不易流动水为刺身鱼的主要水分群。
不同的横向弛豫时间对应的峰面积表示不同状态水分的相对含量,如图2所示,各水分群的峰面积随着贮藏时间的延长而变化,表明3种不同温度贮藏条件下的刺身鱼均存在着不同程度的迁移情况。且随着贮藏时间的延长,各水分群对应的弛豫时间均呈现出右移趋势,这与ZHANG等[24]和LI等[25]分别对猪最长肌和速冻猪肉肉饼在冻藏期间的水分研究结论一致。但在图2-c中,超低温处理组的弛豫时间右移程度与低温处理组和转组相比较小,这说明贮藏温度越低,对刺身鱼水分自由度的影响越小[21]。由图2可知,3种不同温度贮藏条件下的刺身鱼在贮藏后期都出现了自由度更高的一组水分群T23,这可能是由于贮藏过程中形成的冰晶和再结晶对刺身鱼细胞造成了机械损伤,同时在冻结过程中离开细胞进入细胞外间隙的水无法返回细胞内间隙[26],最终导致刺身鱼内自由水增加,水分自由度增大。
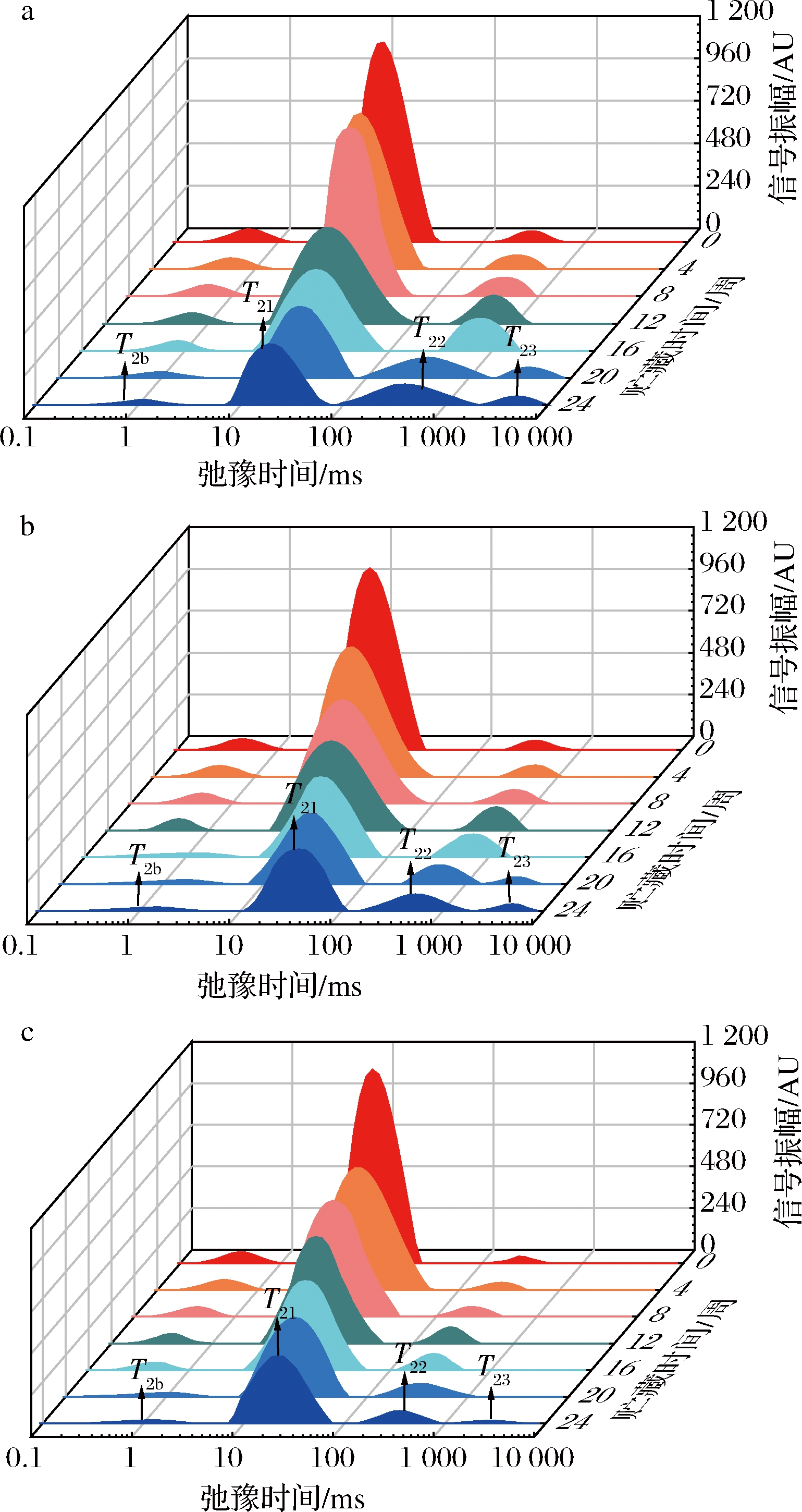
a-低温处理组; b-转组;c-超低温处理组
图2 不同处理组刺身鱼低场核磁共振图谱
Fig.2 Low-field NMR map of sashimi in different treatment groups
2.2.2 不同温度贮藏条件下刺身鱼的水分含量
图3和图4分别表示了不同温度贮藏条件下的刺身鱼在贮藏期间水分总峰面积的变化情况和其内部各水分群的相对含量变化情况。如图3所示,贮藏温度越低,刺身鱼中水分总峰面积越小,但在贮藏过程中,同一贮藏时间下转组和超低温处理组的水分总峰面积差别不显著(P>0.05)。3种不同温度贮藏条件下的刺身鱼在其贮藏期间的水分总峰面积均呈现显著下降的趋势(P<0.05),这是因为不易流动水是其中主要的水分群,受不易流动水的含量影响最大,因此呈现出与图7中相同的下降趋势。而在图4中,0~24周的贮藏期内,3种贮藏条件下的刺身鱼内结合水相对含量的波动较为平缓,且变化幅度较小,均在4.3%~5.0%左右,这是因为结合水是与大分子紧密结合的水分群,受温度等外界条件的影响极小。低温处理组、超低温处理组和转组的刺身鱼在贮藏过程中的不易流动水相对含量均随着时间的延长显著减少(P<0.05),分别从91.63%、93.73%、92.36%下降至61.18%、81.34%、72.40%,而自由水随时间延长显著增加(P<0.05),分别由3.45%、 1.74%、3.12%增加至34.36%、14.28%、 23.23%。但在贮藏前期,不同贮藏条件下的刺身鱼内不易流动水和自由水变化均不显著(P>0.05)。这表明不同温度贮藏条件下刺身鱼内均存在不易流动水向自由水迁移的现象,但这种水分迁移的程度受温度影响较大,贮藏温度越低,刺身鱼内水分迁移的量越少。
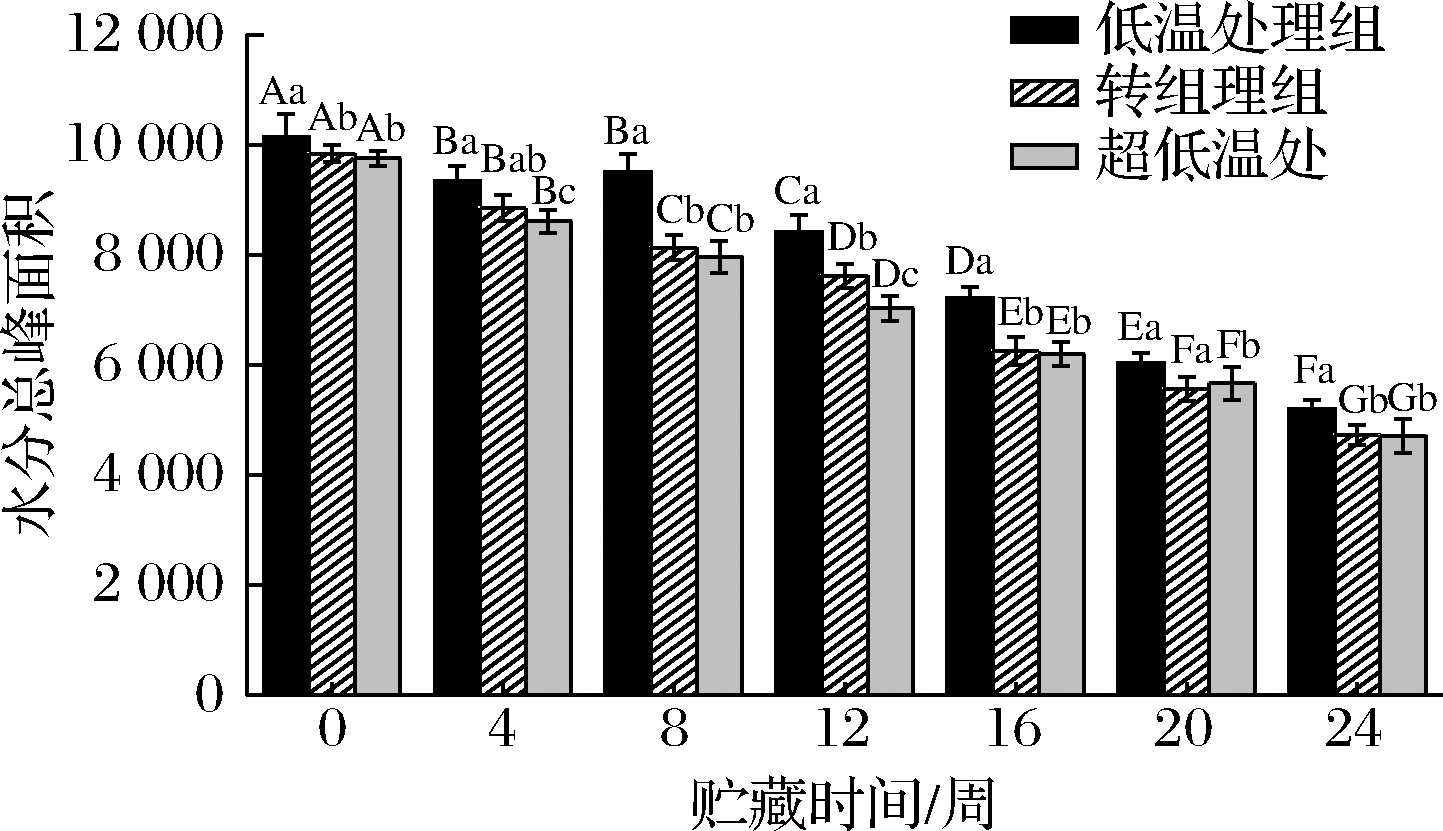
图3 不同贮藏条件下刺身鱼水分总峰面积随贮藏时间的变化
Fig.3 Changes of total peak moisture area of sashimi with storage time under different storage conditions
注:不同大写字母表示组内差异显著(P<0.05);不同小写字母表示组间差异显著(P<0.05)(下同)

a-结合水相对含量;b-不易流动水相对含量;c-自由水相对含量
图4 不同贮藏条件下刺身鱼内各水分群相对含量变化
Fig.4 Changes of relative contents of moisture groups in sashimi under different storage conditions
2.2.3 不同温度贮藏条件下刺身鱼的MRI成像
作为一种无损的食品基质内部结构可视化技术,MRI已广泛应用于食品水分分布的研究[27]。为了更直观地了解刺身鱼在贮运过程中内部水分的变化信息,对不同温度贮藏条件下的刺身鱼进行了MRI成像分析。图像经过伪彩处理后如图5所示,图中越亮(越趋近于黄色)的区域表示1H密度信号越强,该区域的水分越多;反之(越趋近于蓝色),则1H密度信号越弱,该区域的水分越少。随着贮藏时间的延长,3种 不同温度贮藏条件下的刺身鱼MRI图的亮度均呈现出由高到低的衰减趋势,这与其水分总峰面积的变化相符。在贮藏中期,1H密度信号从内部区域到外部区域呈不断增强的趋势,这表明水从肌纤维内逐渐排出,迁移到肌纤维间隙[28]。到贮藏后期,刺身鱼中的水分重新恢复均匀分布,但样品边缘信号较弱,外部轮廓较为模糊。这可能是因为贮藏达到后期,刺身鱼肌纤维组织损坏严重,导致体系对水分子的束缚能力下降,使得水分逐渐恢复均匀分布[29]。从不同温度的贮藏条件来看,低温处理组的伪彩图像亮度减弱最明显,说明刺身鱼在此条件下的水分流失最严重。

图5 不同贮藏条件下刺身鱼的MRI成像
Fig.5 MRI imaging of sashimi under different storage conditions
2.3 不同温度贮藏条件下刺身鱼的HE染色分析
为了观察刺身鱼的肌纤维状态以及冰晶的形成状况,通过HE染色的方式对其进行了处理。图6展示了在不同温度贮藏条件下贮藏了24周的刺身鱼肌纤维组织状态、冰晶大小及分布情况。图中红色片状区域为刺身鱼正常肌纤维组织,浅红色点状区域为损坏的肌纤维组织,而白色空洞区域则为冰晶。由图6可知,刺身鱼肌纤维分布均匀。其中,低温处理组的刺身鱼内肌纤维坏死溶解最多,在一个视野内的冰晶最少且体积最大;转组的刺身鱼内肌纤维坏死溶解较少,形成的冰晶较低温处理组多且小;超低温处理组的刺身鱼内肌纤维保持最好,形成的冰晶最多且体积最小。冰晶的形成会对刺身鱼肌肉组织造成损害,且这种损害是不可逆的,冰晶越大,刺身鱼肌肉组织受到的损伤越大[30-31],同时这也是水分从肌纤维内的不易流动水向肌纤维外的自由水迁移的重要原因。因此,低温处理组的刺身鱼肌纤维坏死溶解最多,导致该组刺身鱼体系内的持水能力最差,水分损失最为严重。而超低温处理组因其经过冰结晶最大生成带的时间最短,冻结速度最快,组织细胞内向细胞外转移的水分少,能使那些尚处于原来状态的汁液迅速形成量多而细小的冰晶,对组织造成的损伤小,所以该组的肌纤维能较完整地保持。HE染色的微观观察结果为冰晶对肌纤维造成的机械损伤提供了直接证据,并且支撑和验证了LF-NMR以及MRI对刺身鱼水分研究的结果。
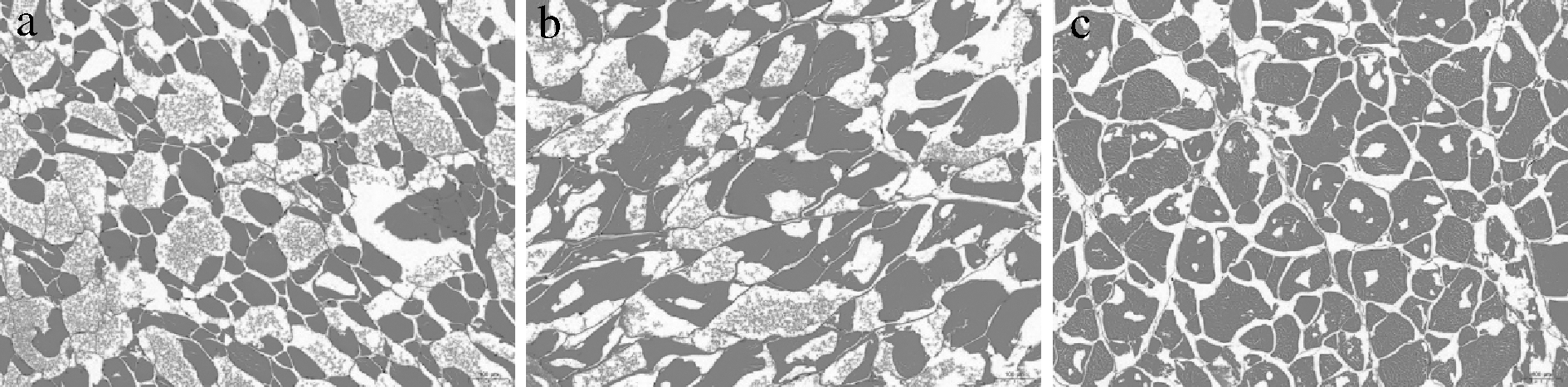
a-低温处理组; b-转组; c-超低温处理组
图6 不同贮藏条件下刺身鱼的微观结构组织
Fig.6 Microstructure of sashimi under different storage conditions
3 结论
通过LF-NMR和HE染色分析对低温处理组、超低温处理组、转组3种不同温度贮藏过程中刺身鱼内水分随贮藏时间的变化进行了探究。研究发现,在3种不同温度贮藏过程中的刺身鱼内均存在结合水、不易流动水和自由水3种不同状态的水分群,其中不易流动水为刺身鱼的主要水分群;在0~24周的贮藏期内,低温处理组、超低温处理组和转组中的不易流动水和自由水相对含量随贮藏时间变化显著(P<0.05), 其中不易流动水相对含量分别从91.63%、93.73%、92.36%下降至61.18%、81.34%、72.40%,自由水分别由3.45%、1.74%、3.12%增加至34.36%、14.28%、23.23%,而结合水相对含量在3种贮藏过程中均处于4.3%~5.0%,波动幅度均较小;水分分布则由贮藏初期的均匀分布变化为由内向外迁移,到贮藏后期又重新恢复均匀状态,且3种不同温度贮藏条件下的刺身鱼均有不同程度的水分流失。此外,超低温处理组和转组的刺身鱼通过冰结晶最大生成带的时间最短,均为29 min,更有利于刺身鱼快速冻结。结合HE染色结果可知,在超低温处理组中,刺身鱼内形成的冰晶尺寸最小,对肌纤维造成的机械损伤小,有利于肌纤维的完整保持和体系内持水力的维持,水分迁移量更少。因此,一直处于超低温条件下进行贮运的刺身鱼在水分和肌纤维保持方面都具有良好的效果,能更好地保证其冻结品质。
[1] HE Q, LI Z Y, YANG Z, et al.A superchilling storage-ice glazing (SS-IG) of Atlantic salmon (Salmo salar) sashimi fillets using coating protective layers of Zanthoxylum essential oils (EOs)[J].Aquaculture, 2020, 514:734506.
[2] BELTR N J A, BELLÉS M.Effect of Freezing on the Quality of Meat[M].Amsterdam: Elsevier, 2019:493-497.
N J A, BELLÉS M.Effect of Freezing on the Quality of Meat[M].Amsterdam: Elsevier, 2019:493-497.
[3] XANTHAKIS E, HAVET M, CHEVALLIER S, et al.Effect of static electric field on ice crystal size reduction during freezing of pork meat[J].Innovative Food Science & Emerging Technologies, 2013, 20:115-120.
[4] LI D M, ZHU Z W, SUN D W.Effects of freezing on cell structure of fresh cellular food materials:A review[J].Trends in Food Science & Technology, 2018, 75:46-55.
[5] 赵金红, 胡锐, 刘冰, 等.几种冷冻新技术对食品冻结过程中冰晶形成的影响[J].食品与机械, 2012, 28(6):241-245.
ZHAO J H, HU R, LIU B, et al.Effect of novel freezing technologies on ice crystals during food freezing[J].Food & Machinery, 2012, 28(6):241-245.
[6] 陈成, 王晓曦, 王瑞, 等.核磁共振技术在食品中水分迁移状况的研究现状[J].粮食与饲料工业, 2015(8):5-8;13.
CHEN C, WANG X X, WANG R, et al.Research progress of moisture migration in food by nuclear magnetic resonance[J].Cereal & Feed Industry, 2015(8):5-8;13.
[7] S NCHEZ-ALONSO I, MORENO P, CARECHE M.Low field nuclear magnetic resonance (LF-NMR) relaxometry in Hake (Merluccius merluccius L.) muscle after different freezing and storage conditions[J].Food Chemistry, 2014, 153:250-257.
NCHEZ-ALONSO I, MORENO P, CARECHE M.Low field nuclear magnetic resonance (LF-NMR) relaxometry in Hake (Merluccius merluccius L.) muscle after different freezing and storage conditions[J].Food Chemistry, 2014, 153:250-257.
[8] MCDONNELL C K, ALLEN P, DUGGAN E, et al.The effect of salt and fibre direction on water dynamics, distribution and mobility in pork muscle:A low field NMR study[J].Meat Science, 2013, 95(1):51-58.
[9] SØRLAND G H, LARSEN P M, LUNDBY F, et al.Determination of total fat and moisture content in meat using low field NMR[J].Meat Science, 2004, 66(3):543-550.
[10] ANTEQUERA T, CABALLERO D, GRASSI S, et al.Evaluation of fresh meat quality by hyperspectral imaging (HSI), nuclear magnetic resonance (NMR) and magnetic resonance imaging (MRI):A review[J].Meat Science, 2021, 172:108340.
[11] TAN M Q, LIN Z Y, ZU Y X, et al.Effect of multiple freeze-thaw cycles on the quality of instant sea cucumber:Emphatically on water status of by LF-NMR and MRI[J].Food Research International, 2018, 109:65-71.
[12] 冯爱博, 杨光, 贺亮, 等.低场核磁共振技术对不同贮藏条件下雷竹笋水分迁移规律的研究[J].食品与发酵科技, 2018, 54(1):18-23.
FENG A B, YANG G, HE L, et al.Study on the migration of bamboo shoots with different storage conditions by low-field magnetic resonance spectroscopy[J].Food and Fermentation Sciences & Technology, 2018, 54(1):18-23.
[13] 罗洁莹, 汤梅, 丘苑新, 等.利用LF-NMR技术研究鹰嘴蜜桃在贮藏过程中水分的变化[J].仲恺农业工程学院学报, 2019, 32(1):23-27;34.
LUO J Y, TANG M, QIU Y X, et al.Change of water status during olecranon peach storage by LF-NMR technique[J].Journal of Zhongkai University of Agriculture and Engineering, 2019, 32(1):23-27;34.
[14] 樊燕, 侯虎, 孙晨阳, 等.加工方式对俄罗斯鲟鱼肉水分状态的影响[J].中国食品学报, 2017, 17(6):97-102.
FAN Y, HOU H, SUN C Y, et al.Effects of processing methods on the moisture status change of Russian sturgeon[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(6):97-102.
[15] 梁雯雯, 杨天, 郑志红, 等.升温方式对二段加热鲢鱼糜水分分布和品质的影响[J].大连海洋大学学报, 2021,36(4):646-652.
LIANG W W, YANG T, ZHENG Z H, et al.Effects of heating methods on water distribution and quality of silver carp surimi during two stage heating[J].Journal of Dalian Ocean University, 2021,36(4):646-652.
[16] 陈佳奇, 刘天毅, 贾逾泽, 等.水煮鱼微波烹饪过程中鱼肉水分及组织变化对嫩度的影响[J].食品与机械, 2020, 36(4):51-55.
CHEN J Q, LIU T Y, JIA Y Z, et al.Effects of moisture and tissue changes on tenderness of boiledfish during microwave cooking[J].Food & Machinery, 2020, 36(4):51-55.
[17] 赵征, 张民.食品技术原理 第2版[M].北京:中国轻工业出版社, 2014.
ZHAO Z, ZHANG M.Food Technology Principles (second edition) [M].Beijing:China Light Industry Press, 2014.
[18] 李玉环, 范秀萍, 秦小明, 等.3种石斑鱼不同部位冻结特性的比较研究[J].食品研究与开发, 2018, 39(1):11-16.
LI Y H, FAN X P, QIN X M, et al.Comparison of freezing characteristics in different parts from three kinds of groupers[J].Food Research and Development, 2018, 39(1):11-16.
[19] 刘会省, 迟海, 杨宪时, 等.冻结方式对南极磷虾品质的影响[J].现代食品科技, 2013, 29(7):1 601-1 605.
LIU H X, CHI H, YANG X S, et al.Effects of freezing methods on the quality of Antarctic krill (Euphausia superba) [J].Modern Food Science and Technology, 2013, 29(7):1 601-1 605.
[20] 许澄. 草鱼冻藏品质变化及草鱼新鲜度快速检测方法探究[D].上海:上海海洋大学, 2015.
XU C.Quality changes of frozen grass carp & fast detection method for grass carp based on machine vision[D].Shanghai:Shanghai Ocean University, 2015.
[21] 马莹, 杨菊梅, 王松磊, 等.基于LF-NMR及成像技术分析牛肉贮藏水分含量变化[J].食品工业科技, 2018, 39(2):278-284.
MA Y, YANG J M, WANG S L, et al.Analysis of water content in beef storage by LF-NMR and imaging technique[J].Science and Technology of Food Industry, 2018, 39(2):278-284.
[22] BERTRAM H C, DØNSTRUP S, KARLSSON A H, et al.Continuous distribution analysis of T2 relaxation in meat—An approach in the determination of water-holding capacity[J].Meat Science, 2002, 60(3):279-285.
[23] S NCHEZ-ALONSO I, MARTINEZ I, S
NCHEZ-ALONSO I, MARTINEZ I, S NCHEZ-VALENCIA I, et al.Estimation of freezing storage time and quality changes in hake (Merluccius merluccius L.) by low field NMR[J].Food Chemistry, 2012, 135(3):1 626-1 634.
NCHEZ-VALENCIA I, et al.Estimation of freezing storage time and quality changes in hake (Merluccius merluccius L.) by low field NMR[J].Food Chemistry, 2012, 135(3):1 626-1 634.
[24] ZHANG M C, XIA X F, LIU Q, et al.Changes in microstructure, quality and water distribution of porcine longissimus muscles subjected to ultrasound-assisted immersion freezing during frozen storage[J].Meat Science, 2019, 151:24-32.
[25] LI F F, ZHONG Q, KONG B H, et al.Deterioration in quality of quick-frozen pork patties induced by changes in protein structure and lipid and protein oxidation during frozen storage[J].Food Research International, 2020, 133:109142.
[26] DU X, CHANG P, TIAN J Y, et al.Effect of ice structuring protein on the quality, thermal stability and oxidation of mirror carp (Cyprinus carpio L.) induced by freeze-thaw cycles[J].LWT, 2020, 124:109140.
[27] ADILETTA G, IANNONE G, RUSSO P, et al.Moisture migration by magnetic resonance imaging during eggplant drying:A preliminary study[J].International Journal of Food Science & Technology, 2014, 49(12):2 602-2 609.
[28] CHENG S S, WANG X H, LI R R, et al.Influence of multiple freeze-thaw cycles on quality characteristics of beef semimembranous muscle:With emphasis on water status and distribution by LF-NMR and MRI[J].Meat Science, 2019, 147:44-52.
[29] 李靖. 不同冻藏时间猪背最长肌的品质变化研究[D].成都:西华大学, 2018.
LI J.Quality changes of pork longissimus dorsi with different frozen storage time[D].Chengdu:Xihua University, 2018.
[30] 洪惠, 朱思潮, 罗永康, 等.鳙在冷藏和微冻贮藏下品质变化规律的研究[J].南方水产科学, 2011, 7(6):7-12.
HONG H, ZHU S C, LUO Y K, et al.Quality changes of bighead carp (Aristichthys nobilis) during chilled and partial freezing storage[J].South China Fisheries Science, 2011, 7(6):7-12.
[31] ZHANG B, ZHAO J L, CHEN S J, et al.Influence of trehalose and alginate oligosaccharides on ice crystal growth and recrystallization in whiteleg shrimp (Litopenaeus vannamei) during frozen storage with temperature fluctuations[J].International Journal of Refrigeration, 2019, 99:176-185.