黄皮(Clausena lansium L.)属芸香科黄皮属小乔木,种质资源丰富,主要分布于我国南部广东、广西、福建、海南、云南及台湾等地,在澳大利亚、北美及中美地区也有栽培[1]。黄皮在我国华南地区已有1 500多年的种植历史,是我国南方的一种特产名果,果实外形与葡萄相似,风味独特,富含多种酚类、有机酸及氨基酸等生物活性物质[2],具有抗氧化、抑肿瘤、预防老痴呆等多种功效[3-4]。据《中华本草》记载,黄皮具有行气、消食、化痰等功效,是一种药食同源水果,深受南方地区消费者喜爱[5-6]。但黄皮产期短,每年的5~7月为黄皮的成熟期,采收集中,且果实水分含量高,果皮薄、果肉柔软多汁,采收过程中易遭机械性损伤,易褐变或腐烂变质,不易贮藏和运输[7-8],很大程度上限制了黄皮果的开发利用,生产上多将其加工成凉果、果酱和果酒等深加工产品,从而提高黄皮的利用价值。
“黄皮鼓”作为潮州三宝之一,是典型的广式传统凉果,深受岭南地区消费者喜爱,是逢年过节馈赠亲友的良品佳果。黄皮鼓的制作,一般要经过去核、盐渍、晒胚、脱盐、熟化、糖渍、调味和干燥等工序[9],其盐渍和脱盐过程不仅会造成盐水排放污染,还会造成黄皮营养物质的大量流失。将黄皮果清洗去核后直接干燥,制作成黄皮果干,可以有效替代黄皮盐胚,不仅能对黄皮进行有效保藏,还能更大程度地保留黄皮原有的功效成分。目前关于黄皮凉果的加工研究,主要集中在“黄皮盐胚到黄皮凉果”阶段的制备工艺研究[9-10],而关于黄皮干燥特性及品质研究报道较少。CHOKEPRASERT等[11]研究了热风干燥、真空干燥和晒干对黄皮品质的影响,发现40 ℃真空干燥黄皮色泽保留最佳,但耗时最长;朱婷婷等[12]研究了促干剂处理对黄皮热风干燥过程中水分迁移及物理品质的影响,发现促干剂处理可以提高黄皮干燥速率、提升质构及抑制褐变。热风干燥具有设备简单,成本低,操作简便,处理量大等优点,目前仍被广泛用于果蔬干燥的实际生产[13]。本研究通过探讨不同热风干燥温度下黄皮干燥特性,分析其多酚、有机酸及游离氨基酸含量和抗氧化等营养功能指标,明确干燥温度对黄皮果干品质的影响,以期为黄皮的进一步加工提供理论和技术支撑。
1 材料与方法
1.1 材料与试剂
鸡心黄皮,购于广州市水果市场,水分含量为(78.4 ±1.5)%,剪枝、除杂后挑选成熟度一致、外观完好的黄皮清洗,用小刀在其表面划开一道口子,去核后开展干燥试验。
酚类物质标准品:丁香苷、儿茶素、绿原酸、表儿茶素、丁香酸、香草酸、香兰素、阿魏酸、芦丁、橙皮素、槲皮素,有机酸标准品(酒石酸、苹果酸、柠檬酸),上海源叶生物科技有限公司;Trolox试剂,美国Sigma公司;福林酚试剂,上海楷洋生物技术有限公司;其他试剂均为国产色谱纯或分析纯。
1.2 仪器与设备
101-3ABS电热鼓风干燥箱,上海科恒实业发展有限公司;UV-1800型紫外分光光度计,日本岛津公司;Agilent 1200 series型高效液相色谱仪,美国安捷伦科技有限公司;L-8900型全自动氨基酸分析仪,日本日立公司。
1.3 方法
1.3.1 干燥工艺流程
准确称量(250±5.0) g新鲜去核黄皮,分别于50、60、70和80 ℃条件下进行热风干燥,风速设定为2.4 m/s,至干基含水率小于0.16 g/g后,停止干燥[12],样品装入自封袋中置于-20 ℃冰箱中保存待用。
1.3.2 复水曲线的测定
复水曲线的测定,参考ZHAO等[14]的方法,略有修改。准确称取不同温度干燥样品(5±0.5) g,室温条件下,按固液比1∶50(g∶mL)进行复水试验,每隔1 h 将样品取出,拭去样品表面水分,进行称重,至样品质量增加低于0.3 g时停止复水,复水比按公式(1)计算:
![]()
(1)
式中:RR为样品的复水比;Mt为样品复水至某一时刻的质量;M0为称取的干燥样品质量。
1.3.3 总酚和黄酮含量的测定
1.3.3.1 样液的制备
参考TAN等[15]的方法,略作修改。将上述不同干燥温度制备的黄皮果干打粉,过80目筛,用万分之一天平准确称量黄皮粉样品约1.0 g于25 mL离心管中,加入8 mL 80%(体积分数)甲醇,超声(频率40 KHz、 功率200 W)提取30 min,8 000 r/min离心10 min后取上清,重复提取1次,合并上清后定容至20 mL后制得提取液,于4 ℃下留存备用。
1.3.3.2 总酚含量的测定
取0.2 mL稀释一定倍数的提取液于试管中,补蒸馏水至2 mL,加1 mL 10%(质量分数)福林酚,涡旋混匀后静置6 min,随后加入2 mL 7.5% (质量分数) Na2CO3溶液,涡旋混匀后定容至10 mL,于75 ℃下反应10 min,以80%的甲醇溶液作为空白对照,于765 nm波长下测定其吸光值。以没食子酸为标准物质绘制标准曲线,结果以单位质量黄皮粉干物质中没食子酸当量表示,单位为mg/g干基。
1.3.3.3 总黄酮含量的测定
取0.5 mL稀释一定倍数的提取液于试管中,加0.3 mL 5% (质量分数) NaNO2,涡旋混匀后静置6 min, 随后加0.3 mL 10% (质量分数) Al(NO3)3,涡旋混匀后放置6 min,加4 mL 4% (质量分数) NaOH,涡旋混匀后定容至10 mL,于室温下静置15 min, 以80%的甲醇溶液作为空白对照,于510 nm波长下测定期吸光值。以芦丁为标准物质绘制标准曲线,结果以单位质量干基黄皮粉的芦丁当量表示,单位为mg/g干基。
1.3.4 酚类物质含量的测定
酚类物质的含量采用HPLC测定。取1 mL上述1.3.3.1 中制备的提取液,过0.22 μm有机滤膜后待测,测定条件参考YE等[2]的方法,略作修改。色谱条件:C18色谱柱(4.6 mm×250 mm,5 μm),柱温35 ℃,二极管阵列检测器,检测波长280 nm;流动相:A:1%(体积分数)甲酸,B:甲醇,梯度洗脱:0~0.01 min, 40% B; 0.01~10 min, 60% B;10~20 min, 80% B;20~30 min, 100% B;30~40 min, 40% B;流速:0.9 mL/min,进样量:10 μL。
1.3.5 有机酸含量的测定
有机酸的测定采用HPLC测定。参考QIU等[16]的方法,用0.3%(质量分数)偏磷酸提取,振荡2 min,转速12 000 r/min 下离心15 min,取上清制得提取液,过0.22 μm水系滤膜后待测。色谱条件:C18色谱柱(4.6 mm×250 mm,5 μm),柱温30 ℃,二极管阵列检测器,检测波长210 nm;流动相:0.1 mol/L (NH4)2HPO4,pH值2.7,流速:1 mL/min,进样量:10 μL。
1.3.6 游离氨基酸的测定
游离氨基酸采用L-8900型全自动氨基酸分析仪测定。样品前处理方法参考PU等[17]的方法,略作修改,具体为:准确称取1 g黄皮粉样品,加入4 mL 80 g/L 的5-磺基水杨酸,振荡混匀,超声提取20 min后,用高速离心机在12 000 r/min下离心15 min,取上清液定容至5 mL。取0.8 mL定容后溶液,加3.2 mL 无水乙醇,涡旋混合1 min后静置醇沉4 h,用高速离心机在12 000 r/min下离心15 min,去除多糖,所得上清液过0.22 μm滤膜,于棕色进样瓶中待测。
1.3.7 抗氧化能力的测定
1.3.7.1 DPPH自由基清除能力
参考TAN等[15]的方法,略作修改。将1.3.3.1制备的提取液稀释一定倍数后,取2 mL加入4 mL DPPH自由基溶液完全混合,室温避光反应30 min,于517 nm处测定吸光值,空白组以2 mL 80%甲醇代替待测溶液。以0、20、30、40、60、80、100 μmol/L的Trolox为标准溶液,绘制标准曲线。抗氧化结果均以单位质量黄皮干基中含有Trolox当量表示,单位为μmol/g 干基。
1.3.7.2 ABTS阳离子自由基清除能力
参考TAN等[15]的方法,将1.3.3.1制备的提取液稀释一定倍数后,取0.1 mL与3.6 mL ABTS阳离子自由基溶液混合,室温静置1 min,于734 nm处测定吸光值,空白组以0.1 mL 80%甲醇代替待测溶液。以0、25、50、75、100、125、150 μmol/L的Trolox为标准溶液,绘制标准曲线。
1.3.7.3 铁离子还原抗氧化能力(ferric ion reducing antioxidant power, FRAP)
参考SI等[18]的方法,将1.3.3.1制备的提取液稀释一定倍数后,吸取0.2 mL加入6 mL FRAP工作液,涡旋混合,37 ℃保温30 min后于593 nm处测定吸光值,空白组以0.2 mL 80%甲醇代替待测溶液。以0、100、200、300、400、500、600、700、800 μmol/L的Trolox溶液为标准溶液,绘制标准曲线。
1.3.8 数据分析
每组实验重复3次,采用SPSS 17.0进行方差分析,选取t检验比较不同处理组间的显著性差异(P<0.05),结果采用均值±标准差表示;图采用Origin 8.0进行绘制。
2 结果与分析
2.1 不同干燥温度对干燥特性的影响
不同干燥温度对黄皮干燥速率影响显著。如图1-A所示,不同温度条件下,随着干燥时间的延长,黄皮干基含水率均逐渐下降,干燥温度越高,干燥曲线越陡,所需干燥时间越短。当干燥温度分别为50、60、70、80 ℃时,黄皮的干燥时间分别为42、30、20和12 h。温度的升高不仅能加速黄皮表面水分的蒸发,而且能够降低气体相对湿度,导致黄皮表面与空气的相对湿度差增加,从而增加水分扩散动力,缩短干燥时间。进一步,通过干燥速率曲线(图1-B)可知,黄皮在干燥过程中主要经历加速和降速2个阶段,且降速期比加速期长。初期干基含水率为3.22 g/g时,50、60、70、80 ℃条件下的干燥速率比例为1∶1.02∶1.48∶2.49;后期干燥至干基含水率为0.2 g/g时,4个 温度条件下的干燥速率比例为1∶1.67∶2.83∶6.67,表明干燥温度对干燥后期的样品的水分扩散速率影响大于干燥前期。这主要是因为,干燥过程主要为降速阶段,黄皮在干燥过程中,黄皮内部水分扩散占主导因素,直接控制黄皮干燥速率的变化,这与苹果、猕猴桃等多数高糖物料的干燥特性一致[19-20]。在干燥后期,由于黄皮样品表皮失水褶皱变形,导致剩余水分难以向外挥发,高温干燥时,分子运动加快,物料表面的热空气对流加快,物料内体积热增加,加速水分子运动,导致水分扩散速率显著高于低温干燥,这与朱婷婷等[12]对黄皮干燥的研究结果一致。
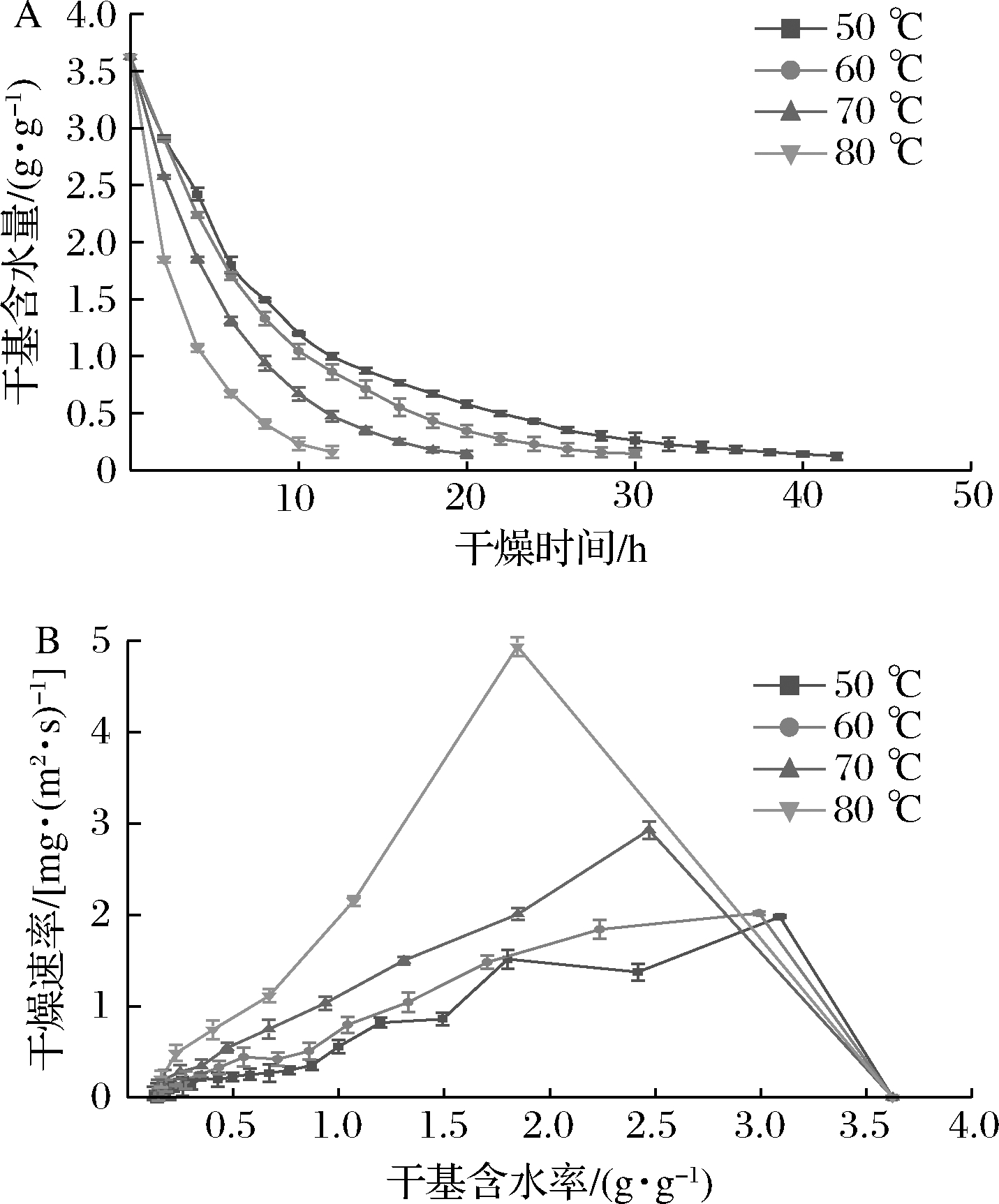
A-干燥曲线;B-干燥速率曲线
图1 不同干燥温度黄皮干燥特性
Fig.1 Drying characteristic curves of wampee at different drying temperatures
2.2 不同干燥温度对复水特性的影响
复水特性是衡量干制品品质的常用指标之一,可以体现干制品重新吸收水分恢复到新鲜状态的程度。如图2可知,随着干燥时间的延长,不同温度干燥黄皮复水比逐渐增大,最后趋于稳定。不同干燥温度对黄皮复水速率和终末复水比影响显著,50 ℃和80 ℃干燥样品复水速率和终末复水比显著低于60 ℃和70 ℃干燥样品(P<0.05),50、60、70和80 ℃干燥的黄皮终末复水比分别为2.80、3.20、3.31和2.98,达到复水终点的时间分别为8、8、8和9 h。不同干燥温度复水速率和终末复水比的差异可能与物料干燥后的微观结构和物质变化有关[14],在50 ℃低温干燥过程中,由于干燥时间长,物料内部细胞结构收缩严重,导致微观结构紧密,使其恢复到新鲜性状能力变弱;而在80 ℃高温干燥的条件下,干燥过程水分蒸发速度快,造成黄皮表面形成“硬壳”,在复水过程中形成水分吸收屏障,导致复水速率低于其他干燥温度样品。

图2 不同干燥温度黄皮复水比
Fig.2 Rehydration ratio of wampee dried with different temperatures
2.3 不同干燥温度对总酚和总黄酮含量的影响
总酚和总黄酮是黄皮中重要的生物活性物质,具有较强的抗氧化能力,能有效清除自由基,延缓衰老[21]。不同温度干燥的黄皮总酚和总黄酮含量如图3所示:黄皮总酚和总黄酮含量均随温度的升高而降低。其中,50 ℃干燥黄皮总酚含量显著高于70和80 ℃干燥的黄皮(P<0.05),含量为7.84 mg/g没食子酸当量;50 ℃干燥黄皮总黄酮含量显著高于60、70和80 ℃ 干燥的黄皮(P<0.05),含量为9.99 mg/g芦丁当量,而60、70和80 ℃干燥的黄皮总酚和总黄酮均无显著差异(P>0.05)。酚类物质含量的变化往往与原料中多酚氧化酶的作用紧密相关[22],60 ℃可能是影响黄皮总酚和总黄酮的关键温度,此温度下黄皮内多酚氧化酶仍具有较高的活性,从而导致多酚类物质氧化损失。总体而言,即使采用80 ℃干燥,其总酚和总黄酮含量与50 ℃相比仍分别保留了93.62%和86.59%,表明温度的升高对总酚和总黄酮含量的影响不大。
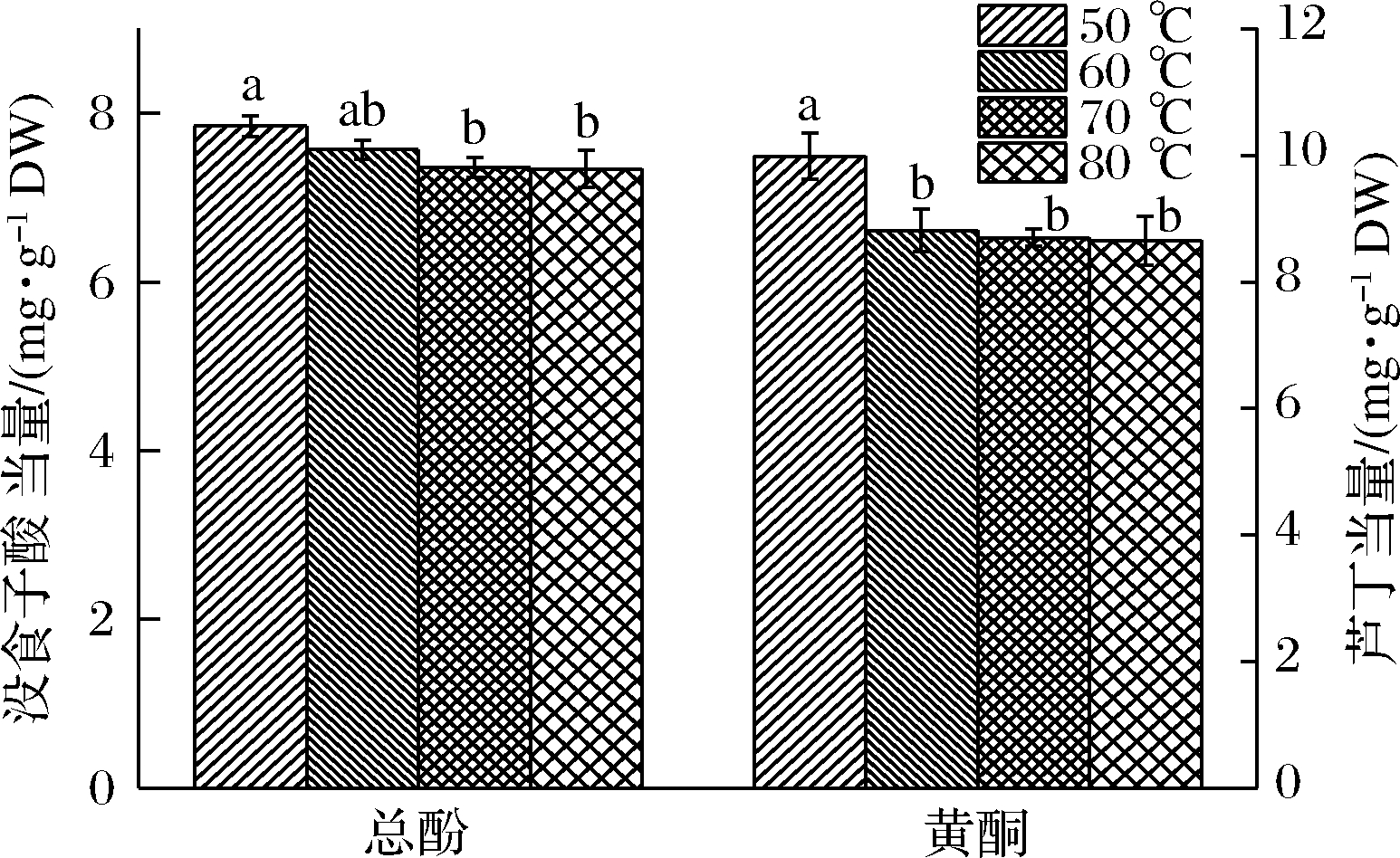
图3 不同干燥温度黄皮总酚和黄酮含量
Fig.3 Total phenols and flavonoids content of wampee dried with different temperatures
注:同一指标、不同组别小写字母不同表示差异显著(P <0.05)(下同)
2.4 不同干燥温度对多酚类物质含量的影响
为进一步明确黄皮中多酚类物质在不同干燥温度条件下的变化情况,本研究采用高效液相色谱法测定了不同温度干燥的黄皮中多酚类物质的含量,结果如表1。共检测到丁香苷、绿原酸、表儿茶素、芦丁、橙皮素和槲皮素等6种多酚类物质,其中橙皮素含量最高(≥ 2.59 mg/g),绿原酸含量最低(≤ 0.54 mg/g),且不同处理组间橙皮素含量差异不显著(P>0.05)。干燥温度对丁香苷含量影响最为显著,当温度由60 ℃上升至80 ℃时,丁香苷的降解率高达43.33%,显著高于其他酚类物质(P<0.05),其次是表儿茶素和芦丁,当干燥温度升高至80 ℃时含量较其他干燥温度组显著降低。反之,绿原酸和槲皮素含量随着温度的升高而略有增高,80 ℃处理组黄皮中绿原酸和槲皮素含量显著高于其他处理组,上述结果与MICHALSKA等[23]研究的不同干燥温度对李果渣中酚类物质含量变化趋势一致。整体而言,6种多酚类物质的总量随干燥温度的升高而降低,与2.3中所述总酚含量变化趋势一致。
表1 不同干燥温度黄皮多酚物质含量 单位:mg/g干基
Table 1 Contents of phenolic compounds in wappee dried with different drying temperatures
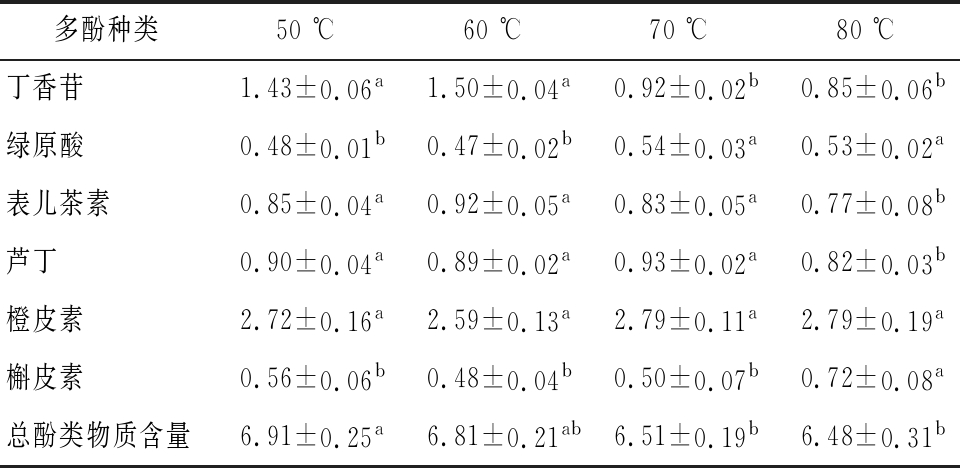
注:同行肩标小写字母不同表示差异显著(P < 0.05)(下同)
多酚种类50 ℃60 ℃70 ℃80 ℃丁香苷1.43±0.06a1.50±0.04a0.92±0.02b0.85±0.06b绿原酸0.48±0.01b0.47±0.02b0.54±0.03a0.53±0.02a表儿茶素0.85±0.04a0.92±0.05a0.83±0.05a0.77±0.08b芦丁0.90±0.04a0.89±0.02a0.93±0.02a0.82±0.03b橙皮素2.72±0.16a2.59±0.13a2.79±0.11a2.79±0.19a槲皮素0.56±0.06b0.48±0.04b0.50±0.07b0.72±0.08a总酚类物质含量6.91±0.25a6.81±0.21ab6.51±0.19b6.48±0.31b
2.5 不同干燥温度对有机酸含量的影响
果实中有相当部分的干物质是有机酸,是体现水果特殊风味的重要物质,具有抗氧化、抗菌以及酸化等功能特性,在食品营养学中占有重要位置。不同品种黄皮果实中有机酸的成分和含量均存在一定的差异,本研究中不同温度干燥的黄皮中均检测到柠檬酸、苹果酸和酒石酸3种有机酸。如表2所示,酒石酸的含量最高(123.87~138.20 mg/g干基),是黄皮中最主要的有机酸,柠檬酸次之(47.02~60.39 mg/g干基),苹果酸含量最低(11.97~20.42 mg/g干基),这与彭程等[24]测定的不同品种鸡心黄皮中有机酸组分含量分布规律一致。进一步分析发现,所测黄皮样品中酒石酸含量无显著性差异(P>0.05),80 ℃处理组黄皮中柠檬酸含量仅较50 ℃处理组显著降低(P<0.05), 表明酒石酸和柠檬酸在干燥过程中具有良好的热稳定性,这与DING等[25]针对不同干燥温度对柠檬片中有机酸含量的影响结果相似,而与之不同的是,苹果酸随干燥温度的升高而显著降低。
表2 不同干燥温度黄皮有机酸含量 单位:mg/g干基
Table 2 Contents of organic acids in wappee dried with different drying temperatures

有机酸种类50 ℃60 ℃70 ℃80 ℃酒石酸137.15±5.57a136.64±4.60a132.87±4.05a138.20±3.99a柠檬酸60.39±3.36a51.59±4.49ab51.79±5.38ab47.02±3.14b苹果酸20.42±3.87a16.55±1.58ab11.97±1.96c12.31±1.27c
2.6 不同干燥温度对游离氨基酸含量的影响
果蔬中游离氨基酸是一类重要的营养物质,同时也参与果蔬加工过程中褐变产物的形成。如表3所示,不同温度干燥黄皮样品中共检测出24种游离氨基酸氨基酸,其中含8种人体必需氨基酸。对于总游离氨基酸含量而言,60 ℃处理组的含量最高,为18 384.09 μg/g 干基,显著高于其他处理组(P<0.05),这可能是因为一方面温度的升高能促进黄皮中蛋白的水解产生更多的游离氨基酸,另一方面随着干燥的进行,氨基酸与果实中的还原糖发生美拉德反应造成氨基酸的消耗[26],黄皮在干燥过程中氨基酸含量处于动态波动状态,60 ℃干燥能最有效保留样品中游离氨基酸含量。对黄皮中必需氨基酸含量分析发现,与总游离氨基酸含量变化趋势一致,60 ℃处理组的必需氨基酸含量最高,为765.68 μg/g干基,且不同温度处理组之间含量差异显著(P<0.05)。整体而言,60 ℃干燥处理能样品中总游离氨基酸和人体必需氨基酸含量最高。
根据游离氨基酸的味觉特征,可将其分为甜味、苦味、鲜味和无味四类[27]。由表3可知,甜味氨基酸(5 184.29~10 013.38 μg/g干基)和鲜味氨基酸(800.03~1 488.11 μg/g干基)是干燥黄皮中主要的存在的味觉活性氨基酸,能增强食品风味,缓解苦涩;鲜味氨基酸包括天冬氨酸和谷氨酸,作为主要呈味氨基酸,是黄皮鲜味滋味的主要来源。苦味氨基酸在黄皮中也占有一定的比重,其可能主要存在于黄皮皮中。不同干燥温度对呈味氨基酸含量影响显著,60 ℃ 干燥样品中甜味、鲜味和苦味氨基酸的含量均最高,其在不同干燥温度样品中的含量分布与总游离氨基酸一致。
表3 不同干燥温度黄皮游离氨基酸含量 单位:μg/g干基
Table 3 Contents of free amino acid in wappee dried with different drying temperatures
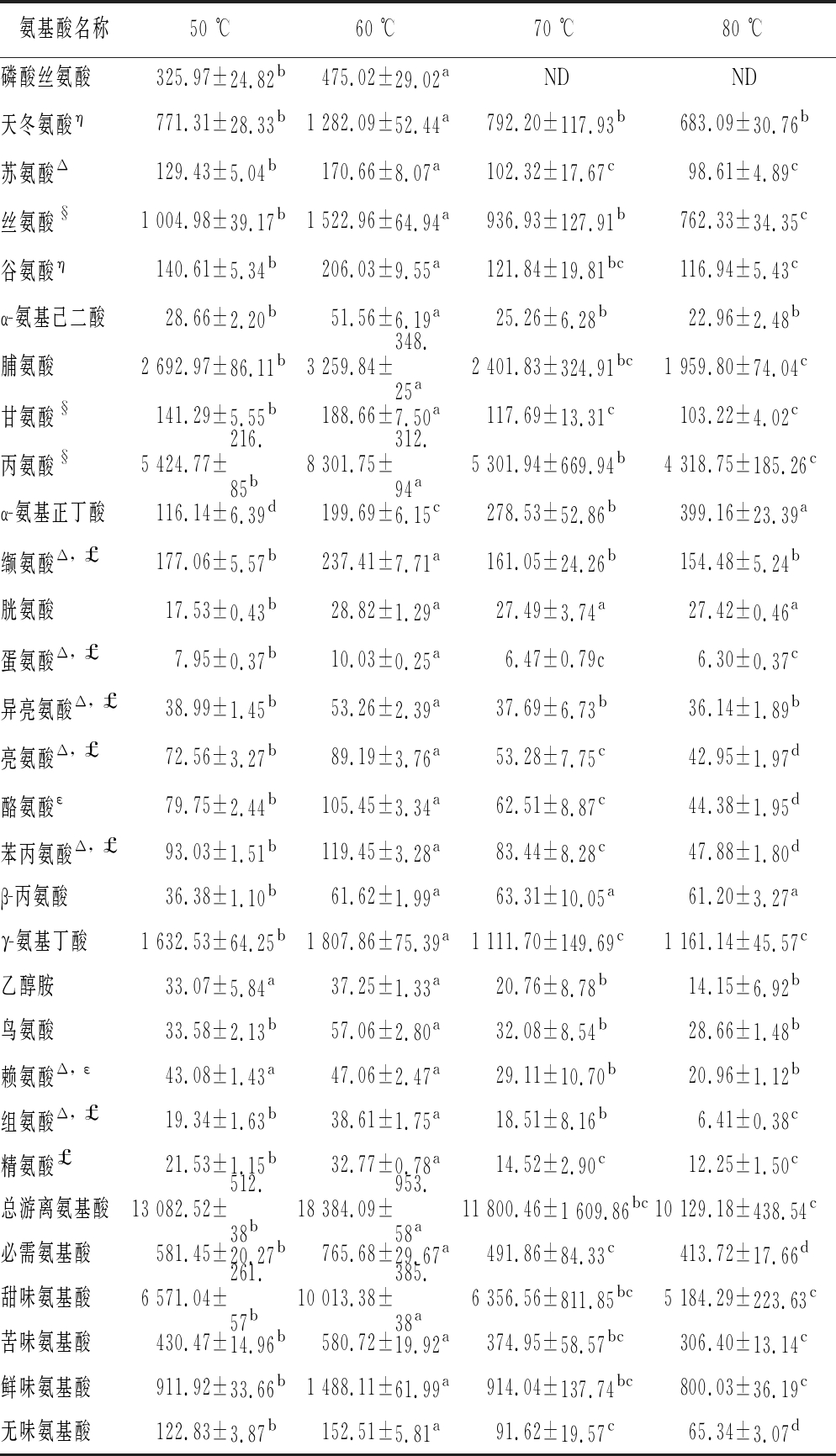
注:Δ人为体必需氨基酸,§为甜味氨基酸,£表示苦味氨基酸,η表示 鲜味氨基酸,ε表示无味氨基酸,ND表示未检测到
氨基酸名称50 ℃60 ℃70 ℃80 ℃磷酸丝氨酸325.97±24.82b475.02±29.02aNDND天冬氨酸η771.31±28.33b1 282.09±52.44a792.20±117.93b683.09±30.76b苏氨酸Δ129.43±5.04b170.66±8.07a102.32±17.67c98.61±4.89c丝氨酸§1 004.98±39.17b1 522.96±64.94a936.93±127.91b762.33±34.35c谷氨酸η140.61±5.34b206.03±9.55a121.84±19.81bc116.94±5.43cα-氨基己二酸28.66±2.20b51.56±6.19a25.26±6.28b22.96±2.48b脯氨酸2 692.97±86.11b3 259.84±348.25a2 401.83±324.91bc1 959.80±74.04c甘氨酸§141.29±5.55b188.66±7.50a117.69±13.31c103.22±4.02c丙氨酸§5 424.77±216.85b8 301.75±312.94a5 301.94±669.94b4 318.75±185.26cα-氨基正丁酸116.14±6.39d199.69±6.15c278.53±52.86b399.16±23.39a缬氨酸Δ, £177.06±5.57b237.41±7.71a161.05±24.26b154.48±5.24b胱氨酸17.53±0.43b28.82±1.29a27.49±3.74a27.42±0.46a蛋氨酸Δ, £7.95±0.37b10.03±0.25a6.47±0.79c6.30±0.37c异亮氨酸Δ, £38.99±1.45b53.26±2.39a37.69±6.73b36.14±1.89b亮氨酸Δ, £72.56±3.27b89.19±3.76a53.28±7.75c42.95±1.97d酪氨酸ε79.75±2.44b105.45±3.34a62.51±8.87c44.38±1.95d苯丙氨酸Δ, £93.03±1.51b119.45±3.28a83.44±8.28c47.88±1.80dβ-丙氨酸36.38±1.10b61.62±1.99a63.31±10.05a61.20±3.27aγ-氨基丁酸1 632.53±64.25b1 807.86±75.39a1 111.70±149.69c1 161.14±45.57c乙醇胺33.07±5.84a37.25±1.33a20.76±8.78b14.15±6.92b鸟氨酸33.58±2.13b57.06±2.80a32.08±8.54b28.66±1.48b赖氨酸Δ, ε43.08±1.43a47.06±2.47a29.11±10.70b20.96±1.12b组氨酸Δ, £19.34±1.63b38.61±1.75a18.51±8.16b6.41±0.38c精氨酸£21.53±1.15b32.77±0.78a14.52±2.90c12.25±1.50c总游离氨基酸13 082.52±512.38b18 384.09±953.58a11 800.46±1 609.86bc10 129.18±438.54c必需氨基酸581.45±20.27b765.68±29.67a491.86±84.33c413.72±17.66d甜味氨基酸6 571.04±261.57b10 013.38±385.38a6 356.56±811.85bc5 184.29±223.63c苦味氨基酸430.47±14.96b580.72±19.92a374.95±58.57bc306.40±13.14c鲜味氨基酸911.92±33.66b1 488.11±61.99a914.04±137.74bc800.03±36.19c无味氨基酸122.83±3.87b152.51±5.81a91.62±19.57c65.34±3.07d
2.7 不同干燥温度对抗氧化活性的影响
研究采用DPPH法、FRAP法和ABTS法来评价不同干燥温度条件下黄皮的抗氧化活性,结果采用单位质量样品Trolox当量浓度表示,浓度越高,抗氧化活性越强。如图4所示,无论采用何种评价方法,50 ℃ 干燥黄皮表现出最高的抗氧化活性,显著高于其他干燥组(P<0.05),而60~80 ℃处理组的抗氧化活性则无显著性差异(P>0.05),但较50 ℃干燥黄皮保留率在87.15%以上,这与2.3中总酚含量变化规律一致,也进一步证明多酚类物质是影响黄皮抗氧化活性的主要物质。同一样品采用不评价方法,其抗氧化能力也有所不同,采用FRAP法测得的抗氧化能力最高,ABTS法次之,DPPH法最低,这与PENG等[28]采用上述3中方法测定的不同预处理制备的胡萝卜样品中抗氧化活性规律一致。上述情况的出现,主要是因为不同抗氧化评价方法反应机制不同,而黄皮中存在的抗氧化活性物质种类各异,其理化特性也不尽相同[29]。整体而言,不管采用何种干燥温度,对黄皮的抗氧化活性影响不大。

图4 不同干燥温度黄皮抗氧化活性
Fig.4 Antioxidant activity of wappee dried with different drying temperatures
3 结论
黄皮的热风干燥过程分为加速和降速2个阶段,干燥温度升高,黄皮干燥速率显著增大、时间明显缩短,温度对黄皮干燥后期速率的影响大于干燥前期。干燥温度对黄皮复水特性,多酚类物质、有机酸、游离氨基酸含量及抗氧化活性均影响显著。60 ℃干燥的黄皮复水效果最佳,而50 ℃干燥样品由于干燥时间长,组织收缩严重导致复水效果最差;干燥温度越高,黄皮中总酚和黄酮含量越低,但与50 ℃干燥相比,80 ℃ 干燥样品总酚和黄酮含量保留率仍高达93.62% 和86.59%;不同干燥温度的黄皮中共检测出6种多酚类物质,橙皮素和丁香苷是黄皮中的主要多酚类物质,橙皮素含量不受干燥温度影响,而丁香苷在70 ℃和80 ℃干燥后降解显著;酒石酸是鸡心黄皮中含量最高的有机酸(≥123.87 mg/g干基),其含量受干燥温度的影响不大;60 ℃干燥能最有效保留黄皮中游离氨基酸,含量达18 384.09 μg/g干基,通过呈味氨基酸特征归类,其中甜味氨基酸和鲜味氨基酸为黄皮中的主要呈味氨基酸;黄皮DPPH自由基、ABTS阳离子自由基和FRAP抗氧化活性随干燥温度的升高呈下降趋势,但60~80 ℃ 干燥的黄皮抗氧化活性较50 ℃样品保留率在87.15%以上。
综上所述,在黄皮热风干燥生产过程中,结合干燥效率和干燥品质,60~70 ℃为黄皮的最佳干燥温度区间,在此温度区间内,黄皮具有较快的干燥速率且各品质指标均能保持良好。研究结果可为黄皮干制提供一定的理论参考,为通过干制样品制备高品质黄皮凉果提供一定的技术支撑。
[1] 陆育生, 林志雄, 曾杨, 等.中国黄皮果树种质资源果实品质性状的多样性分析[J].分子植物育种, 2015, 13(2):317-330.
LU Y S, LIN Z X, ZENG Y, et al.Diversity of wampee (Clausena lansium (Lour.) Skeels) germplasms in China revealed based on fruit quality traits[J].Molecular Plant Breeding, 2015, 13(2):317-330.
[2] YE Y T, CHANG X X, BRENNAN M A, et al.Comparison of phytochemical profiles, cellular antioxidant and anti-proliferative activities in five varieties of wampee (Clausena lansium) fruits[J].International Journal of Food Science & Technology, 2019, 54(7):2 487-2 493.
[3] PRASAD K N, XIE H H, HAO J, et al.Antioxidant and anticancer activities of 8-hydroxypsoralen isolated from wampee [Clausena lansium (Lour.) Skeels] peel[J].Food Chemistry, 2010, 118(1):62-66.
[4] LI B Y, YUAN Y H, HU J F, et al.Protective effect of Bu-7, a flavonoid extracted from Clausena lansium, against rotenone injury in PC12 cells[J].Acta Pharmacologica Sinica, 2011, 32(11):1 321-1 326.
[5] 张瑞明, 万树青, 赵冬香.黄皮的化学成分及生物活性研究进展[J].天然产物研究与开发, 2012, 24(1):118-123, 88.
ZHANG R M, WAN S Q, ZHAO D X.Advances in chemical constituents and biological activities of Clausena lansium[J].Natural Product Research and Development, 2012, 24(1):118-123, 88.
[6] RODRIGUES S, DE BRITO E S, DE OLIVEIRA SILVA E.Wampee — Clausena lansium[M].Amsterdam:Elsevier, 2018:439-441.
[7] 屈红霞, 蒋跃明, 李月标, 等.黄皮耐贮性与果皮超微结构的研究[J].果树学报, 2004, 21(2):153-157.
QU H X, JIANG Y M, LI Y B, et al.Research on the storage life and peel ultrastructure in wampee (Clausena lansium)[J].Journal of Fruit Science, 2004, 21(2):153-157.
[8] 屈红霞, 蒋跃明, 李月标, 等.黄皮果实采后呼吸特性及品质变化[J].亚热带植物科学, 2003, 32(3):16-20.
QU H X, JIANG Y M, LI Y B, et al.Respiration characteristics and quality changes of wampee fruits during storage[J].Subtropical Plant Science, 2003, 32(3):16-20.
[9] 赵笑梅,黄苇,李远志.低糖润喉黄皮果脯的研制[J].农产品加工(学刊), 2013(7):36-39.
ZHAO X M, HUANG W, LI Y Z.Low-sugar and throat-cooling preserved Clausena Lansium[J].Academic Periodical of Farm Products Processing, 2013(7):36-39.
[10] 罗树灿,陈小惠,李远志.陈皮液渍无核黄皮果脯加工工艺的研究[J].农产品加工, 2017(22):19-23.
LUO S C, CHEN X H, LI Y Z.Study on preserved none- nuclear Clausena lansium with tangering peel processing technology[J].Farm Products Processing, 2017(22):19-23.
[11] CHOKEPRASERT P, HUANG T C, CHEN H H, et al.Effect of drying conditions on the qualities of dried wampee [Clausena lansium (Lour.) Skeels][J].Kasetsart Journal, 2005, 39(3):416-423.
[12] 朱婷婷,陈燕帆,连惠勇.促干剂对热风干燥条件下黄皮品质的影响[J].食品科技, 2020, 45(5):76-83.
ZHU T T, CHEN Y F, LIAN H Y.Effects of dry-promoting agent on the quality of Clausena Lansium (Lour.) Skeels under hot-air-drying condition[J].Food Science and Technology, 2020, 45(5):76-83.
[13] MUJUMDAR A S, LAW C L.Drying technology:Trends and applications in postharvest processing[J].Food and Bioprocess Technology, 2010, 3(6):843-852.
[14] ZHAO Y Y, BI J F, YI J Y, et al.Evaluation of sensory, textural, and nutritional attributes of shiitake mushrooms (Lentinula edodes) as prepared by five types of drying methods[J].Journal of Food Process Engineering, 2019, 42(4):e13029.
[15] TAN S, KE Z L, CHAI D, et al.Lycopene, polyphenols and antioxidant activities of three characteristic tomato cultivars subjected to two drying methods[J].Food Chemistry, 2021, 338: 128062.
[16] QIU J, VUIST J E, BOOM R M, et al.Formation and degradation kinetics of organic acids during heating and drying of concentrated tomato juice[J].LWT, 2018, 87:112-121.
[17] PU Y F, DING T, WANG W J, et al.Effect of harvest, drying and storage on the bitterness, moisture, sugars, free amino acids and phenolic compounds of jujube fruit (Zizyphus jujuba cv.Junzao)[J].Journal of the Science of Food and Agriculture, 2018, 98(2):628-634.
[18] SI X, CHEN Q Q, BI J F, et al.Comparison of different drying methods on the physical properties, bioactive compounds and antioxidant activity of raspberry powders[J].Journal of the Science of Food and Agriculture, 2016, 96(6):2 055-2 062.
[19] 王雪媛,高琨,陈芹芹,等.苹果片中短波红外干燥过程中水分扩散特性[J].农业工程学报, 2015, 31(12):275-281.
WANG X Y, GAO K, CHEN Q Q, et al.Water diffusion characteristics of apple slices during short and medium-wave infrared drying[J].Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(12):275-281.
[20] VALLESPIR F, RODR GUEZ
GUEZ  , C
, C RCEL J A, et al.Ultrasound assisted low-temperature drying of kiwifruit:Effects on drying kinetics, bioactive compounds and antioxidant activity[J].Journal of the Science of Food and Agriculture, 2019, 99(6):2 901-2 909.
RCEL J A, et al.Ultrasound assisted low-temperature drying of kiwifruit:Effects on drying kinetics, bioactive compounds and antioxidant activity[J].Journal of the Science of Food and Agriculture, 2019, 99(6):2 901-2 909.
[21] PANDEY K B, RIZVI S I.Plant polyphenols as dietary antioxidants in human health and disease[J].Oxidative Medicine and Cellular Longevity, 2009, 2(5):270-278.
[22] BUSTOS M C, ROCHA-PARRA D, SAMPEDRO I R, et al.The influence of different air-drying conditions on bioactive compounds and antioxidant activity of berries[J].Journal of Agricultural and Food Chemistry, 2018, 66(11):2 714-2 723.
[23] MICHALSKA, WOJDY O A, MAJERSKA J, et al.Qualitative and quantitative evaluation of heat-induced changes in polyphenols and antioxidant capacity in Prunus domestica L.by-products[J].Molecules, 2019, 24(16): 3 008.
O A, MAJERSKA J, et al.Qualitative and quantitative evaluation of heat-induced changes in polyphenols and antioxidant capacity in Prunus domestica L.by-products[J].Molecules, 2019, 24(16): 3 008.
[24] 彭程,陈喆,常晓晓,等.黄皮种质资源果汁中有机酸成分的分析[J].华南师范大学学报(自然科学版), 2019, 51(4):57-66.
PENG C, CHEN Z, CHANG X X, et al.A componential analysis of organic acid in wampee fruit juice from different germplasm resources[J].Journal of South China Normal University (Natural Science Edition), 2019, 51(4):57-66.
[25] DING S H, WANG R R, ZHANG J, et al.Effect of drying temperature on the sugars, organic acids, limonoids, phenolics, and antioxidant capacities of lemon slices[J].Food Science and Biotechnology, 2017, 26(6):1 523-1 533.
[26] LI X B, FENG T, ZHOU F, et al.Effects of drying methods on the tasty compounds of Pleurotus eryngii[J].Food Chemistry, 2015, 166:358-364.
[27] ZHAO Y T, ZHENG Y M, LI Z Y, et al.Effects of ultrasonic pretreatments on thermodynamic properties, water state, color kinetics, and free amino acid composition in microwave vacuum dried Lotus seeds[J].Drying Technology, 2020, 38(4):534-544.
[28] PENG J, BI J F, YI J Y, et al.Apple juice concentrate impregnation enhances nutritional and textural attributes of the instant controlled pressure drop (DIC)-dried carrot chips[J].Journal of the Science of Food and Agriculture, 2019, 99(14):6 248-6 257.
[29] REDONDO D, ARIAS E, ORIA R, et al.Thinned stone fruits are a source of polyphenols and antioxidant compounds[J].Journal of the Science of Food and Agriculture, 2017, 97(3):902-910.