白酒是我国传统蒸馏酒,随着我国经济的高速发展,白酒产量和销量逐年增长。白酒发酵过程中产生的醛类化合物通常视为白酒中的呈香、呈味物质[1],近年来,其中甲醛(formaldehyde, FOR)、乙醛(acetaldehyde, ACE)[2]、乙二醛(glyoxal, GO)、丙酮醛(methylglyoxal, MGO)、丙烯醛(acrolein, ACR)、巴豆醛(crotonaldehyde, CRO)、糠醛(furfural, FUR)[3]、5-羟 甲基糠醛(5-hydroxymethylfurfural,5-HMF)、丙醛(propionaldehyde、PRO)、戊醛(valeraldehyde、VAL)、己醛(hexanal、HEX)、苯甲醛(benzaldehyde、BEN)和苯乙醛(phenylacetaldehyde、PHE)等小分子活泼羰基化合物对人体的危害引起医药、食品行业的高度重视[4]。活泼羰基化合物(reactive carbonyl species,RCS)能通过迈克尔加成反应(Michael addition reaction)或席夫碱反应(Schiff base reaction)与蛋白质、核酸、磷脂的亲核位点发生共价结合,导致细胞毒性和致突变性[5-6]。研究证明,RCS体内蓄积可导致癌症、神经退行性疾病、糖尿病并发症、阿尔茨海默症、衰老、动脉粥样硬化等多种疾病[7]。目前白酒中有害物质的研究主要集中在氨基甲酸乙酯[8]、生物胺[9]、氰化物[10]等,而对醛类的研究报道主要集中在FOR[11-12]和ACE[13-14],多种RCS检测研究刚刚起步,如FUR[15]。因此,建立分析白酒中多种RCS检测方法,监控白酒加工过程及成品酒中含量,提高白酒的安全性,具有重要的现实意义。
目前,国外报道的酒类中RCS的检测方法有:采用高效液相色谱-荧光检测器检测葡萄酒[16-17]、酒精饮料[18]中的MGO和GO;气质联用技术检测葡萄酒[19]、啤酒[20]中的MGO、GO和ACR;采用气相色谱-氮磷检测器测定酒精饮料[21]中的MGO和GO,苹果酒中的ACR[22];超高效液相质谱联用技术测定葡萄酒中5-HMF[23];高效液相色谱-光电二极管阵列检测器分析葡萄汁、葡萄酒中5-HMF、FUR和2-糠酸[24]以及朗姆酒中的5-HMF和CRO[25]等其他醛和酯类。白酒生产工艺异于啤酒、葡萄酒,其成品中各类化合物组成、含量也大不相同,方法难以直接套用。迄今除质谱外,尚未有报道同时测定多种RCS的分析方法。采用质谱检测器,成本昂贵,操作难度相对较高,不易在企业和相关行业中推广普及[26-27]。相比而言,高效液相色谱-紫外分析方法简便、易于普及,不过衍生化试剂难以满足多种RCS的同步衍生化,实现同时分析多种RCS。因此,本文拟采用气相色谱法建立同时检测白酒中多种RCS的分析方法。
由于酒体中含有非常多的小分子挥发性物质,如:醇、醛以及各种酯类风味物质等,造成干扰,采用常规气相色谱分析方法难以一次性检出多种RCS。故本文采用衍生化方法,采用气相色谱-电子捕获检测器(gas chromatography-electron capture detector,GC-ECD),旨在建立针对RCS分析的专属方法。方法运行过程中酒体中部分风味醛类也同时检出,故顺势一并进行了定量分析。而后采用该方法对国内市场白酒12种香型,9个产地100多种白酒样品进行了检测,统计学聚类分析了白酒中的7种RCS含量,本研究为检测白酒中存在的RCS含量提供了方法。
1 材料与方法
1.1 材料与试剂
ACR(98%),萨恩化学技术(上海)有限公司;MGO、GO(40%)美国Sigma-Aldrich公司;CRO(99%),Adamas-beta试剂;FUR(99%)、ACE(40%),上海展云化工有限公司;FOR(100 mg/L),生态环境部标准样品研究所;PRO(98%)、VAL(95%)、HEX(98%)、BEN(98%)、O-(2,3,4,5,6-五氟苄基)羟胺盐酸盐[O-(2,3,4,5,6-pentafluorobenzyl) hydroxylamine, PFBHA](98%),日本TCI公司;PHE(95%),阿法埃莎(中国)化学有限公司;1,2-二溴丙烷(98%),上海安谱实验科技股份有限公司;以上均为质量分数;正己烷(色谱纯),德国Merck公司;实验用水为超纯水;其余试剂均为国产分析纯。
实验用成品酒均通过市售或酒厂取样方式获得,12种香型酒样见表1。
表1 白酒样品
Table 1 Baijiu samples
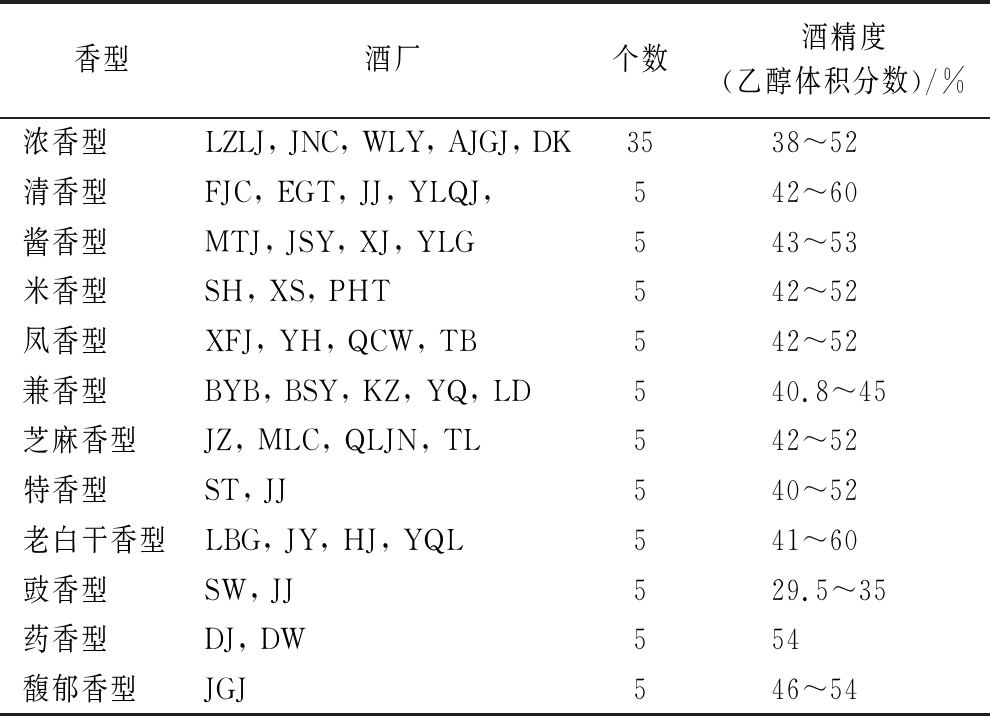
香型酒厂个数酒精度(乙醇体积分数)/%浓香型LZLJ, JNC, WLY, AJGJ, DK3538~52清香型FJC, EGT, JJ, YLQJ,542~60酱香型MTJ, JSY, XJ, YLG543~53米香型SH, XS, PHT542~52凤香型XFJ, YH, QCW, TB542~52兼香型BYB, BSY, KZ, YQ, LD540.8~45芝麻香型JZ, MLC, QLJN, TL542~52特香型ST, JJ540~52老白干香型LBG, JY, HJ, YQL541~60豉香型SW, JJ529.5~35药香型DJ, DW554馥郁香型JGJ546~54
1.2 仪器与设备
Agilent 6890 N 气相色谱仪(配有电子捕获检测器)、HP-5MS色谱柱(30 m×0.32 mm,0.25 μm),美国Agilent公司;Thermo Biofuge Stratos超速冷冻离心机、Nanopure超纯水机,美国Thermo公司;Organomation N-EVAP 氮气吹干仪,美国Organomation公司;PWC 254型分析天平,英国ADAM公司。
1.3 实验方法
1.3.1 溶液的配制
1.3.1.1 标准储备液的配制
精确吸取适量ACR、MGO、GO、CRO、FUR、FOR、ACE、PRO、VAL、HEX、BEN和PHE标准品于100 mL棕色容量瓶中,加入乙腈溶解并定容后配制成质量浓度分别为0.03、0.03、0.03、0.12、0.6、0.03、3.0、0.12、0.12、0.3、0.12、0.12 mg/mL的标准品储备液,置于4 ℃条件下避光保存备用。
1.3.1.2 标准系列溶液的配制
精确吸取1.3.1.1中储备液适量于容量瓶中,用乙腈逐级稀释至标准系列溶液,其中ACR、MGO、GO和FOR质量浓度为0.005、0.01、0.02、0.05、0.1、0.25、 0.5、0.75 μg/mL,CRO、PRO、VAL、BEN和PHE质量浓度为0.02、0.04、0.08、0.2、0.4、1、2、3 μg/mL,HEX浓度为0.05、0.1、0.2、0.5、1、2.5、5、7.5 μg/mL,FUR质量浓度为0.1、0.2、0.4、1、2、5、10、15 μg/mL,ACE质量浓度为0.5、1、2、5、10、25、50、75 μg/mL。
1.3.1.3 衍生化试剂溶液的配制
精确称取MOREIRA等[18]适量于干燥的容量瓶中,加入超纯水溶解并定容后配制成质量浓度为5 mg/mL 的水溶液。
1.3.1.4 1,2-二溴丙烷溶液的配制
精确吸取1,2-二溴丙烷标准品适量于容量瓶中,加入正己烷溶解并定容后配制成质量浓度为1 mg/mL 1,2-二溴丙烷储备液,-10 ℃保存。临使用前精确吸取适量储备液于100 mL容量瓶中,加入正己烷溶解并定容后配制成质量浓度为0.5 μg/mL内标1,2-二溴丙烷溶液。
1.3.2 样品前处理
参考文献[28]的方法并进行优化,取适量白酒样品用超纯水将其酒精度(乙醇体积分数)稀释至10%,涡旋混匀,取出3 mL加入5 mg/mL PFBHA 1 mL[29],盖紧试管塞,摇匀,于60 ℃摇床中避光反应1 h,反应结束后冷水冷却,加入50 μL浓硫酸,然后加入4 mL正己烷,涡旋3 min,静置5 min,取出正己烷层(上层)入10 mL玻璃管(含有3 mL0.2 mol/L 硫酸)中,涡旋30 s,静置5 min,取出正己烷层(上层)氮气吹干,300 μL正己烷复溶,用0.22 μm有机滤膜过滤,GC-ECD检测。
1.3.3 色谱条件
色谱柱:HP-5MS色谱柱;升温程序:50 ℃保持1 min, 以4 ℃/min升至220 ℃,再以20 ℃/min升温至250 ℃,保持10 min;载气(N2)流速1 mL/min,压力34.2 kPa,进样量1 μL;不分流进样模式;进样口温度230 ℃,ECD检测器温度300 ℃。
1.4 数据统计及图表绘制方法
所有实验均平行3次,采用Excel 2010、SPSS 17.0分析实验数据,结果以![]() 表示;利用R语言绘制层次聚类-热图。
表示;利用R语言绘制层次聚类-热图。
2 结果与分析
2.1 色谱峰确立
由图1可知,通过对醛类物质共衍生化条件及色谱条件的优化,各待测物质在气相色谱中分离度良好,空白无杂质峰干扰,达到分析要求。

1-1,2-二溴丙烷;2-FOR;3-PFBHA;4,4′-ACE;5,5′-ACR;6-PRO;7、7′-CRO;8、8′-VAL;9、9′-HEX;10、10′-FUR;11、11′-BEN;12、12′-PHE;13、13′-GO;14、14′-MGO
A-混合标准品溶液;B-白酒样品
图1 混合标准品溶液及白酒样品的色谱图
Fig.1 GC chromatograms of mix standard solution and liquor samples
2.2 方法学考察
2.2.1 标准曲线、线性范围、检出限及定量限测定
取标准溶液按照1.3.2方法处理,按1.3.3条件进行GC-ECD分析。以质量浓度为横坐标x,以醛类化合物和内标峰面积比值为纵坐标y,分别绘制标准曲线并计算回归方程。根据信噪比确定检出限(limit of detection, LODs)(信噪比=3)以及定量限(limit of quantitation, LOQs)(信噪比=10)。如表2所示12种 醛类化合物呈现良好的线性关系,相关系数在0.998以上,LODs和LOQs满足分析要求。
表2 醛类化合物的标准曲线、相关系数、线性范围、检出限和定量限
Table 2 Regression equation, correlation coefficient, linear range, LODs and LOQs of carbonyl compounds by GC-ECD
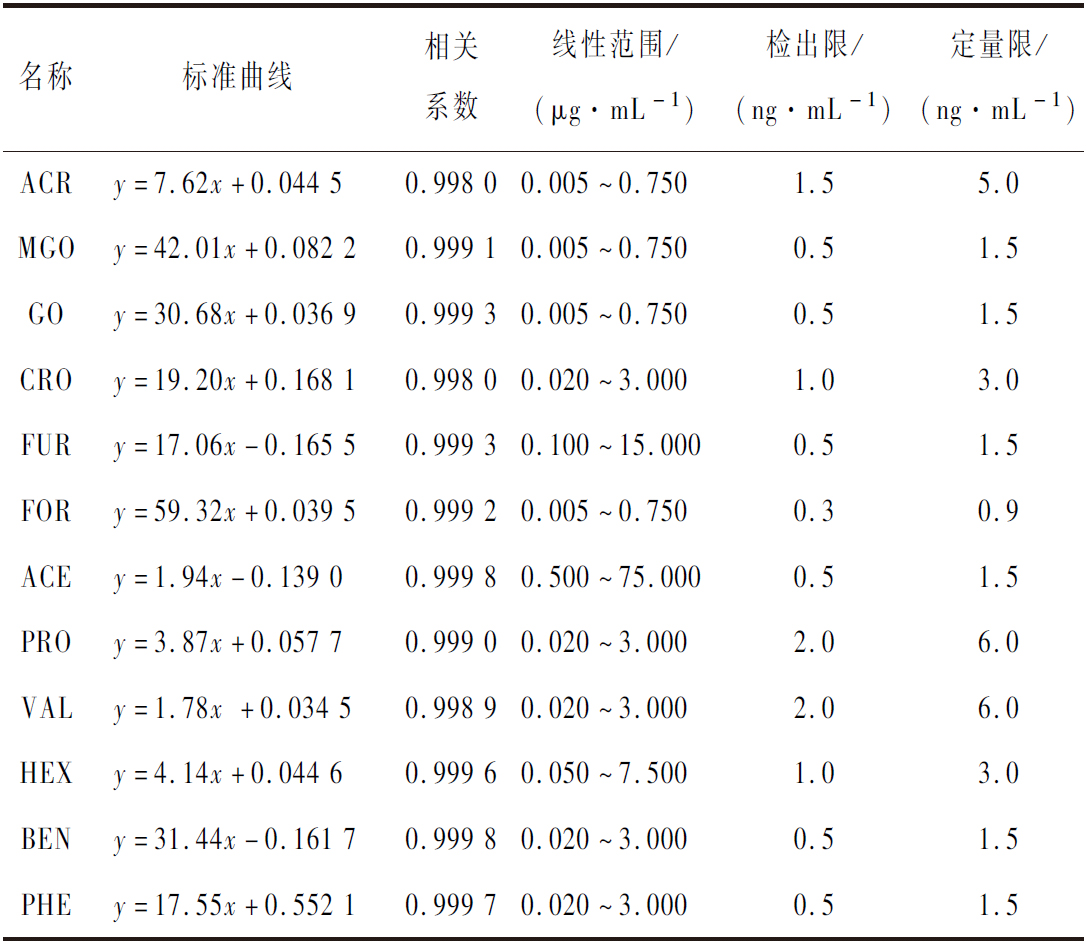
名称标准曲线相关系数线性范围/(μg·mL-1)检出限/(ng·mL-1)定量限/(ng·mL-1)ACRy=7.62x+0.044 50.998 00.005~0.7501.55.0 MGOy=42.01x+0.082 20.999 10.005~0.7500.51.5 GOy=30.68x+0.036 90.999 30.005~0.7500.51.5 CROy=19.20x+0.168 10.998 00.020~3.0001.03.0 FURy=17.06x-0.165 50.999 30.100~15.0000.51.5 FORy=59.32x+0.039 50.999 20.005~0.7500.30.9 ACEy=1.94x-0.139 00.999 80.500~75.0000.51.5 PROy=3.87x+0.057 70.999 00.020~3.0002.06.0 VALy=1.78x +0.034 50.998 90.020~3.0002.06.0 HEXy=4.14x+0.044 60.999 60.050~7.5001.03.0 BENy=31.44x-0.161 70.999 80.020~3.0000.51.5 PHEy=17.55x+0.552 10.999 70.020~3.0000.51.5
2.2.2 样品稳定性测定结果
将混合标准溶液按1.3.2中的方法处理后,分别4 ℃ 避光放置0、1、2、4、8、16、24 h后在1.3.3中的色谱条件下测定各醛类化合物和内标的峰面积,ACR、MGO、GO、CRO、FUR、FOR、ACE、PRO、VAL、HEX、BEN、PHE衍生物与内标峰面积比值的相对标准偏差(relative standard deviation, RSD)分别为1.18%、2.69%、 1.98%、0.47%、3.70%、1.20%、1.56%、0.61%、 1.94%、1.93%、2.94%、0.62%,结果表明衍生化后样品溶液在24 h内稳定性良好。
2.2.3 加标回收率和精密度测定结果
向已知12种醛类化合物的白酒样品中分别加入高、中、低3个质量浓度水平的混合标准溶液,混合均匀后将样品酒精度稀释至10%,取3 mL按1.3.2方法处理,每个加标水平平行做6次实验,计算相应组分的加标回收率和RSD,结果见表3。12种醛类化合物平均加标回收率为86.98%~109.55%,RSD均<5%,表明该方法精密度良好,准确度高。
表3 加标回收率和精密度结果(n=6)
Table 3 Results of average recoveries and precision
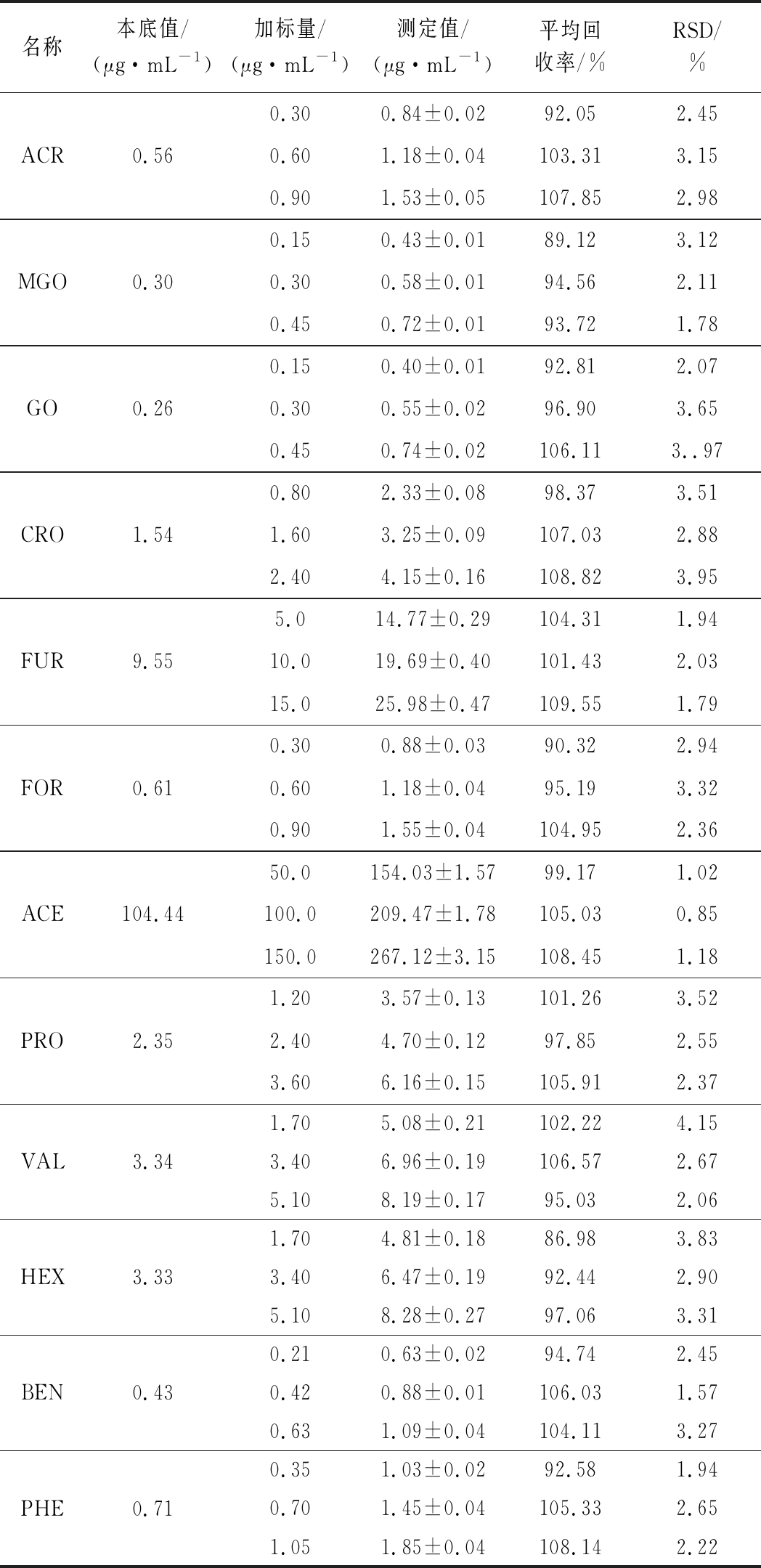
名称本底值/(μg·mL-1)加标量/(μg·mL-1)测定值/(μg·mL-1)平均回收率/%RSD/%ACR0.560.300.84±0.0292.052.450.601.18±0.04103.313.150.901.53±0.05107.852.98MGO0.300.150.43±0.0189.123.120.300.58±0.0194.562.110.450.72±0.0193.721.78GO0.260.150.40±0.0192.812.070.300.55±0.0296.903.650.450.74±0.02106.113..97CRO1.540.802.33±0.0898.373.511.603.25±0.09107.032.882.404.15±0.16108.823.95FUR9.555.014.77±0.29104.311.9410.019.69±0.40101.432.0315.025.98±0.47109.551.79FOR0.610.300.88±0.0390.322.940.601.18±0.0495.193.320.901.55±0.04104.952.36ACE104.4450.0154.03±1.5799.171.02100.0209.47±1.78105.030.85150.0267.12±3.15108.451.18PRO2.351.203.57±0.13101.263.522.404.70±0.1297.852.553.606.16±0.15105.912.37VAL3.341.705.08±0.21102.224.153.406.96±0.19106.572.675.108.19±0.1795.032.06HEX3.331.704.81±0.1886.983.833.406.47±0.1992.442.905.108.28±0.2797.063.31BEN0.430.210.63±0.0294.742.450.420.88±0.01106.031.570.631.09±0.04104.113.27PHE0.710.351.03±0.0292.581.940.701.45±0.04105.332.651.051.85±0.04108.142.22
综上所述,我们采用常用色谱GC-ECD,通过衍生化,建立一种同时定量测定多种RCS (ACR/MGO/GO/CRO/FUR/FRO/ACE)以及风味醛类物质(PRO/VAL/HEX/BEN/PHE)共12种醛类的方法,由此,在没有质谱条件下,采用GC同样可以一次性检测白酒中的风险因子和风味物质等多种醛类。GC成本低,方法简单,稳定性高,能达到较高的精密度和准确度,易于在行业中推广使用。在此基础上,我们对不同香型不同产地的白酒进行了全面分析。
2.3 不同香型成品酒中醛类化合物的分析
不同香型的白酒配料、酒曲、生产工艺、发酵温度、产地等各不相同,根据主体香气成分可分为酱香型、浓香型、清香型、兼香型、米香型、凤香型、芝麻香型、豉香型、特香型、药香型、老白干香型、馥郁香型共12种香型[30]。每种香型选取5种酒样,共定量检测出FRO、ACE、GO、MGO、ACR、CRO、FUR、5-HMF、PRO、VAL、HEX、BEN、PHE 12种醛类物质,与之前的报道相似[31]。由表4可知,酱香型白酒中12种醛类物质总含量最高,芝麻香型次之,豉香型最少;丁醛、VAL、HEX的含量均处于国家标准允许的安全范围[32],其余醛类无国家标准规定。
表4 不同香型成品酒中醛类物质含量(n=3) 单位:μg/mL
Table 4 Contents of aldehydes in different aroma type of finished liquors
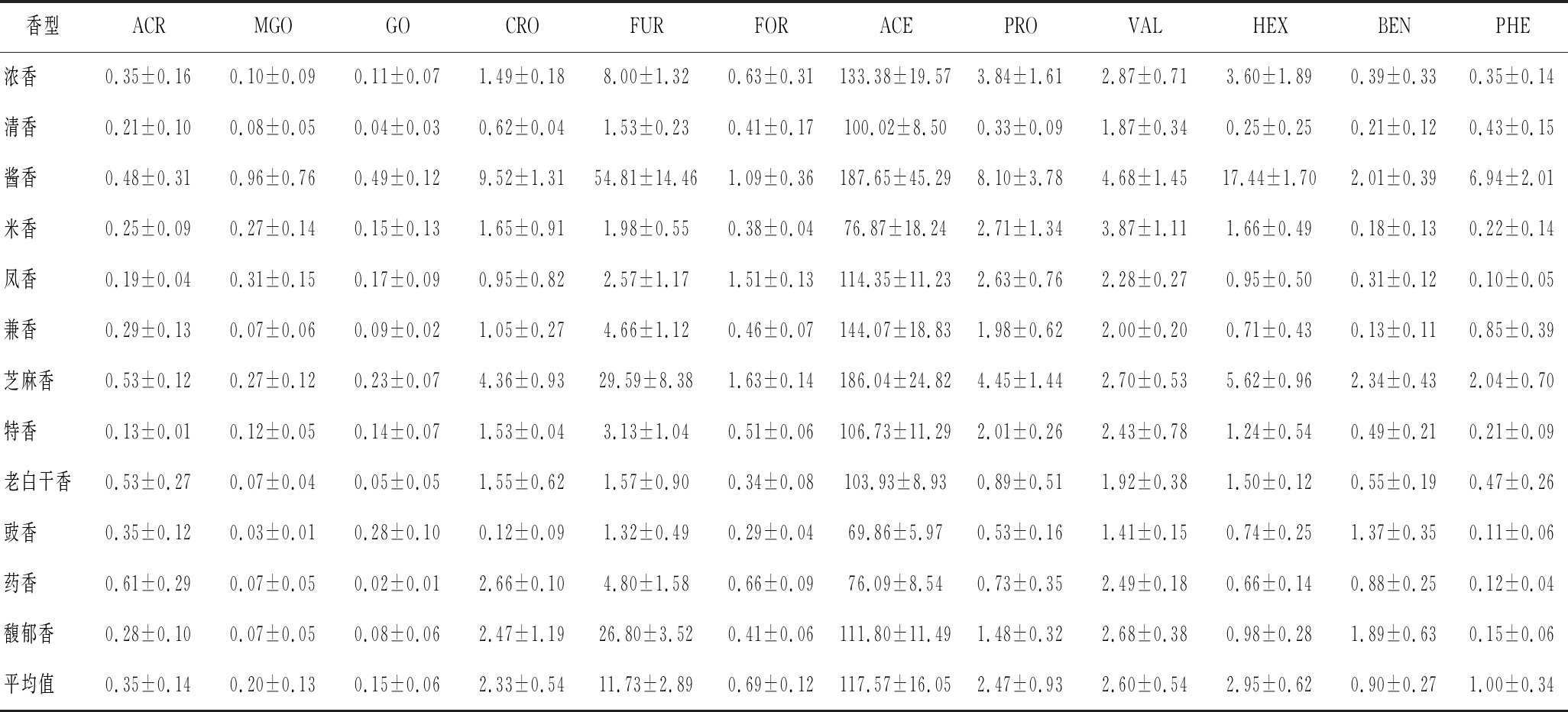
香型ACRMGOGOCROFURFORACEPROVALHEXBENPHE浓香0.35±0.160.10±0.090.11±0.071.49±0.188.00±1.320.63±0.31133.38±19.573.84±1.612.87±0.713.60±1.890.39±0.330.35±0.14清香0.21±0.100.08±0.050.04±0.030.62±0.041.53±0.230.41±0.17100.02±8.500.33±0.091.87±0.340.25±0.250.21±0.120.43±0.15酱香0.48±0.310.96±0.760.49±0.129.52±1.3154.81±14.461.09±0.36187.65±45.298.10±3.784.68±1.4517.44±1.702.01±0.396.94±2.01米香0.25±0.090.27±0.140.15±0.131.65±0.911.98±0.550.38±0.0476.87±18.242.71±1.343.87±1.111.66±0.490.18±0.130.22±0.14凤香0.19±0.040.31±0.150.17±0.090.95±0.822.57±1.171.51±0.13114.35±11.232.63±0.762.28±0.270.95±0.500.31±0.120.10±0.05兼香0.29±0.130.07±0.060.09±0.021.05±0.274.66±1.120.46±0.07144.07±18.831.98±0.622.00±0.200.71±0.430.13±0.110.85±0.39芝麻香0.53±0.120.27±0.120.23±0.074.36±0.9329.59±8.381.63±0.14186.04±24.824.45±1.442.70±0.535.62±0.962.34±0.432.04±0.70特香0.13±0.010.12±0.050.14±0.071.53±0.043.13±1.040.51±0.06106.73±11.292.01±0.262.43±0.781.24±0.540.49±0.210.21±0.09老白干香0.53±0.270.07±0.040.05±0.051.55±0.621.57±0.900.34±0.08103.93±8.930.89±0.511.92±0.381.50±0.120.55±0.190.47±0.26豉香0.35±0.120.03±0.010.28±0.100.12±0.091.32±0.490.29±0.0469.86±5.970.53±0.161.41±0.150.74±0.251.37±0.350.11±0.06药香0.61±0.290.07±0.050.02±0.012.66±0.104.80±1.580.66±0.0976.09±8.540.73±0.352.49±0.180.66±0.140.88±0.250.12±0.04馥郁香0.28±0.100.07±0.050.08±0.062.47±1.1926.80±3.520.41±0.06111.80±11.491.48±0.322.68±0.380.98±0.281.89±0.630.15±0.06平均值0.35±0.140.20±0.130.15±0.062.33±0.5411.73±2.890.69±0.12117.57±16.052.47±0.932.60±0.542.95±0.620.90±0.271.00±0.34
基于ACR、MGO、GO、CRO、FUR、FOR和ACE 7种RCS含量绘制热图,并对12个香型进行聚类分析。如图2所示,12个香型可归为两大类,第Ⅰ大类包括酱香型和芝麻香型,ACR、MGO、GO、CRO、FUR、FOR和ACE均相对较高,其中GO、CRO、FUR和ACE含量最高,国内已有文献报道芝麻香型酒中ACE含量最高,酱香型次之[13-14];可能是酱香型白酒和芝麻香型白酒均采用高温发酵的生产工艺,酱香型采用高温制曲、高温堆积、高温发酵、高温馏酒,其生产周期长,贮藏时间长;芝麻香型白酒采用高氮配料、高温堆积、高温发酵、高温馏酒[33-34],而较高的温度和高氮配料均有利于美拉德反应进行,已有大量文献报道RCS来源于美拉德反应或部分微生物发酵过程。因此,有必要对酒配料和发酵过程中RCS的形成进一步研究。其余香型可归为第Ⅱ大类。其中,药香型因其ACR含量较高而聚集,药香型白酒采用百草入曲,大、小曲发酵,双醅串蒸,偏碱性筑窑材料,究竟是哪种因素导致ACR含量增高尚需对各种因素综合分析研究。相比而言药香型的其他醛类含量明显较低。凤香型因其FOR含量较高而聚集。豉香型因其GO,ACR含量高而聚集,豉香型白酒在加工工艺会将酒泵入浸肉池,肥肉酝浸多天,而肥肉富含油脂。大量文献报道油脂氧化过程中会产生GO、ACR等[35],这可能是导致酒体中RCS含量增高的原因。老白干香型白酒3种聚类中,7种RCS含量均较低。清香型和特香型白酒中,RCS含量均较低,其中ACR含量最低。馥郁香型白酒除FUR略高,其他RCS含量均较低。浓香型白酒未能聚类,不同样品中7种RCS含量各不相同,反复抽取多种样品实验均未果。酒厂内容调研发现,浓香型白酒基酒存在异地采购勾兑而成现象。是否由于基酒不同造成的影响而不能聚类,有待进一步研究。

N-浓香型;Q-清香型;J-酱香型;M-米香型;F-香型;NJ-兼香型;Z-芝麻香型;T-特香型;L-老白干香型;C-豉香型;Y-药香型;NQ-馥郁香型
图2 不同香型成品酒中RCS含量热图聚类分析
Fig.2 Heatmap and cluster analysis of contents of RCS in different aroma type of finished liquors
2.4 不同产地成品酒中醛类化合物的分析
各类白酒差异性不仅归因于不同的加工工艺,其地域差异性导致气候、温湿度、水质、发酵微生物等因素也会影响白酒质量。白酒按产区可大致分为6大板块,分别为川黔板块、苏皖板块、鲁豫板块、两湖板块、东北板块和华北板块。本实验初步考察了9个产地的不同成品酒含量,其中RCS采用统计学方法,如表5所示。基于ACR、MGO、GO、CRO、FUR、FOR和ACE 7种RCS含量绘制热图,并对9个产地进行聚类分析。如图3所示,9个产地可归为2大类。贵州单独为Ⅰ类,7种RCS含量均较高,MGO、GO、CRO、FUR和ACE含量最高。四川、湖南、河北、广东,7种RCS含量总和略低,除少数GO含量较高,其余几种RCS含量均较低。江苏和陕西FOR含量较高,其余几种RCS含量略高。此外,贵州、湖南、河北、广东、陕西3个样品完全聚类,四川、山西、江苏其2个样品也能聚类,安徽3个样品各不相同,无法聚类。
表5 不同产地成品酒中醛类物质含量(n=3) 单位:μg/mL
Table 5 Contents of aldehydes in finished liquors from different regions
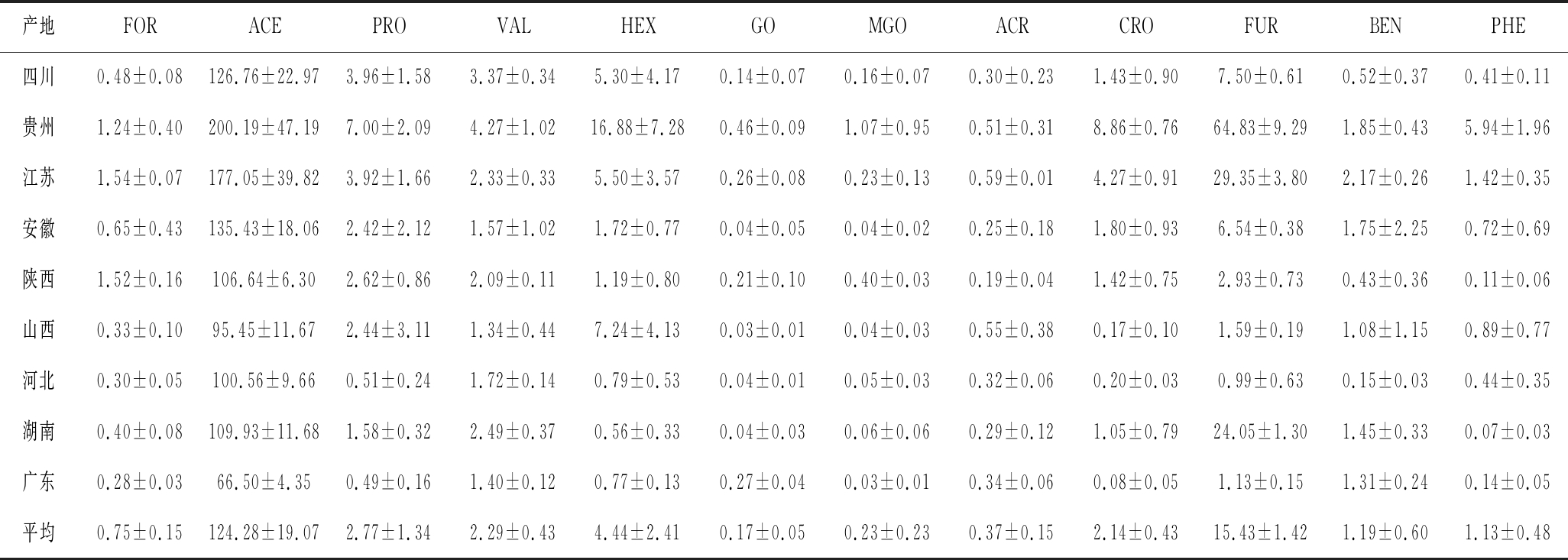
产地FORACEPROVALHEXGOMGOACRCROFURBENPHE四川0.48±0.08126.76±22.973.96±1.583.37±0.345.30±4.170.14±0.070.16±0.070.30±0.231.43±0.907.50±0.610.52±0.370.41±0.11贵州1.24±0.40200.19±47.197.00±2.094.27±1.0216.88±7.280.46±0.091.07±0.950.51±0.318.86±0.7664.83±9.291.85±0.435.94±1.96江苏1.54±0.07177.05±39.823.92±1.662.33±0.335.50±3.570.26±0.080.23±0.130.59±0.014.27±0.9129.35±3.802.17±0.261.42±0.35安徽0.65±0.43135.43±18.062.42±2.121.57±1.021.72±0.770.04±0.050.04±0.020.25±0.181.80±0.936.54±0.381.75±2.250.72±0.69陕西1.52±0.16106.64±6.302.62±0.862.09±0.111.19±0.800.21±0.100.40±0.030.19±0.041.42±0.752.93±0.730.43±0.360.11±0.06山西0.33±0.1095.45±11.672.44±3.111.34±0.447.24±4.130.03±0.010.04±0.030.55±0.380.17±0.101.59±0.191.08±1.150.89±0.77河北0.30±0.05100.56±9.660.51±0.241.72±0.140.79±0.530.04±0.010.05±0.030.32±0.060.20±0.030.99±0.630.15±0.030.44±0.35湖南0.40±0.08109.93±11.681.58±0.322.49±0.370.56±0.330.04±0.030.06±0.060.29±0.121.05±0.7924.05±1.301.45±0.330.07±0.03广东0.28±0.0366.50±4.350.49±0.161.40±0.120.77±0.130.27±0.040.03±0.010.34±0.060.08±0.051.13±0.151.31±0.240.14±0.05平均0.75±0.15124.28±19.072.77±1.342.29±0.434.44±2.410.17±0.050.23±0.230.37±0.152.14±0.4315.43±1.421.19±0.601.13±0.48
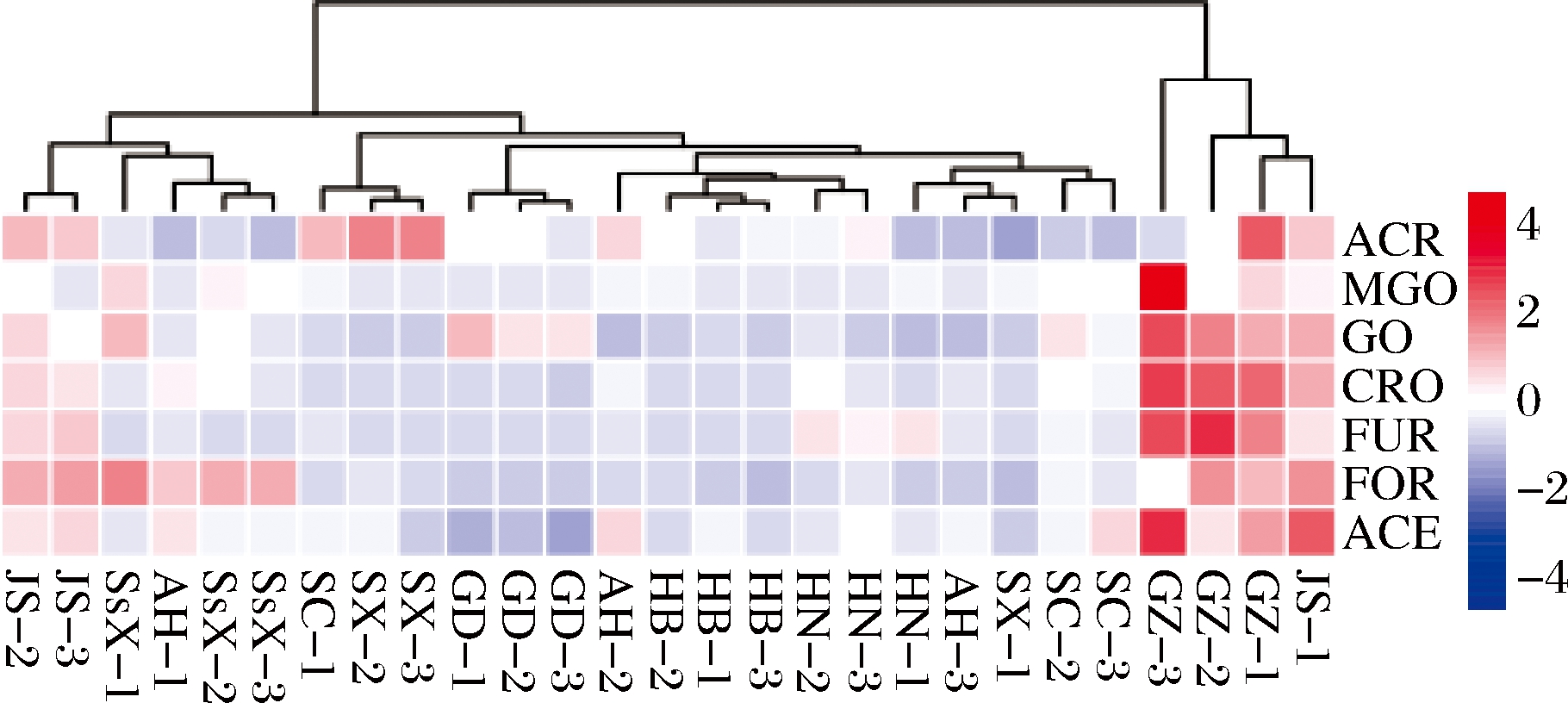
JS-江苏;GZ-贵州;SC-四川;SX-山西;AH-安徽;HN-湖南;HB-河北;GD-广东;SsX-陕西
图3 不同产地成品酒中RCS含量热图聚类分析
Fig.3 Heatmap and cluster analysis of contents of RCS in finished liquors from different regions
3 结论
本文建立了一种同时检测白酒中ACR、MGO、GO、CRO、FUR、FOR、ACE、PRO、VAL、HEX、BEN和PHE共12种醛类的GC-ECD分析方法。该方法LODs为0.3~2.0 ng/mL,LOQs为0.9~6.0 ng/mL,回收率86.98%~109.55%,方法的精密度高、稳定性好,灵敏度高,操作简便易行。采用统计学聚类分析法分析了12种香型、9个产地白酒中RCS含量。结果表明,不同香型白酒中7种RCS差异明显,其中酱香型和芝麻香型白酒中RCS含量较高。不同产地对RCS的影响也较为明显。贵州地区生产的白酒中RCS含量较高。而由于白酒配方迥异、加工工艺复杂,水质、气候、微生物等影响因素众多,导致酒体RCS含量高的原因尚需针对具体加工工艺进一步深入研究。
[1] TIAN C J, ZHEN Z.Reactive carbonyl species:Diabetic complication in the heart and lungs[J].Trends in Endocrinology and Metabolism, 2019, 30(8):546-556.
[2] PICARIELLO L, GAMBUTI A, PETRACCA F, et al.Enological tannins affect acetaldehyde evolution, colour stability and tannin reactivity during forced oxidation of red wine[J].International Journal of Food Science & Technology, 2018, 53(1):228-236.
[3] PERESTRELO R, RODRIGUEZ E, C MARA J S.Impact of storage time and temperature on furanic derivatives formation in wines using microextraction by packed sorbent tandem with ultrahigh pressure liquid chromatography[J].LWT-Food Science and Technology, 2017, 76:40-47.
MARA J S.Impact of storage time and temperature on furanic derivatives formation in wines using microextraction by packed sorbent tandem with ultrahigh pressure liquid chromatography[J].LWT-Food Science and Technology, 2017, 76:40-47.
[4] GELBKE H P, BUIST H, EISERT R.Derivation of safe exposure levels for potential migration of formaldehyde into food[J].Food and Chemical Toxicology, 2019, 132:110598.
[5] ELLIS E M.Reactive carbonyls and oxidative stress:Potential for therapeutic intervention[J].Pharmacology & Therapeutics, 2007, 115(1):13-24.
[6] LIU X Y, ZHU M X, XIE J P.Mutagenicity of acrolein and acrolein-induced DNA adducts[J].Toxicology Mechanisms and Methods, 2010, 20(1):36-44.
[7] SHIBAMOTO T.Analytical methods for trace levels of reactive carbonyl compounds formed in lipid peroxidation systems[J].Journal of Pharmaceutical & Biomedical Analysis, 2006, 41(1):12-25.
[8] 范文来, 王栋.近10年我国传统饮料酒白酒和黄酒品质安全研究现状与展望[J].食品安全质量检测学报, 2019, 10(15):4 811-4 829.
FAN W L, WANG D.Current practice and future trends of alcoholic beverages safety of China traditional Baijiu and Huangjiu in recent decades[J].Journal of Food Safety and Quality Inspection, 2019, 10(15):4 811-4 829.
[9] 税丕容. 白酒中潜在有害物质的研究进展[J].食品安全导刊, 2018(21):87-87.
SHUI P R.Research progress on potential harmful substances in liquor[J].China Food Safety Magazine, 2018(21):87-88.
[10] 张明赞, 何腊平, 张义明.白酒中甲醇、甲醛、氰化物和金属离子的研究进展[J].食品安全质量检测学报, 2015, 6(9):3 563-3 568.
ZHANG M Z, HE L P, ZHANG Y M.Research progress of methanol, formaldehyde, cyanide and metal ions in Chinese liquor[J].Journal of Food Safety and Quality Inspection, 2015, 6(9):3 563-3 568.
[11] 郑淼, 岳红卫, 钟其顶.白酒质量安全风险及其控制[J].食品科学技术学报, 2016, 34(2):18-23.
ZHENG M, YUE H W, ZHONG Q D.Safety risk and its control of Chinese white spirits[J].Journal of Food Science and Technology, 2016, 34(2):18-23.
[12] 朱梦旭, 范文来, 徐岩.我国白酒蒸馏过程以及不同年份产原酒和成品酒中甲醛的研究[J].食品与发酵工业, 2015, 41(9):153-158.
ZHU M X, FAN W L, XU Y.Characterization of formaldehyde from distillation cut, raw liquor of different vintage, and finished Chinese liquor[J].Food and Fermentation Industries, 2015, 41(9):153-158.
[13] 朱梦旭, 范文来, 徐岩.我国白酒蒸馏过程及原酒、成品酒中乙醛的研究[J].食品与发酵工业, 2016, 42(4):6-11.
ZHU M X, FAN W L, XU Y.Research on acetaldehyde from distillation cut, raw liquor, finished liquor[J].Food and Fermentation Industries, 2016, 42(4):6-11.
[14] 张秋, 范光森, 李秀婷.我国白酒质量安全现状浅析[J].中国酿造, 2016, 35(11):15-20.
ZHANG Q, FAN G S, LI X T.Brief analysis on the status of Baijiu quality and safety in China[J].Chinese Brew, 2016, 35(11):15-20.
[15] 许汉英. 白酒中糠醛含量与香型之间关系的研究[J].酿酒,2002, 29(5):37-39.
XU H Y.Study on relativity between furfural content and fragrance style of Chinese liquor[J].Liquor-Making, 2002, 29(5):37-39.
[16] HURTADO-S NCHEZ M D C,ESPINOSA-MANSILLA A, ROPR
NCHEZ M D C,ESPINOSA-MANSILLA A, ROPR GUEZ-C
GUEZ-C CERES M I, et al.Evaluation of liquid chromatographic behavior of lumazinic derivatives, from α-dicarbonyl compounds, in different C18 columns:Application to wine samples using a fused-core column and fluorescence detection[J].Journal of Agricultural and Food Chemistry, 2014, 62(1):97-106.
CERES M I, et al.Evaluation of liquid chromatographic behavior of lumazinic derivatives, from α-dicarbonyl compounds, in different C18 columns:Application to wine samples using a fused-core column and fluorescence detection[J].Journal of Agricultural and Food Chemistry, 2014, 62(1):97-106.
[17] RODR GUEZ-C
GUEZ-C CERES M I, PALOMINO-VASCO M, MORA-DIEZ N, et al.Dispersive liquid-liquid microextraction for a rapid determination of glyoxal in alcoholic beverages[J].Talanta, 2017, 168:100-104.
CERES M I, PALOMINO-VASCO M, MORA-DIEZ N, et al.Dispersive liquid-liquid microextraction for a rapid determination of glyoxal in alcoholic beverages[J].Talanta, 2017, 168:100-104.
[18] MOREIRA N, ![]() A M, ROGERSON F, et al.Development and optimization of a HS-SPME-GC-MS methodology to quantify volatile carbonyl compounds in Port wines[J].Food Chemistry, 2019, 270:518-526.
A M, ROGERSON F, et al.Development and optimization of a HS-SPME-GC-MS methodology to quantify volatile carbonyl compounds in Port wines[J].Food Chemistry, 2019, 270:518-526.
[19] SAISON D, DE SCHUTTER D P, DELVAUX F, et al.Determination of carbonyl compounds in beer by derivatisation and headspace solid-phase microextraction in combination with gas chromatography and mass spectrometry[J].Journal of Chromatography A, 2009, 1 216(26):5 061-5 068.
[20] JEONG J H, CHA J, LEE K G.Validation of analytical method for α-dicarbonyl compounds using gas chromatography-nitrogen phosphorous detector and their levels in alcoholic beverages[J].International Journal of Food Science & Technology, 2017, 52(6):1 491-1 497.
[21] LEDAUPHIN J, LEFRANCOIS A, MARQUET N, et al.Development of an accurate and sensitive gas chromatographic method for the determination of acrolein content in calvados and cider[J].LWT-Food Science and Technology, 2006, 39(9):1 045-1 052.
[22] SERRA-CAYUELA A, CASTELLARI M, BOSCH-FUSTÉ J, et al.Identification of 5-hydroxymethyl-2-furfural (5-HMF) in cava sparkling wines by LC-DAD-MS/MS and NMR spectrometry[J].Food Chemistry, 2013, 141(4):3 373-3 380.
[23] ORTU E, CABONI P.Levels of 5-hydroxymethylfurfural, furfural, 2-furoic acid in sapa syrup, Marsala wine and bakery products[J].International Journal of Food Properties, 2017,20:2 543-2 551.
[24] SAMPAIO O M, RECHE R V, FRANCO D W.Chemical profile of rums as a function of their origin:The use of chemometric techniques for their identification[J].Journal of Agricultural and Food Chemistry, 2008, 56(5):1 661-1 668.
[25] ALARCON R A.Fluorometric determination of acrolein and related compounds with m-aminophenol[J].Analytical Chemistry, 1968, 40(11):1 704-1 708.
[26] WANG Y T, LIN H C, ZHAO W Z, et al.Acrolein acts as a neurotoxin in the nigrostriatal dopaminergic system of rat:Involvement of α-synuclein aggregation and programmed cell death[J].Scientific Reports, 2017, 7:45741.
[27] CHEN W Y, ZHANG J W, GHARE S, et al.Acrolein is a pathogenic mediator of alcoholic liver disease and the scavenger hydralazine is protective in mice[J].Cellular & Molecular Gastroenterology & Hepatology, 2016, 2(5):685-700.
[28] 朱梦旭. 白酒中易挥发的有毒有害小分子醛及其结合态化合物研究[D].无锡:江南大学, 2016.
ZHU M X.Volatile, toxic and small molecular aldehydes and their derivatives in Chinese liquor[D].Wuxi: Jiangnan University, 2016.
[29] PETROZZIELLO M, TORCHIO F, PIANO F, et al.Impact of increasing levels of oxygen consumption on the evolution of color, phenolic and volatile compounds of Nebbiolo wines[J].Frontiers in Chemistry, 2018, 6:137.
[30] 刘涛. 试论白酒的分类、生产工艺及其营养价值[J].酿酒, 2018, 45(3):21-22.
LIU T.Discussions on the classification,production technology and nutrition value of liquor[J].Liquor Making, 2018, 45(3):21-22.
[31] 陈飞. 基于微量组分的白酒基酒分类鉴别与模式识别研究[D].重庆:重庆大学, 2018.
CHEN F.Study on classification and pattern recognition of base liquors based on trace components[D].Chongqing: Chongqing University, 2018.
[32] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 33406—2016 白酒风味物质阈值测定指南[S].北京:中国标准出版社, 2016.
State Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, China National Standardization Administration Committee.GB/T 33406—2016 Guide for the determination of liquor flavor substance thresholds[S].Beijing:China Standards Press, 2016.
[33] 赵益梅,唐佳代,江璐.酿造工艺对酱香大曲酒的影响概述[J].现代食品, 2020(5):106-111.
ZHAO Y M, TANG J D, JIANG L.Overview of the influence of brewing process on Moutai-flavor Daqu liquor [J].Modern Food, 2020(5):106-111.
[34] 李小东. 堆积发酵条件对芝麻香型白酒香气品质的影响[D].无锡:江南大学, 2018.
LI X D.Effects of accumulation fermentation conditions on aroma quality of Sesame-scented liquor[D].Wuxi:Jiangnan University, 2018.
[35] JIANG Y P, HENGEL M, PAN C P, et al.Determination of toxic α-dicarbonyl compounds, glyoxal, methylglyoxal, and diacetyl, released to the headspace of lipid commodities upon heat treatment[J].Journal of Agricultural & Food Chemistry, 2013, 61(5):1 067-1 071.