红霉素(erythromycin A,EA)是由链霉素所产生的一种碱性大环内酯类抗生素,在酸性条件下易降解产生多种副产物,如脱水红霉素、红霉素A烯醇醚和伪红霉素A烯醇醚等[1]。在蜂业生产中,红霉素被用于防治意蜂的美洲幼虫腐臭病,特别是对土霉素有抗性的美洲幼虫腐臭病[2]。红霉素的不合理使用导致红霉素及其降解物在蜂产品中残留,对蜂产品质量安全和人体健康带来潜在风险。
红霉素的降解产物不具有抗微生物特性,且脱水红霉素和红霉素A烯醇醚被认为是人类在红霉素治疗中产生胃肠不适的原因[3]。蜂蜜的pH为3.3~6.5[4],蜂王浆的pH为4.0~4.5[5],两者均为酸性介质,红霉素极易在其中降解残留,引发人体过敏反应等不良副作用[6]。但目前尚未有红霉素降解物残留测定的相关标准参考,因此,建立蜂蜜和蜂王浆中红霉素及其降解物残留的分析方法对于监测蜂产品中红霉素残留情况以及保障蜂产品的消费安全具有实际意义。
目前,关于对蜂蜜和蜂王浆中红霉素及其降解物的定量检测方法报道较少,在我国标准及相关文献中关于红霉素的测定方法主要是液相色谱-串联质谱法,前处理技术主要采用固相萃取法[6-10],但操作步骤繁琐、试剂消耗量大,不适于批量样品检测。QuEChERS(quick, easy, cheap, effective, rugged, safe)法是集萃取和净化为一体的前处理技术,具有操作简便快速、环境友好、检测高效等优点,常用于提取食品中的农药和兽药残留等化学污染物[11-12]。但尚无使用QuEChERS法同时提取蜂产品中红霉素及其降解物的研究,故本研究采用QuEChERS法,结合超高效液相色谱-串联质谱,建立了蜂蜜和蜂王浆中红霉素及其降解物的分析方法。
1 材料与方法
1.1 仪器与试剂
Agilent 1290超高效液相色谱仪、6495三重四级杆串联质谱仪,美国Agilent公司;Milli-Q超纯水系统,美国Millipore公司;万分之一天平,上海梅特勒-托利多仪器有限公司;CR22G 高速冷冻离心机,日本日立公司;G560E涡旋混匀器,美国Scientific Industries 公司。
甲醇和乙腈(色谱纯),德国Merck公司;甲酸(色谱纯),美国Fluka公司;红霉素、脱水红霉素、伪红霉素A烯醇醚和红霉素A烯醇醚标准品(纯度≥99%),加拿大 TRC公司。
称取适量标准品,在避光条件下,分别用甲醇配制成1 000 mg/L的储备液并储存在-20 ℃冰箱中(现配现用)。根据实验需要用乙腈稀释标准储备液,配成适当浓度的标准工作溶液。
1.2 样品前处理
分别称取5.00 g(精确到0.01 g)蜂蜜样品或2.00 g (精确到0.01 g)蜂王浆样品于50 mL离心管中,加入5 mL水使样品完全溶解,加入10 mL乙腈经涡旋1 min,超声提取10 min后,加入脱水试剂 (4 g无水硫酸钠和1 g氯化钠),涡旋振荡1 min,以8 000 r/min离心10 min,取5.0 mL上清液于分散固相萃取管 [400 mg N-丙基乙二胺(primary secondary amine, PSA)+1 200 mg 无水硫酸镁],涡旋混匀1 min后于8 000 r/min速率下离心10 min,所得上清液经0.22 μm有机滤膜过滤,超高效液相色谱-串联质谱测定。
1.3 测定条件
1.3.1 色谱条件
色谱柱:Agilent Poroshell 120 EC-C18(3.0 mm×100 mm×2.7 μm);流动相 A:含0.1%(体积分数,下同)甲酸的水溶液;流动相 B:甲醇;梯度程序:0~1 min: 55%~60% B,1~4 min:60%~75% B,4~5 min: 75%~98% B,5~7 min:98% B;进样量:2 μL; 柱温:30 ℃;运行时间:7 min;流速:0.3 mL/min;后运行时间:2 min。
1.3.2 质谱条件
电喷雾正离子模式(ESI+);多重反应监测(multiple reaction monitoring,MRM);离子源温度:250 ℃;干燥气流速:15 L/min;干燥气压力:45 psi;鞘气温度:350 ℃;鞘气流速:12 L/min;离子源电压:3 500 V;红霉素及其降解物的定性,定量离子对等质谱分析参数见表1。
2 结果与分析
2.1 仪器条件的优化
2.1.1 质谱条件的优化
将配制的红霉素及其降解物的标准贮备液稀释成质量浓度为 500 ng/mL 的标准工作溶液,采用ESI+对其进行全扫描。进入一级质谱后,得到稳定的红霉素及其降解物4种物质的[M+H]+ 离子峰,进一步对子离子、碰撞能量等参数进行优化。获得红霉素、脱水红霉素、伪红霉素A烯醇醚和红霉素A烯醇醚的二级质谱全扫描图后,选择离子丰度最高、基质干扰最小的2个离子对作为特征离子对,将信号响应最高的离子对作定量离子,响应次高的作定性离子。设定合适的峰驻留时间确保色谱峰的采样点数在15~20点,从而得到较好的定量重复性,进行样品分析时结合化合物的保留时间。得到的离子对及其对应的质谱参数见表1。
表1 红霉素及其降解物的保留时间及质谱分析参数
Table 1 Retention time and mass spectrometry parameters of erythromycin A and its degradation products
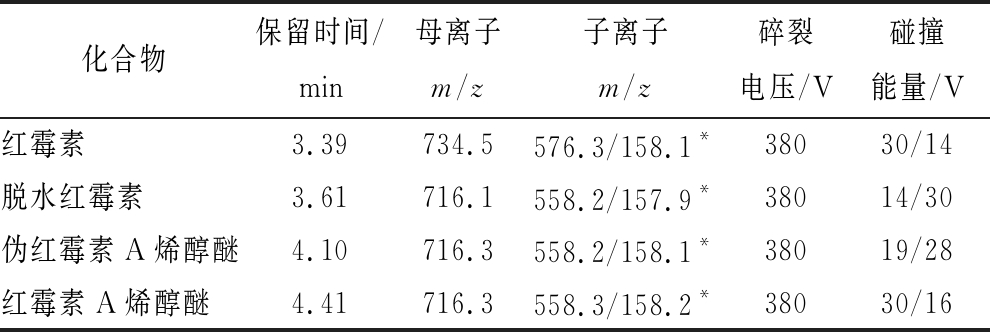
注:*表示定量离子
化合物保留时间/min母离子m/z子离子m/z碎裂电压/V碰撞能量/V红霉素3.39734.5576.3/158.1*38030/14脱水红霉素3.61716.1558.2/157.9*38014/30伪红霉素A烯醇醚4.10716.3558.2/158.1*38019/28红霉素A烯醇醚4.41716.3558.3/158.2*38030/16
2.1.2 色谱条件的优化
试验选择了甲醇-0.1%甲酸水溶液,0.1%甲酸水-乙腈组成的流动相体系,发现0.1%的甲酸水和甲醇为流动相时,4种物质的离子化效率最佳。为了降低基质干扰,增强分离度以及延长色谱柱的使用寿命,在优化梯度洗脱程序后,实现了红霉素及其降解物的良好分离。得到的TIC图谱如图1所示。
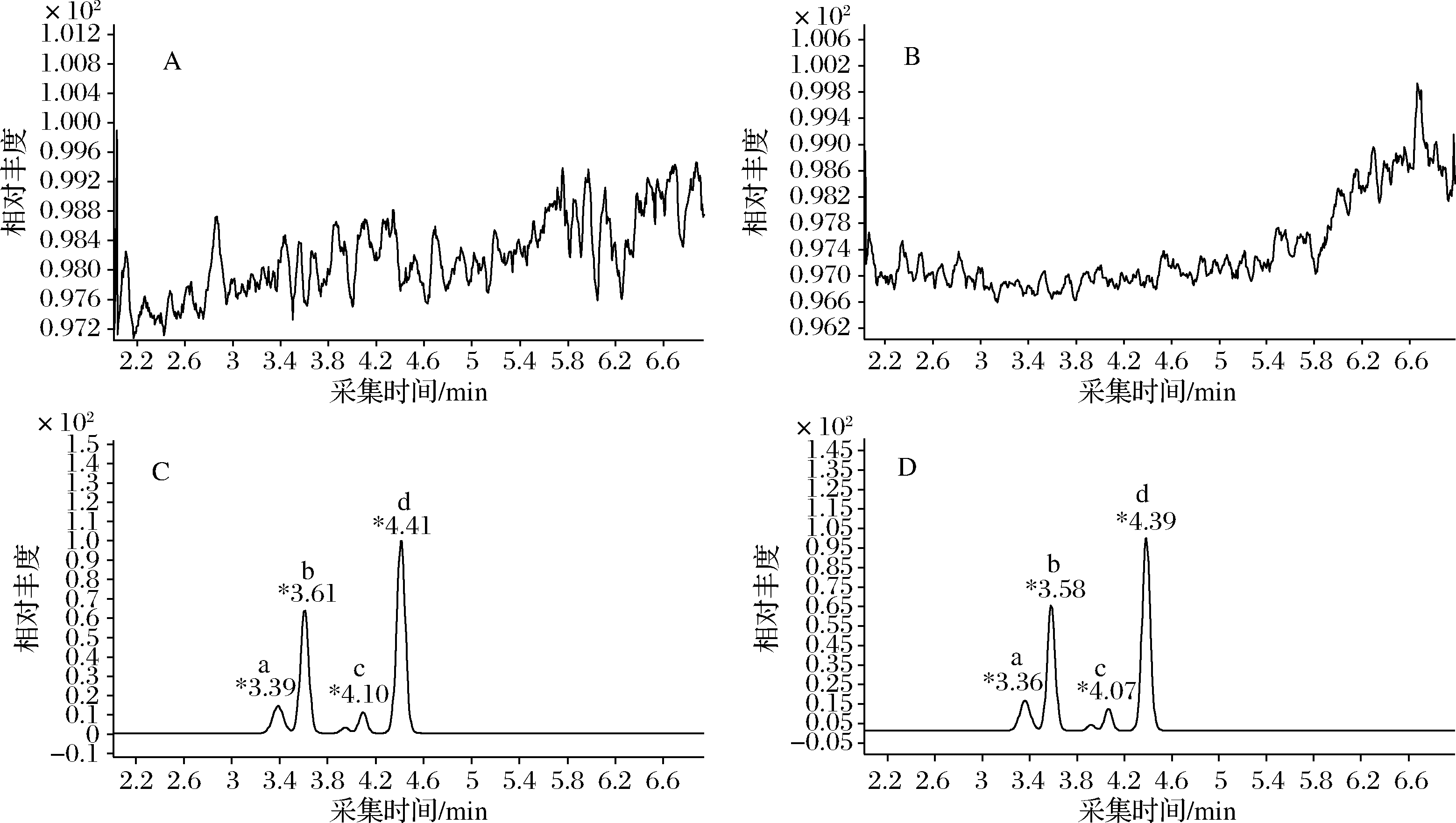
a-红霉素A;b-脱水红霉素;c-伪红霉素A烯醇醚;d-红霉素A烯醇醚A-蜂蜜空白;B-蜂王浆空白;C-蜂蜜样品;D-蜂王浆样品
图1 50 μg/kg 添加水平下蜂蜜和蜂王浆样品中红霉素及其降解物TIC图
Fig.1 TIC chromatogram of erythromycin A and its degradation products in honey and royal jelly at 50 μg/kg spiked level
注:*表示不同化合物的保留时间
2.2 前处理条件的优化
蜂蜜的主要成分为糖类物质,此外还含有少量的蛋白质、氨基酸、维生素、矿物质、有机酸、类胡萝卜素、酶和芳香物质等[13]。蜂王浆中含有多种生物活性物质,如游离氨基酸、蛋白质、糖、脂肪酸、矿物质和维生素等,其中蛋白质占新鲜蜂王浆的12%~15%[14]。基质较为复杂,为了提高蜂蜜和蜂王浆中红霉素及其降解物的提取效率,降低基质干扰,应尽可能地除去糖类、蛋白和脂类干扰物,建立稳定、可靠、回收率高的样品前处理方法。
2.2.1 提取溶剂的选择
乙腈和弱酸性缓冲溶液在QuEChERS方法中常被用作提取溶剂,但红霉素易溶于极性有机溶剂且在酸性条件下不稳定。试验分别选择甲醇、乙腈和乙酸乙酯作为提取试剂进行考察。结果表明,相对于甲醇提取液来说,乙腈提取液较易分层,水分较少。原因在于乙腈对糖的溶解性较小,在水中的溶解度低于甲醇,且具有沉淀蛋白的作用。而将乙酸乙酯作为提取溶剂时,产生严重乳化现象,回收率低,重复性差。因此,最终选择乙腈作为本研究的提取剂。此外,根据相关研究[15],盐析剂选用了4 g 硫酸钠和1 g 氯化钠,在去除水分的同时,可促进提取液乙腈层和水层的分离。
2.2.2 净化条件的优化
萃取溶液中干扰物的存在可能会影响色谱分离,并增强或降低目标分析物的离子信号,也会导致离子源的污染。为了解决这个问题,研究选择了不同的吸附剂进行组合净化。无水MgSO4、PSA、C18和石墨化炭黑(graphitized carbon black,GCB)是常用的吸附剂材料。PSA 在硅胶上键合了乙二胺-N-丙基官能团,主要作用是去除蜂蜜、蜂王浆提取物中的极性色素、脂肪酸、有机酸和糖类物质[16]。MgSO4 作为一种干燥剂,可用于去除有机溶剂中的痕量水[17],样品含水量越少PSA净化效果越好,结合合适的无水MgSO4用量能发挥更好的净化作用。C18产生强非极性相互作用,可以吸附蜂蜜和蜂王浆中的一些脂质等非极性、弱极性的化合物[18]。GCB具有特殊的层状结构,对去除色素以及固醇类杂质有很好的效果[19]。
试验比较了MgSO4+PSA、MgSO4+PSA+C18和MgSO4+PSA+C18+GCB的净化效果。称取一定量的蜂蜜、蜂王浆样品并加标,考察在相同量下,使用不同混合比例的分散剂对加标回收率的影响,结果见图2。 在有GCB和C18吸附剂存在的条件下,红霉素在蜂蜜和蜂王浆基质中的回收率较低,且明显低于脱水红霉素、伪红霉素A烯醇醚和红霉素A烯醇醚3种降解物,说明对红霉素具有吸附作用。在对蜂蜜样品进行净化时,考虑到蜂蜜中的脂质较少,首先采用150 mg PSA+900 mg MgSO4的吸附剂,发现4种目标物质在蜂蜜样品中的回收率均低于70%,显然净化效果不够,而后选择了400 mg PSA+1 200 mg MgSO4比例的吸附剂,发现回收率显著高于前者。在对蜂王浆样品进行净化时,首先采用400 mg PSA+1 200 mg MgSO4+400 mg C18EC的吸附剂,发现红霉素和伪红霉素A烯醇醚的回收较低,说明C18对两者具有吸附作用。之后采用400 mg PSA+1 200 mg MgSO4 的吸附剂,红霉素回收率显著提高。因此,综合蜂蜜和蜂王浆样品中红霉素及其降解物脱水红霉素、伪红霉素A烯醇醚和红霉素A烯醇醚的回收率情况,最终选择了400 mg PSA+1 200 mg MgSO4的吸附剂。
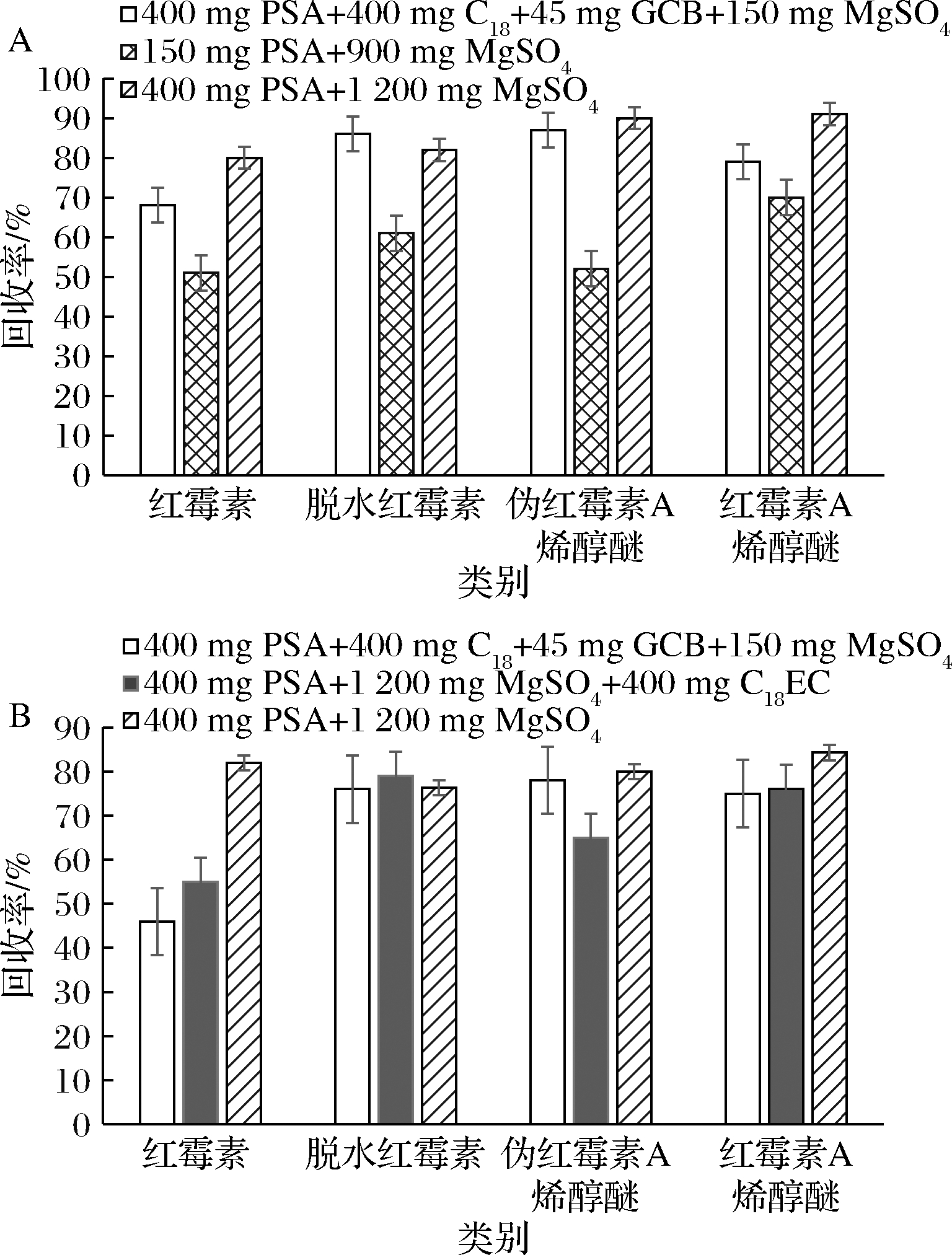
A-蜂蜜;B-蜂王浆
图2 不同净化剂、蜂蜜和蜂王浆中红霉素及其降解物的回收率
Fig.2 Recoveries of erythromycin A and its degradation products in honey and royal jelly with different purifying agent
2.3 方法学验证
2.3.1 基质效应、线性范围、检出限和定量限
基质效应是基质共提物干扰目标化合物的离子化,使得目标化合物在仪器上的响应发生了增强或者抑制的现象,从而影响目标物的定量测定。本研究采用提取后加入法和绝对基质相应法来评价基质效应,基质效应(matrix effect,ME)计算如公式(1)所示[20]:
![]()
(1)
以浓度为横坐标,峰面积为纵坐标,绘制基质匹配校准曲线和溶剂校准曲线,计算并评价了红霉素及(其降解物在蜂蜜和蜂王浆中的基质效应。当ME<-20%时,表现为基质抑制效应;-20%≤ME≤20% 时,表现为弱基质效应;ME>20% 时,表现为基质增强效应。
按照建立的样品前处理方法处理空白样品,用得到的空白基质提取液将标准工作液逐级稀释至0.2、2.0、5.0、10.0、50.0和100.0 ng/mL,获得基质匹配标准曲线溶液;同时用乙腈稀释标准工作液至0.2、2.0、5.0、10.0、50.0和100.0 ng/mL,获得溶剂标准曲线溶液。如表2所示,在0.2~100 ng/mL线性范围内蜂王浆基质标线性关系良好,在0.2~50 ng/mL线性范围内蜂蜜基质标线性关系良好。ME值为-51%~2%, 表明存在基质效应。因此,选用基质匹配标准曲线对蜂蜜和蜂王浆中的红霉素及其降解物进行定量。用MassHunter定量软件计算得到各目标化合物线性回归方程及其相关系数。如表2所示,各化合物的线性关系良好,均大于0.99。相关研究报道方法中,蜂蜜中红霉素A、红霉素 A 烯醇醚和脱水红霉素 A 的检出限、定量限分别为0.5和2.0 μg/kg[7];蜂王浆中红霉素 A、红霉素 A 烯醇醚、脱水红霉素A的检出限和定量限分别为0.5和5.0 μg/kg[6],而本研究建立了同时测定蜂蜜和蜂王浆中红霉素 A、红霉素 A 烯醇醚、脱水红霉素 A和伪红霉素A烯醇醚4种化合物的检测方法,检出限[信噪比(S/N≥3)]为0.2~0.63 μg/kg,定量限(S/N≥10)为0.5~1.9 μg/kg,与先前研究相比,本方法具有更低的检出限和定量限。
表2 基质匹配标准曲线与溶剂标准曲线的比较
Table 2 Comparison of matrix-matched calibration and solvent calibration

分析物基质线性范围/(ng·mL-1)基质效应标准曲线方程r2检出限/(μg·kg-1)定量限/(μg·kg-1)红霉素溶剂0.2~100-y=10 221.738 0x-1 981.777 10.997 2--蜂蜜0.2~50-7%y=9 481.184 0x+147.459 30.999 90.20.5蜂王浆0.2~100-15%y=8 667.249 2x-1 690.102 80.999 90.31脱水红霉素溶剂0.2~100-y=21 764.845 2x-2 144.112 80.999 7--蜂蜜0.2~50-7%y=20 297.371 8 x-201.480 50.999 90.51.5蜂王浆0.2~100-51%y=10 713.445 7x+8 820.719 40.999 10.521.6红霉素A烯醇醚溶剂0.2~100-y=30 723.466 5x-5 050.457 20.997 6--蜂蜜0.2~500y=30 613.277 2x-3 713.570 90.999 90.41.2蜂王浆0.2~100-9%y=28 048.407 1x+2 483.470 10.999 90.571.7伪红霉素A烯醇醚溶剂0.2~100-y=12 094.548 9x-6 243.054 30.993 9--蜂蜜0.2~502%y=12 350.835 4x-6 000.336 10.998 40.61.8蜂王浆0.2~100-5%y=11 466.804 6x-4 657.913 40.999 40.631.9
2.3.2 准确度和精密度
由于蜂王浆和蜂蜜成分复杂,且组分存在差异,故对样品的称样量进行了优化,分别称取5 g蜂蜜和2 g蜂王浆进行后续前处理操作,在蜂蜜和蜂王浆样品中分别添加5.0、10.0、25.0 μg/L的红霉素及其降解物的标准储备液进行加标回收试验,每个加标浓度设定6个平行,并做空白实验。标准曲线采用空白基质样品前处理后添加标准品并制备成系列工作溶液的方法进行测定和绘制,考察了红霉素及其代谢物的回收率和相对标准偏差(relative standard deviation,RSD)。研究发现不同添加浓度的分析物平均回收率范围为70%~93%,RSD≤4.0%。方法具有良好的回收率和重现性,可实现现蜂蜜和蜂王浆基质中红霉素及其降解物的准确分析测定。
表3 红霉素及其降解物蜂蜜、蜂王浆基质中的添加回收率
Table 3 Recoveries of spiked erythromycin A and its degradation products in honey and royal jelly

分析物添加水平/(μg·kg-1)蜂蜜蜂王浆平均回收率/%RSD/%平均回收率/%RSD/%红霉素脱水红霉素红霉素A烯醇醚伪红霉素A烯醇醚1084%2.10%87%3.50%2080%0.90%83%0.90%5076%2.90%76%0.40%1085%1.10%81%4.00%2082%1.50%78%2.60%5077%1.10%70%1.70%1093%1.50%87%2.60%2091%0.40%88%1.40%5087%1.20%78%1.30%1089%2.40%85%1.90%2090%1.10%83%0.90%5080%0.80%71%2.10%
2.4 实际样本的测定
从市场分别抽检30个蜂蜜和蜂王浆样品,应用本方法进行检测,以保留时间和碎片离子定性,外标法定量,结果表明,红霉素及其降解物均未检出。
3 结论
本文通过优化色谱条件、质谱条件、QuEChERS方法的提取溶剂和净化吸附材料,实现了基于超高效液相色谱-串联质谱法对蜂蜜和蜂王浆中红霉素及其降解物残留的定性定量。本法快速、准确、灵敏度高、操作简单,方法检出限为0.2~0.63 μg/kg,定量限为0.5~1.9 μg/kg,回收率为70%~93%,RSD为0.4%~4.0%。方法已经应用于实际样品测定,抽检的样品中未检测到红霉素及其代谢物。建立的方法可以形成标准检测方法用于蜂蜜和蜂王浆中红霉素及其降解产物的日常检测。
[1] VOLMER D A, HUI J P M.Study of erythromycin A decomposition products in aqueous solution by solid-phase microextraction/liquid chromatography/tandem mass spectrometry[J].Rapid Communications in Mass Spectrometry, 1998, 12(3):123-129.
[2] KOCHANSKY J, KNOX D A, FELDLAUFER M, et al.Screening alternative antibiotics against oxytetracycline-susceptible and resistant Paenibacillus larvae[J].Apidologie, 2001, 32(3):215-222.
[3] PARIZA R J.From Patent to Prescription:Paving the Perilous Path to Profit[M].Hoboken, NJ:John Wiley & Sons, Inc, 2006:1-16.
[4] KNIGHT A.The therapeutic effects of honey[J].Religion State & Society, 2013, 6(1):375-385.
[5] MURE AN C I, BUTTSTEDT A.pH-dependent stability of honey bee (Apis mellifera) major royal jelly proteins[J].Scientific Reports, 2019, 9(1):9 014.
AN C I, BUTTSTEDT A.pH-dependent stability of honey bee (Apis mellifera) major royal jelly proteins[J].Scientific Reports, 2019, 9(1):9 014.
[6] 张晓燕, 朱文君, 刘艳, 等.高效液相色谱-串联质谱法测定蜂王浆中红霉素及其代谢物[J].食品安全质量检测学报, 2014, 5(10):2 994-2 999.
ZHANG X Y, ZHU W J, LIU Y, et al.Determination of erythromycin A and its metabolites in royal jelly by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety & Quality, 2014, 5(10):2 994-2 999.
[7] 张晓燕, 郑定钊, 袁芳, 等.高效液相色谱-串联质谱法测定蜂蜜中的红霉素及其代谢物[J].分析测试学报, 2013, 32(9):1 131-1 134.
ZHANG X Y, ZHENG D Z, YUAN F, et al.Determination of erythromycin A and its metabolites in honey by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis, 2013, 32(9):1 131-1 134.
[8] THOMPSON T S, VAN DEN HEEVER J P.Degradation of erythromycin in honey and selection of suitable marker residues for food safety analysis[J].Food Chemistry, 2012, 133(4):1 510-1 520.
[9] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 22941—2008 蜂蜜中林可霉素、红霉素、螺旋霉素、替米考星、泰乐菌素、交沙霉素、吉他霉素、竹桃霉素残留量的测定 液相色谱-串联质谱法[S].北京:中国标准出版社, 2008.
State Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, China National Standardization Administration Committee.GB/T 22941—2008 Determination of lincomycin,erythromycin,spiramycin, tilmicosin,tylosin,josamycin,kitasamycin,oleandomycin residues in honey-LC-MS-MS method [S].Beijing:China Standards Press, 2009.
[10] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 22946—2008 蜂王浆和蜂王浆冻干粉中林可霉素、红霉素、替米考星、泰乐菌素、螺旋霉素、克林霉素、吉他霉素、交沙霉素残留量的测定 液相色谱-串联质谱法[S].北京:中国标准出版社, 2008.
State Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, China National Standardization Administration Committee.GB/T 22946—2008 Determination of lincomycin,erythromycin,tilmicosin,tylosin,spiramycin,clindamycin,kitasamycin and josamycin residues in royal jelly and lyophilized royal jelly powder—LC-MS-MS method [S].Beijing:China Standards Press, 2009.
[11] 吕青骎, 王玮, 梁丽姣, 等.QuEChERS结合超高效液相色谱质谱法测定禽蛋及其制品中42种农药及其代谢物[J].食品与发酵工业, 2020, 46(5):255-262.
LYU Q Q, WANG W, LIANG L J, et al.Determination of 42 pesticides and their metabolites in poultry eggs and productsby QuEChERS-UPLC-MS/MS[J].Food and Fermentation Industries, 2020, 46(5):255-262.
[12] 容裕棠, 张宪臣, 张朋杰, 等.QuEChERS-超高效液相色谱-串联质谱法同时测定蜂蜜中21种磺胺类药物残留[J].食品与发酵工业, 2018, 44(4):226-233.
RONG Y T, ZHANG X C, ZHANG P J, et al.Simultaneous determination of twenty-one sulfonamides residues in honey by QuEChERS ultra liquid chromatography-mass mass spectrometry[J].Food and Fermentation Industries, 2018, 44(4):226-233.
[13] DA SILVA P M, GAUCHE C, GONZAGA L V, et al.Honey:Chemical composition, stability and authenticity[J].Food Chemistry, 2016, 196:309-323.
[14] ZHOU L, XUE X F, ZHOU J H, et al.Fast determination of adenosine 5′-triphosphate (ATP) and its catabolites in royal jelly using ultraperformance liquid chromatography[J].Journal of Agricultural and Food Chemistry, 2012, 60(36):8 994-8 999.
[15] 杨明, 伊鋆, 陈丹, 等.氧化锌QuEChERS/高效液相色谱-串联质谱法测定蜂蜜中7种林可酰胺类与大环内酯类兽药残留[J].分析测试学报, 2020, 39(8):974-979.
YANG M,YI J, CHEN D, et al.Determination of seven lincosamides and macrolides residues in honeys by high performance liquid chromatography-tandem mass spectrometry with ZnO QuEChERS[J].Journal of Instrumental Analysis, 2020, 39(8):974-979.
[16] TIAN F J, QIAO C K, LUO J, et al.Development and validation of a method for the analysis of five diamide insecticides in edible mushrooms using modified QuEChERS and HPLC-MS/MS[J].Food Chemistry, 2020, 333:127468.
[17] 钱卓真, 汤水粉, 梁焱, 等.QuEChERS-高效液相色谱-串联质谱法同时测定水产养殖环境沉积物中磺胺类、喹诺酮类、大环内酯类抗生素[J].质谱学报, 2019, 40(4):356-368.
QIAN Z Z, TANG S F, LIANG Y, et al.Simultaneous determination of sulfonamides, quinolones and macrolides antibiotics residues in sediment from aquaculture environment by QuEChERS-HPLC-MS/MS[J].Journal of Chinese Mass Spectrometry Society, 2019, 40(4):356-368.
[18] SONG S Y, ZHU K C, HAN L J, et al.Residue analysis of 60 pesticides in red swamp crayfish using QuEChERS with high-performance liquid chromatography-tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2018, 66(20): 5 031-5 038.
[19] 黄何何, 张缙, 徐敦明, 等.QuEChERS-高效液相色谱-串联质谱法同时测定水果中21种植物生长调节剂的残留量[J].色谱, 2014, 32(7):707-716.
HUANG H H, ZHANG J, XU D M, et al.Determination of 21 plant growth regulator residues in fruits by QuEChERS-highperformance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography, 2014, 32(7):707-716.
[20] 李建勋, 范蓓, 周杰, 等.QuEChERS-超高效液相色谱-飞行时间质谱法快速筛查蔬菜中154种农药残留[J].食品与发酵工业, 2019, 45(19):239-250.
LI J X, FAN B, ZHOU J, et al.Rapid screening of 154 pesticide residues in vegetables by QuEChERS-ultra high performance liquid chromatography-time mass spectrometry[J].Food and Fermentation Industries, 2019, 45(19):239-250.