大蒜(Allium sativum L.)皮(简称蒜皮),是保护蒜瓣(即蒜米)的干燥外层膜质部分。我国是大蒜生产、消费、出口大国,尤其是脱水蒜片的出口量保持逐年增加,2017年达21.27万t[1],仅生产这些脱水蒜片就会产生约5万t废弃蒜皮。因此,蒜皮资源丰富,亟待开发升值。
天然多酚不仅能抗氧化[2-6]、抗炎[7-10]、抗衰老[11-13],还具有降血糖[14-17]、降血脂[18-20]、抗阿尔茨海默症[21-23]、调节脂代谢等功能[24]。已知蒜皮含有反式对香豆酸、反式阿魏酸、愈创木基甘油-β-咖啡酸醚(guaiacylglycerol-β-caffeic acid ether,GCAE)、愈创木基甘油-β-阿魏酸醚(guaiacylglycerol-β-ferulic acid ether,GFAE)、N-反式对香豆酰真蛸胺(N-trans-coumaroyloctopamine,CO)、N-反式阿魏酰真蛸胺(N-trans-feruloyloctopamine,FO)[25]等多酚类化合物(结构式分别见图1-B~图1-G)。目前,除已报道的FO具有抗阿尔茨海默症、治疗非酒精性脂肪性肝炎、抑制黑色素生成等活性外[26-28],尚未见其他功能的相关研究,也未见其定量测定的报道。因此,为充分利用蒜皮或其所含多酚,亟需简便、快速、准确测定蒜皮多酚的方法。
本文拟以超声法提取蒜皮、固相萃取法处理提取液,建立快速、简便、准确定量测定蒜皮中的咖啡酸(图1-A)、GCAE、CO、对香豆酸、GFAE、阿魏酸6种酚类化合物的方法。
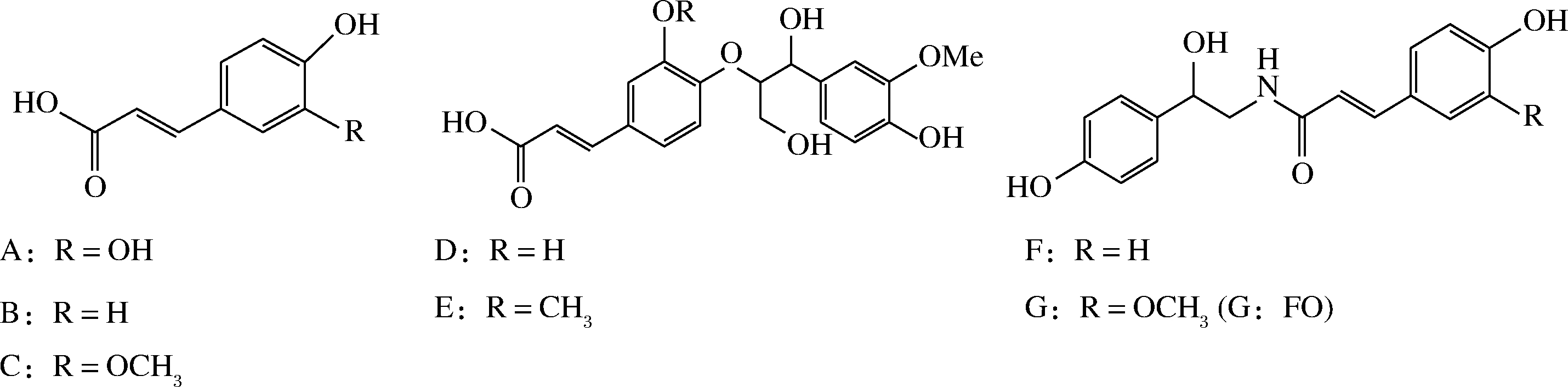
A-反式咖啡酸;B-反式对香豆酸、;C-反式阿魏酸;D-GFAE;E-GCAE;F-CO;G-FO
图1 反式咖啡酸、反式对香豆酸、反式阿魏酸、GFAE、GCAE、CO、FO的结构式
Fig.1 Structural formulas of trans-caffeic acid, trans-p-coumaric acid, trans-ferulic acid, GFAE, GCAE, CO, FO
1 材料与方法
1.1 材料与试剂
甲酸(色谱纯),天津市科密欧化学试剂有限公司;乙腈(色谱纯),RCI Labscan有限公司;甲醇(色谱纯),天津市彪仕奇科技发展有限公司;乙醇(分析纯),广东广式试剂有限公司;咖啡酸、阿魏酸、对香豆酸(色谱纯),上海阿拉丁生化科技股份有限公司;N-反式对香豆酰基去甲辛弗林(色谱纯),四川维克奇生物科技有限公司。
蒜皮(金乡大蒜外皮)粉末, 山东省金乡县大蒜研究所馈赠。
1.2 仪器与设备
LC-20A高效液相色谱仪(配SPD-M20A紫外检测器),岛津(广州)检测技术有限公司;ODS-H C18色谱柱(250 mm×4.6 mm,5 μm),中谱科技(福州)有限公司;Discovery DPA-6S(500 mg,6 mL) 固相萃取柱,北京康林科技有限公司;旋转蒸发器,上海申顺生物科技有限公司;AB SCIEX X500R QTOF高分辨质谱系统,美国SCIEX公司;超声波清洗器,宁波新艺超声设备有限公司。
1.3 试验方法
1.3.1 定性测定方法
采用高效液相色谱-高分辨率质谱联用(high-performance liquid chromatography-quadruple time of flight mass spectrometry,HPLC-QTOF MS)定性测定酚类物质的方法,即:在待优化的HPLC方法下,分离样品中各物质并获得相应的色谱峰,然后根据高分辨率质谱仪(high resolution mass spectrometer,HRMS)测定未知物质的分子质量,再对比标准品的相应信息对相关色谱峰物质定性;若无标准品则据生物代谢、参考文献[25]等信息进行定性。
质谱条件:负离子电离模式,电喷雾离子源,电喷雾气压力50 psi,气帘气压力30 psi,辅助加热气压力60 psi,离子源温度550 ℃。TOF-MS参数:扫描质量数m/z 50~5 000,离子化电压5 500 V,去簇电压(80±40) V,累积时间0.1 s。IDA 参数:触发二级碎裂扫描的离子强度阈值10 cps,动态背景扣除,质荷比误差范围50 MDa,最大候选离子数10。
1.3.2 HPLC梯度洗脱程序的优化
根据参考文献[29-30]和预实验结果,设计5种HPLC梯度洗脱程序(表1),根据所获样品HPLC图选择最佳梯度洗脱程序。
表1 HPLC系列梯度洗脱程序
Table 1 Different elution programs for HPLC
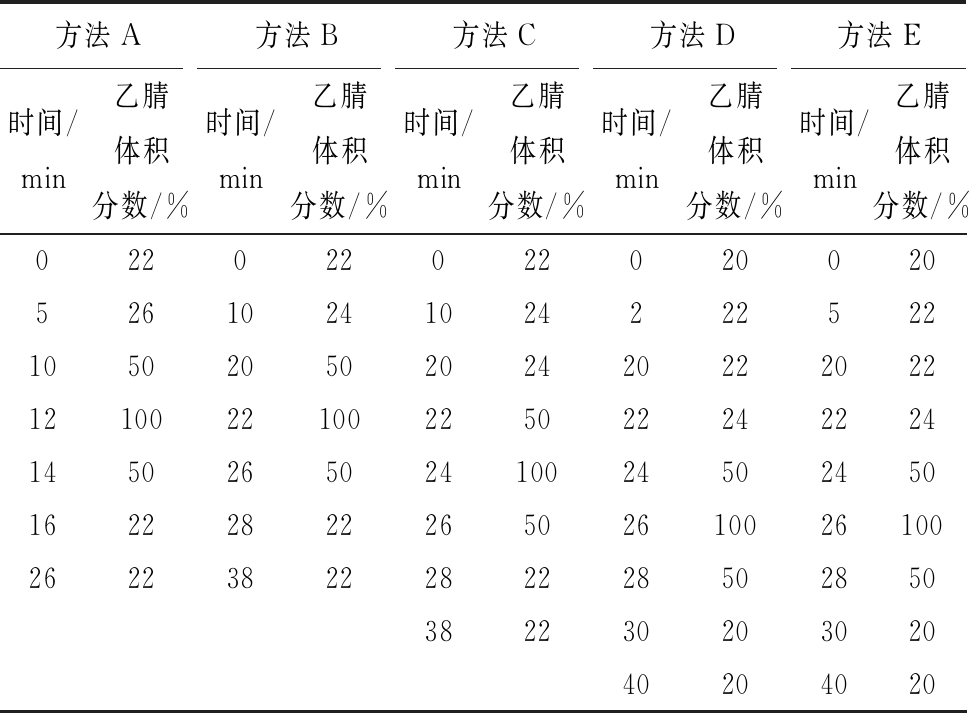
方法A方法B方法C方法D方法E时间/min乙腈体积分数/%时间/min乙腈体积分数/%时间/min乙腈体积分数/%时间/min乙腈体积分数/%时间/min乙腈体积分数/%0220220220200205261024102422252210502050202420222022121002210022502224222414502650241002450245016222822265026100261002622382228222850285038223020302040204020
其他HPLC条件:ODS-H C18色谱柱(250 mm×4.6 mm,5 μm);柱温:40 ℃;进样量:5.0 μL;流动相A:0.1%(体积分数)甲酸水溶液;流动相B:乙腈;流速:0.5 mL/min;紫外检测波长320 nm。
1.3.3 标准溶液的配制
(1) 单一标准储备液
分别称取上述已经定性确定的、可以购买到的咖啡酸、阿魏酸、对香豆酸、CO 4种标准品各10 mg,用甲醇溶解并分别定容于10 mL容量瓶中,配制成1 mg/mL 的单标溶液。
(2) 混合标准工作液
各取2 mL单标溶液于10 mL容量瓶中定容,配制成200 mg/L的混合标准母液,将此溶液连续稀释配成质量浓度分别为150、100、50、25、10、5、2.5、0.25、 0.025 mg/L的系列标准样品上样液。
1.3.4 标准曲线的绘制
为考察线性范围、检出限以及定量下限,在色谱条件下,将1.3.3(2)中的一系列不同浓度的混合标准溶液HPLC进样分析,以标准品峰面积为纵坐标,对应质量浓度(mg/L)为横坐标绘制标准曲线,得到4种标准品的回归方程和相关系数。
1.3.5 样品的提取
精密称取蒜皮干粉末20 g,加入100 mL 体积分数为80%的乙醇,于超声功率300 W、超声频率25 kHz、超声温度50 ℃下,提取30 min后,以10 000 r/min离心10 min,取上清液,重复提取过程3次,收集所得的上清液即为蒜皮提取液。
取4 mL浓缩后的蒜皮提取液经旋转蒸发仪蒸干后,用1 mL甲醇复溶,然后过0.45 μm有机微孔滤膜,在色谱条件下HPLC直接进样分析。
1.3.6 固相微萃取方法
(1) 活化
将固相萃取小柱(DPA-6S)柱依次用6 mL甲醇、6 mL的水预先活化。
(2) 萃取方法
取4 mL浓缩后的蒜皮提取液加入到固相萃取小柱中,缓慢压滤,控制流速为1.0 mL/min,待样品被完全吸附后,用6 mL水冲洗小柱以除去大部分干扰物质,弃去滤液后,用6 mL体积分数70%的甲醇将多酚类物质洗脱下来,收集甲醇滤液,经旋转蒸发仪蒸干后,用1 mL甲醇复溶,过0.45 μm有机微孔滤膜后,在色谱条件下HPLC进样检测。
1.3.7 加标回收率和精密度的测定
准确量取已知4种酚类化合物含量的蒜皮提取液0.5 mL,稀释至1.5 mL后,平均分为3等份,分别向每等份中加入2.5、5、10 mg/L 3个水平的混合标准品各0.5 mL,混匀后按照1.3.6进行处理,每个加标水平平行测定5次。
将所测得的峰面积代入1.3.4中4种标准品的回归方程,计算各多酚的质量分数,并由测得量与加入量计算4种酚类化合物的回收率。
1.3.8 样品中6种酚类物质的定量测定
(1) 咖啡酸、阿魏酸、对香豆酸、CO的定量
对有标品咖啡酸、阿魏酸、对香豆酸、CO 4种酚类物质,根据1.3.4所获标准曲线对其进行定量测定。
(2) GFAE、GCAE的定量
由于无法购买到GCAE、GFAE标准品,无法对其进行定量测定。但考虑到酚类物质在检测器下的紫外吸收是由其特征官能团苯环所决定的,且GCAE、GFAE的结构式中GCAE含有2个咖啡酸、GFAE中含有2个阿魏酸,意味着GCAE、GFAE的紫外最大摩尔吸光度应该分别是咖啡酸、阿魏酸的2倍,所以,可以以咖啡酸、阿魏酸作为参照,即咖啡酸、以阿魏酸2倍的校正因子和GCAE、GFAE的峰面积对其定量。
1.3.9 重复性的测定
将1.3.6下的样品在色谱条件下HPLC连续进样测定5次,测得的峰面积代入1.3.4所得4种标准品的线性回归方程,计算出4种酚类化合物的平均含量和相对标准偏差(relative standard deviatio,RSD)。
以咖啡酸、阿魏酸作为参照计算出无标品的GCAE、GFAE的平均含量和RSD。
1.4 数据统计与分析
蒜皮中各组分的HPLC色谱图以及多组色谱叠加图由岛津的Labsoluton软件处理生成,回收率、重复性、误差、工作曲线,以及相关表格的数据处理,均采用Excel-2016软件进行处理。
2 结果与分析
2.1 HPLC-HRMS对6种酚类物质的定性分析
HPLC-HRMS测定结果如表2所示。在保留时间为10.87 min总离子流(total ion chromatography,TIC)图中(图2-A),MS测定其分子质量为180.035 0 Da(图2-B),该质谱峰的数据库给出的唯一分子式为C9H8O4,综合考虑生物代谢(即生物代谢中代表该分子式的物质只有咖啡酸),推测该物质为咖啡酸。通过比较咖啡酸标品TIC图的保留时间和质谱数据(图2-C、图2-D),显示两者结果是一致的,即证实了图2-A中1为咖啡酸。这是首次在蒜皮中检测到了咖啡酸。
同样地,在保留时间分别为15.92、16.27、19.85 min 时(表2),MS测定其分子质量分别为299.108 0、 164.040 0、194.051 0 Da,该分子质量与参考文献[25]所述的CO、对香豆酸、阿魏酸的分子质量一致,通过比较CO、对香豆酸、阿魏酸标品TIC图的保留时间,其保留时间都是一致,证明图2-A中3、4、6分别为CO、对香豆酸、阿魏酸。
表2 六种酚类化合物HPLC-HRMS测定结果
Table 2 The determination results of six phenolic compounds by HPLC-HRMS
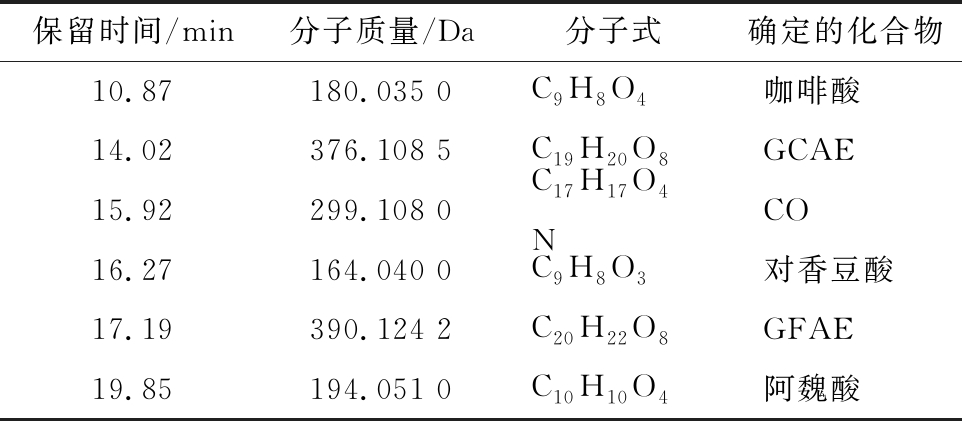
保留时间/min分子质量/Da分子式确定的化合物10.87180.035 0C9H8O4咖啡酸14.02376.108 5C19H20O8GCAE15.92299.108 0C17H17O4 NCO16.27164.040 0C9H8O3对香豆酸17.19390.124 2C20H22O8GFAE19.85194.051 0C10H10O4阿魏酸
保留时间分别为14.02、17.19 min时,其质谱峰显示的分子质量分别为376.108 5、390.124 2 Da,且所对应的分子式与参考文献[25]所述的GCAE、GFAE分子式一致,即图2-A中2为GCAE,5为GFAE。

A-样品;B-样品中咖啡酸;C-咖啡酸标准品TIC图;D-咖啡酸标准品MS图
图2 样品TIC图、样品中咖啡酸MS图、咖啡酸标准品TIC图以及咖啡酸标准品MS图
Fig.2 TIC graph of sample, MS graph of caffeic acid in the sample, TIC graph of caffeic acid standard, and MS graph of caffeic acid standard
综上定性确定了本文拟测定的咖啡酸、阿魏酸、对香豆酸、CO、GCAE、GFAE共6种酚类物质。
2.2 蒜皮中酚类物质的定量分析
2.2.1 测定条件的优化
(1)梯度洗脱程序的确定
如图3所示,通过降低乙腈浓度,同时调整中间时段的乙腈递增速率(表1,方法A~方法E),从而增大样品中对香豆酸(图3色谱峰4)、GFAE(图3色谱峰5)与杂质峰之间分离度,并逐步出现GFAE的完整峰形。方法E中,香豆酸与GFAE已完全分离,能够满足定量分析的要求,各目标组分峰形完整且在23 min内能完全出峰。但方法E并不能分离出FO[25];因此,若要测定FO,还必需重新改善方法。
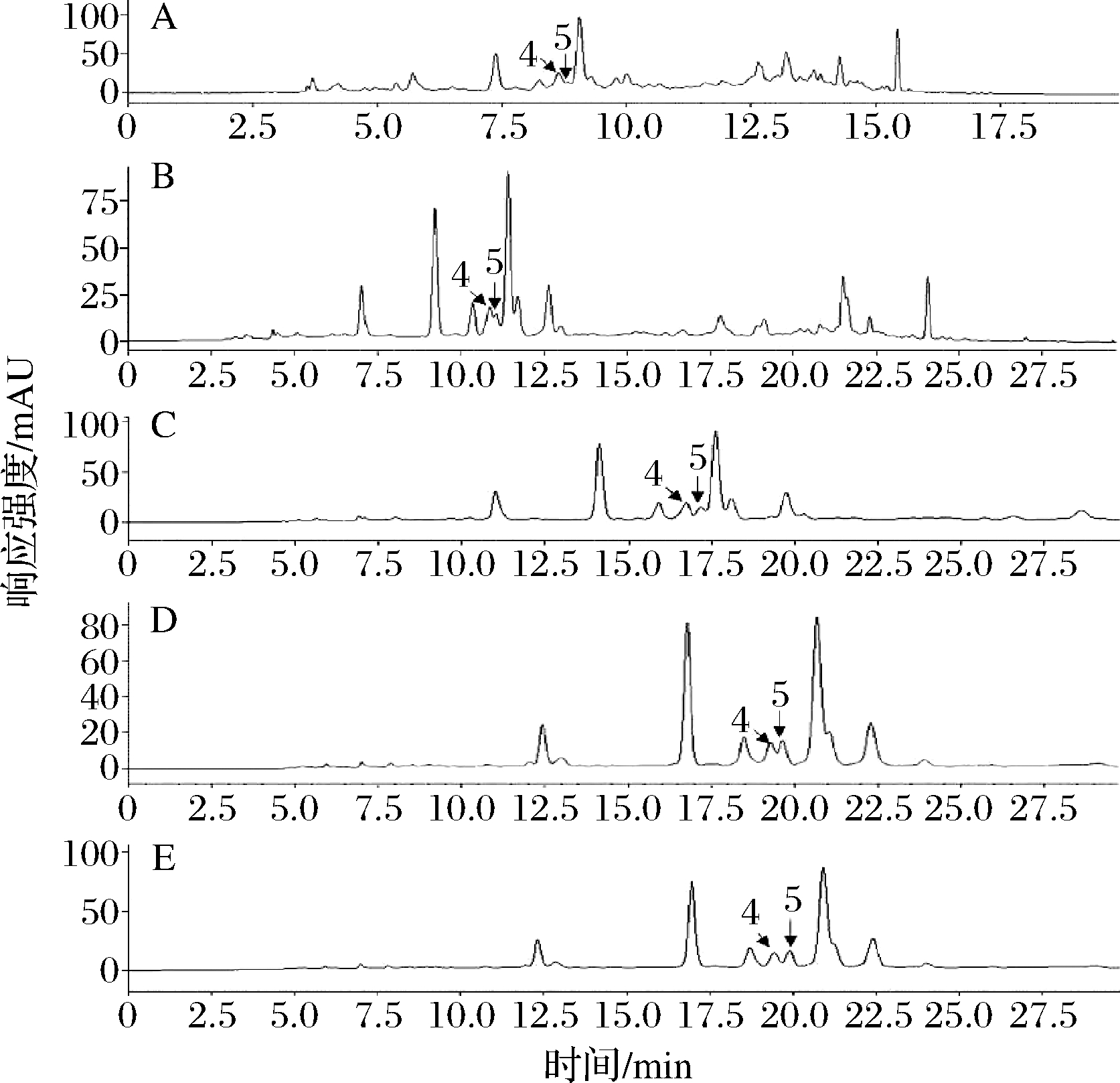
4-对香豆酸;5-GFAE; A-方法A;B-方法B; C-方法C;D-方法D;E-方法E
图3 在不同方法下样品的HPLC图
Fig.3 HPLC chromatograms of samples under different methods
(2)检测波长的确定
在200~400 nm得到4种酚类标准品的紫外吸收光谱图,如图4所示,CO(a)、对香豆酸(b)、咖啡酸(c)、阿魏酸(d)的最大吸收波长分别为294、309、324、321 nm。鉴于各种物质在320 nm左右区域均有吸收峰,且不受流动相中其他物质的干扰,因此,选择320 nm波长测定上述酚类物质。

a-CO;b-对香豆酸;c-咖啡酸;d-阿魏酸
图4 CO、对香豆酸、咖啡酸、阿魏酸的紫外吸收图谱
Fig.4 UV absorption spectra of CO, p-coumaric acid, caffeic acid and ferulic acid
2.2.2 标准曲线、线性范围和检出限测定结果
根据信噪比为3确定检出限(limit of detection,LOD)以及信噪比为10确定定量限(limit of quantitation,LOQ)。如表3所示,4种酚类化合物在相应范围内线性关系良好,相关系数均为0.999 9,检出限为0.33~0.66 mg/L,定量限为1.26~2.32 mg/L。
表3 四种酚类化合物的标准曲线、相关系数、线性范围、检出限和定量限
Table 3 Standard curve, correlation coefficient, linear range, detection limit and lower limit of quantification of four phenolic components
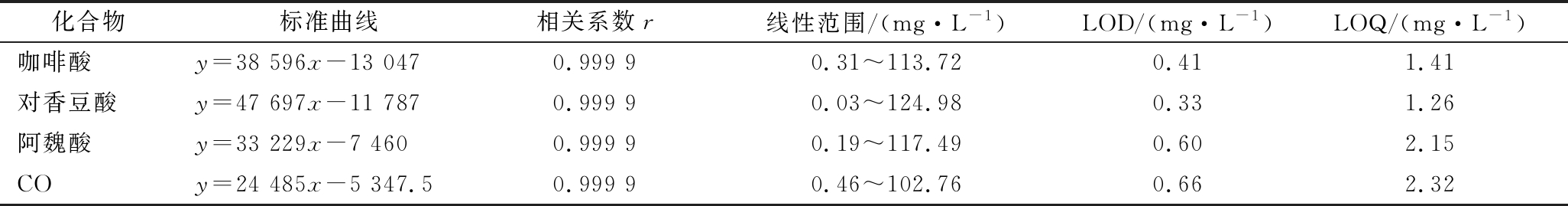
化合物标准曲线相关系数r线性范围/(mg·L-1)LOD/(mg·L-1)LOQ/(mg·L-1)咖啡酸y=38 596x-13 0470.999 90.31~113.720.411.41对香豆酸y=47 697x-11 7870.999 90.03~124.980.331.26阿魏酸y=33 229x-7 4600.999 90.19~117.490.602.15COy=24 485x-5 347.50.999 90.46~102.760.662.32
2.2.3 回收率和精密度测定结果
4种酚类化合物加标回收率为82.79%~100.58%, RSD均小于1%,表明该方法准确、可靠(表4)。
表4 加标回收率测定结果(n=5)
Table 4 Measured results of spike recovery rate (n=5)

化合物原有值/(mg·kg-1)加标量/(mg·kg-1)测定值/(mg·kg-1)平均回收率/%RSD/%咖啡酸1.511.252.582.602.592.632.5793.990.892.53.623.633.613.633.6690.520.5256.366.426.406.426.4398.400.43对香豆酸0.901.251.761.791.781.801.7782.790.892.52.942.912.902.922.9686.060.8255.505.565.525.525.5493.700.41阿魏酸2.771.253.703.733.713.733.7292.490.352.54.824.844.814.824.8091.420.3157.697.737.747.727.7399.380.25CO2.201.253.313.293.333.283.3297.230.632.54.444.504.514.464.4995.320.6557.207.277.287.227.24100.580.46
2.2.4 重复性实验
咖啡酸、对香豆酸、阿魏酸、CO、GCAE、GFAE含量测定的RSD分别为0.53%、0.28%、0.18%、0.31%、 0.03%、0.16%(n=5),6种酚类化合物的RSD均小于1%,表明此方法的重复性良好,具体结果如表5所示。
表5 六种酚类化合物含量的重复性测定结果
Table 5 Repeatability determination results of six phenolic compounds
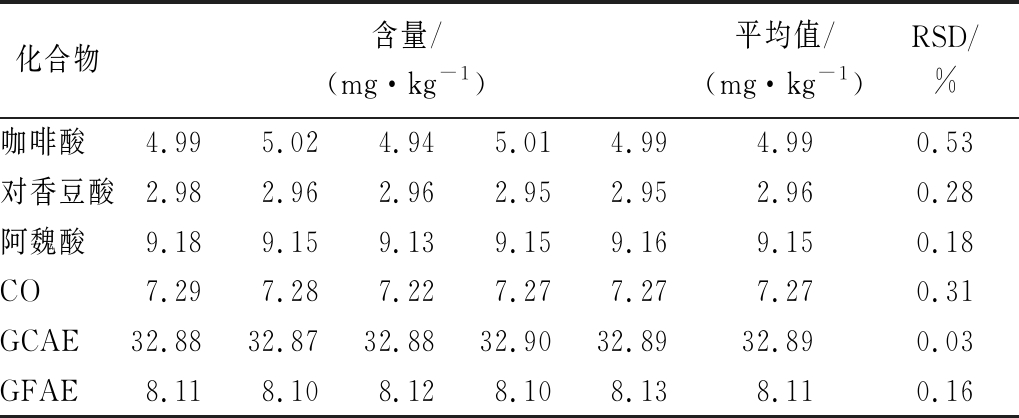
注:GCAE以咖啡酸计;GFAE以阿魏酸计(下同)
化合物含量/(mg·kg-1)平均值/(mg·kg-1)RSD/%咖啡酸4.995.024.945.014.994.990.53对香豆酸2.982.962.962.952.952.960.28阿魏酸9.189.159.139.159.169.150.18CO7.297.287.227.277.277.270.31GCAE32.8832.8732.8832.9032.8932.890.03GFAE8.118.108.128.108.138.110.16
2.3 样品的测定
2.3.1 固相微萃取对测定蒜皮多酚结果的影响
由图5可知,未经DPA-6S柱固相微萃取的样品色谱图(图5-A)中杂质峰很多,目标物与杂质峰不能很好地分离,且目标物含量低。而采用固相萃取柱前处理提取液(图5-B),以淋洗去杂、富集的方式除去了大部分干扰物,提高了目标组分的含量,从而对目标组分的定量更加准确。

1-咖啡酸;2-GCAE;3-CO;4-对香豆酸;5-GFAE;6-阿魏酸
A-未经前处理;B-固相萃取处理后
图5 未经前处理、固相萃取处理后样品的HPLC图
Fig.5 HPLC chromatograms of the sample without pretreatment and after pretreatment with solid phase extraction
2.3.2 样品测定结果
由表6可知,样品中6种酚类物质的含量大小顺序为:GCAE>阿魏酸>GFAE>CO>咖啡酸>对香豆酸。其中,GCAE的含量最高,达32.89 mg/kg,而对香豆酸的含量最低,达2.96 mg/kg,6种酚类物质总计为65.37 mg/kg。
表6 蒜皮中6种酚类化合物的含量
单位:mg/kg
Table 6 Contents of six phenolic compounds in garlic skin

化合物 含量咖啡酸4.99阿魏酸9.15对香豆酸2.96CO7.27GCAE32.89GFAE8.11总计65.37
3 结论
本研究采用HPLC-HRMS法首次确定了蒜皮中含有咖啡酸。通过超声法提取蒜皮中的酚类化合物,固相萃取法前处理蒜皮多酚提取液,同时采用梯度洗脱方法建立了高效液相色谱法定量检测蒜皮中的对香豆酸、咖啡酸、阿魏酸、CO,并以咖啡酸、阿魏酸作为参考估算蒜皮中GCAE、GFAE的含量。在此方法下,6种酚类化合物分离效果良好,方法的精密度、重复性、线性关系均满足定性定量要求,适用于蒜皮中6种酚类化合物的定量检测,为蒜皮多酚物质提取以及蒜皮在食品、饲料和药用等领域的应用等提供了有效的检测方法。
[1] 邹嘉琦. 大蒜价格与产业链利益主体行为影响关系研究—以山东省为例[D].泰安:山东农业大学, 2019.
ZOU J Q.Research on the relationship between garlic price and the behavior of subjects in the industrial chain—A case study of Shandong[D].Taian:Shandong Agricultural University, 2019.
[2] PERRON N R, BRUMAGHIM J L.A review of the antioxidant mechanisms of polyphenol compounds related to iron binding[J].Cell Biochemistry and Biophysics, 2009, 53(2):75-100.
[3] 孙悦, 左丽丽.植物多酚功能的研究进展[J].吉林医药学院学报, 2020, 41(5):386-388.
SUN Y, ZUO L L.Research progress of plant polyphenol function[J].Journal of Jilin Medical University, 2020, 41(5):386-388.
[4] 何强, 董静雯.果蔬中的多酚及其功能特性[J].西华大学学报(自然科学版), 2019, 38(4):37-44.
HE Q, DONG J W.Polyphenols in fruits and vegetables and its function[J].Journal of Xihua University (Natural Science Edition), 2019, 38(4):37-44.
[5] 郭爱伟, 刘莉莉, 杨亚晋, 等.植物多酚的生物活性及其在家禽生产中的应用[J].动物营养学报, 2019, 31(2):491-499.
GUO A W, LIU L L, YANG Y J, et al.Research progress on bioactivity of plant polyphenols and application in poultry production[J].Chinese Journal of Animal Nutrition, 2019, 31(2):491-499.
[6] 白晓琳, 樊梓鸾, 李璐, 等.多酚类化合物与其他活性物质协同作用研究进展[J].食品工业科技, 2019, 40(6):308-311.
BAI X L, FAN Z L, LI L, et al.Research progress on synergistic effect of polyphenols and other active substances[J].Science and Technology of Food Industry, 2019, 40(6):308-311.
[7] 阴海鹏. 多酚类化合物通过抑制NLRP3炎症小体发挥抗炎作用的研究[D].济南:山东大学, 2018.
YIN H P.Polyphenols prevents inflammation through inhibition of the NLRP3 inflammasome[D].Jinan:Shandong University, 2018.
[8] 邢静, 李玉玲, 张彧, 等.内毒素介导的炎症反应机制和多酚类化合物抗炎治疗的研究进展[J].中华危重症医学杂志(电子版), 2016, 9(4):283-288.
XING J, LI Y L, ZHANG Y, et al.Research progress on endotoxin-mediated inflammatory response mechanism and anti-inflammatory therapy with polyphenols[J].Chinese Journal of Critical Care Medicine (Electronic Edition), 2016, 9(4):283-288.
[9] ZHANG H, TSAO R.Dietary polyphenols, oxidative stress and antioxidant and anti-inflammatory effects[J].Current Opinion in Food Science, 2016, 8:33-42.
[10] KIM Y S, YOUNG M R, BOBE G, et al.Bioactive food components, inflammatory targets, and cancer prevention[J].Cancer Prevention Research (Philadelphia,Pa.), 2009, 2(3):200-208.
[11] 陈慧, YOSHINORI K, 扈洪波, 等.SIRT3多酚激活剂的筛选及其对UVB诱导HaCaT细胞衰老的修复作用[J].食品科学, 2021, 42(5):115-121.
CHEN H, KATAKURA Y, HU H B, et al.Anti-aging effects of SIRT3-inducing polyphenols on UVB-irradiated HaCaT cells[J].Food Science, 2021, 42(5):115-121.
[12] 王怀玲. 蓝莓多酚化合物抗衰老活性及作用机制研究[D].广州:华南理工大学, 2018.
WANG H L.Research on antiaging activity and mechanism of blueberry polyphenols[D].Guangzhou:South China University of Technology, 2018.
[13] 范红艳, 王艳春, 顾饶胜, 等.茶多酚抗衰老的研究进展[J].中国老年学杂志, 2011, 31(5):893-895.
FAN H Y, WANG Y C, GU R S, et al.Research progress of tea polyphenols on anti-aging[J].Chinese Journal of Gerontology, 2011, 31(5):893-895.
[14] 许飞, 陈林军, 聂志妍, 等.膳食营养素在2型糖尿病中降血糖作用及其机制的研究进展[J].生物学杂志, 2020, 37(3):96-101.
XU F, CHEN L J, NIE Z Y, et al.Recent advances on the hypoglycemic effect and mechanism of dietary nutrients in type 2 diabetes mellitus[J].Journal of Biology, 2020, 37(3):96-101.
[15] 黄修晴, 初众, 房一明, 等.植物多酚降血糖机制的研究进展[J].食品工业科技, 2020, 42(18):461-469.
HUANG X Q, CHU Z, FANG Y M, et al.Research progress on hypoglycemic mechanism of plant polyphenols[J].Science and Technology of Food Industry, 2020, 42(18):461-469.
[16] 朱晓丹, 江冰洁, 刘新元, 等.天然产物中黄酮、多酚及生物碱类化合物治疗2型糖尿病研究进展[J].中国现代中药, 2019, 21(11):1 592-1 598.
ZHU X D, JIANG B J, LIU X Y, et al.Mechanism and research progress of flavonoids, polyphenols and alkaloids in natural products for type 2 diabetes mellitus[J].Modern Chinese Medicine, 2019, 21(11):1 592-1 598.
[17] SINGH B, SINGH J P, KAUR A, et al.Phenolic composition and antioxidant potential of grain legume seeds:A review[J].Food Research International, 2017, 101:1-16.
[18] 吴建华, 吴志瑰, 裴建国, 等.多酚类化合物的研究进展[J].中国现代中药, 2015, 17(6):630-636.
WU J H, WU Z G, PEI J G, et al.Advances in studies on polyphenols[J].Modern Chinese Medicine, 2015, 17(6):630-636.
[19] 伊娟娟, 王振宇.天然降血脂产物的研究进展[J].中国林副特产, 2012(5):46-48.
YI J J, WANG Z Y.Advances in studies on the natural hypolipidemic products[J].Forest by-Product and Speciality in China, 2012(5):46-48.
[20] 陈会良, 顾有方.中草药化学成分与降血脂功能的研究进展[J].中国中医药科技, 2006, 13(4):287-288.
CHEN H L, GU Y F.Research progress on the chemical constituents of Chinese herbal medicines and the function of lowering blood lipids[J].Chinese Journal of Traditional Medical Science And Technology, 2006, 13(4):287-288.
[21] 王志鑫, 张伟, 檀建新.植物多酚提取物防治阿尔茨海默氏病研究进展[J].食品研究与开发, 2013, 34(9):118-122.
WANG Z X, ZHANG W, TAN J X.A review of the neuroprotective mechanisms of plant polyphenol extracts in Alzheimer′s disease[J].Food Research and Development, 2013, 34(9):118-122.
[22] 张玉森, 董瑞瑞, 杨倩, 等.阿尔兹海默病中线粒体损伤机制及多酚对其防治的研究进展[J].现代预防医学, 2017, 44(13):2 411-2 414.
ZHANG Y S, DONG R R, YANG Q, et al.Progress of study on mitochondrial damage mechanisms in Alzheimer′s disease and polyphenol prevention and treatment effects[J].Modern Preventive Medicine, 2017, 44(13):2 411-2 414.
[23] 唐广燕. 茶多酚与阿尔茨海默氏症的多靶点治疗[J].生命的化学, 2009, 29(3):395-397.
TANG G Y.Polyphenols in tea and the multitargeted therapy of Alzheimer′s disease[J].Chemistry of Life, 2009, 29(3):395-397.
[24] CHOU C H, LIU C W, YANG D J, et al.Amino acid, mineral, and polyphenolic profiles of black vinegar, and its lipid lowering and antioxidant effects in vivo[J].Food Chemistry, 2015, 168:63-69.
[25] ICHIKAWA M, RYU K, YOSHIDA J, et al.Identification of six phenylpropanoids from garlic skin as major antioxidants[J].Journal of Agricultural and Food Chemistry, 2003, 51(25):7 313-7 317.
[26] WU Y, WU Z R, CHEN P, LI Y, et al.Effect of the tyrosinase inhibitor (S)-N-trans-feruloyloctopamine from garlic skin on tyrosinase gene expression and melanine accumulation in melanoma cells[J].Bioorganic & Medicinal Chemistry Letters, 2015, 25(7):1 476-1 478.
[27] 武燕, 刘健, 吴争荣.大蒜皮中肉桂酰胺N-trans-feruloyloctopamine对老年痴呆大鼠模型的治疗作用[J].中国现代应用药学, 2015, 32(12):1 437-1 439.
WU Y, LIU J, WU Z R.Effect of N-trans-feruloyloctopamine from garlic skin on Alzheimer′s disease model rats[J].Chinese Journal of Modern Applied Pharmacy, 2015, 32(12):1 437-1 439.
[28] WU Z R, CHEN P, LI Y, et al.Two cinnamoyloctopamine antioxidants from garlic skin attenuates oxidative stress and liver pathology in rats with non-alcoholic steatohepatitis[J].Phytomedicine, 2015, 22(1):178-182.
[29] 姜莉, 姜晨曦, 王玉堂, 等.桑葚酒中多酚类化合物的高效液相色谱法测定[J].食品工业, 2014, 35(7):248-251.
JIANG L, JIANG C X, WANG Y T, et al.Determination of eleven polyphenolic compounds in mulberry wine by high performance liquid chromatography[J].The Food Industry, 2014, 35(7):248-251.
[30] 李永库, 李晓静, 欧小辉.固相萃取-高效液相色谱法同时测定葡萄酒中没食子酸等8种多酚类化合物[J].食品科学, 2008,29(4):283-286.
LI Y K, LI X J, OU X H.Simultaneous analysis of eight phenolic compounds in wines by SPE-HPLC-PAD[J].Food Science, 2008,29(4):283-286.