蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜物质。由于具有较高的营养、保健和药用价值,蜂蜜在经济文化社会快速发展的今天越来越受到人们的青睐。蜂蜜主要成分包括水分、葡萄糖、果糖,还含有少量的蛋白质、氨基酸、有机酸、类胡萝卜素、维生素、矿物质、芳香物质等[1],其中含有的黄酮类化合物、维生素C、过氧化氢酶等成分具有广泛的生物学活性[2-5]。由于蜜蜂品种、植物来源、地理位置、气候条件、成熟程度以及加工和贮藏条件的差异,蜂蜜可能表现出不同的稠度、颜色、风味和香气[6-7]。蜂蜜可由单一花种花蜜酿造而来,也可由多花种的混合花蜜酿造而来[8],植物来源不同的蜂蜜营养价值和保健功能也有差别[9]。由于具有特定的香味和口感,单花蜂蜜尤其受到消费者的青睐[10],但由于利益驱使,不法分子以劣质蜂蜜冒充优质花种蜂蜜、将劣质蜂蜜混入优质花种蜂蜜中或在蜂蜜中掺杂、掺假后高价出售,以次充好,扰乱蜂蜜市场损害消费者利益[11]。因此,从蜂蜜的植物来源角度评价蜂蜜的质量、鉴别蜂蜜的真实性具有重要意义。
近年来,多种方法被用于蜂蜜植物来源鉴别,包括不同花源蜂蜜蛋白质组分差异[12]、高效液相色谱法[13-15]、顶空固相微萃取-质谱联用法[16-17]、液相色谱-质谱联用法[1]、超高压液相色谱飞行时间质谱法[18]、实时荧光定量PCR法和红外光谱技术法等[19-20]。单花种蜂蜜芳香挥发性成分具有高度的特异性[21],这是对其进行风味分析的物质基础。因此,通过芳香挥发性物质的定性分析对于鉴别不同植物来源蜂蜜具有可行性。
气相离子迁移谱(gas chromatography-Ion mobility spectrometry, GC-IMS)融合了气相色谱和离子迁移谱二者的优势,具有分离性能好、响应速度快、灵敏度高等优势,其工作原理如图1所示。样品随载气进入仪器,按照红色虚线方向,首先经过气相色谱柱的初次分离,随后进入离子迁移管,待测分子在电离区电离后,在电场和逆向漂移气的作用下迁移实现2次分离,到达法拉第盘进行检测,无需任何特殊的样品前处理即可快速检测样品中的痕量挥发性有机化合物。基于挥发性有机化合物的痕量检测,GC-IMS已在疾病检测、环境保护和食品安全及风味分析等领域得到广泛关注和应用[22-27]。

图1 GC-IMS原理示意图
Fig.1 Schematic diagram of GC-IMS principle
重庆三峡库区独特的自然地理条件、良好的生态环境和丰富的植物资源利于中华蜜蜂(中蜂)的生存繁衍,饲养中蜂是当地山区农民延续千年的传统。基于多样的蜜源植物和覆盖全年的采蜜花期,重庆三峡库区也被称为“三峡蜜库”。近年来,重庆三峡库区中蜂产业在脱贫攻坚领域做出了重要贡献,随着规模的不断扩大,中蜂蜜的质量控制成为亟待解决的问题。不同植物来源的蜂蜜风味、口感、功效和价格均有差异,为防止以假乱真、以次充好,本研究采用GC-IMS技术对重庆三峡库区特色油菜花、柑橘花、五倍子花和枇杷花中蜂蜜的挥发性有机化合物进行测定,并结合主成分分析(principal component analysis, PCA)和线性判别(linear discriminante analysis, LDA)方法建立不同植物来源中蜂蜜的判别模型,为重庆长江三峡库区特色中蜂蜜质量控制提供新策略,助推蜜蜂产业在为全面脱贫建成小康社会做出重要贡献的基础上继续为促进实施乡村振兴战略发挥作用。
1 材料与方法
1.1 试验材料
油菜花中蜂蜜样品14个、五倍子花中蜂蜜样品9个、枇杷花中蜂蜜样品13个、柑橘花中蜂蜜样品11个、多花种6个、洋槐花5个、苕子花6个,以上样品采自重庆市万州区七和中蜂养殖合作社、重庆市万州区马槽寨农业专业合作社、重庆蜂谷美地生态养蜂有限公司及养蜂个体户,均能确保样品真实性。
1.2 仪器与设备
FlavourSpec 1H1-00053型GC-IMS,德国G.A.S 公司;CTC-PAL 自动进样装置,瑞士CTC Analytics AG公司;FS-SE-54-CB-1,15 m,ID,0.53 mm毛细管柱,美国Restek公司。
1.3 GC-IMS 检测条件
顶空进样条件:取2 g样品,置于20 mL顶空瓶中,60 ℃孵育15 min后进样400 μL,进样针温度65 ℃, 载气为高纯N2(纯度≥99.999%);气相色谱条件:色谱柱:FS-SE-54-CB-1,15 m,ID:0.53 mm;色谱柱温:60 ℃;运行时间:20 min;载气为高纯N2,载气流速为起始2 mL/min,2~20 min 线性上升至100 mL/min; 离子迁移谱条件:离子源为Tritium(6.5 keV), 正离子模式,漂移管长度为9.8 cm,漂移气流速为150 mL/min;漂移管温度为45 ℃;平均次数为12;电场强度:350 V/cm,网格脉冲宽度为100 μs, 触发延迟时间为100 ms,采样频率为150 kHz,重复率为30 ms。
1.4 数据处理
采用GC-IMS Library Search V2.2.1 分析软件(G.A.S Inc.)对样品中的挥发性成分进行定性分析。采用SIMCA-13.0对所测多维数据进行可视化分析处理,通过SPSS进行LDA并建立判别模型。GC-IMS 三维谱中每一个特征峰代表一种挥发性有机成分,以不同样品中特征峰的有无或强弱为依据,使用LAV 软件选择标记,并以该特征区域离子强度的最大值作为特征变量,进行数据分析。
2 结果与分析
2.1 GC-IMS谱图分析
从GC-IMS谱图中可实现对不同样品所含的挥发性物质组成进行直观比较和初步判断,尤其在图谱二维俯视图中,不同样品中的挥发性成分种类及浓度差异清晰可见,当以油菜花中蜂蜜样品(图2-a)为参照进行差异对比时,其他3组样品中对应的挥发性物质的浓度高低一目了然,红色越深,说明对应成分浓度比油菜花中蜂蜜样品中浓度高的越多;蓝色越深则低的越多。
由于原始图谱对应的矩阵数量较大(3 073×4 500), 为便于数据运算和增强可视化效果,在保留有效信息的基础上,截取保留时间和迁移时间分别在73.710~620.100 s和7.799~15.385 ms内的矩阵数据(1 400×1 000)用于分析。从油菜花中蜂蜜、五倍子花中蜂蜜、枇杷花中蜂蜜及柑橘花中蜂蜜样品的图谱中各选1个,如图2所示,从左到右样品依次为油菜花中蜂蜜、五倍子花中蜂蜜、枇杷花中蜂蜜和柑橘花中蜂蜜的GC-IMS三维彩色谱图,通过对比可以发现油菜花中蜂蜜和五倍子花中蜂蜜中的挥发性有机成分种类明显多于其他2种蜂蜜,枇杷花中蜂蜜最少。

a-油菜花中蜂蜜; b-五倍子花中蜂蜜; c-枇杷花中蜂蜜; d-柑橘花中蜂蜜
图2 GC-IMS 谱图
Fig.2 GC-IMS spectrum
依据差谱原则每种蜂蜜均选取同样的58个挥发性有机成分对应的特征峰进行排序对比[28-29],每种蜂蜜各取3个样品以示意,如图3所示,横轴为标记的特征成分对应的特征点,纵轴为样品编号。从图中可以看出,同一花种蜂蜜的不同样品因含有共有的挥发性有机成分在特征峰对比图库中表现出明显的相似性,不同花种蜂蜜则存在明显的差异。油菜花中蜂蜜在编号为1~12的特征成分浓度明显高于其他3种花种蜂蜜,编号为35~42的特征成分主要存在于五倍子花蜂蜜中,枇杷花中蜂蜜含量较高的成分编号为46、48~51,编号为52~55、57、58的特征成分更多地存在于柑橘花中蜂蜜中;另外,编号为13~20的特征成分同时存在于油菜花中蜂蜜和五倍子花中蜂蜜中,柑橘花中蜂蜜中编号21、22、24、26、27、29、34、47的特征成分明显低于其他3种花种蜂蜜,编号43~45 的成分是五倍子花中蜂蜜和枇杷花中蜂蜜区别另外2种蜂蜜的特征成分。对标记的特征峰通过GC-IMS Library Search软件检索,部分对应的挥发性成分化学信息如表1所示。
表1 部分特征峰对应的挥发性成分名称
Table 1 Volatile component names corresponding to some characteristic peaks
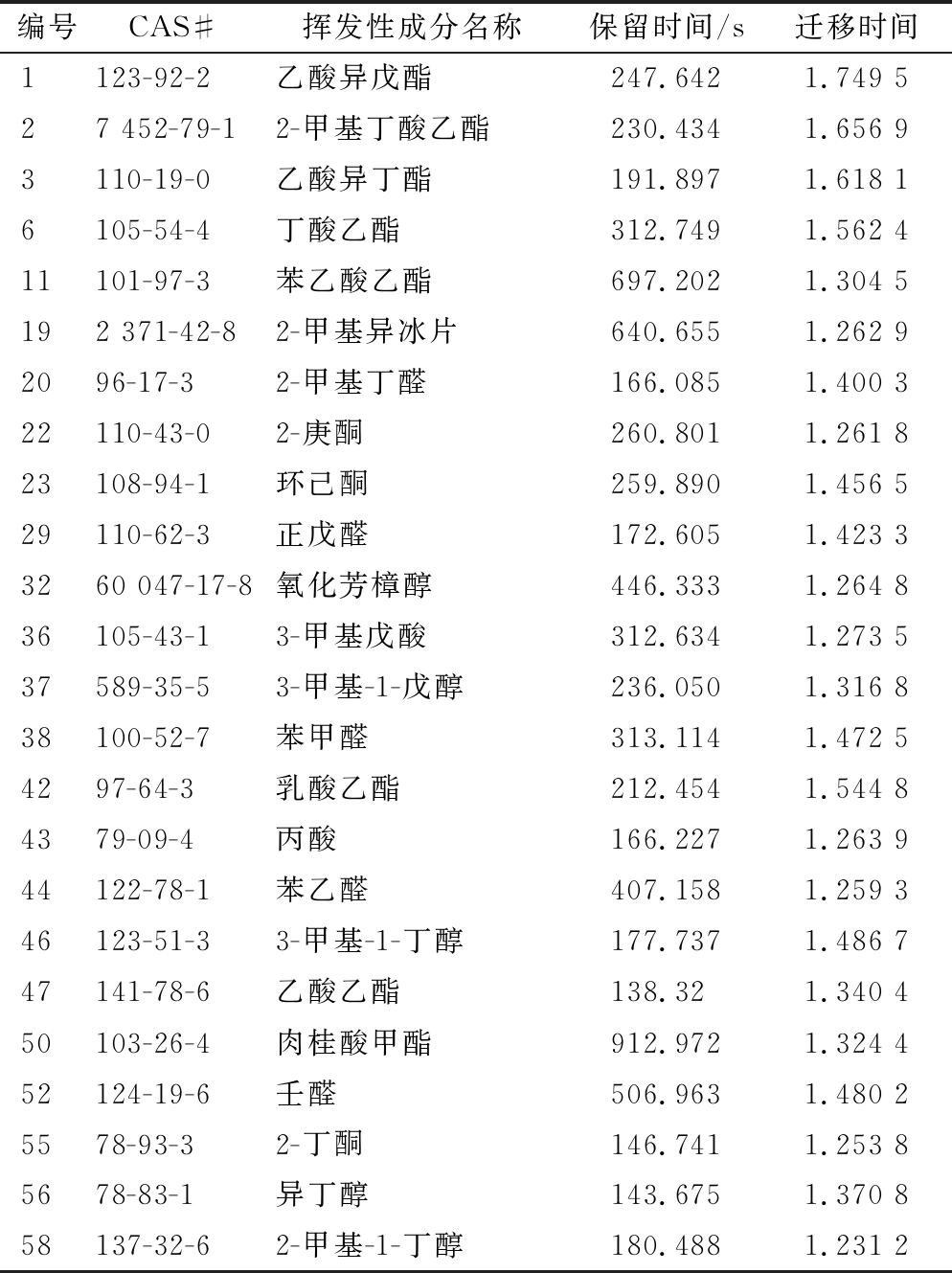
编号CAS#挥发性成分名称保留时间/s迁移时间1123-92-2乙酸异戊酯247.6421.749 527 452-79-12-甲基丁酸乙酯230.4341.656 93110-19-0乙酸异丁酯191.8971.618 16105-54-4丁酸乙酯312.7491.562 411101-97-3苯乙酸乙酯697.2021.304 5192 371-42-82-甲基异冰片640.6551.262 92096-17-32-甲基丁醛166.0851.400 3 22110-43-02-庚酮260.8011.261 823108-94-1环己酮259.8901.456 529110-62-3正戊醛172.6051.423 33260 047-17-8氧化芳樟醇446.3331.264 836105-43-13-甲基戊酸312.6341.273 537589-35-53-甲基-1-戊醇236.0501.316 838100-52-7苯甲醛313.1141.472 54297-64-3乳酸乙酯212.4541.544 84379-09-4丙酸166.2271.263 944122-78-1苯乙醛407.1581.259 346123-51-33-甲基-1-丁醇177.7371.486 747141-78-6乙酸乙酯138.321.340 450103-26-4肉桂酸甲酯912.9721.324 452124-19-6壬醛506.9631.480 25578-93-32-丁酮146.7411.253 85678-83-1异丁醇143.6751.370 858137-32-62-甲基-1-丁醇180.4881.231 2
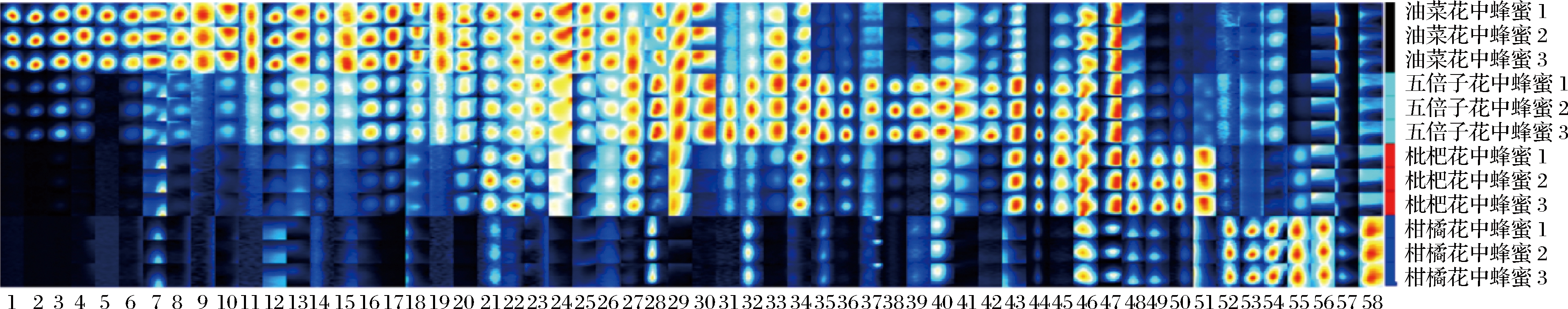
图3 不同花种蜂蜜的挥发性有机成分对应的特征峰对比库
Fig.3 Gallery of different kinds of honey with different characteristic peaks
2.2 PCA
PCA是一种有效的多维数据降维分析方法,利用PCA可将原始特征变量线性变换为低维新特征变量,保留了原有特征的主要信息,有利于数据的直观分析[30]。本研究中特征变量为所选取的58种挥发性成分表现出的特征峰强度,与47个样品组成47×58的矩阵,运用SIMCA-13.0对其进行主成分分析,前3个主成分累计贡献率为81.35%。如图4-a所示为PCA分析的二维得分图,4个不同植物来源的中蜂蜜分别处于不同的区域,无重叠,说明不同花种中蜂蜜的特征挥发性成分非常明显,以此为依据能够较好地将4种中蜂蜜分开。
载荷图反映的是所选取的58个特征性挥发性成分与不同蜂蜜样品在得分图中位置的对应情况,位置越近表明该种特征成分在相应蜂蜜中的含量越高,相反,位置越远含量越低。结合PCA得分图中4种中蜂蜜的象限位置从载荷图(图4-b)可以看出,油菜花中蜂蜜和五倍子花中蜂蜜特征性挥发成分相对较多,而枇杷花中蜂蜜和柑橘花中蜂蜜相对较少,比如编号为52~55、57和58的挥发性成分属于柑橘花中蜂蜜的特征成分,编号为46、48~51的挥发性成分属于枇杷花中蜂蜜的特征成分;另外,从图4中还可以看出,在油菜花中蜂蜜和五倍子花中蜂蜜交叉位置分布有较多挥发性成分,表明这些成分是2种蜂蜜区别于枇杷花中蜂蜜和柑橘花中蜂蜜的共有特征成分。此分析结果与图3中表示的各蜂蜜的特征成分一致。
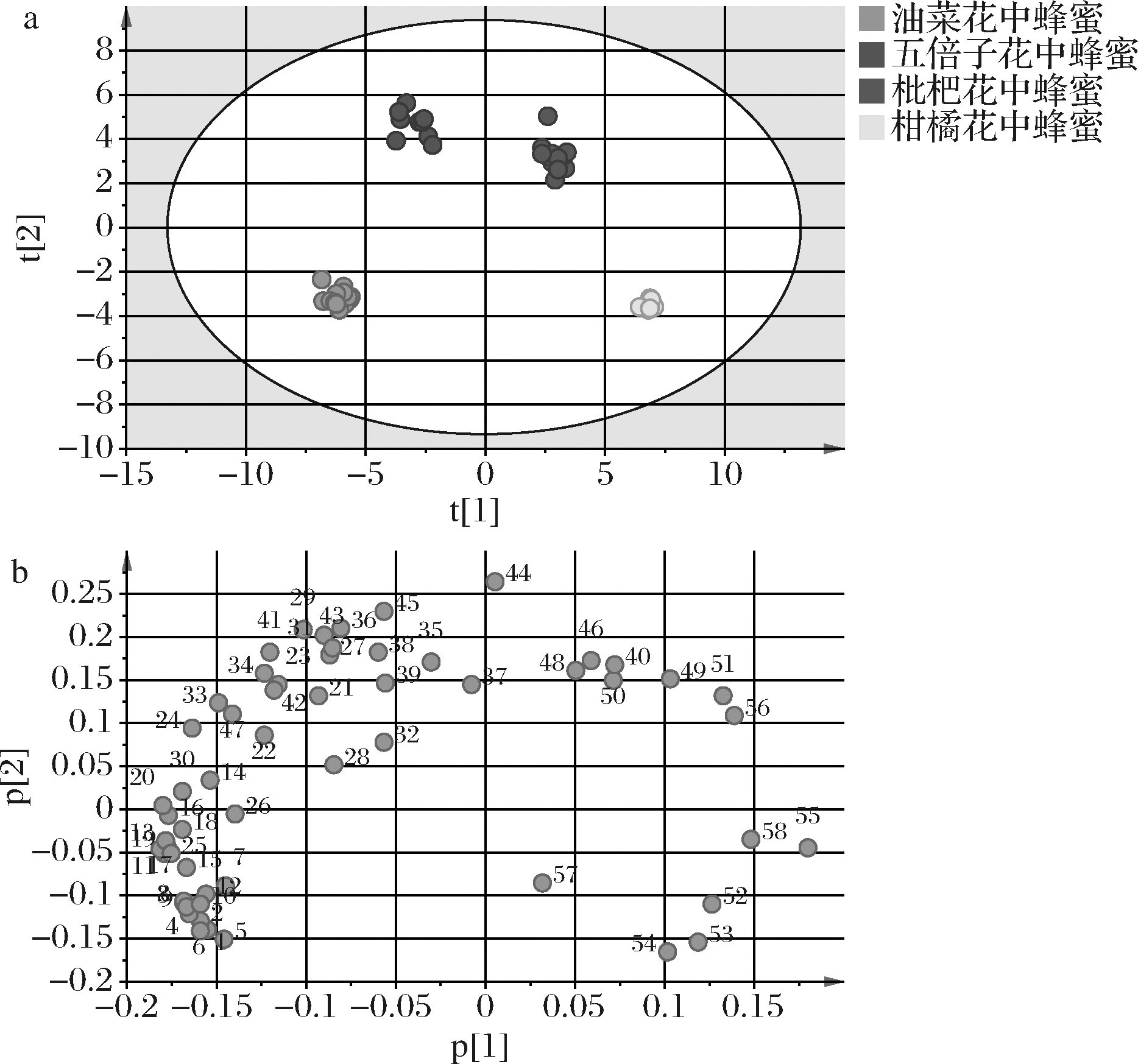
a-主成分得分图;b-载荷图
图4 主成分得分图和载荷图
Fig.4 Principal component scores plot and loads plot
2.3 不同植物来源蜂蜜的判别
将原始数据经PCA后的前3个主成分进行LDA分析,进一步研究区分预测重庆三峡库区4种不同植物来源中蜂蜜的可能性,建立对应植物来源中蜂蜜的判别模型。以前3个主成分为坐标轴对经过PCA降维后的数据进行线性分析,函数系数选用Fisher′s,由于样品数量较少,本研究通过“留一分类”的方式进行判别验证,这种方式是每次只使用一个样品数据作为测试集,剩下的全部作为训练集,所有的样品数据均作为测试集判别1次,例如油菜花中蜂蜜共14个样品,分别将每个样品作为测试集,其余13个作为训练集,共验证14次,其他种类蜂蜜样品同样判别验证。判别分类结果如表2所示,4种不同花种中蜂蜜鉴别正确率为100%,由此可见前3个主成分能够代表大部分蜂蜜的种类信息,采用LDA建模分析方法可以较好地将重庆三峡库区油菜花中蜂蜜、五倍子花中蜂蜜、枇杷花中蜂蜜和柑橘花中蜂蜜分类。
表2 LDA判别验证结果
Table 2 The results of LDA discriminant verification
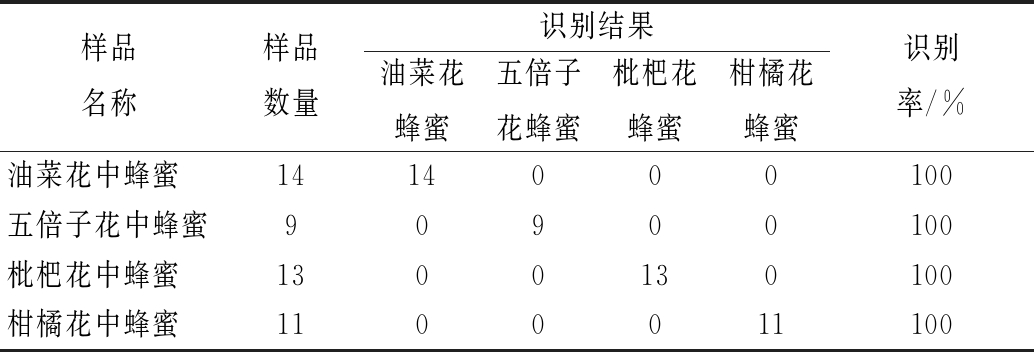
样品名称样品数量识别结果油菜花蜂蜜五倍子花蜂蜜枇杷花蜂蜜柑橘花蜂蜜识别率/%油菜花中蜂蜜1414000100五倍子花中蜂蜜90900100枇杷花中蜂蜜1300130100柑橘花中蜂蜜1100011100
为进一步验证LDA建模判别的准确性,收集来自重庆三峡库区的17个其他植物来源中蜂蜜样品用于模型判别,其中包括多花种6个、洋槐花5个、苕子花6个。验证结果如表3所示,误判率仅为5.9%,其中多花种蜂蜜有一个样品判别错误。通过溯源得知,此多花种蜂蜜被误判的样品取蜜时间为4月中旬,此时油菜花期刚过去不久,蜂蜜中存在较大比例的油菜花中蜂蜜。
表3 其他植物来源中蜂蜜判别结果
Table 3 The results of other plant sources honey of honey Apis cerana discriminant verification

样品名称样品数量识别结果油菜花中蜂蜜五倍子花中蜂蜜枇杷花中蜂蜜柑橘花中蜂蜜误判率/%多花种中蜂蜜61000洋槐花中蜂蜜500005.9苕子花中蜂蜜60000
3 结论
本研究运用气相离子迁移谱技术对重庆三峡库区4种不同植物来源的特色中蜂蜂蜜(油菜花中蜂蜜、五倍子花中蜂蜜、枇杷花中蜂蜜和柑橘花中蜂蜜)进行测定和分析,依据58种不同植物来源中蜂蜜挥发性有机物质的GC-IMS图谱,对不同蜜源蜂蜜进行鉴别和分类。运用PCA和LDA方法建立了重庆三峡库区4种不同植物来源中蜂蜜的判别模型。结果表明,本研究建立的判别模型对重庆三峡库区4种特色中蜂蜜的准确判别率为100%,对其他植物来源的17种中蜂蜜的误判率仅为5.9%。建立不同植物来源蜂蜜的判别方法对于蜂蜜质量控制具有重要意义,本研究表明运用GC-IMS技术结合化学计量学的LDA方法建模判别方法是可行的,与传统方法相比不需要复杂的样品前处理过程,操作简单,成本低,为中蜂蜜品种鉴别和质量控制提供了新的技术参考。
[1] TETTE P A S, GUIDI L R, BASTOS E M A F, et al.Synephrine - A potential biomarker for orange honey authenticity[J].Food Chemistry, 2017, 229:527-533.
[2] ALQARNI A S, OWAYSS A A, MAHMOUD A A, et al.Mineral content and physical properties of local and imported honeys in Saudi Arabia[J].Journal of Saudi Chemical Society, 2014, 18(5):618-625.
[3] BLASCO C, VAZQUEZ-ROIG P, ONGHENA M, et al.Analysis of insecticides in honey by liquid chromatography-ion trap-mass spectrometry:comparison of different extraction procedures[J].Journal of Chromatography A, 2011, 1218(30):4 892-4 901.
[4] SILVA L R, LIMA S M P, VASCONCELOS N A E L M.Cultural diversity- dialogue between interdisciplinary indigenous peoples and non indigenous - an experiment in initial teacher training[J].Revista Ambivalências, 2016, 4(7):309-323.
[5] FINOLA M S, LASAGNO M C, MARIOLI J M.Microbiological and chemical characterization of honeys from central Argentina[J].Food Chemistry, 2007, 99(4):1 649-1 653.
[6] DOWNEY G, HUSSEY K, KELLY J D, et al.Preliminary contribution to the characterisation of artisanal honey produced on the island of Ireland by palynological and physico-chemical data[J].Food Chemistry, 2005, 91(2):347-354.
[7] KOMATSU S S, MARCHINI L C, DE C C MORETIA A C.Análises físico-químicas de amostras de méis de flores silvestres, de eucalipto e de laranjeira, produzidos por Apis mellifera L., 1758 (Hymenoptera, Apidae) no estado de são paulo.2.conteúdo de açúcares e de proteína[J].Ciência E Tecnologia De Alimentos, 2002, 22(2):143-146.
[8] BASTOS D H M, FRANCO M R B, SILVA M A A P D, et al.Volatile composition and aroma and flavor profiles of eucalyptus and orange honeys[J].Food Technol, 2002, 22(2):122-129.
[9] 曹炜, 卢珂, 陈卫军, 等.不同种类蜂蜜抗氧化活性的研究[J].食品科学, 2005, 26(8):352-356.
CAO W, LU K, CHEN W J, et al.Study on antioxidation effects of different honeys[J].Food Science, 2005, 26(8):223-227.
[10] FALLICO B, ZAPPAL M, ARENA E, et al.Effects of conditioning on HMF content in unifloral honeys[J].Food Chemistry, 2004, 85(2):305-313.
M, ARENA E, et al.Effects of conditioning on HMF content in unifloral honeys[J].Food Chemistry, 2004, 85(2):305-313.
[11] 杨娟. 基于多种光谱技术的蜂蜜和蜂胶品种鉴别研究[D].北京:中国农业科学院,2016.
YANG J.Identification of honey and Propolis varieties based on various spectral techniques[D].Beijing:Chinese Academy of Agricultural Sciences, 2016.
[12] 张颖, 张光艳, 王宇翔, 等.不同花源蜂蜜蛋白质组分及提取方法的比较[J].食品与发酵工业, 2019, 45(14):91-96.
ZHANG Y, ZHANG G Y, WANG Y X, et al.Comparison of protein composition and extraction methods between honey from different floral origins[J].Food and Fermentation Industries, 2019, 45(14):91-96.
[13] 程妮. 蜂蜜植物源鉴别新方法及其保肝活性研究[D].西安:西北大学, 2015.
CHENG N.The novel method for identification of the botanic origin of honey and its hepatoprotection[D].Xi′an:Northwest University, 2015.
[14] CAVAZZA A, CORRADINI C, MUSCI M, et al.High-performance liquid chromatographic phenolic compound fingerprint for authenticity assessment of honey[J].Journal of the Science of Food and Agriculture, 2013, 93(5):1 169-1 175.
[15] 贺琼, 何亮亮, 康予馨, 等.高效液相色谱-电化学检测指纹图谱鉴别3种单花种蜂蜜花源[J].食品科学, 2017, 38(2):290-295.
HE Q, HE L L, KANG Y X, et al.Authentication of three monofloral honeys by high performance liquid chromatography with electrochemical detection[J].Food Science, 2017, 38(2):290-295.
[16] KARABAGIAS I K, BADEKA A, KONTAKOS S, et al.Characterization and classification of Thymus capitatus (L.) honey according to geographical origin based on volatile compounds, physicochemical parameters and chemometrics[J].Food Research International, 2014, 55:363-372.
[17] ROBOTTI E, CAMPO E, RIVIELLO M, et al.Optimization of the extraction of the volatile fraction from honey samples by SPME-GC-MS, experimental design, and multivariate target functions[J].Journal of Chemistry, 2017:1-14.
[18] ![]() S A, FREW R D, et al.Discrimination of honey of different floral origins by a combination of various chemical parameters[J].Food Chemistry, 2015, 189:52-59.
S A, FREW R D, et al.Discrimination of honey of different floral origins by a combination of various chemical parameters[J].Food Chemistry, 2015, 189:52-59.
[19] 孙涛, 夏明星, 孔德英, 等.五倍子蜂蜜TaqMan探针实时荧光定量PCR检测方法的建立[J].贵州农业科学, 2016, 44(8):15-18.
SUN T, XIA M X, KONG D Y, et al.Establishment of a TaqMan real-time PCR assay for detecting the Chinese gall honey[J].Guizhou Agricultural Sciences, 2016, 44(8):15-18.
[20] GOK S, SEVERCAN M, GOORMAGHTIGH E, et al.Differentiation of Anatolian honey samples from different botanical origins by ATR-FTIR spectroscopy using multivariate analysis[J].Food Chemistry, 2015, 170:234-240.
[21] GERHARDT N, BIRKENMEIER M, SCHWOLOW S, et al.Volatile-compound fingerprinting by headspace-gas-chromatography ion-mobility spectrometry (HS-GC-IMS) as a benchtop alternative to 1H NMR profiling for assessment of the authenticity of honey[J].Analytical Chemistry, 2018, 90(3):1 777-1 785.
[22] HERN NDEZ-MESA M, ESCOURROU A, MONTEAU F, et al.Current applications and perspectives of ion mobility spectrometry to answer chemical food safety issues[J].TrAC Trends in Analytical Chemistry, 2017, 94:39-53.
NDEZ-MESA M, ESCOURROU A, MONTEAU F, et al.Current applications and perspectives of ion mobility spectrometry to answer chemical food safety issues[J].TrAC Trends in Analytical Chemistry, 2017, 94:39-53.
[23] VAUTZ W, FRANZKE J, ZAMPOLLI S, et al.On the potential of ion mobility spectrometry coupled to GC pre-separation-A tutorial[J].Analytica Chimica Acta, 2018, 1 024:52-64.
[24] KARPAS Z.Applications of ion mobility spectrometry (IMS) in the field of foodomics[J].Food Research International, 2013, 54(1):1 146-1 151.
[25] 王卫国, 梁茜茜, 程沙沙, 等.离子迁移谱检测痕量爆炸物新技术和应用[J].科学通报, 2014, 59(12):1 079-1 086.
WANG W G, LIANG X X, CHENG S S, et al.Development of ion mobility spectrometry and its application for detection trace explosives[J].Chinese Science Bulletin, 2014, 59(12):1 079-1 086.
[26] VAUTZ W, SLODZYNSKI R, HARIHARAN C, et al.Detection of metabolites of trapped humans using ion mobility spectrometry coupled with gas chromatography[J].Analytical Chemistry, 2013, 85(4):2 135-2 142.
[27] 冯雪, 尹利辉, 金少鸿, 等.离子迁移谱及其在药学领域的应用[J].药物分析杂志, 2013, 33(7):1 109-1 114.
FENG X, YIN L H, JIN S H, et al.Ion mobility spectrometry and its applications in pharmaceutical research and development[J].Chinese Journal of Pharmaceutical Analysis, 2013, 33(7):1 109-1 114.
[28] HOLLINGSWORTH B V, REICHENBACH S E, TAO Q, et al.Comparative visualization for comprehensive two-dimensional gas chromatography[J].Journal of Chromatography A, 2006, 1 105(1-2):51-58.
[29] CAVANNA D, ZANARDI S, DALL′ASTA C, et al.Ion mobility spectrometry coupled to gas chromatography:A rapid tool to assess eggs freshness[J].Food Chemistry, 2018, 271:691-696.
[30] 苏学素, 张晓焱, 焦必宁, 等.基于近红外光谱的脐橙产地溯源研究[J].农业工程学报, 2012, 28(15):240-245.
SU X S, ZHANG X Y, JIAO B N, et al.Determination of geographical origin of navel orange by near infrared spectroscopy[J].Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(15):240-245.