乳制品包括液态乳、乳粉、干酪等许多种类,兼具营养价值和生理功能,是人类饮食的重要组成部分[1]。乳制品不但可以为人体供给营养和能量,还能促进儿童及青少年骨骼的生长发育[2]。此外,由于其可能会引起过敏反应,牛乳已经被联合国粮食及农业组织和世界卫生组织定为八大食品过敏原之一[3]。蛋白质是乳制品中的重要成分,牛乳中蛋白质含量约为3.0%~3.7%,其中酪蛋白约占牛乳总蛋白的80%[4],其表型包括αS1-酪蛋白(αS1-casein,αS1-CN)、αS2-酪蛋白(αS2-casein,αS2-CN)、β-酪蛋白(β-casein,β-CN)和κ-酪蛋白(κ-casein,κ-CN),其中β-CN中被关注较多的是A1 β-CN和A2 β-CN[5-7]。乳清蛋白约占牛乳总蛋白的20%,具有独特的生化特性和营养功能,含有10%~20%的α-乳白蛋白(α-Lactalbumin, α-La)和40%~50%的β-乳球蛋白(β-Lactoglobulin, β-Lg),除此之外,还含有乳铁蛋白和免疫球蛋白[8-10]等。蛋白质的种类和含量直接影响乳制品的品质和营养价值,因此对乳蛋白组分进行更加细化的检测分析尤为重要。目前已报道的乳蛋白检测方法有电泳法、酶联免疫法(enzyme-linked immunosorbent assay, ELISA)、高效液相色谱法(high performance liquid chromatography, HPLC)、液相色谱-质谱联用法(liquid chromatography-mass spectrometry, LC-MS)等,本文对各类方法进行总结,旨在为相关检测方法的研发与应用提供参考。
1 电泳法
电泳是在不同粒子所带电荷不同或电荷相同但荷质比不同的情况下,在同一电场中,随着时间的推移位移不相同来进行分离的方法。电泳法快速简便,在诸多方法中,聚丙烯酰胺凝胶电泳在蛋白质分析中应用十分广泛,包括非变性聚丙烯酰胺凝胶电泳(native-polyacrylamide gel electrophoresis, native-PAGE)和变性聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis, SDS-PAGE)。二者都是通过对染色后的蛋白质进行扫描来实现定量,native-PAGE的分离效果受蛋白质的分子质量、形状和带电荷情况影响较大[11];SDS-PAGE添加了SDS和巯基乙醇变性剂且需要加热,其分离效果主要受蛋白质的分子质量影响[12]。PESIC等[13]利用native-PAGE对绵羊乳和山羊乳中的牛β-Lg和α-La进行分析,通过2种羊乳中牛β-Lg和α-La的谱带强度与牛乳在其中掺加量的线性关系,能够快速测定羊乳中牛乳清蛋白的含量。韩奕奕等[14]等通过一系列SDS-PAGE实验确定了乳制品中β-Lg测定的电泳条件,可对乳制品中β-Lg 的含量进行快速测定。虽然这2种方法被广泛用于蛋白质的研究,但由于其着色剂和脱色剂需要现配现用导致方法的重现性难以保证。通过对PAGE条件的不断改良,使用尿素-PAGE可在不进行更复杂的表型鉴定的情况下鉴别牛乳中的A1 β-CN和A2 β-CN[15]。
毛细管区带电泳(capillary zone electrophoresis, CZE)简化了添加缓冲液的操作,缩短了样品分析时间,可在与生理条件相近的情况下对乳蛋白组分进行分离,避免蛋白质在分析过程中发生降解[16]。利用CZE可对液态乳和乳粉中的酪蛋白进行分离并对α-CN、 β-CN、κ-CN进行定量,还可以通过对β-CN的A1和A2表型的定量检测,得到优质蛋白在总酪蛋白中的占比从而对乳制品质量进行评价[17-18]。与PAGE相比,CZE具有更高的灵敏度,自动化程度高,所需样品量少,可以分离不带电荷或带相反电荷的蛋白质,但电渗现象受被测物质组成影响较大,重现性差。
除此之外,等电聚焦(isoelectric focusing, IEF)是在PAGE的基础上通过调整pH梯度实现对目标蛋白质的分离检测。在不需要通过酸或酶促沉淀来消除乳清蛋白的情况下,使用IEF技术可鉴别散装和单个牛乳样品是否为A2 β-CN乳,简化了检测牛乳中β-CN不同表型相对比例的步骤[19]。将IEF凝胶图像分析与生物分析仪定量技术相结合可以更加全面地对乳制品中的蛋白质组分进行鉴别,并进一步对蛋白的多态性进行探究,明确其蛋白表型(αS1-CN, αS2-CN, β-CN, κ-CN, β-Lg, α-La)并量化分析[20]。
电泳技术也在向着高通量和高重复性发展,将IEF和SDS-PAGE结合产生的双向凝胶电泳(two-dimensional electrophoresis, 2-DE)可通过等电点和分子质量对蛋白质进行分离,获得更加全面、分辨率更高的谱图[21],目前在差异蛋白质检测中应用十分广泛。在不断的实践中对于实验样本的多样性和2-DE技术的操作复杂性问题,有针对性地进行改良和优化将为电泳技术的进一步发展和应用提供更大的空间。
2 酶联免疫法
ELISA是使与酶连接的抗原或抗体与目标抗体或抗原产生反应,再根据显色程度进行定性、定量的方法,具有高灵敏性、高特异性、高通量等优点[22],可用于检测样品中含量较低的目标蛋白,在临床化学、药理学和生物标志物分析等方面应用广泛,常见分类有间接ELISA、直接ELISA、竞争ELISA[23]。间接ELISA可使用单克隆抗体对不同品种乳制品中特定乳蛋白进行特异性检测,在此基础上与聚合酶链式反应相结合可对羊乳中掺杂1%以上的牛乳进行特异性分析,且与羊乳无交叉反应[24]。李媛媛等[25]使用间接竞争ELISA,把兔抗αS-CN多克隆抗体作为一抗,标记辣根过氧化物的羊抗兔免疫球蛋白作为二抗,以此放大一抗信号,增加灵敏度,成功实现了牛乳中的αS-CN的检测。与间接竞争法相比,双抗体夹心法对目标蛋白质的检测灵敏度更高,识别靶向蛋白的抗体群的性质与不同ELISA方法的特殊性影响样品中乳蛋白的测定[26]。ELISA方法设备成本低、检测速度快、易于使用、便于样本批量处理,目前多数应用于乳制品中过敏原蛋白的检测。
传统免疫分析与电化学分析相结合形成的电化学免疫法更加快速、灵敏,仅需要适当的缓冲液稀释即可进行测定。例如,测定β-Lg含量的三明治结构的磁免疫传感器[27],将β-Lg共价固定在活化的磁珠上,磁珠被羧基修饰,用辣根过氧化物标记β-Lg作为抗原,将抗体放置在一次性丝网印刷碳电极表面进行捕获,检出限可达0.8 ng/mL,可以应用于不同乳源乳制品中β-Lg的检测。此外,基于IgE线性表位的单克隆抗体和过氧化氢酶介导的荧光夹心酶联免疫法,可对婴幼儿配方乳粉中β-Lg进行测定,方法的检出限为7.81 ng/mL[28]。免疫分析方法特异性极强,许多快速可靠的ELISA检测试剂盒也已经进入市场,但该方法制备新靶点抗体的过程较为复杂,而且对样品的要求较高[29],其高特异性的特点也使得只能对单一蛋白质进行检测。
目前,免疫法广泛应用于羊乳、骆驼乳、驴乳等不同奶源乳制品的牛乳掺假检测中,能够实现乳制品相互掺假的现场快速检测,确保乳制品的品质与真实性,而更高的灵敏度和更低的检出限在免疫法的发展与实际应用中将成为必然要求。
3 高效液相色谱法
HPLC在乳蛋白的检测方面应用广泛,对于不同研究目的和蛋白组分的测定已有大量的研究报道(表1),通常采用荧光或紫外吸收进行定量,方法重现性好[30]。FERREIRA等[31]对不同乳源混合物中同源β-Lg进行了测定,建立了检测乳制品和乳酪中绵羊乳、山羊乳和牛乳含量的一种非常灵敏且准确的方法,检出限为2%。研究者通过对前人的方法进行改良开发了一种新的反相高效液相色谱法(reversed-phase HPLC,RP-HPLC),用于分离和定量牛乳蛋白的不同表型(αS1-CN, αS2-CN, A1 β-CN, A2 β-CN, κ-CN, α-La, β-Lg)。该方法可同时分离和定量所有目标蛋白,可有效评价乳蛋白的组成。对水牛乳中乳蛋白的分析结果显示,水牛乳蛋白中αS1-CN, αS2-CN, β-CN, κ-CN分别占总酪蛋白含量的32.2%、15.8%、36.5%和15.5%,而β-Lg的含量约为α-La的1.3倍[32-33]。通过进一步对RP-HPLC检测方法的优化,可在30 min内对牛乳中的主要蛋白质(α-CN, β-CN, κ-CN, α-La, β-Lg)进行分离和定量,检出限在0.08~0.28 g/L,可用于商品牛乳中蛋白质含量的测定[34]。并且可以从已知基因型的单个动物乳汁样本中提取纯基因变体,在30 min内对样品中目标蛋白质的不同基因变异体进行分离和定量,以评价目标蛋白质多态性对蛋白含量的影响[35]。尽管目前通过不断的改良和发展,在一定程度上缩短了检测时间,但大多数方法仍需要至少15 min清洗和平衡色谱柱[30-35]。
表1 高效液相色谱法检测乳品中乳蛋白
Table 1 Determination of proteins in dairy products by high performance liquid chromatography
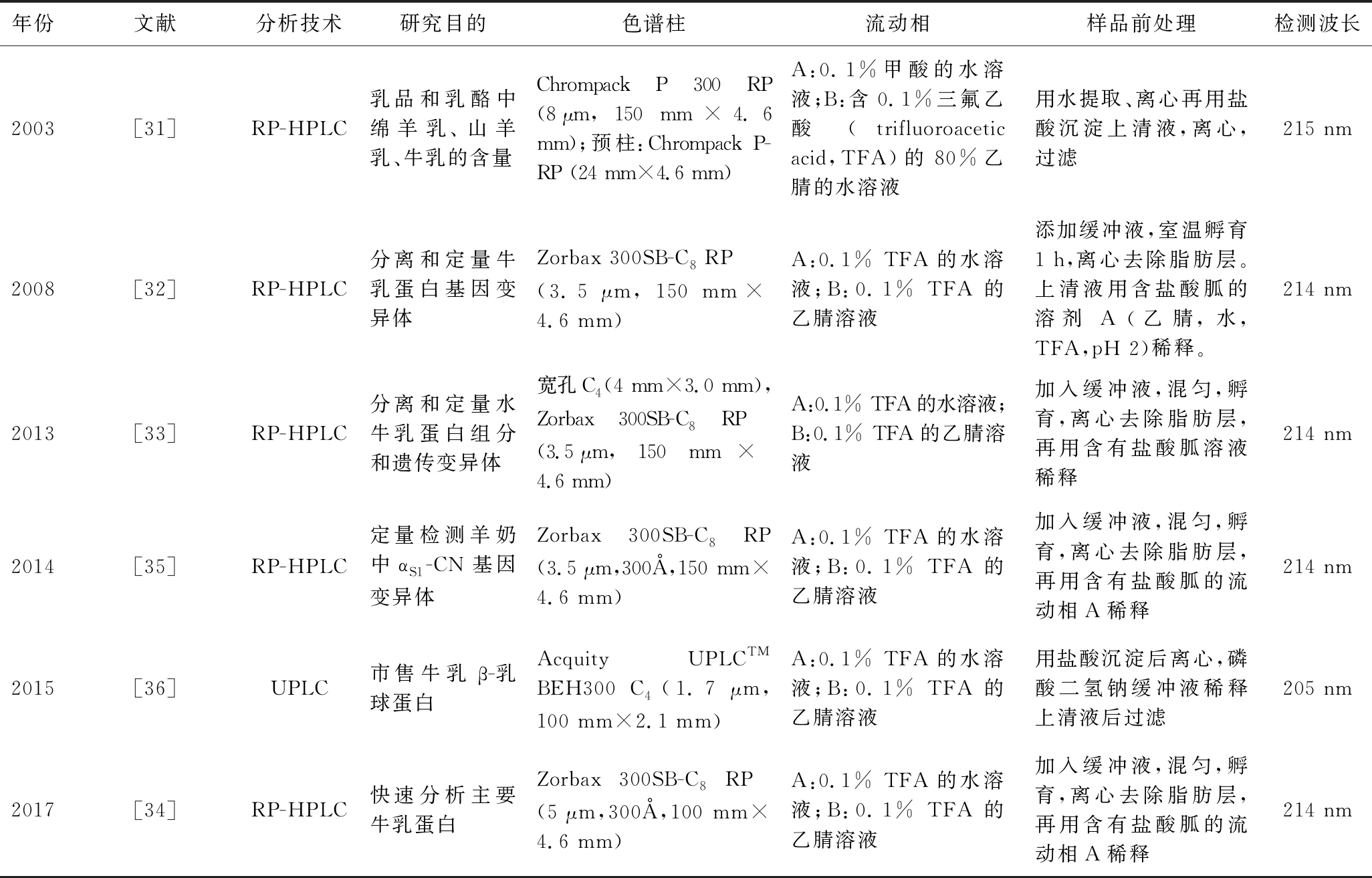
年份文献分析技术研究目的色谱柱流动相样品前处理检测波长2003[31]RP-HPLC乳品和乳酪中绵羊乳、山羊乳、牛乳的含量Chrompack P 300 RP (8 μm, 150 mm×4.6 mm);预柱:Chrompack P-RP (24 mm×4.6 mm)A:0.1%甲酸的水溶液;B:含0.1%三氟乙酸(trifluoroacetic acid,TFA)的80%乙腈的水溶液用水提取、离心再用盐酸沉淀上清液,离心,过滤215 nm2008[32]RP-HPLC分离和定量牛乳蛋白基因变异体Zorbax 300SB-C8 RP (3.5 μm, 150 mm×4.6 mm)A:0.1% TFA的水溶液;B:0.1% TFA的乙腈溶液添加缓冲液,室温孵育1 h,离心去除脂肪层。上清液用含盐酸胍的溶剂A(乙腈,水,TFA,pH 2)稀释。214 nm2013[33]RP-HPLC分离和定量水牛乳蛋白组分和遗传变异体宽孔C4 (4 mm×3.0 mm),Zorbax 300SB-C8 RP (3.5 μm, 150 mm×4.6 mm)A:0.1% TFA的水溶液;B:0.1% TFA的乙腈溶液加入缓冲液,混匀,孵育,离心去除脂肪层,再用含有盐酸胍溶液稀释214 nm2014[35]RP-HPLC定量检测羊奶中αS1-CN基因变异体Zorbax 300SB-C8 RP (3.5 μm,300Å,150 mm×4.6 mm)A:0.1% TFA的水溶液;B:0.1% TFA的乙腈溶液加入缓冲液,混匀,孵育,离心去除脂肪层,再用含有盐酸胍的流动相A稀释214 nm2015[36]UPLC市售牛乳β-乳球蛋白Acquity UPLCTM BEH300 C4 (1.7 μm, 100 mm×2.1 mm)A:0.1% TFA的水溶液;B:0.1% TFA的乙腈溶液用盐酸沉淀后离心,磷酸二氢钠缓冲液稀释上清液后过滤205 nm2017[34]RP-HPLC快速分析主要牛乳蛋白Zorbax 300SB-C8 RP (5 μm,300Å,100 mm×4.6 mm)A:0.1% TFA的水溶液;B:0.1% TFA的乙腈溶液加入缓冲液,混匀,孵育,离心去除脂肪层,再用含有盐酸胍的流动相A稀释214 nm
在传统HPLC的基础上,超高效液相色谱(ultra-performance liquid chromatography,UPLC)技术无论检测速度、分离效果都得到了进一步的提升。BOITZ 等[36]运用UPLC技术快速地测定了牛乳中的β-Lg含量,并通过β-Lg含量来区分液态牛乳的不同热处理方式,方法检出限和定量限分别为7 mg/L和23 mg/L, 总运行时间为3 min,比以往的方法更加迅捷。
HPLC在蛋白质分离纯化中的优异性使得这项技术在蛋白质组学研究中发挥着重要作用,同时,复杂多样的实验样品也对其提出了更高的要求,推动了HPLC的进一步发展。作为蛋白质检测中不可或缺的关键技术手段,通过与质谱等其他技术相结合,在保证准确性的基础上缩短检测时间,实现对蛋白质定性和定量的目的。
4 液相色谱-质谱联用法
质谱已发展成为分离科学中最流行和最实用的检测技术之一,质谱检测技术的引入使得蛋白质分析得到重大改进,它具有独特的选择性,并且能够获得高度结构特异性的信息[37]。LC-MS可以在蛋白质水平或者肽段水平实现对蛋白质的绝对定量,即可以对完整的蛋白质或者酶解产生的特征肽段进行定量分析,测定时间短,检出限低,动态范围宽,在乳蛋白检测鉴别中的应用越来越广泛(表2)。现有研究提出了一种快速制样(有机溶剂提取、酸沉淀、离心)与LC-MS分析相结合的检测方法,用于检测牛乳掺入水牛乳和马苏里拉奶酪的问题,该方法能够在15 min内完成样品分析,同时能够在每次运行中完全识别β-Lg的变体,对乳蛋白定量也可应用于掺假鉴别中[38]。MIRANDA等[39]用RP-HPLC-MS对6种乳蛋白(αS1-CN, αS2-CN, β-CN, κ-CN, α-La, β-Lg)进行了测定,旨在建立乳制品特征蛋白的质量数据库,方法对主要亚型的观测质量和理论质量之间的差异非常小,平均低于0.35 Da。可通过LC-MS的方法鉴定牛乳中3种β-CN变异体A1、A2和I,使得蛋白表型的分析更加细化,其中A2 β-CN在几种被发现的表型中比例最高,占β-CN的48.2%[40]。
表2 液相色谱-质谱联用法检测乳制品中乳蛋白
Table 2 Determination of proteins in dairy products by LC-MS

年份文献分析技术研究目的色谱柱流动相内标样品前处理2007[41]HPLC-ESI-QqQ-MS绝对定量β-乳球蛋白及其在不同乳制品中的应用Supelco Discovery Bio Wide C8 (150 mm×2.1 mm, 3 μm)A:0.5%醋酸的水溶液;B:0.5%醋酸的乙腈溶液山羊β-Lg;水牛β-Lg牛乳:加入山羊β-Lg后,添加乙酸和二氯甲烷,离心;加工后的乳制品:添加含Triton X-100的氯化钠溶液、山羊β-Lg,4 ℃下离心,过滤,盐酸酸化,离心;分析前加水稀释,加入水牛β-Lg2010[38]LC/MSD-Trap-SL-QIT-MSβ-乳球蛋白变异体检测水牛乳和马苏里干酪与牛乳的掺假Supelco Discovery Bio Wide Pore C8 (150 mm×2.1 mm, 3 μm)A:0.5%醋酸的水溶液;B:0.5%醋酸的乙腈溶液无离心后加入乙酸和二氯甲烷,涡旋,离心,取上层2010[42]UPLC-ESI-MS婴幼儿配方乳粉中的α-牛乳白蛋白和β-乳球蛋白BEH300 C18(150 mm×2.1 mm, 1.7 μm)A:0.1% TFA的水溶液;B:0.1% TFA的乙腈溶液人乳乳清蛋白溶解在含有0.2% Triton X-100的氯化钠溶液中,用TFA将溶液调节至pH 4.6,加水。在室温下均质,过滤2011[37]HPLC- QTrap-MS/MS食品中反刍动物乳主要乳蛋白标志肽Zorbax SB-C18(150 mm×2.1 mm, 3.5 μm)A:10%乙腈的水溶液;B:95%乙腈的水溶液特征肽段将样品与缓冲液混合后离心过滤干燥,加入含尿素的NH4HCO3缓冲液(pH=8)中,用DTT和碘乙酰胺在NH4HCO3中还原和烷基化,加入胰蛋白酶溶液,37 ℃孵育一夜,加入甲酸使反应停止2017[44]UPLC-ESI-TOF-MS/MS定量分析羊乳制品中牛乳和乳清粉的掺伪率narrow-bore Acqu-ity UPLC BEH 300 C18(2.1 mm×100 mm,1.7 μm)A:0.1% 甲酸的水溶液;B:0.1%甲酸的乙腈溶液同位素标记的特征肽样品溶解并稀释,与稳定同位素标记内标和超纯水混合,70 ℃水浴中用DTT还原30 min,烷基化30 min,2017[43]UPLC-ESI-QqQ-MSβ-Lg酶解后的特征肽ZORBAX SB-C18(2.1 mm×50 mm, 1.8 μm)A:0.1% 甲酸的水溶液;B:0.1% 甲酸的乙腈溶液内标肽ETTVFENL-PEK稀释,加入内标肽段溶液、二硫苏糖醇溶液、碘乙酰胺溶液、胰蛋白酶溶液,溶剂为NH4HCO3溶液过夜反应,最后加入10%甲酸水溶液室温静置,离心,过滤2020[39]LC-ESI-TOF-MS6种主要牛乳蛋白的分子多样性和定量Discovery BIO Wide Pore C5 (150 mm×2.1 mm)A:0.025% TFA的水溶液;B:0.02% TFA的乙腈溶液无离心,在室温下,加入澄清液(Bis-Tris缓冲液,尿素,柠檬酸钠,二硫苏糖醇)来澄清脱脂牛乳2020[40]UPLC-Q-Orbitrap HRMS检测牛乳中β-酪蛋白表型Agilent Poroshell 120 (100 mm×3.0 mm, 2.7 μm) EC-18A:0.1% TFA的水溶液;B:100%乙腈溶液无离心,加醋酸铵溶液(pH 4.2)离心,超纯水、丙酮洗涤沉淀,干燥,溶于尿素缓冲液,添加Tris缓冲液(pH 8.2),离心
尽管LC-MS具有高灵敏度和高选择性,但基质效应可能会影响方法的准确性。加入内标可适当消除基质效应的影响,理论上,最优的内标是被同位素标记的目标蛋白或类似物。CZERWENKA等[41]使用LC-MS定量分析牛乳中的β-Lg,在样品制备过程中,先后引入山羊β-Lg和水牛β-Lg作为内标,来补偿整个实验中前处理损失和基质效应。REN等[42]以人乳清蛋白作为内标建立了同时对牛乳中α-La和β-Lg定量的超高效液相色谱-串联质谱法(UPLC-MS/MS),在6 min(总运行时间8 min)内完成了对乳清蛋白的分离检测,提高了测量精度、准确性和重现性,回收率为94.9%~98.7%,可用于鉴别和定量生物基质中天然形式的蛋白质。
目前,使用LC-MS检测乳制品蛋白的方法越来越成熟,从对完整蛋白质的检测发展为对酶解后特征肽段的检测,并以此为依据进行定量[43]。ANSARI等[37]建立了一种基于固相微萃取的LC-MS方法,重点对α-CN、β-CN、α-La和β-Lg用胰蛋白酶消化后获得的肽段(5~12个氨基酸)进行分析,考虑了掺假混合物中不同浓度的乳蛋白,此方法对不同食品样品中天然乳蛋白进行定性、定量分析。KE等[44]建立了一种针对牛乳制品和羊乳制品中4种酪蛋白(αS1-CN, αS2-CN, β-CN, κ-CN)和2种主要乳清蛋白(α-La, β-Lg)的UPLC-MS/MS方法,分析了6种乳蛋白的特征性多肽,并用同位素标记的特征肽段作为内标补偿基质效应,方法重现性良好。
基于质谱技术的蛋白组学对乳蛋白的定量分析通常包括样品前处理、蛋白质提取、蛋白酶酶解、质谱仪检测和数据分析五部分。其中蛋白质定量方法常用的有同位素标记相对和绝对定量技术 (isobaric tags for relative and absolute quantification, iTRAQ),串联质谱标签技术(tandem mass tag, TMT)和无标定量技术(label-free quantification)[45-46]。iTRAQ 可用于乳蛋白质组差异分析[47-48],TMT和其原理相近但通量更高,二者被广泛应用于乳蛋白定量。相较于有标定量昂贵的试剂盒,无标定量只需要分析大量质谱数据,比较相应肽段在不同样品中的信号强度即可实现相对定量。但无标定量要求仪器保证较高的重复性,为保证结果的可靠性需要进行足够的技术重复。数据非依赖型的质谱采集技术结合传统鸟枪法,在数据依赖型采集的基础上建立成为当下最热门的质谱技术之一[49],可以实现良好的重复性、高通量、高准确性,并在逐渐发展中出现了一种新兴技术——全碎片离子顺序窗口化获取质谱,将蛋白质组深度覆盖能力与定量一致性和准确性相结合[50]。但这2种技术对于分析算法要求高,需要结合相应的分析软件对质谱图进行解析。
通过将不同技术方法应用于不同种类质谱仪,并结合生物信息学数据分析方法,将帮助研究者们更加深入全面地实现对乳制品蛋白组学的研究。
5 小结
明确乳制品中蛋白质的组分和含量是评价乳制品的营养价值、过敏特性以及真实性的基础。世界各国都十分重视如何强化乳制品的营养成分和如何降低其致敏性,尤其在“健康中国2030”的背景下,国家大力倡导乳制品的消费,都使得诸多学者将目光着眼于如何更快、更简洁地分离检测更多种类的乳蛋白。由总蛋白含量检测逐步过渡到蛋白组分的分析,利于完善乳制品的品质科学评价与表达,并可预防乳制品真实性问题的出现,保障消费者和诚信企业的合法权益。对于乳蛋白的检测分析,ELISA法虽然方便快捷、特异性好,但是却存在交叉反应和无法同时对多种乳蛋白进行检测的问题;电泳法和HPLC法可获得较多的成分信息,但部分电泳法的重复性有待进一步提升,HPLC法单次分析时间长,且需花费较长的时间对色谱柱进行维护。LC-MS法在蛋白组学研究领域发挥着自身的优势,相较于以上几种检测方法,LC-MS法的灵敏度更高,检出限低,能够在较短的时间内获得大量的信息,但仪器设备价格昂贵对其推广造成了一定的阻碍。在乳蛋白检测分析的实际应用中可根据检测需求将不同的检测方法进行整合优化,开发更加快捷、稳定、灵敏的检测技术,提升方法的适用性和时效性,支撑乳蛋白组分的精细化分析。
[1] 曲海波. 浅论乳及乳制品的品质检验[J].商场现代化, 2013(5):100.
QU H B.Quality inspection of milk and dairy products[J].Market Modernization Magazine, 2013(5):100.
[2] KüLLENBERG DE GAUDRY D, LOHNER S, SCHMUCKER C, et al.Milk A1 β-casein and health-related outcomes in humans:A systematic review[J].Nutrition Reviews, 2019, 77(5):5.
[3] 何圣发, 陈红兵, 龙彩云, 等.牛乳过敏原β-乳球蛋白检测方法的研究进展[J].食品安全质量检测学报, 2019, 10(7):1 763-1 769.
HE S F, CHEN H B, LONG C Y, et al.Research progress on the detection methods of cow′s milk allergen β-lactoglobulin[J].Journal of Food Safety and Quality, 2019,10(7):1 763-1 769.
[4] SLETTEN G B, LØVBERG K E, MOEN L H, et al.A comparison of time-resolved fluoroimmunoassay and ELISA in the detection of casein in foodstuffs[J].Food and Agricultural Immunology, 2005, 16(3):235-243.
[5] PLANK J, ANDRES P R, KRAUSE I, et al.Gram scale separation of casein proteins from whole casein on a Source 30Q anion-exchange resin column utilizing fast protein liquid chromatography (FPLC)[J].Protein Expression and Purification, 2008, 60(2):176-181.
[6] 张艳, 胡志和, 赖宜萍.牛乳中αS-、β-酪蛋白组分的分离[J].食品科学, 2009, 30(14):31-36.
ZHANG Y, HU Z H, LAI Y P.Separation of αS - and β-caseins from milk[J].Food Science, 2009, 30(14):31-36.
[7] BROOKE-TAYLOR S, DWYER K, WOODFORD K, et al.Systematic review of the gastrointestinal effects of A1 compared with A2 β-casein[J].Advances in Nutrition, 2017, 8(5):739.
[8] CHATTERTON D E W, SMITHERS G, POUPAS P, et al.Bioactivity of beta-lactoglobulin and alpha-lactalbumin—Technological implications for processing[J].International Dairy Journal, 2006, 16(11):1 229-1 240.
[9] FEE C J, CHAND A.Capture of lactoferrin and lactoperoxidase from raw whole milk by cation exchange chromatography[J].Separation and Purification Technology, 2006, 48(2):143-149.
[10] 夏超, 许慧卿.乳清蛋白的功能特性及在可食性膜中的应用[J].中国乳业, 2019(11):82-84.
XIA C, XU H Q.Functional properties of whey protein and its application in edible film[J].China Dairy, 2019(11):82-84.
[11] KOSTAL V, KATZENMEYER J, ARRIAGA E A.Capillary electrophoresis in bioanalysis[J].Analytical Chemistry, 2008, 80(12):4 533-4 550.
[12] 宋宏新, 刘静, 张歌, 等.变性与非变性电泳对牛羊乳蛋白质差异比较研究[J].陕西科技大学学报(自然科学版), 2013, 31(6):109-113.
SONG H X, LIU J, ZHANG G, et al. The study of the differences between cow and goat milk proteins by SDS-PAGE and native-PAGE[J]. Journal of Shaanxi University of Science & Technology (Natural Science Edition), 2013, 31(6):109-113.
[13] PESIC M, BARAC M, VRVIC M, et al.Qualitative and quantitative analysis of bovine milk adulteration in caprine and ovine milks using native-PAGE[J].Food Chemistry, 2011, 125(4):1 443-1 449.
[14] 韩奕奕, 黄菲菲, 王建军, 等.凝胶电泳法(SDS-PAGE)测定乳与乳制品中β-乳球蛋白的含量[J].乳业科学与技术, 2009, 32(2):74-77.
HAN Y Y, HUANG F F, WANG J J, et al.The determination of β-lactoglobulin content in milk and dairy products by SDS-PAGE electrophoresis[J].Journal of Dairy Science and Technology, 2009, 32(2):74-77.
[15] DUARTE-V ZQUEZ M A, GARC
ZQUEZ M A, GARC A-UGALDE C R,
A-UGALDE C R,  LVAREZ B E, et al.Use of urea-polyacrylamide electrophoresis for discrimination of A1 and A2 beta casein variants in raw cow′s milk[J].Journal of Food Science and Technology, 2018, 55(5):1 942-1 947.
LVAREZ B E, et al.Use of urea-polyacrylamide electrophoresis for discrimination of A1 and A2 beta casein variants in raw cow′s milk[J].Journal of Food Science and Technology, 2018, 55(5):1 942-1 947.
[16] 张智武, 许建香.3种电泳方法定量分析牛奶蛋白的比较[J].中国乳品工业, 2005,33(8):51-54;57.
ZHANG Z W, XU J X.Quantitative analyzing bovine milk proteins by comparing three electrophoresis methods[J].China Dairy Idustry, 2005,33(8):51-54;57.
[17] 冯慿, 丁晓静, 高铁, 等.毛细管区带电泳测定液态奶及奶粉中的A2 β-酪蛋白及总β-酪蛋白[J].色谱, 2020, 38(6):722-729.
FENG P, DING X J, GAO T, et al.Determination of A2 β-casein and total β-casein in cow milk and milk powder by capillary zone electrophoresis[J].Chinese Journal of Chromatography, 2020, 38(6):722-729.
[18] 王丽娜, 李子超, 李昀锴, 等.基于毛细管区带电泳系统的南方水牛奶酪蛋白分析技术研究[J].分析测试学报, 2011, 30(3):264-268.
WANG L N, LI Z C, LI Y K, et al.Analysis of water buffalo caseins in South China by capillary zone electrophoresis[J].Journal of Instrumental Analysis, 2011, 30(3):264-268.
[19] CAROLI A M, SAVINO S, BULGARI O, et al.Detecting β-casein variation in bovine milk[J].Molecules, 2016, 21(2):141.
[20] LICITRA R, CHESSA S, SALARI F, et al.Milk protein polymorphism in Amiata donkey[J].Livestock Science, 2019, 230:103845.
[21] 陈静廷, 卜登攀, 马露, 等.不同等电点沉淀法和超速离心法提取牛奶乳清蛋白的双向电泳分析[J].食品科学, 2014, 35(20):180-184.
CHEN J T, BU D P, MA L, et al.2-DE Analysis of whey protein extracted by different isoelectric precipitations and ultracentrifugation methods from cow milk[J].Food Science, 2014, 35(20):180-184.
[22] MONACI L, TREGOAT V, HENGEL A J, et al.Milk allergens, their characteristics and their detection in food:A review[J].European Food Research and Technology, 2006, 223(2):149-179.
[23] 袁水林, 熊鼎, 陈红兵, 等.间接竞争ELISA法检测牛乳中β-乳球蛋白含量的准确性评价[J].食品科学, 2014, 35(18):100-104.
YUAN S L, XIONG D, CHEN H B, et al.Evaluation of the accuracy of indirect competitive ELISA used to detect milk β-lactoglobulin[J].Food Science, 2014, 35(18):100-104.
[24] LóPEZ-CALLEJA I M, GONZ LEZ I, FAJARDO V, et al.Application of an indirect ELISA and a PCR technique for detection of cows’ milk in sheep′s and goats′ milk cheeses[J].International Dairy Journal, 2007, 17(1):87-93.
LEZ I, FAJARDO V, et al.Application of an indirect ELISA and a PCR technique for detection of cows’ milk in sheep′s and goats′ milk cheeses[J].International Dairy Journal, 2007, 17(1):87-93.
[25] 李媛媛, 刘宾, 曹凤波, 等.测定三种乳蛋白抗原性间接竞争ELISA法的建立[J].食品工业, 2015, 36(3):290-295.
LI Y Y, LIU B, CAO F B, et al.Indirect competitive ELISA for detection of the antigenic of three kinds of protein from cow′s milk[J].The Food Industry, 2015, 36(3):290-295.
[26] DE LUIS R, LAVILLA M, S NCHEZ L, et al.Development and evaluation of two ELISA formats for the detection of β-lactoglobulin in model processed and commercial foods[J].Food Control, 2009, 20(7):643-647.
NCHEZ L, et al.Development and evaluation of two ELISA formats for the detection of β-lactoglobulin in model processed and commercial foods[J].Food Control, 2009, 20(7):643-647.
[27] RUIZ-VALDEPE AS MONTIEL V, CAMPUZANO S, CONZUELO F, et al.Electrochemical magnetoimmunosensing platform for determination of the milk allergen β-lactoglobulin[J].Talanta, 2015, 131:156-162.
AS MONTIEL V, CAMPUZANO S, CONZUELO F, et al.Electrochemical magnetoimmunosensing platform for determination of the milk allergen β-lactoglobulin[J].Talanta, 2015, 131:156-162.
[28] HE S F, LI X, GAO J Y, et al.Development of a H2O2-sensitive quantum dots-based fluorescent sandwich ELISA for sensitive detection of bovine β-lactoglobulin by monoclonal antibody[J].Journal of the Science of Food and Agriculture, 2018, 98(2):519-526.
[29] 党慧杰, 刘振民, 郑远荣.牛乳主要过敏原及其检测技术研究进展[J].食品安全质量检测学报, 2020, 11(3):765-770.
DANG H J, LIU Z M, ZHENG Y R.Research progress of cow milk allergens and their detection techniques[J].Journal of Food Safety and Quality, 2020, 11(3):765-770.
[30] 吴少辉, 张成桂, 刘光明.高效液相色谱法在蛋白质分离检测中的应用[J].畜牧与饲料科学, 2011, 32(8):63-65.
WU S H, ZHANG C G, LIU G M.Application of high performance liquid chromatography in the separation and detection of protein[J].Animal Husbandry and Feed Science, 2011, 32(8):63-65.
[31] FERREIRA I M P L V O, CAÇOTE H.Detection and quantification of bovine, ovine and caprine milk percentages in protected denomination of origin cheeses by reversed-phase high-performance liquid chromatography of beta-lactoglobulins[J].Journal of Chromatography A, 2003, 1 015(1-2):111-118.
[32] BONFATTI V, GRIGOLETTO L, CECCHINATO A, et al.Validation of a new reversed-phase high-performance liquid chromatography method for separation and quantification of bovine milk protein genetic variants[J].Journal of Chromatography A, 2008, 1 195(1-2):101-106.
[33] BONFATTI V, GIANTIN M, ROSTELLATO R, et al.Separation and quantification of water buffalo milk protein fractions and genetic variants by RP-HPLC[J].Food Chemistry, 2013, 136(2):364-367.
[34] MA L, YANG Y, CHEN J, et al.A rapid analytical method of major milk proteins by reversed-phase high-performance liquid chromatography[J].Animal Science Journal, 2017, 88(10):1 623-1 628.
[35] MONTALBANO M, TORTORICI L, MASTRANGELO S, et al.Development and validation of RP-HPLC method for the quantitative estimation of αs1-genetic variants in goat milk[J].Food Chemistry, 2014, 156:165-169.
[36] BOITZ L I, FIECHTER G, SEIFRIED R K, et al.A novel ultra-high performance liquid chromatography method for the rapid determination of β-lactoglobulin as heat load indicator in commercial milk samples[J].Journal of Chromatography A, 2015, 1 386:98-102.
[37] ANSARI P, STOPPACHER N, RUDOLF J, et al.Selection of possible marker peptides for the detection of major ruminant milk proteins in food by liquid chromatography-tandem mass spectrometry[J].Analytical and Bioanalytical Chemistry, 2011, 399(3):1 105-1 115.
[38] CZERWENKA C, MÜELLER L, LINDNER W.Detection of the adulteration of water buffalo milk and mozzarella with cow′s milk by liquid chromatography-mass spectrometry analysis of β-lactoglobulin variants[J].Food Chemistry, 2010, 122(3):901-908.
[39] MIRANDA G, BIANCHI L, KRUPOVA Z, et al.An improved LC-MS method to profile molecular diversity and quantify the six main bovine milk proteins, including genetic and splicing variants as well as post-translationally modified isoforms[J].Food Chemistry: 2020, 5:100080.
[40] NGUYEN D D, SOLAH V A, BUSETTI F, et al.Application of ultra-high performance liquid chromatography coupled to high-resolution mass spectrometry (OrbitrapTM) for the determination of beta-casein phenotypes in cow milk[J].Food Chemistry, 2020, 307:125532.
[41] CZERWENKA C, MAIER I, POTOCNIK N, et al.Absolute quantitation of β-lactoglobulin by protein liquid chromatography-mass spectrometry and its application to different milk products[J].Analytical Chemistry, 2007, 79(14):5 165-5 172.
[42] REN Y P, HAN Z, CHU X J, et al.Simultaneous determination of bovine α-lactalbumin and β-lactoglobulin in infant formulae by ultra-high-performance liquid chromatography-mass spectrometry[J].Analytica Chimica Acta, 2010, 667(1-2):96-102.
[43] 袁明美, 封聪, 王守云, 等.LC-MS/MS法测定牛乳及其制品中β-乳球蛋白的含量[J].化学研究, 2017, 28(2):219-223.
YUAN M M, FENG C, WANG S Y, et al.Determination of bovine β-lactoglobulin in dairy products by LC-MS/MS[J].Chemical Research, 2017, 28(2):219-223.
[44] KE X, ZHANG J S, LAI S Y, et al.Quantitative analysis of cow whole milk and whey powder adulteration percentage in goat and sheep milk products by isotopic dilution-ultra-high performance liquid chromatography-tandem mass spectrometry[J].Analytical and Bioanalytical Chemistry, 2017, 409(1):213-224.
[45] 常乘, 朱云平.基于质谱的定量蛋白质组学策略和方法研究进展[J].中国科学:生命科学, 2015, 45(5):425-438.
CHANG C, ZHU Y P.Strategies and algorithms for quantitative proteomics based on mass spectrometry[J].Scientia Sinica (Vitae), 2015, 45(5):425-438.
[46] 朱金蕾, 张锴, 何锡文, 等.基于质谱技术蛋白质定量方法的研究进展[J].分析化学, 2010, 38(3):434-441.
ZHU J L, ZHANG K, HE X W, et al.New development of quantitative mass spectrometry-based proteomics[J].Chinese Journal of Analytical Chemistry, 2010, 38(3):434-441.
[47] 邓微, 李韫同, 李墨翰, 等.基于iTRAQ技术分析牛初乳与常乳乳清差异蛋白质组[J].食品科学, 2021, 42(2):241-246.
DENG W, LI H T, LI M H, et al.Analysis of differential whey proteome between bovine colostrum and mature milk using isobaric tags for relative and absolute quantitation technology[J].Food Science, 2021, 42(2):241-246.
[48] YANG Y X, BU D P, ZHAO X W, et al.Proteomic analysis of cow, yak, buffalo, goat and camel milk whey proteins:Quantitative differential expression patterns[J].Journal of Proteome Research, 2013, 12(4):1 660-1 667.
[49] 吴琼, 隋欣桐, 田瑞军.高通量蛋白质组学分析研究进展[J].色谱, 2021, 39(2):112-117.
WU Q, SUI X T, TIAN R J.Advances in high-throughput proteomic analysis[J].Chinese Journal of Chromatography, 2021, 39(2):112-117.
[50] LUDWIG C, GILLET L, ROSENBERGER G, et al.Data-independent acquisition-based SWATH-MS for quantitative proteomics:A tutorial[J].Molecular Systems Biology, 2018, 14(8):e8126.