赭曲霉毒素A (ochratoxin A,OTA) 是一种由曲霉属和青霉属的某些产毒菌株产生的次级代谢产物,是已知的6种赭曲霉毒素中毒性最强的一种,广泛存在于咖啡、啤酒、红酒、玉米、小麦、燕麦和蔬菜中[1]。毒理学研究表明,OTA被人体吸收后,对人体肾脏和肝脏有强烈的毒性,同时具有免疫抑制、致癌、致畸和致突变作用[2], 对人体健康造成严重威胁。因此,对食品中的OTA含量进行检测具有重要意义。为了更好地监控食品中的OTA含量,世界各国规定了OTA在食品及谷物等农产品中的限量标准,如欧盟委员会规定供幼儿食用的谷类食品中OTA限量0.5 μg/kg,葡萄汁和葡萄酒中OTA限量2 μg/kg,谷物加工食品中OTA限量3 μg/kg,原始谷物和焙烤咖啡中OTA限量5 μg/kg 和干果中OTA限量10 μg/kg[3-4]。同时,我国也制定了食品及其原料中OTA含量的限量标准,如葡萄酒中OTA限量2 μg/kg,谷物及其制品、大豆和咖啡中OTA限量5 μg/kg[5]。
现用于检测食品及农产品中OTA含量的方法有仪器分析法、胶体金侧流层析法和电化学传感器。仪器分析法包括高效液相色谱法、液相色谱-质谱法、超高效液相色谱-荧光法、超高效液相色谱-电喷雾电离串联质谱联用法、气相色谱-质谱法等。尽管这些方法灵敏度和准确性高,但检测时需要专业人员操作昂贵的大型仪器,而且制备样品的过程复杂。胶体金侧流层析法不需要大型仪器检测,操作简单,可用肉眼直接对结果进行判定。但胶体金弱的光学性能以及低的生物分子结合率导致其灵敏度偏低[6],影响了其在OTA快速检测中的应用和发展。而电化学传感器具有便携、快速和经济的优势,可以弥补上述方法的缺点,目前已用于食品及农产品中OTA含量的检测。因此,本文对电化学传感器在OTA检测中的应用研究进展进行了综述,以期为开发OTA检测新方法提供理论支撑。
1 电化学传感器
电化学传感器主要是基于待测物的电化学性质将待测物的化学量转为电学量,然后对其进行检测的一种传感器。其工作原理就是将化学复合材料或生物活性物质固定在电极表面,利用其对分析物的特异性进行识别,识别信息经电极传递给信息转换部分,然后被转换成检测信号,最后根据特异性识别前后电信号的变化量,对分析物进行定性和定量分析[7]。与其他传统的检测分析方法相比,电化学传感器具有便携、选择性好、灵敏度高及可进行现场检测的优势。
2 电化学传感器在OTA检测中的应用
电化学传感器按照修饰材料或识别活性物质的不同分为电化学免疫传感器、分子印迹电化学传感器、电化学适配体传感器和其他电化学传感器4种类型。
2.1 电化学免疫传感器
电化学免疫传感器是一种将免疫分析技术与电化学检测技术相结合建立的传感检测方法[8]。其主要工作原理是通过固定在电极表面上的抗体对抗原进行特异性识别,将抗原浓度转化为电信号,再对电信号进行处理以数字的方式呈现检测结果,从而对目标物进行定量检测[9]。在电化学免疫传感器中, 抗体作为识别元件,其固定化方法、固定量和抗体活性均会影响传感器性能。该方法的优点在于抗原与抗体的特异性识别,避免了检测过程中的非特异性干扰。
根据是否对免疫分子标记电化学免疫传感器可分为标记型和无标记型2种。标记型电化学免疫传感器在检测前需要对抗体进行标记,操作步骤较多,检测过程较复杂。如LIU等[10]构建了一种间接竞争法检测OTA的电化学免疫传感器,该传感器用碱性磷酸酶标记抗体,检测范围为1.00~1.00×103 ng/mL,检测限低至2.00×10-1 ng/mL,具有良好的重现性和高选择性。而无标记型电化学免疫传感器是直接检测抗原抗体反应时造成的电学量变化,极大地简化了操作过程。如MALVANO等[11]开发了一种基于丝网印刷碳电极的无标记电化学免疫传感器,并将其用于红酒中OTA的定量检测。试验将OTA抗体修饰到丝网印刷电极表面,采用循环伏安法对修饰电极进行表征,运用阻抗法对红酒中OTA的含量进行检测。优化条件下,该传感器在3.00×10-1~20 ng/mL范围内可对OTA进行准确快速的检测,检测限2.50×10-1 ng/mL。KNENE等[12]建立了一种对咖啡中OTA含量检测的无标记电化学免疫传感器,检测范围5.00×10-1~20 ng/mL, 检测限9.60×10-2 ng/mL。与标记型电化学免疫传感器相比,无标记型电化学免疫传感器的检测范围较小,但其无需对抗体进行标记,操作更简便。
近年来,金纳米粒子、碳纳米材料、磁性纳米粒子和纳米杂化材料已用于电化学免疫传感器中,这些纳米材料为固定抗体提供了良好的生物相容性表面,提高了检测灵敏度[13],其中磁性纳米粒子和金纳米粒子用于检测OTA的电化学免疫传感器,如ZHANG等[14]研制了一种基于磁性纳米粒子的电化学免疫传感器,该研究结合酶联免疫吸附法对OTA含量进行检测,检测范围为1.00×10-2~8.20×10-1ng/mL,检测限7.00×10-3ng/mL。选择谷物和饲料样品进行添加回收试验,结果表明,加标回收率为78.7%~113.5%,相对标准偏差在3.60%~9.8%,变异系数小于15%。HOU等[15]开发了一种基于噬菌体展示模拟表位肽的超灵敏电化学免疫传感器,以OTA模拟表位肽作为识别元件,用金纳米粒子修饰玻碳电极,构建检测OTA的电化学免疫传感器,检测范围为7.17×10-6~5.49×10-4 ng/mL,检测限2.04×10-6 ng/mL;对玉米样品和啤酒样品进行添加回收试验,回收率分别为89.6% ~107.4%和99.3%~104.3%。和传统的OTA电化学免疫传感器(检测限8×10-2 ng/mL)相比[16],基于磁性纳米粒子构建的OTA电化学免疫传感器灵敏度提高了近9倍。与磁性纳米粒子的信号放大相比,基于金纳米粒子的OTA电化学免疫传感器的信号放大效果更好,其灵敏度提高了近300倍。综上,用磁性纳米粒子和金纳米粒子均可提高OTA电化学免疫传感器的灵敏度。基于金纳米粒子电化学免疫传感器的灵敏度提高可能是因为金纳米粒子具有良好的导电性,修饰到电极上提高了电子传递速率,从而提高电化学免疫传感器灵敏度。磁性纳米粒子提高传感器的灵敏度可能是因为磁性纳米粒子具有类似过氧化物酶的催化性能[17],故在电化学免疫传感器中可作为催化剂,加快反应速度,从而使传感器的灵敏度得到提高。相比之下,基于金纳米粒子构建的电化学免疫传感器检测范围更宽,检测限更低。
2.2 分子印迹电化学传感器
分子印迹电化学传感器是一种将分子印迹技术和电化学传感技术相结合的分析方法。分子印迹技术是指制备能识别目标分子聚合物的技术[18]。所制备的聚合物作为分子印迹电化学传感器的识别元件,具有专一性强,稳定性高,可重复使用,检测灵敏,成本低,同时还克服了电化学检测方法受杂质干扰的不足[19]。近年来,研究者还通过引入各种纳米材料来进一步提高分子印迹电化学传感器的检测性能,现用于电化学传感器的纳米材料有碳纳米材料、金属纳米材料、磁性纳米材料、金属氧化物以及复合纳米材料[20],其中用于检测OTA分子印迹电化学传感器的纳米材料有多壁碳纳米管和银纳米粒子。
多壁碳纳米管比表面积大,稳定性好,具有良好的生物相容性和导电性,在分子印迹电化学传感器中,其作为良好的载体材料和印迹基质用于修饰电极[20-21],能提高OTA分子印迹电化学传感器的灵敏度。如PACHECO等[22]用多壁碳纳米管和分子印迹聚合物修饰玻碳电极,用OTA印迹的聚吡咯作为识别元件,制备了检测OTA含量的分子印迹电化学传感器,原理如图1所示。检测范围为2.02~4.04 ng/mL, 检测限1.70 ng/mL。在啤酒和葡萄酒样品中检测的加标回收率为84%~104%,相对标准偏差在4.2%~7.5%。
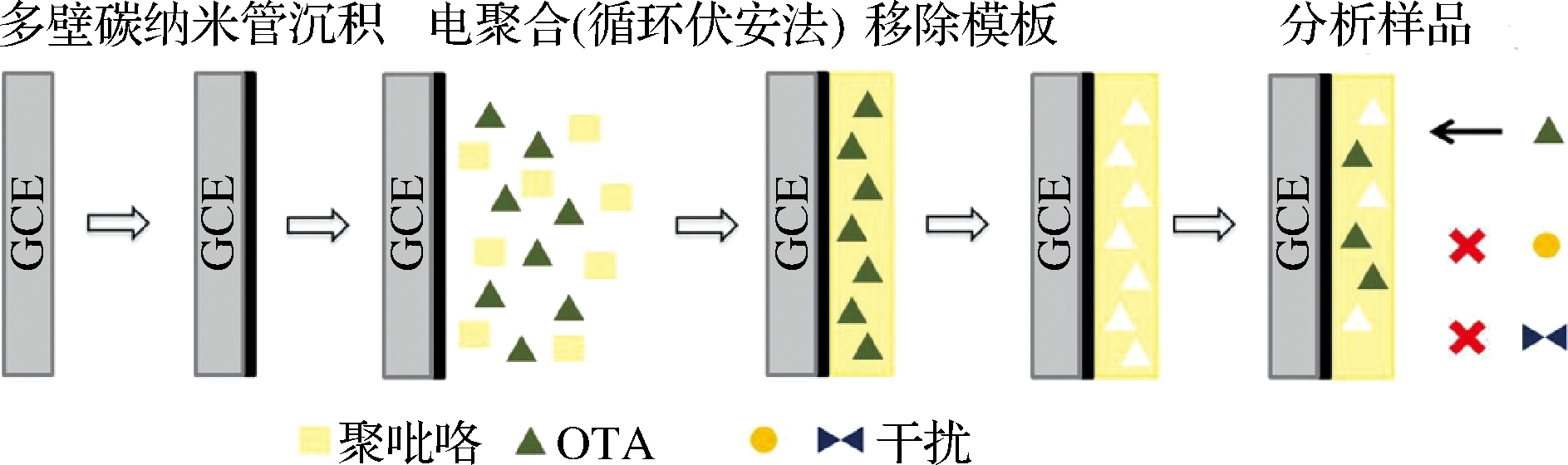
图1 基于多壁碳纳米管的分子印迹传感器原理图
Fig.1 Schematic diagram of a molecularly imprinted sensor based on multi-walled carbon nanotubes
银纳米粒子用于分子印迹电化学传感器能够增加电极的比表面积,增强识别位点与电化学换能器之间的电子传递速度,从而放大分子印迹电化学传感器的检测信号[20]。然而,银纳米粒子单独修饰电极稳定性差,往往需要与其他材料相结合,形成杂化银纳米粒子,掺入分子印迹膜提高分子印迹电化学传感器灵敏度。YOLA等[23]设计了一种基于银纳米粒子的分子印迹电化学传感器,用于葡萄汁和葡萄酒样品中OTA的检测,试验原理见图2。该分子印迹电化学传感器掺杂多金属氧酸盐H3PW12O40和功能化的还原氧化石墨烯修饰玻碳电极,其中还原氧化石墨烯能加快传感器的电子传递速率,提高传感器的灵敏度。经优化,该传感器在2.02×10-2~6.06×10-1 ng/mL范围内能对OTA进行灵敏的快速分析,检测限低至6.46×10-3 ng/mL。
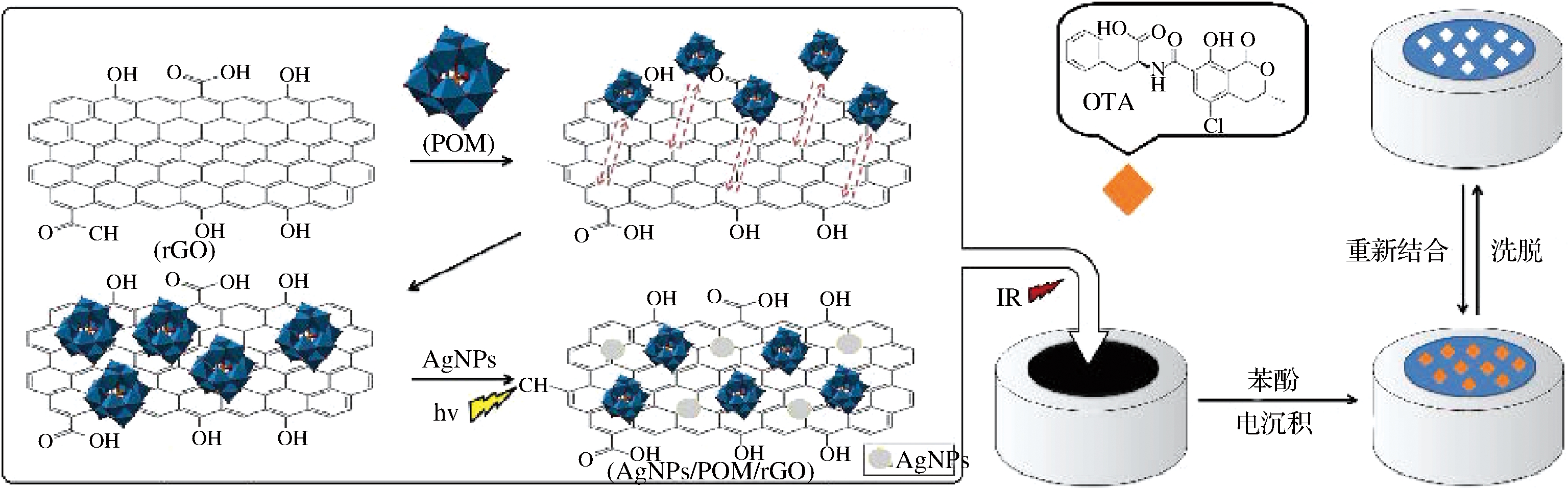
图2 基于还原氧化石墨烯分子印迹传感器原理图
Fig.2 Schematic diagram of molecularly imprinted sensor based on reduced graphene oxide
和多壁碳纳米管构建的OTA分子印迹电化学传感器相比,银纳米粒子构建的传感器检测限更低,这可能是因为在银纳米粒子中掺杂金属氧酸盐和功能化的还原氧化石墨烯在增加电子传递速率的基础上既克服了银纳米粒子修饰电极稳定性差的缺陷,又增大了电极的比表面积,同时还提高了反应过程中的催化性能,从而使OTA分子印迹电化学传感器的灵敏度更高。
2.3 电化学适配体传感器
适配体是通过指数富集配体系统进化技术从体外人工合成的单链核酸文库中筛选出来的寡核苷酸片段[24],是由20~80个核苷酸组成的RNA或单链DNA,可以折叠构成热力学稳定的三维结构,通过氢键、范德华力、静电作用等与靶分子(如金属离子、氨基酸、蛋白质、酶等)特异性结合[25]。适配体又被称为“化学抗体”[24],与传统抗体相比,适配体的特异性强、靶物质范围广、易修饰、稳定性强且可在常温下运输、筛选周期短、易获得和成本低。鉴于这些优势,适配体已被广泛地用作电化学传感器的识别元件。根据工作方式不同可将其分为亲合型、构型变换型和混合型3种类型。本文总结了电化学适配体传感器在OTA检测中的应用(表1)。
由表1可见,电化学适配体传感器已广泛的用于小麦、玉米、红酒、白酒、葡萄酒、啤酒、咖啡等样品中OTA含量的检测。用于电化学适配体传感器的纳米材料有金属纳米材料、碳纳米材料、金属氧化物和复合纳米材料等,其中金纳米粒子、银纳米粒子、石墨烯和纳米复合材料材料等用于OTA电化学适配体传感器中。应用纳米材料构建的大部分电化学适配体传感器比未应用纳米材料的电化学适配体传感器检测限低,如MAZAAFRIANTO等[30]设计了一种无标记的电化学适配体传感器,在咖啡和啤酒样品中的检测限为7.83×10-2 ng/mL;KAUR等[26]设计了一种基于石墨烯的电化学适配体传感器用于葡萄汁中OTA的检测,检测限为1.00×10-7 ng/mL。应用了石墨烯的电化学适配体传感器检测限低,可能是因为石墨烯具有良好的生物兼容性和导电性,同时还具有较大的比表面积[44]。同时还可以看出,在上述的纳米材料中,金纳米粒子应用较多,主要因为其具有良好的生物兼容性和导电性,制备过程简单和粒径可控优点[45]。另外,在电化学适配体传感器中使用金纳米粒子,检测限更低,无论是单独使用还是与其他纳米材料组成纳米复合材料使用,均可使电化学传感器具有较低的检测限,这主要取决于其具有良好的导电性和较大的比表面积。
表1 电化学适配体传感器在OTA检测中的应用
Table 1 Application of electrochemical aptaensor in OTA detection
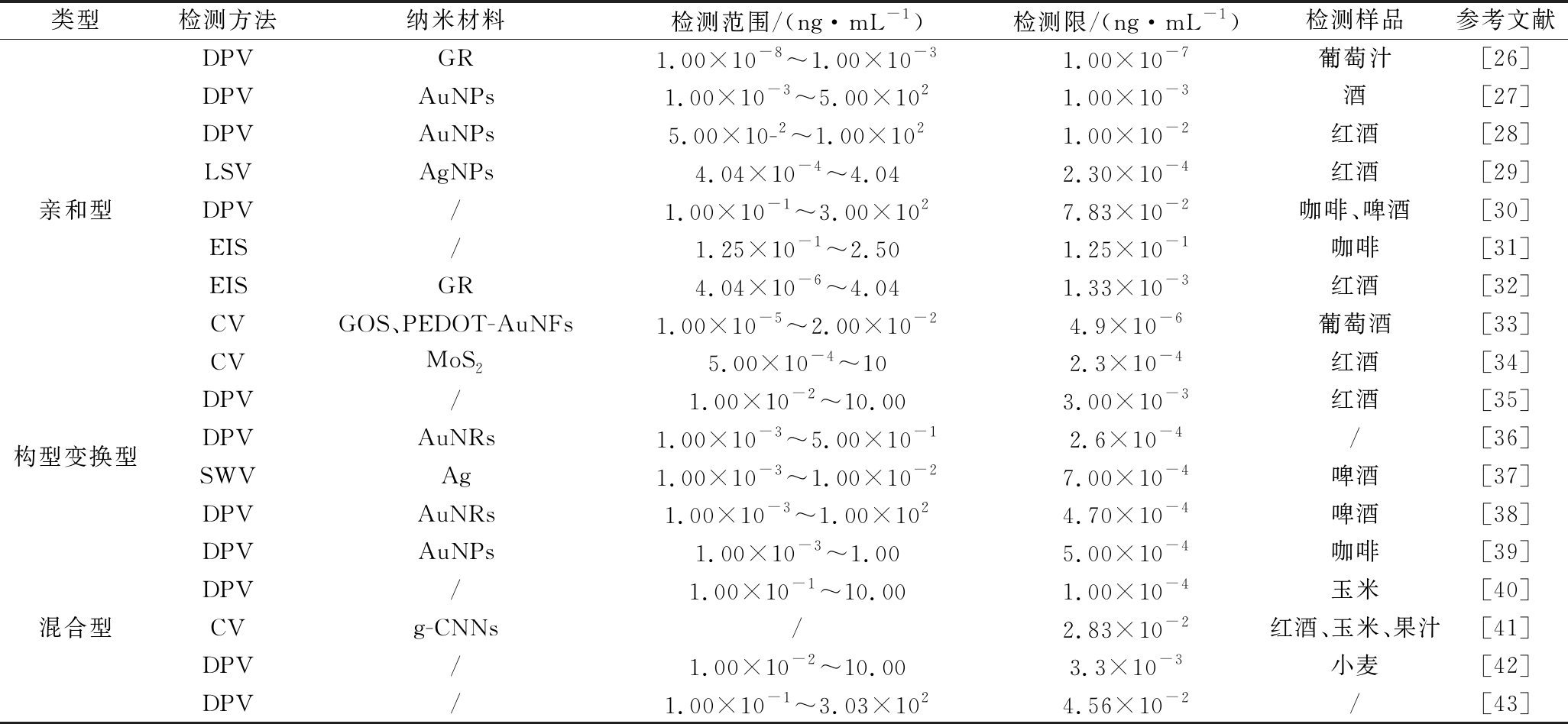
注:DPV:微分伏安脉冲法;GR:石墨烯;AuNPs:金纳米粒子;LSV:线性扫描伏安法;AgNPs:银纳米粒子;EIS:电阻抗法;CV:循环伏安法;GOS:氧化石墨烯海绵;PEDOT-AuNFs:聚(3,4-乙二氧基噻吩)-金纳米花复合材料;MoS2:二硫化钼;AuNRs:金纳米棒;Ag:银;SWV:方波伏安法;g-CNNs: 类石墨氮化碳纳米片;/:文章未标明
类型检测方法纳米材料检测范围/(ng·mL-1)检测限/(ng·mL-1)检测样品参考文献亲和型DPVGR1.00×10-8~1.00×10-31.00×10-7葡萄汁[26]DPVAuNPs1.00×10-3~5.00×1021.00×10-3酒[27]DPVAuNPs5.00×10-2~1.00×1021.00×10-2红酒[28]LSVAgNPs4.04×10-4~4.042.30×10-4红酒[29]DPV/1.00×10-1~3.00×1027.83×10-2咖啡、啤酒[30]EIS/1.25×10-1~2.501.25×10-1咖啡[31]EISGR4.04×10-6~4.041.33×10-3红酒[32]CVGOS、PEDOT-AuNFs1.00×10-5~2.00×10-24.9×10-6葡萄酒[33]CVMoS25.00×10-4~102.3×10-4红酒[34]构型变换型DPV/1.00×10-2~10.003.00×10-3红酒[35]DPVAuNRs1.00×10-3~5.00×10-12.6×10-4/[36]SWVAg1.00×10-3~1.00×10-27.00×10-4啤酒[37]DPVAuNRs1.00×10-3~1.00×1024.70×10-4啤酒[38]混合型DPVAuNPs1.00×10-3~1.005.00×10-4咖啡[39]DPV/1.00×10-1~10.001.00×10-4玉米[40]CVg-CNNs/2.83×10-2红酒、玉米、果汁[41]DPV/1.00×10-2~10.003.3×10-3小麦[42]DPV/1.00×10-1~3.03×1024.56×10-2/[43]
2.4 其他电化学传感器
除了上述的三类电化学传感器,还有研究者应用其他修饰材料或识别物质构建检测OTA的电化学传感器,如XIANG等[46]利用黑磷烯具有良好的电化学稳定性、电催化活性和优良的防垢性能等性质,设计了一种检测OTA的电化学传感器。采用微分伏安脉冲法对啤酒和葡萄汁中的OTA进行检测,检测范围为3×102~1×104ng/mL,检测限1.8×102 ng/mL。DRIDI等[47]设计了一种基于热裂解酶的电化学传感器,对橄榄油中的OTA进行检测。该方法对OTA浓度在8.08×10-1~40.38 ng/mL范围呈现良好的线性关系,检测限4.38×10-1 ng/mL。AFZALI等[48]利用金纳米颗粒的高比表面积、电催化和吸附特性,设计了一种选择性强、操作简单的电化学传感器,该传感器在谷类食品和啤酒样品中的检测范围为2.02×10-1~40.38 ng/mL,检测限为8.08×10-2 ng/mL。JALALVAND[49]将石墨烯、多壁碳纳米管、壳聚糖、离子液体、胶原-离子液体和氧化镍纳米材料结合在一起修饰玻碳电极,构建了一种用于果汁样品中OTA检测的电化学传感器,其中胶原中含有大量的氧和氮原子,使其与金属氧化物具有良好的亲和力,避免了金属氧化物纳米粒子的聚集,提高了传感器的稳定性,检测范围为4.04×10-3~4.04 ng/mL,检测限2.02×10-3 ng/mL, 该传感器的重现性好且成本低。
3 展望
近年来,随着各种纳米材料或识别元件的应用,OTA电化学传感器的灵敏度正在逐步改善,提高了OTA电化学传感器的稳定性和重现性,但仍有一些性能需要继续改进:(1)在电化学免疫传感器中,抗原抗体在电极表面固载的稳定性仍需提高;(2)在分子印迹电化学传感器中,功能单体种类单一,构建方法较为复杂;(3)开发无毒无害、价格低廉、生物兼容性更好的纳米材料,如可开发新的纳米复合材料,提高电化学传感器的检测性能。
电化学传感器在OTA检测中具有广阔的应用前景,未来有取代传统的检测技术的潜力,因此,研发快速、灵敏、绿色、可用于现场检测的电化学传感器将是OTA检测未来研究发展方向。
[1] NAMEGHI M A, DANESH N M, RAMEZANI M, et al.A fluorescent aptasensor based on a DNA pyramid nanostructure for ultrasensitive detection of ochratoxin A[J].Analytical and Bioanalytical Chemistry, 2016, 408(21):5 811-5 818.
[2] JIANG C M, LAN L, YAO Y Y, et al.Recent progress in application of nanomaterial-enabled biosensors for ochratoxin A detection[J].TrAC Trends in Analytical Chemistry, 2018, 102:236-249.
[3] PAGKALI V, PETROU P S, SALAPATAS A, et al.Detection of ochratoxin A in beer samples with a label-free monolithically integrated optoelectronic biosensor[J].Journal of Hazardous Materials, 2017, 323:75-83.
[4] CHEN R P, SUN Y F, HUO B Y, et al.Highly sensitive detection of ochratoxin A based on bio-barcode immunoassay and catalytic hairpin assembly signal amplification[J].Talanta, 2020, 208:120405.
[5] 国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 2761—2017 食品安全国家标准食品中真菌毒素限量[S].北京:中国标准出版社, 2017.
National Health and Family Planning Commission of the People′s Republic of China, State Food and Drug Administration.GB 2761—2017 National food sacfety standard Limits of mycotoxins in food[S].Beijing:China Standard Press, 2017.
[6] HUANG X L, AGUILAR Z P, XU H Y, et al.Membrane-based lateral flow immunochromatographic strip with nanoparticles as reporters for detection:A review[J].Biosensors and Bioelectronics, 2016, 75:166-180.
[7] 李文进, 刘霞, 李蓉卓, 等.电化学传感器在农药残留检测中的研究进展[J].食品与机械, 2013, 29(4):241-245.
LI W J, LIU X, LI R Z, et al.Progress on pesticide residues detection by electrochemical sensor[J].Food & Machinery, 2013, 29(4):241-245.
[8] RICCI F, VOLPE G, MICHELI L, et al.A review on novel developments and applications of immunosensors in food analysis[J].Analytica Chimica Acta, 2007, 605(2):111-129.
[9] BURCU BAHADIR E, KEMAL SEZGINTÜRK M.Applications of electrochemical immunosensors for early clinical diagnostics[J].Talanta, 2015, 132:162-174.
[10] LIU X R, YANG Z G, ZHANG Y F, et al.A novel electrochemical immunosensor for ochratoxin A with hapten immobilization on thionine/gold nanoparticle modified glassy carbon electrode[J].Analytical Methods, 2013, 5(6):1 481-1 486.
[11] MALVANO F, ALBANESE D, CRESCITELLI A, et al.Impedimetric label-free immunosensor on disposable modified screen-printed electrodes for ochratoxin A[J].Biosensors, 2016, 6(3):33-46.
[12] KUNENE K, WEBER M, SABELA M, et al.Highly-efficient electrochemical label-free immunosensor for the detection of ochratoxin A in coffee samples[J].Sensors and Actuators B:Chemical, 2020, 305:127438.
[13] FELIX F S, ANGNES L.Electrochemical immunosensors-A powerful tool for analytical applications[J].Biosensors and Bioelectronics, 2018, 102:470-478.
[14] ZHANG X, WANG Z H, XIE H, et al.Development of a magnetic nanoparticles-based screen-printed electrodes (MNPs-SPEs) biosensor for the quantification of ochratoxin A in cereal and feed samples[J].Toxins, 2018, 10(8):317-329.
[15] HOU S L, MA Z E, MENG H, et al.Ultrasensitive and green electrochemical immunosensor for mycotoxin ochratoxin A based on phage displayed mimotope peptide[J].Talanta, 2019, 194:919-924.
[16] SUN C N, LIAO X F, HUANG P X, et al.A self-assembled electrochemical immunosensor for ultra-sensitive detection of ochratoxin A in medicinal and edible malt[J].Food Chemistry, 2020, 315, 126289.
[17] 郝一雄, 郭金虎.纳米材料在生物免疫传感器中应用的研究进展[J].同济大学学报(医学版), 2020, 41(4):530-536.
HAO Y X, GUO J H.Research advances in application of nanomaterials in immunosensors[J].Journal of Tongji University (Medical Science), 2020, 41(4):530-536.
[18] 王芳, 李道敏, 李兆周, 等.分子印迹技术在食品药品分析检测中的应用[J].核农学报, 2015, 29(7):1 358-1 365.
WANG F, LI D M, LI Z Z, et al.The application of molecular imprinting technique in the analysis of foods and drugs[J].Journal of Nuclear Agricultural Sciences, 2015, 29(7):1 358-1 365.
[19] GUO W, PI F W, ZHANG H X, et al.A novel molecularly imprinted electrochemical sensor modified with carbon dots, chitosan, gold nanoparticles for the determination of patulin[J].Biosensors and Bioelectronics, 2017, 98:299-304.
[20] ZHONG C J, YANG B, JIANG X X, et al.Current progress of nanomaterials in molecularly imprinted electrochemical sensing[J].Critical Reviews in Analytical Chemistry, 2018, 48(1):15-32.
[21] YANG B, FU C, LI J P, et al.Frontiers in highly sensitive molecularly imprinted electrochemical sensors:Challenges and strategies[J].TrAC Trends in Analytical Chemistry, 2018, 105:52-67.
[22] PACHECO J G, CASTRO M, MACHADO S, et al.Molecularly imprinted electrochemical sensor for ochratoxin A detection in food samples[J].Sensors and Actuators B:Chemical, 2015, 215:107-112.
[23] YOLA M L, GUPTA V K, ATAR N.New molecular imprinted voltammetric sensor for determination of ochratoxin A[J].Materials Science and Engineering: C, 2016, 61:368-375.
[24] SUN H G, ZU Y L.A highlight of recent advances in aptamer technology and its application[J].Molecules, 2015, 20(7):11959.
[25] GUAN B Z, ZHANG X W.Aptamers as versatile ligands for biomedical and pharmaceutical applications[J].International Journal of Nanomedicine, 2020, 15:1 059-1 071.
[26] KAUR N, BHARTI A, BATRA S, et al.An electrochemical aptasensor based on graphene doped chitosan nanocomposites for determination of Ochratoxin A[J].Microchemical Journal, 2019, 144:102-109.
[27] CHEN W, YAN C, CHENG L, et al.An ultrasensitive signal-on electrochemical aptasensor for ochratoxin A determination based on DNA controlled layer-by-layer assembly of dual gold nanoparticle conjugates[J].Biosensors and Bioelectronics, 2018, 117:845-851.
[28] LI D L, ZHANG X, MA Y C, et al.Preparation of an OTA aptasensor based on a metal-organic framework[J].Analytical Methods, 2018, 10(26):3 273-3 279.
[29] ZHANG J, YANG K, CHEN L.In situ deposition of silver nanoparticles on polydopamine nanospheres for an ultrasensitive electrochemical aptasensor of ochratoxin A[J].Journal of the Electrochemical Society, 2019, 166(6):H182-H186.
[30] MAZAAFRIANTO D N, ISHIDA A, MAEKI M, et al.Label-free electrochemical sensor for ochratoxin A using a microfabricated electrode with immobilized aptamer[J].ACS Omega, 2018, 3(12):16823.
[31] ZEJLI H, GOUD K Y, MARTY J L.Label free aptasensor for ochratoxin A detection using polythiophene-3-carboxylic acid[J].Talanta, 2018, 185:513-519.
[32] YANG Y J, ZHOU Y, XING Y, et al.A label-free aptasensor based on aptamer/NH2 Janus particles for ultrasensitive electrochemical detection of Ochratoxin A[J].Talanta, 2019, 199:310-316.
[33] WANG P X, WANG L Y, DING M, et al.Ultrasensitive electrochemical detection of ochratoxin A based on signal amplification by one-pot synthesized flower-like PEDOT-AuNFs supported on a graphene oxide sponge[J].Analyst, 2019, 144(19):5 866-5 874.
[34] TANG J, HUANG Y, CHENG Y P, et al.Two-dimensional MoS2 as a nano-binder for ssDNA:Ultrasensitive aptamer based amperometric detection of Ochratoxin A[J].Mikrochimica Acta, 2018, 185(3):1-8.
[35] WANG Y H, NING G, WU Y H, et al.Facile combination of beta-cyclodextrin host-guest recognition with exonuclease-assistant signal amplification for sensitive electrochemical assay of ochratoxin A[J].Biosensors and Bioelectronics, 2019, 124-125:82-88.
[36] WEI M, ZHANG W Y.Ultrasensitive aptasensor with DNA tetrahedral nanostructure for ochratoxin A detection based on hemin/G-quadruplex catalyzed polyaniline deposition[J].Sensors and Actuators B:Chemical, 2018, 276:1-7.
[37] SUEA-NGAM A, HOWES P D, STANLEY C E, et al.An exonuclease I-assisted silver-metallized electrochemical aptasensor for ochratoxin A detection[J].ACS Sensors, 2019, 4(6):1 560-1 568.
[38] WEI M, XIN L K, FENG S, et al.Simultaneous electrochemical determination of ochratoxin A and fumonisin B1 with an aptasensor based on the use of a Y-shaped DNA structure on gold nanorods[J].Microchimica Acta, 2020, 187(2):1-7.
[39] WANG X Y, SHAN Y Q, GONG M, et al.A novel electrochemical sensor for ochratoxin A based on the hairpin aptamer and double report DNA via multiple signal amplification strategy[J].Sensors and Actuators B:Chemical, 2019, 281:595-601.
[40] WEI M, ZHANG W Y.The determination of ochratoxin A based on the electrochemical aptasensor by carbon aerogels and methylene blue assisted signal amplification[J].Chemistry Central Journal, 2018, 12(1):45-53.
[41] ZHU X, KOU F X, XU H F, et al.Label-free ochratoxin A electrochemical aptasensor based on target-induced noncovalent assembly of peroxidase-like graphitic carbon nitride nanosheet[J].Sensors and Actuators B:Chemical, 2018, 270:263-269.
[42] ZHU C X, LIU D, LI Y Y, et al.Ratiometric electrochemical aptasensor for ultrasensitive detection of ochratoxin A based on a dual signal amplification strategy:Engineering the binding of methylene blue to DNA[J].Biosensors and Bioelectronics, 2020, 150:111814.
[43] MAZAAFRIANTO D N, ISHIDA A, MAEKI M, et al.An electrochemical sensor based on structure switching of dithiol-modified aptamer for simple detection of ochratoxin A[J].Analytical Sciences, 2019, 35(11):1 221-1 226.
[44] 曾德福, 周亮, 王诗, 等.碳纳米材料在电化学传感器中的研究与应用[J].湖北科技学院学报(医学版), 2020,34(2):163-166.
ZENG D F, ZHOU L, WANG S, et al.Research and application of carbon nanomaterials in electrochemical sensors[J].Journal of Hubei University of Science and Technology (Medical Sciences), 2020, 34(2):163-166.
[45] 田风玉, 周静, 何悦, 等.光学适配体传感器在赭曲霉毒素A检测中的应用研究进展[J].食品与发酵工业, 2019, 45(4):242-249,262.
TIAN F Y, ZHOU J, HE Y, et al.Research progress on the application of optical aptasensors in detecting ochratoxin A[J].Food and Fermentation Industries, 2019, 45(4):242-249,262.
[46] XIANG Y, CAMARADA M B, WEN Y P, et al.Simple voltammetric analyses of ochratoxin A in food samples using highly-stable and anti-fouling black phosphorene nanosensor[J].Electrochimica Acta, 2018, 282:490-498.
[47] DRIDI F, MARRAKCHI M, GARGOURI M, et al.Thermolysin entrapped in a gold nanoparticles/polymer composite for direct and sensitive conductometric biosensing of ochratoxin A in olive oil[J].Sensors and Actuators B:Chemical, 2015, 221:480-490.
[48] AFZALI D, FATHIRAD F, GHASEMINEZHAD S.Determination of trace amounts of ochratoxin A in different food samples based on gold nanoparticles modified carbon paste electrode[J].Journal of Food Science and Technology-Mysore, 2016, 53(1):909-914.
[49] JALALVAND A R.Fabrication of a novel and high-performance amperometric sensor for highly sensitive determination of ochratoxin A in juice samples[J].Talanta, 2018, 188:225-231.