食品安全控制主要包括化学控制、物理控制和生物控制,其中生物尤其是微生物控制是最为关键的。食品的微生物污染是消费者、监管机构和食品工业目前所需解决的主要问题[1]。微生物极易污染生的水果、蔬菜、鱼和肉类产品,因为这些食品拥有较高的水分活度和丰富的营养成分[2]。例如新鲜蔬菜和水果经常被蜡样芽孢杆菌和单核细胞增生李斯特菌污染[3]。加工食品的致病菌微生物污染大多局限于食品表面,其中涉及人员、设备、加工环境的交叉污染方面的风险大大增加[4]。食源性疾病大部分都是由细菌引起的,并且发病率很高,对公众健康构成严重的威胁。杀菌是控制食品中微生物的重要手段,指通过运用各种手段杀灭食品本身污染的、从食品包装容器带入的、加工与调配过程中由操作人员和设备引入的、以及生产环境中存在的各种微生物,从而延长产品的贮藏期,保证产品质量安全的一种技术[5]。随着人民物质生活质量的提高,消费者对饮食的认识和食品质量安全的意识迅速增强,对食品安全的要求越来越高。消费者对食品的感官和营养品质的需求促使食品加工商采用更新的技术,在不影响营养和感官特性的情况下控制食品中的微生物,在提高食品安全性同时不损害品质[4,6]。
光敏剂介导光动力杀菌可通过可见光激发光敏剂,产生活性氧达到杀灭微生物(包括细菌、真菌、病毒)的目的,是一种有潜力的新型非热杀菌技术[4]。非热杀菌技术以最大限度地减少食品中各种营养成分的损失, 尽量保持食品的原有风味并提高杀菌技术的经济性、方便性,优化食品的包装与贮藏条件, 延长食品的货架期, 以满足广大消费者日益增长的物质生活的需要[5,7]。光动力杀菌技术开辟了一条能有效杀菌、保持食品特质的新道路。把此技术运用在食品处理、包装、加工设备和工业环境中,对改善食品微生物控制起了很大的作用[8]。本综述介绍了光动力杀菌技术的原理及影响食品中杀菌效果的因素,并比较了其与其他杀菌技术之间的优缺点,同时整理了不同光敏剂介导的光动力杀菌技术在食品中的应用,并对光动力杀菌技术进行展望。
光敏剂介导光动力杀菌技术(photodynamic technology, PDT),是一种依靠发生非热光物理反应和光化学反应来灭菌的技术,在氧存在下需要可见光和光敏剂[9]。它是利用光动力反应进行疾病诊断和治疗的一种新型环保的非热杀菌技术,是一种可选择性灭活恶性肿瘤细胞和致病性微生物(包括细菌、真菌和病毒)的新方法[4]。光动力反应是光敏剂在特定波长光源激发下,产生活性氧引起生物分子氧化和细胞损伤的过程,其中光敏剂在光动力杀菌中起了关键性的作用[10]。
光敏剂是能够吸收特定波长光线照射并将其转化为可用能量的一类化合物[11]。其将能量传递给不能吸收光子的分子,促其发生化学反应,而本身不参与化学反应并恢复到原先的状态[12]。光敏剂物质通常具有良好的共轭结构,自身能够高效的吸收光照射能量而激发,激发后能够将能量传递反应物并返回基态[12]。目前已知有数百种天然和合成染料可以作为PDT的光敏剂,范围从植物提取物到复杂的合成大环化合物[13]。
光敏剂是光动力杀菌的核心,是影响杀菌效果的关键因素[10,14]。理想的光敏剂应该具备以下特性:(1)化学纯度高,结构明确,性质稳定;(2)易被适当波长的光激活;(3)仅在光照时具有强的光毒性,暗毒性低,安全有效;(4)合成简单且产率高,三线态氧寿命长而且产量多,能够有效地产生单线态氧以及其他活性氧成分;(5)在生理pH值可溶解;(6)成本低[2,11,15]。当光敏剂作为食品添加剂时,还必须具备以下条件:不伤害人体、不破坏食品原有营养成分、符合国家食品添加剂的添加标准[10]。目前并非所有的光敏剂均能完全满足以上条件,所以新型光敏剂的开发研制备受重视[11]。
1.1.1 光敏剂分类
1.1.1.1 第一代光敏剂
80年代以前及80年代早期研发的卟啉等光敏剂称为第一代光敏剂,主要指以卟啉骨架为主要结构单元的血卟啉衍生物,例如二血卟啉醚等[15-16]。尽管第一代光敏剂易制成水溶性制剂,但是在用于医学治疗时,光毒性大,靶向性、稳定性都比较差,其在红光部分的吸光效率低,穿透性大大降低,因而治疗深度也不够[14-15,17]。
1.1.1.2 第二代光敏剂
80年代后期制成的卟啉衍生物或合成物称为第二代光敏剂,均为单体化合物,包括卟啉、卟吩、稠环醌以及金属酞菁等,这些单体化合物主要来源于有机合成,有效成分单一明确[15-16]。相比第一代光敏剂,第二代光敏剂的结构更加单一,靶向性更强,活性氧产量更高,利用率显著增强,作用的光波波长较长,组织穿透性强[14-15,17]。第二代光敏剂进一步推动了光动力杀菌技术的发展[15]。
1.1.1.3 第三代光敏剂
20世纪末,在第二代光敏剂的基础上,人们在其结构上添加具有生物学特性的化学基团物质,如多聚体和脂质体等,研究出了第三代光敏剂,如生物结合物(抗体结合物,脂质体结合物)和内含光淬灭或光漂白特性的结合物[15-17]。通过纳米载体对光敏剂的包载,以及多肽或抗体对光敏剂的靶向修饰等应用技术使第三代光敏剂具有更佳的生物相容性、更强的肿瘤靶向性以及更高的细胞活性氧产率等特性,显示出巨大的优势[14]。
光动力杀菌涉及光敏剂、光源与氧的结合,每种因素本身都是无害的,只有同时暴露于光敏剂、光和氧的细胞才产生细胞毒性效应[13]。光动力杀菌中涉及的潜在机制由光敏剂吸收特定波长的光并跃迁到其第一激发态的能力来控制,其涉及的反应过程和作用原理如图1所示:
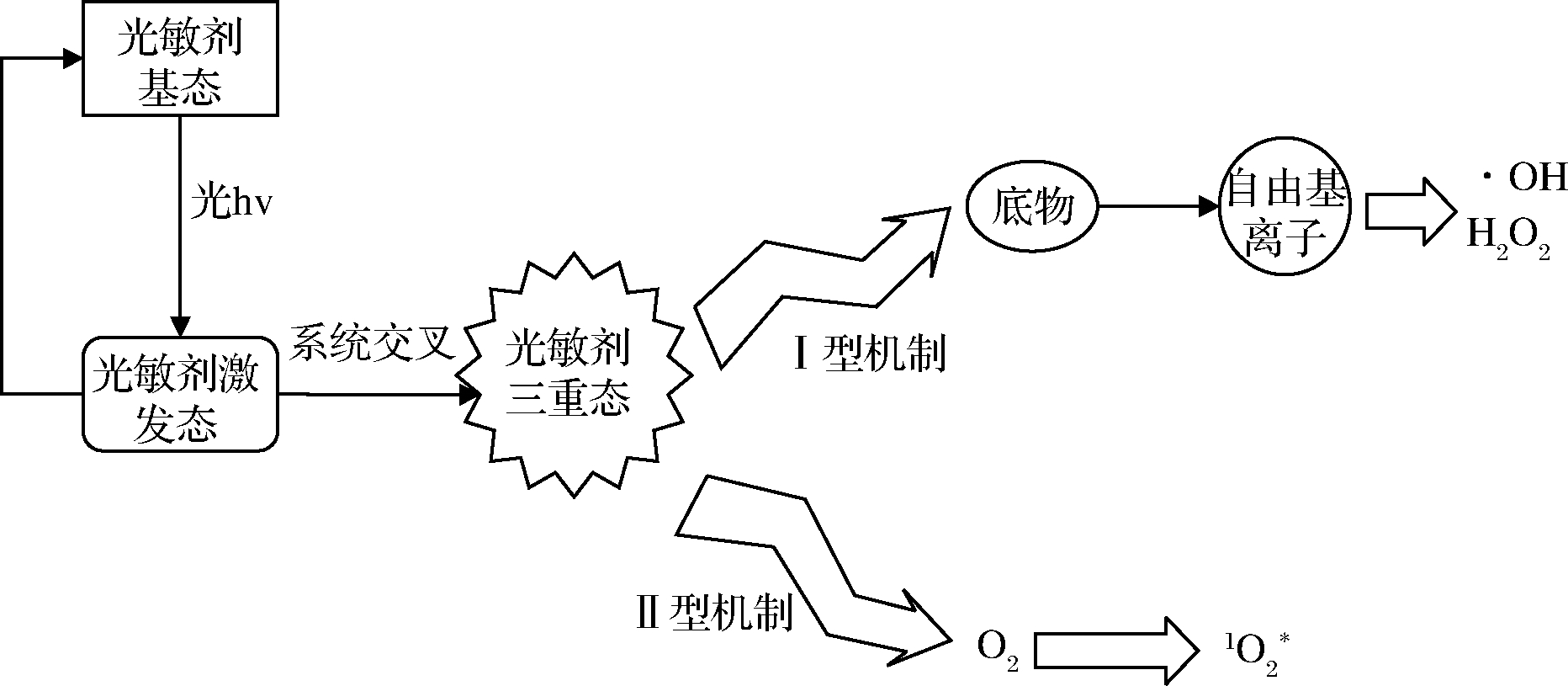
图1 作用原理示意图
Fig.1 Schematic diagram of action principle
光敏剂分子是一种单线态的基态,具有2个反方向旋转的电子,在特定波长的光源照射激发下,无毒的光敏剂吸收光子的能量后从基态跃迁到第一激发态。由于第一激发态的光敏剂非常不稳定,很容易失去能量并退回到基态,所以可以通过系统交叉的方式转换到更稳定的三重激发态[4,13,17]。三重激发态的光敏剂有充足时间与周围分子相互作用,并且通常认为在这种状态下产生细胞毒性物质(超氧阴离子自由基或羟基自由基、单重态氧等),最终导致氧化损伤和细胞死亡[13]。
三重激发态的光敏剂有2种反应机制:I型机制和II型机制。
I型机制是具有2种限制机制(氢原子提取和电子转移反应)的化学过程,涉及到光敏剂的激发态和底物(生物、溶剂或另一种敏化剂)之间的反应,并产生自由基和自由基离子。这些自由基通常具有高度活泼的反应性,能够和氧气反应产生超氧阴离子自由基![]() 能通过歧化作用形成过氧化氢(H2O2),也能通过电子的还原形成氧化羟自由基(·OH)[13]。而II型机制是由三重激发态的光敏剂和基态分子氧(O2)之间的能量转移产生的,这导致了单重态氧
能通过歧化作用形成过氧化氢(H2O2),也能通过电子的还原形成氧化羟自由基(·OH)[13]。而II型机制是由三重激发态的光敏剂和基态分子氧(O2)之间的能量转移产生的,这导致了单重态氧![]() 和一些活性氧物质的形成。
和一些活性氧物质的形成。![]() 是高活性氧,具有强氧化作用,能够破坏细胞大分子物质的结构(例如蛋白质、脂质和核酸等),并导致细胞受损乃至死亡,从而达到灭活致病微生物的目的[4,6,13]。在机理上,II型机制比I型机制更容易产生活性氧,大多数活性氧是通过II型而不是I型产生的,因此人们普遍认为II型机制在光动力杀菌中占主导地位,许多光敏剂都被认为是通过Ⅱ型机制来发生反应的[13,17]。
是高活性氧,具有强氧化作用,能够破坏细胞大分子物质的结构(例如蛋白质、脂质和核酸等),并导致细胞受损乃至死亡,从而达到灭活致病微生物的目的[4,6,13]。在机理上,II型机制比I型机制更容易产生活性氧,大多数活性氧是通过II型而不是I型产生的,因此人们普遍认为II型机制在光动力杀菌中占主导地位,许多光敏剂都被认为是通过Ⅱ型机制来发生反应的[13,17]。
通过任一机制产生的活性氧物质非特异性地对细胞附近的多种目标(例如细胞壁和细胞膜)甚至细胞内(例如肽和核酸)造成氧化损伤,例如·OH很容易与有机分子结合,或者从有机分子中提取电子,这导致自由基链式反应的引发,导致细胞成分的广泛损伤;产生的活性氧物质氧化细胞膜中的脂质,特别是不饱和脂肪酸,导致膜流动性降低,因此膜结合蛋白被破坏[8,18]。通过破坏细胞成分,光敏剂介导的光动力杀菌诱导了微生物细胞形态和功能的变化[19]。形态损伤主要包括中介体结构的改变,细菌细胞壁和内膜的直接破坏会破坏膜的完整性,导致细胞质内容物的渗漏,进而使膜转运系统失活;功能改变通常是由膜电位紊乱、蛋白质和酶活性丧失以及代谢过程(如DNA复制、葡萄糖转运)抑制引起的[19]。这可能会导致细胞凋亡、坏死或腐败,最终导致细胞破坏和死亡[18]。
为了探讨光敏剂介导光动力杀菌技术是否能成功处理食品,应当考虑多种因素对杀菌效果的影响。
1.3.1 菌株种类
光动力杀菌被证明对多种微生物(营养形态和孢子中的革兰氏阳性和革兰氏阴性菌,以及生物膜、哺乳动物病毒和噬菌体、真菌和酵母以及寄生原虫)有效,例如金黄色葡萄球菌、沙门氏菌、单核细胞增生李斯特氏菌、大肠杆菌、蜡样芽孢杆菌、荧光假单胞菌、米根霉和黄曲霉等[1]。
MACLEAN等[20]发现革兰氏阳性菌比革兰氏阴性菌更容易被光动力灭活。NITZAN等[21]的研究可证明这一观点,可能是在特定的光照下,革兰氏阳性菌(例如金黄色葡萄球菌)比革兰氏阴性菌产生了更多的卟啉,导致其更容易被灭活。但是,GUFFEY等[22]的研究又发现某些革兰氏阴性菌(例如铜绿假单胞菌)在特定光照下,比革兰氏阳性菌更为敏感,这与前面的研究结论相反。而GHATE等[2]测试比较了这2种革兰氏性质的菌株对光动力杀菌的敏感性,发现革兰氏性质对光动力的敏感性没有很大的影响。因此,影响光动力杀菌的敏感性的因素应该是菌株种类,而不是革兰氏性质[2]。
1.3.2 光波长、辐照度以及光通量分布
波长影响光动力杀菌是被研究最广泛的因素,实施光动力杀菌需要特定波长的光源激发光敏剂,适合的照射光源是必要条件[18,23]。目前没有一个光源能发出完美的单色光,这意味着实际上使用光源是峰值波长的光谱,所以应该使用发射光谱尽可能与光敏剂吸收光谱重叠的窄光源[23]。与已证实具有杀菌性能的紫外线相比,可见光似乎在食品工业中更受欢迎,因为它具有更高的安全性和透射性,其中蓝色区域(400~500 nm)对微生物灭活的效率更高[18]。到目前为止,已经确定细菌细胞中的内源性卟啉在电磁光谱的蓝色区域(400~500 nm)吸收,且大多数内源性卟啉可能在电磁光谱的较低范围(400~420 nm)内吸收[23]。但是蓝光区域的光穿透能力较低,光敏剂介导光动力杀菌通常被认为是一种表面去污技术,主要用于食品或加工设施表面的去污[18]。
辐照度是指单位时间内投射到单位面积上的辐射能量。在临床医学和最近的食品科学中的大量研究表明,辐照度在杀菌结果中也起着重要作用。GHATE等[23]在使用405 nm发光二极管灭活沙门氏菌时发现,辐照度和光照时间的所有组合都会导致沙门氏菌失活,但低辐照度(92 mW/cm2)加上长光照时间(13.58 h)会导致最显著的失活。辐照度对杀菌结果产生的影响可能随辐照度范围、污染的性质(如浮游生物vs固着生物)和食物基质而变化,所以在应用光敏剂介导光动力杀菌技术时,应注意辐照度的选择[23]。
最近的一些研究表明,来自高强度光源的光分布可能高度偏向中心,当光源离样品太近时,也会出现偏斜分布。倾斜导致光能集中在样品的某一点,使其易受该点物理化学变化的影响,并损害其在其他点的微生物质量。避免倾斜的一种方法是使用跨越整个表面长度的灯阵列(如发光二极管条),然而这并不总是可行的[23]。在这种情况下,单一的高强度光源可能更实用,它可以通过减小光源与样品的距离来获得更大的分布均匀性[23]。
1.3.3 食品相关因素
1.3.3.1 酸碱度
食物的酸度也可能影响食物中外源性光敏剂的功效。大多数食物都是酸性的,但也有少数食物是碱性的,例如蛋黄等。对食物酸碱度起主要作用的酸因食物种类而异,这些酸具有不同的极性和渗透细胞膜的能力,所以会引起细菌细胞的不同反应[23]。GHATE等[24]评估了在相同pH值(4.5)下,常见食物中不同的有机酸(苹果酸、柠檬酸和乳酸)对4种食源性病原体的影响,其中乳酸是最有影响力的,其次是柠檬酸和苹果酸。这可能是因为乳酸和柠檬酸在进入细胞过程中具有破坏细胞膜的额外能力,而苹果酸只降低了细胞内的pH值[24]。
长期以来,人们一直使用乳酸、乙酸和柠檬酸等有机酸来抑制食物中细菌的生长。柠檬酸等弱酸进入细菌细胞后分解,降低细胞内的pH值,影响细菌细胞膜的渗透性和代谢机制,从而增加光敏剂对细菌细胞的渗透率和细菌对光敏剂的敏感性[24]。有机酸的抗菌作用高度依赖于其未解离的形式,这种形式能够穿透细胞膜,最终解离成氢离子和阴离子,降低细胞内的酸碱度。一些有机酸还可能螯合金属离子,破坏细胞膜的结构,如柠檬酸能够从细菌细胞壁中除去钙离子和镁离子,释放出磷脂和脂蛋白。磷脂和脂蛋白的损失导致细胞壁渗透性增加,进一步恶化细胞[24]。
而在高酸碱度下,细胞中蛋白质发生溶解且羟基离子对膜脂质产生皂化作用,使得细菌细胞膜变弱从而使细菌更容易受到活性氧的破坏。这可能是环境酸碱度对细菌细胞膜脂质组成的影响[25]。据报道,使用盐酸降低酸碱度会导致膜中饱和脂肪酸的比例增加,而使用氢氧化钠增加酸碱度会导致大肠杆菌细胞膜脂质组成中不饱和脂肪酸的比例增加。不饱和脂肪酸可能比饱和脂肪酸对活性氧更敏感,所以更高比例的不饱和脂肪酸可以增强光动力杀菌的有效性,这依赖于产生的活性氧的细胞毒性作用[25]。然而这一现象不能解释单核细胞增生李斯特菌在碱性条件下更具抗性的原因,因此需要进一步的研究来阐明食物酸碱度对杀菌效果的影响。
为了找出食物酸碱度对杀菌效果的影响,DE等[26]研究了酸化溶液(使用柠檬酸盐缓冲液,pH值从6降至2.5)中姜黄素的光吸收能力:在相当短的光照时间(仅照射2 min)内,杀菌效果提高,大肠杆菌菌落总数降低5 lgCFU/mL,这可能是因为受到柠檬酸对细胞膜渗透性或微生物细胞代谢活性的影响。因此,姜黄素对微生物细胞的渗透率更高,同时细胞对光敏剂的敏感性更高,这反过来又会促进更高的光吸收,有利于将姜黄素作为光敏剂的光动力杀菌技术成为酸性环境食品如果汁的保存技术[18]。
1.3.3.2 食物表面性质
光敏剂介导光动力杀菌本质上是一种表面净化技术,这使得食物的表面性质成为影响杀菌效果的重要因素。食物的表面可以为微生物提供隐藏的缝隙,使它们免受光线的影响,如果被处理的表面是离散的而不是连续的(例如一层颗粒),杀菌效果将受到食物表面颗粒性质的影响[23]。GLUECK等[27]试图通过光照来研究粒子几何形状对大肠杆菌在几个表面上失活的影响,其中黄瓜、番茄和莴苣等代表平坦表面,葫芦巴种子和绿豆代表球形表面,而绿豆芽代表复杂的几何形状。研究发现平坦表面的微生物能良好失活,球形表面只有在照明期间定期翻转后微生物才能有效失活,而复杂的表面即使在翻转之后微生物被光照也不能有效失活[27]。
自然界中的大多数微生物都是以生物膜的形式生长的[23]。微生物细胞壁的可变组成(即带电残留物和阳离子的存在和数量)有助于增加微生物对光敏剂的易感性。更明确地说,静电相互作用显著影响微生物细胞的结合能力和吸收光敏剂的能力[18]。有研究表明细胞等电点(影响细菌细胞的电荷)和光敏剂的等电点(影响其净电荷)是外源光敏剂功效的潜在重要决定因素,但是相对于等电点,食物的酸碱度更能影响光敏剂的功效[23]。
革兰氏阳性细菌是中性的、阳离子的,而通常更具挑战性的革兰氏阴性细菌通常需要使用阳离子的光敏剂来有效灭活。这是因为革兰氏阳性菌在细胞质膜周围有一个更宽且更多孔的包膜,无论其电荷如何,光敏剂都可以很容易地穿透该包膜,而革兰氏阴性菌的外膜上有带负电荷的磷酸基团,需要利用静电吸引和亚静电附着的作用来促进其穿透细胞膜[23]。综上,研究表明提高光敏剂的浓度,使用阳离子光敏剂,并将光敏剂与抗菌肽结合,可以更好地结合到靶细胞上,并能提高杀菌效率。表面粗糙度、疏水性和表面电荷都会影响生物膜的形成,从而影响微生物对光敏剂的易感性,但关于它们的研究很少,需要更多的研究来调查其对光敏剂介导的光动力杀菌的影响[18]。
1.3.3.3 水分活度
食物基质的水分活度影响微生物在食物上生长的能力,一般来说,细菌可以在水分活度为0.9或更高的环境中生长,而霉菌可以在水分活度低至0.7的环境中生长。水分活度控制微生物的渗透胁迫及其应激反应。低水分活度的典型应激反应包括膜脂组成中不饱和度的增加,这有可能加强光动力的杀菌效果[23]。水的活性也会影响食物中存在的细菌细胞类型,如低水分活度可能会增加污染细菌种群中内生孢子的比例,从而给根除任务带来挑战。同样,丝状真菌也能够产生无性孢子,这些无性孢子在不利的生长条件下保持休眠状态,使其更难被消除[23]。然而,目前还没有研究证明水分活度的变化对光敏剂介导光动力杀菌效果的影响。
近年来我国食品杀菌技术有了很大进步,但是在杀菌技术的研究开发方面还存在较大的问题:杀菌过程中可能对食品品质或口感造成影响以及杀菌可能会引起易燃、易爆、对人体有伤害等安全隐患[5]。因此,近年来国内外正在探索各种新型杀菌技术,来更好地控制食品和食品加工处理的环境,既能有效消除或减少微生物污染,又能在不影响食品质量和公众健康的情况下保护环境,以满足消费者对食品的需求[2,8]。表1介绍了不同杀菌技术的优缺点。
表1 不同杀菌技术的优缺点比较
Table 1 Comparison of advantages and disadvantages of different sterilization technologies
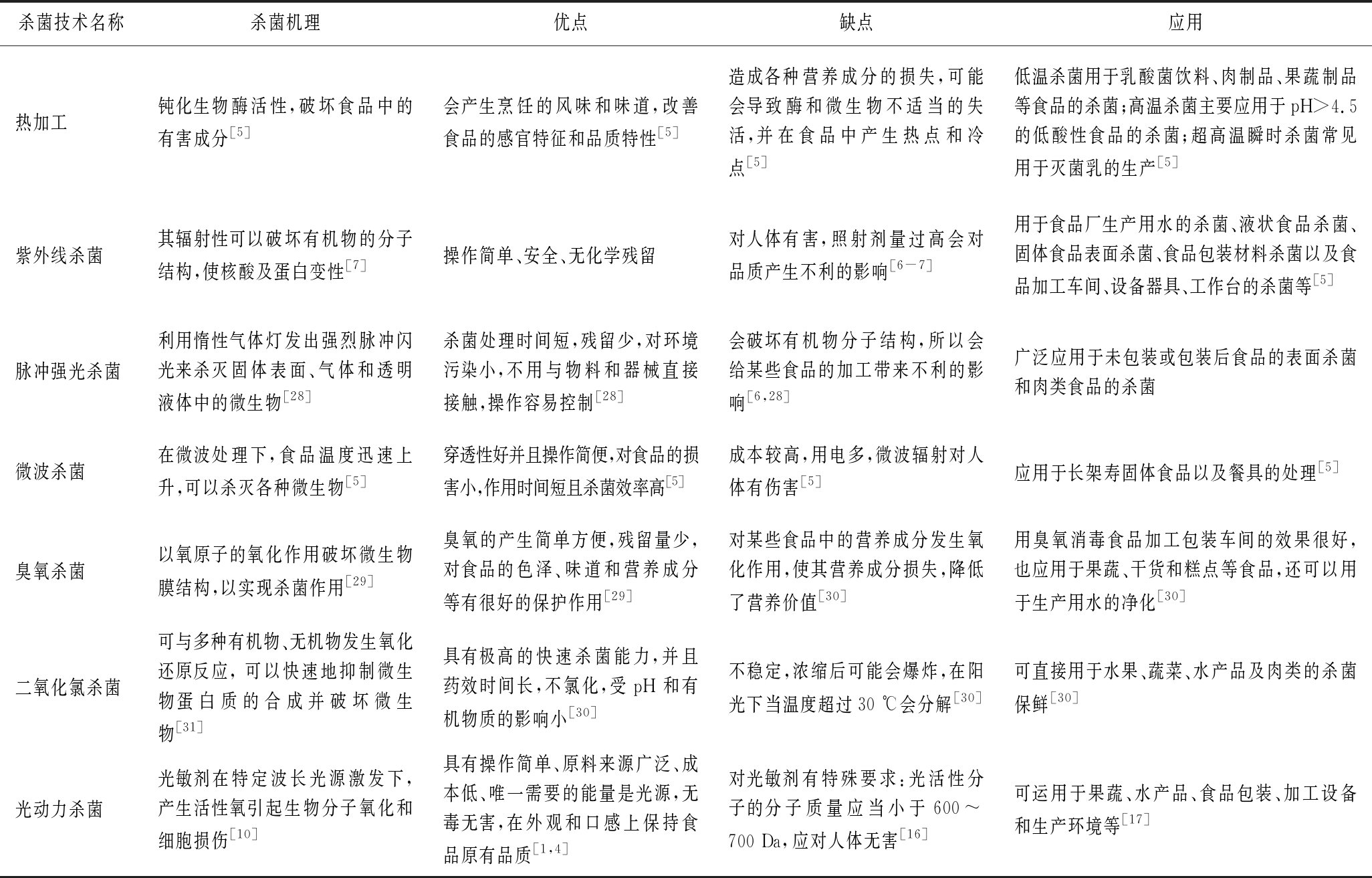
杀菌技术名称杀菌机理优点缺点应用热加工钝化生物酶活性,破坏食品中的有害成分[5]会产生烹饪的风味和味道,改善食品的感官特征和品质特性[5]造成各种营养成分的损失,可能会导致酶和微生物不适当的失活,并在食品中产生热点和冷点[5]低温杀菌用于乳酸菌饮料、肉制品、果蔬制品等食品的杀菌;高温杀菌主要应用于pH>4.5的低酸性食品的杀菌;超高温瞬时杀菌常见用于灭菌乳的生产[5]紫外线杀菌其辐射性可以破坏有机物的分子结构,使核酸及蛋白变性[7]操作简单、安全、无化学残留对人体有害,照射剂量过高会对品质产生不利的影响[6-7]用于食品厂生产用水的杀菌、液状食品杀菌、固体食品表面杀菌、食品包装材料杀菌以及食品加工车间、设备器具、工作台的杀菌等[5]脉冲强光杀菌利用惰性气体灯发出强烈脉冲闪光来杀灭固体表面、气体和透明液体中的微生物[28]杀菌处理时间短,残留少,对环境污染小,不用与物料和器械直接接触,操作容易控制[28]会破坏有机物分子结构,所以会给某些食品的加工带来不利的影响[6,28]广泛应用于未包装或包装后食品的表面杀菌和肉类食品的杀菌微波杀菌在微波处理下,食品温度迅速上升,可以杀灭各种微生物[5]穿透性好并且操作简便,对食品的损害小,作用时间短且杀菌效率高[5]成本较高,用电多,微波辐射对人体有伤害[5]应用于长架寿固体食品以及餐具的处理[5]臭氧杀菌以氧原子的氧化作用破坏微生物膜结构,以实现杀菌作用[29]臭氧的产生简单方便,残留量少,对食品的色泽、味道和营养成分等有很好的保护作用[29]对某些食品中的营养成分发生氧化作用,使其营养成分损失,降低了营养价值[30]用臭氧消毒食品加工包装车间的效果很好,也应用于果蔬、干货和糕点等食品,还可以用于生产用水的净化[30]二氧化氯杀菌可与多种有机物、无机物发生氧化还原反应, 可以快速地抑制微生物蛋白质的合成并破坏微生物[31]具有极高的快速杀菌能力,并且药效时间长,不氯化,受pH和有机物质的影响小[30]不稳定,浓缩后可能会爆炸,在阳光下当温度超过30 ℃会分解[30]可直接用于水果、蔬菜、水产品及肉类的杀菌保鲜[30]光动力杀菌光敏剂在特定波长光源激发下,产生活性氧引起生物分子氧化和细胞损伤[10]具有操作简单、原料来源广泛、成本低、唯一需要的能量是光源,无毒无害,在外观和口感上保持食品原有品质[1,4]对光敏剂有特殊要求:光活性分子的分子质量应当小于600~700 Da,应对人体无害[16]可运用于果蔬、水产品、食品包装、加工设备和生产环境等[17]
目前存在多种可以在食品中添加的光敏剂,下文列举了一些在不同光敏剂介导下食品应用的光动力杀菌技术。
姜黄素(C21H20O6, 7-双-4-羟基-3-甲氧基苯基-1, 6-庚二烯-3, 5-二酮)是一种从姜科姜黄根茎中提取的多酚类化合物,是一种天然食用色素和食品添加剂,安全性很高,具有来源广、成本低、无污染等优点和食品染色的功能[10,18]。姜黄素具有光敏活性,对红色毛癣菌、金黄色葡萄球菌、大肠杆菌等有强烈的抑制作用,可以治疗皮肤病[32]。姜黄素有一定的毒性,不能在食品中任意添加,在冷冻饮品(食用冰除外)中的最大使用量是0.15 g/kg;在可可制品、巧克力和巧克力制品(包括代可可脂巧克力及制品)以及糖果、碳酸饮料和果冻中的最大使用量是0.01 g/kg,其中固体饮料按稀释倍数增加使用量,若用于果冻粉按冲调倍数增加使用量;在糖果中的最大使用量是0.7 g/kg;在面糊(如用于鱼和禽肉的拖面糊)、裹粉、煎炸粉中的最大使用量是0.3 g/kg;在装饰糖果(如工艺造型,或用于蛋糕装饰)、顶饰(非水果材料)和甜汁、方便米面制品以及调味糖浆中的最大使用量是0.5 g/kg;在复合调味料中的最大使用量是0.1 g/kg;而在熟制坚果与籽类(仅限油炸坚果与籽类)、粮食制品馅料和膨化食品是按生产需要适量使用[33]。
从结构角度来看,姜黄素含有2个芳香环,带有原甲氧基酚羟基,其中高极性芳香环通过一个七碳环对称连接脂肪链(即由富含甲烷的片段组成的桥,负责姜黄素的疏水性质)和2个α,β-不饱和羰基化合物(即β-二酮部分)[18]。姜黄素具有2种主要的构象(即酮和烯醇互变异构),后者通过强分子内氢键在溶液和固态中比酮形式能量更稳定,因此姜黄素通常以烯醇互变异构体的形式存在[18]。姜黄素的光吸收能力也与其化学结构有关,即在主链碳链中存在交替的单键和双键,被认为是一种分子共轭系统[18]。姜黄素的宽吸收光谱(~430 nm)是由于姜黄素的烯酮基团在溶液中以烯醇形式π→π*跃迁[18,34]。其烯醇形式的完美平面构型允许在两个苯环内共振,导致线性扩展π-电子系统,使其在可见光谱区有强烈吸收峰(420 nm)[18,34]。然而,酮互变异构体的扭曲结构导致其吸收最大值向近紫外区移动(389 nm),这是由于缺少烯醇式的大共轭体系造成的[18,34]。
姜黄素的光降解很可能以溶液和固体形式发生,导致光产物的积累,在相同的波长范围内具有吸光度[18]。姜黄素的光毒性通常是通过分子内和分子间激发态质子转移产生的,这是由于它有非常低的荧光量子产率(≤0.2)[35]。不同的因素影响姜黄素的光毒性,包括氢键和电荷离域以及光稳定性[18]。然而,具有疏水性的姜黄素的有效利用受到限制,主要是由于其水溶性低和化学稳定性差(特别是在碱性溶液中)[18]。一般来说,光敏剂的水溶性差会导致它们在溶液中聚集,从而通过不附着和渗透到细菌细胞中来抵消光毒性潜力,导致光敏剂聚集体的单线态氧量子产率较低[18]。因此姜黄素的光毒性的极性、氢键给与和接受性质以及π-粘合性质高度依赖于溶剂[18,35]。将姜黄素溶解在质子溶剂(即氢键溶剂)如甲醇和乙醇中,产生可忽略的小荧光量子产率和寿命,而在非质子溶剂如苯、乙腈、氯仿和氘代氯仿中观察到更高的产率和寿命[18]。
于金珅等[10]的研究发现,在420 nm LED蓝光照射下,由姜黄素介导的光动力技术对鲜切马铃薯表面的大肠杆菌与金黄色葡萄球菌均有良好的杀菌效果:在姜黄素浓度为30 μmol/L时,与对照组相比,大肠杆菌菌落总数降低3.60 lgCFU/mL,金黄色葡萄球菌菌落总数降低5.23 lgCFU/mL,且姜黄素的浓度超过30 μmol/L时,杀菌效果会下降。曹斌斌等[32]证明,在LED蓝光光源(波长范围420~480 nm)照射下,姜黄素介导的光动力杀菌方法可以有效灭活牡蛎肠道及牡蛎体内90%以上的细菌,并且低姜黄素浓度的实验组杀菌效果不佳,姜黄素浓度为10 μmol/L实验组杀菌效果极好。武娟[36]的研究结果表明在470 nm 的蓝色光源照射下,由姜黄素介导的光动力处理对牡蛎中大肠杆菌的效果尚佳,其中10 μmol/L姜黄素的处理浓度最佳,与空白组相比大肠杆菌的存活能力降化了2.44 lgCFU/mL。
PVP是由单体N-乙烯基吡咯烷酮在水或异丙醇中进行自由基聚合反应产生的一种非离子型水溶性高分子化合物[37-38]。PVP 的结构中, 形成其链和吡咯烷酮环上的亚甲基是非极性基团,具有亲油性;分子中的内酰胺是强极性基团, 具有亲水和极性基团作用[39]。这种结构特征使PVP可溶于水、乙醇、胺、含氯溶剂、硝基烷烃和低分子脂肪酸,并且与大多数无机盐和多种树脂相溶;不溶于乙醚、丙酮等[38-39]。
PVP具有优异的溶解性、低毒性、化学稳定性、成膜性、粘接性、生物相容性和保护胶作用,且PVP作为食品添加剂,具有良好的食物安全性,其使用限量为按生产需要适量使用[33,37-38]。在食品加工方面PVP因无毒、溶解性优异而得到广泛应用,PVP能够能选择性吸附多酚类物质,使其不能与铁生成红色络合物, 不会影响饮料的外观和货架寿命,从而达到澄清稳定的作用[40,37]。在啤酒生产过程中加入微量的PVP可改进啤酒的澄清度,防止混浊、稳定色泽、改善口味、延长贮存期[37]。PVP还可用于非营养型甜味佐料的浓缩与稳定, 以及对维他命和矿物质成分的浓缩提取,也可用作各种食品的包装材料, 有利于包衣过程的自动化生产, 可降低包衣成型时间,可以用于食品的无菌生产[40]。
WINTER等[40]引入了与聚乙烯吡咯烷酮结合的姜黄素(含有少量的去甲氧基姜黄素和双去甲氧基姜黄素),用来提供光动力失活在水溶液中的溶解度,研究结果表明聚乙烯吡咯烷酮作为光敏剂的光动力杀菌技术可以很好地灭活革兰氏阳性和革兰氏阴性细菌:5 μmol 的聚乙烯吡咯烷酮孵育5 min,用蓝光发光二极管阵列[(435±10) nm,33.8 J/cm]照射,导致活金黄色葡萄球菌的数量减少>6 lgCFU/mL;将聚乙烯吡咯烷酮—碳浓度提高到50 μmol/L(孵育15或25 min), 可以完全根除金黄色葡萄球菌,可以很好地应用于食品消毒。
核黄素(一种水溶性维生素B2),分子式C17H2ON4O6, 微溶于水,呈强黄绿色荧光,主要由黄素单核苷酸和黄素鸟嘌呤二核苷酸2种重要成分组成,参与机体复杂氧化反应[41]。核黄素具有优良的共轭结构,能够作为电子穿梭体,高效地传递电子;广泛参与各项生命活动,在氧化还原调节、呼吸能量代谢等方面,发挥着重要的调节作用[12]。核黄素具有利尿、降血脂和改善心脏功能的作用,是一种动物和人生命活动所必需的多功能性维生素,但动物和人自身不能合成,需要通过食物摄取(主要存在于蔬菜和动物的食物中)[12,41-42]。在食品和饮料中,核黄素在肝脏、鸡蛋和乳制品中含量最高,酵母也富含核黄素,像啤酒这样的发酵饮料也含有大量的核黄素[42]。
核黄素吸收最大波长在365和445 nm左右的光,导致其拥有特有的黄色[42]。核黄素对光极其敏感,在强碱或可见光、紫外线下时不稳定,光照及紫外照射会引起核黄素不可逆的分解:在337 nm激光作用下,核黄素仅产生三重激发态;而在248 nm激光作用下,可产生三重态激发和氧化型自由基,导致细胞衰老甚至死亡[41]。与其他光敏剂不同,核黄素可能![]() 氧化,所以在低氧压力条件下,I型机制的底物会保护核黄素通
氧化,所以在低氧压力条件下,I型机制的底物会保护核黄素通![]() 的氧化降解[42]。
的氧化降解[42]。
核黄素对食品品质存在影响,高氧条件(80%)有利于核黄素发生光氧化,从而引起肉制品发生松软,导致肉制品品质下降;乳制品内部核黄素发生化学反应,促使牛奶的感官品质发生变化;啤酒含有核黄素,光照射下会产生一种类似于肛门腺排出的气味[41]。因此核黄素作为食品添加剂,有一定毒性,在干制蔬菜(仅限脱水马铃薯)中的最大使用量是0.3 g/kg; 在方便米面制品和固体复合调味料中的最大使用量是0.05 g/kg[33]。
BANERJEE等[43]发现光照核黄素对大肠杆菌和金黄色葡萄球菌及其混合培养物具有杀菌和抗生物膜作用:在450 nm蓝光照射下,大肠杆菌和金黄色葡萄球菌光灭活后分别观察到约5 lgCFU/mL和4 lgCFU/mL的减少;与对照组相比,大肠杆菌、金黄色葡萄球菌和混合培养对生物膜的抑制率分别为34%和50%。KHAN等[44]也证明了核黄素有优异的光敏特性,在辐照率为38.6 W/m的光照射下对大肠杆菌杀菌显著,大肠杆菌存活菌落数降低了50~60 μmol/mL。
叶绿素是地球上分布最广的天然色素之一,主要存在于绿色植物中。叶绿素属卟啉类化合物, 以卟啉作为基础,1个镁和 4个吡咯环上的氮结合构成的,在植物和微生物光合反应中起重要作用[45]。叶绿素呈深绿或墨绿色油状或糊状,性质不稳定(遇光、酸、碱、氧、氧化剂等都易分解), 且难溶于水, 易溶于丙酮和乙醚等有机溶剂和油脂类,为方便使用, 常将其制成叶绿素的衍生物,性质较稳定,易溶于水,应用相对较广泛[45-46]。天然叶绿素对蓝紫光和红光有很强的选择吸收,而对绿光则很少吸收,因此叶绿素呈现绿色[46]。
叶绿素铜钠盐(C34H31CuN4 Na3O6)作为叶绿素的衍生物,是一种非常稳定的金属卟啉,呈墨绿色粉末状, 略带金属光泽, 无臭或微有特殊的氨样气味, 有吸湿性, 对光、热、酸和碱较稳定,易溶于水, 稍溶于乙醇和氯仿, 微溶于乙醚和石油醚,水溶液呈蓝绿色澄清透明液, 钙离子存在时则有沉淀析出[45]。叶绿素铜钠盐拥有独特的抗菌能力,特殊的除臭性能,天然无污染,对环境友好,被广泛应用于食品加工领域[45]。
叶绿素铜钠盐有一定毒性,作为食品添加剂在冷冻饮品(食用冰除外)、蔬菜罐头、熟制豆类、加工坚果与籽类、糖果、粉圆、焙烤食品、饮料类(包装饮用水除外)、配制酒和果冻中最大使用量均为0.5 g/kg,其中固体饮料按稀释倍数增加使用量,果冻粉按冲调倍数增加使用量;在果蔬汁(浆)类饮料中,最大使用量为按生产需要适量使用,固体饮料按稀释倍数增加使用量[33]。
PASKEVICIUTE等[3]比较了用叶绿素介导光动力杀菌、次氯酸盐处理和简单用水洗涤去除番茄中耐热菌株单核细胞增生李斯特氏菌和蜡样芽孢杆菌的效果,发现叶绿素介导光动力杀菌最有效:对照样品中番茄果实上李斯特菌的数量为3.6 lgCFU/mL,用水冲洗可使番茄表面的微生物量减少0.6 lgCFU/mL,次氯酸盐处理减少1.4 lgCFU/mL,而在光照405 nm下,叶绿素介导的光动力减少了1.6 lgCFU/mL;番茄表面的芽孢杆菌数量达到4.4 lgCFU/mL,用水冲洗使这一群体减少了0.8 lgCFU/mL,次氯酸盐处理减少了1.2 lgCFU/mL,叶绿素介导的光动力使番茄表面的耐热芽孢杆菌的数量减少了1.6 lgCFU/mL。赵若晴[9]发现用浓度为10-3 mol/L的叶绿素铜钠盐作为光敏剂,当405 nm光照射15~30 min后,蔬菜汁中金黄色葡萄球菌的杀菌效果高达3.5个对数。
金丝桃素(多环菲咯啉二酮)来源于植物贯叶金丝桃,其又名贯叶连翘,以其抗抑郁、抗病毒和抗肿瘤作用而闻名,通常用于治疗目的,也可用作食品和酒精饮料制备中的调味剂[8,47]。
金丝桃素分子式为C30H16O8,呈蓝黑色针状结晶体,分子结构上下对称,有共轭体系,580~589 nm处有特征性吸收峰[47]。金丝桃素分子间具有极强的亲和力,易相互结合[48]。金丝桃素中邻近的酸碱官能团可以促进氢键的形成,此氢键在分子识别和小分子特异性子结合中起到了至关重要的作用[48]。金丝桃素热稳定性低,遇光容易分解、氧化,其具有多酚羟基结构,极性大,在甲醇、乙醇、四氢呋喃、吡啶及其他有机胺类化合物中容易溶解,可溶于碱性水溶液,当pH< 11.5时,水溶液呈红色,pH>11.5时水溶液呈绿色,且带有红色荧光[47]。金丝桃素没有毒性或遗传毒性作用,是一种有效的抗细菌和酵母的光敏剂[8]。金丝桃素在600~700 nm表现出高单线态氧生成、高荧光产率和强吸收[8]。
KAIRYTE等[49]在光照585 nm下,当金丝桃素作为光敏剂时,培养5 min后导致李斯特氏菌减少了约5个对数(P<0.05),将培养时间延长至10 min可使李斯特菌的灭活增加至6对数以上(P<0.05);而沙门氏菌对基于金丝桃素的光敏作用有很强的抗性:用10 mL金丝桃素孵育60 min,然后在138 ℃光照对沙门氏菌的生长没有影响(数据与对照没有区别),而用更高浓度的金丝桃素孵育和光照使细胞数量减少1 lgCFU/mL。
近年来,以光敏剂为核心的光动力学杀菌技术已成为一种理想的新型杀菌方式,在微生物控制领域展现出广阔的应用前景[9]。PDT的杀菌效果直接取决于光敏剂的性质,PDT 的发展在很大程度上依赖于光敏剂的发展[16]。光敏剂作为光动力杀菌技术的核心,已经历了从第一代到第二代、第三代乃至各种新型靶向纳米型光敏剂的发展,当今PDT研究仍然致力于新型光敏剂的开发研制,同时对新型光源的研发以及作用机制开展了深入广泛的研究[11,17]。大量的研究证明了光动力在不同科学的广泛领域中可能的实际用途,可以成功地治疗不同的疾病例如皮肤病、动脉粥样硬化、类风湿性关节炎等[50]。PDT的应用已经不仅仅局限在医学领域,其在食品冷杀菌领域具有潜在的应用价值,但是光动力杀菌在食品领域中的研究仍然较少并且存在难点[9-10]。大多数研究是在模型系统中进行的,并没有在食品中进行测试,相关数据肯定与实际情况有区别[8]。有的光敏剂存在一定的毒性,不能在食品中随意的添加,在不同的食品中有一定的限量,超过限量就会对人体造成威胁。经过处理后,食品中天然成分的光降解可能通过脂质氧化使其有不良的感官效果。因此,应该考虑到不同食物基质的复杂性、食物基质与处理的相互作用、货架期和处理后食物的质量并阐明处理过的食物中的天然成分在决定光动力杀菌作用的有效性中起着消极还是积极的作用,需要更多的研究来调查其对杀菌效果的影响[3,18]。光敏剂介导的光动力杀菌技术的主要缺点是不能穿透食品外层,更适用于食品、食品包装或食品设施的表面消毒[18]。活性氧的生成功效是光动力杀菌成功的关键,光敏剂作为的核心要素,在很大程度上决定了PDT的疗效[11,19]。未来可以通过对已知光敏剂的精心优化和新型高效光敏剂的开发,高度提高活性氧的产量,特别是最具破坏性的羟自由基。虽然光敏剂介导的光动力杀菌技术不能解决所有的抗微生物问题,但在特殊情况下使用这种新方法或将其与公认的微生物控制技术相结合可以获得改进。
[1] PENHA C B, BONIN E, DA SILVA A F, et al.Photodynamic inactivation of foodborne and food spoilage bacteria by curcumin[J].LWT-Food Science and Technology, 2017, 76:198-202.
[2] GHATE V S, NG K S, ZHOU W B, et al.Antibacterial effect of light emitting diodes of visible wavelengths on selected foodborne pathogens at different illumination temperatures[J].International Journal of Food Microbiology, 2013, 166(3):399-406.
[3] PASKEVICIUTE E, ZUDYTE B, LUKSIENE Z.Towards better microbial safety of fresh produce:Chlorophyllin-based photosensitization for microbial control of foodborne pathogens on cherry tomatoes[J].Journal of Photochemistry and Photobiology B:Biology, 2018, 182:130-136.
[4] LOPEZCARBALLO G, HERNANDEZMUNOZ P, GAVARA R, et al.Photoactivated chlorophyllin-based gelatin films and coatings to prevent microbial contamination of food products[J].International Journal of Food Microbiology, 2008, 126(1-2):65-70.
[5] 陈颖慧. 食品杀菌技术概述[J].时代农机, 2017, 44(7): 151-152.
CHEN Y H.Overview of food sterilization technology [J].Times Agricultural Machinery, 2017, 44(7): 151-152.
[6] BHAVYA M L, UMESH H H.Efficacy of blue LED in microbial inactivation:Effect of photosensitization and process parameters[J].International Journal of Food Microbiology, 2019, 290:296-304.
[7] 张艳慧, 胡文忠, 刘程惠, 等.光电杀菌技术在鲜切果蔬保鲜中应用的研究进展[J].食品科学, 2020, 41(15):309-313.
ZHANG Y H, HU W Z, LIU C H, et al.Research progress of application of photoelectrobactericidal technology in fresh-cut fruits and vegetables [J].Food Science, 2020, 41(15):309-313.
[8] LUKSIENE Z, BROVKO L.Antibacterial photosensitization-based treatment for food safety[J].Food Engineering Reviews, 2013, 5(4):185-199.
[9] 赵若晴. 蔬菜汁中金黄色葡萄球菌生长预测模型的构建及光动力杀菌技术研究[D].长春:吉林大学,2020.
ZHAO R Q.Construction of growth prediction model of staphylococcus aureus in vegetable juice and study on photodynamic sterilization technology [D].Changchun:Jilin University, 2020.
[10] 于金珅, 张芳.姜黄素介导的光动力技术对鲜切马铃薯的杀菌效果[J/OL].食品工业科技[2020-07-22].https://kns.cnki.net/kcms/detail/11.1759.TS.20200722.1541.002.html.
YU J S, ZHANG F.The bactericidal effect of curcumin mediated photodynamic technology on fresh-cut potato[J/OL].Science and Technology of Food Industry [2020-07-22].https://kns.cnki.net/kcms/detail/11.1759.TS.20200722.1541.002.html.
[11] 宋坤. 光敏剂—纳米粒载体系统在卵巢癌光动力学治疗中的实验研究[D].济南:山东大学, 2006.
SONG K.Experimental study of photosensitizer—nanoparticle carrier system in the photodynamic treatment of ovarian cancer [D].Jinan:Shandong University, 2006.
[12] 徐芳. 核黄素光敏化生成活性氧的机制及其应用研究[D].合肥:中国科学技术大学, 2012.
XU F.Mechanism and application of riboflavin photochemical generation of reactive oxygen Species [D].Hefei:University of Science and Technology of China, 2012.
[13] SHARMAN W M, ALLEN C M, VAN L J E.Photodynamic therapeutics:Basic principles and clinical applications[J].Drug Discovery Today, 1999, 4(11):507-517.
[14] 史澍睿, 王悦, 万国运, 等.光动力疗法的抗肿瘤机制及光敏剂的研究进展[J].国际生物医学工程杂志, 2016, 39(5):303-308.
SHI S R, WANG Y, WAN G Y, et al.Research progress on the anti-tumor mechanism and photosensitizer of photodynamic therapy [J].International Journal of Biomedical Engineering, 2016, 39(5):303-308.
[15] 张凤玲. 分子靶向抗癌光敏剂的合成及光动力活性研究[D].福州:福州大学, 2014.
ZHANG F L.Synthesis and photodynamic activity of molecular targeted anti-cancer photosensitizers [D].Fuzhou:Fuzhou University, 2014.
[16] 李廷慧, 顾瑛, 邱海霞, 等.光敏剂的临床应用及研究进展[J].中国激光医学杂志, 2013, 22(5):283-288.
LI T H, GU Y, QIU H X, et al.Clinical application and research progress of photosensitizers [J].Chinese Journal of Laser Medicine, 2013, 22(5):283-288.
[17] 韩晓博, 郑英虹, 杨力明.光敏剂在光动力治疗中的研究进展[J].上海大学学报(自然科学版), 2017, 23(2):169-178.
HAN X B, ZHENG Y H, YANG L M.Research progress of photosensitizer in photodynamic therapy [J].Journal of Shanghai University (Natural Sciences), 2017, 23(2):169-178.
[18] SEIDI D M, MEREDDY R, NETZEL M E, et al.An insight into curcumin-based photosensitization as a promising and green food preservation technology[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(4):1 727-1 759.
[19] PANG X, LI D, ZHU J, et al.Beyond antibiotics:Photo/sonodynamic approaches for bacterial theranostics[J].Nano-micro letters, 2020, 12(1):1-23.
[20] MACLEAN M, MACGREGOR S J, ANDERSON J G, et al.Inactivation of bacterial pathogens following exposure to light from a 405-nanometer light-emitting diode array[J].Applied and Environmental Microbiology, 2009, 75(7): 1 932-1 937.
[21] NITZAN Y, SALMON D M, SHPOREN E, et al.ALA induced photodynamic effects on Gram positive and negative bacteria[J].Photochemical and Photobiological Sciences, 2004,3: 430-435.
[22] GUFFEY J S, WILBORN J.In vitro bactericidal effects of 405-nm and 470-nm blue light[J].Photomedicine and Laser Surgery, 2006, 24(6): 684-688.
[23] GHATE V S, ZHOU W, YUK H.Perspectives and trends in the application of photodynamic inactivation for microbiological food safety[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18(2):402-424.
[24] GHATE V, KUMAR A, ZHOU W B, et al.Effect of organic acids on the photodynamic inactivation of selected foodborne pathogens using 461 nm LEDs[J].Food control, 2015, 57:333-340.
[25] GHATE V, LEONG A L, KUMAR A, et al.Enhancing the antibacterial effect of 461 and 521 nm light emitting diodes on selected foodborne pathogens in trypticase soy broth by acidic and alkaline pH conditions[J].Food Microbiology, 2015, 48:49-57.
[26] DE OLIVEIRA E F, TIKEKAR R, NITIN N.Combination of aerosolized curcumin and UV-A light for the inactivation of bacteria on fresh produce surfaces[J].Food Research International, 2018, 114:133-139.
[27] GLUECK M, SCHAMBERGER B, ECKL P, et al.New horizons in microbiological food safety:Photodynamic decontamination based on a curcumin derivative[J].Photochemical & photobiological sciences, 2017, 16(12):1 784-1 791.
[28] 江天宝. 脉冲强光杀菌技术及其在食品中应用的研究[D].福州:福建农林大学, 2007.
JIANG T B.Research on pulse strong light sterilization technology and its application in food [D].Fuzhou:Fujian Agriculture and Forestry University, 2007.
[29] 刘玉莲. 臭氧气体处理对馒头的保鲜效果研究[D].郑州:河南农业大学, 2018.
LIU Y L.Study on the preservation effect of ozone gas treatment on steamed bread [D].Zhengzhou:Henan Agricultural University, 2018.
[30] 徐斐燕. 鲜切西兰花的保鲜技术研究[D].杭州:浙江大学, 2006.
XU F Y.Study on fresh-cut broccoli preservation technology [D].Hangzhou:Zhejiang University, 2006.
[31] 王凤清, 葛东文, 王东升, 等.二氧化氯杀菌技术在岔北注水站的应用[J].油田化学, 2006, 23(3):231-234.
WANG F Q, GE D W, WANG D S, et al.Application of chlorine dioxide sterilization technology in Cha-Bei water injection station [J].Oilfield Chemistry, 2006, 23(3):231-234.
[32] 曹斌斌, 武娟, 许川山, 等.姜黄素介导的光动力冷杀菌方法对牡蛎杀菌的效果研究[J].食品科学, 2016, 37(5):46-49.
CAO B B, WU J, XU C S, et al.Study on the effect of curcumin mediated photodynamic cold sterilization on the sterilization of oyster [J].Food Science, 2016, 37(5):46-49.
[33] 中华人民共和国国家卫生和计划生育委员会.GB2760—2016 食品安全国家标准 食品添加剂使用标准[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China.GB2760—2016 National Standard for Food Safety standard for the use of food additives [S].Beijing:China Standard Press, 2016.
[34] SHEN L, JI H F.Theoretical study on physicochemical properties of curcumin[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2007, 67(3-4):619-623.
[35] PRIYADARSINI K I.Photophysics, photochemistry and photobiology of curcumin:Studies from organic solutions, bio-mimetics and living cells[J].Journal of Photochemistry and Photobiology C:Photochemistry Reviews, 2009, 10(2):81-95.
[36] 武娟. 生鲜牡蛎中大肠杆菌和诺如病毒的检测及光动力非热力杀菌相关研究[D].青岛:中国海洋大学, 2015.
WU J.Detection of Escherichia coli and Norovirus in fresh oysters and study on photodynamic non-thermal sterilization [D].Qingdao:Ocean University of China, 2015.
[37] 钟思青, 储博钊.聚乙烯吡咯烷酮单体的合成工艺进展及其应用[J].化学世界, 2020, 61(2):77-82.
ZHONG S Q, CHU B Z.Progress of synthesis of polyvinylpyrrolidone monomer and its application [J].Chemistry World, 2020, 61(2):77-82.
[38] 郭智琼. 聚乙烯吡咯烷酮PVP K12在大鼠体内的药代动力学研究[D].长春:吉林大学, 2020.
GUO Z Q.Pharmacokinetics of polyvinylpyrrolidone PVP K12 in rats [D].Changchun:Jilin University, 2020.
[39] 马婷芳, 史铁钧.聚乙烯吡咯烷酮的性能、合成及应用[J].应用化工, 2002(3):16-19.
MA T F, SHI T J.Performance, synthesis and application of polyvinylpyrrolidone [J].Applied Chemical Engineering, 2002(3):16-19.
[40] WINTER S, TORTIK N, KUBIN A, et al.Back to the roots:Photodynamic inactivation of bacteria based on water-soluble curcumin bound to polyvinylpyrrolidone as a photosensitizer[J].Photochem Photobiol Science, 2013, 12(10):1 795-802.
[41] 林以琳, 邱建清, 李世洋, 等.核黄素介导的光动力技术的研究进展[J].食品工业科技, 2020, 41(6):332-337.
LIN Y L, QIU J Q, LI S Y, et al.Research progress of riboflavin-mediated photodynamic technology [J].Science and Technology of Food Industry, 2020, 41(6):332-337.
[42] CARDOSO D R, LIBARDI S H, SKIBSTED L H.Riboflavin as a photosensitizer.Effects on human health and food quality[J].Food & Function, 2012, 3(5):452-487.
[43] BANERJEE S, GHOSH D, VISHAKHA K, et al.Photodynamic antimicrobial chemotherapy (PACT) using riboflavin inhibits the mono and dual species biofilm produced by antibiotic resistant Staphylococcus aureus and Escherichia coli[J].Photodiagnosis and Photodynamic Therapy, 2020, 32:102002.
[44] KHAN S, P M R, RIZVI A, et al.ROS mediated antibacterial activity of photoilluminated riboflavin:A photodynamic mechanism against nosocomial infections[J].Toxicology Reports, 2019, 6:136-142.
[45] 李江婷. 叶绿素铜钠盐溶液在可见光范围内的光谱特性研究[D].新乡:河南师范大学, 2017.
LI J T.Study on the spectral characteristics of copper sodium chlorophyllin solution in visible light [D].Xinxiang:Henan Normal University, 2017.
[46] 付天齐, 王向伟, 胡江华, 等.叶绿素及其Cu、Zn衍生物的伪装性能研究[J].光电技术应用, 2015, 30(2):33-36.
FU T Q, WANG X W, HU J H, et al.Study on the camouflage performance of chlorophyll and its Cu and Zn derivatives [J].Photoelectric Technology Applications, 2015, 30(2):33-36.
[47] 易静雯. 金丝桃素光动力学效应诱导RINm5F胰岛细胞瘤细胞凋亡及其机制研究[D].长春:东北师范大学, 2015.
YI J W.Photodynamic effect of hypericin induces apoptosis of RINm5F islet cell tumor cells and its mechanism [D].Changchun:Northeast Normal University, 2015.
[48] 李泽波. 金丝桃素及其衍生物高效合成工艺的研究[D].杨凌:西北农林科技大学, 2014.
LI Z B.Study on the efficient synthesis technology of hypericin and its derivatives [D].Yangling:Northwest A&F University, 2014.
[49] KAIRYTE K, LAPINSKAS S, GUDELIS V, et al.Effective inactivation of food pathogens Listeria monocytogenes and Salmonella enterica by combined treatment of hypericin-based photosensitization and high power pulsed light[J].Journal of Applied Microbiology, 2012, 112(6):1 144-1 151.
[50] LUKSIENE Z.Photodynamic therapy:Mechanism of action and ways to improve the efficiency of treatment[J].Medicina (Kaunas, Lithuania), 2003, 39(12):1 137-1 150.